乙酸乙酯
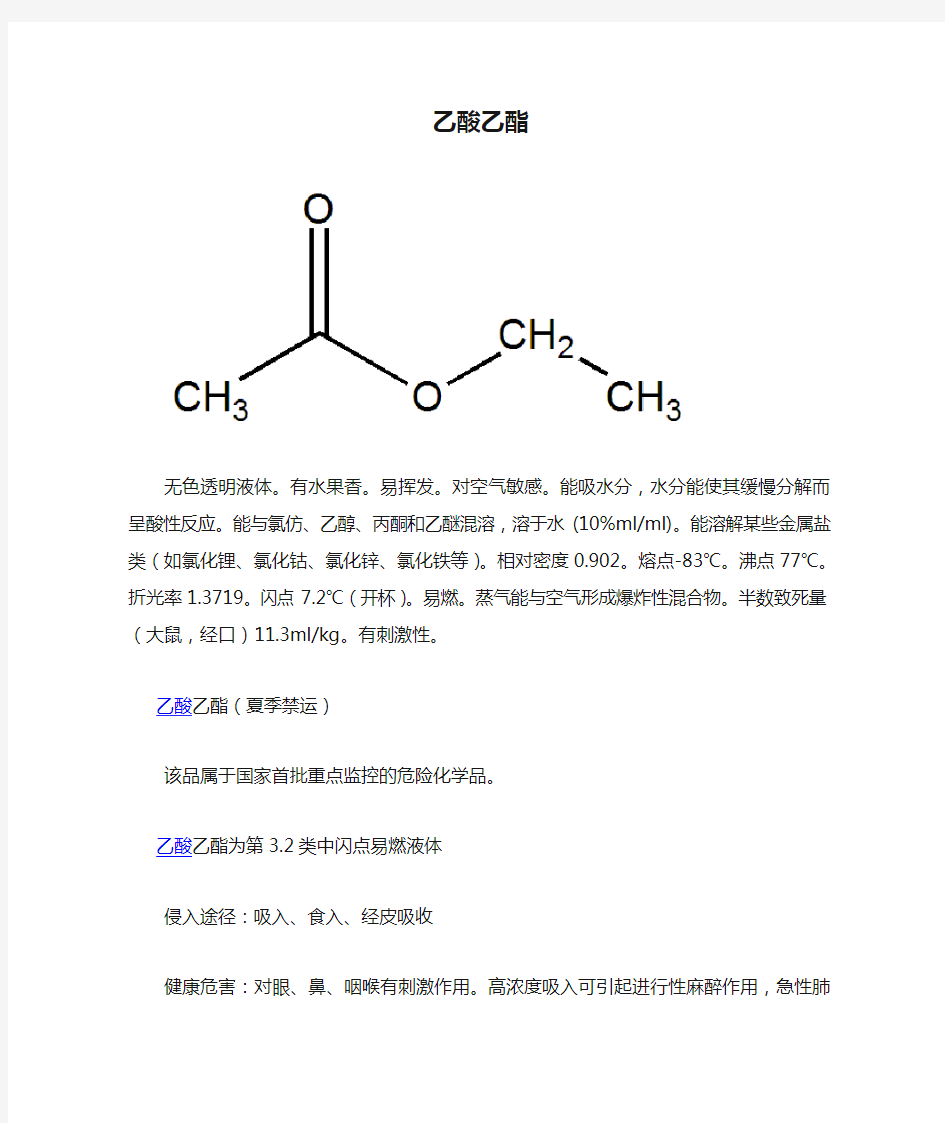

乙酸乙酯
无色透明液体。有水果香。易挥发。对空气敏感。能吸水分,水分能使其缓慢分解而呈酸性反应。能与氯仿、乙醇、丙酮和乙醚混溶,溶于水(10%ml/ml)。能溶解某些金属盐类(如氯化锂、氯化钴、氯化锌、氯化铁等)。相对密度0.902。熔点-83℃。沸点77℃。折光率1.3719。闪点7.2℃(开杯)。易燃。蒸气能与空气形成爆炸性混合物。半数致死量(大鼠,经口)11.3ml/kg。有刺激性。
乙酸乙酯(夏季禁运)
该品属于国家首批重点监控的危险化学品。
乙酸乙酯为第3.2类中闪点易燃液体
侵入途径:吸入、食入、经皮吸收
健康危害:对眼、鼻、咽喉有刺激作用。高浓度吸入可引起进行性麻醉作用,急性肺水肿,肝、肾损害。持续大量吸入,可致呼吸麻痹。误服者可产生恶心、呕吐、腹痛、腹泻等。有致敏作用,因血管神经障碍而致牙龈出血;可致湿疹样皮炎。慢性影响:长期接触本品有时可致角膜混浊、继发性贫血、白细胞增多。
用途
萃取剂,从水溶液中提取许多化合物(磷、钨、砷、钴)。有机溶剂。分离糖类时作为校正温度计的标准物质。检定铋、金、铁、汞、氧化剂和铂。测定铋、硼、金、铁、钼、铂、钾和铊。生化研究,蛋白质顺序分析。环保、农药残留量分析。有机合成。香料制造、可以做白酒勾兑用香料、人造香精、乙基纤维素、硝酸纤维素、赛璐璐、清漆、涂料、人造革、油毡、人造纤维、印刷油墨等。也可作人造珍珠的粘结剂、药物和有机酸的萃取剂以及水果味香料的原料。
安全措施
贮于低温通风处,远离火种、热源。
紧急处理
吸入:迅速脱离现场至新鲜空气处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
误食:饮足量温水,催吐,就医。
皮肤接触:脱去被污染衣着,用肥皂水和清水彻底冲洗皮肤。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
灭火剂:抗溶性泡沫、二氧化碳、干粉、砂土。用水灭火无效。
灭火注意事项:可用水保持火场中容器冷却。
理化性质实验室制取乙酸乙酯装置
乙酸乙酯又称醋酸乙酯[2]。纯净的乙酸乙酯是无色透明具有刺激性气味的液体,是一种用途广泛的精细化工产品,具有优异的溶解性、快干性,用途广泛,是一种非常重要的有机化工原料和极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树脂、乙酸纤维树酯、合成橡胶、涂料及油漆等的生产过程中。其主要用途有:作为工业溶剂,用于涂料、粘合剂、乙基纤维素、人造革、油毡着色剂、人造纤维等产品中;作为粘合剂,用于印刷油墨、人造珍珠的生产;作为提取剂,用于医药、有机酸等产品的生产;作为香料原料,用于菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。我们所说的陈酒很好喝,就是因为酒中含有乙酸乙酯。乙酸乙酯具有果香味。因为酒中含有少量乙酸,和乙醇进行反应生成乙酸乙酯。因为这是个可逆反应,所以要具有长时间,才会积累导致陈酒香气的乙酸乙酯。[6] 官能团酯基-coo(碳与氧之间是双键)存在:除人工合成外,还存在于菠萝、香蕉等果品中。反应中浓硫酸主要作用⒈催化剂⒉吸水剂为了分离乙酸乙酯一般用饱和碳酸钠溶液因为饱和碳酸钠溶液可以降低乙酸乙酯在水中的溶解度,同时可以吸收没有反应的乙酸和乙醇。外观与性状外观:无色澄清粘稠状液体。香气:有强烈的醚似的气味,清灵、微带果香的酒香,易扩散,不持久。球棍模型
熔点(℃):-83.6 折光率(20℃):1.3708--1.3730 沸点(℃):77.06 相对密度(水=1):0.894--0.898 相对蒸气密度(空气=1):3.04 饱和蒸气压(kPa):13.33(27℃)燃烧热(kJ/mol):2244.2 临界温度(℃):250.1 临界压力(MPa):3.83 辛醇/水分配系数的对数值:0.73 闪点(℃)(开杯):7.2 引燃温度(℃):426 爆炸上限%(V/V):11.5 爆炸下限%(V/V):2.0 室温下的分子偶极距:6.555*10^-30 比例模型溶解性:微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。
编辑本段主要用途其主要用途有:作为工业溶剂,用于涂料、粘合剂、乙基纤维素、人造革、油毡着色剂、人造纤维等产品中;作为粘合剂,用于印刷
油墨、人造珍珠的生产;作为提取剂,用于医药、有机酸等产品的生产;作为香料原料,用于菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。用作溶剂,及用于染料和一些医药中间体的合成。是食用香精中用量较大的合成香料之一,大量用于调配香蕉、梨、桃、菠萝、葡萄等香型食用香精。是硝酸纤维素、乙基纤维素、乙酸纤维素和氯丁橡胶的快干溶剂,也是工业上使用的低毒性溶剂。还可用作纺织工业的清洗剂和天然香料的萃取剂,也是制药工业和有机合成的重要原料。编辑本段注意事项⒈健康危害:对眼、鼻、咽喉有刺激作用。高浓度吸入可进行麻醉作用,急性肺水肿,肝、肾损害。持续大量吸入,可致呼吸麻痹。误服者可产生恶心、呕吐、腹痛、腹泻等。有致敏作用,因血管神经障碍而致牙龈出血;可致湿疹样皮炎。慢性影响:长期接触该品有时可致角膜混浊、继发性贫血、白细胞增多等。⒉燃爆危险:该品易燃,具刺激性,具致敏性。编辑本段毒理学资料毒性:属低毒类。急性毒性:LD505620mg/kg(大鼠经口);4940mg/kg(兔经口);LC505760mg/m3,8小时(大鼠吸入);人吸入2000ppm×60分钟,严重毒性反应;人吸入800ppm,有病症;人吸入400ppm短时间,眼、鼻、喉有刺激。亚急性和慢性毒性:豚鼠吸入2000ppm,或7.2g/m3,65资助接触,无明显影响;兔吸入16000mg/m3×1小时/日×40日,贫血,白细胞增加,脏器水肿和脂肪变性。编辑本段危险特性易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触会猛烈反应。在火场中,受热的容器有爆炸危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。燃烧(分解)产物:一氧化碳、二氧化碳。现场应急监测方法:气体检测管法实验室监测方法:无泵型采样气相色谱法(WS/T155-1999,作业场所空气)应急处理处置方法:一、泄漏应急处理迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。小量泄漏:用活性炭或其它惰性材料吸收。也可以用大量水冲洗,洗水稀释后放入废水系统。大量泄漏:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。编辑本段实验室制法化学方程式:CH3CH2OH+CH3COOH==浓硫酸;加热==CH3CH2OOCCH3+H2O[3] 乙酸乙酯的制取:先加乙醇,再加浓硫酸(加入碎瓷片以防暴沸),最后加乙酸,然后加热(可以控制实验)。
乙酸的酯化反应制乙酸乙酯
乙酸乙酯的方程式:乙酸酯化反应方程式
1:酯化反应是一个可逆反应。为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。一般是使反应物酸和醇中的一种过量。在工业生产中,究竟使哪种过量为好,一般视原料是否易得、价格是否便宜以及是否容易回收等具体情况而定。在实验室里一般采用乙醇过量的办法。乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。2:制备乙酸乙酯时反应温度不宜过高,要迅速升温至170℃左右,温度在140℃时会产生乙醚和亚硫酸或乙烯等杂质。液体加热至沸腾后,应改用小火加热。事先可在试管中加入几
片碎瓷片,以防止液体暴沸。3:导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。 3.1:浓硫酸既作催化剂,又做吸水剂。 3.2:Na2CO3溶液的作用是:⑴饱和碳酸钠溶液的作用是冷凝酯蒸气,减小酯在水中的溶解度(利于分层),除出混合在乙酸乙酯中的乙酸,溶解混合在乙酸乙酯中的乙醇。⑵Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。 3.3:为有利于乙酸乙酯的生成,可采取以下措施:⑴制备乙酸乙酯时,反应温度不宜过高。⑵最好使用冰醋酸和无水乙醇。同时采用乙醇过量的办法。
⑶起催化作用的浓硫酸的用量很小,但为了除去反应中生成的水,浓硫酸的用量要稍多于乙醇的用量。⑷使用无机盐Na2CO3溶液吸收挥发出的乙酸。
3.4:用Na2CO3不能用碱(NaOH)的原因。虽然也能吸收乙酸和乙醇,但是碱会催化乙酸乙酯彻底水解,导致实验失败。 3.5:乙稀与醋酸直接酯化生产醋酸乙酯用磷酸盐作催化剂。 3.6:乙醛缩合法:以烷基铝为催化剂将乙醛进行缩合反应生产醋酸乙酯国外工业生产大多采用此工艺。编辑本段检测可燃气体浓度报警器用来检测可燃气体的泄露。当工业环境中有可燃气体泄露时,当可燃气体浓度报警器检测到气体浓度达到爆炸临界点时,可燃气体浓度报警器就会发出报警信号,以提醒现场工作人员采取安全措施,并驱动排风、切断、喷淋系统,防止发生爆炸、火灾、中毒事故,从而保障安全生产。[
乙酸乙酯(EA),又名醋酸乙酯,是应用最广泛的脂肪酸酯之一,具有优良的溶解性能,是一种快干性的、极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树酯、乙酸纤维树酯、合成橡胶等生产:也可用于生产复印机用液体硝基纤维墨水;在纺织工业中用作清洗剂;食品工业中用作特殊改性酒精的香味萃取剂;香料1=业中是最重要的香料添加剂,可作为调香剂的组分。以外,EA也可用作粘合剂的溶剂、油漆的稀释剂以及制造药物、染料的原料。
1.1 国际市场分析
乙酸乙酯由于其特殊的性能,在世界化工市场相当活跃。美国和日本是世界上最大的乙酸乙酯生产和消费国。全世界生产能力中美国占31.73%,日本占35.75%。美国的主要生产公司是Easmmn公司、Hoechst Calanese及孟山都公司,总生产能力为127 kt/a 日本的主要生产公司是千叶乙酸乙酯、日本合成化学、德山石油化学及协和油化,总生产能力为193 kWa。在亚洲地区,乙酸乙酯的主要市场是日本、中国和东南亚,日本是该地区乙酸乙酯的净出口国,约占该地区生产能力的50%。近年来,日本的乙酸乙酯产量以每年10%的速率增长,增加量基本
用于出口。亚洲地区的生产缺口达70 kt/a,目前主要从美国和欧洲进El。
1.2 国内供需及预测
(1)生产能力
目前,我国乙酸乙酯的生产企业有3o多家,年生产能力在万吨以上的仅有两家,其余均为千吨级生产装置,除上海石化采用乙醛法生产、山东临沭化肥厂采用乙醇脱氢法生产外都是采用直接酯化法
(2)产量和进口量
我国己酸乙酯生产能力及产量近10年来稳步增长,1996年生产能力比1985
年增长两倍,产量也比1985年翻一番随着我国化学工业及相关业的发展,对乙酸乙酯的需求也不断增长。目前国内的乙酸乙酯的供需缺口只有通过进口来弥补1996年进口量为35 kt,而1999年进口量已达到64.8 kt。
(3)消费段市场预测
随着我国化学工业、医药工业及汽车工业的迅速发展,我国乙酸乙酯消费量将加速增长。据预测,到2O(O 年乙酸乙酯的年需求增长率为6.5%,2005—2010年将以每年5.2%的速度增长。在欧美市场的消费结构中,欧美国家乙酸乙酯消耗的最大领域在涂料行业,乙酸乙酯的消耗
在该行业中占50%以上。而我国的乙酸乙酯在涂料行业中的消耗仅24%。这主要是因为国产涂料在汽车和电子工业的应用发展不快,随着我国汽车工业和电子工业迅速发展,必将会带动国内乙酸乙酯消费的加。
表1为2005年和2010年我国乙酸乙酯的市场需求预测情况
表1 2OO$和2010年乙醴乙酯需求预测
我国对乙酸乙酯需求的增长率很高,要满足
市场需求不能仅靠进口。虽然国内乙酸乙酯的生
产厂家比较多.但大多数采用传统的酯化法,产量
小,生产工艺落后,使生产成本较高,产品的市场
竞争力较弱。目前,受国际市场的冲击,许多厂已
处于停产或半停产状态,国内乙酸乙酯市场产品
缺口很大。
2
2 工业乙酸乙酯的制备方法
目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。传统的乙酸酯化法工艺在国外被逐步淘汰而大规模生产装置主要是乙醛缩合法和乙醇脱氢法,在乙醛原料较丰富的地区万吨级以匕的乙醛缩合法装置得到了广泛的应用。乙醇脱氧法
是近年开发的新工艺,在乙醇丰富且低成本的地区得到了推广最新的乙酸乙酯生产方法是乙烯加成法,1998年在印度尼西亚迈拉库地区采用日本昭和电工专利技术建成了50 kt/a生产装置。
(1)乙酸酯化法
乙酸酯化法是传统的乙酸乙酯生产方法,在催化剂存在下,由乙酸和乙醇发生酯化反应而得。
CH3CH2OH+CH3C00H=CH3C00CH2CH3+H20
乙醇乙酸乙酸乙酯水
反应除去生成水,可得到高收率,该法生产乙酸乙酯的主要缺点是成本高、
设备腐蚀性强,在国际上是属于被淘汰的工艺路线
(2)乙醛缩合法
在催化剂乙醇铝的存在下,两个分子的乙醛自动氧化和缩合,重排形成一分子的乙酸乙酯。
2CH3CHO→CH3COOCH2CH3
乙醛乙酸乙酯
该方法加世纪70年代在欧美、日本等地已形成了大规模的生产装置,在生产成本和环境保护等方面都有着明显的优势
(3)乙醇脱氢法
采用铜基催化剂使乙醇脱氢生成粗乙酸乙酯,经高低压蒸馏除去共沸物,得到纯度为99.8%以上乙酸乙酯。
2C2H5OH →CH3COOCH2CH3+H2
乙醇乙酸乙酯氢
(4)乙烯加成法
在以附载在二氧化硅等载体上的杂多酸金属盐或杂多酸为催化剂的存在下,乙烯气相水合后与气化乙酸直接酯化生成乙酸乙酯。
CH2CH2+CH3COOH=CH3COOCH2CH3
乙烯乙酸乙酸乙酯
该反应乙酸的单程转化率为66%,以乙烯计乙酸乙酯的选择性为94%。Rhone.Poulenc、昭和电工和BP等跨国公司都开发了该生产工艺。
由于上海石化股份有限公司具有丰富的乙烯、乙酸和乙醛,故本文对乙酸酯化法、乙醛缩合法和乙烯加成法生产乙酸乙酯的技术经济指标予以对比分析。
3 技术经济指标对比
对于同为80 kt/a级的工业己酸乙酯生产装置,分析其各项经济技术指标,对比如表2。由表2可看出,在3种方法中,乙醛法生产乙酸乙酯的蒸汽消耗明显低于另两种方法,综合总能源消耗乙醛法要远低于乙烯法和乙酯法。由于乙醛法生产乙酸乙酯在国外,特别是日本已处于成熟阶段,而我国在加世纪9o年代中间试验的基础上刚实现万吨级工业化,所以技术指标和国外先进水平还有差距。
制备乙酸乙酯的工业方法研究
摘要摘要摘要摘要::::乙酸乙酯是一种重要的精细化学品应用比较广泛,世界需求量很大。其主要工业制备方法有乙酸酯化法、乙醛缩合法、乙醇脱氢法和乙烯加成法。本文介绍了四种制法的反应原理和工艺特点,结合当代社会精细化工产业的发展特点对这几种制法进行比较分析。关键字关键字关键字关键字::::乙酸乙酯酯化反应反应机理乙醛缩合乙醇脱氢乙烯加成Abstract: Ethyl acetate is an important fine chemicals,it is used widely in the world and in great demand.The main industrial preparation of ethyl acetate are acid esterification,oxidation of acetaldehyde,ethanol dehydrogenation and ethylene-plus method.This article describes the principle of the reaction system of law and process characteristics.With contemporary society characterized by the development of fine chemical industry we compare these various methods . Keywords: ethyl acetate、esterification、reaction mechanis、aldehyde condensation
Dehydrogenation of ethanol、Addition of ethylene 1.1.1.1.前言前言前言前言精细化工产品(即精细化学品)是指那些具有特定的应用功能,技术密集,商品性强,产品附加值较高的化工产品。精细化工产品种类多、附加值高、用途广、产业关联度大,直接服务于国民经济的诸多行业和高新技术产业的各个领域。大力发展精细化工已成为我国调整化学工业结构、提升化学工业产业能级和扩大经济效益的战略重点[1]。乙酸乙酯( EA),又名醋酸乙酯,作为一类重要的精细化学品应用较为广泛,具有良好的溶解性、快干性,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树酯、乙酸纤维树酯、合成橡胶等生产;也可用于生产复印机用液体硝基纤维墨水;在纺织工业中用作清洗剂;食品工业中用作特殊改性酒精的香味萃取剂;香料工业中是重要的香料添加剂,可作为调香剂的组分。此外,乙酸乙酯也可用作黏合剂的溶剂、油漆的稀释剂以及制造药物、染料的原料。近年来乙酸乙酯在国内外的应用增长较快,1990-2000年间,国内生产能力年均增长率在14%左右,产量年均增长10%。近几年国内乙酸乙酯的生产能力及产量虽在迅速上升,但进口量却有增无减,乙酸乙酯是目前国内进口量较大的有机化工产品,国内的生产能力虽比较大,但多数装置规模小,不具竞争力,在技术和成本上无法与大型装置抗衡,将逐步被淘汰。虽然目前国内的生产企业也在不断改进技术、扩大生产规模,国外公司也进入中国通过建立合资企业建设先进的乙酸酯类生产装置,但国内快速发展的市场,尤其是建筑、汽车等行业在未来几年内的强劲发展,必定推动国内乙酸酯类的需求[2-4]。 2.2.2.2.工业制法工业制法工业制法工业制法乙酸乙酯工业化生产方法主要有乙酸酯化法、乙醛缩合法、乙醇脱氢法,以及乙烯加成法等[5]。2.1 2.1 2.1 2.1 乙酸酯化法乙酸酯化法乙酸酯化法乙酸酯化法在浓硫酸催化作用,乙醇与乙酸发生酯化反应生成乙酸乙酯,化学反应方程式如下:C2H5 OH+ CH3COOH
CH3COOC2 H5+ H2 O 其机理如下图1所示
仔细分析酯化机理我们不难发现,真正起催化作用的是浓硫酸提供的H+ ,因此,只要是质子酸,如常见的其他质子酸HCl、HNO3、H3PO4在理论上都能起催化作用。此法又有间歇法和连续法工艺,无论是间歇法还是连续法大都使用硫酸做催化剂。该法存在以下缺点:反应温度高、乙酸利用率低、易发生副反应、设备腐蚀、废液污染环境、生产成本高。然而,由于这种生产工艺存在反应温度高、乙酸利用率低、易发生副反应、腐蚀设备、废液污染环境、生产成本高等缺点,长期以来,科研工作者在催化剂方面和生产工艺改进方面做了大量的工作[6],如用酸性阳离子交换树脂、分子筛、杂多酸和固体超强酸等来代替硫酸,以解决设备腐蚀和污染问题,但这些催化剂催化活性下降快,催化效率较低,成本高,以及与现有工艺的适用性等问题,至今没有实现工业化。2.2 2.2 2.2 2.2 乙醛缩合法乙醛缩合法乙醛缩合法乙醛缩合法在乙醇铝催化剂作用下,在0-20℃时乙醛自动氧化缩合成乙酸乙酯,化学反应式如下:2CH3CHO CH3COOC2H5 上述方法20世纪70年代在欧美、日本等地已形成了大规模的生产装置,在生产成本和环境保护等方面有着明显的优势。20世纪90年代,我国在中间实验的基础上刚实现万吨级工业化,所以技术指标和国外先进水平还有差距。该法不存在大量水的共沸问题,容易得到纯度为99.5%以上的优级品。因而,与直接酯化法比,该法具有下列优点:反应条件温和、反应转化率和乙酸乙酯的收率高、原料成本低、经济效益明显,但该方法存在如下缺点:一是催化剂制备技术难度较大且在
水中易被水解;二是该反应为放热反应,需要用温度较低的冰盐水冷却。2.3 2.3 2.3 2.3 乙醇氧化法乙醇氧化法乙醇氧化法乙醇氧化法从原料的来源和成本分析,以乙醇为原料的合成路线较合理、廉价。乙醇氧化法按其反应机理可分为2种双功能催化剂体系。2.3.1 氧气参与反应采用Pd-Cu/分子筛催化剂,反应温度为150℃,乙醇被氧化为乙酯乙酯,其机理如下
C2H5OH+?O2 CH3CHO+ H2 O CH3CHO+?O2
CH3 COOH C2H5 OH+ CH3COOH CH3COOC2H5 + H2O
2.3.2 无氧气参与反应以Cu/ CoO/ ZnO/ Al2O3混合氧化物为催化剂,乙醇在碱中心上脱氢为乙醛,乙醛在水的参与下通过酸碱协同作用歧化为乙酸和乙醇,乙酸和乙醇再在酸中心上酯化为乙酸乙酯。其机理如下[7]:C2H5OH CH3CHO+ H2 2CH3 CHO+ H2O C2 H5 OH+ CH3COOH C2H5 OH+ CH3COOH CH3COOC2 H5 + H2 O
歧化反应所需的水来自原料乙醇中的水分,酯化反应所产生的水又可循环使用,是一种具有产率高、无腐蚀和原料成本低廉的合成路线。使用这种催化剂并同时采用先进后处理技术的整套工业装置在山东临沐化肥厂正式投产运行,单程转化率66%以上,单程选择性92% 以上,产品纯度99% 以上。但该方法存在着催化剂表面性质的复杂性,除了目标产物乙酸乙酯外,还生成醚、醛、酸和4 碳以上的酯。因此,进一步调变催化剂组分以改善其催化性能,特别是提高其选择性仍是今后重点研究的课题
2.4 2.4 2.4 2.4 乙烯加成法乙烯加成法乙烯加成法乙烯加成法采用负载在二氧化硅等载体上的杂多酸金属盐或杂多酸为催化剂,乙酸和乙烯在反应温度为150℃、压力为1.0MPa 条件下反应生成乙酸乙酯。其化学反应方程式如下CH3 COOH+ C2 H4 CH3COOC2H5 上述反应过程在多段管状反应器中进,在每段之间移走反应热以抑制
3.3.3.3.结论结论结论结论中国精细化工工业在发展的同时,一些问题也日益显露出来。特别是科研开发体制改革进展缓慢,重复建设严重,低档产品居多,精细化率低,附加值不高,企业规模小,集中度低,配置效率不高等严重等制约了行业的进一步发展和品质的提高。因此,中国精细化工企业必须抓住新的发展形势,加大科技创新,开展技术前瞻研究,建立和完善技术创新体系和机制,完善配套措施,提高整体效益和竞争力,为企业创造公平竞争的外部环境,淘汰、削减或限制落后的产品和生产工艺,只有这样才能在新形势下立于不败之地。我国对乙酸乙酯需求的增长率很高,要满足市场需求不能仅靠进口,因此我们应该坚持高起点、高水平、统一规划;坚持技术开发与市场开发同步进行;加大科技投入、集中科技力量;加强国际合作[9]。根据我国现状,现在常用的工业生产方法有乙酸酯化法、乙醛缩合法、乙醇脱氢法,以及乙烯加成法,比较这四种制备方法得出以下结论:(1)工业生产乙酸乙酯的各种方法中,乙醛法、乙烯法和酯化法均为成熟的工艺路线并且能得到高质量的乙酸乙酯产品,而酯化法生产工艺存在反应温度高、乙酸利用率低、易发生副反应、腐蚀设备、废液污染环境、生产成本高、生产产品质量达到优级品的难度相对较大等缺点,在国际上是属于被淘汰的工艺路线[10]。(2)乙醇脱氢法存在着催化剂表面性质的复杂性,除了目标产物乙酸乙酯外,还生成醚、醛、酸和4 碳以上的酯。因此,进一步调变催化剂组分以改善其催化性能,特别是提高其选择性仍是今后重点研究的课题。(3)按目前国内市场价格分析,乙酸乙酯的生产成本依次为乙醛法、乙
烯法和酯化法。其中,酯化法的生产成本高很多,所以乙醛法和乙烯法比酯化法更有市场竞争力。乙烯法因其工艺特点,在同规模装置中总投资最高。
目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。传统的乙酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要是乙醛缩合法和乙醇脱氢法,在乙醛原料较丰富的地区万吨级以上的乙醛缩合法装置得到了广泛的应用。乙醇脱氢法是近年开发的新工艺,在乙醇丰富且低成本的地区得到了推广。最新的乙酸乙酯生产方法是乙烯加成法,1998年在印度尼西亚迈拉库地区采用日本昭和电工专利技术建成了50 kt/a生产装置。(1)乙酸酯化法乙酸酯化法是传统的乙酸乙酯生产方法,在催化剂存在下,由乙酸和乙醇发生酯化反应而得。CH3CH2OH+CH3COOH=CH3COOCH2CH3+H2O 乙醇乙酸乙酸乙酯水反应除去生成水,可得到高收率。该法生产乙酸乙酯的主要缺点是成本高、设备腐蚀性强,在国际上是属于被淘汰的工艺路线。(2)乙醛缩合法在催化剂乙醇铝的存在下,两个分子的乙醛自动氧化和缩合,重排形成一分子的乙酸乙酯。2CH3CHO→CH3COOCH2CH3 乙醛乙酸乙酯该方法20世纪70年代在欧美、日本等地已形成了大规模的生产装置,在生产成本和环境保护等方面都有着明显的优势。(3)乙醇脱氢法采用铜基催化剂使乙醇脱氢生成粗乙酸乙酯,经高低压蒸馏除去共沸物,得到纯度为99.8%以上乙酸乙酯。2C2H5OH→CH3COOCH2CH3+H2 乙醇乙酸乙酯氢(4)乙烯加成法在以附载在二氧化硅等载体上的杂多酸金属盐或杂多酸为催化剂的存在下,乙烯气相水合后与气化乙酸直接酯化生成乙酸乙酯。CH2CH2+CH3COOH=CH3COOCH2CH3 乙烯乙酸乙酸乙酯该反应乙酸的单程转化率为66%,以乙烯计乙酸乙酯的选择性为94%。Rhone-Poulenc 、昭和电工和BP等跨国公司都开发了该生产工艺。
课程设计概念设计
课程设计概念设计 荆楚理工学院课程设计任务书 设计题目:3000吨/年乙酸乙酯项目概念设计。 教研室主任:许维秀指导教师:危想平 2019年11月 乙酸乙酯车间工艺设计 一、设计任务 1.设计任务:乙酸乙酯项目概念设计 2.产品名称:乙酸乙酯 3、设计规模:3000吨/年乙酸乙酯 4、开工时间:7000小时/年 3、原料组成:冰醋酸100%、乙醇95%、硫酸93% 4、全装置总收率,损耗分配和设备类型自定 5.产品用途:作为制造乙酰胺、乙酰乙酸酯、甲基庚烯酮、其他有机化合物、合成香料、合成药物等的原料;用于乙醇脱水、乙酸浓缩、萃取有机酸;作为溶剂广泛应用于各 种工业中;食品工业中作为芳香剂等。 二、概述 1.乙酸乙酯性质及用途 乙酸乙酯又名乙酸乙酯,乙酸醚,英文名称Ethyl Acetate或 Acetic Ether Vinegar naphtha.乙酸乙酯是具有水果及果酒芳香的无色透明液体,其沸点为77℃,熔点为-83.6℃,密度为0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等有机溶剂。 乙酸乙酯的重要用途是工业溶剂,它是许多树脂的高效溶剂,广泛应用于油墨、人造革、胶粘剂的生产中,也是清漆的组份。它还用于乙基纤维素、人造革、油毡、着色纸、 人造珍珠的粘合剂、医用药品、有机酸的提取剂以及菠萝、香蕉、草莓等水果香料和威士忌、奶油等香料。此外,还用于木材纸浆加工等产业部门。对于用很多天然有机物的加工,例如樟脑、脂肪、抗生素、某些树脂等,常使用乙酸乙酯和乙醚配制成共萃取剂,它还可 用作纺织工业和金属清洗剂。 2.乙酸乙酯发展状况
(1)国内发展状况 为了改进硫酸法的缺点,国内陆续开展了新型催化剂的研究,如酸性阳离子交换树脂 ﹑全氟磺酸树脂﹑HZSM-5等各种分子筛﹑铌酸﹑ZrO2-SO42-等各种超强酸,但均未用于 工业生产。 国内还开展了乙醇一步法制取乙酸乙酯的新工艺研究,其中有清华大学开发的乙醇脱 氢歧化酯化法,化学工业部西南化工研究院开发的乙醇脱氢法和中国科学院长春应用化学 研究所的乙醇氧化酯化法。 中国科学研究院长春应用化学研究所对乙醇氧化酯化反应催化剂进行了研究,认为采 用Sb2O4-MoO3复合催化剂可提高活性和选择性。化学工业部西南化工研究院等联合开发 的乙醇脱氢一步合成乙酸乙酯的新工艺,已通过单管试验连续运行1000小时,取得了满 意的结果。现正在进行工业开发工作。 近来关于磷改性HZSM-5沸石分子筛上乙酸和乙醇酯化反应的研究表明,用HZSM-5及 磷改性HZSM-5作为乙酸和乙醇酯化反应的催化剂,乙醇转化率变化不大,但酯化反应选 择性明显提高。 使用H3PMo12O40?19H2O代替乙醇-乙酸酯化反应中的硫酸催化剂,可获得的产率为 91.48%,但是关于催化剂的剂量、反应时间和乙醇/乙酸的质量比对产品产量的研究 还在进行之中。 (2)国外发展状况 由于使用硫酸作为酯化反应的催化剂存在硫酸腐蚀性强、副反应多等缺点,近年各国 均在致力于固体酸酯化催化剂的研究和开发,但这些催化剂由于价格较贵、活性下降快等 原因,至今工业应用不多。据报道,美Davy Vekee公司和UCC公司联合开发的乙醇脱氢 制乙酸乙酯新工艺已工业化。 据报道,国外开发了一种使用Pd/silicoturgstic双效催化剂使用乙烯和氧气一步生 成乙酸乙酯的新工艺。低于180℃和在25%的乙烯转化率的条件下,乙酸乙酯的选择性为46%。催化剂中的Pd为氧化中心silicoturgstic酸提供酸性中心。 随着科技的不断进步,更多的乙酸乙酯的生产方法不断被开发,我国应不断吸收借鉴 国外的先进技术,从根本上改变我国乙酸乙酯的生产状况。 三. 乙酸乙酯的生产方案及流程 1.酯化法 酯化工艺是在硫酸催化剂存在下,乙酸与乙醇发生酯化脱水反应生成乙酸乙酯的工艺。
醋酸乙酯的生产技术
醋酸乙酯的生产技术 醋酸乙酯( EA) 又名乙酸乙酯, 分子式为C4H8O2, 为具有水果香味的无色透明液体, 具有优异的溶解性、挥发速度和快干性, 在工业中主要用作生产涂料、粘合剂、乙基纤维素、氯化橡胶、乙烯树脂、乙酸纤维素酯、纤维素乙酸丁酯、人造革、油毡着色剂以及人造纤维等的溶剂, 也可作为粘合剂用于印刷油墨、人造珍珠等的生产, 作为提取剂用于医药、有机酸产品等的生产, 此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料, 在纺织工业中用作清洗剂等。近年来, 随着世界经济持续稳定增长, 建筑、汽车等行业发展迅速, 环保法规日益严格, 采用高档溶剂生产涂料、油墨、粘合剂等产品已成大势所趋, 从而带动醋酸乙酯类溶剂需求的快速增长。 一、生产技术及其进展 目前, 乙酸乙酯的工业生产方法主要有: 醋酸酯化法 乙醛缩合法 乙醇脱氢法 醋酸/ 乙烯加成法 4 种。 目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。传统的乙酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要是乙醛缩合法和乙醇脱氢法,在乙醛原料较丰富的地区万吨级以上的乙醛缩合法装置得到了广泛的应用。乙醇脱氢法是近年开发的新工艺,在乙醇丰富且低
成本的地区得到了推广。最新的乙酸乙酯生产方法是乙烯加成法,1998年在印度尼西亚迈拉库地区采用日本昭和电工专利技术建成了50 kt/a生产装置。大规模生产装置主要采用后三种方法,其中新建装置多采用乙烯加成法。 (1)乙酸酯化法 乙酸酯化法是传统的乙酸乙酯生产方法,在催化剂存在下,由乙酸和乙醇发生酯化反应而得。 CH3CH2OH+CH3COOH=CH3COOCH2CH3+H2O 乙醇乙酸乙酸乙酯水 反应除去生成水,可得到高收率。该法生产乙酸乙酯的主要缺点是成本高、设备腐蚀性强,在国际上是属于被淘汰的工艺路线。 (2)乙醛缩合法 在催化剂乙醇铝的存在下,两个分子的乙醛自动氧化和缩合,重排形成一分子的乙酸乙酯。 2CH3CHO→CH3COOCH2CH3 乙醛乙酸乙酯 该方法20世纪70年代在欧美、日本等地已形成了大规模的生产装置,在生产成本和环境保护等方面都有着明显的优势。 (3)乙醇脱氢法 采用铜基催化剂使乙醇脱氢生成粗乙酸乙酯,经高低压蒸馏除去共沸物,得到纯度为99.8%以上乙酸乙酯。 2C2H5OH→CH3COOCH2CH3+H2 乙醇乙酸乙酯氢 (4)乙烯加成法 在以附载在二氧化硅等载体上的杂多酸金属盐或杂多酸为催化剂的存在下,乙烯气相水合后与气化乙酸直接酯化生成乙酸乙酯。 CH2CH2+CH3COOH=CH3COOCH2CH3
乙酸乙酯的结构特点和主要化学性质
酯 学案 宋清冬 学习目标:乙酸乙酯的结构特点和主要化学性质。乙酸乙酯水解的基本规律。 温故知新:酯的定义。写出乙酸与乙醇反应的方程式。 学习内容: 一、酯 1、酯的一般通式: 。饱和一元羧酸和饱和一元醇形成的酯的分子式为 ,所以这种酯与碳原子数相同的饱和一元羧酸互为同分异构体。 2、酯的通性 物理性质:酯 溶于水,易溶于 ,密度比水 ,低级酯有果香味。这种特殊的性质往往被用来鉴别酯类化合物。 3、酯的命名:酯类化合物是根据生成酯的酸和醇的名称来命名的,例如: 4、酯的化学性质: 乙酸乙酯在 条件下完全水解; 乙酸乙酯在 条件下部分水解; 乙酸乙酯仅在加热的条件下不水解或几乎不水解。 总之在有酸(或碱)存在并加热的条件下,酯类水解生成相应的酸(或盐)和醇。 RCOOR ` + H 2O RCOOR ` + H 2O RCOOH + NaOH → 或合并为 二、酯化反应 1、一元羧酸与一元醇之间的酯化反应 CH 3COOH + HOC 2H 5 2、一元羧酸与多元醇之间的酯化反应 2CH 3COOH + CH 2OH CH 2OH 3、多元羧酸与一元醇之间的酯化反应 COOH COOH + 2CH 3CH 2OH 三、思考交流 1.为什么酒存放时间越久越香? 2.喝醋不能解酒? 3、日常生活中,我们经常使用热的纯碱水溶液(显碱性)洗涤炊具上的油污,分析这是利用了什么原理? 当堂练习 1.下列分子式只能表示一种物质的是 A.C 3H 7Cl B.CH 2Cl 2 C.C 2H 6O D.C 2H 4O 2 2.下列基团:-CH 3、-OH 、-COOH 、-C 6H 5,相互两两组成的有机物有 A.3种 B.4种 C.5种 D.6种 3、尼泊金甲酯可在化妆品中作防腐剂。结构简式为 , 下列说法中不正确的是 A 、该物质属于芳香烃 B 、该物质的分子式为C 8H 8O 3 C 、该物质能够和FeCl 3反应,使溶液呈紫色 D 、在一定条件下,1mol 该物质最多能和2molNaOH 反应 4.下面四种变化中,有一种变化与其他三种变化类型不同的是: A .CH 3CH 2OH + CH 3COOH CH 3COOCH 2CH 3 + H 2O B .CH 3CH 2OH 浓硫酸 170℃ CH 2=CH 2↑+H 2O C .2CH 3CH 2OH 浓硫酸 140℃ CH 3CH 2OCH 2CH 3 + H 2O D. CH 3CH 2OH + HBr CH 3CH 2Br + H 2O 5. 甲组中的 能跟乙组中的所有物质发生反应,乙组中的 也能跟甲组的所有物质发生反应 6、图为实验室制乙酸乙脂的装置。 1)在大试管中配制一定比例的乙醇、乙酸和浓H 2SO 4混合液的方法为: 然后轻轻的振荡试管,使之混合均匀。 2)装置中通蒸汽的导管要插在饱和Na 2CO 3溶液的液面以上,不能插在溶液中,目的是 3)浓H 2SO 4的作用: (1) (2) 4)饱和Na 2CO 3的作用:(1) (2) 5)试管中加入沸石的作用: 6)实验室生成的乙酸乙脂,其密度比水 (填“大”或“小”), 有 的气味。 浓H 2SO 4
化工设计专业课程设计
南京工业大学 《化工设计》专业课程设计 设计题目乙醛缩合法制乙酸乙酯 学生姓名胡曦班级、学号化工091017 指导教师姓名任晓乾 课程设计时间2012年5月12日-2012年6月1日 课程设计成绩 设计说明书、计算书及设计图纸质量,70% 独立工作能力、综合能力及设计过程表现,30% 设计最终成绩(五级分制) 指导教师签字
目录一、设计任务3 二、概述4 2.1乙酸乙酯性质及用途4 2.2乙酸乙酯发展状况4 三. 乙酸乙酯的生产方案及流程5 3.1酯化法5 3.2乙醇脱氢歧化法7 3.3乙醛缩合法7 3.4乙烯、乙酸直接加成法9 3.5各生产方法比较9 3.5确定工艺方案及流程9 四.工艺说明10 4.1. 工艺原理及特点10 4.2 主要工艺操作条件错误!未定义书签。 4.3 工艺流程说明10 4.4 工艺流程图(PFD)错误!未定义书签。4.5物流数据表10 4.6物料平衡错误!未定义书签。 4.6.1工艺总物料平衡10 4.6.2 公共物料平衡图错误!未定义书签。 五. 消耗量19 5.1 原料消耗量19 5.2 催化剂化学品消耗量19 5.3 公共物料及能量消耗21 六. 工艺设备19 6.1工艺设备说明19 6.2 工艺设备表19 6.3主要仪表数据表19 6.4工艺设备数据表19 6.5精馏塔Ⅱ的设计19 6.6最小回流比的估算21 6.7逐板计算23 6.8逐板计算的结果及讨论23 七. 热量衡算24 7.1热力学数据收集24
7.2热量计算,水汽消耗,热交换面积26 7.3校正热量计算、水汽消耗、热交换面积(对塔Ⅱ)29 八.管道规格表24 8.1 装置中危险物料性质及特殊储运要求24 8.2 主要卫生、安全、环保说明26 8.3 安全泄放系统说明24 8.4 三废排放说明26 九.卫生安全及环保说明24 9.1 装置中危险物料性质及特殊储运要求24 9.2 主要卫生、安全、环保说明26 9.3 安全泄放系统说明24 9.4 三废排放说明26 表10校正后的热量计算汇总表34 十有关专业文件目录34 乙酸乙酯车间工艺设计 一、设计任务 1.设计任务:乙酸乙酯车间 2.产品名称:乙酸乙酯 3.产品规格:纯度99.5% 4.年生产能力:折算为100%乙酸乙酯10000吨/年 5.产品用途:作为制造乙酰胺、乙酰醋酸酯、甲基庚烯酮、其他有机化合物、合成香料、合成药物等的原料;用于乙醇脱水、醋酸浓缩、萃取有机酸;作为溶剂广泛应用于各种工业中;
乙酸乙酯的生产
乙酸乙酯的生产 吴尚08化工040803222 摘要:介绍了乙酸乙酯的原料及产品的价格和物理数据等,同时对工业生产乙酸乙酯的反应机理、工艺路线、工艺流程、主要设备、产品分离、三废处理进行了分类介绍。 关键词:乙酸乙酯;生产工艺;物理数据 乙酸乙酯,又名醋酸乙酯,是乙酸的主要下游产品,是重要的精细化工原料。它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的生产中,或作为原料、或作为工艺溶剂、萃取剂、稀释剂等等;由于它具有天然水果香味,因此还可作为调香剂组分,应用于香料、食品工业中;也可作为粘合剂用于印刷油墨、人造珍珠等的生产;作为提取剂用于医药、有机酸的产品的生产等;此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料。近年来乙酸乙酯在国内外的应用增长较快,随着国内涂料、粘合剂产品环保要求的进一步提高,乙酸乙酯作为无毒溶剂,其应用得到广泛的重视,我国涂料行业已逐渐使用环保型涂料,因此将会进一步推动乙酸乙酯的市场增长。 一、乙酸乙酯的物理参数 外观:无色澄清液体。 香气:有强烈的醚似的气味,清灵、微带果香的酒香,易扩散,不持久。 熔点(℃):-83.6; 折光率(20℃):1.3708—1.3730; 沸点(℃):77.06; 相对密度(水=1):0.894—0.898; 相对蒸气密度(空气=1):3.04; 饱和蒸气压(kPa):13.33(27℃); 燃烧热(kJ/mol):2244.2; 临界温度(℃):250.1; 临界压力(MPa):3.83; 辛醇/水分配系数的对数值:0.73;
闪点(℃)(开杯):7.2; 引燃温度(℃):426; 爆炸上限%(V/V):11.5; 爆炸下限%(V/V):2.0; 室温下的分子偶极距:6.555*10^-30; 溶解性:微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。 二、乙酸乙酯的主要生产工艺 目前,乙酸乙酯的工业生产方法主要有醋酸酯化法、乙醛缩合法、乙醇脱氢法和醋酸/乙烯加成4种。传统的醋酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要采用乙醛缩合法、乙醇脱氢法和醋酸/乙烯加成法,其中新建装置多采用醋酸/乙烯加成法,我国的乙酸乙酯则主要采用醋酸酯化法进行生产。 2.1传统的乙酸/乙醇酯化法 有机羧酸与醇类在无机强酸催化作用下发生酯化作用生成酯类,这是有机羧酸的主要性质之一,乙酸乙酯即是由乙酸和乙醇在浓硫酸催化剂参与下进行酯化反应制得的。这个反应是可逆的,将乙醇过量以及有效移除反应产生的水,可以提高乙酸乙酯的产得率,通常反应的平衡转化率为67%。 CH3COOH+C2HsOH≠CH3COOC2H5+H20 乙酸乙醇乙酸乙酯水 工业生产可以是间歇的,也可以是连续的,这主要取决于生产规模。连续的工艺流程如图1所示。 现简述于下:乙酸、95%浓度的乙醇和96%浓度硫酸(加料量的1%)混合后连续流过预热器,再导人酯化塔,在塔内允许混合物返流.适量的馏出物从塔顶馏出,塔顶温度控制在80%。 酯化塔馏出物含约70%醇、20%酯和10%水(乙酸在塔内完全消耗),被送入分离塔,在该塔内允许该三元混合物返流,从约700℃的分离塔顶馏出三元共沸物(83%乙酸乙酯,9%乙醇,8%水)导人比例混合器,与相等容积的水混合后,在澄清器内澄清分层。 底层是含有少量醇和酯的水液层,被导人分离塔下部,回收其中的酯,多余的含醇水液返回酯化塔下部,醇被蒸出,酯化塔底馏分是硫酸等重组分废液,送去废水处理系统。 澄清器上层液层含93%乙酸乙酯、5%水和2%醇,溢流进人干燥塔,在该塔内,酯被充分蒸馏除水和醇。塔顶凝液含少量酯和醇,返回酯化塔再利用,侧线取出纯度95%以上的乙酸乙酯去贮槽或再进一步精制。 由于使用硫酸作催化剂,不仅对设备造成腐蚀,大量含酸废液也造成处理困难和污染环境等问题,另外由于转化率较低,造成原料消耗高,导致生产成本增
乙酸乙酯皂化反应实验报告(详细参考)
浙江万里学院生物与环境学院 化学工程实验技术实验报告 实验名称:乙酸乙酯皂化反应 姓名成绩 班级学号 同组姓名实验日期 指导教师签字批改日期年月日
一、实验预习(30分) 1.实验装置预习(10分)_____年____月____日 指导教师______(签字)成绩 2.实验仿真预习(10分)_____年____月____日 指导教师______(签字)成绩 3.预习报告(10分) 指导教师______(签字)成绩 (1)实验目的 1.用电导率仪测定乙酸乙酯皂化反应进程中的电导率。 2.掌握用图解法求二级反应的速率常数,并计算该反应的活化能。 3.学会使用电导率仪和超级恒温水槽。 (2)实验原理 乙酸乙酯皂化反应是个二级反应,其反应方程式为 CH3COOC2H5+Na++OH-→CH3COO-+Na++C2H5OH 当乙酸乙酯与氢氧化钠溶液的起始浓度相同时,如均为a,则反应速率表示为 (1)式中,x为时间t时反应物消耗掉的浓度,k为反应速率常数。将上式积分得 (2) 起始浓度a为已知,因此只要由实验测得不同时间t时
的x值,以对t作图,应得一直线,从直线的斜率便可求出k值。 乙酸乙酯皂化反应中,参加导电的离子有OH-、Na+和CH3COO-,由于反应体系是很稀的水溶液,可认为CH3COONa是全部电离的,因此,反应前后Na+的浓度不变,随着反应的进行,仅仅是导电能力很强的OH-离子逐渐被导电能力弱的CH3COO-离子所取代,致使溶液的电导逐渐减小,因此可用电导率仪测量皂化反应进程中电导率随时间的变化,从而达到跟踪反应物浓度随时间变化的目的。 令G0为t=0时溶液的电导,G t为时间t时混合溶液的电导,G∞为t=∞(反应完毕)时溶液的电导。则稀溶液中,电导值的减少量与CH3COO-浓度成正比,设K为比例常数,则 由此可得 所以(2)式中的a-x和x可以用溶液相应的电导表示,将其代入(2)式得: 重新排列得: (3) 因此,只要测不同时间溶液的电导值G t和起始溶液的电导值G0,然后 以G t对作图应得一直线,直线的斜率为,由此便求出某温 度下的反应速率常数k值。由电导与电导率κ的关系式:G=κ代入(3)式得: (4) 通过实验测定不同时间溶液的电导率κt和起始溶液 的电导率κ0,以κt,对作图,也得一直线,从直线的斜率也可求出反应速率数k值。如果知道不同温度下的反应速率常数k(T2)和k(T1),根据Arrhenius公式,可计算出该反应的活化能E和反应半衰期。 (5)
富马酸二甲酯合成工艺设计
一.设计任务 1、基本数据 生产任务:年产200吨富马酸二甲酯 反应原料纯度:顺丁烯二酸 98% 甲醇 98% 硫酸 98% 生产要求:年工作日为300天,间歇生产 2、设计内容及要求 (一)内容 1、对富马酸二甲酯反应系统的物料衡算、热量衡算; 2、主体反应设备合成釜的选型计算以及辅助设备的选型计算; 3、绘制物料衡算的工艺流程图(一张); 4、绘制带控制节点的的工艺流程图(一张); 5、绘制车间平面布置图(一张); 6、编制设计说明书(一份)。 (二)具体要求 1、绘制的带控制点的工艺流程图必须符合化工制图的规范,并且字体必须工整。 2、编制的课程设计说明书应对计算过程与工艺流程的选择以及控点的确定进行详细的说明和解释。 二.产品简介 富马酸二甲酯为由甲醇与富马酸或顺丁烯二酸酐、顺丁烯二酸酯化而成,简称富马酯(DMF) ,学名反丁烯二甲酯、别名延胡索酸二甲酯,结构式 ( :CHCOOCH3) 2 ,分子式C6H8O4 ,是无色或白色鳞片晶体,熔点102~105 ℃, 常温会升华,无味,略具酯的香味,易溶于氯仿、醇、丙酮、乙酸乙酯,可溶于苯、甲苯、CCl4 ,微溶于水及热水中,对光稳定,在紫外线及阳光下72 h 基本无变化,110 ℃热 1 h 不分解,对热、碱、盐也有一定的稳定性。但其水溶液对热的酸、碱稳定性较差,对氧化剂、还原剂、蛋白质、纤维、脂肪、糖等有好的稳定性,对金属无腐蚀性,其水溶液pH 值为 6. 7~7. 3 ,所以DMF 性质稳定。富马酸二甲酯(DMF)是目前国内外研究开发的一种新型防霉防腐剂,具有良好的抑菌杀菌作用,其应用pH 值范围较广(为3~8) ,可在酸性或中性条件下使用,能抑制30 多种霉菌。其综合抗菌防腐性能优于目前常用的苯甲酸、山梨酸、丙酸及
氰乙酸乙酯MSDS
氰乙酸乙酯MSDS 1、物质的理化常数 国标编号: 61646 CAS: 105-56-6 中文名称: 氰乙酸乙酯 英文名称: ethyl cyanocaetate 别名: 分子式: C5H7NO2;NCCH2COOCH2CH3 分子量: 113.12 熔点: -22.5℃沸点:206~2 密度: 相对密度(水=1)1.06 蒸汽压: 110℃ 溶解性: 微溶于水、碱液、氨水,可混溶于乙醇、乙醚 稳定性: 稳定 外观与性 状: 无色液体,略有气味 危险标记: 14(有毒品) 用途: 用于有机合成,制药工业,染料工业 2.对环境的影响 该物质对环境有危害,应特别注意对水体的污染。 一、健康危害 侵入途径:吸入、食入、经皮吸收。 健康危害:低浓度时实验动物有呼吸急促、流泪、嗜睡、精神萎靡、反应迟钝;浓度稍高还可出现呼吸困难,侧卧,眼球突出;浓度高时出现极度呼吸困难,痉挛,死亡。可经皮吸收引起中毒死亡。
二、毒理学资料及环境行为 急性毒性:LD50400~3200mg/kg(大鼠经口);LC50550mg/m3,2小时(大鼠吸入) 危险特性:遇明火能燃烧。受高热或与酸接触会产生剧毒的氰化物气体。与强氧化剂接触可发生化学反应。遇水或水蒸气反应放出有毒的或易燃的气体。 燃烧(分解)产物:一氧休碳、二氧化碳、氧化氮。 3.现场应急监测方法 水质快速比色管法(日本制,氰化物) 4.实验室监测方法 气相色谱法,参照《分析化学手册》(第四分册,色谱分析),化学工业出版社 5.环境标准 前苏联车间空气中有害物质的最高容许浓度2mg/m3 6.应急处理处置方法 一、泄漏应急处理 迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。不要直接接触泄漏物。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。小量泄漏:用砂土或其它不燃材料吸附或吸收。大量泄漏:构筑围堤或挖坑收容。用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。 二、防护措施 呼吸系统防护:可能接触其蒸气时,应该佩戴自吸过滤式防毒面具(半面罩)。紧急事态抢救或撤离时,建议佩戴自给式呼吸器。 眼睛防护:戴安全防护眼镜。 身体防护:穿聚乙烯防毒服。 手防护:戴橡胶手套。
乙酸乙酯
乙酸乙酯 乙酸乙酯得分子式就是C4H8O2,CAS号为141-78-6、就是乙酸中得羟基被乙氧基取代而生成得化合物.无色透明液体,有水果香,易挥发,对空气敏感,能吸水分,水分能使其缓慢分解而呈酸性反应。可用作纺织工业得清洗剂与天然香料得萃取剂,也就是制药工业与有机合成得重要原料。 基本信息 乙酸乙酯 Aceticether 醋酸乙酯 CH3COOC2H5 相对分子质量 88、11 有机物-酯 不管制 密封阴凉干燥保存 展开 分子结构 乙酸乙酯 基本信息 中文名称:乙酸乙酯 英文名称:Ethyl acetate 中文别名:醋酸乙酯;醋酸乙脂[1] 英文别名:Acetic acidethylester;ethyl acetate B&J brand4 L; ETHYLA CETATE ULTRARESI—ANAL、; ETHYL ACETATE CAPILLARYGRADE;Eth ylAcetate Specially Purified —SPECIFIED; Acetic Ether;RFE; aceti cester CAS号:141—78-6 分子式:C4H8O2
分子量:88、1051 物性数据 1、性状:无色澄清液体,有芳香气味,易挥发.[1] 2、熔点(℃):-8 3、6[2] 3、沸点(℃):77、2[3] 4、相对密度(水=1):0、90(20℃)[4] 5、相对蒸气密度(空气=1):3、04[5] 6、饱与蒸气压(kPa):10、1(20℃)[6] 7、燃烧热(kJ/mol):—2072[7] 8、临界温度(℃):250、1[8] 9、临界压力(MPa):3、83[9] 10、辛醇/水分配系数:0、73[10] 11、闪点(℃):—4(CC);7、2(OC)[11] 12、引燃温度(℃):426、7[12] 13、爆炸上限(%):11、5[13] 14、爆炸下限(%):2、2[14] 15、溶解性:微溶于水,溶于乙醇、丙酮、乙醚、氯仿、苯等多数有机溶剂.[15]16、黏度(mPa·s,20oC):0、449 17、闪点(oC,闭口):-3 18、闪点(oC,开口):7、2 19、燃点(oC):425、5 20、蒸发热(KJ/mol,b、p、):32、28 21、熔化热(KJ/mol):118、99 22、生成热(KJ/mol):446、31 23、比热容(KJ/(kg·K),20、4oC,定压):1、92 24、电导率(S/m,25oC):3、0×10—9 25、热导率(W/(m·K),20oC):0、15198 26、体膨胀系数(K-1,20oC):0、00139 27、临界密度(g·cm—3):0、308 28、临界体积(cm3·mol-1):286 29、临界压缩因子:0、255 30、偏心因子:0、366 31、溶度参数(J·cm—3)0、5:18、346 32、van derWaals面积(cm2·mol-1):7、790×109
11乙酸乙酯皂化反应试题
实验十一乙酸乙酯皂化反应 第一题、填空题 1. 乙酸乙酯溶液应在使用前现配,目的是____________________________。 2. 乙酸乙酯皂化反应中,我们将酯加入到NaOH溶液中,而不是反过来操作,目的是__________________________________________。 3. 二级反应的速度常数有K=1/t(a-b)lnb(a-x)/a(b-x)和K=X/a(a-x)·1/t二种形式,条 件分别为__________________________和______________________________。 4.乙酸乙酯皂化反应,K(G0--G t )可表示________________________________。 5.乙酸乙酯皂化反应中,给出了________________________,测定_________________,用_________________与______________________作图处理,求得反应速度常数。 6. 测定乙酸乙酯皂化反应中的实验用水应为。 7. 常时间放置的去离子水内含有。 8. 测量溶液电导值时,须对其恒温,因为____________________,若温度升高,则电导 值_____________________。 9.乙酸乙酯皂化反应中,以K t对(K0 -K t )/t作图,初期点偏离直线的原因是_________________或__________________所致。 10.电导池常数是法得到的。向电导池内加入溶液的量定量加入,因为 11. 电导测量时须使用____电源,目的是防止____________________。 12.电导法测HAc电离常数时,测量KCI溶液电导的目的是_____________________。 13.电导池常数是____________________________法得到的。 14. 若将15℃下配制的饱和硫酸钡溶液用电导法测其25℃时的Ksp,其结果必然 _________理论值。 15. 电导电极上镀有一层铂黑目的是__________________________________,防止__________________________。 16. 电导测量时,若采用直流电将_________________,若采用低频交流电,会使电极__________。 第二题、选择题 1.若将氢氧化钠加入到乙酸乙酯中一半时作为反应起点,不考虑酯的挥发,对所测结果: 有正误差;有负误差;
乙酸乙酯的反应器设计流程
摘要 乙酸乙酯是一类重要的有机溶剂和有机化工基本原料,其用途非常广泛,目前我国采用传统的方法制备即乙酸和乙醇为原料,浓硫酸为催化剂直接催化合成乙酸乙酯。所以通过对乙酸乙酯的理化性质,社会用途与需求和国内外发展现状进行研究调查以及乙酸乙酯在实验室制法和工业生产各方面对比之后,为此对乙醇和乙酸的缩合进行了乙酸乙酯合成工艺的课程设计。本选题为年产量为年产5017吨乙酸乙酯的反应器的设计。对工业生产中的物料衡算,热量衡算和合成工艺的设备等方面为间歇釜式反应器的工业设计提供较为详尽的数据与图纸。本选题为年产量为年产5017吨乙酸乙酯的反应器的设计。 关键字:乙酸;乙醇;乙酸乙酯;合成工艺;间歇式反应器 Abstract Ethyl acetate is a kind of important organic solvents and basic organic chemical raw materials,
its application is very broad, our country prepared using traditional methods that acetic acid and ethanol as raw material, concentrated sulfuric acid catalyzed direct synthesis of ethyl acetate. So through the social use of physical and chemical properties of ethyl status quo needs, and conduct research and development at home and abroad as well as various aspects of ethyl acetate after comparing laboratory and industrial production system of law, for the condensation of ethanol and acetic acid were synthesis of ethyl curriculum design. The topic for the annual production of 5,017 tons annual output of ethyl reactor design. In industrial production of material balance, heat balance and synthesis process equipment to provide more detailed data and drawings for the batch tank reactor industrial design. The topic for the annual production of 5,017 tons annual output of ethyl reactor design. Key words: Acetic acid; Ethanol; Ethyl acetate; Synthesis process; Batch reactor 目录 摘要 (Ⅰ) Abstract (Ⅱ) 第一章前言 (4) 1.1 乙酸乙酯概述 (4)
乙酸乙酯
第一部分化学品及企业标识 化学品中文名:乙酸乙酯 化学品英文名:Ethyl acetate 企业名称:安徽时联特种溶剂股份有限公司 企业地址:安徽省安庆市皖河大道7号 邮编: 246001 传真: 联系电话: 电子邮件地址:企业应急电话: 产品推荐及限制用途:用作溶剂及合成苯的衍生物,如香料、染料、塑料、医药、炸药、橡胶等。
第二部分危险性概述 紧急情况概述:易燃液体。 GHS危险性类别:根据《化学品分类和标签规范》(GB 30000-2013),该产品属于易燃液体-2,特异性靶器官系统毒性一次接触-3,严重眼睛损伤/眼睛刺激性 -2. 标签要素: 标签要素: 象形图: 警示词:危险 危险信息:高度易燃液体和蒸气;可能引起呼吸道刺激,可能引起昏昏欲睡或眩晕; 引起严重眼睛刺激。 防范说明:该物质对环境有危害,应特别注意对水体的污染。 【预防措施】 远离热源、火花、明火和热表面。 禁止吸烟。保持容器密闭。 使用防爆的电气/ 通风/ 照明设备。只能使用不产生火花的工具。采 取防止静电放电的措施。 避免吸入粉尘/烟/气体/烟雾/蒸气/喷雾。操作后彻底清洁皮肤。使用 本产品时不要进食、饮水或吸烟。 只能在室外或通风良好之处使用。戴防护手套/穿防护服/戴护目镜/戴 面罩。 【应急响应】 如果吞咽并觉不适: 立即呼叫解毒中心或就医。 如皮肤(或头发)沾染:立即去除/ 脱掉所有沾染的衣服。用水清洗皮 肤/ 淋浴。如觉皮肤刺激:求医/就诊。脱掉玷污的义务,清洗后方可 再用。
如吸入:将患者移至新鲜空气处并保持呼吸舒适姿势休息。 如与眼睛接触:用水缓慢温和地冲洗几分钟。如戴隐形眼镜并可方便 的取出,然后继续冲洗。如仍觉眼睛刺激:求医/就诊。 如食入:漱口,呼救解毒控制中心或医生。 火灾时:用干砂,干粉或抗溶性泡沫扑灭。 【安全储存】 存放于通风良的地方。保持容器密闭。保持低温。存放处须加锁。 【废弃处置】 将内容物/ 容器处理到得到批准的废物处理厂。 物理化学危险:高度易燃液体,遇强氧化剂或明火有火灾危险,高温天气下暴露在空气中有自燃危险。 健康危害:吸入:吸入可能有害。可能引起呼吸道刺激。蒸气可引起睡意和眩昏。摄入:误吞对人体有害。皮肤:如果通过皮肤吸收可能是有害的。可能造成皮肤刺激。眼睛:造成严重眼刺激。 环境危害:对水生生物有害,污染水源。
乙酸乙酯
乙酸乙酯 乙酸乙酯的分子式是C4H8O2,CAS号为141-78-6.是乙酸中的羟基被乙氧基取代而生成的化合物。无色透明液体,有水果香,易挥发,对空气敏感,能吸水分,水分能使其缓慢分解而呈酸性反应。可用作纺织工业的清洗剂和天然香料的萃取剂,也是制药工业和有机合成的重要原料。 基本信息 乙酸乙酯 Aceticether 醋酸乙酯 CH3COOC2H5 相对分子质量 88.11 有机物-酯 不管制 密封阴凉干燥保存 展开 分子结构 乙酸乙酯 基本信息 中文名称:乙酸乙酯 英文名称:Ethyl acetate 中文别名:醋酸乙酯;醋酸乙脂[1] 英文别名:Acetic acid ethyl ester; ethyl acetate B&J brand 4 L; ETHYLACETATE ULTRA RESI-ANAL.; ETHYL ACETATE CAPILLARY GRADE; Ethyl Acetate Specially Purified - SPECIFIED; Acetic Ether; RFE; acetic ester
CAS号:141-78-6 分子式:C4H8O2 分子量:88.1051 物性数据 1.性状:无色澄清液体,有芳香气味,易挥发。[1] 2.熔点(℃):-8 3.6[2] 3.沸点(℃):77.2[3] 4.相对密度(水=1):0.90(20℃)[4] 5.相对蒸气密度(空气=1):3.04[5] 6.饱和蒸气压(kPa):10.1(20℃)[6] 7.燃烧热(kJ/mol):-2072[7] 8.临界温度(℃):250.1[8] 9.临界压力(MPa):3.83[9] 10.辛醇/水分配系数:0.73[10] 11.闪点(℃):-4(CC);7.2(OC)[11] 12.引燃温度(℃):426.7[12] 13.爆炸上限(%):11.5[13] 14.爆炸下限(%):2.2[14] 15.溶解性:微溶于水,溶于乙醇、丙酮、乙醚、氯仿、苯等多数有机溶剂。[15] 16.黏度(mPa·s,20oC):0.449 17.闪点(oC,闭口):-3 18.闪点(oC,开口):7.2 19.燃点(oC):425.5 20.蒸发热(KJ/mol,b.p.):32.28 21.熔化热(KJ/mol):118.99 22.生成热(KJ/mol):446.31 23.比热容(KJ/(kg·K),20.4oC,定压):1.92 24.电导率(S/m,25oC):3.0×10-9 25.热导率(W/(m·K),20oC):0.15198 26.体膨胀系数(K-1,20oC):0.00139 27.临界密度(g·cm-3):0.308 28.临界体积(cm3·mol-1):286 29.临界压缩因子:0.255 30.偏心因子:0.366
关于制取乙酸乙酯的注意事项
制取乙酸乙酯的要点归纳 乙酸的酯化反应制乙酸乙酯的方程式: CH3COOH + CH3CH2OH === CH3COOC2H5 + H2O (此反应为可逆反应、需加热、浓硫酸作催化剂、吸水剂) 关于药品加入的几种顺序的解释: 第一种:先加入乙酸后缓慢加入浓硫酸,并不断搅拌。再加入乙醇。这个方法的好处是可以减少乙醇的挥发。但由于乙酸中加入浓硫酸后放热,使乙酸产生挥发而损失原料,从工业角度的“最低廉成本制取最大量产物”的原则考虑,乙酸较乙醇贵,所以这个方法可行但一般不取用。 第二种:先加入乙酸和乙醇,之后再缓慢加入浓硫酸,并不断搅拌。这个方法比上面一个安全。但同样会造成原料挥发而产生损失。如果对比起来,第二种方法优于第一种方法。 第三种:最佳的药品加入的顺序:先加乙醇→再加浓硫酸→最后加乙酸→然后加热 原因解释:酯化反应是一个可逆反应。为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。一般是使反应物酸和醇中的一种过量。在工业生产中,究竟使哪种过量为好,一般视原料是否易得、价格是否便宜以及是否容易回收等具体情况而定。而在实验室里一般采用乙醇过量的办法,乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。由于浓硫酸的密度比乙醇和醋酸和密度都要大。浓硫酸与乙醇混合后会放出大量的热。若先加浓硫酸,由于乙醇的密度小,加入后会浮在液体表面,导致在表面放热,使表面的液体沸腾、溅出,很危险。此种方法当然也会造成乙醇挥发损失,但前面说过,乙醇相对乙酸便宜。所以冰醋酸放到最后加。 注意事项: 1、制备乙酸乙酯时反应温度不宜过高,要保持在60 ℃~70 ℃左右,温度过高时会产生乙醚和亚硫酸等杂质。液体加热至沸腾后,应改用小火加热。事先可在试管中加入几片碎瓷片,以防止液体暴沸。 2、导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。 3、浓硫酸既作催化剂,又做吸水剂。 4、Na2CO3溶液的作用是: (1)饱和碳酸钠溶液的作用是冷凝酯蒸气,减小酯在水中的溶解度(利于分层),吸收蒸出的乙酸和乙醇。 (2)Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。 5、为有利于乙酸乙酯的生成,可采取以下措施: (1)制备乙酸乙酯时,反应温度不宜过高,保持在60 ℃~70 ℃。不能使液体沸腾。 (2)最好使用冰醋酸和无水乙醇,同时采用乙醇过量的办法。 (3)起催化作用的浓硫酸的用量很小,但为了除去反应中生成的水,浓硫酸的用量要稍多于乙醇的用量。 (4)使用无机盐Na2CO3溶液吸收挥发出的乙酸。
乙酸乙酯车间工艺设计
目录 一、设计任务 (2) 二、概述 (2) 1.乙酸乙酯性质及用途 (2) 2.乙酸乙酯发展状况 (3) 三. 乙酸乙酯的生产方案及流程 (4) 1、酯化法 (4) 2. 乙醇脱氢歧化法 (5) 3、乙醛缩合法 (6) 4、乙烯、乙酸直接加成法 (7) 5、确定工艺方案及流程 (8) 四.工艺计算 (8) 4.1. 物料衡算 (8) 4.2 初步物料衡算 (10) 五. 设备设计 (16) 5.1 精馏塔Ⅱ的设计 (16) 5.2最小回流比的估算 (18) 5.3 逐板计算 (20) 5.4 逐板计算的结果及讨论 (20) 六. 热量衡算 (21) 6.1 热力学数据收集 (21) 6.2 热量计算,水汽消耗,热交换面积 (23) 6.3 校正热量计算、水汽消耗、热交换面积(对塔Ⅱ) (26) 表10校正后的热量计算汇总表 (32)
乙酸乙酯车间工艺设计 一、设计任务 1.设计任务:乙酸乙酯车间 2.产品名称:乙酸乙酯 3.产品规格:纯度99% 4.年生产能力:折算为100%乙酸乙酯1880吨/年 5.产品用途:作为制造乙酰胺、乙酰乙酸酯、甲基庚烯酮、其他有机化合物、合成香料、合成药物等的原料;用于乙醇脱水、乙酸浓缩、萃取有机酸;作为溶剂广泛应用于各种工业中;食品工业中作为芳香剂等。 由于本设计为假定设计,因此有关设计任务书中的其他项目如:进行设计的依据、厂区或厂址、主要技术经济指标、原料的供应、技术规格以及燃料种类、水电汽的主要来源,与其他工业企业的关系、建厂期限、设计单位、设计进度及设计阶段的规定等均从略。 二、概述 1.乙酸乙酯性质及用途 乙酸乙酯又名乙酸乙酯,乙酸醚,英文名称Ethyl Acetate或 Acetic Ether Vinegar naphtha.乙酸乙酯是具有水果及果酒芳香的无色透明液体,其沸点为77℃,熔点为-83.6℃,密度为0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等有机溶剂。 乙酸乙酯的重要用途是工业溶剂,它是许多树脂的高效溶剂,广泛应用于油墨、人造革、胶粘剂的生产中,也是清漆的组份。它还用于乙基纤维素、人造革、油毡、着色纸、人造珍珠的粘合剂、医用药品、有机酸的提取剂以及菠萝、香蕉、草莓等水果香料和威士忌、奶油等香料。此外,还用于木材纸浆加工等产业部门。对于用很多天然有机物的加工,例如樟脑、
4-工业乙酸乙酯中醋酸含量的测定习题及答案(精)
一、选择题 1、用H2 C2 O4 · 2H2O 标定KMnO4溶液时,溶液的温度一般不超过(D ),以防H2 C 2 O 4的分解。 A. 60 ° C B. 75 ° C C. 40 ° C D. 85 ° C 2、用纯水将下列溶液稀释10 倍,其中pH 值变化最大的是(A )。 A. 0.1 mol/L HCl B. 0.1 mol/L HAc C. 1 mol/L NH 3 · H 2 O D. 1 mol/L HAc + 1 mol/L NaAc 3、用同一KMnO 4 标准溶液分别滴定等体积的FeSO 4 和H 2 C 2 O 4 溶液,消耗等体积的标准溶液,则FeSO 4与H 2C 2O 4两种溶液的浓度之间的关系为(A )。 A. B. C. D. 4. 若用0.1000mol/L KOH溶液分别滴定2 5.00mL 某H2SO4和HAc溶液,若消耗的体积相等, 则表示这两种溶液中 ( D ) (A) [H+]相等(B) c(H2SO4) = c(HAc) (C) c(H2SO4) = 2c(HAc) (D) 2c(H2SO4) = c(HAc) 5. 现有一含H3PO4和NaH2PO4的溶液,用NaOH标准溶液滴定至甲基橙变色, 滴定体积为a(mL)。同一试液若改用酚酞作指示剂, 滴定体积为b(mL)。则a 和b 的关系是( C ) (A) a>b(B) b = 2a(C) b>2a(D) a = b 二、简答 1、与其他基准物质比较,邻苯二甲酸氢钾有什么优点? 答案: 邻苯二甲酸氢钾易制得纯品,在空气中不吸水,易保存,摩尔质量大,与NaOH反应的计量比为1:1 2、已标定的NaOH溶液在保存中吸收了二氧化碳,用它来测定HCI的浓度,若以酚酞为指示剂对测定结果有何影响?改用甲基橙,又如何? 答案: 测定C HCI,用酚酞指示剂,偏高(多消耗NaOH)
