第8章_三元相图_笔记及课后习题详解(已整理_袁圆_2014.8.7)

8.1 复习笔记
一、三元相图的基础
三元相图的基本特点:完整的三元相图是三维的立体模型;三元系中的最大平衡相数为四。三元相图中的四相平衡区是恒温水平面;三元系中三相平衡时存在一个自由度,所以三相平衡转变是变温过程,反应在相图上,三相平衡区必将占有一定空间。
1.三元相图成分表示方法
(1)等边成分三角形
图8-1 用等边成分三角形表示三元合金的成分
三角形内的任一点S都代表三元系的某一成分点。
(2)等边成分三角形中的特殊线
①等含量规则:平行于三角形任一边的直线上所有合金中有一组元含量相同,此组元为所对顶角上的元素。
②等比例规则:通过三角形定点的任何一直线上的所有合金,其直线两边的组元含量之比为定值。
③背向规则:从任一组元合金中不断取出某一组元,那么合金浓度三角形位置将沿背离此元素的方向发展,这样满足此元素含量不断减少,而其他元素含量的比例不变。
④直线定律:在一确定的温度下,当某三元合金处于两相平衡时,合金的成分点和两平衡相的成分点必定位于成分三角形中的同一条直线上。
(3)成分的其他表示方法:
①等腰成分三角形:两组元多,一组元少。
②直角成分坐标:一组元多,两组元少。
③局部图形表示法:一定成分范围内的合金。
2.三元相图的空间模型
图8-2 三元匀晶相图及合金的凝固(a)相图(b)冷却曲线
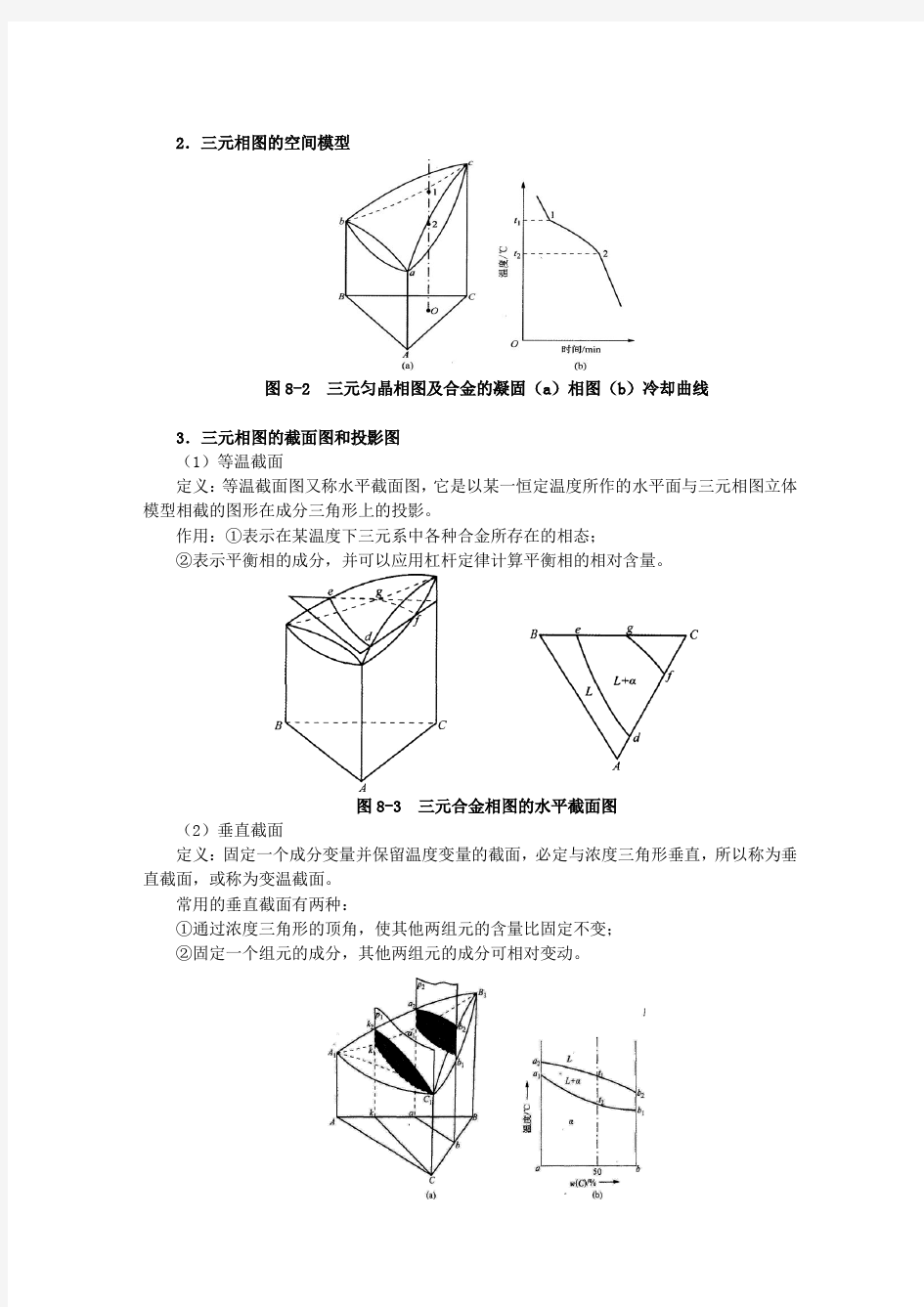
3.三元相图的截面图和投影图
(1)等温截面
定义:等温截面图又称水平截面图,它是以某一恒定温度所作的水平面与三元相图立体模型相截的图形在成分三角形上的投影。
作用:①表示在某温度下三元系中各种合金所存在的相态;
②表示平衡相的成分,并可以应用杠杆定律计算平衡相的相对含量。
图8-3 三元合金相图的水平截面图
(2)垂直截面
定义:固定一个成分变量并保留温度变量的截面,必定与浓度三角形垂直,所以称为垂直截面,或称为变温截面。
常用的垂直截面有两种:
①通过浓度三角形的顶角,使其他两组元的含量比固定不变;
②固定一个组元的成分,其他两组元的成分可相对变动。
图8-4 三元相图的垂直截面图
(3)三元相图的投影图
定义:把三元立体相图中所有相区的交线都垂直投影到浓度三角形中,就得到了三元相图的投影图。
4.三元相图中的杠杆定律及重心定律
(1)杠杆定律
(2)重心定律
二、固态互不溶解的三元共晶相图
1.相图的空间模型
图8-5 组元在固态完全不互溶的三元共晶相图
A、B、C三组元的初始结晶面:ae1Ee3a、be1Ee2b、ce2Ee3c
共晶转变线:
e1E:L→A+B
e2E:L→B+C
e3E:L→C+A
E点为三元共晶点:L E→A+B+C
2.截面图
(1)垂直截面图:
①垂直截面图中的水平线不一定是恒温转变线,但三相区之间的水平线是恒温转变线;
②At截面是一个特殊截面,结晶出的是纯组元A相,由直线法则可知a’q’是连接线。故该温度下可求A和L的相对量。
图8-6 垂直截面图(a)浓度三角形(b)rs截面(c)At截面
(2)水平截面图
①两相区和单相区之间的分界线是曲线;
②两相区和三相区之间的分界线是直线,实际山是两个相区分界的联结线;
③三相区是三角形。
图8-7 不同温度下的水平截面图
3.投影图
图8-8所示的投影图中,粗线e1E,e 2E和e 3E是3条共晶转变线的投影,它们的交点E是三元共晶点的投影。
图8-8 三元相图的水平投影图
利用这个投影图分析合金的凝固过程,不仅可以确定相变临界温度,还能确定各相的成分和相对含量。
合金组织组成物的相对含量可以利用杠杆法则进行计算;位于投影图(见图8-8)中各个区域的合金之室温组织列于表8-1中。
表8-1 固态完全不溶、具有共晶转变的三元合金系中典型合金的室温组织
4.相区接触法则
三元相图也遵循二元相图同样的相区接触法则,即相邻相区的相数差1(点接触除外)。
三、固态有限互溶的三元共晶相图
1.相图分析
(1)液相面和固相面
液、固两相平衡区和单相固溶体区之间都存在一个和液相面共轭的固相面,即:固相面afmla和液相面ae1Ee3a共轭
固相面bgnhb和液相面be1Ee2b共轭
固相面cipkc和液相面ce2Ee3c共轭
图8-9 组元在固态有限溶解的共晶相图
五种相界面:3个液相面,6个两相共晶转变起始面,3个单相固相面,3个两相共晶终止面(即为两相固相面),1个四相平衡共晶平面。
六种区域:液相区;3个单相固溶体区;3个液、固二相平衡区;3个固态两相平衡区,3个发生两相共晶转变的三相平衡区及1个固态二相平衡区。
图8-10 三元共晶相图的两相区和三相区的立体投影图
(2)二元共晶转变的空间结构
二元共晶转变的空间结构是三棱柱体,三条棱是三条单变量
(3)三元共晶转变面
成分为E的液相在水平面mnp(三元共晶转变面)发生四相平衡的共晶转变:
L E→αm+βn+γp
(4)三个固相平衡三棱台
(5)固溶体的溶解度曲面
六个固溶度曲面,每个固溶度曲面表示有由某个固溶体析出另外两个中的一个固溶体(表示为二次固溶体)。
(6)单相区
2.投影图
图8-11 三元共晶相图的投影图
表8-2 固态有限互溶、具有共晶转变的三元合金系结晶过程和室温组织 合金所在区
结晶过程
室温组织
Ⅰ L α→
α
Ⅱ ,L ααβ→→Ⅱ
αβ+Ⅱ Ⅲ ,,L ααβαβγ→→→+ⅡⅡⅡ
αβγ++ⅡⅡ
Ⅳ
,,,L L ααβαββα→→+→→ⅡⅡ
()ααβαβ++++ⅡⅡ
Ⅴ
,,,,L L ααβαββααβγβαγ→→+→→→+→+ⅡⅡ
ⅡⅡⅡⅡ
()ααβαβγ+++++ⅡⅡⅡ
Ⅵ
,,,,L L L ααβαβγ
αβγβαγγαβ→→+→++→+→+→+ⅡⅡⅡⅡⅡⅡ
()()
ααβαβγαβγ++++++++ⅡⅡⅡ
Ⅶ(在mE 上的合金) ,,,L L ααβγαβγβαγγαβ→→++→+→+→+ⅡⅡ
ⅡⅡⅡⅡ
()ααβγαβγ++++++ⅡⅡⅡ
2.截面图
(1)水平截面图:
图8-12 固态有限互溶的三元合金系水平截面图特点:①三相区都呈三角形;
②三相区以三角形的边与两相区连接,相界线就是相邻两相区边缘的共轭线;
③两相区一般以两条直线及两条曲线作为周界。
(2)垂直截面图
图8-13三元共晶相图的垂直截面(a)投影图(b)VW截面(c)QR截面
五、包共晶型三元系相图
包共晶转变的反应式为
L+α→β+γ
其中A-B系具有包晶转变,A-C系也具有包晶转变,B-C系具有共晶转变
六、具有四相平衡包晶转变的三元系相图
四相平衡包晶转变的反应式为
L+α+β→γ
七、形成稳定化合物的三元系相图
组元之间形成稳定的三元化合物,分析相图时把这些化合物看作独立组元。各种化合物彼此之间、化合物和纯组元之间都可以组成伪二元系,从而把相图分割成几个独立的区域。
图8-14 一组二元系中形成稳定化合物的三元合金相图
八、三元相图小结
1.单相状态
处于单相状态时,自由度数为f=4-1=3,一个温度变量和两个相成分的独立变量。占据了一定的温度和成分范围,且可以独立变化。它的截面可以是各种形状的平面图形。
2.两相平衡
两相平衡区的自由度为2,除了温度之外,其中某一相的某一个组元的含量是独立可变的。在三元系中,一定温度下的两个平衡相之间存在着共轭关系。两相区与三相区的界面由不同温度下两个平衡相的共轭线组成。
3.三相平衡
三相平衡时系统的自由度为1,即温度和各相成分只有一个是可以独立变化的。
4.四相平衡
三元系四相平衡的自由度为零,即平衡温度和平衡相的成分都是固定的。三元系中四相平衡转变如下表所示。
表8-3 三元系中的四相平衡转变
8.2课后习题详解
8-1 某三元合金K在温度为T1时分解为B组元和液相,两个相的相对量。已知合金K中A组元和C组元的重量比为3,液相含B量为40%,试求合金K的成分。
答:由已知条件作图如下,温度T1组元B、液相L和合金K应在一条直线上,则由杠杆定律可得:
合金K中w(B)=80%,又已知:w(A)+w(C)=100%-80%=20%和w(A)=3w (B)。由此解得:A,C的质量分数分别为15%,5%。
即K合金成分为:A,B,C的质量分数分别为15%,80%,5%。
8-2 三组元A,B和C的熔点分别是1000℃,900℃和750℃,三组元在液相和固相都完全互溶,并从三个二元系相图上获得下列数据。
①在投影图上作出950℃和850℃的液相线投影。
②在投影图上作出950℃和850℃的固相线投影。
③画出从A组元角连接到BC中点的垂直截面图。
答:①根据已知条件分别作AB,AC和BC二元相图,并假设液相线和固相线是光滑的,然后在三个二元相图上作950℃的割线,可在AB二元相图上得到与液相线相交点的B,A的质量分数约为70%,30%,在AC二元相图上与液相线相交点的C,A的质量分数约为35%,65%,而在BC相图上则不与液相线相交。最后在三元投影图上,用光滑曲线连接两个二元成分,即为950℃液相线的近似投影,同理可得850℃的液相线投影。(见下图ab)
②作图同上,如图37(a)中虚线所示。
③如图37(b)所示。
8-3 图8-3所示,已知A,B,C三组元固态完全不互溶,A,B,C的质量分数分别为80%,10%,10%的O合金在冷却过程中将进行二元共晶反应和三元共晶反应,在二元共晶反应开始时,该合金液相成分(a点)A,B,C的质量分数分别为60%,20%,20%,而三元共晶反应开始时的液相成分(E点)A,B,C的质量分数分别为50%,10%,40%。
①试计算A初%,(A+B)%和(A+B+C)%的相对量。
②写出图中I和P合金的室温平衡组织。
答:①
②I合金:B+(A+B+C)共晶
P合金:(B+C)共晶+(A+B+C)共晶
8—4 A,B,C的质量分数分别为40%,30%和30%的三元系合金在共晶温度形成三相平衡,三相成分如下:
①计算液相、α相和β相各占多少分数。
②试估计在同一温度,α相和β相的成分同上,但各占50%时合金的成分。
答:首先作一浓度三角形,如图38所示,然后标上各相成分,合金成分点为:
①
②设合金成分为x,并必定在α-β相成分点的连线上,由杠杆定律得:
再从浓度三角形上查得w(B)=14.5%,w(C)=38%。
8-5 Cu-Sn-Zn三元系相图在600℃时的部分等温截面如图8-5所示。
①请在此图中标出合金成分点P点(Cu-32%Zn-5%Sn),Q点(Cu-40%Zn-6%Sn)和T点(Cu-33%Zn-1%Sn),并指出这些合金在600℃时由哪些平衡相组成?
②若将5kg的P合金、5kg的Q合金和10kg的T合金熔合在一起,则新合金的成分为多少?
答:见下图:
①在600℃时合金P由α+β相组成;合金Q由β+γ相组成;合金T由α相组成。
②设所求合金中铜、锡、锌的质量分数分别为w(Cu),w(Sn),w(Zn)。根据已知条件,
P,Q,T合金分别占新合金中的质量分数为25%,25%,50%,由重心定律可得:
w(Ca)=25%×63%+25%×54%+50%×66%=62.25%
w(Sn)=25%×5%+25%×6%+50%×l%=3.25%
w(Zn)=25%×62%+25%×40%+50%×33%=34.5%
即新合金的成分Cu,Sn,Zn的质量分数分别为62.25%,3.25%,34.5%。
8-6 根据图8—6中的合金X,在四相反应前为Q+R+U三相平衡,四相反应后为U+Q+V 三相平衡。试证明:该反应为R→Q+U+V类型反应。
答:如图8-6所示,X成分的合金经过四相平衡温度时会发生如下反应:
R+U+Q→U+V+Q
反应前U相和Q相的相对量为(用重心定律在△QRU上计算)
反应后U相和Q相的相对量为(用重心定律在△QUV上计算)
显然,反应后U相和Q相的量都增加,故为生成相;同时,反应前后R相从有到无,故为反应相;V相从无到有,也为生成相。所以这一反应可以简化为R→Q+U+V。同理,在四相平面所包含的任一部分,都可以证明:经过四相平衡温度时会发生R→Q+U+V类反应。
8-7 根据图8-7中的合金X,在四相反应前为Q+R+U三相平衡,四相反应后为U+Q+V 三相平衡。试证明该反应为R+Q→U+V类型反应。
答:如图8-7所示,X成分的合金经过四相平衡温度时会发生如下反应:
R+U+Q→U+V+Q
反应前,U相和Q相的相对量为(用重心定律在△QRU上计算):
反应后,U相和Q相的相对量为(用重心定律在△QUV上计算)
显然,反应后Q相的量减少,故为反应相;U相的量增加,故为生成相;同时,反应前后的R相从有到无,故为反应相;V相从无到有,故为生成相;所以这一反应可以简化为R+Q→U+V。同理,在四相平面所包含的任一部分都可以证明:经过四相平衡温度时会发生R+Q→U+V类反应。
8-8 根据图8-8所示Fe-W-C三元系的低碳邵分的液相面的投影图,试标出所所有四相反应。
答:四相反应如下:
2755~2400℃时:L+W5C3→WC+W2C,其液相成分变温线的温度走向如图8-8所示。
~2400℃时:L+W2C→WC+W
~1700℃时:L+WC+W→M6C
~1500℃时:L+W→M6C+Fe3W2
1380℃时:L+Fe3W2→M6C+α
1335℃时:L+α→γ+M6C
~1200℃时:L+M6C_→WC+γ
1085℃时:L→γ+Fe3C+WC
其液相成分变温线的温度走向如下图所示:
8-9 根据图8-9所示,Al-Mg-Mn系富Al一角的投影图,
①写出图中两个四相反应。
②写出图中合金I和II的过程。
答:①在P点发生的反应:L+MnAl3→MnAl4+Mg5A18
在E T点发生的反应:L→Al+MnAl4+Mg5Al8
②成分I的合金冷却时首先结晶出Al,然后剩余液相成分达到E T点,
发生的反应:L→MnAl4+A1+Mg5A18三元共晶反应。
成分Ⅱ的合金冷却时首先结晶出Mg5Al8,随后发生L→MnAl3+Mg5Al8的共晶反应。这合金继续冷却剩余液相成分达到P点,经过第一个四相平面,发生L+MnAl3→MnAl4+Mg5A18四相反应,反应后余下L+MnAl4+Mg5Al8三相,当液相成分从P点到达E T,发生L→Al+MnAl4+Mg5Al8四相反应(第二个四相平面),最后进入Al+MnAl4+Mg5Al8三相区直至室温。
8-10 如图8-10所示A-B-C三元系中有两个稳定化合物A m B n和B1C k,
①画出可能存在的伪二元系。
②如何用简单的实验方法证明哪种伪二元系是正确的?
答:①如下图所示。
②当三元系存在两个以上的稳定化合物时,把三元系简化划分的方法就不止一种,如图所示,在A-B二元系中有一个AmBn稳定的化合物,在B-C二元系中有一个
B1C k稳定的化合物,划分简化三元系时即可按图中实线,也可按图中虚线加上两个化合物的连线划分。但不可能同时存在这两种划分方法,它们是不相容的,只有一种划分方法是真实的。如果两种划分都是可能的话,则在实线和虚线的交点成分可以在一个温度范围存在四相,这是不可能的。至于哪一种方法是正确的,可用简单的方法实际测定。例如对图中的M 成分,待它平衡后检验它存在什么相,如果存在A m B n相,则实线是正确的;如果存在B1C k 相,则虚线是正确的。
三元合金相图习题
三元合金相图 一、填空 1. 三元相图等温截面的三相区都是___________________形。 2. 图1是A-B-C三元系成分三角形的一部分,其中X合金的成分是_____________________。 图1 3. 图2是三元系某变温截面的一部分,其中水平线代表________________反应,反应式为______________________ 。 图2 4.图3是某三元系变温截面的一部分,合金凝固时,L+M+C将发生_________________反应。
图3 5. 三元相图的成分用__________________________表示。 6. 四相平衡共晶反应的表达式__________________________。 7. .图6是A-B-C三元共晶相图的投影图,在常温下: 合金I的组织是______________________________________ 合金II的组织是_______________________________________ 合金III的组织是______________________________________ 图4 8.三元相图有如下几类投影图 (1)_____________________________(2)________________________________(3)_______________________ ___(4)________________________________。 9. 三元系中两个不同成分合金,合成一个新合金时,则这三个合金成分点____________________________。 10. 四相平衡包共晶反应式为__________________________。 11. 三元相图垂直截面可用于分析__________________________________。 12. 三元系三条单变量线相交于__________,就代表一个__________________,并可根据单变量线箭头 _____________判断__________________。
《经济计量学精要》笔记和课后习题详解
《经济计量学精要》笔记和课后习题详解 第一章经济计量学的特征及研究范围 1.1复习笔记 一、什么是经济计量学 经济计量学是利用经济理论、数学、统计推断等工具对经济现象进行分析一门社会科学。 经济计量学运用数理统计学分析经济数据,对构建于数理经济学基础之上的模型进行实证分析,得出数值结果。 二、为什么要学习经济计量学 经济计量学涉及经济理论、数理经济学、经济统计学(即经济数据)以及数理统计学。然而,它又是一门有独立研究方向的学科,原因如下: 1.经济理论所提出的命题和假说,多以定性描述为主。但是,经济理论本身却无法定量测度这两个变量之间的强度关系,经济计量学家的任务就是提供这样的数值估计。经济计量学依据观测或试验,对大多数经济理论给出经验解释。 2.数理经济学主要是用数学形式或方程(或模型)描述经济理论,而不考虑对经济理论的测度和经验验证。而经济计量学主要关注的却是对经济理论的经验验证。经济计量学家通常采用数理经济学家提出的数学模型,只不过是把这些模型转换成可以用于经验验证的形式。 3.经济统计学主要涉及经济数据的收集、处理、绘图、制表。经济统计学家的工作是收集GDP、失业、就业、价格等数据,而不是利用这些数据来验证经济理论。但这些数据恰恰是经济计量分析的原始数据。 虽然数理统计学提供了许多分析工具,但由于经济数据独特的性质(大多数经济数据的生成并非可控试验的结果),因此,经济计量学经常需要使用特殊方法。 三、经济计量学方法论 1.建立一个理论假说 首先要了解经济理论对这一问题是怎样阐述的,然后是对这个理论进行验证。 2.收集数据 一般来说,有三类数据可用于实证分析: (1)时间序列数据:时间序列数据是按时间跨度收集得到的。比如GDP、失业、就业、货币供给、政府赤字等,这些数据是按照规则的时间间隔收集得到的。这些数据可能是定量的,也可能是定性的。 (2)截面数据:截面数据是指一个或多个变量在某一时点上的数据集合。例如美国人口调查局每十年进行的人口普查。 (3)合并数据(时间序列数据与截面数据的组合):合并数据既包括时间序列数据又包括截面数据。例如,20年间10个国家的失业率数据,那么这个数据集就是一个合并数据——每个国家20年间的失业率构成时间序列数据,而10个不同国家每年的失业率又组成截面数据。 (4)面板数据:面板数据是一种特殊类型的合并数据,也称纵向数据或微观面板数据。即同一个横截面单位(比如某个家庭或某个公司)的跨期调查数据。 与自然科学不同,许多收集的经济数据(比如GDP、货币供给、道琼斯指数、汽车销售量等)是非试验性的,也就是说,数据收集机构(比如政府)并不直接监控这些数据。 3.设定劳动力参与率的数学模型 根据变量之间的散点图确定变量之间的数学模型。 4.设定统计或经济计量模型 经济变量之间的关系往往不是数学模型中那么精确的函数关系,还受到其他未知因素的影响,因此需要设定计量模型,将一些未知因素包含在模型中。 5.估计经济计量模型参数 利用所获得的经济数据,通过一定的统计方法估计出模型中未知参数。 6.核查模型的适用性:模型设定检验
王利平《管理学原理》第3版笔记和课后习题详解
王利平《管理学原理》(第3版)笔记和课后习题详解[免费下载] 封面 内容简介、编委 目录 第一篇绪论 第1章管理的历史发展 1.1 复习笔记 1.2 课后习题详解 第2章组织管理基本原理 2.1 复习笔记 2.2 课后习题详解 第二篇企业环境管理 第3章企业环境管理概述 3.1 复习笔记 3.2 课后习题详解 第4章企业目标与竞争战略 4.1 复习笔记 4.2 课后习题详解 第5章多元化经营战略 5.1 复习笔记 5.2 课后习题详解 第6章国际化经营战略 6.1 复习笔记 6.2 课后习题详解 第7章企业制度与公司治理 7.1 复习笔记 7.2 课后习题详解 第8章企业外部关系协调 8.1 复习笔记 8.2 课后习题详解 第三篇企业组织管理 第9章企业组织管理概述 9.1 复习笔记 9.2 课后习题详解 第10章组织结构与制度规范 10.1 复习笔记 10.2 课后习题详解 第11章计划和控制 11.1 复习笔记 11.2 课后习题详解 第12章激励 12.1 复习笔记 12.2 课后习题详解 第13章领导
13.1 复习笔记 13.2 课后习题详解 第14章企业文化 14.1 复习笔记 14.2 课后习题详解 第四篇变革与发展过程管理 第15章变革与发展过程管理概述 15.1 复习笔记 15.2 课后习题详解 第16章模式转换与革新 16.1 复习笔记 16.2 课后习题详解 第17章发展过程管理 17.1 复习笔记 17.2 课后习题详解 第18章风险管理 18.1 复习笔记 18.2 课后习题详解 这本书内容太多了,可以到这里免费下载,王利平《管理学原理》(第3版)笔记和课后习题详解[免费下载]》》https://www.360docs.net/doc/ea12868518.html,/DigitalLibrary/Show.aspx?Id=2871
第五章 三元合金相图(习题)
第五章 三元合金相图 1 根据Fe -C -Si 的3.5%Si 变温截面图(5-1),写出含0.8%C 的Fe-C-Si 三元合金在平衡冷却时的相变过程和1100℃时的平衡组织。 图5-1 2 图5-2为Cu-Zn-Al 合金室温下的等温截面和2%Al 的垂直截面图,回答下列问题: 1) 在图中标出X 合金(Cu-30%Zn-10%Al )的成分点。 2) 计算Cu-20%Zn-8%Al 和 Cu-25%Zn-6%Al 合金中室温下各相的百分含量,其中α相成分点为Cu-22.5%Zn-3.45%Al ,γ相成分点为 Cu-18%Zn-11.5%Al 。 3) 分析图中Y 合金的凝固过程。 Y
% 图5-2 3 如图5-3是A-B-C 三元系合金凝固时各相区,界面的投影图,A 、B 、C 分别形成固溶体α、β、γ。 1) 写出P p '',P E '1和P E '2单变量线的三相平衡反应式。 2) 写出图中的四相平衡反应式。 3) 说明O 合金凝固平衡凝固所发生的相变。
图5-3 图5-4 4 图5-4为Fe-W-C三元系的液相面投影图。写出e1→1085℃,P1→1335℃,P2→1380℃单变量线的三相平衡反应和1700℃,1200℃,1085℃的四相平衡反应式。I,II,III三个合金结晶过程及室温组织,选择一个合金成分其组织只有三元共晶。 5 如图5-5为Fe-Cr-C系含13%Cr的变温截面 1)大致估计2Cr13不锈钢的淬火加热温度(不锈钢含碳量0.2%, 含Cr量13%) 2)指出Cr13模具钢平衡凝固时的凝固过程和室温下的平衡组织(Cr13钢含碳量2%)3)写出(1)区的三相反应及795 时的四相平衡反应式。 图5-5 图5-6 6 如图5-6所示,固态有限溶解的三元共晶相图的浓度三角形上的投影图,试分析IV区及VI区中合金之凝固过程。写出这个三元相图中四相反应式。
三元相图的应用
三元相图的应用 用三元相图对煤灰熔点预报研究 利用HR-4灰熔点测定仪,对府谷、露天、宝雁、宝一等4个煤灰样,分别在弱还原性和氧化性气氛下测得它们的灰熔融特征温度,利用CaO.SiO2.AI2O3三元系统相图对实验结果进行比较分析。结果表明:弱还原性气氛下,CaO-Si02.AI203三元相图预报煤灰熔点比实验值高是因为忽略了煤灰中其它杂质矿物质组分;氧化性气氛下,运用CaO-SiO2_Al2 三元相图来预报煤灰熔点,预报值很接近实验值,且煤灰系统中CaO的含量越高预报值和实验值越接近。 锅炉结渣对锅炉安全运行危害极大?。电站锅炉的结渣受煤质特性和炉内燃烧工况影响,煤灰熔融特性是煤质特性中对结渣影响较大的因素。煤灰是由各种矿物质组成的混合物,在高温下熔化过程比较复杂,煤灰中除各矿物质组分外,矿物质之间还会发生反应生成新的矿物质,且各矿物质问也会发生共熔现象。国内为许多专家学者对煤灰熔融性做了大量的研究工作,但用三元相图对不同气氛下煤灰熔点进行预报还很少见诸报道。本文利用三元相图为理论基础,运用HR.4灰熔点测定仪在不同气氛下对煤灰熔融特性进行实验研究。 1 实验装置及条件 实验仪器采用HR.4灰熔点测定仪,它是以硅炭管为发热元件,并配合可控硅调压器进行温度控制的加热炉。它按国标(GB.210)(900℃以前为l5~20℃/min,900℃以后为5±l℃/min)实现自动升温控制功能。试样采用的是府 谷、露天矿、宝雁矿和宝一矿等4种煤灰样,根据GB212.77测定灰成分方法所规定的步骤和要求制成灰样。灰成分分析见表l,煤灰成分数据由北京煤科院提供。实验方法采用GB219.74煤灰熔融性的角锥法,运用HR-4灰熔点测定仪分别在氧化性气氛和还原性气氛测得试样的煤灰熔融特征温度的软化温度(ST)。实验中炉内弱还原性气氛采取封炭法获得,即在刚玉舟中央放置石墨粉l6g,两端放置无烟煤35 g;炉内氧化性气氛通过让空气在炉内自由流通的方式获得,把HR-4灰熔点测定仪置于自然通风状态下即可达到炉内为氧化性气氛。 2 实验结果 4种灰样在弱还原性和氧化性气氛下的软化温度(ST)见表2(本文中的煤灰特征温度均指软温度ST)。
三元相图练习题
三元相图练习题1 一、 在如图所示的相图中完成下面各个问题。 (25分) 1. 直接在给定图中划分副三角形; 2. 直接在给定图中用箭头标出界线上温 度下降的方向及界线的性质; 3. 判断化合物D 和M 的性质; 4. 写出各无变量点的性质及反应式; 5. G 点的析晶路程; 6. 组成为H 的液相在完全平衡条件下进 行冷却,写出结晶结束时各物质的百 分含量(用线段比表示)。 解: 1、 见图; 2、 见图; 3、 D ,一致熔融二元化合物,高温稳定、低温分解; M ,不一致熔融三元化合物; 4、 E1,单转熔点,M C A L +?+ E2,低共熔点,M B C L ++? E3,单转熔点,M B A L +?+ E4,过渡点,B A D L +?→← 5、 6、过H 点做副三角形BCM 的两条边CM 、BM 的平行线HH 1、HH 2,C%=BH 2/BC ×100%,B%=CH 1/BC ×100%,C%=H 1H 2/BC ×100% 1 没有心脏我还可以思念你没有下体我还可以燃烧你 ■■■■■■■■■■■■■张为政整理■■■■■■■■■■■■■勿删■■■■■■■■■■■■■■ L ? A f= 2 熔体G L f= 3 G[B ,(B)] 1[B,B+(A)] L ?A +B f=1 E 3[2,A+B+(M)] L +A ?B +M f=0 E 3[3,A 消失+B +M] L ? B +M f=2 E 2[4, B +M +(C)] L ?M +C +B f=0 E 2(L 消失)[G,M+B+C]
二(20分)下图为CaO-A12O3-SiO2系统的富钙部分相图,对于硅酸盐水泥的生产有一定的参考价值。试: 1、画出有意义的付三角形; 2、用单、双箭头表示界线的性质; 3、说明F、H、K三个化合物的性质和写出各点的相平衡式; 4、写出M熔体的冷却平衡结晶过程; 5、为何在缓慢冷却到无变量点K(1455℃)时再要急剧冷却到室温?
博迪《投资学》(第10版)笔记和课后习题详解答案
博迪《投资学》(第10版)笔记和课后习题详解完整版>精研学习?>无偿试用20%资料 全国547所院校视频及题库全收集 考研全套>视频资料>课后答案>往年真题>职称考试 第一部分绪论 第1章投资环境 1.1复习笔记 1.2课后习题详解 第2章资产类别与金融工具 2.1复习笔记 2.2课后习题详解 第3章证券是如何交易的 3.1复习笔记 3.2课后习题详解 第4章共同基金与其他投资公司 4.1复习笔记 4.2课后习题详解 第二部分资产组合理论与实践 第5章风险与收益入门及历史回顾 5.1复习笔记 5.2课后习题详解 第6章风险资产配置 6.1复习笔记 6.2课后习题详解 第7章最优风险资产组合 7.1复习笔记 7.2课后习题详解 第8章指数模型 8.1复习笔记 8.2课后习题详解 第三部分资本市场均衡 第9章资本资产定价模型 9.1复习笔记 9.2课后习题详解 第10章套利定价理论与风险收益多因素模型 10.1复习笔记 10.2课后习题详解 第11章有效市场假说
11.1复习笔记 11.2课后习题详解 第12章行为金融与技术分析 12.1复习笔记 12.2课后习题详解 第13章证券收益的实证证据 13.1复习笔记 13.2课后习题详解 第四部分固定收益证券 第14章债券的价格与收益 14.1复习笔记 14.2课后习题详解 第15章利率的期限结构 15.1复习笔记 15.2课后习题详解 第16章债券资产组合管理 16.1复习笔记 16.2课后习题详解 第五部分证券分析 第17章宏观经济分析与行业分析 17.1复习笔记 17.2课后习题详解 第18章权益估值模型 18.1复习笔记 18.2课后习题详解 第19章财务报表分析 19.1复习笔记 19.2课后习题详解 第六部分期权、期货与其他衍生证券第20章期权市场介绍 20.1复习笔记 20.2课后习题详解 第21章期权定价 21.1复习笔记 21.2课后习题详解 第22章期货市场 22.1复习笔记 22.2课后习题详解 第23章期货、互换与风险管理 23.1复习笔记 23.2课后习题详解 第七部分应用投资组合管理 第24章投资组合业绩评价 24.1复习笔记
习题
第一篇冶金熔体 第一章概述 1.什么是冶金熔体?它分为几种类型? 2.何为熔渣?简述冶炼渣和精炼渣的主要作用。 3.什么是富集渣?它与冶炼渣的根本区别在哪里? 4.试说明熔盐在冶金中的主要应用。 5.熔锍的主要成分是什么? 6.为什么熔盐电解是铝、镁、钠、锂等金属的惟一的或占主导地位的生产方法? 第二章冶金熔体的相平衡 1.在三元系的浓度三角形中画出下列熔体的组成点,并说明其变化规律。 X:A 10%,B 70%,C 20%; Y:A 10%,B 20%,C 70%; Z:A 70%,B 20%,C 10%; 若将3kg X熔体与2kg Y熔体和5kg Z熔体混合,试依据杠杆规则用作图法和计算法求出混合后熔体的组成点。 2.试找出图2-44所示的三元系相图中的错误,说明原因并更正。 3.图2-45是生成了一个二元不一致熔融化合物的三元系相图 (1)写出各界线上的平衡反应; (2)写出P、E两个无变点的平衡反应; (3)分析熔体1、2、3、4、5、6的冷却结晶路线。 4.某三元系相图如图2-46中所示,A m B n为二元不一致熔融化合物。试分析熔体1、2、3的冷却结晶过程。 5.图2-47为生成一个三元化合物的三元相图, (1)判断三元化合物N的性质;
(2)标出边界线的温度降低方向; (3)指出无变点K、L、M的性质,写出它们的平衡反应; (4)分析熔体1、2的冷却过程。 6.试分析图2-23熔体3、4、5、6的冷却过程。 7.试根据CaO-SiO2-A12O3系相图说明组成为(w B / %)CaO 40.53,SiO2 32.94,A12O3 17.23,MgO 2.55的熔渣冷却过程中液相及固相成分的变化。 8.试根据图2-30绘制CaO- A12O3- SiO2三元系1500?C时的等温截面图。 9.给出CaO-SiO2-FeO系相图中1500?C的等温截面图,标出各相区内的相平衡关系。组成为(w B / %)CaO 45、SiO2 25、FeO 20的熔渣在此温度下析出什么晶相?怎样才能使此熔渣中的固相减少或消除? 10.假定炉渣碱度为= 2。在1600?C下,当渣中含FeO 58%(w B)时,炉渣是否全部处于液态?如果炉渣碱度不变,因脱碳反应渣中FeO含量降至20%(w B),在此温度下熔渣中是否有固相析出?若有固相析出,试确定其组成。 11.根据CaO-SiO2-FeO系相图,指出下列组成(w B / %)的熔体冷却时,首先析出什么物质?冷却结晶结束后的固相物质是什么? (1)CaO 15、FeO 25、SiO2 60;(5)CaO 10、FeO 55、SiO2 35; (2)CaO 60、FeO 10、SiO2 20;(6)CaO 20、FeO 45、SiO2 35; (3)CaO 5、FeO 80、SiO2 15;(7)CaO 30、FeO 65、SiO2 5; (4)CaO 40、FeO 40、SiO2 20;(8)CaO 75、FeO 10、SiO2 15。 12.如何正确判断无变点的性质?它与化合物的性质和界线的性质有何联系?如果某三元系中只生成了生成一致熔融化合物,该体系中有可能出现转熔点吗? 13.在分析三元系相图时,用到过哪几个规则?试简述这些规则并用图表示之。 14.试用几何方法证明浓度三角形的等比例规则。 15.试说明绘制三元系状态图的等温截面图的主要步骤。 16.在进行三元系中某一熔体的冷却过程分析时,有哪些基本规律? 第三章冶金熔体的结构
第8章-三元相图-笔记及课后习题详解(已整理-袁圆-2014.8.7)汇总
第8章三元相图 8.1 复习笔记 一、三元相图的基础 三元相图的基本特点:完整的三元相图是三维的立体模型;三元系中的最大平衡相数为四。三元相图中的四相平衡区是恒温水平面;三元系中三相平衡时存在一个自由度,所以三相平衡转变是变温过程,反应在相图上,三相平衡区必将占有一定空间。 1.三元相图成分表示方法 (1)等边成分三角形 图8-1 用等边成分三角形表示三元合金的成分 三角形内的任一点S都代表三元系的某一成分点。 (2)等边成分三角形中的特殊线 ①等含量规则:平行于三角形任一边的直线上所有合金中有一组元含量相同,此组元为所对顶角上的元素。 ②等比例规则:通过三角形定点的任何一直线上的所有合金,其直线两边的组元含量之比为定值。 ③背向规则:从任一组元合金中不断取出某一组元,那么合金浓度三角形位置将沿背离此元素的方向发展,这样满足此元素含量不断减少,而其他元素含量的比例不变。 ④直线定律:在一确定的温度下,当某三元合金处于两相平衡时,合金的成分点和两平衡相的成分点必定位于成分三角形中的同一条直线上。 (3)成分的其他表示方法: ①等腰成分三角形:两组元多,一组元少。 ②直角成分坐标:一组元多,两组元少。 ③局部图形表示法:一定成分范围内的合金。 2.三元相图的空间模型
图8-2 三元匀晶相图及合金的凝固(a)相图(b)冷却曲线 3.三元相图的截面图和投影图 (1)等温截面 定义:等温截面图又称水平截面图,它是以某一恒定温度所作的水平面与三元相图立体模型相截的图形在成分三角形上的投影。 作用:①表示在某温度下三元系中各种合金所存在的相态; ②表示平衡相的成分,并可以应用杠杆定律计算平衡相的相对含量。 图8-3 三元合金相图的水平截面图 (2)垂直截面 定义:固定一个成分变量并保留温度变量的截面,必定与浓度三角形垂直,所以称为垂直截面,或称为变温截面。 常用的垂直截面有两种: ①通过浓度三角形的顶角,使其他两组元的含量比固定不变; ②固定一个组元的成分,其他两组元的成分可相对变动。 图8-4 三元相图的垂直截面图
博迪《金融学》(第2版)笔记和课后习题详解修订版答案
博迪《金融学》(第2版)笔记和课后习题详解(修订版)完整版>精研学习?>无偿试用20%资料 全国547所院校视频及题库全收集 考研全套>视频资料>课后答案>往年真题>职称考试 第1部分金融和金融体系 第1章金融学 1.1复习笔记 1.2课后习题详解 第2章金融市场和金融机构 2.1复习笔记 2.2课后习题详解 第3章管理财务健康状况和业绩 3.1复习笔记 3.2课后习题详解 第2部分时间与资源配置 第4章跨期配置资源 4.1复习笔记 4.2课后习题详解 第5章居民户的储蓄和投资决策 5.1复习笔记 5.2课后习题详解 第6章投资项目分析 6.1复习笔记 6.2课后习题详解 第3部分价值评估模型 第7章市场估值原理 7.1复习笔记 7.2课后习题详解 第8章已知现金流的价值评估:债券 8.1复习笔记 8.2课后习题详解 第9章普通股的价值评估 9.1复习笔记 9.2课后习题详解 第4部分风险管理与资产组合理论 第10章风险管理的原理 10.1复习笔记 10.2课后习题详解
第11章对冲、投保和分散化 11.1复习笔记 11.2课后习题详解 第12章资产组合机会和选择 12.1复习笔记 12.2课后习题详解 第5部分资产定价 第13章资本市场均衡 13.1复习笔记 13.2课后习题详解 第14章远期市场与期货市场 14.1复习笔记 14.2课后习题详解 第15章期权市场与或有索取权市场 15.1复习笔记 15.2课后习题详解 第6部分公司金融 第16章企业的财务结构 16.1复习笔记 16.2课后习题详解 第17章实物期权 17.1复习笔记 17.2课后习题详解
第二章 相图练习题
第二章 相图 一、名词解释: 三元系相图中的液相面,三元系相图中的等温线,相图中的无变量点,三元系相图中的初晶面 二、其它 1、相律是指______________________。冶金炉渣三元系的相律表达式为______________________。 2、表示三元系的组成用浓度三角形,浓度三角形内的等含量规则是指_____________________________。 3、三元系的组成用浓度三角形来表示,浓度三角形中的等比规则是指______________________________。在冶金渣三元系中,若自由度为零,则一定是_____相共存。 4.三元系相图中的等温线表示______________________________,相图中等温线之间相距越近的区域,则说明该区间炉渣组成的改变对_______影响大。 5.三元相图中三元共晶点有________相平衡共存,自由度为___ 。 6.在冶金三元系渣相图中,自由度为零时,相数为_____;四相平衡的三元共晶点处的自由度为_____,其析晶反应可以表示为_________。 7.通常对冶金炉渣,相律的表达式为_________,由此推导出三元冶金炉渣系中最多可能存在的相数为_________,此时的自由度为___。 8、如图,回答下列问题: (1)写出P 点的结晶反应式。 (2)指出自由度为零的点。 (3)写出E e 3线上发生的结晶反应式。
8、如图1所示,回答下列问题: (1)指出化合物D 的稳定性。 (2)相图中三角形ADB 区(即分三角形ADB )可以似为哪一类基本相图? (3)写出1E 点、23e E 线、51e E 线的析晶反应式,并指出其中自由度为零的点或线 9.如下所示的相图。回答下列问题:
三元相图软件安装与使用指南
三元相图软件安装与使用指南 日前,我在小木虫网站上传了二元合金相图软件和三元相图软件,有部分虫友反映三元相图软件的安装与使用有些问题,因此,我制作了本指南,希望能对广大虫友有所帮助。 本人电脑系统:Windows xp sp3, Vista和Windows 7系统可能无法兼容此软件。 一、三元相图软件安状 1.将下载到的三元相图软件解压到非系统盘(如:D:\)下,打开文件夹“三元相图软件”,运行SETUP.EXE文件,出现如下界面: 点击“Continue”,出现如下界面:
输入一个用户名,单位名可不输。然后“确认”,知道出现如下界面: 点击“OK”后出现如下界面: 点击电脑图标(如图示),进入如下界面:
直接“Continue”,出现如下界面: 点击“OK”,软件到此安装完毕。
2.运行软件 点击“开始”,运行TERNARY中的Ternary Phase Diagrams,如下图: 出现如下界面(根据电脑配置,有时候也不会出现此界面) 出现这种情况是因为你的机器配置太好,内存过多造成,呵呵! 按如下方法解决: 开始---运行---msconfig---Boot.ini---高级----MAXMEN设置为768,重起电脑。出现如下界面,打钩确认。 再次运行运行TERNARY中的Ternary Phase Diagrams,出现如下界面:
根据系统配置不同,有的在设置好运行的时候会要求输入cdkey,见压缩文件cdkey.txt文件,手动输入即可,复制不行(有时需要输入几次,若出现错误,忽略退出重新运行即可)。 点击“确认”,出现如下界面,选择“三元相图软件”文件夹中“data”文件夹在你电脑上的位置(见前面开始解压文件的位置)。确认无误后出现如下界面: 至此,软件设置完成,点击Keywords,输入相关元素符号查询即可(输一个元素符号,点击一次后面的“Search”,最后点“OK”),如下:
第三章多元凝聚系统相图及其应用(精)
第三章多元凝聚系统相图及其应用 和传统化学不同,本书不讨论含水系统,而把注意力集中在凝聚态相图同时,和金属物理或物理冶金学不同,本书主要是讨论金属氧化物系统相图。无机材料化学是一门应用学科,因此,本书除了介绍一些必要的基本原理外,重点放在解释如何分析相图,以及讨论相图对实际过程的指导意义。 多元凝聚系统的相律表达式为f * = C–Φ+ 1,f*为条件自由度,C为独立组元数,Φ为相数,数字1代表温度变量。本书采用大多数无机材料化学类文献[3~7]约定俗成的说法,在下文中把f *称为自由度,并以通常代表自由度的符号f来表示。于是,凝聚系统相律便写成为 f = C –Φ+ 1 。(3–1) 对于二元凝聚系统,C = 2,于是(3–1)式便成为f = 3–Φ。可见在二元凝聚系统中,平衡共存的相最多只有3个,最大自由度f = 2,是温度和任意1个浓度项这2个热力学强度因素。 §3.1 二元系统相图 3.1.1KF–BaTiO3系统和提拉法低温制备单晶 图3–1 KF–BaTiO3相图,纵标为温度T, 横标为BaTiO3的物质的量分数x[7] 参见Karan C, Skinner B J. J. Chem. Phys., 1953, 21: 2 225[8] 图3–1为KF–BaTiO3系统相图。这是一种最简单的具有一个低共熔点(eutectic point)的二元系统相图[1],或称为二元固态不互溶凝聚系统相图[2]。本书相图(二元系统及下文的
三元系统立体相图)纵标单位一般为绝对温度T(个别相图仍保留摄氏温度t),横标为物质的量分数x或质量分数w等。 由图3–1可见,如欲将BaTiO3熔融,用提拉法生长BaTiO3单晶,温度要求高达1 885 K。若加入一定量的KF,就可在比1 106 K略高一点的温度,提拉出质量合格的BaTiO3单晶[7],而使制备温度下降700 K左右。通常配料控制在靠近BaTiO3的一侧。但BaTiO3含量过高时,拉制温度会过高[7],这是由于此种情况下在比1 106 K稍高一点的温度时,系统的液相量过少。一般可通过实验确定最佳的原料配比和提拉温度。 3.1.2 CaO–Al2O3系统和转熔过程的包晶反应 一、CaO–Al2O3系统 此系统的相图如图3–2所示。本书和大部分无机材料化学类文献[3, 7, 8]一样,把分子式为CaAl2O4的化合物,写成CaO·Al2O3,简写为CA,其他以此类推。系统中CA、CA2、六铝酸钙CA6和铝酸三钙C3A均为不一致熔融化合物(物理化学教科书往往称它们为不稳定化合物[12,]),它们各自的分解温度[或称为转熔温度(peritectic temperatures)]亦已在图中标出。七铝酸十二钙C12A7在通常的温度下为一致熔融化合物(或称为稳定化合物[1, 2]、同成分熔融化合物)。有的文献认为它的熔点为1 665 K[7, 9],但较为经典的文献则认为它的熔点为1 728 K[10],后一个数据与图3–2中C12A7组成附近的两个低共熔点温度较为相符。C3A 和CA在完全干燥的空气中于1 633 K时,能生成质量分数50.65%Al 2O3和49.35%的CaO两者的低共熔混合物(eutectic mixture)[7],在此种情况下,C12A7在相图中当然没有稳定的相区。最近报道C12A7具有宝贵的电性能。 此相图的化合物与水泥密切相关。C12A7虽然在硅酸盐水泥和矾土水泥中均有存在,但它的水化活性较差,是水泥中不希望有的矿物组成。此外,C12A7还是一种良的导体,但是好的电导体却很少是透明的[26]。Nature(03 Oct. 2002)报道了在氢气气氛中,通过热处理,可把氢离子结合进C12A7,从而把它做成透明的。C3A与水反应强烈,硅酸盐水泥中C3A含量较高时,水化速度较快。CA是矾土水泥的主要矿物,CA和水化合时反应较快,产物强度也较高,所以矾土水泥也称为快硬高强水泥。此外,CA2常作为耐火水泥的主要矿物。
三元相图的绘制详解
三元相图的绘制 本实验是综合性实验。其综合性体现在以下几个方面: 1.实验内容以及相关知识的综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。 2.运用实验方法和操作的综合 本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。本实验中滴定终点的判断,不同于分析化学中的大多数滴定。本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。 一.实验目的 1. 掌握相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。 二.实验原理 三组分体系K = 3,根据相律: f = K–φ+2 = 5–ф 式中ф为相数。恒定温度和压力时: f = 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。一般用等边三角形的方法表示三元相图。 在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:
图1 图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。三角形内任一点则表示三组分体系的组成。如点P 的组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液的三组分体系的相图如图2所示。该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。曲线DEFHIJKL为溶解度曲线。EI和DJ是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿)绘制溶解度曲线的方法有许多种,本实验采用的方法是:将将完全互溶的两组分(如氯仿和醋酸)按照一定的比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三. 实验准备 1. 仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2. 药品:冰醋酸,氯仿,NaOH溶液(0.2mol·mol–3),酚酞指示剂。
第7章 三元相图作业答案
第六章 三元相图作业答案 Chapter 6 Ternary Phase Diagram 作业1:30kg 成分为O (20%A ,50%B ,30%C )的合金与10kg 成分为Z (20%A ,10%B ,70%C )的合金熔化在一起后, 形成新合金x, 试求x 合金中A 、B 、C 组元的含量各是多少,并在浓度三角形中标出各合金。 解答: 30 7050101030--=--=C C B B X X X X X B %=40% X C %=40% X A %=20% 作业2:某三元合金K 在温度为t1时分解为B 组元和液相两个相的相对量 2=L B W W 。已知合金K 中A 组元和C 组元重量比为3,液相含B 量为40%, 试求合金K 的成分。
解答: B B L B X X BK KL W W --===100402 X B -40=200-2X B 3X B =240 X B =80% 已知 X A +XB=100%-80%=20% X A /X C =3 故 X A =15% X C =5% 作业3: A 、 B 、 C 三组元固态完全不互溶,右图为其三元相图投影图。已知合金O 的成分为80%A 、10%B 、10%C ,a 点的成分为60%A 、20%B 、20%C ,E 点的成分为50%A 、10%B 、40%C 。 (1)写出图中合金I 和P 的室温平衡组织。 (2)简要写出合金O 的结晶过程和室温平衡组织。 (3)计算室温下合金O 的组织组成物的相对含量。
解: (1) I :B+(A+B+C ) P :(B+C )+(A+B+C ) (2) 合金O 加热到液相面温度以上后,缓慢降 温,首先遇到液相面Ae 1Ee 3A ,开始结晶出初晶A ,这时液相的成分等于合金成分,两相平衡相联结线的投影是AO 线。继续冷却时,不断析出初晶A ,液相中A 组元的含量 不断减少,B 、C 组元的含量不断增加,液相成分沿AO 的延长线变化。当液相成分到达a 点时,开始发生三相共晶转变,L →(A+B )。此后在温度继续下降时,液相中不断凝固出两相共晶(A+B ),液相成分沿aE 线变化,直到E 点发生四相共晶转变L →(A+B+C )。在略低于E 点温度凝固完毕,不再发生其它转变。故合金在室温下的平衡组织为A+(A+B )+(A+B+C )。(3分) (3) 作aD//BC ,OF//BC ,aM//AB ,EN//AB ,延长Ea 交AB 于q ()%5060 100) 80100(60100%=----=== AD DF Aa Oa A (1分) %2540 20 405.05.0%)1()%(=-?=?=-= +AN MN A Eq Ea B A (1分) (A+B+C)%=1-A%-(A+B)%=25% (1分) 作业4 图示为A 、B 两组元固态完全不溶解、C 组元固态部分溶解的三元相图 的投影图。 (1).假定T A >T B >T C >T e1>T e3>T e2>T E ,画出T 温度(T e3>T>T e2)的等温截面图, 并标注出各相区;(5分) (2).画出XY 变温截面图,并标注出各相区;(5分) (3).分析合金O 的相变过程。(2分)
三元相图的绘制详解
三元相图得绘制 本实验就就是综合性实验。其综合性体现在以下几个方面: 1、实验内容以及相关知识得综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其就就是在一般得实验中(比如分析化学实验、无机化学实验等)作图都就就是用得直角坐标体系,几乎没有用过三角坐标体系,因此该实验中得等边三角形作图法就具有独特得作用。这类相图得绘制不仅在相平衡得理论课中有重要意义,而且对化学实验室与化工厂中经常用到得萃取分离中具有重要得指导作用。 2、运用实验方法与操作得综合 本实验中涉及到多种基本实验操作与实验仪器(如电子天平、滴定管等)得使用。本实验中滴定终点得判断,不同于分析化学中得大多数滴定。本实验得滴定终点,就就是在本来可以互溶得澄清透明得单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定得终点,有助于学生掌握多种操作,例如取样得准确、滴定得准确、终点得判断准确等。 一、实验目得 1、掌握相律,掌握用三角形坐标表示三组分体系相图。 2、掌握用溶解度法绘制三组分相图得基本原理与实验方法。 二、实验原理 三组分体系K= 3,根据相律: f =K–φ+2=5–ф 式中ф为相数。恒定温度与压力时: f= 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系得状态与组成之间得关系,称为三元相图。一般用等边三角形得方法表示三元相图。 在萃取时,具有一对共轭溶液得三组分相图对确定合理得萃取条件极为重要。在定温定压下,三组分体系得状态与组分之间得关系通常可用等边三角形坐标表示,如图1所示:
图1图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A与B,B与C,C 与A所组成得二组分体系得组成。三角形内任一点则表示三组分体系得组成。如点P得组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液得三组分体系得相图如图2所示。该三液系中,A与B,及A与C完全互溶,而B与C部分互溶。曲线DEFHIJKL为溶解度曲线。EI与DJ就就是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿) 绘制溶解度曲线得方法有许多种,本实验采用得方法就就是:将将完全互溶得两组分(如氯仿与醋酸)按照一定得比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三、实验准备 1、仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2、药品:冰醋酸,氯仿,NaOH溶液(0、2mol·mol–3),酚酞指示剂。 四、操作要点(各实验步骤中得操作关键点) 1、因所测得体系中含有水得成分,所以玻璃器皿均需干燥。
陈先红《公共关系学原理》笔记和课后习题详解
陈先红《公共关系学原理》笔记和课后习题详解 第1章绪论 【知识框架】 【考点难点归纳】 考点一:公共关系一词的地理演变★★ 1.英语演变 (1)“Public Relations” “Public Relations”在英语中最早起源于1842年出版的《公众情感理论和规范》,豪科·史密斯在这本书中使用了该词。 (2)“Relations With the Publics” 美国传播学家戈登认为公共关系应该是“Relations With the Publics”,即与公众的关系,而非“Public Relations”。传统公共关系理论都是以美式英语为主导的文化解读。 (3)“Public Relationships”
①19世纪80年代中期,公共关系学界继“Public Relations”后又出现一个新词汇“Public Relationships”,与前者相比更加强调关系的相互性、情感性、主观能动性,更加强调一种和谐的关系性质和状态。 ②这个新词汇的出现,标志着关系管理正在成为公共关系理论的主流理论典范,公共关系研究的重心开始从以传播为中心转向以关系为中心。 2.德语演变 (1)“Public Relations”的德译文是“Offentlichkeit sarbeiten”,有两层含义:“公众工作”和“公共领域”。 ①“公众工作”。意为“公共关系是在公共机构中就公众问题为公众服务”。 ②“公共领域”。意为“公共关系不仅仅是公众间的关系,还包括一个公众圈与另一个公众圈,一个公共机构与另一个公共机构间的关系”。 (2)目前,德译词“Public Relations”和“Offentlichkeit”在德国同时使用,前者强调“公众性”,而后者强调“公共性”。 3.韩语演变 在韩语中,韩译词是“軎旦瞽罟”以及“Hong B0”,与英国“PR”的含义没有差别。4.日语演变 公关的日文翻译是“广报”,即广而报之,它是与广告的广而告之相对而言的,并且处于广告和市场营销的对立面。 5.汉语演变 在汉语中,汉译词是“公共关系”或“公众关系”,简称“公关”。 (1)负面含义,大众普遍认为公关是觥筹交错的交际应酬。 (2)正面含义,使用“公共关系”或者“公关活动”时通常表达较多的正面含义,意味着
三元相图
8.4 三元系相图简介(1) 8.4.1 三元相图概述 工业上使用的大多数材料是由两种以上组分构成的,例如陶瓷、合金钢、A BS塑料等等都是属于三元体系。即使有些二元体系,因为不可避免的原因,也会存在一些杂质,因而也构成三元甚至多元体系。在多元系统中,各组元之间的交互作用并非是加和性的,例如在二元系统中加入第三组元后,不仅改变了原有组元之间的溶解度,而且在某些情况下还可以发生新的转变,形成新相。加入第3组元或更多组元后,会使体系出现液相的温度大幅度降低,这对耐高温场合应用的材料,需要特别引起注意。因此,要全面了解和掌握材料的结构(或组织)、性能以及相应的加工工艺,除了使用二元相图外,还需要掌握和应用三元甚至多元相图。当然,三元相图是使用最多、最普遍的一类相图,虽然组分只比二元体系增加了一种,但是三元相图的复杂性远远超过二元相图,实际三元相图的测定与绘制非常困难,相图的分析和应用也更复杂。本节主要介绍三元相图的基本内容,三元相图的基本类型以及结合不同材料专业方向的实际相图的分析与应用将在各专业方向课程中讲授。 对于三元凝聚系统,F=?C –P + 1= 4 –P,当F = 0时,P = 4,即三元凝聚系统中可能存在的平衡共存的相数最多为4个。当P = 1时,F = 3,即系统的最大自由度为3。这3个自由度指温度和三个组分中的任意2个浓度。由于要描述三元系统的状态,需要三个独立变量,其完整的状态图应该是一个三坐标的立体图。与普通的三维坐标系不同,三元系统相图的状态图是以三角形为底,表示三组分的组成,垂直于底面的坐标表示温度,所以这个状态图是一个三方棱柱体,柱体内的任一点代表了某一组成在一定温度下的状态。但这样的立体图不便于应用,我们实际使用的是它的平面投影图。图8-35是一个最简单的具有低共熔点的三元系统相图立体状态图,图8-36是其在底面上的投影图。
