2020-2021学年高二份周测(18日)化学试题-含答案

定远育才学校2020—2021学年度12月周测(18日)
高二化学试卷(至第四章第一节)
命题人:
一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意)
1.常温下0.1 mol ·L -1的下列溶液中c (NH +4)最大的是( )
A .NH 4Al(SO 4)2
B .NH 4Cl
C .NH 3·H 2O
D .CH 3COONH 4
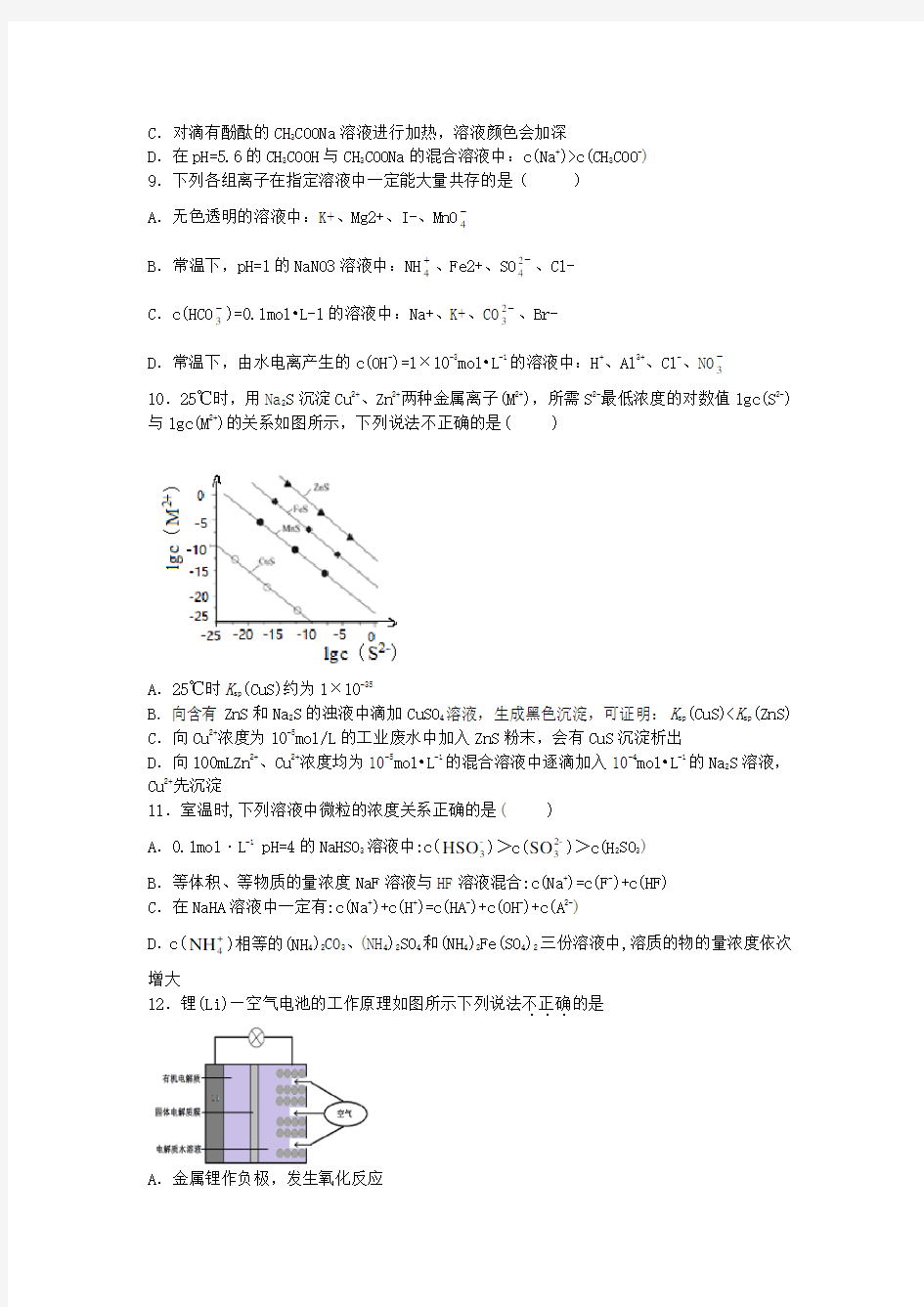
2.已知某一温度下,0.1 mol ·L -1 NaHA 的强电解质溶液中:c (H +) 一定不正确的是( ) A .c (Na +)=c (HA -)+2c (A 2-)+c (OH -) B .c (H 2A)+c (HA -)+c (A 2-)=0.1 mol ·L -1 C .将上述溶液稀释至0.01 mol ·L -1,c (H +)·c (OH -)不变 D .c (A 2-)+c (OH -)=c (H +)+c (H 2A) 3.已知常温下:某NaHSO 3溶液的p H =5,则在NaHSO 3溶液中微粒的物质的量浓度关系一定正确的是( ) A .c (N a +)>c (HSO -3)>c (OH -)>c (H +)>c (SO 2-3) B .c (Na +)+c (H +)=c (OH -)+c (SO 2-3)+c (HSO -3) C .c (Na +)=c (SO 2-3)+c (HSO -3)+c (H 2SO 3) D .c (OH -)=c (H +)+c (HSO -3)+c (H 2SO 3) 4.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是( ) A .当溶液中[CH 3COO -]=[Na +]时,醋酸与氢氧化钠恰好完全反应 B .当溶液中[CH 3COO -]=[Na +]时,一定是氢氧化钠过量 C .当溶液中[CH 3COO -]=[Na +]>[H +]=[OH -]时,一定是醋酸过量 D .当溶液中[Na +]>[CH 3COO -]>[OH -]>[H +]时,一定是氢氧化钠过量 5.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( ) A .在0.1 mol ·L -1NaHCO 3溶液中:[Na +]>[HCO -3]>[CO 2-3]>[H 2CO 3] B .在0.1 mol ·L -1Na 2CO 3溶液中:[OH -]-[H +]=[HCO -3]+[H 2CO 3] C .向0.2 mol ·L -1NaHCO 3溶液中加入等体积0.1 mol ·L -1NaOH 溶液: [CO 2-3]>[HCO -3]>[OH -]>[H +] D .常温下,CH 3COONa 和CH 3COOH 混合溶液(pH =7,[Na +]=0.1 mol ·L -1): [Na +]=[CH 3COO -]>[CH 3COOH]>[H +]=[OH -] 6.常温下,一定体积pH =2的二元弱酸H 2R 溶液与一定体积pH =12的NaOH 溶液混合后溶液呈中性。该混合溶液中,离子浓度关系正确的是( ) A .[Na +]=2[R 2-]+[HR -] B .[Na +]=10-2 mol ·L -1 C .[R 2-]+[OH -]+[HR -]=[Na +]+[H +] D .[R 2-]>[Na +]>[H +]>[OH -] 7.现有常温下的四份溶液:①0.01mol/L CH 3COOH 溶液;②0.01mol/L HCl 溶液;③pH=12的氨水;④pH=12的NaOH 溶液。下列说法正确的是( ) A .①中水的电离程度最小,③中水的电离程度最大 B .将②、③混合,若pH=7,则消耗溶液的体积:②>③ C .将①、④混合,若c(CH 3COO -)>c(H +),则混合液一定呈碱性 D .将四份溶液分别稀释100倍后,溶液的pH :③>④,①<② 8.下列有关说法中正确的是 ( ) A .0.1 mol ·L -1 Na 2SO 3溶液中:c(Na +)=2c(2-3SO )+c(- 3HSO )+c(H 2SO 3) B .0.1 mol ·L -1NaHCO 3溶液中:c(Na +)>c(-3HCO )>c(2-3CO )>c(H 2CO 3) C .对滴有酚酞的CH 3COONa 溶液进行加热,溶液颜色会加深 D .在pH=5.6的CH 3COOH 与CH 3COONa 的混合溶液中:c(Na +)>c(CH 3COO -) 9.下列各组离子在指定溶液中一定能大量共存的是( ) A .无色透明的溶液中:K+、Mg2+、I-、MnO 4- B .常温下,pH=1的NaNO3溶液中:NH 4+、Fe2+、SO 24-、Cl- C .c(HCO 3-)=0.1mol ?L-1的溶液中:Na+、K+、CO 23-、Br- D .常温下,由水电离产生的c(OH -)=1×10-3mol ?L -1的溶液中:H +、Al 3+、Cl -、NO 3- 10.25℃时,用Na 2S 沉淀Cu 2+、Zn 2+两种金属离子(M 2+),所需S 2-最低浓度的对数值lgc(S 2-) 与lgc(M 2+)的关系如图所示,下列说法不正确的是( ) A .25℃时K sp (CuS)约为1×10-35 B .向含有ZnS 和Na 2S 的浊液中滴加CuSO 4溶液,生成黑色沉淀,可证明:K sp (CuS) C .向Cu 2+浓度为10-5mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 D .向100mLZn 2+、Cu 2+浓度均为10-5mol ?L -1的混合溶液中逐滴加入10-4mol ?L -1的Na 2S 溶液, Cu 2+先沉淀 11.室温时,下列溶液中微粒的浓度关系正确的是( ) A .0.1mol ·L -1 pH=4的NaHSO 3溶液中:c(-3HSO )>c(2- 3SO )>c(H 2SO 3) B .等体积、等物质的量浓度NaF 溶液与HF 溶液混合:c(Na +)=c(F -)+c(HF) C .在NaHA 溶液中一定有:c(Na +)+c(H +)=c(HA -)+c(OH -)+c(A 2-) D .c(+4NH )相等的(NH 4)2CO 3、(NH 4)2SO 4和(NH 4)2Fe(SO 4)2三份溶液中,溶质的物的量浓度依次增大 12.锂(Li)—空气电池的工作原理如图所示下列说法不正确...的是 A .金属锂作负极,发生氧化反应 B.Li+通过有机电解质向水溶液处移动 C.正极的电极反应:O2+4e—==2O2— D.电池总反应:4Li+O2+2H2O==4LiOH 13.如图是某同学设计的原电池装置,下列叙述中正确的是( ) A.电极Ⅰ上发生还原反应,作原电池的负极 B.电极Ⅱ的电极反应式为Cu2++2e-===Cu C.该原电池的总反应:2Fe3++Cu===Cu2++2Fe2+ D.盐桥中装有含氯化钾的琼胶,其作用是传递电子 14.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( ) A.甲烧杯中溶液的pH逐渐减小 B.乙烧杯中发生还原反应 C.外电路的电流方向是从a到b D.电池工作时,盐桥中的SO2-4移向甲烧杯 15.M、N、P、E四种金属,①M+N2+N+M2+②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡③N、E用导线连接放入E的H2SO4溶液中,电极反应为E2++2e-E,N-2e- N2+。四种金属的还原性由强到弱的顺序是( ) A.P、M、N、E B.E、N、M、P C.P、N、M、E D.E、P、M、N 16.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( ) A.正极附近 B.电子通过导线由铜片流向锌片 C.正极有O2逸出 D.铜片上有H2逸出 二、填空题(共52分) 17.利用反应Cu+2Ag+===2Ag+Cu2+设计了如图所示的原电池。回答下列问题: (1)该原电池的负极材料是__________,发生________(填“氧化”或“还原”)反应。 (2)X是__________溶液,Y是__________溶液。 (3)正极上出现的现象是____________________________________________________。 (4)在外电路中,电子从______(填电极材料)极流向________极。 18.由锌片、铜片和200 mL 稀H 2SO 4组成的原电池如下图所示。 (1)原电池的负极反应式为_______________________________________, 正极反应式为___________________________________________。 (2)电流的方向是________。 (3)一段时间后,当在铜片上放出1.68 L(标准状况)气体时,H 2SO 4恰好消耗一半。则产生这些气体的同时,共消耗________g 锌,有________个电子通过了导线,原硫酸的物质的量浓度是________。 19.现有①0.2 mol ·L -1 NaOH 溶液 ②0.2 mol ·L -1 HX 溶液,两溶液等体积混合后,测 得溶液中[Na +]>[X -]。则 (1)①中由水电离出的[OH -]________②中由水电离出的[H +](填“>”“=”或“<”)。 (2)上述混合液中共存在________种粒子,且[HX]________[X -](填“>”“=”或“<”,下同), [HX]+[X -]________0.1 mol ·L -1(忽略体积变化)。 (3)上述混合液显________性(填“酸”“碱”或“中”),其原因用离子方程式表示为___________________________________________________________________________。 20.电解质的水溶液中存在电离平衡。 (1)醋酸是常见的弱酸。 ①醋酸在水溶液中的电离方程式为_______。 ②下列方法中,可以使醋酸稀溶液中CH 3COOH 电离程度增大的是_______(填字母序号)。 a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体 (2)①一定温度下,向1 L 0.1 mol ·L -1CH 3COOH 溶液中加入0.1 mol CH 3COONa 固体,则醋酸 的电离平衡 向_______(填“正”或“逆”)反应方向移动;溶液中-+33c(CH COO )c(H )c(CH COOH) 的值_______(填“增大”、“减小”或“不变”)。 (3)99℃时,K W =1.0×10-12,该温度下测得0.1 mol·L -1Na 2A 溶液的pH=6。 ①H 2A 在水溶液中的电离方程式为_______。 ②该温度下,将0.01 mol· L -1H 2A 溶液稀释到20倍后,溶液的pH=_______。 ③体积相等、pH=1的盐酸与H 2A 溶液分别与足量的Zn 反应,产生的氢气_______。 A .盐酸多 B .H 2A 多 C .一样多 D .无法确定 定远育才学校2020—2021学年度12月周测(18日) 高二化学试卷答案 选择题AACCD ABCCB ACCCA D 二、填空题(共52分) 17 .(1)铜 氧化 (2)CuSO4[CuCl2、Cu(NO3)2等可溶性铜盐溶液也可] AgNO3 (3)银棒上有银白色物质析出 (4)Cu Ag 18.【答案】(1)Zn-2e-===Zn2+2H++2e-===H2↑ (2)由Cu极流向Zn极 (3)4.875 9.03×10220.75 mol·L-1 19.(1)< (2)6 < =(3)碱X-+H2O HX+OH-20.CH3COOH?CH3COO-+H+ b、c 逆不变 H2A=2H++A2-3C
