基团保护专项训练

基团保护专项训练
【要点例析】
1.保护基的使用与避免:在有机合成中,尤其是在复杂产物的合成中,几乎都要用到保护基,一般情况下,当复杂的分子中含有多个能够同时进行同一种反应的基团时,这时往往利用保护基将其中不需要反应的基团先保护起来,待合成任务完成后,再脱去保护基。但是,从减少反应成本的角度考虑,最好的策略是尽量避免使用保护基,也能达到有机合成之目的。2.保护基的必备条件:(1)只和要保护的基团发生反应,和其他基团不反应;(2)反应较易进行,精制也比较容易;(3)保护基易脱除,在除去保护基时,不影响其他基团。
3.常见的基团保护法:基团保护一般包括引入保护基和去保护基的两个过程。包括:对碳碳双键的保护;对醇羟基的保护;对酚羟基的保护;对羧基的保护;对羰基的保护;对氨基的保护等。
例1(2010年上海高考题)粘合剂M的合成路线如下图所示:
完成下列填空:
(1)写出A和B的结构简式:A , B
(2)写出反应类型:反应⑥反应⑦
(3)写出反应条件:反应②反应⑤
(4)反应③和⑤的目的是。
(5)C的具有相同官能团的同分异构体共有种。
(6)写出D在碱性条件下水解的反应方程式:。
解析:(1)根据合成路线图中A(C3H6)的后续反应,推断其为丙烯;A转化为B后,B 可以继续生成CH2=CHCH2OH,说明B是卤代烃;(2)根据路线图中的变化,可知反应⑥是酯化反应;反应⑦是加聚反应;(3)反应②是卤代烃水解,其反应条件为:NaOH/H2O,加热;反应③应是碳碳双键与HX加成,反应④只氧化羟基,反应⑤是消除HX再形成碳碳双键,所以反应⑤的条件是:NaOH/C2H5OH,加热;(4)根据上述(3)的分析,反应过程中③和⑤的目的是保护碳碳双键;(5)根据粘合剂M的结构切割逆推,C是CH2=CH-COOCH3,其含有相同官能团(碳碳双键和酯基)的同分异构体有:甲酸酯3种(丙烯基、烯丙基、异丙烯基)、乙酸乙烯醇酯1种,共计4种;(6)根据粘合剂M的结构切割逆推,D是CH2=CH-CO-NH2,在
碱性条件下水解得到羧酸钠和氨气:。
(此题与2007年上海高考有机合成题类似)
解答:(1)A:CH3CH=CH2;B:CH2=CHCH2Cl(CH2=CHCH2Br);
(2)反应⑥:酯化反应;反应⑦:加聚反应;
(3)反应②:NaOH/H2O,加热;反应⑤NaOH/C2H5OH,加热;
(4)保护碳碳双键;
(5)4种;
(6)。
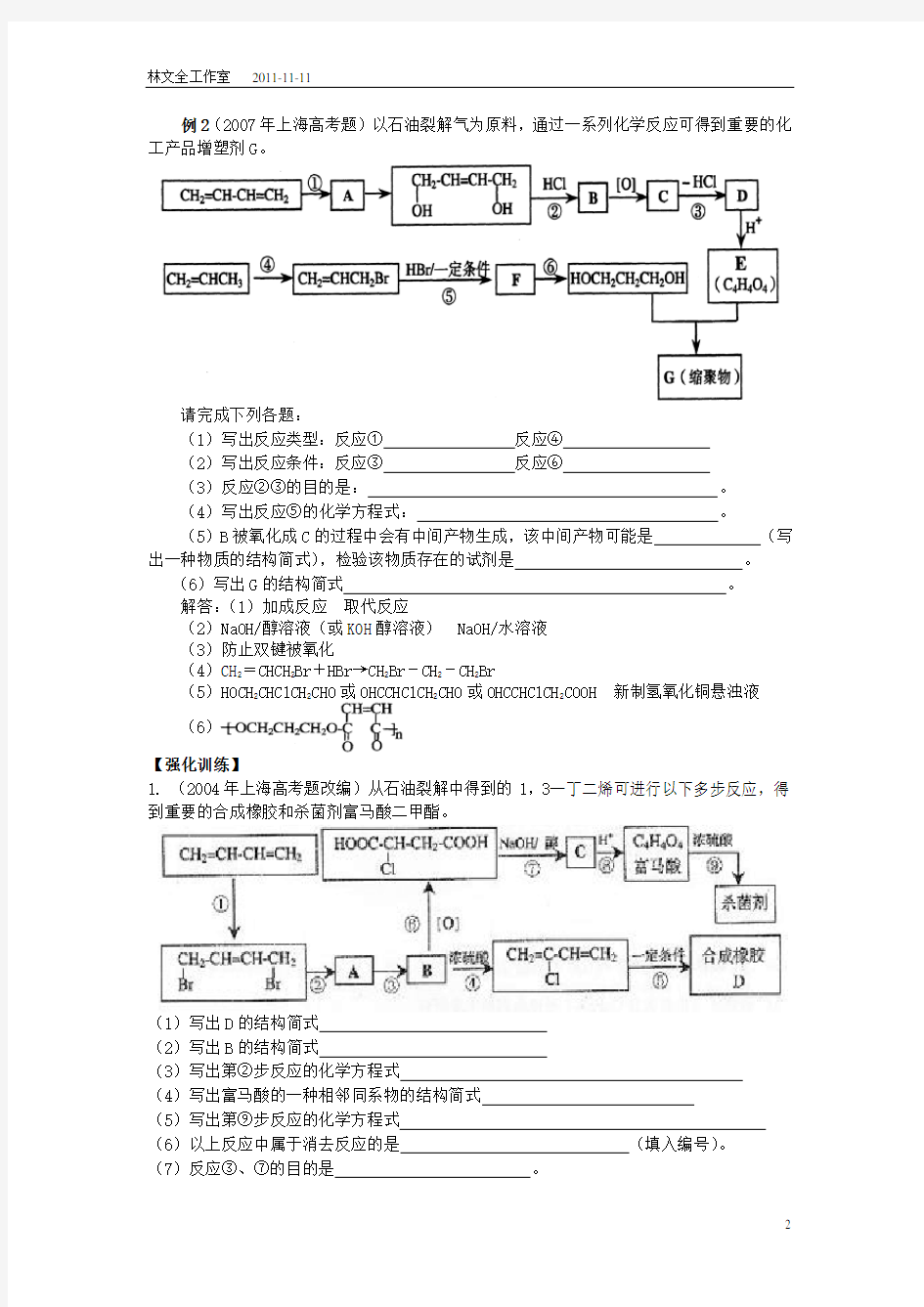
例2(2007年上海高考题)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
请完成下列各题:
(1)写出反应类型:反应①反应④
(2)写出反应条件:反应③反应⑥
(3)反应②③的目的是:。
(4)写出反应⑤的化学方程式:。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(6)写出G的结构简式。
解答:(1)加成反应取代反应
(2)NaOH/醇溶液(或KOH醇溶液) NaOH/水溶液
(3)防止双键被氧化
(4)CH2=CHCH2Br+HBr→CH2Br-CH2-CH2Br
(5)HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH 新制氢氧化铜悬浊液
(6)
【强化训练】
1.(2004年上海高考题改编)从石油裂解中得到的1,3—丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
(1)写出D的结构简式
(2)写出B的结构简式
(3)写出第②步反应的化学方程式
(4)写出富马酸的一种相邻同系物的结构简式
(5)写出第⑨步反应的化学方程式
(6)以上反应中属于消去反应的是(填入编号)。
(7)反应③、⑦的目的是。
2.已知烯烃中C =C 双键在某些强氧化剂作用下易发生断裂,因而在有机合成中有时需要对其保护.保护的过程可简单表示如下:
又知卤代烃在碱性条件下易发生水解,例如:CH 3CH 2Cl +H 2O CH 3CH 2OH +HCl ,但烯烃中碳碳双键在酸性条件下才能与水发生加成反应.现用石油产品丙烯及必要的无机试剂合成丙烯酸,设计的合成流程如下:
请写出②、③、④三步反应的化学方程式. 3.(2011年浦东二模)以甲苯为原料制取高分子化合物(C 7H 5NO)n (聚对氨基苯甲酸),基本流程如下:
甲苯????→?控制用量)(X B ?→?Y C ?→?
Z
D→(C 7H 5NO)n (1)甲苯和苯酚同属____(选择填空)。
a .芳香族化合物
b .芳香烃
c .苯的同系物
d .烃的衍生物 (2)写出D→(C 7H 5NO)n 的化学方程式(有机物用结构简式表示)。 (3)已知:①苯氨(C 6H 5NH 2)可由硝基苯被还原剂(铁粉+盐酸)还原获得。
所得苯氨容易被氧化。
②甲苯要引进第二个取代基,可取代在苯环的对位上:
苯甲酸要引进第二个取代基则取代在间位上:
写出试剂X 、Y 、Z 的化学式(或名称)。X__________,Y___________,Z_________。 4.(2011年浦东二模)聚乳酸是一种塑料,容易在乳酸菌作用下降解,所以它被认为是可替代聚苯乙烯的理想材料,用以应对日益严重的塑料制品造成的“白色污染”。以玉米为原料制备聚乳酸的一种方法和相关变化可简单表示如下:
玉米→A (C 6H 10O 5)n →B(C 6H 12O 6)→乳酸→C(C 6H 8O 4) →(C 3H 4O 2)n 聚乳酸
乳酸是一种含有取代基的羧酸。C 是一种含六元环的化合物,每摩尔C 由2摩尔乳酸生成,C 开环聚合成聚乳酸。
(1)“A→B”属于______反应。
(2)写出乳酸与过量碳酸钠在溶液中反应的离子方程式(有机物用结构简式表示)。
(3)估计乳酸在水中的溶解性为____(选择填空)。
a .可溶
b .微溶
c .难溶 (4)C 属于____类化合物。
HCOOCH
2
NH
2
(5)与乳酸具有相同最简式并能发生银镜反应的最简单的化合物是______。
(6)要使乳酸变成油酸的一种同系物,常用的一种试剂是_________。
(7)如果在实验室改用丙烯为原料制取乳酸(辅以Br2等必要的无机试剂),反应按三个步骤进行,这三个步骤依次为____、____、____(选择填空)。
A.取代 B.加成 C.消去 D.选择性氧化
5.(2011年普陀二模)对乙酰氨基酚,俗称扑热息痛,具有很强的解热镇痛作用,工业上通过下列方法合成:
请按要求填空:
(1)扑热息痛中除肽键外其他的官能团有(填写名称)。写出扑热息痛与氢氧化钠溶液反应的化学方程式:。
(2)写出①的反应类型:。
(3)写出化合物D的结构简式:。
(4)反应①、③的目的是。
(5)扑热息痛有很多同分异构体,同时符合下列要求的同分异构体有种:(Ⅰ) 苯环上有两个对位取代基,一个含氮不含碳,另一个含碳不含氮。
(Ⅱ) 两个氧原子处于同一官能团中。例如:
6.(2011年上海二模)化合物A是石油化工的一种重要原料,用A和水煤气为原料经图所示途径合成化合物D(分子式为C3H6O3)。
请回答下列问题:
(1)写出下列物质的结构简式:A ;B ;C ;D 。
(2)指出反应②的反应类型:。反应④的目的是。
(3)写出反应③的化学方程式:。
(4)化合物D′是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D′生成E和F的化学方程式:
D ′→
E : 。
D ′→F : 。
7. (2011年虹口二模)喹硫平是一种非典型抗精神病药物,其合成路线如下图所示:
MnO 4/H +
C 4H 6Br 2③NaOH(aq)
④
HBr ⑤⑥COOH HOOC
⑦⑧H +
N
N
N = C S CH 2
CH 2OCH 2CH 2
OH
( C 13H 9NO 4
S )A
F
①
COOH
SH
FeSO 4·H 2O
②
NH 2
S
COOH B (
)
…喹
平硫
已知:C 的系统命名为1,4-二溴-2-丁烯。
完成下列填空: (1)写出结构简式:A __________________________,D ___________________________。 (2)B 中除硫醚键(—S —)外,还含有的官能团名称为______________________________。 (3)②的反应类型:________________,①~⑦中属于取代反应的有__________(填序号);⑦的反应条件:__________________________。 (4)反应⑤和⑦的目的是________________________________________________________。 (5)D 的既含有羟基,又含有醛基的同分异构体共有______种。
(6)B 发生聚合反应的化学方程式为______________________________________________。 8.(2011年南京二模)替米呱隆(Timiperone)主要用于治疗精神分裂症。其合成路线如下:
(1)A →B 的反应类型为 。
Q)B →化学方程式为 ,将B 转化为C 的目的是 。 (3)由D 制备反应中要加入试剂X(C 6H 4NO 2Cl),X 的结构简式为
(4)C 在一定条件下反应可以得到G( ),符合下列条件的G 的同分异构体共有 种(不考虑立体异构)。
a .苯环上共有4个取代基,其中有2个处于间位的-CH 2Cl 取代基;
b .苯环上的一氯取代产物只有1种;
c .能与FeCl 3溶液发生显色反应;
d .能发生银镜反应。
(5)已知:
写出由B制备高分子化台物的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
NaOH
加热
浓硫酸
加热
高考有机合成中基团保护专项训练参考答案
1.(1)[ CH 2—CCl=CH —CH 2 ]n (2)HOCH 2CHClCH 2CH 2OH
(3)BrCH 2CH=CHCH 2Br+2H 2O HOCH 2CH=CHCH 2OH+2HBr
(4)HOOCCH=CHCH 2COOH (或其它合理答案)
(5)HOOCCH=CHCOOH+2CH 3OH CH 3OOCCH=CHCOOCH 3+2H 2O
(6)④ ⑦ (7)防止碳碳双键被氧化
2. ②CH 2=CH —CH 2Cl +H 2O
CH 2=CH —CH
2OH
+HCl
③CH 2=CH —CH 2OH +Br 2?→?
3.(1)a (2)
(3)浓HNO 3/浓H 2SO 4 KMnO 4/H + Fe/HCl
4.(1)水解 (2)CH 3CH(OH)COOH+CO 32-→CH 3CH(OH)COO -+HCO 3-(3)a (4)酯 (5)甲醛 (6)浓硫酸(7)B A D(3分) 5.(1)苯环、(酚)羟基
(2)取代反应
(3) (4)保护酚羟基不被硝酸氧化 (5) 5
6.(1)A :CH 2=CH 2 B :CH 3CH 2CHO C :CH 2=CHCHO D :CH 2(OH)CH(OH)CHO (2)取代
保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化 (3)CH 3CHBrCHO+NaOH
CH 2=CHCHO+NaBr+H 2O (4)CH 3CH(OH)COOH
CH 2=CHCOOH+H 2O
7.(1)S
,HOCH 2CH=CHCH 2OH ;(2)氨基、羧基(2分); (3)还原反应,①④(2分),NaOH/C 2H 5OH ,加热;(4)保护碳碳双键;(5)5;
8. (1)取代反应 (2)
保护羰基,防止其在后面催化加氢时被还原(3)
氨基酸总结
氨基酸的分类及其结构
甘氨酸:无手性C 颉氨酸、亮氨酸、异亮氨酸、甲硫氨酸:大脂肪侧链 脯氨酸:唯一成环氨基酸,氨基酸的侧链既与α-碳原子结合又与α-氨基N-原子结合,缺少H-bond donor,无法形成α螺旋结构 苯丙氨酸:侧链有芳香环,疏水氨基酸 络氨酸:酪氨酸的芳香环有一个羟基。与其他氨基酸侧链呈化学惰性相比,酪氨酸的羟基有化学反应性,疏水性弱。 色氨酸:吲哚基团替代丙氨酸侧链的氢原子。吲哚基团有的两个环融合在一起,一个环有NH基团。有NH故疏水性弱。 丝氨酸:侧链有极性但不带电荷。侧链有羟基与脂肪链相连。亲水,其反应活性比丙氨酸和颉氨酸大得多。 苏氨酸:侧链有极性但不带电荷。侧链有羟基与脂肪链相连。亲水,其反应活性比丙氨酸和颉氨酸大得多。有第二个不对称碳原子,但蛋白质的苏氨酸只有一种构型。 天冬酰胺、谷氨酰胺:极性但不带电荷。含酰胺的极性氨基酸 半胱氨酸:极性不带电。结构上类似苏氨酸,但是用巯基替代了羟基。巯基比羟基活泼。一对巯基靠近可以形成二硫键,稳定蛋白质的结构。 赖氨酸:带电荷的氨基酸,高度亲水,侧链长,末端是氨基,在中性pH时侧链末端带正电荷。 精氨酸:带电荷,高度亲水,侧链长,末端是胍基,在中性pH时侧链末端带正电荷。 组氨酸:带电荷,高度亲水,侧链含有咪唑基,咪唑基是芳香环,也能被质子化后带正电荷。咪唑的pKa值接近于6,在中性pH附近的溶液中咪唑基既可以质子化也可以不带电荷,实际情况取决于咪唑基团所在的局部环境。组氨酸常在酶的活性中心。在酶促反应中咪唑环既可以结合质子,有可以释放质子。 天冬氨酸:酸性氨酸。常被称为天冬氨酸盐,主要是强调在生理pH溶液中侧链基团解离,因此带负电荷。在有些蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。 谷氨酸:酸性氨酸。常被称为谷氨酸盐,主要是强调在生理pH溶液中侧链基团解离,因此带负电荷。在有些蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。 天津理工大学化学化工学院XJC编辑
常见的羟基的保护与脱保护方法
目录 1.简介 (2) 2.硅醚 (2) 2.1三甲基硅醚(T M S-O R) (3) 2.2叔丁基二甲基硅醚(T B D M S-O R) (4) 2.3叔丁基二苯基硅醚(T B D P S-O R) (4) 3.苄醚 (6) 4.取代苄醚 (7) 5.取代甲基醚 (8) 6.四氢吡喃醚 (9) 7.烯丙基醚 (10)
1.前言 羟基广泛存在于许多在生理上和合成上有意义的化合物中,如核苷,碳水化合物、甾族化合物、大环内酯类化合物、聚醚、某些氨基酸的侧链。。另外,羟基也是有机合成中一个很重要的官能基,其可转变为卤素、氨基、羰基、酸基等多种官能团。在化合物的氧化、酰基化、用卤代磷或卤化氢的卤化、脱水的反应或许多官能团的转化过程中,我们常常需要将羟基保护起来。在含有多官能团复杂分子的合成中,如何选择性保护羟基和脱保护往往是许多新化合物开发时的关键所在,如紫杉醇的全合成。羟基保护主要将其转变为相应的醚或酯,以醚更为常见。一般用于羟基保护醚主要有硅醚、甲基醚、烯丙基醚、苄基醚、烷氧甲基醚、烷巯基甲基醚、三甲基硅乙基甲基醚等等。羟基的酯保护一般用的不多,但在糖及核糖化学中较为多见。 2.羟基硅醚保护及脱除 硅醚是最常见的保护羟基的方法之一。随着硅原子上的取代基的不同,保护和去保护的反应活性均有较大的变化。当分子中有多官能团时,空间效应及电子效应是影响反应的主要因素。在进行选择性去保护反应时,硅原子周围的空间效应,以及被保护分子的结构环境均需考虑。例如,一般情况下,在TBDMS基团存在时,断裂DEIPS( 二乙基异丙基硅基) 基团是较容易的,但实际得出的一些结果是相反的。在这些例子中,分子结构中空间阻碍是产生相反选择性的原因。电子效应的不同也会影响反应的选择性。对于两种空间结构相似的醇来说,电子云密度不同造成酸催化去保护速率不同,因此可以选择性去保护。这一点对酚基和烷基硅醚特别有效:烷基硅醚在酸中容易去保护,而酚基醚在碱性条件下更容易去保护。降低硅的碱性还可以用于改变Lewis酸催化反应的结果,并且有助于选择性去保护。在硅原子上引入吸电子取代基可以提高碱性条下水解反应的灵敏性,而对酸的敏感性降低。对大多数醚来说,在酸中的稳定性为TMS (1) 氨基酸的侧链保护基团 氨基酸 侧链官能团 保护基 保护基结构式 保护基脱除条件 Asp/ Glu OH O OtBu O O 90%TFA ,30min OAll O O Pb(Ph 3P)4-AcOH-NMM ;Pb(Ph 3P)4-PhSiH 3 in DCM , 10-30min Asn/ Gln NH 2O Trt N H 90%TFA ,30-60min Cys SH Trt S 90%TFA ,30-60min Acm S N H O Hg(Ⅱ);Ag(Ⅰ); Tl(Ⅲ); Ph (SO )Ph-CH 3SiCl 3 tBu S HF (20℃);Hg(Ⅱ); Ph (SO )Ph-CH 3SiCl 3 StBu S S RSH ,Bu 3P Other reducing agents Mmt 0.5-1%TFA in DCM-TES (95:5),30min ; 3%TFA ,5-10min Tmob MeO OMe OMe 5%TFA-3% TES in DCM His NH N τπ Trt N τ 50%TFA in DCM ,30min Lys/ Orn NH 2 Boc N H O 90%TFA ,30-60min Alloc O N H O Pb(Ph 3P)4(0.1eq )-PhSiH 3 (24eq )in DCM ,10min Mtt N H 1%TFA in DCM ,30min ; AcOH-TFE-DCM(1:2:7) Dde 2%水合肼 in DMF , 5-10min Ser/ OH tBu O 90%TFA ,30min 有机合成中的基团保护、导向基(高考必备) (一)基团保护 在有机合成中,些不希望起反应的官能团,在反应试剂或反应条件的影响下而产生副反应,这样就不能达到预计的合成目标,因此,必须采取对这些基团进行保护,完成合成后再除去保护基,使其复原。 对保护措施一定要符合下列要求:①只对要保护的基团发生反应,而对其他基团不反应;②反应较容易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其他基团。 下面只简略介绍要保护的基团的方法。 1、羟基的保护 在进行氧化反应或某些在碱性条件进行的反应,往往要对羟基进行保护。如防止羟基受碱的影响,可用成醚反应。 防止羟基氧化可用酯化反应。 2、对氨基的保护 氨基是个很活泼的基团,在进行氧化、烷基化、磺化、硝化、卤化等反应时往往要对氨基进行保护。 (1)乙酰化 (2)对NR 2可以加H + 质子化形成季铵盐,– NH 2也可加H + 成 – NH 3而 保护。 3、对羰基的保护 羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。对羰基的保护一般采用缩醛或缩酮反应。 4、对羧基的保护 羧基在高温或遇碱性试剂时,有时也需要保护,对羧基的保护最常用的是酯 – OH –OR – NH 2 CH 3 COCl 或酸酐 –NH 2-C -CH 3 O –COOH + R –OH – COOR H + –CHO + 2ROH – CH(OR)2 H + -O -C -R O – OH 化反应。 5、对不饱和碳碳键的保护 碳碳重键易被氧化,对它们的保护主要要加成使之达到饱和。 (二)导向基 在有机合成中,往往要“借”某个基团的作用使其达到预定的目的,预定目的达到后,再把借来的基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导向基”。当然这样的基团,要符合易“借”和易去掉的原则,如由苯合成1,3,5 – 三溴苯,在苯的亲电取代反应中,溴是邻、对位取代基,而1,3,5 – 三溴苯互居间位,显然不是由溴的定位效应能引起的。但如苯上有一个强的邻、对位定位基存在,它的定位效应比溴的定位效应强,使溴进入它的邻、对位,这样溴就会呈间位,而苯环上原来并无此类基团,显然要在合成时首先引入,完成任务后,再把它去掉,恰好氨基能完成这样的任务,因为它是一个强的邻、对位定位基,它可如下引入: – H → – NO 2 → – NH 2 ,同时氨基也容易去掉:– NH 2 → – N 2 → – H 因此,它的合成路线是: 根据导向基团的目的不同,可分为下列几种情况: 1、致活导向 假如要合成 可以用 但这种方法产率低,因为丙酮两个甲基活性一样,会有副反应发生: 但在丙酮的一个甲基上导入一个致活基团,使两个甲基上的氢的活性有显著 O C 6H 5 O + C 6H 5 Br O C 6H 5 C 6H 5 Br O C 2H 5ONa O O COOC 2H 5 1)H 3O O O C 6H 5 C 6H 5 Br 碱 C 6H 5 Br 碱 O C 6H 5 C 6H 5 O 保护氨基酸:是指氨基酸的功能基团与其它基团反应而封闭了氨基酸功能基 团活性的氨基酸衍生物,都能叫保护氨基酸。包括a氨基和羧基,以及侧链功能基团。 氨基保护基的选择策略: 选择一个氨基保护基时,必须仔细考虑到所有的反应物,反应条件及所设计的反应过程中会涉及的底物中的官能团。 最好的是不保护. 若需要保护,选择最容易上和脱的保护基,当几个保护基需要同时被除去时,用相同的保护基来保护不同的官能团是非常有效。要选择性去除保护基时,就只能采用不同种类的保护基。 要对所有的反应官能团作出评估,确定哪些在所设定的反应条件下是不稳定并需要加以保护的,选择能和反应条件相匹配的氨基保护基。 还要从电子和立体的因素去考虑对保护的生成和去除速率的选择性 如果难以找到合适的保护基,要么适当调整反应路线使官能团不再需要保护或使原来在反应中会起反应的保护基成为稳定的;要么重新设计路线,看是否有可能应用前体官能团(如硝基等);或者设计出新的不需要保护基的合成路线。 Ⅰ氨基酸的保护基(保护羧基) (一)叔丁基tBu - (tert-butyl) ester 标准保护程序: 在N-保护的氨基酸的溶液中,加入DMAP(0.5当量)和叔丁醇(1.2当量)在干燥的DCM (DCM是一氧化二碳?),0℃在惰性气氛下,加入EDCI(1.1当量),并搅拌2小时。然后将混合物在室温下,搅拌直到TLC通过(通常是14小时),在真空下浓缩。将残余物再溶解在乙酸乙酯中,用水萃取两次,然后用饱和碳酸氢钠水溶液萃取两次。将有机溶液干燥(硫酸镁)并真空浓缩。如果必要将残留物通过快速色谱法(SiO)纯化。 脱保护: 将该化合物溶解在甲酸中在室温下搅拌直至反应完成(TLC通过)(通常是12小时)。然后将溶液浓缩,并重复加入甲苯浓缩数次。如有必要,可以将所得残余物通过快速色谱法(SiO)进行纯化。 (二)苄基Bn - (benzyl) ester 标准保护程序: 氨基酸在惰性气氛下搅拌用无水THF和O的苄基N,N'-diisopropylisourea(见文献进行合成)在室温下,直到完成通过TLC(通常为2天)。将混合物冷却至-20℃,并过滤。将滤液真空浓缩,并在必要时通过快速色谱法(SiO)纯化。 去除 氨基酸衍生物溶解在1:1的甲醇:叔丁醇和Pd(OH)2-C在氢气气氛下加入。将混合物搅拌,直到完全通过TLC(通常>3小时),然后过滤并浓缩。将所得残余物然后可以通过快 Protecting Groups in Organic Synthesis 选择保护基的原则: 羟基的保护基 酯类保护基的除去(cleavage) 碱性条件下水解, 水解能力: t-BuCO(Piv) < PhCO < MeCO < ClCH2CO 常用的碱:K2CO3, NH3, NH2NH2, Et3N, i-Pr2NEt et al 去除Piv一般用较强的强碱体系,如 KOH/H2O, LiAlH4, DIBAL, KBHEt3 第三章氨基酸 一、是非题 1 自然界的多肽物质均由L构型的氨基酸组成,完全没有例外() 2 组氨酸是人体的一种半必需氨基酸() 3 蛋白质中的所有的氨基酸(除甘氨酸外)都是左旋的() 4 因甘氨酸在酸性或碱性水溶液中都能解离,所以可作中性PH缓冲液介质() 5 脯氨酸与茚三酮反应生成紫色产物() 6 高等生物体内常见的L型氨基酸中液包括多巴(dopa)() 7 蛋白质中所有的组成氨基酸都可以用酸水解后用氨基酸分析定量测出() 8 所有的氨基酸中,因碳原子是一个不对称原子,因此都具有旋光性() 答案 1 .错 2. 对 3. 错 4. 错 5. 错 6. 对7. 错8. 错 二、填空题 1 精氨酸的pK1(COOH)值为2.17,pK2值为9.04,pK3值为12.98,其pI(等电点时的pH值)为。天冬氨酸的pK1(COOH)值为1.88,pK2(COOH)值为3.65,pK3()值为9.60,其pI值为 2 苯丙氨酸是人体的必需氨基酸,这是因为 3 用分光光度计在280nm测定蛋白质有强烈吸收,主要是由于,和等氨基酸侧链基团起作用 4 已知某种氨基酸的pK1和pK2分别是2.34和9.69,它的pI是 5 氨基酸定量分析的经典方法是,氨基酸序列测定中最普遍的方法是法 答案 1 (11.02)(2.77) 2 (体内不能合成) 3(酪氨酸/Tyr)(色氨酸/Trp)(苯丙氨酸/Phe) 4(6.02) 5(茚三酮)(Edman/Val) 三、选择题 1.下列有关氨基酸的叙述,哪个是错误的? A.酪氨酸和苯丙氨酸都含有苯环 B.酪氨酸和丝氨酸都含羟基 C.亮氨酸和缬氨酸都是分支氨基酸 D.脯氨酸和酪氨酸都是非极性氨基酸 E.组氨酸、色氨酸和脯氨酸都是杂环氨基酸 2.下列哪一类氨基酸完全是非必需氨基酸? A.碱性氨基酸 B.含硫氨基酸 C.分支氨基酸 Boc法固相多肽合成 SPPS是以在不溶性聚合物支持体上按序添加ɑ-氨基和侧链保护的氨基酸为基础的。而Boc法则是以易酸解的Boc基团作为N-ɑ-保护基团。切除此保护基团后,下一个被保护氨基酸通过使用连接试剂或预先激活的受保护氨基酸衍生物添加上去。多肽链的C端通过一连接体与树脂相连,其依赖于不同的连接剂的使用而被切割成为多肽酸或多肽酰胺。通常选择性使用氨基酸侧链保护基团而使得切除树脂的同时切除这些侧链保护基团。 Boc基团用TFA切除。肽基树脂的最后切除和侧链保护基团的切除需要使用强酸,在Boc化学中使用HF酸或TFMSA。DCM和DMF是树脂脱保护耦联和洗涤的首选溶剂。 Boc法其缺点是反复使用TFA酸解脱保护会导致多肽复合物中易酸解的保护基团产生一些副反应,而且Boc基团的切割和脱保护要求使用危险的HF和昂贵的实验仪器,而这些都是研究者不愿使用的。 一般的Boc法固相合成方式描述如下。 一、树脂合成: 1、Peptide acid Merrifield Resin and PAM Resin 2、Peptide carboxamide MBHA Resin 二、肽链合成: 氨基酸的耦联同Fmoc SPPS 类似,不同的是氨基酸N末端保护基Boc的脱除。 N-端Boc基团的切除: 在HF切割以前须将 N-端Boc保护基团用TFA除去。因为它不仅会阻碍后面的HF切割除去t-bu基团,而且还会通过离子交换切除所有肽链中Boc基团保护的氨基酸。手工切割N-端Boc基团方法是用TFA/DCM比为1:1的溶液在室温条件下洗涤反应15分钟。 三、切割 无水HF是多肽中Boc树脂切割的常用试剂。在大多数Boc树脂多肽的所有的切割程序中HF是最通用和危害最小的。其主要缺点就是它的高毒性和反应活性,因此必须使用防HF头罩及切割仪器。其它的强酸如TFMSA和TMSOTF也能用 基团的保护 方式一:使基团先参与反应又释放出 方式二:反应的先后顺序问题 (1)基团保护 ①醛基的保护如: ②双键的保护如: ③羟基的保护如: R--OH R--OCH3 R--OCH3R--OH ④羧基的保护如: ⑤氨基的保护如: 练习 1、(氨基的保护)苄佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得: 请回答下列问题: (1)写出A、B、C的结构简式:A____________,B______________, C______________。 (2)用1H核磁共振谱可以证明化合物C中有____种氢处于不同的化学环境。 (3)①与②能否颠倒位置,为什么? 2、(酚羟基的保护)工业上用甲苯生产对- 羟基苯甲酸乙酯HO——COOC2H5(一种常用 的化妆品防霉剂),其生产过程如下(反应条件未全部注明)所示: 按上图填空: (1)有机物A 的结构简式为 (2)写出反应⑤的化学方程式(有机物写结构简式,注明反应条件) (3)反应②和反应④的反应类型分别是(选填编号) 、 a .取代反应,b .加成反应,c .消去反应,d .酯化反应,e .氧化反应 (4)写出反应③的化学方程式(有机物写结构简式,不用写反应条件,但要配平) (5)在合成线路中设计③和⑥两步反应的目的是 。 3、(醛基的保护)化合物A 是石油化工的一种重要原料,用A 和水煤气为原料经下列途径合成化合物D (分子式为C 3H 6O 3). 已知: 请回答下列问题: (1).写出下列物质的结构简式: A :__________; B :____________; C :_____________; D :___________. (2).指出反应②的反应类型______________________.(3).写出反应③的化学方程式_______________. (4).反应④的目的是___________________________________________________. (5).化合物D ’是D 的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.D ’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E (C 3H 4O 2),又可以生成六原子环状化合物F (C 6H 8O 4).请分别写出D ’生成E 和F 的化学方程式: A B COOH OCH 3 ③ 一定条件 ② Cl 2 ①催化剂 CH 3I CH 3 CH 3 OH C 2H 5OH ⑤ CH 3 OCH 3 ④ COOC 2H 5 OCH 3 HI ⑥ H CH 3 §官能团的保护 1.易于被保护基团反应,且除被保护基团外不影响其他基团. 2.保护基团必须经受得起在保护阶段的各种反应条件. 3.保护基团易于除去. 化学合成中常用的保护基 碳氢键的保护 羟基的保护 氨基的保护 羰基的保护 羧基的保护 1. 碳氢键的保护 乙炔及末端炔烃中的炔氢较活泼,它可以与活泼金属`强碱`强氧化剂及有机金属化合物反应. 常用的炔氢保护基为三甲硅基.将炔烃转变为格氏试剂后同三甲基氯硅烷作用.即可引入三甲硅基.该保护基对于金属有机试剂`氧化剂很稳定.可在使用这类试剂的场合保护炔基. 2.羟基的保护 醚类 缩醛和缩酮类 酯类 羟基是一个活性基团,它能够分解格氏试剂和其他有机金属化合物,本身易被氧化,叔醇还容易脱水,并可以发生烃基化和酰基化反应.所以在进行某些反应时,若要保留烃基,就必须将它保护起来. 醇羟基常用的保护方法有3类: 2.1 转变成醚 甲醚 用生成甲醚的方法保护羟基是一个经典方法.通常使用硫酸二甲酯,在氢氧化钠或氢氧化钡存在下,在DMF或DMSO溶剂中反应得到. 优点:该保护基很容易引入,且对酸,碱,氧化剂和还原剂都很稳定. 缺点:难于脱保护,用氢卤酸回流脱保护基条件比较剧烈,常使分子遭到破坏,只有当分子中其他部位没有敏感基团时才适用. 2.1 转变成醚 叔丁醚 将醇的二氯甲烷溶液或悬浮液在硫酸复合物存在下,在室温与过量的异丁烯作用,可得到叔丁醚. 优点:对碱及催化氢化是稳定的. 缺点:对酸敏感,其稳定性低于甲醚.由于脱保护基所用的酸性条件剧烈,当分子中 存在对酸敏感的基团时不适用 2.1 转变成醚 三甲硅醚 三甲硅醚广泛用于保护糖类,甾类及其他醇羟基.通常引入三甲基硅基保护基所用的试剂有三甲基氯化硅和碱;六甲基二硅氨烷.在含水醇溶液中加热回流即可除去保护基. 优点:醇的三甲硅醚对催化氢化,氧化还原反应是稳定的,该保护基可在非常温和的条件下引入和去除. 缺点:对酸和碱敏感,只能在中性条件下使用. 2.2 转变成缩醛或缩酮 2,3-二氢-4H-吡喃在酸的催化作用下,与醇类起加成反应,生成四氢吡喃醚衍生物.这是最常用的醇羟基的保护方法之一.此保护基广泛用于炔醇,甾类及核苷酸的合成中. 2.3 转变成酯 醇与酰卤,酸酐作用生成羧酸酯;与氯甲酸作用生成碳酸酯. 所生成的酯在中性和酸性条件下比较稳定,因此可在硝化`氧化和形成酰氯时用成酯的方法保护羟基.保护基团可通过碱性水解除去,或在锌-铜的乙酸溶液中除去. 3.氨基的保护 伯胺和仲胺很容易被氧化,且易发生烃 基化,酰基化以及与醛酮羰基的亲核加成反 应.在合成中常采用: (1)氨基质子化 (2)变为酰基衍生物 (3)变为烃基衍生物等方法将氨基保护起来 3.1 质子化 此方法仅用于防止氨基的氧化,因为理论上说 采用氨基质子化,即占据氮尚未共用电子对,以阻 止取代反应的放生.这是对氨基保护最简单的法. 3.2 转变为酰基衍生物 将氨基酰化转变成酰胺是保护氨常用的方法.通常伯胺酰基化已足以保护基,防止其被氧化和烃化反应的发生.常用的酰基化试剂为酰卤和酸酐. 保护基可在酸性和碱性条件下水解出去. 3.2 转变为酰基衍生物 邻苯二甲酸酐与伯胺所生成的邻苯二甲酰亚胺非常稳定,不受催化氢化碱性还原,醇解以及氯化氢,溴化氢,乙酸溶液的影响,也适用于保护伯胺.在酸性或碱性条件下水解或用肼解法脱去保护. 3.3 转变为烃基衍生物 【转贴】保护基缩略语、全名大全 保护基缩略语、全名大全 注意:在某些例子中,不同的缩略语代表相同的保护基,或者相同的缩略语代表不同的保护基;列表根据"protective groups in organic synthesis " third edition整理。整理过程中可能有疏漏和错误,欢迎大家指出,以便完善。全名中的alpha代表α 此外欢迎大家在回复中补充新的缩略语。补充格式:缩略语全名 ABO 2,7,8-trioxabicyclo[3.2.1]octyl AC acetyl ACBZ 4-azidobenzyloxycarbonyl AcHmb 2-acetoxy-4-methoxybenzyl Acm acetamidomethyl Ad 1-adamantyl Adoc 1-adamantyloxycarbonyl Adpoc 1-(1-adamantyl)-1-methylethoxycarb onyl Alloc or AOC allyloxycarbonyl Als allylsulfonyl AMB 2-(acetoxymethyl)benzoyl AN 4-methoxyphenyl or anisyl Anpe 2-(4-acetyl-2-nitrophenyl)ethyl AOC or Alloc allyloxycarbonyl p-AOM p-anisyloxymethyl 4-methoxyphenoxy)methyl Azb p-azidobenzyl Bam benzamidomethyl BBA butane-2,3-bisacetal BDMS biphenyldimethylsilyl Bdt 1,3-benzodithiolan-2-yl Betsyl or Bts benzothiazole-2-sulfonyl Bic 5-benzisoxazolylmethoxycarbonyl Bim 5-benzisoazolylmethylene Bimoc benz[f]inden-3-ylmethoxycarbonyl BIPSOP N-2,5-bis(triisopropylsiloxy)pyrrol yl BMB o-(benzoyloxymethyl)benzoyl Bmpc 2,4-dimethylthiophenoxycarbonyl Bmpm bis(4-methoxyphenyl)- 1'-pyrenylmethyl Bn benzyl Bnpeoc 2,2-bis(4'-nitrophenyl)ethoxycarbon yl BOC t-butoxycarbonyl BOM benzyloxymethyl Bpoc 1-methyl-1-(4-biphenyl)ethoxycarbon yl BSB benzoSTABASE Bsmoc 1,1-dioxobenzo[b]thiophene-2-ylmet hoxycarbonyl Bts or Betsy1 benzothiazole-2-sulfonyl B`SE 2-t-butylsulfonylethyl Bum t-butoxymethyl t-Bumeoc 1-(3,5-di-t-butylphenyl)-1-methyl ethoxycarbonyl Bus t-butylsulfonyl Bz benzoyl CAEB 2-[(2-chloroacetoxy)ethyl]benzoyl Cam carboxamidomethyl CAMB 2-(chloroacetoxymethyl)benzoyl Cbz or Z benzyloxycarbonyl CDA cyclohexane-1,2-diacetal CDM 2-cyano-1,l-dimethylethyl CE or Cne 2-cyanoethyl Cee 1-(2-chloroethoxy)ethyl cHex cyclohexyl Climoc 2-chloro-3-indenylmethoxycarbonyl Cms carboxymethylsulfenyl Cne or CE 2-cyanoethyl Coc cinnamyloxycarbonyl Cpeoc 2-(cyano-1-phenyl)ethoxycarbonyl CPTr 4,4',4''-tris(4,5-dichlorophthalimido)tri phenylmethyl CTMP 1-[(2-chloro-4-methyl)phenyl]-4-met hoxypiperidin-4-yl Cys cysteine DAM di-p-anisylmethyl or bis(4-methoxyphenyl)methyl DA TE 1,1-di-p-anisyl-2,2,2-trichloroethyl DB-t-BOC 1,1-dimethyl-2,2-dibromoethoxy 12.4 基团的保护(P209) 保护基应满足下列3点要求(李209): (1) 保护基在温和条件下容易引入所要保护的分子。 (2) 保护基与被保护基形成的结构能够经受住保护阶段所发生的反应的条件,而不起反应。 (3) 保护基易于在温和条件下除去,即可以在不损及分子其余部分的条件下除去,而且对反应物分子不起其他作用(如不会因空间效应而引起立体结构的变化)。 一、羟基的保护 醇与酚都容易被氧化、烷基化和酰基化(酚羟基使苯环易于氧化)。但有不同,仲醇和叔醇常易脱水,有时要加以阻止。保护醇类ROH 的方法一般是将羟基制成醚类ROR ′或酯类ROCOR ′,前者对氧化剂或还原剂都有相当的稳定性。这是羟基保护的主要方法。 (一)形成甲醚类(讲) 先用碱脱去羟基的质子,再与合成子+CH 3作用,如使用试剂NaH /(CH 3)2SO 4、CH 3I/OH -或(CH 3)2SO 4/OH -。 ROH ROCH 3 333 对RMgX 、LiAlH 4、CrO 3、碱稳定。 C 6H 5OH C 6H 5OCH 3 C 6H 5OH CH 3I 或(CH 3)2SO 4 - HI 对RMgX 、LiAlH 4、CrO 3、碱稳定。 (二)形成混合型缩醛 ⑴ 四氢吡喃醚ROTHP (Tetrahydropyranyl )(讲) 制备时,使用二氢吡喃与醇类在酸催化下进行加成作用。对RMgX 、LiAlH 4、CrO 3、碱、金属氢化物稳定。(前讲义) ROH O ,TsOH,Et O ROH +2 欲恢复到醇类,则在酸性水溶液中进行水解,即可脱去保护基团。 (三)形成乙酸酯类(ROCOCH 3) 用乙酐在吡啶中将一级、二级醇转变为乙酸酯,吡啶是用来吸收生成的乙酸(巨167): ROH ROCOCH 3 K 2CO 3溶液 (CH 3CO)2O 吡啶 -CH 3OH ROH 二、二醇的保护 三、羰基的保护 最重要的是形成缩醛和缩酮。缩醛和缩酮的保护基不与碱、氧化试剂或亲核试剂 氨基保护方法 胺类化合物对氧化和取代等反应都很敏感,为了使分子其它部位进行反应时氨基保持不变,通常需要用易于脱去的基团对氨基进行保护。例如,在肽和蛋白质的合成中常用氨基甲酸酯法保护氨基,而在生物碱及核苷酸的合成中用酰胺法保护含氮碱基。化学家们在肽的合成领域内,对已知保护基的相对优劣进行了比较并在继续寻找更有效的新保护基。除了肽的合成外,这些保护基在其它方面也有很多重要应用。 下面介绍保护氨基的一些主要方法和基团。 1 形成酰胺法 将胺变成取代酰胺是一个简便而应用非常广泛的氨基保护法。单酰基往往足以保护一级胺的氨基,使其在氧化、烷基化等反应中保持不变,但更完全的保护则是与二元酸形成的环状双酰化衍生物。常用的简单酰胺类化合物其稳定性大小顺序为甲酰基<乙酰基< 苯甲酰基。 酰胺易于从胺和酰氯或酸酐制备,并且比较稳定,传统上是通过在强酸性或碱性溶液中加热来实现保护基的脱除。由于若干基质,包括肽类、核苷酸和氨基糖,对这类脱除条件不稳定,故又研究出了一些其他脱除方法,其中有甲酰衍生物的还原法,甲酰基以及对羟苯基丙酰基衍生物的氧化法,苯酰基和对羟苯基丙酰基衍生物的电解法,卤代酰基、乙酰代乙酰基以及邻硝基、氨基、偶氮基或苄基衍生物等“辅助脱除法”,等等。 为了保护氨基,已经制备了很多N2酰基衍生物,上述的简单酰胺最常用,卤代乙酰基衍生物也常用。这些化合物对于温和的酸水解反应的活性随取代程度的增加而增加:乙酰基< 氯代乙酰基< 二氯乙酰基< 三氯乙酰基< 三氟乙酰基。此外,在核苷酸合成的磷酸化反应中,胞嘧啶、腺嘌呤和鸟嘌呤中的氨基是分别由对甲氧苯酰基、苯酰基和异丁酰或甲基丁酰基予以保护的,这些保护基是通过氨解脱除的。另外,伯胺能以酰胺的形式加以保护,这就防止了活化的N2乙酰氨基酸经过内酯中间体发生外消旋化。 111 甲酰衍生物 胺类化合物很容易进行甲酰化反应,常常仅用胺和98 %的甲酸制备。甲酸乙酸酐也是一个有用的甲酰化试剂。对于某些容易发生消旋化的氨基酸可用甲酸和N ,N′2双环己基碳二亚胺(DCC) 在0 ℃时进行甲酰化反应,也可用酯类进行氨解。 甲酰胺类是相当稳定的化合物,因此广泛应用于肽的合成。甲酰基的脱除也有很多方法,氧化或还原法脱酰反应均可被采用。N2甲酰衍生物用15 %过氧化氢水溶液处理,可以顺利地进行氧化脱解。用氢化钠在二甲氧基乙烷中回流可以代替用酸或碱水解去除酰基。 112 乙酰基及其衍生物 胺类化合物的乙酰化或取代乙酰衍生物是用酰氯、酸酐进行酰化或在二环己基碳二亚胺(DCC) 或焦亚磷酸四乙基酯存在下,直接与酸综合加以制备,有时也可用酯或硫酯氨解的方法;制备乙酰胺另一好的方法是用胺和乙烯酮〔15〕或异丙烯乙酸酯反应。如果用双烯酮〔17〕反应,则得到的是乙酰乙酰基衍生物。 用乙酰基保护氨基比用其他保护基要多。由于它比甲酰基更稳定,因此,在进行亲电取代、硝化、卤代等反应时常选择乙酰基来保护芳香胺。乙酰胺丙二酸酯也可用于合成α2氨基酸,但在脱乙酰基时所需的酸或碱性条件,可使分子内其 基团保护专项训练 【要点例析】 1.保护基的使用与避免:在有机合成中,尤其是在复杂产物的合成中,几乎都要用到保护基,一般情况下,当复杂的分子中含有多个能够同时进行同一种反应的基团时,这时往往利用保护基将其中不需要反应的基团先保护起来,待合成任务完成后,再脱去保护基。但是,从减少反应成本的角度考虑,最好的策略是尽量避免使用保护基,也能达到有机合成之目的。2.保护基的必备条件:(1)只和要保护的基团发生反应,和其他基团不反应;(2)反应较易进行,精制也比较容易;(3)保护基易脱除,在除去保护基时,不影响其他基团。 3.常见的基团保护法:基团保护一般包括引入保护基和去保护基的两个过程。包括:对碳碳双键的保护;对醇羟基的保护;对酚羟基的保护;对羧基的保护;对羰基的保护;对氨基的保护等。 例1(2010年上海高考题)粘合剂M的合成路线如下图所示: 完成下列填空: (1)写出A和B的结构简式:A , B (2)写出反应类型:反应⑥反应⑦ (3)写出反应条件:反应②反应⑤ (4)反应③和⑤的目的是。 (5)C的具有相同官能团的同分异构体共有种。 (6)写出D在碱性条件下水解的反应方程式:。 解析:(1)根据合成路线图中A(C3H6)的后续反应,推断其为丙烯;A转化为B后,B 可以继续生成CH2=CHCH2OH,说明B是卤代烃;(2)根据路线图中的变化,可知反应⑥是酯化反应;反应⑦是加聚反应;(3)反应②是卤代烃水解,其反应条件为:NaOH/H2O,加热;反应③应是碳碳双键与HX加成,反应④只氧化羟基,反应⑤是消除HX再形成碳碳双键,所以反应⑤的条件是:NaOH/C2H5OH,加热;(4)根据上述(3)的分析,反应过程中③和⑤的目的是保护碳碳双键;(5)根据粘合剂M的结构切割逆推,C是CH2=CH-COOCH3,其含有相同官能团(碳碳双键和酯基)的同分异构体有:甲酸酯3种(丙烯基、烯丙基、异丙烯基)、乙酸乙烯醇酯1种,共计4种;(6)根据粘合剂M的结构切割逆推,D是CH2=CH-CO-NH2,在 碱性条件下水解得到羧酸钠和氨气:。 (此题与2007年上海高考有机合成题类似) 解答:(1)A:CH3CH=CH2;B:CH2=CHCH2Cl(CH2=CHCH2Br); (2)反应⑥:酯化反应;反应⑦:加聚反应; (3)反应②:NaOH/H2O,加热;反应⑤NaOH/C2H5OH,加热; (4)保护碳碳双键; (5)4种; (6)。 多肽合成中Fmoc-氨基酸侧链的保护 在多肽合成中活泼的侧链基团要加以永久性的保护,使其在a-氨基的脱保护反 应和氨基酸缩合反应中保持稳定。它们的这种永久性保护与a-氨基的暂时性保 护配套形成正交保护,待所有缩合反应完成后再将保护基团在一定的条件下脱除。Fmoc-氨基酸的侧链保护基应在碱性条件下稳定,在酸性条件下(TFA)脱除。以 下是各个不同的氨基酸侧链常用的保护基团。 1、天冬氨酸(Asp)和谷氨酸(Glu) Asp和Glu侧链羧基常用tBu保护。可用TFA,TMSBr等脱除。但是用tBu 保护仍有侧链环化形成酞亚胺的副反应发生。近年来发展了一些新的保护基如环烷醇酯、金刚烷醇酯等可减轻这一副反应,这些保护基可用三氟甲磺酸三甲硅烷酯(TMSOTf)除去。 2、丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr) 丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)的羟基Tyr的酚羟基通常用叔丁基(tBu)保护。 3、天冬酰胺(Asn)和谷氨酞胺(Gln) Asn和Gln的a-羧基活化时可能会发生分子内脱氢反应生成氰基化合物。碱性时Gln的侧链可以环化生成酰胺,为避免这些问题,可以用9-咕吨基,2,4,6-三甲氧卞基,4,4'-二甲氧二苯甲基或三苯甲基(Trt)等保护,这四种基团均可用TFA脱除。 4、组氨酸(His) His是最容易发生消旋化的氨基酸,Boc基团是一个较理想的保护基,降低了咪唑环的碱性,抑制了消旋。 5、半胱氨酸(Cys) CyS的-SH具有强亲核性,易被酰化成硫醚,也易被氧化为二硫键,常用保 护基有二类:一类用TFA可脱除,如对甲苄基、对甲氧苄基和二苯甲基等;第 二类可用(CF3CO)3T1 / TFA脱除,对TFA稳定。如tBu, Bom和乙酰胺甲基等,第三类对弱酸稳定,如苄基和叔丁硫基(StBu)等,CyS(StBu)可用琉基试剂和磷试剂还原,CyS(BZl)可用Na/NH3脱保护。 常见的氨基酸保护基有哪些 从最简单的病毒到人类,所有生物体内复杂的蛋白质结构都是由相同的20种氨基酸组成,这就构成了千姿百态的蛋白质世界。生物学家在对蛋白质深入研究的过程中,发现一类由氨基酸构成但又不同于蛋白质的中间物质,这类物质被称作多肽。肽是比蛋白质简单、分子量小,由氨基酸通过肽键相连的一类化合物。多肽具有调节机体生理功能和为机体提供营养的双重功效,它几乎影响着人体的一切代谢合成。一种肽含有的氨基酸少于10个称为寡肽,超过的就称为多肽;氨基酸为50多个以上的多肽就是人们熟悉的蛋白质。 由于常见的20种氨基酸中有氨基和羧基,并且很多侧链都带有活性,所以在多肽化学合成中氨基酸的保护非常关键,直接决定了合成能够成功的关键。一般要求,这些保护基在合成过程中稳定,无副反应,合成结束后可以完全定量的脱除。 1、α-氨基保护基 常用的氨基保护基可分为烷氧羰基、酰基和烷基三类。其中烷氧羰基保护基可防止消旋化,因此应用广泛,使用最普遍的是Z、Fmoc和Boc。Z基团可用钯黑,5%~20%钯炭催化氢化法脱除。Boc基团具有与Z基团不同的化学性质,不能用催化氢化法脱除,但易于酸解脱除,它可以和Z基团搭配使用,有选择性地脱除。Fmoc基团的特点是对酸稳定,可被碱脱除。因此尤其适合于合成含有Trp、Met、Cys等对酸不稳定的多肽。 2、α-羧基保护基 与氨基保护基相比,羧基保护基种类较少,一般以盐或酯的形式存在。盐是对羧基的临时保护,常用的有钾盐、钠盐、三乙胺盐和三丁胺盐等。常用的酯类有甲 酯、乙酯、苄酯和叔丁酯。叔丁酯是近年来最常用的羧基保护基,可用酸在温和条件下脱除。 3、侧链保护基 为了避免副反应的发生,某些氨基酸的侧链官能团需采用适当的保护基加以保护。同一个侧链有多种不同的保护基,可以在不同的条件下选择性的脱除,这点在环肽以及多肽修饰上具有很重要的意义,而且侧链保护基和选择的合成方法有密切的关系。 多肽化学合成方法,包括液相和固相两种方法。液相合成方法现在主要采用BOC 和Z两种保护方法,主要应用于短肽的合成,如阿斯巴甜,力肽,催产素等,相对于固相合成,具有保护基选择多,成本低廉,合成规模容易放大的许多优点。主要缺点是,合成范围小,一般都集中在10个氨基酸以内的多肽合成,还有合成中需要对中间体进行提纯,时间长,工作量大。固相合成方法现在主要采用FMOC和BOC两种方法,它具有合成方便,迅速,容易实现自动化,而且可以比较容易合成到30个氨基酸左右的多肽。 常见的氨基和羧基保护基氨基酸的侧链保护基团.doc
有关官能团的保护
氨基酸的保护
保护基团方法大全
(1) 保护基的供应来源,包括经济程度。 (2) 保护基团必须能容易进行保护,且保护效率高。 (3) 保护基的引入对化合物的结构论证不致增加过量的复杂性, 如保护中忌讳产生新的手性中心。 (4) 保护以后的化合物必须承受的起以后进行的反应和后处理过 程。 (5) 保护基以后的化合物对分离、纯化、各种层析技术要稳定。 (6) 保护基团在高度专一的条件下能选择性、高效率地被除去。 (7) 去保护过程的副产物和产物能容易被分离。 呼之即来, 呼之即来,挥之即去。 挥之即去。 切莫请神容易, 切莫请神容易,送神难。 送神难。
1). 酯类保护基 t-BuCO (Piv); PhCO; MeCO; ClCH2CO et al.
OH HO OH OH
PivCl (1eq) Py-CH2Cl2 0-25 oC
HO
O
O
90% Nicolaou, K. C.; Webber, S. E. Synthesis, 1986, 453
OTBDMS TBDMSO O O OTBDMS
DIBAL(2.5eq) CH2Cl2, -78 oC
TBDMSO
OH
95% Nicolaou, K. C.; Webber, S. E. Synthesis, 1986, 453第三章 氨基酸
Boc法_固相多肽合成
有机合成中基团的保护
官能团的保护
保护基缩略语、全名大全
基团的保护
氨基保护方法
基团保护专项训练
多肽合成中Fmoc
常见的氨基酸保护基有哪些
