药品质量信息汇总分析表部分.doc

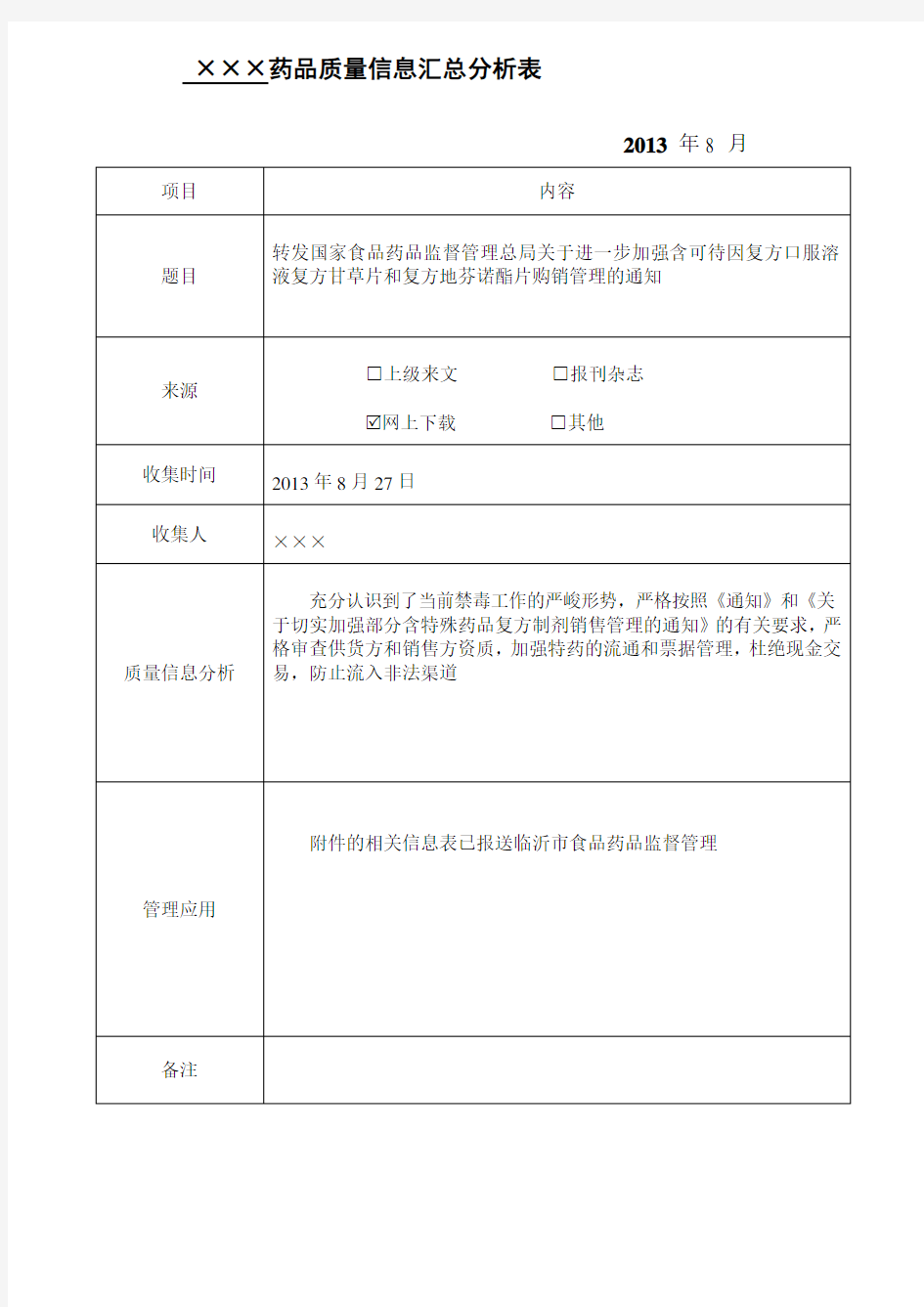
×××药品质量信息汇总分析表
2013年8 月
×××药品质量信息汇总分析表
2013年8 月
×××药品质量信息汇总分析表
2013年8 月
×××药品质量信息汇总分析表
2013年9月
×××药品质量信息汇总分析表
2013年9月
×××药品质量信息汇总分析表
2013年9 月
×××药品质量信息汇总分析表
2013年9 月
×××药品质量信息汇总分析表
2013年10 月
2013年10 月
2013年10 月
×××药品质量信息汇总分析表
2013年10 月
×××药品质量信息汇总分析表
2013年10 月
×××药品质量信息汇总分析表
2013年10 月
×××药品质量信息汇总分析表
2013年11 月
2016年产品质量情况分析报告
2016年产品质量情况分析报告
2016年产品质量状况分析报告 质量管理部 质量是企业的生命。近年来,随着公司技改开发的大力投入,产业布局的系统优化和整合完善,形成了以202车间为代表的南方矿分离体系和以204车间焙烧工序为龙头、201车间萃取分离工序为承接、218车间沉淀煅烧为收尾的北方矿分离体系,形成了稀土加工分离、稀土金属、稀土研磨材料、稀土贮氢材料、稀土磁性材料、稀土发光材料、氯碱化工等七大产业链。公司严把质量关,从原材料的入厂、中间品的控制到产成品出厂都严格按内部标准执行,在各工序间制定了质量控制标准,细化了关键岗位控制标准,编制了质量岗位巡视路线图,强化质量巡视工作,从而使公司的产品质量有了较明显的提升,确保了公司在市场中的竞争力。下面就公司产品质量做如下具体分析: 一、原材料方面 目前公司所用稀土原料全部来自外购,南方矿多采购自江西和广东,稀土总量为92%左右,稀土配分、放射性大小由于产地不同存在一定的差异,202车间在萃取分离过程中及时调整萃取工艺指令同时做好镧产品中放射性的去除工作;北方矿主要为包头高矿,兼顾山东矿和四川矿,矿型差异较大,204车间联合研究所做好实验工作,研究焙烧工艺,做好各类矿型混合焙烧的技术策划;碳铵做为公司沉淀工序的重要原料,由于市场原因,采购自不同厂家,2016年合格率为89.69%,不合格原因除总量偏低外,不同厂家的产品对沉淀过程
液、镧铈液、镨钕液稀土组分不合格的主要原因受生产工艺影响,在萃取稀土过程中,温度、酸度、流量等条件稍微控制不当,容易使产品配分引起波动。产品中非稀土杂质超标的主要原因是201车间高纯线除杂不彻底,下游218车间需加强在沉淀环节和煅烧环节对稀土杂质的控制,及时调整生产工艺,关注外接稀土料液、生产用水、沉淀剂碳铵中Fe、CaO、Mg、Na、等非稀土杂质的含量以及生产设备、搅拌装置等腐蚀程度对产品质量的影响,车间生产技术人员在追求稀土产品相对纯度满足的前提下应足够重视对非稀土杂质的控制。三、产成品方面 202车间2016年产品一次合格率为99.82%,较2015年上升 0.65%,产品质量有明显提升;218车间2016年产品一次合格率为99.95%,较2015年上升0.05%,产品质量与2015年基本持平;205车间、磁材车间、贮氢车间、应用型产品质量一次合格率均为100%;金属车间2016年产品一次合格率为96.31%,较2015年降低1.5%,产品质量有所下降。其中202车间氧化钆松装比重不合格,主要原因是沉淀过程控制不当,在今后的生产过程中要把单纯控制产品化学指标转变为为产品晶形晶貌的控制;218车间氧化镨钕稀土杂质La2O3不合格,主要原因为为转产前未彻底清理炉膛导致煅烧过程污染使产品中组分La2O3超标,在今后的生产过程中车间技术人员应提高质量意识,做好生产前的质量策划;金属镧、金属铈、金属钕、镧铈金镨钕金属中稀土杂质AL、C、Si、Mo等超标,主要原因电解过程控制
药品质量评审报告
辽宁大明药房大明药房有限公司 2014年GSP进货质量评审记录 2015年1月05日 保存年限3年(自2015年1月至2018年12月) 装订人:装订日期:2015年1月05日存放地点:质管部
辽宁大明药房大明药房有限公司 2014年度年药品购进质量评审报告 一、评审目的: 为了掌握药品进货质量情况,提高质量意识,树立质量第一的思想,严格按照药监部门批准的《药品经营许可证》核准的经营范围和经营方式从事药品经营,规范公司经营行为,良好地实施公司质量体系,确保了药品经营质量。 二、评审依据: 《药品经营质量管理规范》、本公司的有关制度程序和国家的相关法律法规。 三、评审机构及人员: 评审机构:质量领导小组; 评审人员: 四、综合评价: 1、进货质量:业务部购进的药品品种质量情况良好,能针对市场需求,产品适销,销售情况良好。购进药品的原则以销定购为前提。依据公司制定的药品采购管理制度,由采供部编制年度购货计划,质量管理部参与审核,公司领导审批签字。对首营品种、首营企业实行了购销合同管理,并制订相应的质量 保证协议。做到采购药品量足、质高、规格齐、品种对路、价格适宜,满足了市场需求扩大了销售提高了效益。 2、供应商情况:公司严格按照《药品经营质量管理规范》及《实施细则》的要求把质量放在选择药品和供货单位的首位。公司所购近药品都来自正规的药品生产、经营企业,进货前严格审查了供货方的法定资格、经营范围和质量信誉。对首营企业进行了包括企业资质和质量保证能力的审核,审核由质量管理部会同业务部共同进行,并经质量质量人批准。分别建立了供货企业质量档
案和首营品种质量档案。供货方合法证照齐全(包括首营企业、首营品种之所需资料)。经营行为与范围与证照内容一致,履行合同能力包括药品、数量、价格、交货期、票、账、货、款均相符及服务等方面均符合规定要求。全年审核首营企业**家,首营品种**个。对与本公司进行业务联系的供货单位销售人员也进行合法资格的验证,严格杜绝伪劣药品进入流通领域,从企业业务经营的源头确保消费者的合法权益。 药品生产企业多为GMP达标,社会信誉较高、交货及时、能严格按照国家物价部门的价格服务于需方,并注意回访,重视需方的建议和意见,能及时调整需方所提出的适应满足市场的合理要求。 3 、药品质量:验收员严格按照法定标准和合同规定的质量条款对购进药品、销后退回药品的质量进行了逐批验收,药品养护员制定了养护计划,对在库药品按季进行循环检查,对质量不稳定的药品、国家和广东省基本药物、近效期药品进行了重点养护。今年药品总的进货批次为***次,其中验收合格批次为***次,入库验收合格率为100%。药品在库养护中,能够按其性能储存于相应的库中,保证了药品储存的稳定性。 销售退回药品共**批次,不合格药品**批次;合格率**%。退货原因一是其他企业或药店销不畅,二次少量部分运输、摆放过程中人为形成的破损,作为不合格药品处理,顾客投诉情况尚未发现。 4、首营品种质量分析:所供药品标准从外观质量验收、包装情况、标签说明书等方面的检查亦符合规定要求,并存入质量档案。 5、进货拒收情况:由于市场调查及时,信息反馈情况良好,所购进药品适销,降低了库存贮存保管和养护的成本。 6、主要大宗单品种销售情况:尚未出现过大宗单品种销售情况。 7、客户反映质量问题:客户反映所供药品质量情况良好,内在质量、外观质量、包装情况未发现过质量方面的问题。
药学研究主要信息汇总表[1] CTD
注:本信息汇总表与国食药监注[2010]387号文中附件中的CTD格式申报主要研究信息汇总表略有不同。本汇总表适用于已经按照《药品注册管理办法》附件2提交申报资料的品种。为了提高审评效率,请注册申请人按本汇总表的要求重新整理研究信息并电子提交。 仿制药药学研究主要信息汇总表 原料药 2.3.S.1 基本信息 2.3.S.1.1药品名称 原料药的中英文通用名、化学名 2.3.S.1.2 结构 原料药的结构式、分子式、分子量 2.3.S.1.3 理化性质 原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。 2.3.S.2 生产信息 2.3.S.2.1生产商 生产商的名称(一定要写全称,与公章名称一致)、地址以及生产场所的地址。 2.3.S.2.2 生产工艺和过程控制 (1)工艺流程图/反应方程式:此处可仅提供反应方程式,标明各步反应的工艺参数、收率、所用溶剂和反应试剂。注明信息来源的申报资料编号和页码。 (2)工艺描述:按反应路线简述各步反应的反应类型(氧化、还原、取代、缩合、烃化、酰化等),各步反应的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特殊的反应条件(如高温、高压、深冷等)应说明。按工艺流程来描述工艺操作,以注册批为代表,列明各反应物料的投料量及各步收率范围。注明信息来源的申报资料编号和页码。 (3)生产设备:提供主要和特殊设备的型号及技术参数。注明信息来源的申报资料编号和页码。 (4)大生产的拟定批量:kg(g)/批。 2.3.S.2.3 物料控制 提供生产用起始物料和重要物料的质量控制信息(包括来源/生产商信息、质量标准等)。注明信息来源的申报资料编号和页码。 2.3.S.2.4关键步骤和中间体的控制 列出所有关键步骤(包括终产品的精制、纯化工艺步骤)及其工艺参数控制范围。并说明关键步骤是如何界定的、关键工艺参数范围的确定有哪些研究数
药品检查分析总结及整改措施
药品检查分析总结及整改措施 篇一:XX年第三季度药品质量管理检查情况分析总结及整改措施 XX年第三季度药品质量管理检查情况 分析总结及整改措施 第三季度药品质量管理小组对我院药品质量、各临床科室备用药品的管理进行每月抽检,对一些存在的安全隐患及时采取防范措施,避免药品质量问题的发生,保证了药品的安全供应。 具体检查情况如下: 药库: 1. 抽查药品:酒石酸美托洛尔、辅酶A、前列地尔、地特胰岛素、诺和锐特充、甘精胰岛素,优泌乐25,贝飞达、脾氨肽、鲑降钙素、狂犬病疫苗、破伤风抗毒素、重组人白介素、重组人促红素这些药品均按储存要求放置在药库冰箱的冷藏室中。冰箱冷藏室温度显示:2——8°C。 2. 抽查药库抢救药品有专用房间,标签相符。 3. 药库温湿度记录齐全,药库温湿度均符合储存药品需求。 4. 药库入库验收记录完整齐全,有高危药品、冷藏药品养护记录。 5. 特殊药品管理符合“五专”管理规定,有严格进出
库记录。存在问题:药库部分药品还需进一步分类明确,标签有部分脱落情况,还需及时更换标签。其余没有问题的方面需要继续保持。一门诊药房: 1. 抽查药品:诺和锐特充,重组人干扰素,辅酶A,酒石酸美托洛尔,门冬胰岛素30笔芯、金双歧、甘精胰岛素、贝飞达、脾氨肽、鲑降钙素、狂犬病疫苗、破伤风抗毒素、优泌乐25、地特胰岛素笔 芯这些药品均按储存要求放置在药库冰箱的冷藏室中。冰箱冷藏室温度显示:2——8°C。 2. 抽检药品:厄贝沙坦、阿托伐他丁,辛伐他汀(舒降之)、二甲双胍(格华止)阿奇霉素(希舒美)、头孢克肟(特普宁)、云南白药胶囊,祖师麻膏药,胆石清,曲美布丁,银杏叶滴丸、这几种药品,均是分类摆放,均有明显的标签标示,无有效期小于三个月的药品。 3. 麻醉、精神药品有专人管理、专柜储存、有专门账册并且有详尽出入库的登记。 4. 一门诊药房温湿度记录齐全,温湿度均符合储存药品需求。存在问题:由于一门诊药房冰箱有限,需要冷藏的药品比较多,摆放过于拥挤,分类不明确,标签不尽相符。 改进措施:1. 购置冰箱,增加容量;2. 减少冷藏药品库存,及时多频次进货。 其余没有问题的方面需要继续保持。
质量分析报告.doc
一、质量情况 1、大冲车间 一月份共生产6330固定支架39506件,其中不合格品6件,不合格率为0.02﹪。生产左货厢支撑座1834件,其中不合格品14件,不合格率为0.76﹪。2、焊接车间 焊接车间在一月份共生产左导套焊合件22947件,其中不合格品147件,不合格率为0.64﹪。 二、原因分析 1、大冲车间 大冲车间生产6330固定支架由于尺寸过小而导致产品不合格,而造成不合格的主要原因是:操作者在剪载过程中由于操作不当,定位松动而造成的尺寸超差。 同时左货厢支撑座在落料工序中,由于零件放不到位而造成零件缺陷。2、焊接车间 焊接车间在对左导套焊合件进行点焊过程中发现焊接不牢固而造成零件不合格,其主要原因是:电压不稳定,操作者也未能调好参数而造成。 三、建议采取措施 建议车间操作者、技术质量室有关人员对以上不合格情况作进一步的分析,并制订有效的纠正措施,控制不合格的再次发生或减少不合格的出现。 质检部 2007年2月03日161
一、质量情况 1、大冲车间 2月份共生产6330固定支架27025件,其中不合格品25件,不合格率为0.09﹪(1月份不合格率为0.02﹪),不合格率比1月份增加0.07个百分点。2月份的产量教1月份减少12481件。 2、小冲车间 在2月份共生产左内开臂34012件,不合格品12件,不合格率为0.04﹪;生产有左棘爪臂33010件,其中不合格品有10件,不合格率为0.03﹪。 二、原因分析 1、大冲车间 造成6330固定支架不合格主要表现为:在成型工序中对称度0.4尺寸超差,其出现的主要原因是:操作者在工作中操作不当,定位松动而造成尺寸超差。 2、小冲车间 在成型内开臂过程中,操作者由于疏忽定位未锁紧就进行操作而造成零件尺寸超差。 棘爪臂在落料过程中,零件未放到位造成零件缺陷,导致零件咬边。 三、建议采取措施 建议车间工作者在进行操作时能认真负责,尽量避免不合格品的出现。 质检部 2007年3月05日47
产品质量分析报告模版
2010年产品质量分析报告 【说明】 一、应开展年度质量回顾分析的产品如下: 1) 常年生产、产量较大的品种; 2) 高风险品种:如注射剂类产品、毒性药品、精神药品、麻醉药品、放射性药品、血液制品、疫苗等。 二、企业应使用风险管理理念,对产品进行分类后,选取具代表性的品种或品规开展质量回顾分析。 分类原则如下: 1)生产工艺和质量控制相似、共线生产的非高风险类产品,经质量受权人批准,可按剂型或产品系列进行分类。 2)高风险产品,经质量受权人批准,可按品种或产品系列进行分类。 3)常年生产的产品,经质量受权人批准,可按剂型、产品或产品系列进行分类。 4)无菌原料药,经质量受权人批准,可按产品或产品系列进行分类。 5)该年度变更工艺或关键生产设备等变更(如注射剂灌装设备变更、除菌过滤系统变更、灭菌设备改变)的产品,经质量受权人批准,可按剂型、产品或产品系列进行分类。
委托加工的产品,经质量受权人批准,可按产品或产6). 品系列进行分类。 三、本模版是企业撰写《年度产品质量回顾分析报告》的基本要求,仅供企业参考。各企业可根据实际情况,在积极学习和充分借鉴国外先进经验的基础上,不断完善相关内容。 2010年产品质量分析报告
产品名称、规格 回顾日期:XX年XX月-XX年XX月产品编码:XXXXX 起草签时间 QA 审核签时间 Q经 批准签时间 车间主 生产部负责 工艺技术负责 物料/销售负责人 质量受权人
] 目录[ 1概要……………………………….………………………………….…2回顾期限…………………………………………………….…….……3制造情况………………………………………………….……….……4产品描述………………………………………………….……….…… 4.1产品工艺………………………………………….……….…….. 4.2产品给药途径及适应症………………………….……….…….. 4.3关键参数………………………………………….……….…….. 5物料质量回顾…………………………………………….…….……… 5.1原辅料、包装材料质量问题回顾……………………….………. 5.2主要原辅料购进情况回顾……………………………….………. 5.3供应商管理情况回顾………………………….….……………… 5.4工艺用水、与药品直接接触的气体质量问题回顾……….….… 6产品质量标准情况…………………………………………….………. 6.1产品质量标准…………………………………………………….. 6.2质量指标统计及趋势分析……………………………………….. 7 生产工艺分析………………………………………………………..… 7.1关键工艺参数控制情况…………………………………….……. 7.2中间体控制情况………………………………………………….. 7.3工艺变更情况………………….…………………………………. 7.4物料平衡………………………………………………………….. 7.5收率……..………………………………………………………… 7.6返工与再加工……………………….……………………………. 7.7设施设备情况…………………………………………………….. 8 偏差回顾………………..……………………………………………… 9 超常超标回顾………………………………..………………………… 10 产品稳定性考察……………………………………..………………… 11 拒绝批次………………………………………………………..……… 11.1拒绝的物料……………………………………………………….. 11.2拒绝的中间产品及成品………………………………………….. 12 变更控制回顾……………………………………..…………………… 13 验证回顾……………………………..………………………………… 14 环境监测情况回顾………………………………………………..…… 15 人员情况……………………………..………………………………… 16 委托加工、委托检验情况回顾…………………..…………………… 17 不良反应……………………………………………..………………… 18 产品召回、退货………………………………..……………………… 18.1产品召回………………………………………………………….. 18.2退货………………………………………………………………..
信息技术期末考试质量分析报告
信息技术期末考试质量 分析报告 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
信息技术期末考试质量分析报告2013~2014学年度第一学期初一年级信息技术 期末考试质量分析报告 一、试卷的指导思想 《信息技术课程标准》中指出:评价的目的是为了考查学生达到学习目标的程度,对信息技术的学习具有较强的导向作用。通过评价的合理实施,不断提高信息技术教师的教学水平,激发学生学习、应用信息技术的兴趣,帮助学生逐步提高信息素养。 本次考试的试卷正是本着面向全体学生,检验学生对信息技术这门学科的掌握情况,有利于教师改进自己的教学,有利于促进学生的发展。 二、考试类型 本次考试的类型为一上机操作,所有的试题都在电脑上进行。考试分两部分,一部分是笔试内容,占40分,第二部分是操作内容,占60分。考试的范围为第一单元,第四单元第1-6课,这是我校初一学生的统考,考试时间为1节课,45分钟。 三、试卷的特点 本份试卷题量较小,内容主要侧重于第四单元,有些是书本知识,有些是扩展知识。所考知识都是上课讲过的内容,学生如果平时认真听课,是能够轻松完成的。注重学生的理解运用,进行必要的识记。试卷包括选择题10题,共20分,判断题5题,共5分,填空题5题,共10分,简答题1题,共5分。 四、学生的答题情况统计及分析 本次考试全级最高分97分,最低分为60分,合格率为100%,优秀率为 58.4%。总的来说成绩很不错,所考知识有很多反复讲过的知识点,在检测与评估中做这的题目,学生也没能做出来,特别是灵活变换一下的题目,很多学生就转不过弯来。在考试过程中,发现许多学生写错字,比如说“直排工具”很多学生写成“直派工具”等。选择题错得最多的是5、8、9,这三个题目都是要理解的,学生都做错。 填空题做得还较好,只有第1题很多学生不会填,还有第3题,很多学生都写成“历史画笔工具”。 判断题的第4题。很多学生可能没有看清楚题目,结果也做错。 这次考试没有复习的时间,都是提前一个星期通知学生要考试,让学生自己复习,没有统一在课堂复习。 五、改进措施与反思 在以后的教学中加强对学生的评价,可以通过多些督促学生完成检测与评估,每课过关。还要注意对学生学习方法的指导,很多学生对于用什么方法学习信息技术都不大清楚,用其它科的学习方法。信息技术学科有它本身的特点,要求理论与实践,知识与技能相结合。要让学生学会联系生活,联系实
药品质量分析调研报告简易版
The Short-Term Results Report By Individuals Or Institutions At Regular Or Irregular Times, Including Analysis, Synthesis, Innovation, Etc., Will Eventually Achieve Good Planning For The Future. 编订:XXXXXXXX 20XX年XX月XX日 药品质量分析调研报告简 易版
药品质量分析调研报告简易版 温馨提示:本报告文件应用在个人或机构组织在定时或不定时情况下进行的近期成果汇报,表达方式以叙述、说明为主,内容包含分析,综合,新意,重点等,最终实现对未来的良好规划。文档下载完成后可以直接编辑,请根据自己的需求进行套用。 XX~XX年,在市局的统一领导和统筹安排 下,全市各市、县、分局及直属单位认真贯彻 《药品管理法》和《药品质量监督抽验管理规 定》,坚持监督检查和抽样检验相结合,加强 抽样的靶向性、针对性,严格药品抽验程序, 以最小的抽验成本,达到了最大的抽验效能。 按照省局下达的任务,对全市范围内药品生 产、经营企业和医疗机构进行了监督抽样,保 证了人民群众用药的安全有效。为了进一步提 高工作效率,提高药品监督抽验的不合格率, 为今后的药品抽验工作提供科学可靠的依据, 现将我市XX~XX年度药品质量情况分析如下:
一、药品抽验完成情况 XX~XX年总计抽验化学药、生化药、抗生素、中成药、中药材、中药饮片2620批。其中不合格药品277批,抽验不合格率10.6%。其中计划性抽验2210批,不合格药品84批,不合格率3.8%。日常监督抽验410批,不合格药品193批,不合格率47.1%。 铁力市抽验药品496批,不合格药品66批,不合格率13.3%。 嘉荫县抽验药品183批,不合格药品24批,不合格率13.1%。 一分局抽验药品172批,不合格药品31批,不合格率18.0%。 二分局抽验药品380批,不合格药品26批,不合格率6.8%。
2013药品质量信息搜集汇总分析
2013年药品质量信息搜集汇总分析 药品经营企业质量信息是指反映药品经营各环节中药品及工作质量情况的基本数据、原始记录、报表、资料、文件以及药品使用过程中反应出来的各种情报资料,包括药品生产(这里主要指药品验收、储存、养护、存放)、质量信息与经营服务信息,可分为固定信息和非固定信息、企业外部信息和内部信息。 为掌握药品质量的发展变化规律,本公司在2013年搜集了大量的基础资料,并及时、准确、全面、系统地对这些信息进行了科学的处理,保证了信息畅通。在信息传递过程中,坚决杜绝口头传递的习惯,及时填写药品质量信息反馈单,保证工作不发生差错。 我们质量管理部门的工作人员会定期查阅相关医药文献杂志、国家(湖北省、武汉市)食品药品监督管理局网站,获取最新的药品质量管理信息。我们搜集的资料主要包括药品监督管理部门发布的暂停销售的药品种类、药品不良反应信息、药品违法广告品种、抽检不合格的药品、药品相关法律法规等。获得相关信息后,质量管理部门在第一时间将信息以纸质文件的形式传递给相关的业务部或仓储部,这些部门在第一时间处理信息并将信息单传递回质量管理部门。 通过药品不良反应信息通报的信息传递,我们的质量相关部门了解到了像珍菊降压片、复方青黛丸(胶丸、胶囊、片)等药品的用药风险,以便做好药品的销售和采购工作,确保消费者的利益。
通过违法广告暂停销售通报的信息传递,我们及时核查本公司产品,若一旦发现此类产品,则立即停止销售和采购。经核实本公司不涉及搜集信息中相关产品,且禁止采购这些产品,使我们的采购工作更加规范,符合国家法律法规文件精神要求,从而按照国家批准的经营范围,进行药品经营活动,诚信服务,守法经营。 通过学习药品相关法律法规文件,我公司员工的药品质量管理的意识得到了整体提高。为我们的日常工作提供了很大的便利。 总之,2013年,由于我们根据自身的实际情况,建立了信息反馈系统,且经各部门和各工作岗位人员的协调配合,使我们的质量管理工作得到了较为明显的改善,从而促进公司质量管理体系的正常运行。
药品购进质量评审报告
广东启元药业有限公司 2014年GSP进货质量评审记录 2015年1月05日 保存年限3年(自2015年1月至2018年12月) 装订人:孙晓珊装订日期:2015年1月05日存放地点:质管部
广东启元药业有限公司 2014年度年药品购进质量评审报告 一、评审目的: 为了掌握药品进货质量情况,提高质量意识,树立质量第一的思想,严格按照药监部门批准的《药品经营许可证》核准的经营范围和经营方式从事药品经营,规范公司经营行为,良好地实施公司质量体系,确保了药品经营质量。 二、评审依据: 《药品经营质量管理规范》、本公司的有关制度程序和国家的相关法律法规。 三、评审机构及人员: 评审机构:质量领导小组; 评审人员:洪淑琴、吴洁琼、孙晓珊、洪世从、蔡伟华、陈锐沛 四、综合评价: 1、进货质量:业务部购进的药品品种质量情况良好,能针对市场需求,产品适销,销售情况良好。购进药品的原则以销定购为前提。依据公司制定的药品采购管理制度,由采供部编制年度购货计划,质量管理部参与审核,公司领导审批签字。对首营品种、首营企业实行了购销合同管理,并制订相应的质量保证协议。做到采购药品量足、质高、规格齐、品种对路、价格适宜,满足了市场需求扩大了销售提高了效益。 2、供应商情况:公司严格按照《药品经营质量管理规范》及《实施细则》的要求把质量放在选择药品和供货单位的首位。公司所购近药品都来自正规的药品生产、经营企业,进货前严格审查了供货方的法定资格、经营范围和质量信誉。对首营企业进行了包括企业资质和质量保证能力的审核,审核由质量管理部会同业务部共同进行,并经质量质量人批准。分别建立了供货企业质量档
原料药产品年度质量回顾分析报告模板
原料药产品年度质量回顾分析报告模板 XX(产品名称)年度质量回顾分析报告_ 回顾周期:XX年XX月XX日一XX年XX月XX日产品年度质量报告编码:XXXXX XXXXX
1.1 1.1 概要.............................. 1.2 1.2回顾周期.......................... 1.3 1.3产品描述.......................... 1.4 1.4生产质量情况 ...................... 2 2原辅料质量情况回顾....................... 3 3生产工艺中间控制情况回顾................ 3.1 3.1关键工艺参数控制情况 .............. 3.2 3.2中间体控制情况 .................... 3.3 3.3 收率.............................. 4 4成品检验结果回顾......................... 5 5 公共系统回顾 5.1 5.1工艺用水回顾 ...................... 5.2 5.2环境监测回顾 ...................... 5.3 5.3 与药品直接接触的工艺用气体质量回顾 6 偏差调查 .................................. 7稳定性考察及不良趋势分析.................... 8变更控制回顾................................ 9验证回顾.................................... 10 产品投诉/退货/ 召回情况回顾 10.1投诉情况回顾.......................... 10.2退货/召回情况回顾..................... 11相关研究回顾............................... 12上一次年度质量报告跟踪..................... 13结论....................................... 1、概述
制药厂产品质量回顾分析报告
制药厂产品质量回顾分 析报告 文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-
目录1 概要
根据《产品质量回顾管理规程》xxxxxxxx的规定,XXXX年X月对XX产品进行产品质量回顾分析。本报告在随机抽取XX批的基础上重点对该品种进行了统计和趋势分析。 2 回顾期限 XXXX年XX月XX日-XXXX年XX月XX日 3 制造情况 本回顾年度共生产XX产品XX批,总产量为XX(单位),总收率为XX.XX%。 4 产品描述 4.1性状 4.2功能主治 4.3用法与用量 4.4工艺流程图 4.5关键参数 5 物料质量回顾 5.1 原辅料、包装材料质量问题回顾 评价: 5.2 主要原辅料购进情况回顾
评价: 5.3 供应商的管理情况回顾 新增供应商: 变更供应商: 供应商审计: 小结: 5.4工艺用水、与药品直接接触的气体质量问题回顾 饮用水系统: 制剂反渗透纯化水系统: 压缩空气系统: 小结: 6 成品质量标准情况 6.1 产品质量标准 6.2质量指标统计及趋势分析 (见附01) 对6.1的参数项目实际检验数据实施统计与分析 A: B:
C: D: E: 小结:XXXXXXXX 7 生产工艺分析 7.1关键工艺参数控制情况(见附02) 7.2工艺变更情况: 7.3返工与再加工 7.4设备设施情况(与该产品有关的设施设备及与药品接触气体) 变更情况: 维护情况: 维修情况: 小结:XXXXXX 8 偏差回顾 评价: XXXXXX 9 超常超限回顾 10 产品稳定性考察 (见附03): 评价: XXXXXX 11 拒绝批次 11.1拒绝的物料 评价: XXXXXX 11.2拒绝的成品及中间产品
2019年药品产品质量分析报告
药品产品质量分析报告 医药产品是指能够提供给医生/患者使用,并能满足某种利益和需要的具有特殊功能的有形物质和服务。那么药品产品质量分析报告有哪些?大家不妨来看看推送的药品产品质量分析报告,希望给大家带来帮助! XXXX年上半年,我局在靖边县委、县政府和市质监局的正确领导下,在各乡镇、有关部门和广大企业的大力支持配合下,紧紧围绕地区经济建设和社会发展这个大局,以科学发展观统领质监工作,以经济建设为中心,以促进经济发展为目标,以质量、安全为主线,全面提高质量技术监督工作的有效性。深入扎实的开展好“质量兴县”工作。并以此为根本开展了一系列卓有成效的工作,为规范市场经济秩序、提高地方产品的整体质量水平做出用心的贡献。 一、基本状况 上半年,加强对化工产品、装饰材料(木质门)、建材等产品的监督抽查。共监督检验了80家企业,抽检样品86个,样品合格78个。不合格8个,合格率91%。还有部分未抽检,预计七月份抽检完毕。 二、抽查产品类别共性质量问题: 根据以上状况综合分析,我县建材生产企业是产品质量监管的重点,也是急待解决和整顿的重要资料,因为这些产品直接关系到地方基础设施建设,关系到社会大型建筑和国家人民的生命财产安全。重点是要加强生产企业的质量控制和管理,个性是要加强对产品的定
期监督检验和质量抽查,以确保产品出厂检验合格,并对存在的质量问题,帮忙企业分析存在的原因,制定整改方案和改善措施,指导和引导企业规范生产经营,全面提高我县的建材产品质量管理水平。 二、对策措施 (一)进一步健全产品质量分析报告制度。我局坚持每半年对我县的产品质量状况进行质量分析,为加强质量管理工作带给了科学依据。今后要进一步健全产品质量分析报告制度,紧紧围绕我县经济建设和社会发展这个大局,以经济建设为中心,以质量、安全为主线,以深化改革为动力,全面提高质量技术监督工作的有效性,及时将我县的产品质量状况和监督工作的有效性进行分析,为我县政府制定发展规划,进行宏观管理和决策带给科学的依据。 (二)进一步加大服务力度。用心帮忙企业加强和完善质量管理制度鼓励企业采用ISO9000族标准及其它国际通行的先进管理标准,结合企业实际,建立健全质量体系。同时,严格监督企业实施。多方面、多渠道收集最齐全、最新的国家标准、行业标准、地方标准,以供有需要的企业查询。帮忙企业制定满足市场需求、具有竞争潜力的企业内控标准。用心引导企业农产品进行地理标志保护产品认证。透过质量损失率和质量成本的统计、核算、分析,促使企业加强生产过程控制,减少质量损失,合理优化资源配置,改善产品结构,增加经济效益。 (三)进一步推进名牌战略的实施。用心引导企业树立名牌战略意识,以科技为先导,加大争创名牌产品的工作力度,用心培育名
医疗质量分析总结
医疗质量安全分析总结 2018年度我院根据年初医政医管目标责任安排部署医疗工作,严格按照国家卫计委2016年十号令《医疗质量管理办法》以及岐卫计发《2017》143号文件精神执行,加强医疗质量管理,确保医疗安全,防范医疗纠纷、事故的发生。以“改善医疗服务行动”、“群众满意卫生院创建”工作为抓手,提高医院服务能力和水平,构建和谐医患关系,维护社会稳定。 一、主要从以下几个方面开展工作: (一)加强法律法规学习,强化责任意识。 由医务科安排定期学习《医疗质量管理办法》、《执业医师法》、《医疗机构管理条例》、《十八项核心制度》等法律法规,熟知法律规范,强化医务人员的规范操作责任意识。 (二)加强质量管理,落实安全责任。 成立了院长为第一责任人、副院长为直接责任人、医务科长及护士长主管、相关医护人员为成员的医疗质量管理领导小组,制定医疗质量管理方案,负责日常督导考核管理工作。每月抽查病历进行病历质量、护理质量分析,召开医疗质量安全分析会议;对存在的问题进行通报,要求相关人员及时按要求整改,不断强化医疗质量管理工作。建立医疗事故防范预案、医疗不良事件报告制度,对发生的不良事件及医疗事故
苗头第一时间由医疗质量管理小组处理,杜绝了事态的发展。 (三)加强人员培训,提高诊疗水平。 由医务科制定年初培训学习计划,每月对全体医务人员进行三基三严知识培训,定期由相关科室主管人员进行业务知识培训;积极参加上级部门安排的学术讲座及培训;根据医院工作需求,由县中医院对口帮扶医师开展培训讲座。送相关医务人员在县级医院进行短训;通过集中培训与个人自学相结合的方式,不断提高医务人员的诊疗水平。 (四)规范诊疗行为,加强医疗文书书写。 严格落实十八项核心制度。落实“五合理”(合理住院、合理检查、合理治疗、合理用药、合理收费)管理制度;严把入院指征,实行首诊医生负责制,加强三级医师查房制度;实行危急值、危重病患报告制度;加强病历等医疗文书书写。通过半年医政医管检查、“病历书写、规范体格检查培训”、派医务人员到县医院借阅学习病历、院内培训、医疗质量点评等方式,不断加强医疗文书书写,提高病历内涵质量。强化查对制度,加强巡视制度,避免和杜绝医疗差错事故的发生。 (五)加强医患沟通及病人管理,维护工作秩序。 要求医务人员掌握沟通方法和技巧,及时如实与患者或家属进行病情、诊疗计划、治疗期间相关事项的沟通,按要求签订知情同意书;做好医患配合工作。患者住院期间原则上不
药品经营质量风险评估报告
质量风险评估报告 起草(签名/日期): 审核(签名/日期): 批准(签名/日期):
一、概述 质量风险管理是指贯穿产品生命周期的药品质量风险评估、控制、沟通和审核的系统过程。GSP的基本原则与药品质量风险管理的目标相一致。药品经营企业作为质量风险管理主体,在药品经营环节实施GSP过程中,通过运用质量风险管理的方法,正确识别质量风险、评估质量风险,科学控制质量风险,达到降低质量风险危害程度的目的,从而发挥质量风险管理对企业GSP贯彻实施的保证作用,进一步确保所经营药品的质量,切实保障公众用药的安全有效。 本报告的方案通过预先主动地制定方法以识别和控制在药品流通过程中存在的潜在质量问题,达到防范风险,预防质量事故的目的。 二、目的 通过质量风险分析评估,评估公司现有的质量管控措施是否全面,必要时完善相关管控措施,明确公司的风险控制策略。 三、范围 药品经营质量与企业组织机构、人员、管理制度与职责、过程管理、设备设施等诸多要素共同整合的复杂过程,任何一个要素发生问题都会影响所经营药品的质量,引发药品质量风险。 药品风险来源复杂,有人为因素,也有药品本身的“两重性”因素。人为因素可导致假药、劣药经营、药品质量问题、标识缺陷和包装质量问题、用药差错问题等,多属可控制风险;药品属性因素包括药品天然风险,其中包括药品已知风险和未知风险。已知风险包括药品已知不良反应和已知药物相互作用等,属可控制风险; 药品未知风险包括药品未知不良反应,非临床适应症患者使用,未试验人群的应用(如孕产妇、婴幼儿、老年人、肝肾功能障碍者等,他们一般被排除在临床试验入选标准之外),多属不可控制风险。 本风险分析包含组织机构、人员资质,管理制度与职责、设备设施、药品采购、药品检查、药品验收、药品储存、药品销售、药品运输等过程,主要是针对可控风险,不可控风险不在本报告的方案之内。
产品质量情况分析报告
产品质量情况分析报告文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
2016年产品质量状况分析报告 质量管理部 质量是企业的生命。近年来,随着公司技改开发的大力投入,产业布局的系统优化和整合完善,形成了以202车间为代表的南方矿分离体系和以204车间焙烧工序为龙头、201车间萃取分离工序为承接、218车间沉淀煅烧为收尾的北方矿分离体系,形成了稀土加工分离、稀土金属、稀土研磨材料、稀土贮氢材料、稀土磁性材料、稀土发光材料、氯碱化工等七大产业链。公司严把质量关,从原材料的入厂 、中间品的控制到产成品出厂都严格按内部标准执行,在各工序间制定了质量控制标准,细化了关键岗位控制标准,编制了质量岗位巡视路线图,强化质量巡视工作,从而使公司的产品质量有了较明显的提升,确保了公司在市场中的竞争力。下面就公司产品质量做如下具体分析:一、原材料方面 目前公司所用稀土原料全部来自外购,南方矿多采购自江西和广东,稀土总量为92%左右,稀土配分、放射性大小由于产地不同存在一定的差异,202车间在萃取分离过程中及时调整萃取工艺指令同时做好镧产品中放射性的去除工作;北方矿主要为包头高矿,兼顾山东矿和四川矿,矿型差异较大,204车间联合研究所做好实验工作,研究焙烧工艺,做好各类矿型混合焙烧的技术策划;碳铵做为公司沉淀工序的重要原料,由于市场原因,采购自不同厂家,2016年合格率为89.69%,不合格原因除总量偏低外,不同厂家的产品对沉淀过程影响差异较大,218车间技术组积极收集实验和生产数据,确定合格供应商。
二、中间品方面 204车间车间2016年产品一次合格率为99.78%,较较2015年上升 0.24%,所产水浸液产品质量相对稳定,个别批次REO未达标、Fe 2O 3 超 标,主要原因为焙烧系统所投原料较为复杂,受201车间非皂化工段影响,下游物料交接不畅,导致焙烧工序、洗渣工序控制不稳定,204车间应强化员工操作水平,车间技术组继续摸索纯低矿分解反应最佳工艺技术条件,加强和细化生产过程工艺管理工作。 201车间2016年产品一次合格率为95.44%,较2015年降低3.42%,氯化镧液不合格指标为稀土杂质CeO2超标和非稀土杂质CaO、MgO、 Na2O、MnO2、SO42-超标;氯化铈液不合格指标为稀土La2O3超标;富铈液不合格指标为稀土组分镧铈不合格和非稀土杂质Na2O超标;镧铈液不合格指标为稀土组分镧铈不合格;氯化镨液不合格指标为稀土杂质 La2O3、CeO2、Nd2O3超标;氯化钕液不合格指标为稀土杂质La2O3、 Pr6O11超标;镨钕液不合格指标为稀土杂质Pr6O11、Nd2O3不合格。存在不合格的主要原因为非皂化工段处于试车阶段,控制技术指标需不断优化以及操作稳定性需不断提高,高纯产品中其他稀土杂质超标的主要原因是萃取工艺控制不当,相邻或性质相近的稀土元素分离系数相近,工艺技术参数调整不及时会导致在萃取分离和除杂时稀土杂质容易不断富集,对于高纯产品来说,稀土杂质未检出最好,其含量越低,质量就越有保证。富铈液、镧铈液、镨钕液稀土组分不合格的主要原因受生产工艺影响,在萃取稀土过程中,温度、酸度、流量等条件稍微控制不当,容易使产品配分引起波动。产品中非稀土杂质超标的主要原因是201
产品质量状况分析报告
产品质量状况分析报告 篇一:产品质量状况分析报告 无锡市宏杰电器配件厂 HJ-D-PZ-059A ------管理评审输入汇报资料部门:品质部 主题:产品质量控制 标题:2011年1月-20XX年2月产品质量状况分析报告 产品质量状况分析报告 质量是企业的生命,是企业的生存,为了实现企业的转型,提高企业的竞争能力,2010年年初我司引入新的更高标准的质量管理体系—TS-16949。体系推行之初,我司通过加强内部管理、事先预防、持续改进等一系列措施来提高产品质量。截止20XX年2月底,全面完成了公司下达的各项指标。在顾客投诉方面,年初接到一起不合格产品的信息,通过我们的售后服务,及时得到了解决,顾客比较满意。 从原辅材料的入厂到成品出厂都严格按体系标准执行,在各工序之间制定了质量控制标准。确定了监督人员,对特殊过程的人员及设备进行了严格的检定,对过程加强了信息反馈机制,使各个过程持续受控进行。
自从执行了TS-16949质量管理体系以来,我公司的产品受到了顾客的一致好评,未发生过一次严重质量事故,而且比体系执行以前产品质量更加稳定,各项指标均有很大改观。从2011年1月至20XX年2月总体产品质量情况如下: 各部门质量目标实现结果: 1、采购部:物资供货及时率100% 2、仓储部:交货及时准确率100% 3、品质部:出厂产品合格率 100% 顾客满意度>85分 产品质量与前年同期相比,产品交付合格率有了明显提高,充分证明了我公司的质量水平上了一个新的台阶。但过程检测合格率仍有待进一步提高,拟再增加两名检验人员,加强过程检测。 通过对供方的调查,我们对供方的生产能力和产品质量保证能力有了较感性的认识。有助于我们选择优秀的合作伙伴,为延续监控合格供方的供货业绩,我们设计了《合格供方年度质量评价表》,每月统计各合格供应商的供货数量和供货质量。有效监控了原物料的及时性和合格率。2011.1-20XX.2物料供货及时率均为100%。前年在供货能力和质量保证能力,通过比较各部门的综合评定,最终确定、保留了比较好的合格供方,比如苏州禾昌、宁波华彩等。
2019年药品质量分析报告模板
药品质量分析报告模板 药品质量分析报告模板写的是什么内容?那么,药品质量分析报告模板怎么写,你知道怎么写吗?如果不知道,就一起看看整理的内容吧! 关于我省中药材产业建设情况的初步调研报告 省局中药办——杨智海毛省侠张宏斌 8月中下旬,省政协副主席冯月菊带领部分省政协委员,会同省 食品药品监督管理局、省中医药管理局,就我省基层中医药服务能力建设情况先后深入略阳、城固、佛坪、汉滨、紫阳、白河等6县(区),实地查看了市县中医医院、乡镇卫生院、村卫生室、中药产业基地、中成药制药企业等20余家单位,召开了3次座谈会。 我局中药办、市场处在杨智海副巡视员的带领下,积极参与、协助政协完成了调研任务,并借此机会,对我省中药材种植养殖、产地初加工和流通、使用环节的现状和存在问题进行了初步调研。现就有关中药材产业初步调研情况报告如下: 一、基本情况 (一)中药材资源分布和GAP种植情况 我省野生中药材资源丰富,全国364个重点中药材品种中,我省涵盖283种,成商品规模的优势中药材品种约60种。尤其位于长江、黄河两大水系之间的秦岭、巴山山区,被誉为“地球同一纬度生态环境最好的区域”,形成植物南北共生的特点和生物种群的多样性,
素有“生物资源宝库”、“天然物种基因库”之称。据统计,我省的天麻、杜仲、山茱萸、葛根、丹参、柴胡、黄芩、黄芪、延胡索、甘草、沙苑子、连翘、西洋参、金银花等品种无论在数量上还是在品质上都在全国处于优势地位,出产的柴胡、沙苑子、延胡索、天麻、杜仲等药材市场占有率达50%~80%。 我省GAP种植面积较大,主要分布在汉中、安康、商洛、宝鸡、榆林、延安、渭南等7个地区。全省现有中药材种植基地22家,绞股蓝、丹参、天麻、山茱萸、黄连、玄参6个品种通过国家中药材规范化种植(GAP)认证。(全国通过中药材认证的品种有20多个) (二)中药材专业市场情况 中药材销售是中药材产业的下游产业,是中药材产业价值的最终体现。这一环节由批发和零售部门进行,实现最终消费。这其中还包括流通和进出口等方面。 西安万寿路 中药材市场是全国十七个中药材专业批发市场之一,是西北地区最大的中药材集散地,共有经营户600余家,经营中药材品种500余种,市场年经营额过2亿元,主要销往省内及周边地区。万寿路中药材市场在全国十七个中药材专业批发市场中属于规模较小的。 (三)中药生产企业基本情况 截止到201x年7月,我省共有药品生产企业218家,其中中药饮片生产企业33家(中成药生产企业集团内部5家,经营批发企业集团内部4家)。我省年销售额超过5000万元的中药饮片生产企业有3
