(全国版)2019版高考化学一轮复习第9章电化学基础第1节原电池化学电源限时规范特训

第1节原电池化学电源
板块三限时规范特训
时间:45分钟满分:100分
一、选择题(每题8分,共72分)
1.下列电池工作时,O2在正极放电的是( )
答案 B
解析氢燃料电池中,负极上H2放电,正极上O2放电,A、C、D中均不存在O2放电,故选B。
2.按如图所示进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.装置甲、乙中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e-===Zn2+
答案 B
解析甲中发生的反应为Zn+H2SO4===ZnSO4+H2↑,锌片表面产生气泡;乙中铜、锌接触放入稀硫酸中形成原电池,Cu作正极,电极反应式为2H++2e-===H2↑,铜片表面产生气泡,A正确。乙中化学能转化为电能,但甲中未形成原电池,无化学能与电能的转化,B错误。乙中锌、铜之间用导线连接电流计,形成原电池,Zn作负极,Cu作正极,导线中有电流产生,电流计指针发生偏转,C正确。乙中Zn作负极,发生氧化反应,电极反应式为Zn-2e-===Zn2+,D正确。
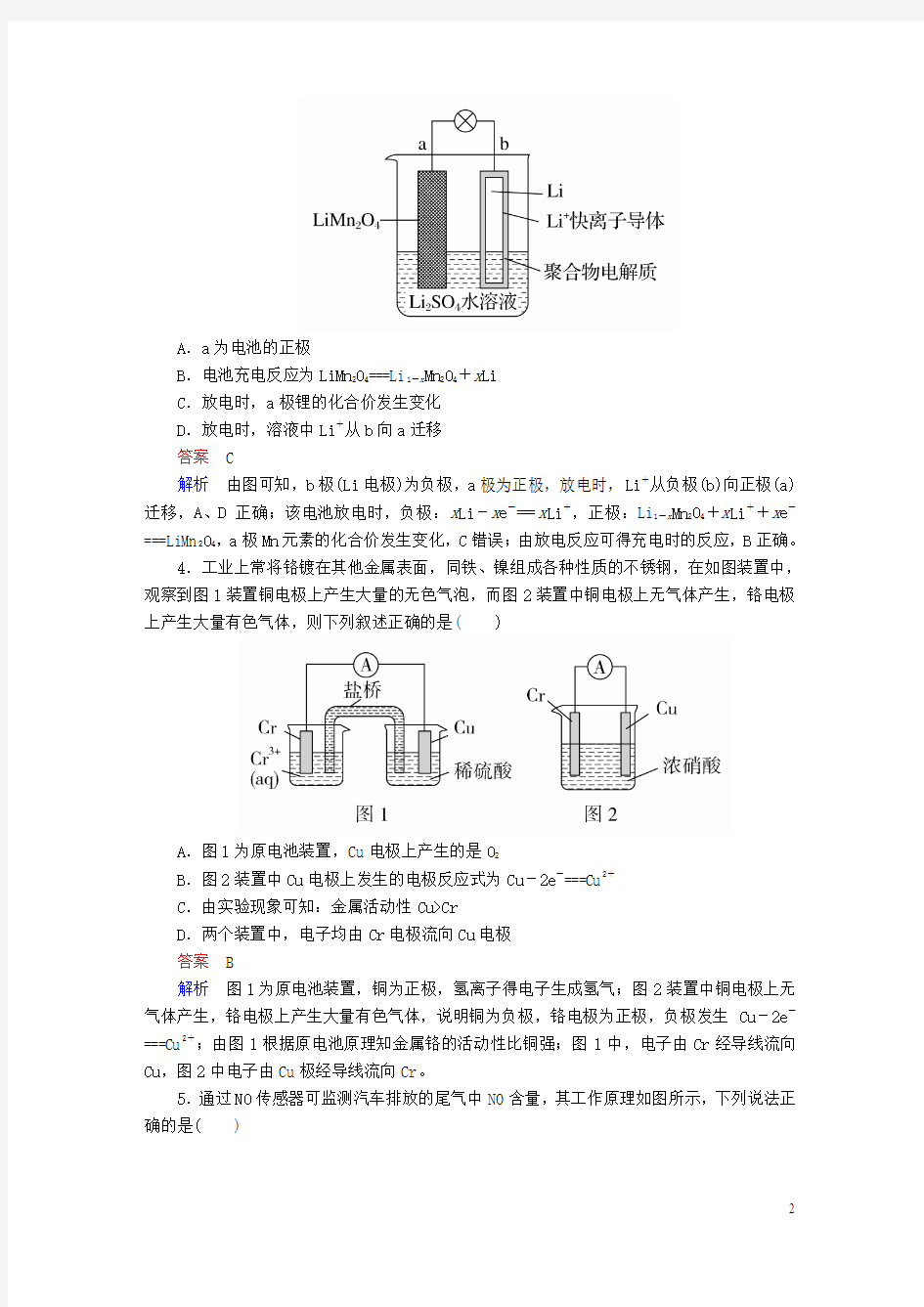
3.如图所示是一个水溶液锂离子电池体系。下列叙述错误的是( )
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-x Mn2O4+x Li
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
答案 C
解析由图可知,b极(Li电极)为负极,a极为正极,放电时,Li+从负极(b)向正极(a)迁移,A、D正确;该电池放电时,负极:x Li-x e-===x Li+,正极:Li1-x Mn2O4+x Li++x e-===LiMn2O4,a极Mn元素的化合价发生变化,C错误;由放电反应可得充电时的反应,B正确。
4.工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在如图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
答案 B
解析图1为原电池装置,铜为正极,氢离子得电子生成氢气;图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明铜为负极,铬电极为正极,负极发生Cu-2e-===Cu2+;由图1根据原电池原理知金属铬的活动性比铜强;图1中,电子由Cr经导线流向Cu,图2中电子由Cu极经导线流向Cr。
5.通过NO传感器可监测汽车排放的尾气中NO含量,其工作原理如图所示,下列说法正确的是( )
A.O2-向正极移动
B.负极的电极反应式为NO-2e-+O2-===NO2
C.O2的电极反应产物是H2O
D.反应消耗的NO与O2的物质的量之比为1∶2
答案 B
解析根据工作原理图知,Pt电极上氧气得电子发生还原反应,作正极,NiO电极上NO 失电子发生氧化反应,则NiO为负极;正极上电极反应式为O2+4e-===2O2-,负极上电极反应式为NO-2e-+O2-===NO2。由图可知O2-移向NiO电极,即向负极移动,故A错误;NiO电极上NO失电子和O2-反应生成二氧化氮,所以电极反应式为NO+O2--2e-===NO2,故B正确;正极上电极反应式为O2+4e-===2O2-,故C错误;反应消耗的NO与O2的物质的量之比为2∶1,故D错误。
6.据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是( )
A.该电池的负极反应为BH-4+8OH--8e-===BO-2+6H2O
B.电池放电时Na+从b极区移向a极区
C.每消耗3 mol H2O2,转移的电子为3 mol
D.电极a采用MnO2作电极材料
答案 A
解析电池总反应为BH-4+4H2O2===BO-2+6H2O,正极反应为H2O2+2e-===2OH-,总反应减去正极反应即可得到负极反应,A正确;在电池中电极a为负极,电极b为正极,在电池放电过程中阳离子向正极移动,B错误;通过正极反应方程式可知,每消耗3 mol H2O2转移电
