高考化学平衡练习题(难)

化学平衡练习题
一、化学反应速率
1、向绝热恒容密闭器中通入SO 2和NO2,一定条件下使反应SO2
(g)+NO 2(g)SO3(g)+NO(g)达到平衡,正反应速率随
时间变化的示意图如下所示。由图可得出的正确结论是
( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a—b段小于b—c段
2、向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反
应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物
质的量浓度随时间变化的曲线.根据以上信息,下列说法正确的
是()
A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L
?min
B.根据上图可求得方程式中a:b=1:3
C.推测在第7min时曲线变化的原因可能是升温
D.推测在第13min时曲线变化的原因可能是降温
3、某恒温密闭容器发生可逆反应:Z(?)+W(?)X(g)+Y(?)△H,在t 1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是()
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t 1~t 2时间段与t 3时刻后的X
浓度不相等
D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
4、(14分)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO 4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaSO 4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)应Ⅰ能自发进行的条件是。
⑵对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
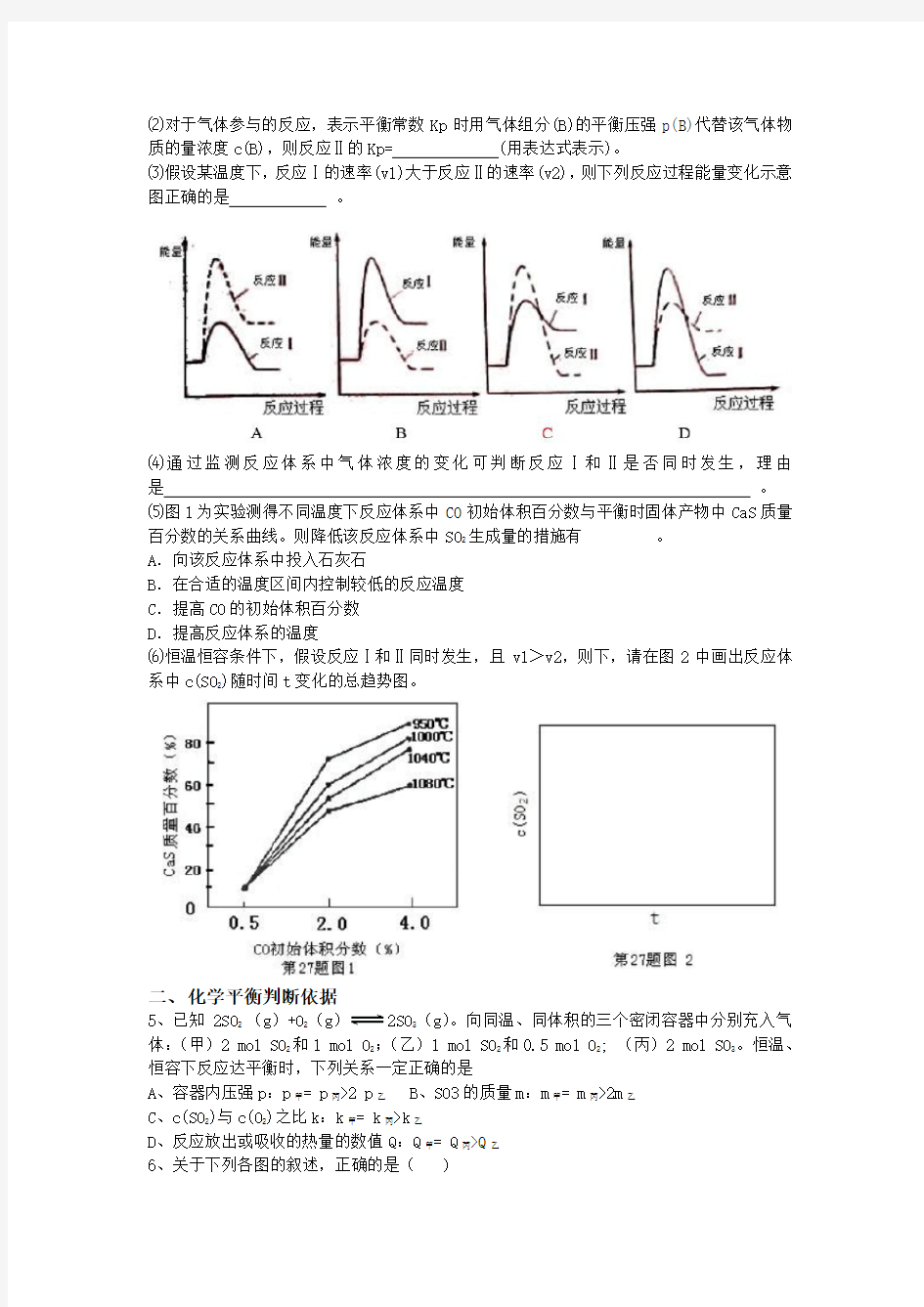
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是。
⑷通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是。
⑸图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
⑹恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,则下,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
二、化学平衡判断依据
5、已知 2SO 2 (g)+O2(g)2SO3(g)。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2; (丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A、容器内压强p:p甲= p丙>2 p乙
B、SO3的质量m:m甲= m丙>2m乙
C、c(SO2)与c(O2)之比k:k甲= k丙>k乙
D、反应放出或吸收的热量的数值Q:Q甲= Q丙>Q乙
6、关于下列各图的叙述,正确的是()
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj?mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
三、化学平衡移动
7、在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2 下X的物质
的量浓度c(X)随时间t变化的曲线如题7图所示,下列叙述正确的是( )
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
8、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO 4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是()
选项x y
A温度容器内混合气体的密度
B CO的物质的量CO2与CO的物质的量之比
C SO2的浓度平衡常数K
D MgSO4的质量(忽略体积)CO的转化率
A.A B.B C.C D.D
9、反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是()
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
10、(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)?H=—92.4kJ?mol ̄1
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)步骤II中制氯气原理如下:
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是。
a.升高温度
b.增大水蒸气浓度
c.加入催化剂
d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到 1.18mol CO、CO2和H2的混合气体,则CO转化率为。
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),简述本流程中提高合成氨原料总转化率的方法:
。
11、二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响
________________________________________________________________________。
(3)有研究者在催化剂(含CuZnAlO和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是
_________________________________________________。
(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池
(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________
_____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
12、捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH 3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH 3(l)+H2O(l)+CO2(g)(NH4)2HCO3(aq)△H2
反应Ⅲ:(NH 4)2CO3(aq)+H2O(l)+CO2(g)2(NH4)2HCO3(aq)△H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3=______.
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①△H3______0(填>、=或<).
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是______.
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度上升到T2,并维持该温度.请在图中画出t1时刻后溶液的pH变化总趋势曲线.
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有______(写出2个).
(4)下列物质中也可能作为CO2捕获剂的是______.
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.
13、化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应 TaS 2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,
向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),
I2(g)的平衡转化率为
(2)如图所示,反应(I)在石英真空管中进行,
先在温度为T2的一端放入未提纯的TaS2粉末和
少量I2(g),一段时间后,在温度为T1的一端
得到了纯净的TaS2晶体,则温度
T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是。(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为,滴定反应的离子方程式为
(4)25℃时,H2SO 3HSO3-+H+的电离常数Ka=1×10-2
mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将(填“增大”“减小”或“不变”)。
高中化学平衡图像专题Word版
化学平衡图像专题 基础知识: 对于反应mA(g) + nB(g) pC(g)+qD(g) △H<0 m+n>p+q 条件改变变化结果 K变化平衡移动反应A的浓度C(A)A转化率C的含量条件改变ν逆ν正变 化 1C(A)增大 2C(A)减小 3C(C)增大 4C(C)减小 5温度升高 6温度降低 7压强增大 8压强减小 9加催化剂 课时探究 探究一、图像绘制,读图解题 例题1:氨气有广泛用途,工业上利用反应3H2(g)+ N2(g)2NH3(g) 来合成 氨气;某小组为了探究外界条件对反应的影响,在a b两种条件下分别加入相同浓度 时间t/min02468 条件a c(H2)/10-2mol·L-1 2.00 1.50 1.100.800.80 条件b c(H2)/10-2mol·L-1 2.00 1.30 1.00 1.00 1.00 12 1 T2 下同),△H 0,根据表格数据请在下面画出c(H2)-t图: (2)a条件下,0~4min的反应速率为;平衡时,H2的转化率为 ; 平衡常数为; (3)在a条件下,8min末将容器体积压缩至原来的1/2,11min后达到新的平衡,画出 8min~12min时刻c(H2)的变化曲线。
探究二、图像解题方法 1、反应mA(g) + nB(g) pC(g)+qD(g) △H <0 m+n>p+q 反应速率和时间图如图所示 ,t 1时刻只改变一个影响因素 ①图1所示 ,t 1 时刻改变的因素是 ,平衡向 方向移动, ②图2所示, t 1 时刻改变的因素是 ,平衡向 方向移动, ③图3所示, t 1 时刻改变的因素是 ,平衡向 方向移动, ④图4所示 ,t 1 时刻改变的因素是 ,平衡向 方向移动, ⑤图5所示, t 1 时刻改变的因素是 ,平衡向 方向移动, 2、①对于反应mA(g)+nB(g) pC(g),右图所示, 请判断温度大小:T 1 T 2,△H 0 ②对于反应mA(g)+nB(g) pC(g),右图所示, 请判断温度大小:T 1 T 2,△H 0 P 1 P 2, m+n p 探究三、陌生图像的解题技能 1、解决的问题是什么?从图像可以得到什么信息?该信息与所学知识的关联?能用关联解决问题? △H 0 mA(g)+nB(g) pC(g) ①y 是A 的浓度,△H 0,m+n p ②y 是C 的含量, △H 0,m+n p
高考化学选择题--经典电离平衡
征服高考化学选择题之八:经典电离平衡题 1、盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是 A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH- B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 2、向三份0.1mol,L CH3COONa溶液中分别加入少量NH4NO 3、Na2SO3、FeCl2溶液(忽略溶液体积变化),则CH3COO-浓度的变化依次为 A.减小、增大、减小 B.增大、减小、减小 C.减小、增大、增大 D.增大、减小、增大 3、实验室现有3种酸碱指示剂,其pH变色范围如下 甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂 4、已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是 A.c(OH)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+) C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+) 5、下列叙述正确的是 A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 () () c c 32 OH NH H O g增大 6、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
高考化学平衡试题目
00-08年高考化学平衡试题 总题数:49 题 第1题(2000年普通高等学校春季招生考试化学京皖卷(旧课程))题目 20.在一定温度下,反应A2(气)+B2(气) 2AB(气)达到平衡的标志是( ) A.单位时间生成n mol的A2同时生成n mol的AB B.容器内的总压不随时间变化 C.单位时间生成2a mol的AB同时生成n mol的B2 D.单位时间生成n mol的A2同时生成n mol的B2 答案 C 第2题(2000年普通高等学校夏季招生考试化学上海卷)题目 19.对于反应2SO2+O2 2SO3,下列判断正确的是() A.2体积SO2和足量O2反应,必定生成2体积SO3 B.其他条件不变,增大压强,平衡必定向右移动 C.平衡时,SO2消耗速度必定等于O2生成速度的两倍 D.平衡时,SO2浓度必定等于O2浓度的两倍 答案 BC 第3题(2000年普通高等学校夏季招生考试化学全国卷(旧课程))题目 13.在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则() A.平衡向正反应方向移动了 B.物质A的转化率减少了 C.物质B的质量分数增加了 D.a>b 答案 AC 第4题(2001年普通高等学校夏季招生考试化学广东、河南卷(旧课程))题目 13.反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断:() A.上述反应是放热反应 B.上述反应是吸热反应 C.a>b D.a<b 答案 BD 第5题(2002年普通高等学校夏季招生考试理综天津、山西、江西卷(新课程))题目 10.对已达化学平衡的下列反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是() A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动 答案 C 第6题(2002年普通高等学校夏季招生考试化学广东广西卷(旧课程))题目 11.在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应: X (g)+2Y(g) 2Z(g),此反应达到平衡的标志是()
高考化学知识点归纳化学平衡及其他知识总结
化学平衡及其他知识总结 化学平衡(化学反应进行的程度) ——化学平衡研究的对象是可逆反应,不可逆反应不存在程度问题 ——化学平衡主要是研究可逆反应的规律,如反应进行的程度以及各种条件对反应进行情况的影响等 化学平衡状态 在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组成成分的含量保持不变的状态 ——当一个可逆反应在一定条件下处于化学平衡状态时,我们就说这个反应达到了化学平衡 ——化学平衡状态的建立与反应途径无关,从正反应或逆反应开始都可以建立(等效平衡) 化学平衡的特征:(三大特征)亦可称为化学平衡状态的标志 “动”:V 正=V 逆≠0,动态平衡(简称“等”) “定”:外界条件一定,各组分百分含量一定(浓度不再改变)(简称“定”) “变”:外界条件改变,平衡被破坏,发生移动而建立新平衡(化学平衡移动) 化学平衡移动:原因——反应条件改变引起V 正≠V 逆 结果——速率、各组分百分含量与原平衡比较均发生变化 方向:V 正>V 逆 向右移动;V 正<V 逆,向左;V 正=V 逆,原平衡不移动 影响化学平衡移动的条件 浓度:增大反应物(或减小生成物)浓度,化学平衡正向移动。反之亦然。 压强:增大(或减小)压强,平衡向气体体积缩小(或扩大)的方向移动 温度:升高(或降低)温度,平衡向吸热(或放热)反应方向移动。 ——催化剂对化学平衡状态无影响 分析化学平衡移动的一般思路(所有的平衡问题都是由速率问题解释的) 勒沙特列原理(平衡移动原理) 如果改变影响平衡的一个条件(如浓度、压强、温度),化学平衡就会向着能够减弱这种改变的方向移动。(不能改变这种改变) ——勒沙特列原理(亦称平衡移动原理)适合于一切平衡体系。 化学平衡:2NO 2 N 2O 4 电离平衡:NH 3·H 2O NH 4+ +OH — 水解平衡:AlO 2- +2H 2O Al(OH)3+OH — 溶解平衡:NaCl Na ++Cl — 其 它: 平衡理论知识网络图 改变条件)( ) (:固定值因固体和纯液体浓度为改变固全或纯液体的量因浓度不变气体如容积不变时充入惰性速率不变速率改变逆 正程度相同=V V 浓度改变压强 应对气体体积无变化的反使用催化剂逆正程度不同V V 温度压强 浓度平衡不移动平衡移动溶解 结晶
化学平衡图像专题复习
专题五化学平衡图像 一、化学平衡图象常见类型 1、速度—时间图 此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向. 例1.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下, 增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的 聚集状态为() A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C.X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体 专练1:A(g)+3B(g) 2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是() A.升温 B.加压 C.增大c(A) D.降低c(C) E.降低c(A) 2、浓度—时间图 此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式 中化学计量数关系等情况. 例2.图2表示800℃时A、B、C三种气体物质的浓度随时间 的变化情况,t1是到达平衡状态的时间.试回答: (1)该反应的反应物是______; (2)反应物的转化率是______; (3)该反应的化学方程式为______. 3、含量—温度(压强)—时间图 这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征. 例3.同压、不同温度下的反应:A(g)+B(g)C(g);△HA的含量 和温度的关系如图3所示,下列结论正确的是() A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0 例4.现有可逆反应A(g)+2B(g)nC(g);△H<0,在相同温度、不同 压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是() A.p1>p2,n>3 B.p1<p2,n>3 C.p1<p2,n<3 D.p1>p2,n=3 4、恒压(温)线 该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强. 例5.对于反应2A(g)+B(g)2C(g);△H<0,下列图象正确的是()
高中化学:电离平衡练习(含答案)
高中化学:电离平衡练习(含答案) 一、单选题 1.下列说法正确的是 A.可以用FeCl3溶液和NaOH溶液反应制备Fe(OH)3胶体 B.FeCl3、FeCl2和Fe(OH)3都可以通过化合反应得到 C.40gNaOH固体溶解于500mL水中,所得溶液的物质的量浓度为2mol/L D.根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 2.现有常温下pH=2的醋酸溶液,下列有关叙述正确的是() COO-) A.c(H+)=c(CH 3 B.醋酸的物质的量浓度为0.01mol·L-1 C.与pH=12的NaOH溶液等体积混合后,溶液呈碱性 D.加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 3.在室温下,0.1mol/L100mL的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取 A.加入少量CH3COONa固体B.通入少量HCl气体 C.升高温度D.加入水 4.下列说法正确的是 A.酸碱盐都是电解质,其电离的过程属于物理变化 B.电解质是可以导电的化合物 C.在水溶液中能电离出H+的化合物都是酸
D .强电解质易溶于水导电性强,而弱电解质难溶于水导电性弱 5.已知常温时CH 3COOH 的电离平衡常数为K 。该温度下向20 mL 0.1 mol·L -1 CH 3COOH 溶液中逐滴加入0.1 mol·L -1 NaOH 溶液,其pH 变化曲线如图所示(忽略温度变化)。下列说法中错误的是( ) A .a 点表示的溶液中c(H +)等于10-3 mol·L -1 B .b 点表示的溶液中c(CH 3COO -)>c(Na +) C .c 点表示CH 3COOH 和NaOH 恰好反应完全 D .b 、d 点表示的溶液中33c CH COO c H c CH COOH -+?()()() 均等于K 6.下列说法正确的是() A .2H S 溶于水的电离方程式为22H S 2H S +-+,向2H S 溶液中加入少量2CuCl 固体,电离平衡 正向移动 B .4KHSO 在熔融状态下的电离方程式为244KHSO K H SO ++- =++,向醋酸中加入少量4 KHSO 固体,电离平衡逆向移动 C .向稀氨水中滴加少量432mol /LNH NO ,溶液,4NH +与OH -结合生成 32NH H O ?,使平衡正向移动,电离常数增大 D .常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小 7.下列属于弱电解质的是 A .BaSO 4 B .CH 3COOH C .C 2H 5OH D . Cu
化学平衡高考题(含答案)
化学平衡 1.(08年全国理综I ·11)已知:4NH 4(g)+5O 2(g) = 4NO(g)+6H 2O(g),ΔH=-1025kJ ·mol - 1 ,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正.. 确. 的是C 2.(08年全国理综II ·13)在相同温度和压强下,对反应 CO 2 ( g ) + H 2 ( g ) CO(g ) + H 2O( g ) 进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表: 物质 物质的量 ) 实验 CO 2 H 2 CO H 2O 甲 a mol a mol ^ 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 } 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol 、 a mol C . D . 1200℃ N O 含量 时间 ) N O 含量 时间 1000℃ 催化剂 1000℃ 无催化剂 N O 含量 时间 10×105Pa < A . B . N O 含量 时间 1000℃ 1200℃
上述四种情况达到平衡后, n ( CO )的大小顺序是 A A .乙=丁>丙=甲 B .乙>丁>甲>丙 C .丁>乙>丙=甲 D .丁>丙>乙>甲 3.(08年天津理综·8)对平衡CO 2(g )CO 2(aq ) .△H =·mol - 1,为增大二氧化碳 气体在水中的溶解度,应采用的方法是D A .升温增压 B .降温减压 C .升温减压 D .降温增压 ' 4.(08年山东理综·14)高温下,某反应达到平衡,平衡常数) H ()CO () O H ()CO (222c c c c K ??=。恒容 时,温度升高,H 2浓度减小。下列说法正确的是A A .该反应的焓变为正值 B .恒温恒容下,增大压强,H 2浓度一定减小 C .升高温度,逆反应速率减小 D .该反应的化学方程式为CO +H 2O CO 2+H 2 5.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: } ①NH 4I(s) NH 3(g)+HI(g);②2HI(g) H 2(g)+I 2(g) 达到平衡时,c (H 2)=·L -1,c (H I )=4mol ·L -1,则此温度下反应①的平衡常数为C A .9 B .16 C .20 D .25 6.(08年四川理综·8)在密闭容器中进行如下反应:H 2(g) +I 2(g) 2HI(g),在温度T 1和T 2时,产物的量与反应时间 的关系如下图所示.符合图示的正确判断是D < A .T 1>T 2,ΔH >0 B .T 1>T 2,ΔH <0 C .T 1<T 2,ΔH >0 D .T 1<T 2,ΔH <0 7.(08年广东理基·36)对于反应2SO 2(g)+O 2(g) 2SO 3(g)能增大正反应速率的措施是 催化剂 高温 T 1碘化氢的量 时 间 T 2
高考化学平衡大题训练
1.甲醇是基本有机化工原料.甲醇及其可制得产品的沸点如下. 名称甲醇二甲胺二甲基甲酰胺甲醚碳酸二甲酯 结构简式CH3OH (CH3)2NH (CH3)2NCHO CH3OCH3(CH3O)2CO 沸点(℃) 64.7 7.4 153℃﹣24.9 90℃ (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为. (2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO(CH3)2NCHO+2H2O△H若该反应 在常温下能自发进行,则△H0 (填“>”、“<”或“=“). (3)甲醇制甲醚的化学方程式为:2CH3OH CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应. 容器编号温度/℃起始物质的量/mol 平衡物质的量/mol CH3OH CH3OCH3H2O Ⅰ387 0.20 x Ⅱ387 0.40 y Ⅲ207 0.20 0.090 0.090 ①x/y=. ②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则反应将向(填“正”或“逆”)反应方向进行. ③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为. (4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示. 电源负极为(填“A”或“B“),写出阳极的电极反应式.若参加反应的O2为 1.12m 3(标 准状况),则制得碳酸二甲酯的质量为kg. 2. (16分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。 (1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1, C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1,则CO还原Fe2O3(s)的热化学方程式为。 (2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为。 (3)CO 2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。 ①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为 KⅠKⅡ(填“>、=或<”)。 ② 容器甲乙
(完整版)化学平衡图像题专题试题
化学平衡图像 一、选择题 1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( ) A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s ) B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/L C .反应开始时10s ,Y 的转化率为79.0% D .反应的化学方程式为:X(g)+ Y(g)Z(g) 2.( 广东19)合成氨工业对国民经济和社会发展具有重要的 意义。对于密闭容器中的反应:N 2(g)+3H 2(g) 2NH 3(g), 673K ,30MPa 下n(NH 3)和n(H 2)随时间变化的关系如下图所示。 下列叙述正确的是 A .点a 的正反应速率比点b 的大 B .点 c 处反应达到平衡 C .点d (t 1时刻) 和点 e (t 2时刻) 处n(N 2)不一样 D .其他条件不变,773K 下反应至t 1时刻,n(H 2)比上图中d 点的值大 3.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( ) A .正反应是放热反应 B .若A 、B 是气体,则D 是液体或固体 C .逆反应是放热反应. D .A 、B 、C 、D 均为气体 4.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( ) A .T 1>T 2,△H>0 B .T 1<T 2,△H>0 C .T 1>T 2,△H<0 D .T 1<T 2,△H<0 5.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是() A .p 1>p 2,n >3 B .p 1<p 2,n >3 C .p 1<p 2,n <3 D .p 1>p 2,n=3 6.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( ) 7.T ℃时,A 气体与B 气体反应生成C 气体。反应过程中A 、B 、C 浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T 1和T 2时,B 的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( ) A .在(t 1+10)min 时,保持其他条件不变,增大压强,平衡向逆反应方向移动 B . t 1+10)min 时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 C .T ℃时,在相同容器中,若由0.3mol·L —1 A 0.1 mol·L —1 B 和0.4 mol·L —1 C 反应,达到平衡后,C 的浓度仍为0.4 mol·L —1 D .其他条件不变,升高温度,正、逆反应速率均增大,且A 的转化率增大 8.右图表示反应N 2(g )+3H 2(g ) 2NH 3(g );ΔH =-92.2kJ/mol 。在某段时间t 0~t 6中 反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( ) A . t 0~t 1 B . t 2~t 3 C . t 3~t 4 D . t 5~t 6 n 2· · · · · a b c d e NH H 2 1
高考化学考点水的电离平衡、PH计算的核心知识(基础)
高考总复习《水的电离平衡、PH计算》的核心知识 【考纲要求】 (1)理解水的电离平衡及其影响; (2)了解水的电离及离子积常数; (3)了解溶液pH的定义。初步掌握测定溶液pH的方法,能进行pH的简单计算。 【考点梳理】 考点一、水的电离和水的离子积 【高清课堂:363382 水的电离和水的离子积】 1.水的电离方程式:在纯水或水溶液中:H2O H++OH—;△H>0 或:2H2O H3O++OH—;△H>0 2.水的离子积: 25℃c(H+)=c(OH-) =1×10-7mol/L c(H+)?c(OH-)=1×10-14=Kw 100℃c(H+)=c(OH-) =1×10-6mol/L c(H+)?c(OH-)=1×10-12=Kw 要点诠释: (1)Kw只与温度有关,温度越高Kw越大。因水的电离是吸热过程,升高温度Kw将增大。 (2)Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液。 3.影响水的电离平衡的因素:H2O H++OH— (1)、定性分析,完成下表:(注:“—”表示不变) 条件 移动方向电离程度c(H+) c(OH-) Kw 温度不变 加入HCl 逆减小增大减小—NaOH 逆减小减小增大—H2O —————CH3COONa 正增大减小增大—NH4Cl 正增大增大减小—NaCl —————Na 正增大减小增大— 升温加热正增大增大增大增大 要点诠释: ①温度:水的电离过程是吸热过程,所以升高温度能促进电离,据此,降温时K W减小,升温时K W增大。但不论温度升高或降低,纯液态水中c (H+)和c (OH―)都相等。实验测得25℃时K W约为10―14,100℃时K W约为10―12。 ②外加酸、碱:向纯水中加入酸或碱,可以增大水中的H+或OH―浓度,均可使水的电离平衡向逆反应方向移动(抑制水的电离)。 ③加入能水解的盐:水的电离程度增大,若盐水解呈酸性,c (H+)>c (OH―);若盐水解呈碱性,c (H+)<c (OH―),但溶液中K W不变。 (2)、定量分析,完成下表:计算酸碱盐溶液中c(H+)溶液、c(OH-)溶液、c(H+)水、c(OH-)水
化学平衡高考题(含答案)
化学平衡 1.(08年全国理综I ·11)已知:4NH 4(g)+5O 2(g) = 4NO(g)+6H 2O(g),ΔH=-1025kJ ·mol -1 ,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不. 正确.. 的是C 2.(08年全国理综II ·13)在相同温度和压强下,对反应 CO 2 ( g ) + H 2 ( g ) CO(g ) + H 2O( g )进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下 表: 上述四种情况达到平衡后, n ( CO )的大小顺序是 A A .乙=丁>丙=甲 B .乙>丁>甲>丙 物质 物质的量 实验 CO 2 H 2 CO H 2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol C . D . 1200℃ N O 含量 时间 1000℃ N O 含量 时间 1000℃ 催化剂 1000℃ 无催化剂 N O 含量 时间 10×105Pa 1×105Pa A . B . N O 含量 时间 1000℃ 1200℃
C .丁>乙>丙=甲 D .丁>丙>乙>甲 3.(08年天津理综·8)对平衡CO 2(g ) CO 2(aq ) .△H =-19.75kJ·mol - 1,为增大 二氧化碳气体在水中的溶解度,应采用的方法是D A .升温增压 B .降温减压 C .升温减压 D .降温增压 4.(08年山东理综·14)高温下,某反应达到平衡,平衡常数) H ()CO () O H ()CO (222c c c c K ??=。恒容 时,温度升高,H 2浓度减小。下列说法正确的是A A .该反应的焓变为正值 B .恒温恒容下,增大压强,H 2浓度一定减小 C .升高温度,逆反应速率减小 D .该反应的化学方程式为CO +H 2O CO 2+H 2 5.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: ①NH 4I(s) NH 3(g)+HI(g);②2HI(g) H 2(g)+I 2(g) 达到平衡时,c (H 2)=0.5mo l ·L -1,c (H I )=4mo l ·L -1,则此温度下反应①的平衡常数为C A .9 B .16 C .20 D .25 6.(08年四川理综·8)在密闭容器中进行如下反应:H 2(g) +I 2(g) 2HI(g),在温度T 1和T 2时,产物的量与反应时 间的关系如下图所示.符合图示的正确判断是D A .T 1>T 2,ΔH >0 B .T 1>T 2,ΔH <0 C .T 1<T 2,ΔH >0 D .T 1<T 2,ΔH <0 7.(08年广东理基·36)对于反应2SO 2(g)+O 2(g) 2SO 3(g)能增大正反应速率的措施是 A .通入大量O 2 B .增大容器容积 C .移去部分SO 3 D .降低体系温度 8.(08年广东化学·8)将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应H 2(g )+Br 2(g) 2HBr (g )△H <0,平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。a 与b 的关系是A 催化剂 高温 T 1碘化氢的量 时 间 T 2
备战高考化学化学反应速率与化学平衡(大题培优)含详细答案
备战高考化学化学反应速率与化学平衡(大题培优)含详细答案 一、化学反应速率与化学平衡 1.某化学兴趣小组欲测定KClO 3,溶液与3NaHSO 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO 3,溶液和310mL0.3mol /LNaHSO 溶液,所得数据如图所示。已知: 2334ClO 3HSO Cl 3SO 3H ----++=++。 (1)根据实验数据可知,该反应在0~4min 内的平均反应速率 ()Cl v -=________()mol /L min ?。 (2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。 方案 假设 实验操作 Ⅰ 该反应放热使溶液温度升高,反应速率加快 向烧杯中加入10mL0.1mo//L 的3KClO 溶液和10mL0.3mol/L 的 3NaHSO 溶液, Ⅱ 取10mL0.1mo/L 的3KClO 溶液加入烧杯中,向其中加入少量NaCl 固体,再加入10mL0.3mol/L 的3NaHSO 溶液 Ⅲ 溶液酸性增强加快了化学反应速率 分别向a 、b 两只烧杯中加入10mL0.1mol/L 的3KClO 溶液;向烧杯a 中加入1mL 水,向烧杯b 中加入1mL0.2mol/L 的盐酸;再分别向两只烧杯中加入10mL0.3mol/L 的3NaHSO 溶液 ①补全方案Ⅰ中的实验操作:________。 ②方案Ⅱ中的假设为________。 ③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。 ④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。 ⑤反应后期,化学反应速率变慢的原因是________。
高中化学09化学平衡图像专题
一、几大影响因素对应的基本v-t图像 1.浓度 当其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。 改变浓度对反应速率及平衡的影响曲线: 2.温度。 在其他条件不变的情况下,升高温度,化学平衡向着吸热的方向进行;降低温度,化学平衡向着放热的方向进行。 化学平衡图像专题知识梳理
由曲线可知:当升高温度时,υ正和υ逆均增大,但吸热方向的速率增大的倍数要大于放热方向的速率增大的倍数,即υ吸>υ放,故化学平衡向着吸热的方向移动;当降低温度时,υ正和υ逆 <υ放,故化学平降低,但吸热方向的速率降低的倍数要大于放热方向的速率降低的倍数,即υ 吸 衡向着放热的方向移动。 3.压强 对于有气体参加且方程式左右两边气体物质的量不等的反应来说,在其他条件不变的情况下,增大压强,平衡向着气体物质的量减小的方向移动;减小压强,平衡向着气体物质的量增大的方向移动。 改变压强对反应速率及平衡的影响曲线[举例反应:mA(g)+n(B)p(C),m+n>p] 由曲线可知,当增大压强后,υ正和υ逆均增大,但气体物质的量减小的方向的速率增大的 倍数大于气体物质的量增大的方向的速率增大的倍数(对于上述举例反应来说,即'υ正增大的倍 数大于'υ逆增大的倍数),故化学平衡向着气体物质的量减小的方向移动;当减小压强后,υ正和υ 均减小,但气体物质的量减小的方向的速率减小的倍数大于气体物质的量增大的方向的速率逆 减小的倍数(对于上述举例反应来说,即'υ正减小的倍数大于'υ逆减小的倍数),故化学平衡向着气体物质的量增大的方向移动。 【注意】对于左右两边气体物质的量不等的气体反应来说: *若容器恒温恒容,则向容器中充入与反应无关的气体(如稀有气体等),虽然容器中的总压强增大了,但实际上反应物的浓度没有改变(或者说:与反应有关的气体总压强没有改变),故无论是反应速率还是化学平衡均不改变。 *若容器恒温恒压,则向容器中充入与反应无关的气体(如稀有气体等),为了保持压强一定,容器的体积一定增大,从而降低了反应物的浓度(或者说:相当于减小了与反应有关的气体压强),故靴和她均减小,且化学平衡是向着气体物质的量增大的方向移动。
高中化学电离平衡九大知识点
高中化学电离平衡九大知识点 一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。 非电解质:在水溶液中或熔化状态下都不能导电的化合物。 强电解质:在水溶液里全部电离成离子的电解质。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物非电解质——共价化合物 注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。 3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。 4、影响电离平衡的因素: A、温度:电离一般吸热,升温有利于电离。 B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。 C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。 D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 5、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主) 6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。) 表示方法:ABA++B- Ki=[ A+][B-]/[AB] 7、影响因素: a、电离常数的大小主要由物质的本性决定。 b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO 二、水的电离和溶液的酸碱性 1、水电离平衡: 水的离子积:KW= c[H+]·c[OH-] 25℃时,[H+]=[OH-] =10-7 mol/L ; KW= [H+]·[OH-] = 1*10-14 注意:KW只与温度有关,温度一定,则KW值一定 KW不仅适用于纯水,适用于任何溶液(酸、碱、盐) 2、水电离特点:(1)可逆(2)吸热(3)极弱 3、影响水电离平衡的外界因素: ①酸、碱:抑制水的电离 KW〈1*10-14 ②温度:促进水的电离(水的电离是吸热的) ③易水解的盐:促进水的电离 KW 〉1*10-14 4、溶液的酸碱性和pH: (1)pH=-lgc[H+] (2)pH的测定方法:
高考化学平衡移动练习题含答案
高考化学平衡移动练习 题含答案 TPMK standardization office【 TPMK5AB- TPMK08-
化学平衡移动专题练习 1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是() A.反应混和物的浓度B.反应物的转化率 C.正、逆反应速率 D.反应混和物的压强 2.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是() A.2NO+O2 2NO2B.Br2(g)+H2 2HBr C.N2O4 2NO2 D.6NO+4NH3 5N 2+3H2O 3.在某温度下,反应ClF(g) + F2(g) ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是 ()A.温度不变,缩小体积,Cl F的转化率增大 B.温度不变,增大体积,Cl F3的产率提高 C.升高温度,增大体积,有利于平衡向正反应方向移动 D.降低温度,体积不变,F2的转化率降低 4.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是 ()①生成物的百分含量一定增加②生成物的产量一定增加 ③反应物转化率一定增大④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂 A.①②B.②⑤C.③⑤D.④⑥ 5.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则() A.平衡向逆反应方向移动了B.物质B的质量分数增加了C.物质A的转化率减小了D.a>b 6.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是() A.x>y B.x=y C.x<y D.不能确定 7.下列事实中,不能用列夏特列原理解释的是 ( )A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3溶液后溶液颜色变浅 B.对二氧化硫的品红溶液加热可使颜色变深 C.反应CO+NO2CO2+NO(正反应放热),升高温度可使 平衡向逆反应方向移动 D.合成氨反应N2+3H22NH3(正反应放热)中使用催化剂8.在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是 () A.升温B.降温C.减小容器体积D.增大容器体积9.在体积可变的密闭容器中,反应mA(g)+nB(s) pC (g)达到平衡后,压缩容器的体积,发现A的转化率随之降 低。下列说法中,正确的是() A.(m+n)必定小于p B.(m+n)必定大于p C.m必定小于p D.n必定大于p 10.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是 () A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡 C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大 11.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应2SO2+O2 2SO3平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物 质,平衡时SO3的物质的量可能大于n的是() A.1 mol SO2+1 mol O2+1 mol SO3 B.4 mol SO2+ 1 mol O2 C.2 mol SO2+1 mol O2+2 mol SO3 D.2 mol SO2+ 1 mol O2 12.下列说法中正确的是()A.可逆反应的特征是正反应速率和逆反应速率相等B.其他条件不变时,升高温度可使化学平衡向放热反应的方向移动 C.其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态 D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态 13.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B 气体,发生可逆反应: 2A(g)+B(g) 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为 () A.67%B.50%C.25%D.5% - 6 -
2019年高考化学专题复习:化学平衡图像专题
化学平衡图像专题 1.对反应2A(g)+2B(g)3C(g)+D(?),下列图象的描述正确的是 A. 依据图①,若t1时升高温度,则ΔH<0 B. 依据图①,若t1时增大压强,则D是固体或液体 C. 依据图②,P1>P2 D. 依据图②,物质D是固体或液体 【答案】B 2.下列图示与对应的叙述相符的是 A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化 B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液 C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 【答案】B 3.—定条件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往2L 恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
A. a 点v(正)>v(逆) B. b点反应放热53.7 kJ C. 催化剂效果最佳的反应是③ D. c点时该反应的平衡常数K=4/3(mol-2.L-2) 【答案】A 4.如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是 A. 正反应是放热反应 B. A、B一定都是气体 C. D一定不是气体 D. C可能是气体 【答案】B 5.下图是恒温下H 2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是 A. 升高温度 B. 增大压强 C. 增大反应物浓度 D. 加入催化剂
高考化学弱电解质的电离平衡
第23讲弱电解质的电离平衡 基础题组 1.(2018陕西西安模拟)下列事实一定能证明HNO2是弱电解质的是() ①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④常温下0.1 mol·L-1 HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8 A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部 2.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是() A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸
3.常温下1 mol·L-1的氨水加水稀释时,下列选项中随着加水量的增加而减小的是() A.c(OH-) B.NH3·H2O电离程度 C.n(H+) D.K W 4.室温下,关于pH=1的醋酸溶液,下列说法正确的是() A.溶液中c(H+)比pH=1的盐酸小 B.1 L该醋酸溶液与足量的Fe粉完全反应,生成0.05 mol H2 C.若将10 mL该醋酸溶液加水稀释至100 mL,溶液pH=2 D.与0.1 mol/L的NaOH溶液完全反应所需溶液体积:V(NaOH溶液)>V(醋酸溶液) 5.(2017湖南三市联考)常温下0.1 mol·L-1醋酸溶液的pH=a,下列措施能使溶液pH=(a+1)的是() A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体 C.加入等体积0.2 mol·L-1盐酸 D.升高溶液的温度 6.室温下,向0.01 mol·L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如下图所示。下列分析正确的是()
