2012届北京市昌平区高三二模化学试题(WORD精校版)

2012昌平区高三二模理综化学试卷
6.下列说法不.正确的是
A.人体缺碘易引起甲状腺肿大
B.我国应禁止使用食品添加剂
C.肥皂是油脂在碱性条件下水解得到的
D.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好
7.下列说法中正确的是
A.向沸水中滴加FeCl3饱和溶液有红褐色沉淀产生
B.制备AlCl3、CuCl2均可以采用将溶液直接蒸干的方法
C.在Ca(OH)2饱和溶液中持续通入CO2,始终不会有沉淀析出
D.向AgCl浊液中滴加适量KI溶液,白色沉淀可转化为黄色沉淀
8.已知:
①向KMnO4晶体滴加浓盐酸,产生某黄绿色气体:
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是
A.①中产生气体的电子式是Cl:Cl
B.上述实验中,共有两个氧化还原反应
C.实验②中FeCl2被氧化
D.实验③发生的是同主族元素单质间的置换反应
9.下列说法中正确的是
A.除去甲苯中混有的苯酚,可先加入NaOH溶液,再进行过滤
B.对苯二甲酸和1,4-丁二醇作用形成的聚合物的链节中只含有一个苯环C.制作豆腐及淀粉水解均与蛋白质变性有关
D.蔗糖及其水解产物均可发生银镜反应
10.下列实验操作与预期实验目的或所得实验结论一致的是
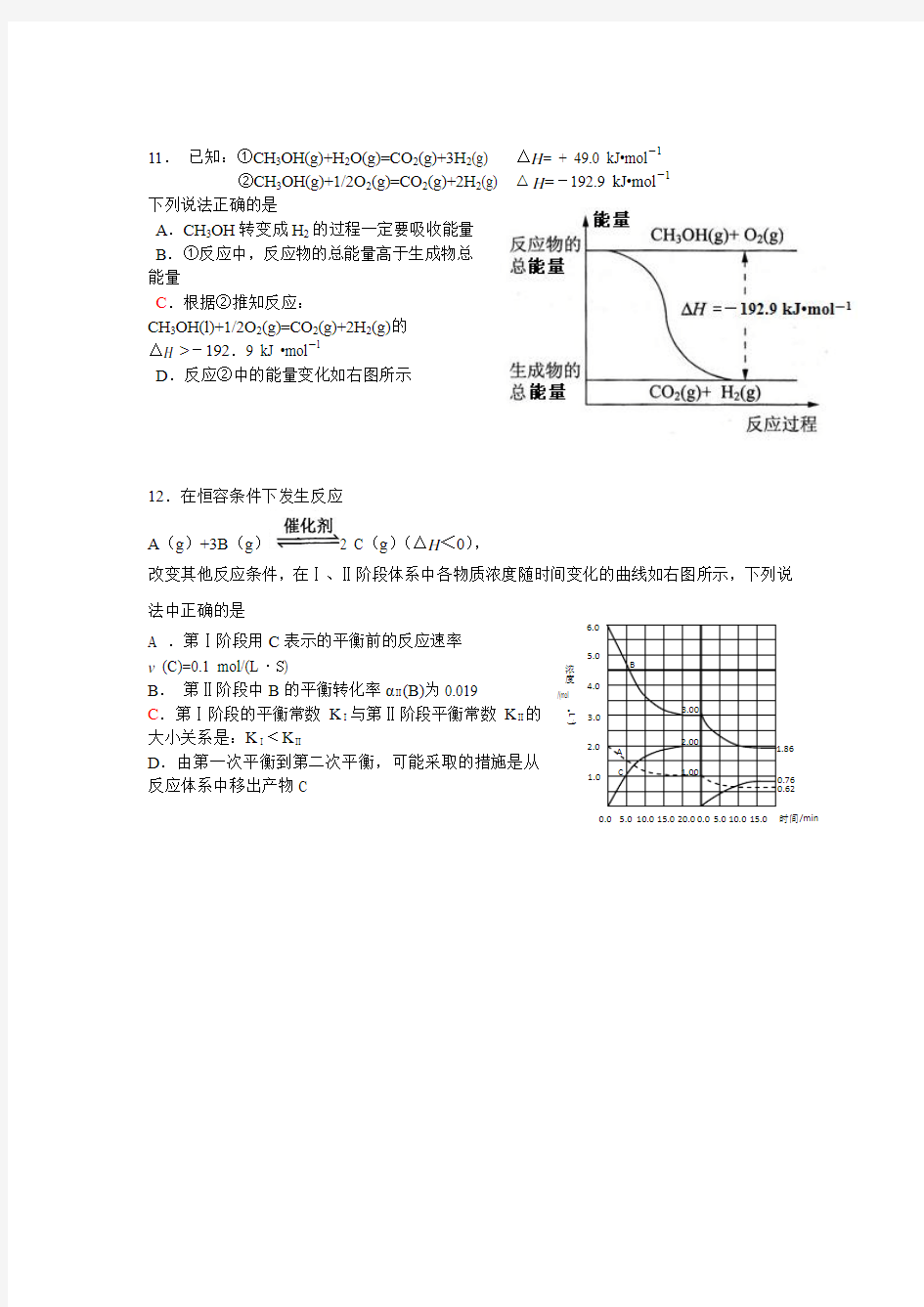
11. 已知:①CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g) △H = + 49.0 kJ?mol -
1
②CH 3OH(g)+1/2O 2(g)=CO 2(g)+2H 2(g) △H =-192.9 kJ?mol -
1 下列说法正确的是 A .CH 3OH 转变成H 2的过程一定要吸收能量 B .①反应中,反应物的总能量高于生成物总能量
C .根据②推知反应:
CH 3OH(l)+1/2O 2(g)=CO 2(g)+2H 2(g)的
△H >-192.9 kJ ?mol -
1
D .反应②中的能量变化如右图所示
12.在恒容条件下发生反应 A (g )+3B (g )
2 C (g )(△H <0),
改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如右图所示,下列说法中正确的是
A .第Ⅰ阶段用C 表示的平衡前的反应速率
v (C)=0.1 mol/(L ·S )
B . 第Ⅱ阶段中B 的平衡转化率αⅡ(B)为0.019
C .第Ⅰ阶段的平衡常数K Ⅰ与第Ⅱ阶段平衡常数K Ⅱ的大小关系是:K Ⅰ﹤K Ⅱ
D .由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
0.0 5.0 10.0 15.0 20.0 0.0 5.0 10.0 15.0 时间/min
1.0
2.0
3.0
4.0
5.0
6.0
浓度/(mol ·L -1
)
A C
1.00
0.62
0.76 2.00 3.00 B
1.86
25.(12分)化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料。
X原子的最外层电子数比次外层电子数少5,Y元素是空气中含量最高的元素。
(1)X的原子结构示意图是,甲的化学式是
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为。(3)1mol X单质与Fe2O3反应,放出414.21 KJ热量,该反应的热化学反应方程式是。(4)利用以X为阳极,在H2SO4溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式。
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子。乙在微生物作用下可与O2发生反应,当有1 mol 乙参加反应时,电子转移6 mol,该反应的化学方程式是。
26.(14分)某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。实验室用下图模拟工艺流程,利用常用的酸、碱和废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
(1)甲的化学式是,乙的化学式是,G 的化学式是。(2)过程Ⅰ中共发生了个化学反应,写出其中不.属于置换反应的离子
..方程式。(3)过程Ⅰ、Ⅱ、Ⅲ、Ⅳ中均进行的实验操作的名称是。
(4)过程Ⅱ中加入稀硫酸的目的是。
(5)由A生成D的实验现象是。
(6)由D生产铁红的化学方程式是。
27.(16分)某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用下图所示装置进行实验,(加热装置和夹持装置均已略去,气密性已检验,F 是用于鼓入空气的双连打气球)
实验操作及现象:
试回答:
(1)操作Ⅰ中产生气体的化学式为__________________________。 (2)操作Ⅰ的目的是 。
(3)C 中白色沉淀的化学式是 ,操作Ⅱ中当C 产生白色沉淀时立刻将B 上提的原因是 。
(4)操作 Ⅲ中装置A 产生无色气体的化学方程式是 。 (5)烧瓶E 内气体颜色逐渐加深的原因是 。 (6)操作Ⅴ现象产生的原因是(结合化学方程式说明) 。
(7)D 装置的作用是____________________________________。
28. (16分)化合物A 和浓硫酸共热只生成烃B ,红外光谱图显示D 中有两个相同的官能团。有关物质之间的转化关系如下:
已知:
(1) 核磁共振氢谱显示 A 的侧链中有两种类型的氢原子,A 的含氧官能团的名称
是 , B 的结构简式是 。
(2) ①的反应类型是 ,②的反应试剂和条件是 。 (3) 写出D 的结构简式 。
(4) A 1是与A 含有相同官能团的同分异构体,同条件下也只得到B ,写出A 1生成B 的
化学方程式 。
(5) 写出A 与E 反应生成H 的化学方程式 。 (6) I 的结构简式是 。
(7) 已知F 有多种芳香族同分异构体,其中符合下列条件的同分异构体共有 种
ⅰ能与稀硫酸及NaOH 溶液反应;ⅱ能发生银镜反应;ⅲ分子中有一个甲基。 写出其中一种的结构简式 。
2012昌平区高三二模化学试卷
′ ′ ′ + 固体碱 △ (R 、R 为烃基) R OH
RCHCH 2OR
|
OH
6.B
7.D
8.C
9.D 10.C 11.C 12.D 25.(12分,每空2分)
(1)
AlN
(2)Al 3++4OH -
===AlO 2-
+2H 2O
(3)2Al(s) + Fe 2O 3(s) === Al 2O 3(s) +2Fe(s) △H = -828.42 kJ/mol
(2分,不标明状态扣1分,△H 错误扣1分,其他合理答案给分)
(4)2Al+3H 2O-6e -
= Al 2O 3+ 6H +
(5)2NH 3+3O 2===2HNO 2+2H 2O 26.(14分,除标示外其余每空2分)
(1)Fe (1分) HNO 3 (1分) CuO (1分) (2)4(1分) 2Fe 3++Fe =3Fe 2+ (3)过滤
(4)除去过程Ⅰ中加入的过量铁粉;使Fe 2+循环利用 (5)生成白色絮状沉淀迅速变成灰绿色,最终变成红褐色
(6)
27.(16分,每空2分) (1)CO 2
(2)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气 (3)CaCO 3 防止消耗硝酸过多影响铜与硝酸的反应 (4)
(5)CO 2比空气重,从长管进入E ,并没有把E 中空气赶尽,致使部分NO 先与未赶尽的空气生成少量红棕色NO 2,当再从F 鼓入空气时,E 中有更多NO 2生成,所以红棕色加深 (6) HNO 3 3NO 2+H 2O =2HNO 3+NO(或4NO+3O 2+2H 2O=4HNO 3) (7)平衡压强,吸收NO 、NO 2、CO 2尾气,防止污染大气 28 (16分,除标示外其余每空2分)
微生物
△
2F e (O H )3=Fe 2O 3+3H 2O △
+2NO↑+4H O 3Cu+8HNO 3 ==3Cu(NO 3)2+2NO↑+4H 2O
(浅)红棕
(1)羟基(1分) ;
(1分)
(2)加成 (1分), NaOH 水溶液 加热 (1分) (3)
+H 2O
(4)
(5)
(6)
(7)7
中的1种
CH=CH 2
3
CH CH 2—OH
3 浓H 2SO 4
加热 CH=CH 2
3
C CH 2—OH C —CH 3 + CH 3 OH CH —CH 2
O
CH 3
固体碱
△ CH —CH 2—O —C —CH 3 CH 3 OH
CH 3
3
OH
OH CH 3
C C O C CH 3 3
高三期末化学试题第I卷
高三期末化学试题 第I卷(选择题共83分) 可能用到的原子量:H-1,O-16,C-12,N-14,C1-35.5,P-31,S-32,Na-23,Mg-24,A1-27,Fe-56,Zn-65,Cu-64,Ba-37,Ag-108 一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个正确选项) 1、在化学变化中一定不能实现的是 A、一种分子变成另一种分子 B、一种原子变成另一种原子 C、一种离子变成另一种离子 D、一种单质变成另一种单质 2、碱金属元素的次外层电子数是 A、2 B、8 C、2或8 D、2,8或18 3、下列试剂:①漂白粉②纯碱晶体③磷酐④过氧化钠⑤绿矾⑥电石,若它们常期置于敞口的试剂瓶暴露于空气中, 由于发生氧化还原反应而变质的是 A、①④⑤ B、①②⑤ C、②④⑥ D、①②③④⑤⑥ 4、已知ICN的性质和卤素相似。氧化碘分解反应的方程式为:2ICN=12+(CN)2。下列ICN的叙述正确的是: A、ICN的晶体是离子晶体 B、ICN是供供化合物 C、ICN不能与NaOH溶液反应 D、ICN在常温下可能是气体 5、下列实验能获得成功的是 A、苯和浓溴水用铁作催化剂制溴苯 B、向氯化钠溶液中滴加浓硫酸制HC1气体 C、淀粉与质量分数为20%的硫酸共煮制单糖 D、电石与水反应在启普发生器中进行制乙炔 二、选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两选项符合题意。若正确答案只包括一个 选择,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分) 6、用N A表示阿伏加德罗常数,下列说法正确的 A、6.4克铜与硫反应失去的电子数为0.2 N A B、1mo lN a2O2与水反应转移电子数为N A C、2.9克乙基(-C2H5)含有的电子数为1.8N A个 D、标准状况下:N A个NO、CO 2、SO 3分子所占的体积均约为22.4升 7、下列离子方程式错误的是 A、向Ba(OH)2溶液中逐滴加入NH 4 HSO4溶液刚好沉淀完全 Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O B、澄清石灰水中通入氟化氢:Ca2+2OH-+2HF=CaF2↓+2H2O C、漂白粉溶液通入SO2:Ca2++2CIO-+SO2+H2O=CaSO3↓+2HCIO D、向硫酸亚铁的酸性溶液中滴入双氧水:4F e2++2H2O2+4H+=4F e3++4H2O 8、在一固定窖的密闭容器中,充入2mo lA和1mo lB发生反应: 2A(气)+B(气)<=>XC(气)达平衡时;C的体积分数为W%,若维持容器的容积和温度不变,按0.6molA、0.3molB 和1.4molC为起始物质,C的体积分数也为W%,则X的值可能为 A、1 B、2 C、3 D、4 9、一定温度下,某密闭容器里发生可逆反应: CO(气)+H2O(气)<=>XC2(气)+H2(气)-Q,(Q>0)当达到平衡时,测得各物质均为n mol。欲使H2的平衡浓度增大1倍,其它条件不变时,下列措施可采用的是: A、升高温度 B、再通入n mol CO和n molH2O(气) C、再通入2n mol CO2和2n mol H2 D、使用催化剂 10、下列叙述不正确的是: A、金属元素从化合态变为游离态时,该元素一定被还原 B、自来水经长时间的煮沸可得到软水
2016对口升学高考试卷-数学word版
湖南省2016年普通高等学校对口招生考试 数学(对口)试题 一. 选择题(本大题共10小题,每小题4分,共40分,在每小题给出的四个选项中,只有一项是 符合题目要求的) 1. 设全集U={1,2,3,4,5},A={1,2},B={5},则() U A B ?=e( ) A.{5} B.{3,4,5} C.{3,4} D.{1,2,5} 2. 函数f(x)= 12x ?? ??? +2,x ∈{-1,2}的最大值为( ) A.4 B.3 C. 52 D. 94 3. “x<-1或x>2”是”x<-1”的( ) A.充分不必要条件 B.必要不充分条件 C.充分必要条件 D.既不充分也不必要条件 4. 不等式|2x+1|>5的解集为( ) A .{x|x>2} B.{x|x<-3} C.{x|-3 A.[1,7] B.[1,9] C.[3,7] D.[3,9 ] 10.已知a,b,c 为三条不重合的直线,给出下面三个命题:①若a ⊥b,a ⊥c 则b//c;②若a ⊥b,a ⊥c 则b ⊥c;③若a//b,b ⊥c,则a ⊥c,其中正确的命题为( ) A .③ B .①② C .①③ D .②③ 二.填空题:(本大题共5小题,每小题4分,共20分) 11.袋中有6个红色球,3个黄色球,4个黑色球,从袋中任取一个球,则取到的球 不是.. 黑色球的概率为 12.已知数列{a n }的前n 项和s n =n 2+2n,则a 2= 13.若不等式x 2+x-c ≤0的解集为{x|-2≤x ≤1},则c= 14.6位同学站成一排照相,其中甲,乙两人必须相邻,共有 种不同的排法(用数字作答) 15.已知A,B 为圆x 2+y 2=1上的两点, AB ,O 为坐标原点,则AB OA ?u u u r u u u r = 三.解答题:(本大题共7小题,其中第21,22小题为选做题。满分60分,解答应写出文字说明,证明过程或演算步骤) 16.(本小题满分10分) 已知函数f(x)=log2(x-2). (I)求f(x)的定义域; (II)若f(m)+f(m-1)=1,求m 的值. 17.(本小题满分10分) 2018年全国高考化学试题及参考答案 一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项是符合题目要求的。 7.磷酸亚铁锂(LiFePO 4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误.. 的是 A .合理处理废旧电池有利于保护环境和资源再利用 B .从“正极片”中可回收的金属元素有Al 、Fe 、Li C .“沉淀”反应的金属离子为Fe 3+ D .上述流程中可用硫酸钠代替碳酸钠 【答案分析】D 。硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。 8.下列说法错误的是 A .蔗糖、果糖和麦芽糖均为双糖 B .酶是一类具有高选择催化性能的蛋白质 C .植物油含有不饱和脂肪酸甘油酯,能使Br 2/CCl 4褪色 D .淀粉和纤维素水解的最终产生均为葡萄糖 【答案与分析】A 。果糖属于单糖。 9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是 ABCD 【答案与分析】D 。实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法是用分液法,而不能采用加热蒸发结晶法, 10. 是阿伏加得罗常数的值,下列说法正确的是 A .16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1 B .22.4L (标准状况下)氩气含有的质子数为18 C .92.0g 甘油(丙三醇)中含有羟基数为1.0 D .1.0molCH 4与Cl 2在光照下反应生成CH 3Cl 分子数为1.0 【答案与分析】B 。盐类水解的程度是很小的,A 不对;隋性气体属于单原子分子,1mol 的氩气在标准状况下所占的体积为22.4L ,所含的电子数和质子数相等,均为18mol ,B 正确;1mol 甘油(丙三醇)中含有3 的羟基,C 错误;CH 4与CL2在光照的条件下反应生成的产物中含有CH 3Cl 、 CH 2Cl 2、CHCl 3及CCl 4,则生成物中含有的CH 3Cl 少于1mol ,D 不对。 11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(列关于该化合物的说法错误的是 正极碱 2溶LiFePO 4 滤 H 2SO 4 含Li 、Fe 、P 炭黑等 碱沉滤Na 2CO 含锂沉 2018 年上海秋季高考语文卷 一积累应用(10 分) 1.填空(5 分) (1)子曰:“君子固穷,。”(《论语·卫灵公》)(1 分) (2)寻寻觅觅,冷冷清清,。(李清照《》)(2 分) (3)《梦游天姥吟留别》中“,”两句描写梦中的声音,震动林泉,使人心惊胆战。(2 分) 2.按要求选择(5 分) (1)下列选项中,各句使用不恰当的一项是()。(2 分) A、老吴七十学画,今天开画展,朋友发来短信:“莫道桑榆晚,为霞尚满天。” B、沈教授为人真挚,安然奉教数十年,深受学生爱戴,可谓“桃李不言,下自成蹊。” C、王老师备课总是深入而又全面,她知道“以其昏昏,使人昭昭”是不可能的。 D、小赵的论文缺乏独到的见解,他的导师给他写评语说:“言之无文,行之不远。” (2)将下列编号的语句依次填入语段空白处,语意连贯的一项是()(3 分) 艺术家可以活在艺术史中,,,,,艺术可以保持对 于时代的冷漠,从而彰显艺术的自主性品格。 ①艺术的独立性不是说艺术可以断绝与时代的关系 ②他们生活在社会历史之中 ③但更为普遍真实的是 ④而是说一种抵抗方式 A、③①④② B、③②①④ C、②①④③ D、②③①④ 二、阅读70 分 (一)阅读下文,完成第 3—7 题。(16 分) 喜怒哀乐的经济逻辑 熊秉元 ①十八世起的哲学家休谟说:“理智乃情感之奴。”也是说,人是情感、情绪的动物。 ②哲学家大多认为,喜怒哀乐,爱恨情仇是驾驭人的原始力量,理智不是居于支配和奴役的地位, 人的境况,还真是可悲可悯。 ③然而,法国人类学家列堆·斯特劳斯提醒世人:原始都落里看来古怪甚至是荒诞不经的仪式举措,背后其实都是有逻辑的。这位大师的见解,相当程度上改变了学界和世人对原始部落的认知。 ④既然原始部落那些古怪的仪式举措可以用新的方法得到解释,那么,情感、情绪是不是也可以用 新的眼光得到新的、不同的解读呢? ⑤我们先从简单的例子说起,如果人真的是情感的动物,那么一旦受到处部环境的刺激,就应不加控制地将情感表达出来,可是,被师长责备时,有多少人会回嘴或怒目以对?对于上司或面试的主考官,有多少人会直接宣泄心中不满的情绪?大概不多,除非打定“此处不留人”的主意!可见,人并非情感的动物。情感的运用其实有规律可循。用经济学的话来说,就是对成本和效益的考量:对师长、上司、主考官等宣泄不满,成本高而效益低,做了不划算,因此不值得这么做。 ⑥比较复杂的一种情况是:很多人把气往父母兄弟身上出,对朋友却格外客气有礼,家人似乎比不 上朋友,这又是为什么呢?这种现象看起来奇怪,其实一点就明,还是成本效益的考量:家人被得罪, 丰台区2017~2018学年度第一学期期末练习 高三化学 2018.01 可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 Na-23 Cu-64 Cl-35.5 第一部分(选择题共42分) 选择题(每题只有一个符合题意的选项,每题3分,共42分) 1.共建“一带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易商品中,主要成分属于无机物的是 A.中国丝绸B.捷克水晶C.埃及长绒棉D.乌克兰葵花籽油 2. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是 A.萃取 B. 蒸馏 C. 干馏 D. 升华 3. 下列变化中,发生氧化还原反应的是 A. 用晶体Si制作半导体 B. 煅烧石灰石制备生石灰 C. 用Na2O2做呼吸面具供氧剂 D. 用可溶性铝盐处理水中悬浮物 4.下列有关性质的比较,不.能. 用元素周期律解释的是 A .金属性:Na > Mg B .酸性:H 2SO 4 > HClO C .碱性:KOH > NaOH D .热稳定性:HC1 > HBr 5. 下列解释事实的方程式不正确... 的是 A. 用Na 2S 处理含Hg 2+废水:Hg 2+ + S 2? HgS↓ B. 燃煤中添加生石灰减少SO 2的排放:2CaO + O 2 + 2SO 2 2CaSO 4 C. 工业上将Cl 2 通入石灰乳中制漂白粉:Cl 2 + OH - Cl - + ClO - + H 2O D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO - + Cl - +2H + Cl 2↑+ H 2 O 6. 国际空间站处理CO 2的一个重要方法是将CO 2还原,所涉及的反应方程式为: CO 2(g) + 4H 2(g) CH 4(g) + 2H 2O(g) 若温度从300℃升至400℃,反应重新达到平衡时,H 2的体积分数增加。下列关于该过程的判断正确的是 A .该反应的ΔH < 0 B .化学平衡常数K 增大 C .CO 2的转化率增加 D .正反应速率增大,逆反应速率减小 7.下列制取 SO 2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是 A .制取SO 2 B .验证漂白性 C .收集SO 2 D .尾气处理 8. 在给定条件下,下列物质的转化能实现的是 A. B. Ru S SO 3 H 2SO 4 O 2/点燃 H 2O NH 3 NO 2 HNO 3 O 2/催化剂 △ H 2O Na Na 2O Na 2CO 3 O 2/点燃 CO 2 △ 绝密★启封并使用完毕前 试题类型:A 2015年普通高等学校招生全国统一考试 理科数学 注意事项: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.第Ⅰ卷1至3页,第Ⅱ卷3至5页. 2.答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置. 3.全部答案在答题卡上完成,答在本试题上无效. 4. 考试结束后,将本试题和答题卡一并交回. 第Ⅰ卷 一、选择题:本大题共12小题,每小题5分,在每小题给出的四个选项中,只有一项是符合题目要 求的. 1.设复数z 满足1+z 1-z =i ,则|z |= A .1 B . 2 C . 3 D .2 2.sin 20°cos 10°-cos 160°sin 10°= A .-32 B .32 C .-12 D .1 2 3.设命题P :?n ∈N ,n 2>2n ,则¬P 为 A .?n ∈N , n 2>2n B .?n ∈N , n 2≤2n C .?n ∈N , n 2≤2n D .?n ∈N , n 2=2n 4.投篮测试中,每人投3次,至少投中2次才能通过测试.已知某同学每次投篮投中的概率为0.6,且各 次投篮是否投中相互独立,则该同学通过测试的概率为 A .0.648 B .0.432 C .0.36 D .0.312 5.已知M (x 0,y 0)是双曲线C :x 22 -y 2=1 上的一点,F 1、F 2是C 上的两个焦点,若 MF 1→· MF 2 → <0 ,则y 0的取值范围是 A .????-33,33 B .????-36,36 C .????- 223,223 D .????-233 ,233 6.《九章算术》是我国古代内容极为丰富的数学名著,书中有如下问题:“今有委米依垣内角,下周八尺, 高五尺.问:积及为米几何?”其意思为:“在屋内墙角处堆放米(如图,米堆为一个圆锥的四分之一),米堆底部的弧度为8尺,米堆的高为5尺,问米堆的体积和堆放的米各为多少?”已知1斛米的体积约为1.62立方尺,圆周率约为3,估算出堆放斛的米约有 A .14斛 B .22斛 C .36斛 D .66斛 7.设D 为△ABC 所在平面内一点BC →=3CD → ,则 A .AD →=-13A B →+43A C → B .A D → =13AB →-43AC → C .AD →=43AB →+13AC → D .AD → =43AB →-13 AC → 2014年普通高等学校招生全国统一考试(新课标Ⅱ卷) 理科综合试卷——化学 7.下列过程没有发生化学反应的是() A.用活性炭去除冰箱中的异味 B.用热碱水清除炊具上残留的油污 C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 D.用含硅胶、铁粉的透气小袋与食品一起密封包装 8.四联苯的一氯代物有() A.3种B.4种C.5种D.6种 9.下列反应中,反应后固体物质增重的是() A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末 C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液 10.下列图示实验正确的是() A.除去粗盐溶液中的不溶物B.碳酸氢钠受热分解 C .除去CO 气体中的CO2气体 D .乙酸乙酯制备演示实验 11.一定温度下,下列溶液的离子浓度关系式正确的是( ) A .pH=5的H 2S 溶液中,c(H +)=c(HS -)=1×10-5mol?L -1 B .pH=a 的氨水溶液,稀释10倍后,其pH=b ,则a=b+1 C .pH=2的H2C2O4溶液与pH=12的NaOH 溶液任意比例混合: c(Na +)+c(H +)=c(OH -)+c(HC 2O 4-) D .pH 相同的①CH 3COONa ②NaHCO 3③NaClO 三种溶液的c(Na +):①>②>③ 12.2013年3月我国科学家报道了如图所示的水溶液锂离子 电池体系,下列叙述错误的是( ) A .a 为电池的正极 B .电池充电反应为LiMn 2O 4=Li 1-x Mn 2O x +xLi C .放电时,a 极锂的化合价发生变化 D .放电时,溶液中Li +从b 向a 迁移 13.室温下,将1mol 的CuSO 4?5H 2O (s )溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为△H 2,CuSO 4?5H 2O 受热分解的化学方程式 为:CuSO 4?5H 2O(s) =====△CuSO 4(s)+5H 2O(l),热效应为△H 3 。则下列判断正确的是( ) A .△H 2>△H 3 B .△H 1<△H 3 C .△H 1+△H 3=△H 2 D .△H 1+△H 2>△H 3 26.(13分)在容积为1.00L 的容器中,通入一定量的N 2O 4,发生反应N 2O 4(g) 2NO 2(g), 随温度升高,混合气体的颜色变深。 绝密★启用前 2018年普通高等学校招生全国统一考试(新课标全国I卷) 英语 (考试时间:120分钟试卷满分:150分) 注意事项: 1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3. 考试结束后,将本试卷和答题卡一并交回。 第一部分听力(共两节,满分30分) 做题时,先将答案标在试卷上。录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。第一节(共5小题;每小题1.5分,满分7.5分) 听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt? A. £ 19. 15. B. £ 9. 18. C. £ 9. 15. 答案是C。 1.what will James do tomorrow ? A.Watch a TV program. B.Give a talk. C.Write a report. 2.What can we say about the woman? A.She's generour. B.She's curious. C.She's helpful. 3.When does the traif leave?https://www.360docs.net/doc/3314393911.html, A.At 6:30. B.At8:30. C.At 10:30. 4.How does the wonar sRwr?m A.By car. B.On foot. C.By bike 5.What is the probable relationship between the speakers? A.Classmates. B.Teacher and student. C.Doctor and patient. 第二节(共15小题;每小题1.5分,满分22.5分) 听下面5段对话或独白。每段对话或独白后有几个小题,从题中所给的A、B、C三个选项中选出最佳选项。听每段对话或独白前,你将有时间阅读各个小题,每小题5秒钟;听完后,各小题将给出5秒钟的作答时间。每段对话或独白读两遍。 听第6段材料,回答第6、7题。 6.What does the woman regret? A.Giving up her research. B.Dropping out of college. C.Changiny her major. 东城区2019-2020学年度第一学期期末教学统一检测 高三化学 本试卷共9页,共100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。 可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 S 32 Cl Fe 56 Cu 64 Ag 108 第一部分(共42分) 本部分共14小题,每小题3分,共42分。在每小题列出的4个选项中,选出最符合题目要求的一项。 1.垃圾分类有利于资源回收利用。下列垃圾的归类不合理 ...的是 A B C D 垃 圾 归 类 2.下列用离子方程式表示的原理中,正确的是 A.用水除去NO气体中的NO2:3NO2 + H2O 2H++ 2NO3- + NO B.用碳酸钙与稀盐酸制取CO2:CO32- + 2H+H2O+ CO2↑ NO + 2H+Ag+ + NO2↑ + H2O C.用稀硝酸溶解银:Ag + 3 D.用明矾作净水剂:Al3+ + 3H2O Al(OH)3 ↓+ 3H+ 3.锗(32G e)与钾(19K)同周期。下列说法正确的是 A.锗位于第4周期第ⅤA族B.7032G e的中子数与电子数的差值为38 C.锗是一种半导体材料D.碱性:Ge(OH)4>KOH 4.下列关于钠及其化合物的叙述不正确 ...的是 A.钠与水反应放出热量 B.Na2O与Na2O2均能与水反应生成NaOH C.钠切开后,光亮的表面迅速变暗,是因为生成了Na2O2 D.用加热的方法可除去Na2CO3粉末中含有的少量NaHCO3 5.有机物X是医药合成的中间体,其结构如下。 下列说法不正确 ...的是 A.X分子存在顺反异构体B.X分子中含有3个甲基 C.X分子中含有羧基、羟基和酯基D.1 mol X最多能与2 mol NaOH发生反应6.对室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有关叙述正确的是 A.温度均升高20℃,两溶液的pH均不变 B.加入适量氯化铵固体后,两溶液的pH均减小 C.加水稀释100倍后,氨水中c(OH-)比氢氧化钠溶液中的小 D.与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多 7.铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、 稀盐酸和水洗涤。下列说法不正确 ...的是 A.稀盐酸的主要作用是除去铁锈 B.a接电源正极,b接电源负极 C.电镀过程中c(Cu2+)基本保持不变 D.阴极发生反应:Cu2++2e–= Cu 8.下列实验操作能达到实验目的的是 实验目的实验操作 A 鉴别苯和溴乙烷取少量苯和溴乙烷,分别加入水 B 除去二氧化碳中的氯化氢将气体通入碳酸钠溶液中 C 比较氯和硅的非金属性强弱将盐酸滴入Na2SiO3溶液中 验证在酸作用下,蔗糖水解能否 D 取水解后的液体,加入新制的氢氧化铜加热 生成葡萄糖 2019年江苏省高考数学试卷 一、填空题 1.已知集合123A ,,,245B ,,,则集合A B U 中元素的个数为_______. 2.已知一组数据4,6,5,8,7,6,那么这组数据的平均数为 ________. 3.设复数z 满足234z i (i 是虚数单位),则z 的模为_______. 4.根据如图所示的伪代码,可知输出的结果S 为________. 5.袋中有形状、大小都相同的 4只球,其中1只白球,1只红球,2只黄球,从中一次随机摸出2只球,则这2只球颜色不同的概率为________. 6.已知向量21a r ,,2a r 1,,若98ma nb mn R r r ,,则m-n 的值为______. 7.不等式 224x x 的解集为________. 8.已知tan 2,1 tan 7,则tan 的值为_______. 9.现有橡皮泥制作的底面半径为 5,高为4的圆锥和底面半径为2、高为8的圆柱各一个。若将它们重新制作成总体积与高均保持不变,但底面半径相同的新的圆锥与圆柱各一个,则新的底面半径为 。10.在平面直角坐标系 xOy 中,以点)0,1(为圆心且与直线)(012R m m y mx 相切的所有圆中,半径最大的圆的标准方程为 。11.数列}{n a 满足 11a ,且11n a a n n (*N n ),则数列}1{n a 的前10项和 为。12.在平面直角坐标系 xOy 中,P 为双曲线122y x 右支上的一个动点。若点P 到直线01y x 的距离对c 恒成立,则是实数c 的最大值为 。13.已知函数 |ln |)(x x f ,1,2|4|10,0)(2x x x x g ,则方程1|)()(|x g x f 实根的 个数为。14.设向量)12,,2,1,0)(6cos 6sin ,6(cos k k k k a k ,则1201)(k k k a a 的值 为。 2016年全国统一考试(新课标I 卷) 一、选择题: 7. 化学与生活密切相关。下列有关说法错误的是( ) A. 用灼烧的方法可以区分蚕丝和人造纤维 B. 食用油反复加热会产生稠环芳烃等有害物质 C. 加热能杀死流感病毒是因为蛋白质受热变性 D. 医用消毒酒精中乙醇的浓度为95% 8. 设A N 为阿伏加德罗常数值。下列有关叙述正确的是( ) A. 14g 乙烯和丙烯混合气体中的氢原子数为A 2N B. 1mol 2N 与4mol 2H 反应生成的3NH 分子数为A 2N C. 1mol Fe 溶于过量硝酸,电子转移数为A 2N D. 标准状况下,2.24L 4CCl 含有的共价键数为A 0.4N 9. 下列关于有机化合物的说法正确的是( ) A. 2-甲基丁烷也称为异丁烷 B. 由乙烯生成乙醇属于加成反应 C. 49C H Cl 有3种同分异构体 D. 油脂和蛋白质都属于高分子化合物 10. 下列实验操作能达到实验目的的是( ) A. 用长颈漏斗分离出乙酸与乙醇反应的产物 B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D. 将2Cl 与HCl 混合气体通过饱和食盐水可得到纯净的2Cl 11. 三室式电渗析法处理含24Na SO 废水的原理如图所示,采用惰性电极,ab 、cd 均为离子 交换膜,在直流电场的作用下,两膜中间的+Na 和24SO - 可通过离子交换膜,而两端隔室中 离子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A. 通电后中间隔室的24SO - 离子向正极迁移,正极区溶液pH 增大 高 三 化 学 可能用到的相对原子质量:O :16 Mg :24 Al :27 Fe :56 第Ⅰ卷 一、选择题 1、诗句“春蚕到死丝方尽……”中的丝是( ) A 、纤维素 B 、蛋白质 C 、淀粉 D 、糖类 2、下列过程需要通过直流电才能实现的是( ) A 、电化腐蚀 B 、比较同浓度盐酸和氨水的导电能力 C 、电泳 D 、电离 3、为防止富脂食品长期放置产生变质现象,在食口包装袋内,除了放置干燥剂外,为防止食品氧化,还要放置( ) A 、无水硫酸铜 B 、铁粉 C 、食盐 D 、生石灰 4、已知在一定条件下,Cl 2、ClO 2(其还原产物为Cl -)、O 2(1molO 3转化为 1molO 2和 1molH 2O)、H 2O 2等物质都具有氧化性,因而常被用作消毒剂。等物质的量的上述物质消毒效率最高的是( ) A 、Cl 2 B 、ClO 2 C 、O 3 D 、H 2O 2 5、绿色化学是当今化学科学研究的前沿,其原则之一是单一反应的原子利用率(原子经济性)要最大化。根据该原则,下列反应原子经济性最差的是( ) A 、获1950年诺贝尔奖的 反应: CH 2=CH 2+CH 2=CH —CH=CH 2→B 、获 1979年诺贝尔奖的(Ph- C 、乙烯催化氧化制乙醛:2CH 2=CH 2+O 2 2CH 3CHO D 、获1963年诺贝尔奖的烯烃聚合反应: NCH 2===CH —CH 3 [CH 2—CH]n 二、不定项选择题 6、下列叙述正确的是( ) A 、两种粒子,若核外电子排布完全相同,则化学性质一定相同 B 、由单原子形成的离子,一定具有稀有气体元素原子核外电子排布 C 、两原子,如果核外电子排布相同,则一定属于同一种元素 D 、阴离子的核外电子排布一定与上一周期稀有气体原子核外电子排布相同 7、如右图所示,A 池用石墨电极电解氢氧化钠溶液,B 池精炼粗铜,一段时间后停止通电,A 池D 极产生的气体在标准状况下为2.24L 。下列说法正确的是( ) +CH 2CH 2+Ph 3===O 催 3 绝密★启用 2012年普通高等学校招生全国统一考试(四川卷) 英语 录入:Love my dog 第Ⅰ卷(选择题共100分) 第一部分英语知识运用(共两节,满分50分) 第一节语法和词汇知识(共20小题;每小题1分,满分20分)从A、B、C、D四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。 1. —Excuse me. How much is the shirt — _______. A. Extra Large B. 50 each C. It sells well D. Altogether there are 5 2. New technologies have made ____ possible to turn out new products faster and at a lower cost. A. that B. this C. one D. it 3. —Goodbye, John. Come back again sometime. —Sure. ______. A. I did B. I do C. I shall D. I will 4. At school, some students are active ______ some are shy, yet they can be good friends with one another. A. while B. although C. so D. as 5. This is not my story, nor ______ the whole story. My story plays out differently. A. is there B. there is C. is it D. it is 6. Tom took a taxi to the airport, only _____ his plane high up in the sky. A. finding B. to find C. being found D. to have found 2017全国统一高考化学试题及答案(新课标1卷) 2017年普通高等学校招生全国统一考试 化学试题及答案(新课标1卷) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56 I 127 一、选择题:本题共13个小题,每小题6分,共78分。 在每小题给出的四个选项中,只有一项是符合题目 要求的。 7.下列生活用品中主要由合成纤维制造的是 A.尼龙绳B.宣纸C.羊绒衫D.棉衬衣 8.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。” 文中涉及的操作方法是 A.蒸馏B.升华C.干馏D.萃取 9.已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是 A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面10.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液 用于吸收少量氧气),下列说法正确的是 A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓 盐酸反应制备氯气 点燃南京市高三上学期期末考试化学试题 本试卷分选择题和非选择题两部分。共120分。考试时间120分钟。 注意事项: 答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要 求填涂在答题卡 ...上;非选择题的答案写在答题纸 ...上对应题目的答案空格内,答案不写在试卷上。考试结束后,请将答题卡、答题纸一并交回。 可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Fe 56 Ag 108 Ba 137 选择题共42分 单项选择题:本题包括6小题,每小题3分,共计18分。每小题只有一个选项符合题意。 1.化学在生产和生活中有着广泛的应用。下列做法错误 ..的是()A.用聚乙烯塑料做食品包装袋 B.用二氧化硫加工食品使食品增白 C.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜要求 D.用明矾做净水剂除去水中的悬浮物 2.氢化亚铜(CuH)可用CuSO4溶液和另一种反应物在40℃~50℃时反应生成。CuH不稳 定,易分解,在氯气中能燃烧,常温下跟盐酸反应能产生气体。以下表述错误 ..的是()A.生成CuH的反应中CuSO4被氧化B.CuH既可作氧化剂也可作为还原剂 C.2CuH+3Cl2====2CuCl2+2HCl D.CuH+HCl=CuCl+H2↑ 3.用N A表示阿伏加德罗常数的值。下列说法正确的是()A.标准状况下,22.4L乙醇中含有的碳原子数目为2N A B.1mol C n H2n含有的共同电子对数为(3n+1)N A C.1mol CO2与1mol Na2O2完全反应时,转移的电子数目为N A D.1mol/L的FeCl3溶液中,所含Fe3+的数目小于N A 4.下列实验能达到的预期目的的是() ①用硝酸钡溶液鉴别硫酸根离子与亚硫根离子; ②用溴水检验汽油中是否含有不饱和脂肪烃; ③用乙醇从碘水中萃取碘; ④用盐析方法分离提纯蛋白质; ⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体; ⑥用氨水清洗试管壁附着的银镜 A.②④⑤B.①③⑥C.①②④⑤D.②③④⑤⑥ 5.在溶液中能大量共存的一组微粒是() 绝密★启用前 2020年普通高等学校招生全国统一考试(全国卷III) 英语 (全国卷Ⅲ适用地区:云南、广西、贵州、四川、西藏等地区) 注意事项: 1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡和试卷指定位置上。 2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3. 考试结束后,将本试卷和答题卡一并交回。 第一部分听力(共两节,满分30分) 做题时,先将答案标在试卷上。录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。 第一节(共5小题;每小题分,满分分) 听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 例:How much is the shirt A. £. B. £. C. £. 答案是C。 1. Where does the conversation probably take place A. In a supermarket. B. In the post office. C. In the street. 2. What did Carl do A. He designed a medal. B. He fixed a TV set. C. He took a test. 3. What does the man do A. He’s a tailor. B. He’s a waiter. C. He’s a shop assistant. 4. When will the flight arrive A. At 18:20. B. At 18:35. C. At 18:50. 5. How can the man improve his article A. By deleting unnecessary words. 1999年普通高等学校招生全国统一考试化学试卷 本试卷分第I 卷(选择题〕和第II 卷(非选择题)两部分,第I 卷1至4页,第II 卷5至10页。共150分。 考试时间[120]分钟。 第I 卷(选择题共:83分) 注意事项: 1.答第I 卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。 2. 每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑如需改动佣橡皮擦干净后。再选涂其它 答案,不能答在试题卷上。 3. 考试结束,监考人将本试卷和答题卡一并收回。 可能用到的原子量:Hl C12 N14 O l6 Na 23 Mg 24 一.选择题(本题包括5小题,每小题3分,并15分,每小题只有一个选项符合题意。) 1.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是 A.提高汽油燃烧效率 B.降低汽油成本 C.避免铅污染大气 D.铅资源短缺 2.Murad 等三位教授最早提出NO 分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获 了1998年诺贝尔医学及生理学奖,关于NO 的下列叙述不正确的是 A.NO 可以是某些含低价N 物质氧化的产物 B.NO 不是亚硝酸酐 C.NO 可以是某些含高价N 物质还原的产物 D.NO 是红棕色气体 3.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是Ir 191 77,则其核内的中子数是 A.77 B.114 C.191 D.268 4.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为 A.39︰61 B.61︰39 C.1︰1 D.39︰11 5.右图装置可用于 A.加热NaHCO 3制CO 2 B.用Cu 与稀HNO 3反应制NO C.用NH 4Cl 与浓NaOH 溶液反应制NH 3 D.用NaCl 与浓H 2SO 4反应制HCl 二.选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选顶符合题意。若正确答案只包 括一个选项,多选时,该题为 0分:着正确答案包括两个选项,只选一个且正确的给1分,选两个且都正 确的给3分,但只要选错一个,该小题就为0分。) 6.关于晶体的下列说法正确的是 A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中贝要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 7.下列各分子中所有原子都满足最外层为8电子结构的是 A.BeCl 2 B.PCl 3 C.PCl 5 D.N 2 北京市东城区2016-2017 学年度第一学期末教学统一检测 高三化学2017.1 本试卷共8 页,共100 分。考试时长100 分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 S 32 K 39 Cr 52 Pb 207 第一部分(选择题共42分)本部分共14小题,每小题3分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。 1.材料是人类赖以生存和发展的重要物质基础。下列物品所用材料的主要成分是有机高分子化合物的是 2.下列化学用语表述正确的是 A.二氧化碳的结构式:O =C =O B.氯化氢的电子式: C.13H 的原子结构示意图:D.水的电离方程式:H2O=H++OH- 3.下列说法中,符合ⅦA族元素结构与性质特征的是 A.原子易形成-2 价阴离子B.单质均为双原子分子,具有氧化性 C .原子半径随原子序数递增逐渐减小 D .氢化物的稳定性随原子序数递增依次增强 4.室温下,关于1.0 mL 0.l mol/L 氨水,下列判断正确的是 A.溶液的pH 等于13 C.加入少量NH4Cl 固体,c(OH-)不变 B.c(OH-)=c(NH4+)+c(H+) D.与1.0 mL 0.l mol/L 盐酸混合后,溶液呈中性 5.用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用: 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol 恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是A.气体的质量不再改变 B.氯化氢的转化率不再改变 C .断开4 mol H-Cl 键的同时生成4 mol H-O 键 D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O) =4∶1∶2∶2全国高考化学试题及参考答案
(完整版)2018年上海高考语文试卷及答案(可编辑修改word版)
2017-2018北京市丰台区第一学期高三期末化学试题
高考数学全国卷精美word版
全国高考化学试题及答案新课标卷
(完整word版)2018年高考英语真题(新课标全国一卷)有答案(2)
东城区2020届高三上学期期末化学试题及答案
高考数学试卷及答案-Word版
高考全国卷1化学试题附答案
高三化学期末考试试题(含答案)
高考试卷英语试题及答案 word版
2017全国统一高考化学试题及答案(新课标1卷)
高三上学期期末考试化学试题及答案
2020年全国卷Ⅲ英语高考试题及答案(word版)
最新1999年全国高考化学试题及答案
北京市东城区高三期末化学试题
