肽键形成部位——肽酰转移酶活性位点
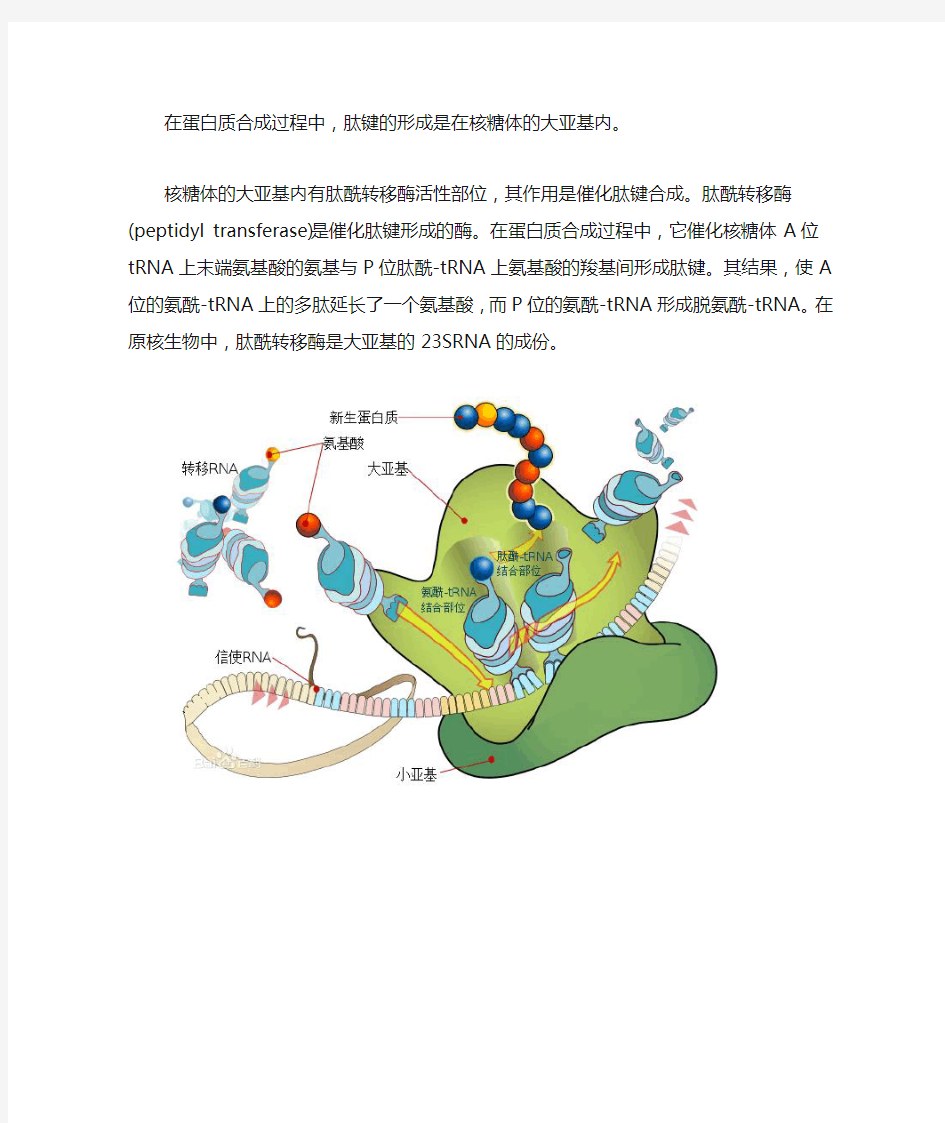
在蛋白质合成过程中,肽键的形成是在核糖体的大亚基内。
核糖体的大亚基内有肽酰转移酶活性部位,其作用是催化肽键合成。肽酰转移酶(peptidyl transferase)是催化肽键形成的酶。在蛋白质合成过程中,它催化核糖体A位tRNA上末端氨基酸的氨基与P位肽酰-tRNA上氨基酸的羧基间形成肽键。其结果,使A位的氨酰-tRNA上的多肽延长了一个氨基酸,而P位的氨酰-tRNA形成脱氨酰-tRNA。在原核生物中,肽酰转移酶是大亚基的23SRNA的成份。
蛋白酶酶切位点
蛋白酶酶切位点 木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素 胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写
名称三字符号单字符号 丙氨酸Ala A 精氨酸Arg R 天冬氨酸Asp D 半胱氨酸Cys C 谷氨酰胺Gln Q 谷氨酸Glu/Gln E 组氨酸His H 异亮氨酸Ile I 甘氨酸Gly G 天冬酰胺Asn N 亮氨酸Leu L 赖氨酸Lys K 甲硫氨酸Met M 苯丙氨酸Phe F 脯氨酸Pro P 丝氨酸Ser S 苏氨酸Thr T 色氨酸Trp W 酪氨酸Tyr Y 缬氨酸Val V 【生化】特异性蛋白酶的酶切位点 胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。胰凝乳蛋白酶phe、trp、tyr 等疏水aa。胃蛋白酶phe、trp、tyr等疏水aa。木瓜蛋白酶arg、lys。葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。CNBr断裂Met。羟胺断裂asn—gly间的肽键。二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。 木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。 木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。 番木瓜未成熟果实中含有木瓜蛋白酶(Papain)、木瓜凝乳蛋白酶A(Chymopapain A )、木瓜凝乳蛋白酶B(Chym opapain B )、木瓜肽酶B (PapayaPeptidase B ) 等多种蛋白水解酶。且已知四种半胱氨酸蛋白酶的一级结构具有高度的同源性。其中,木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。
蛋白酶专一性酶切位点地影响因素分析报告
蛋白酶专一性酶切位点的影响因素分析 摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。 关键词:生物活性肽;蛋白酶;水解条件;酶切位点 Influencing Factors Analysis of Protease Specific Cleavage Sites Abstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production. Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites 1.前言 生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。生物活性肽有的是天然存在的,如谷胱甘肽、催产素、加压素、舒缓激肽、部分抗菌肽等,有的生物活性肽是以非活性的状态存在于某些蛋白质中,当用特定的蛋白酶水解后被释放出来,才成为有特定生理活性的肽。同种蛋白质经不同的蛋白酶酶解后,可以产生具有不同氨基酸序列、不同生理功能的生物活性肽,如大豆蛋白、
蛋白酶的分类及酶切位点
蛋白酶的分类及酶切位点
氨基酸0.ppt 氨基酸的名称与符号
alanine 丙氨酸Ala A arginine 精氨酸Arg R asparagine 天冬酰氨Asn Asx N aspartic acid 天冬氨酸Asp Asx D cysteine 半胱氨酸Cys C glutamine 谷氨酰胺Gln Glx Q glutamic acid 谷氨酸Glu Glx E glycine 甘氨酸Gly G histidine 组氨酸His H isoleucine 异亮氨酸Ile I leucine 亮氨酸Leu L lysine 赖氨酸Lys K methionine 甲硫氨酸Met M phenylalanine 苯丙氨酸Phe F proline 脯氨酸Pro P serine 丝氨酸Ser S threonine 苏氨酸Thr T tryptophan 色氨酸Trp W tyrosine 酪氨酸Tyr Y valine 缬氨酸Val V 血清终止胰酶消化的原理 血清终止的原理其实是竞争抑制。就是用过量的牛血清中含有的蛋白来和胰酶结合。不给胰
酶消化细胞蛋白的机会。 细胞传代时,血清为什么能终止胰酶消化? 胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物! 什么样的细胞不能用胰酶-EDTA消化 植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。 应该是肿瘤细胞吧。正常的细胞,貌似都需要用胰酶或者胶原酶消化。 EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。 EDTA是乙二胺四乙酸,一种金属螯合剂。一般和胰蛋白酶配合使用。原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。它可以螯合这些离子,消除对胰酶的抑制。 干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么? 应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活 《军医进修学院学报》1992年02期 加入收藏投稿 正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究 焦顺昌赵东海黄昌霞王洪海 【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。体外研究发现,NHP的细胞粘附性可达90%;而NHP-EP的细胞粘附
蛋白酶切位点
Enzymes E.C.Number Cleavage sites Serine proteases E.C.3.4.21. α-chymotrypsin(胰凝乳蛋白酶,糜蛋白酶)E.C.3.4.21.1Tyr-|-Xaa,Trp-|-Xaa,Phe-|-Xaa,and also Leu-|-Xaa,Met-|-Xaa, Trypsin(胰朊酶,胰蛋白酶) E.C.3.4.21.4Arg-|-Xaa,Lys-|-Xaa, Pancreatic elastase(胰弹性蛋白酶) E.C.3.4.21.36Ala-|-Xaa,and also Gly-|-Xaa, Val-|-Xaa,Ser-|-Xaa, Thrombin(凝血酶) E.C.3.4.21.5Arg-|-Gly, Plasmin(胞质素,胞浆素) E.C.3.4.21.7Lys-|-Xaa,>Arg-|-Xaa Prolyl oligopeptidase,or prolyl endopeptidase E.C.3.4.21.26Pro-|-Xaa,>>Ala-|-Xaa Plasma kallikrein(血浆激肽释放酶) E.C.3.4.21.34Arg-|-Xaa,Lys-|-Xaa,including Arg-|-Ser,Lys-|-Arg, Leukocyte elastase(白细胞弹性蛋 白酶 ),or neutrophil elastase(中性白细 胞弹性蛋白酶),or lysosomal elastase(溶酶体弹性蛋白酶) E.C.3.4.21.37Val-|-Xaa,Ala-|-Xaa, Cysteine proteases E.C.3.4.22. Cathepsin B(组织蛋白酶) E.C.3.4.22.1Arg-Arg-|-Xaa,and also Leu-|-Xaa, Ala-|-Xaa,Phe-|-Xaa,Trp-|-Xaa, Clostripain(梭菌蛋白酶),or endoproteinase Arg-C E.C.3.4.22.8Arg-|-Xaa including Arg-|-Pro,but not Lys-|-Xaa Calpain(钙激活中性蛋白酶)-1,or μ-calpain E.C.3.4.22.52Met-|-Xaa,Tyr-|-Xaa and Arg-|-Xaa(with Leu or Val as the P2 residue) Aspartic acid proteases E.C.3.4.23. Pepsin(胃朊酶,胃蛋白酶) E.C.3.4.23.1Preferentially Phe-|-Xaa,Tyr-|-Xaa, and also Leu-|-Xaa,and Trp-|-Xaa,,ideally with Xaa= Phe,Trp,or Tyr Cathepsin(组织蛋白酶)D E.C.3.4.23.5Preferentially Phe-|-Xaa,Tyr-|-Xaa, and also Leu-|-Xaa,ideally with Xaa ≠Ala or Val
蛋白酶切位点
Enzymes E.C. Number Cleavage sites Serine proteases E.C.3.4.21. α-chymotrypsin(胰凝乳蛋白酶,糜蛋白酶)E.C.3.4.21.1Tyr-|-Xaa, Trp-|-Xaa, Phe-|-Xaa, and also Leu-|-Xaa, Met-|-Xaa, Trypsin(胰朊酶,胰蛋白酶) E.C.3.4.21.4Arg-|-Xaa, Lys-|-Xaa, Pancreatic elastase(胰弹性蛋白酶) E.C.3.4.21.36Ala-|-Xaa,and also Gly-|-Xaa, Val-|-Xaa, Ser-|-Xaa, Thrombin(凝血酶) E.C.3.4.21.5Arg-|-Gly, Plasmin(胞质素,胞浆素) E.C.3.4.21.7Lys-|-Xaa,> Arg-|-Xaa Prolyl oligopeptidase,or prolyl endopeptidase E.C.3.4.21.26Pro-|-Xaa,>> Ala-|-Xaa Plasma kallikrein(血浆激肽释放酶) E.C.3.4.21.34Arg-|-Xaa, Lys-|-Xaa,including Arg-|-Ser, Lys-|-Arg, Leukocyte elastase(白细胞弹性蛋 白酶 ),or neutrophil elastase(中性白细 胞弹性蛋白酶),or lysosomal elastase(溶酶体弹性蛋白酶) E.C.3.4.21.37Val-|-Xaa, Ala-|-Xaa, Cysteine proteases E.C.3.4.22. Cathepsin B(组织蛋白酶) E.C.3.4.22.1Arg-Arg-|-Xaa, and also Leu-|-Xaa, Ala-|-Xaa, Phe-|-Xaa, Trp-|-Xaa, Clostripain(梭菌蛋白酶),or endoproteinase Arg-C E.C.3.4.22.8Arg-|-Xaa including Arg-|-Pro,but not Lys-|-Xaa Calpain(钙激活中性蛋白酶)-1,or μ-calpain E.C.3.4.22.52Met-|-Xaa, Tyr-|-Xaa and Arg-|-Xaa(with Leu or Val as the P2 residue) Aspartic acid proteases E.C.3.4.23. Pepsin(胃朊酶,胃蛋白酶) E.C.3.4.23.1Preferentially Phe-|-Xaa, Tyr-|-Xaa, and also Leu-|-Xaa,and Trp-|-Xaa,,ideally with Xaa= Phe,Trp,or Tyr Cathepsin(组织蛋白酶)D E.C.3.4.23.5Preferentially Phe-|-Xaa, Tyr-|-Xaa, and also Leu-|-Xaa, ideally with Xaa ≠ Ala or Val
蛋白酶酶切位点
蛋白酶酶切位点 蛋白酶的分类及作用位点 木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素 胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写
名称三字符号单字符号 丙氨酸Ala A 精氨酸Arg R 天冬氨酸Asp D 半胱氨酸Cys C 谷氨酰胺Gln Q 谷氨酸Glu/Gln E 组氨酸His H 异亮氨酸Ile I 甘氨酸Gly G 天冬酰胺Asn N 亮氨酸Leu L 赖氨酸Lys K 甲硫氨酸Met M 苯丙氨酸Phe F 脯氨酸Pro P 丝氨酸Ser S 苏氨酸Thr T 色氨酸Trp W 酪氨酸Tyr Y 缬氨酸Val V 【生化】特异性蛋白酶的酶切位点 胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。胰凝乳蛋白酶phe、trp、tyr 等疏水aa。胃蛋白酶phe、trp、tyr等疏水aa。木瓜蛋白酶arg、lys。葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。CNBr断裂Met。羟胺断裂asn—gly间的肽键。二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。 木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。 木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。 番木瓜未成熟果实中含有木瓜蛋白酶(Papain)、木瓜凝乳蛋白酶A(Chymopapain A )、木瓜凝乳蛋白酶B(Chym opapain B )、木瓜肽酶B (PapayaPeptidase B ) 等多种蛋白水解酶。且已知四种半胱氨酸蛋白酶的一级结构具有高度的同源性。其中,木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。
