铋一铅一锡三元系相图

实验五三元合金的显微组织
(Microstructure of Ternary Alloys)
实验学时:1 实验类型:综合
前修课程名称:《材料科学导论》
适用专业:材料科学与工程
一、实验目的
1.熟悉铋一铅一锡三元系相图和典型合金的显微组织。
2.了解三元合金的显微组织与其三元相图的关系。
二、概述
三元相图可以帮助我们分析三元合金的平衡凝固过程及凝固后的显微组织。对于铸锭和铸件,如果凝固时的冷却速率较小(如砂模铸造),也可借助相图分析其凝固过程和凝固后的显微组织。
下图为铋一铅一锡三元相图的液相面投影图的示意。
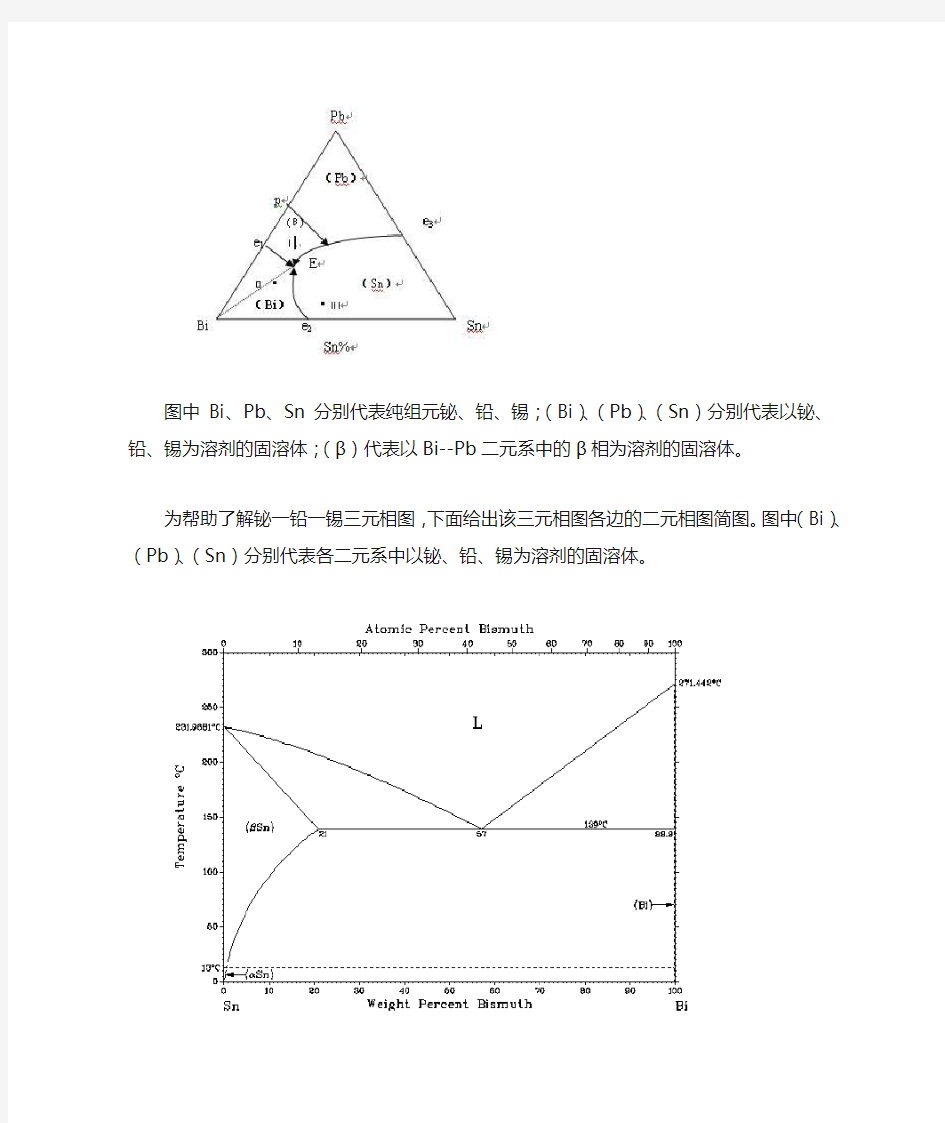
图中Bi、Pb、Sn分别代表纯组元铋、铅、锡;(Bi)、(Pb)、(Sn)分别代表以铋、铅、锡为溶剂的固溶体;(β)代表以Bi--Pb二元系中的β相为溶剂的固溶体。
为帮助了解铋一铅一锡三元相图,下面给出该三元相图各边的二元相图简图。图中(Bi)、(Pb)、(Sn)分别代表各二元系中以铋、铅、锡为溶剂的固溶体。
由上图可知,各二元系在液态时均为无限互溶,但在固态则为有限溶解,在铅一铋二元系中还出现了中间相β。在锡一铋二元系中,有一个共晶转变L→(Sn)+(Bi),转变温度为138.5℃。在铅一铋二元系中有一个包晶转变和一个共晶转变,包晶转变温度为184℃,反应式为L+(Pb)→β;共晶转变温度为125℃,反应式为L→β+(Bi)。在铅一锡二元系中,有一个共晶转变L→(Pb)+(Sn),转变温度为188℃。各二元系中的三相平衡都要进入三元系,成为三元系中的三相平衡。根据相律,三元系中三相平衡的自由度数等于1,因而是在一个温度范围内进行的。当降至某一定温度时,这些三相平衡将参与四相反应。
由液相面投影图可知,在铋一铅一锡三元系中存在两个四相平衡,一是在P点发生的四相包共晶反应,反应式为L+(Pb)→β+(Sn);另一个是在E点发生的四相共晶反应,反应式为L→(Bi)+β+(Sn)。根据相律,三元系中四相平衡的自由度数等于零,因而是一个恒温转变。转变过程中,参加反应的各相成分不变,温度恒定。
根据合金成分在三元相图投影图上的位置,可以分析合金的平衡凝固过程并预计凝固后的组织组成物。下面举例说明。
成分在E点的合金自液态进行凝固时,将直接进人四相平衡,发生四相共晶反应,反应式为L→(Bi)+β+(Sn),这是一个恒温转变,转变温度为96℃,凝固后的组织为(Bi)+β+(Sn)三相共晶体。
成分在e1E线上的合金凝固时,先进行三相共晶反应,反应式为L→(Bi)+β,生成两相共晶体(Bi)+β。这个三相反应是在一个温度范围内进行的。当温度降到E点(96℃)时,剩余的液体将进行四相共晶反应L→(Bi)+β+(Sn),生成三相共晶体(Bi)+β+(Sn)。因此,e1E线上的合金(不包括e1点和E点)凝固后,其组织组成物为两相共晶体(Bi)+β和三相共晶体β+(Bi)+(Sn)。
若忽略固态下铅、锡在铋中很小的溶解度,则可把Bi点和E点联成直线。成分在BiE线上的
合金凝固时,先由液相生成初生晶体(Bi),由于液相成分不能进入三相平衡区,因而没有两相共晶体形成。当液相成分到达E点时,将发生四相共晶反应,生成三相共晶体(Bi)+β+(Sn)。因此,BiE线上的合金凝固后,其组织组成物为初生晶体(Bi)和三相共晶体(Bi)+β+(Sn)。
成分在Bie1EBi范围内的合金凝固时,先从液相结晶出初生晶体Bi,随着温度的降低,当液相成分到达e1E线时,将通过三相共晶反应生成两相共晶体(Bi)+β,当液相成分到达E点时,将发生四相共晶反应,生成三相共晶体(Bi)+β+(Sn)。因此在Bie1EBi 范围内(不包括Bie1EBi 线)的合金凝固后,其组织组成物为初生晶体(Bi)、两相共晶体(Bi)+β和三相共晶体(Bi)+β+(Sn)。
下面举出铋一铅一锡系中三个典型合金砂模铸造的显微组织。各合金的成分为:合金Ⅰ(Bi-33%Pb-17%Sn),合金Ⅱ(Bi-25%Pb-13%Sn),合金Ⅲ(Bi-7%Pb-40Sn%)。它们在液相面投影图上的位置分别用Ⅰ、Ⅱ、Ⅲ标出。
此外,若给出过合金成分点的垂直截面,则可知道合金在凝固过程中所经历的相平衡及所对应的温度及温度范围等;若给出等温截面,则可知道该温度下合金所处的状态,由哪些相组成,并可应用杠杆定理和重心法则求出各相、各组织组成物的相对含量等。
三、实验用设备和材料
⒈光学金相显微镜。
⒉典型成分的铋—铅—锡三元合金砂模铸造的金相试样。
四、实验内容与步骤
⒈在教师的指导下对铋—铅—锡三元相图进行讨论与分析。
⒉将所要观察的各合金的成分点标在该三元相图的投影图上,分析其平衡凝固过程,预计在室温下的组织组成物。
⒊用金相显微镜观察与分析已制备好的典型三元合金金相试样的显微组织。样品使用的浸蚀剂是4%的硝酸酒精。
(5-1)铅锡铋三元合金E点成分(5-2)铅锡铋三元合金Ⅲ点合金
(5-3)铅锡铋三元合金E-Sn连线上的成分(5-4)铅锡铋三元合金Ⅱ点成分
五、本次实验的总结报告
⒈画出铋—铅—锡三元相图的液相面投影图,标出实验中所观察的各合金的成分点。
⒉画出各合金在室温下的显微组织示意图,并注明合金成分、放大倍数及各组织组成物的名称。
三元共晶二元共晶+三元共晶先共晶+二元共晶+三元共晶
二元合金相图
第二章二元合金相图 纯金属在工业上有一定的应用,通常强度不高,难以满足许多机器零件和工程结构件对力学性能提出的各种要求;尤其是在特殊环境中服役的零件,有许多特殊的性能要求,例如要求耐热、耐蚀、导磁、低膨胀等,纯金属更无法胜任,因此工业生产中广泛应用的金属材料是合金。合金的组织要比纯金属复杂,为了研究合金组织与性能之间的关系,就必须了解合金中各种组织的形成及变化规律。合金相图正是研究这些规律的有效工具。 一种金属元素同另一种或几种其它元素,通过熔化或其它方法结合在一起所形成的具有金属特性的物质叫做合金。其中组成合金的独立的、最基本的单元叫做组元。组元可以是金属、非金属元素或稳定化合物。由两个组元组成的合金称为二元合金,例如工程上常用的铁碳合金、铜镍合金、铝铜合金等。二元以上的合金称多元合金。合金的强度、硬度、耐磨性等机械性能比纯金属高许多,这正是合金的应用比纯金属广泛得多的原因。 合金相图是用图解的方法表示合金系中合金状态、温度和成分之间的关系。利用相图可以知道各种成分的合金在不同温度下有哪些相,各相的相对含量、成分以及温度变化时所可能发生的变化。掌握相图的分析和使用方法,有助于了解合金的组织状态和预测合金的性能,也可按要求来研究新的合金。在生产中,合金相图可作为制订铸造、锻造、焊接及热处理工艺的重要依据。 本章先介绍二元相图的一般知识,然后结合匀晶、共晶和包晶三种基本相图,讨论合金的凝固过程及得到的组织,使我们对合金的成分、组织与性能之间的关系有较系统的认识。 2.1 合金中的相及相图的建立 在金属或合金中,凡化学成分相同、晶体结构相同并有界面与其它部分分开的均匀组成部分叫做相。液态物质为液相,固态物质为固相。相与相之间的转变称为相变。在固态下,物质可以是单相的,也可以是由多相组成的。由数量、形态、大小和分布方式不同的各种相组成合金的组织。组织是指用肉眼或显微镜所观察到的材料的微观形貌。由不同组织构成的材料具有不同的性能。如果合金仅由一个相组成,称为单相合金;如果合金由二个或二个以上的不同相所构成则称为多相合金。如含30%Zn的铜锌合金的组织由α相单相组成;含38%Zn的铜锌合金的组织由α和β相双相组成。这两种合金的机械性能大不相同。 合金中有两类基本相:固溶体和金属化合物。 2.1.1 固溶体与复杂结构的间隙化合物 2.1.1.1 固溶体 合金组元通过溶解形成一种成分和性能均匀的、 且结构与组元之一相同的固相称为固溶体。与固溶 体晶格相同的组元为溶剂,一般在合金中含量较多; 另一组元为溶质,含量较少。固溶体用α、β、γ等 符号表示。A、B组元组成的固溶体也可表示为A (B),其中A为溶剂,B为溶质。例如铜锌合金中 锌溶入铜中形成的固溶体一般用α表示,亦可表示 为Cu(Zn)。图2.1 置换与间隙固溶体示意图 ⑴固溶体的分类 ①按溶质原子在溶剂晶格中的位置(如图2.1)分为:
三元系相图绘制
实验三组分相图的绘制 一实验目的 绘制苯一醋酸一水体系的互溶度相图。为了绘制相图就需通过实验获得平衡时,各相间的组成及二相的连结线。即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的成分。但体系达到平衡的时间,可以相差很大。对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡;对于一些难溶的盐,则需要相当长的时间,如几个昼夜。由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后把它移放在温度较低的恒温槽中,令其结晶,加速达到平衡。另外摇动、搅拌、加大相界面也能加快各相间扩散速度,加速达到平衡。由于在不同温度时的溶解度不同,所以体系所处的温度应该保持不变。 二实验原理 水和苯的互溶度极小,而醋酸却与水和苯互溶,在水和苯组成的二相混合物中加入醋酸,能增大水和苯之间的互溶度,醋酸增多,互溶度增大。当加入醋酸到达某一定数量时,水和苯能完全互溶。这时原来二相组成的混合体系由浑变清。在温度恒定的条件下,使二相体系变成均相所需要的醋酸量,决定于原来混合物中水和苯的比例。同样,把水加到苯和醋酸组成的均相混合物中时,当水达到一定的数量,原来均相体系要分成水相和苯相的二相混合物,体系由清变浑。使体系变成二相所加水的量,由苯和醋酸混合物的起始成分决定。因此利用体系在相变化时的浑浊和清亮现象的出现,可以判断体系中各组分间互溶度的大小。一般由清变到浑,肉眼较易分辨。所以本实验采用由均相样品加人第三物质而变成二相的方法,测定二相间的相互溶解度。 当二相共存并且达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连结线。 一般用等边三角形的方法表示三元相图(图1)。等边三角形的三个顶点各代表纯组分;三角形三条边AB、BC、CA分别代表A和B、B和C、C和A所组成的二组分的组成;而三角形内任何一点表示三组分的组成。 例如图1-1中的P点,其组成可表示如下:经P点作平行于三角形三边的直线,并交三边于a、b、c三点。若将三边均分成100等分,则P点的A、B、C组成分别为: A%=Cb,B%=Ac,C%=Ba 对共轭溶液的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC则不溶或部分互溶的相图,如图1-2所示。图中EK1K2K3DL3L2L1F是互溶度曲线,K1L1、K2L2等是连结线。互溶度曲线下面是两相区,上面是一相区。 图1-1等边三角形法表示三元相图图1-2共轭溶液的三元相图
三元相图的绘制(氯仿、盐酸、水)
基 础 化 学 实 验 实验 三相图的绘制——O H HCl CHCl 23--体系
三元相图的绘制 本实验是综合性实验。其综合性体现在以下几个方面: 1.实验内容以及相关知识的综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。 2.运用实验方法和操作的综合 本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。本实验中滴定终点的判断,不同于分析化学中的大多数滴定。本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。 一.实验目的 1. 掌握相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。 二.实验原理 三组分体系K = 3,根据相律: f = K–φ+2 = 5–ф 式中ф为相数。恒定温度和压力时: f = 3–φ 当:φ= 1 则: f = 2 因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。一般用等边三角形的方法表示三元相图。 对共轭溶液的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC则不溶或部分互溶的相图,如图5-1所示。图中EK1K2K3DL3L2L1F是互溶度曲线;K1L1,K2L2是连结线。互溶度曲线下面是两相区,上面是一相区。 共轭溶液的三元相图(A:醋酸;B:水;C:氯仿) 三.实验准备
三组分体系相图绘制.doc
实验八三组分体系等温相图的绘制 一、目的要求 1. 熟悉相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制相图的基本原理。 二、实验原理 对于三组分体系,当处于恒温恒压条件时,根据相律,其自由度f*为:f*=3-Φ式中,Φ为体系的相数。体系最大条件自由度f*max=3-1=2,因此,浓度变量最多只有两个,可用平面图表示体系状态和组成间的关系,通常是用等边三角形坐标表示,称之为三元相图。如图2-8-1所示。 等边三角形的三个顶点分别表示纯物A、B、C,三条边AB、BC、CA 分别表示A和B、B和C、C和A所组成的二组分体系的组成,三角形内任何一点都表示三组分体系的组成。图2-8-1中, P点的组成表示如下:经P点作平行于三角形三边的直线,并交三边于a、b、c三点。若将三边均分成100等份,则P点的A、B、C组成分别为:A%=Pa=Cb,B%=Pb=Ac,C%=Pc=Ba。
2 苯-醋酸-水是属于具有一对共轭溶液的三液体体系,即三组分中二对液体A和B,A和C完全互溶,而另一对液体B和C只能有限度的混溶,其相图如图2-8-2所示。 图2-8-1 等边三角形法表示三元相图图2-8-2 共轭溶液的三元相图图2-8-2中,E、K2、K1、P、L1、L2、F点构成溶解度曲线,K1L1和K2L2是连结线。溶解度曲线内是两相区,即一层是苯在水中的饱和溶液,另一层是水在苯中的饱和溶液。曲线外是单相区。因此,利用体系在相变化时出现的清浊现象,可以判断体系中各组分间互溶度的大小。一般来说,溶液由清变浑时,肉眼较易分辨。所以本实验是用向均相的苯-醋酸体系中滴加水使之变成二相混合物的方法,确定二相间的相互溶解度。 三、仪器试剂 具塞锥形瓶(100mL,2只、25mL,4只);酸式滴定管(20mL,1支);碱式滴定管(50mL,1支);移液管(1mL,1支、2mL,1支);刻度移液管(10mL,1支、20mL,1支);锥形瓶(150mL,2只)。
[VIP专享]铋一铅一锡三元系相图
实验五三元合金的显微组织 (Microstructure of Ternary Alloys) 实验学时:1 实验类型:综合 前修课程名称:《材料科学导论》 适用专业:材料科学与工程 一、实验目的 1.熟悉铋一铅一锡三元系相图和典型合金的显微组织。 2.了解三元合金的显微组织与其三元相图的关系。 二、概述 三元相图可以帮助我们分析三元合金的平衡凝固过程及凝固后的显微组织。对于铸锭和铸件,如果凝固时的冷却速率较小(如砂模铸造),也可借助相图分析其凝固过程和凝固后的显微组织。 下图为铋一铅一锡三元相图的液相面投影图的示意。 图中Bi、Pb、Sn分别代表纯组元铋、铅、锡;(Bi)、(Pb)、(Sn)分别代表以铋、铅、锡为溶剂的固溶体;(β)代表以Bi--Pb二元系中的β相为溶剂的固溶体。 为帮助了解铋一铅一锡三元相图,下面给出该三元相图各边的二元相图简图。图中(Bi)、(Pb)、(Sn)分别代表各二元系中以铋、铅、锡为溶剂的固溶体。
由上图可知,各二元系在液态时均为无限互溶,但在固态则为有限溶解,在铅一铋二元系中还出现了中间相β。在锡一铋二元系中,有一个共晶转变L→(Sn)+(Bi),转变温度为138.5℃。在铅一铋二元系中有一个包晶转变和一个共晶转变,包晶转变温度为184℃,反应式为L+(Pb)→β;共晶转变温度为125℃,反应式为L→β+(Bi)。在铅一锡二元系中,有一个共晶转变L→(Pb)+(Sn),转变温度为188℃。各二元系中的三相平衡都要进入三元系,成为三元系中的三相平衡。根据相律,三元系中三相平衡的自由度数等于1,因而是在一个温度范围内进行的。当降至某一定温度时,这些三相平衡将参与四相反应。 由液相面投影图可知,在铋一铅一锡三元系中存在两个四相平衡,一是在P点发生的四相包共晶反应,反应式为L+(Pb)→β+(Sn);另一个是在E点发生的四相共晶反应,反应式为L→(Bi)+β+(Sn)。根据相律,三元系中四相平衡的自由度数等于零,因而是一个恒温转变。转变过程中,参加反应的各相成分不变,温度恒定。 根据合金成分在三元相图投影图上的位置,可以分析合金的平衡凝固过程并预计凝固后的组织组成物。下面举例说明。 成分在E点的合金自液态进行凝固时,将直接进人四相平衡,发生四相共晶反应,反应式为L→(Bi)+β+(Sn),这是一个恒温转变,转变温度为96℃,凝固后的组织为(Bi) +β+(Sn)三相共晶体。 成分在e1E线上的合金凝固时,先进行三相共晶反应,反应式为L→(Bi)+β,生成两相共晶体(Bi)+β。这个三相反应是在一个温度范围内进行的。当温度降到E点(96℃)时,剩余的液体将进行四相共晶反应L→(Bi)+β+(Sn),生成三相共晶体(Bi)+β+(Sn)。因此,e1E线上的合金(不包括e1点和E点)凝固后,其组织组成物为两相共晶体(Bi)+β和三相共晶体β+(Bi)+(Sn)。 若忽略固态下铅、锡在铋中很小的溶解度,则可把Bi点和E点联成直线。成分在BiE线上的合金凝固时,先由液相生成初生晶体(Bi),由于液相成分不能进入三相平衡区,因而没
三组分液-液系统相图的绘制
三组分液-液系统相图的绘制 一、实验目的 1. 熟悉相律,掌握用三角形坐标表示三组分体系相图。 2. 用溶解度法作出苯-乙酸-水体系的相图。 二、实验原理 对于三组分体系C=3,当处于恒温恒压条件时,根据相律,其自由度*f为: * =3 f- P 式中,P为体系的相数。体系最大条件自由度max * f=3-1=2,因此,浓度变量最多只有两个,可用平面图表示体系状态和组成间的关系,通常是用等边三角形坐标表示,称之为三元相图。如图2-6所示。等边三角形的三个顶点分别表示纯物质A、B、C,三条边AB、BC、CA分别表示A和B、B和C、C和A所组成的二组分体系的组成,三角形内任何一点都表示三组分体系的组成。图2-6中,P点的组成表示如下: 经P点作平行于三角形三边的直线,并交三边于a、b、c三点。若将三边均分成100等份,则P点的A、B、C组成分别为:A%=Pa=Cb,B%=Pb=Ac,C%=Pc=Ba。 苯-乙酸-水是属于具有一对共轭溶液的三液体体系,即三组分中二对液体A和B,A和C完全互溶,而另一对液体B和C只能有限度的混溶,其相图如图2-7所示。
图2中,E、K2、K1、P、L1、L2、F点构成溶解度曲线,K1L1和K2L2是连结线。溶解度曲线内是两相区,即一层是苯在水中的饱和溶液,另一层是水在苯中的饱和溶液。曲线外是单相区。因此,利用体系在相变化时出现的清浊现象,可以判断体系中各组分间互溶度的大小。一般来说,溶液由清变浑时,肉眼较易分辨。所以本实验是用向均相的苯-乙酸体系中滴加水使之变成二相混合物的方法,确定二相间的相互溶解度。 三、仪器药品 仪器:具塞锥形瓶(100mL)1只;酸式滴定管(20mL)1只;移液管(1mL、2mL)各1只;刻度移液管(10mL)1只。 药品:冰乙酸(AR.);苯(AR.);去离子水等。 四、实验步骤 1. 测定互溶度曲线 在洁净的酸式滴定管内装水,用移液管移取10.00mL苯及2.00mL 醋酸,置于干燥的100mL具塞锥形瓶中,然后在不停地摇动下慢慢地滴加水,至溶液由清变浑时,即为终点,记下水的体积。向此瓶中再图1 等边三角形表示三元相图2 共轭溶液的三元相图
四元系统相图简介
四元系统相图结构简介 摘要:相图在化学工程的各方面均有重要的应用,随着成分的增加,相图也变得越来越复杂,以一下简单介绍一下四元系统相图的结构 关键词:四元系统相图结构 正文: 一、四元系统的浓度表示法 四元系统具有四个独立组元(即C=4),如同分析二元和三元系统一样,对于大多数凝聚系统,可以不考虑压力这一变量。于是,四元系统的相律有如下形式: F=5-φ 如φ=1 则F=4 ;φ=5 则F=0 可见相数最多不超过5,自由度最大不超过4。自由度为4,表明有四个独立变数,即温度和组成中三个独立组元的百分含量,因此,用平面正三角形表示四元体系的浓度关系已不可能,必须用正四面体来表示。这种四面体称为浓度正四面体。第四个独立组元的百分含量可由相图得出。 四元系统中的任一组成,在浓度正四面体中都能找到对应的一点;或者相反地,在浓度正四面体中任一点都能找到其对应的四元 系统的组成。如图所示正四面体的每条 边长定为100%,正四面体的各个定点 表示纯独立组元的组成,各条边表示二 元系统的组成;各个等边三角形表示三 元系统的组成,正四面体内的任何一点 对应于四元系统的组成;如果要读出图 中某点(如M点)所含各组元的百分含 量,可通过此点作平行于三个面的平行 面于三条棱向交,其截距B M,C M,D M图(1)四元系统的浓度表示法 分别表示M点所含的B、C、D组元的含量,第四组元A的含量A M可以从100-B M-C M-D M计算
得到。 在这种浓度正四面体内,和三元系统的浓度正三角形类似,也存在相应的几何关系,即等比例规则和等含量规则。如通过四面体任一顶点作任意直线,在这一直线上的各组成点皆有相同比例的其它三个绍分,离顶点愈远,顶点组分的含量愈少;通过四面体某棱的平面,在这一平面上的各组成点,另外两组分的含量比例不变,平行于四面体某个面的平面上的各点,其第四组分的百分含量不变。 通过以上叙述可以总结出初,浓度正四面体的几点性质如下: (1)与正四面体某一面平行的平面上任何一点的组成,所含其对面顶角的组元质量分数不变; (2)通过以正四面体某一棱为轴作的平面上任意点的组成,含不在此轴上的另两个组元之比值不变; (3)通过正四面体的任一顶角向其对面正三角形所作的直线上任何点,其所含的其余三个顶角组分含量之比不变; (4)通过正四面体内的任意一点作平行于任意一棱的平行线,可以确定各组分的浓度。 上述浓度正四面体的性质很易由几何关系求证。 二、四元系统空间图 具有一个最低共熔点的最简单的四元 系统立体图(又称空间图或空间状态图)如 图(2)所示。正四面体的四个顶点A、B、 C、D分别表示四个纯独立组元,六条棱分 别表示六个二元系统,四个等边三角形分 别表示四个三元系统.正四面体内部表示A —B—C—D四元系统。E AB、E AC、E AD、 E BC、E BD、E CD为二元系统的最低共熔点, E ABC、E ABD、E ACD、E BCD为三元系统的最 低共熔点,E为四元系统的最低共熔点, 即四元系统中最低的一个共熔点。图(2)四元系统空间图如图(2)所示,整个四面体由四个初晶体构成,分别称为A、B、C、D的初晶体,每个初晶体出三个平面和三个曲面所围定,如A的初晶体为AE AB E ABD E AD、AE AB E ABC E AC、AE AC E ACD E AD三个平面和E AB E ABD EE ABC、E AB E ABC EE ACD、E AD E ABD EE ACD三个曲面所围定;在初晶体内固、液面相
三元相图的绘制详解
三元相图的绘制 本实验是综合性实验。其综合性体现在以下几个方面: 1.实验内容以及相关知识的综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。 2.运用实验方法和操作的综合 本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。本实验中滴定终点的判断,不同于分析化学中的大多数滴定。本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。 一.实验目的 1. 掌握相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。 二.实验原理 三组分体系K = 3,根据相律: f = K–φ+2 = 5–ф 式中ф为相数。恒定温度和压力时: f = 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。一般用等边三角形的方法表示三元相图。 在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:
图1 图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。三角形内任一点则表示三组分体系的组成。如点P 的组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液的三组分体系的相图如图2所示。该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。曲线DEFHIJKL为溶解度曲线。EI和DJ是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿)绘制溶解度曲线的方法有许多种,本实验采用的方法是:将将完全互溶的两组分(如氯仿和醋酸)按照一定的比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三. 实验准备 1. 仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2. 药品:冰醋酸,氯仿,NaOH溶液(0.2mol·mol–3),酚酞指示剂。
实验三 锡铅锑铋
实验三锡铅锑铋 一实验目的 1.了解锡铅锑铋的化合物的性质:氢氧化物的的酸碱性,低价化合物的还原性和高价化合的氧化性,硫化物和硫代酸盐。 2.了解锡铅锑铋的离子鉴定法。 二实验内容 1.锡和铅 (1)+2价的锡和铅的氢氧化物的酸碱性 +2价的锡和铅的氢氧化物沉淀均为白色,即可溶于酸也可溶于碱 图1 氢氧化亚锡白色沉淀图2 氢氧化亚锡沉淀加入盐酸后溶解(2)+2价锡的还原性和+4价铅的氧化性 1)SnCl2可以将HgCl2还原,
生成白色沉淀, 白色沉淀溶解。 2) 生成银白色沉淀,这也是Bi的离子鉴定 3) 图3 PbO2将MnSO4氧化(3)+2价锡和铅的硫化物的形成和性质 棕褐色沉淀
图4 a,SnS不溶于稀盐酸 b,SnS溶于浓盐酸,产生硫化氢气体 图5 c,不溶于碱 d,不溶于Na2S e,与Na2S2反应,沉淀溶解,生成硫代锡酸根 图6 2)硫化铅的性质
a,不溶于稀盐酸 b,溶于浓盐酸 c,具有还原性,可以与浓硝酸反应,有沉淀和气泡产生 图7 d,可溶于碱 e,与硫化钠不反应 (4)+2价铅的难溶盐的形成 铅盐多数都是难溶的,除了硝酸铅和醋酸铅。实验利用Pb2+与CrO42-反应生成黄色的PbCrO4沉淀以鉴定Pb2+或(CrO42-)。 2.锑和铋 (1)+3价锑和铋的氢氧化物的酸碱性 1)氢氧化锑的酸碱性 a,溶于碱
2)氢氧化铋的酸碱性 a,不溶于碱 b溶于酸 (2)+5价铋的化合物制备及其氧化性 1)制备 2Na2O2+Bi2O3=2NaBiO3↓+Na2O 2)+5价铋具有氧化性 5NaBiO3 + 2Mn2+ + 14H+ = 2MnO4- + 5Bi3+ + 5Na+ + 7H2O (3)+3价锑和铋的硫化物的形成和性质 1)硫化铋的性质 a,不溶于碱 b,与浓盐酸反应 c,与Na2S d, 与Na2S2不反应 (4)+3价锑和铋的鉴定 氯化锑被锡还原成锑金属,用于锑的鉴定 2Sb3++3Sn→2Sb+3Sn2+
三元相图的绘制详解
三元相图得绘制 本实验就就是综合性实验。其综合性体现在以下几个方面: 1、实验内容以及相关知识得综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其就就是在一般得实验中(比如分析化学实验、无机化学实验等)作图都就就是用得直角坐标体系,几乎没有用过三角坐标体系,因此该实验中得等边三角形作图法就具有独特得作用。这类相图得绘制不仅在相平衡得理论课中有重要意义,而且对化学实验室与化工厂中经常用到得萃取分离中具有重要得指导作用。 2、运用实验方法与操作得综合 本实验中涉及到多种基本实验操作与实验仪器(如电子天平、滴定管等)得使用。本实验中滴定终点得判断,不同于分析化学中得大多数滴定。本实验得滴定终点,就就是在本来可以互溶得澄清透明得单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定得终点,有助于学生掌握多种操作,例如取样得准确、滴定得准确、终点得判断准确等。 一、实验目得 1、掌握相律,掌握用三角形坐标表示三组分体系相图。 2、掌握用溶解度法绘制三组分相图得基本原理与实验方法。 二、实验原理 三组分体系K= 3,根据相律: f =K–φ+2=5–ф 式中ф为相数。恒定温度与压力时: f= 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系得状态与组成之间得关系,称为三元相图。一般用等边三角形得方法表示三元相图。 在萃取时,具有一对共轭溶液得三组分相图对确定合理得萃取条件极为重要。在定温定压下,三组分体系得状态与组分之间得关系通常可用等边三角形坐标表示,如图1所示:
图1图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A与B,B与C,C 与A所组成得二组分体系得组成。三角形内任一点则表示三组分体系得组成。如点P得组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液得三组分体系得相图如图2所示。该三液系中,A与B,及A与C完全互溶,而B与C部分互溶。曲线DEFHIJKL为溶解度曲线。EI与DJ就就是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿) 绘制溶解度曲线得方法有许多种,本实验采用得方法就就是:将将完全互溶得两组分(如氯仿与醋酸)按照一定得比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三、实验准备 1、仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2、药品:冰醋酸,氯仿,NaOH溶液(0、2mol·mol–3),酚酞指示剂。 四、操作要点(各实验步骤中得操作关键点) 1、因所测得体系中含有水得成分,所以玻璃器皿均需干燥。
三元相图
8.4 三元系相图简介(1) 8.4.1 三元相图概述 工业上使用的大多数材料是由两种以上组分构成的,例如陶瓷、合金钢、A BS塑料等等都是属于三元体系。即使有些二元体系,因为不可避免的原因,也会存在一些杂质,因而也构成三元甚至多元体系。在多元系统中,各组元之间的交互作用并非是加和性的,例如在二元系统中加入第三组元后,不仅改变了原有组元之间的溶解度,而且在某些情况下还可以发生新的转变,形成新相。加入第3组元或更多组元后,会使体系出现液相的温度大幅度降低,这对耐高温场合应用的材料,需要特别引起注意。因此,要全面了解和掌握材料的结构(或组织)、性能以及相应的加工工艺,除了使用二元相图外,还需要掌握和应用三元甚至多元相图。当然,三元相图是使用最多、最普遍的一类相图,虽然组分只比二元体系增加了一种,但是三元相图的复杂性远远超过二元相图,实际三元相图的测定与绘制非常困难,相图的分析和应用也更复杂。本节主要介绍三元相图的基本内容,三元相图的基本类型以及结合不同材料专业方向的实际相图的分析与应用将在各专业方向课程中讲授。 对于三元凝聚系统,F=?C –P + 1= 4 –P,当F = 0时,P = 4,即三元凝聚系统中可能存在的平衡共存的相数最多为4个。当P = 1时,F = 3,即系统的最大自由度为3。这3个自由度指温度和三个组分中的任意2个浓度。由于要描述三元系统的状态,需要三个独立变量,其完整的状态图应该是一个三坐标的立体图。与普通的三维坐标系不同,三元系统相图的状态图是以三角形为底,表示三组分的组成,垂直于底面的坐标表示温度,所以这个状态图是一个三方棱柱体,柱体内的任一点代表了某一组成在一定温度下的状态。但这样的立体图不便于应用,我们实际使用的是它的平面投影图。图8-35是一个最简单的具有低共熔点的三元系统相图立体状态图,图8-36是其在底面上的投影图。
锡银铋无铅焊锡之润溼性评估与微结构分析
錫銀鉍無鉛銲錫之潤溼性評估與微結構分析 在本研究中,自行熔煉三元錫銀鉍之銲錫,而其中添加於共晶錫銀成份的鉍元素主要的作用在於促進銲錫的潤溼性以及降低合金的熔點。自製銲錫的基本物理性質, 如: 熔點、熱膨脹係數、密度等均為量測分析之重點。而潤溼性部份的評估則藉由兩種不同的實驗方式來量測,一為wetting balance 方法;另一則為直接量測sessile drop 的接觸角。 在三元銲錫的微觀結構中發現,其非為單一相,而是由富錫相、富鉍相以及富銀相所組成的。此外,從DSC的分析結果得知,經由添加~5wt%鉍可使二元錫銀的熔點從221°C降低至215°C。 利用Pendant Drop 的方式量取液態銲錫的表面張力,結果顯示當鉍含量從 0 wt%增加至5.5 wt%(亦即銀含量減少),銲錫的表面張力值592 減低至530 dynes/cm。這應該由於在錫、銀、鉍中,鉍元素的表面張力最低而銀元素的表面張力則最高,所以鉍會降低銲錫之表面張力,反之,銀則會提高表面張力。在Sn-Ag/PtAg/Al2O3及 Sn-Ag/Cu/Al2O3系統中,量得之接觸角約為70°, 而在Sn-Ag-5.5Bi/PtAg/Al2O3及Sn-Ag-5.5Bi/Cu/Al2O3系統中,其接觸角則分別減小至40°及60°。實驗結果顯示,隨著鉍含量增加(0~5.5wt%),接觸角會隨之減小。 溫度對於潤溼性的影響也在本研究中加以討論。以共晶錫鉍系統而言,當溫度由179°C升高至240°C時,SnBi/ Cu/Al2O3與 SnBi/PtAg/Al2O3系統之接觸角從130°降低至60°~40°。由於在溫度升高時,銲錫的流動性也提高,銲錫可較自由的流動,接觸角會因此而降低。此外,溫度通常也具有降低表面張力的效果,此亦為增進潤溼性的原因之一。 在本研究中,除了利用wetting balance作接觸角的量測之外,還使用了另一台可直接量測sessile drop 接觸角之儀器。配合較錫/基板間接觸角量測之
熔融锡、铋及其二元合金的表面张力
第24卷专辑 V01.24 Spec.Issue 中国稀土学报 JOURNALOFTHECHINESERAREEARTHSOCIETY 2006年lO月 Oct.2006 熔融锡、铋及其二元合金的表面张力 李晶,王晓强,柯家骏,范建峰,袁章福掌 (中国科学院过程工程研究所,北京100080) ■耍?用静滴法测量了熔融锡、铋及其二元合金的表面张力。分析了随温度和氧分压的不同,表面张力的变化情况。实验结果表明,在较低的氧分压情况下,熔融纯金属锡和铋的表面张力随温度的升高呈线性减小的关系;但在氧分压较高的情况下,它们的表面张力先随温度的升高而增加,然后随温度的升高而减小。根据热力学原理分析解释了实验结果。在特定氧分压的情况下测量了sn-Bi(Xm=0.455)合金的表面张力,其值随温度的升高有增加的趋势,并分析了导致此结果的原因。 关键诃:表面张力;熔融锡;熔融铋;锡铋合金 中图分类号:TQ013文献标识码:A文章编号:1000-4343(2006).0190-04 表面张力是熔态金属重要的热物理参数之 一,对熔态金属的结晶、相变以及晶粒生长过程 都有很大影响,在冶炼、铸造和焊接等过程起着 重要作用,熔态金属的表面张力及其温度系数的 测定一直是金属热物性研究的一项重要内容。获 得可靠的表面张力数据,对含锡、铋的合金设计 与优化也具有重要的指导意义【l ̄3】。 特别是当前空间科学迅速发展,表面张力及 其温度系数则是空间条件下高性能金属材料制备 技术中的关键参数之一。在微重力条件下,温度是影响表面张力梯度引起的Marangoni对流的主要因素,熔态锡、铋及其合金的表面张力性质对研究熔态锡的Marangoni对流效应、推动空间材料科学的发展具有重要意义【4 ̄丌。 1实验 实验所用的高纯金属锡、铋及其合金(xsi=0.455)均制成圆柱体①3.5mm×3.5turn。实验使用的装置是自行开发的数字化静滴法表面张力测定仪(如图1所示),该装置主要由样品加热熔化系统、成像系统和图形处理计算系统组成,其特点是实验过程实现数字化,摄得照片直接传输到计算机中进行图像处理和计算,省去了传统静滴法实验中的洗相、扫描和手工取点计算的步骤,减少实验过程中人为因素,使实验过程更加客观。 图1静滴法测量表面张力的装置不意图 首先用标准钢球确定成像系统的放大倍数,再将实验试样放在洁净的高纯氧化铝垫片上送入加热炉管中心位置中,调整保持试样水平放置。升温到设定的温度熔化实验样品,恒温15min后进行摄像。摄像时要注意灯光光源的调节,以保证所摄图片的质量。实验摄得图像直接传输到计算机系统中进行图像处理、计算得到设定温度下的表面张力值。整个实验过程用氩气作保护气体,通过调节镁炉温度得到氩气中不同的氧分压(只)情况。 2结果与讨论 2.1熔融锡的表面张力随温度和氧分压的变化关系 在505K'-1023K温度范围内研究了表面张力 收稿日期:200斛17;修订日期:2006-4)6-11 基金项且:国家自然科学基金资助项目(50474043) 作者俺介:李晶(1979-),女,山东济南人,博士研究生 ?通讯联系.K(E-mail:yuanzld@home.ipe.∞.C11)
铋一铅一锡三元系相图
For personal use only in study and research; not for commercial use 实验五三元合金的显微组织 (Microstructure of Ternary Alloys) 实验学时:1 实验类型:综合 前修课程名称:《材料科学导论》 适用专业:材料科学与工程 一、实验目的 1.熟悉铋一铅一锡三元系相图和典型合金的显微组织。 2.了解三元合金的显微组织与其三元相图的关系。 二、概述 三元相图可以帮助我们分析三元合金的平衡凝固过程及凝固后的显微组织。对于铸锭和铸件,如果凝固时的冷却速率较小(如砂模铸造),也可借助相图分析其凝固过程和凝固后的显微组织。 下图为铋一铅一锡三元相图的液相面投影图的示意。 图中Bi、Pb、Sn分别代表纯组元铋、铅、锡;(Bi)、(Pb)、(Sn)分别代表以铋、铅、锡为溶剂的固溶体;(β)代表以Bi--Pb二元系中的β相为溶剂的固溶体。 为帮助了解铋一铅一锡三元相图,下面给出该三元相图各边的二元相图简图。图中(Bi)、(Pb)、(Sn)分别代表各二元系中以铋、铅、锡为溶剂的固溶体。
由上图可知,各二元系在液态时均为无限互溶,但在固态则为有限溶解,在铅一铋二元系中还出现了中间相β。在锡一铋二元系中,有一个共晶转变L→(Sn)+(Bi),转变温度为138.5℃。在铅一铋二元系中有一个包晶转变和一个共晶转变,包晶转变温度为184℃,反应式为L+(Pb)→β;共晶转变温度为125℃,反应式为L→β+(Bi)。在铅一锡二元系中,有一个共晶转变L→(Pb)+(Sn),转变温度为188℃。各二元系中的三相平衡都要进入三元系,成为三元系中的三相平衡。根据相律,三元系中三相平衡的自由度数等于1,因而是在一个温度范围内进行的。当降至某一定温度时,这些三相平衡将参与四相反应。 由液相面投影图可知,在铋一铅一锡三元系中存在两个四相平衡,一是在P点发生的四相包共晶反应,反应式为L+(Pb)→β+(Sn);另一个是在E点发生的四相共晶反应,反应式为L→(Bi)+β+(Sn)。根据相律,三元系中四相平衡的自由度数等于零,因而是一个恒温转变。转变过程中,参加反应的各相成分不变,温度恒定。 根据合金成分在三元相图投影图上的位置,可以分析合金的平衡凝固过程并预计凝固后的组织组成物。下面举例说明。 成分在E点的合金自液态进行凝固时,将直接进人四相平衡,发生四相共晶反应,反应式为L→(Bi)+β+(Sn),这是一个恒温转变,转变温度为96℃,凝固后的组织为(Bi)+β+(Sn)三相共晶体。 成分在e1E线上的合金凝固时,先进行三相共晶反应,反应式为L→(Bi)+β,生成两相共晶体(Bi)+β。这个三相反应是在一个温度范围内进行的。当温度降到E点(96℃)时,剩余的液体将进行四相共晶反应L→(Bi)+β+(Sn),生成三相共晶体(Bi)+β+(Sn)。因此,e1E线上的合金(不包括e1点和E点)凝固后,其组织组成物为两相共晶体(Bi)+β和三相共晶体β+(Bi)+(Sn)。 若忽略固态下铅、锡在铋中很小的溶解度,则可把Bi点和E点联成直线。成分在BiE线上的合金凝固时,先由液相生成初生晶体(Bi),由于液相成分不能进入三相平衡区,因而没有
二元合金相图的定义、作用及建立(精)
职业教育材料成型与控制技术专业教学资源库 金属材料与热处理课程 二元合金相图的定义、作 用及建立 主讲教师:张琳 西安航空职业技术学院
二元合金相图的定义、作用及建立合金的结晶同纯金属的结晶一样,也遵循形核与长大的基本规律。但由于合金成分中包含有两个以上的组元,其结晶过程除受温度影响外,还受到化学成分及组元间不同作用等因素的影响,故结晶过程比纯金属复杂。通常用合金相图来分析合金的结晶过程。 合金相图也称为平衡图或状态图。它是表示在平衡条件下(极其缓慢冷却)合金状态、成分和温度之间关系的图形。根据相图可以了解在平衡状态下不同成分合金在不同温度下所存在的相,还可以了解合金在缓慢加热和冷却过程中的相变规律。根据组元数, 相图分为二元相图、三元相图和多元相图,如图1所示。 (a) Fe-Fe3C二元相
(b ) 三元相图 图1 相图的分类 在生产实践中,相图是分析合金组织及变化规律的重要工具,也是确定热加工工艺的重要依据。它具有下列用途: 由材料的成分和温度预知平衡相; 材料的成分一定而温度发生变化时分析其他平衡相变化的规律; 估算平衡相的数量; 预测材料的组织和性能。 常压下,二元合金的结晶状态取决于温度和成分两个因素,所以二元合金相图一般用温度及成分组成的平面坐标系表示。二元合金相图建立的方法有热分析法、热膨胀法、金相分析法、磁性法、电阻法、X 射线晶体结构分析法等,其中最常用的是热分析法,图2为热分析法绘制的相图。 下面以Cu-Ni 合金为例,介绍利用热分析法建立二元合金相图的过程: (1)配制一系列不同成分的铜-镍合金:①Cu w =100%;②Cu w =80%,Ni w =20%;③Cu w =60%,Ni w =40%;④Cu w =40%,Ni w =60%;⑤Cu w =20%,
三组分体系等温相图的绘制
实验9 三组分体系等温相图的绘制 实验目的 1.绘制苯-乙酸-水三组分体系的相图。 2.学会用韦氏天平测密度的方法。 实验原理 对于三组分体系的自由度φφφ-=+-=+-=5232k f ,体系中相数最小是1,则最大自由度4=f ,即温度,压力和两个浓度。对于凝聚体系,压力对平衡的影响不大,可视压力恒定不变。若固定温度,则此时自由度2=f ,用平面图即可表示。通常所用的平面图是一个等边三角形。 如图9-1所示,三角形的三个顶点A ,B ,C 分别表示三个纯组分。三条边AB ,BC , C A 分别表示A 和B ,B 和C ,C 和A 所组成的二组分体系,在每条边的任一点表示相应的二组分体系的组成。在三角形内任意一点表示三组分体系的组成。如图中的P 点的组成可以通过P 点作平行于三条边的直线,分别交三条边于a ,b ,c 三点,Ac 的长度代表P 点的B 组分含量,Ba 的长度代表P 点C 组分的含量,Cb 的长度代表P 点A 组分的含量。P 点各组分的百分含量分别为W A %=Cb ,W B %=Ac ,W C %=Ba 。 图9-1 用等边三角形表示三元相图 图9-2 共轭溶液的三元相图 对于部分互溶的三种液体所组成的体系,三种液体之间互溶的情况可分为三类:① 一对液体部分互溶,② 两对液体部分互溶,③ 三对液体部分互溶。 苯-乙酸-水为一对液体部分互溶体系,其相图如图9-2所示。即A ,B ,C 三个组分中B 和C 部分互溶,而A 和B 及A 和C 则是完全互溶。若B 和C 所组成溶液的浓度在BE 和FC 之间时,这两个组分是可以完全互溶的。组成在E 、F 之间时溶液分为两层,一层是苯在水中的饱和溶液(E 点),另一层是水在苯中的饱和溶液(F 点),这对溶液称为共轭溶液。如果在E 、F 之间取任意一组成(注意此时体系分为二层),然后往此体系中逐渐滴加HAc ,由于醋酸在两层中分配的量不等,因此代表两层浓度的点的连线不一定和底边平行,如K 1L 1,K 2L 2等等;将这些连线称为连结线。如果向此体系中继续加入HAc ,使得水和苯的互溶度增加,达到D 点时体系完全互溶变为一相。将E K 2DL 1F 线称为溶解度曲线,曲线内为两相区,曲线外为单相区。这种具有一对液体部分互溶体系的相图对化工中多组分的分离极为重要。 实验用品 磨口锥形瓶(100mL ,250mL ),酸式滴定管,移液管(1mL ,2mL ,10mL ),韦氏天平,分液漏斗(125mL )。 苯、醋酸、NaOH (0.5mol·L -1),酚酞指示剂。 实验步骤 1.溶解度曲线的测定 在三个烘干的100mL 锥形瓶内按下列成分配制混合液。 第一瓶:0.2mL 苯+15mL 水 第二瓶:0.5mL 苯+11mL 水
三元相图的绘制
三元相图的绘制 Plotting the Phase Diagram of a Ternary system 本实验是综合性实验。其综合性体现在以下几个方面: 1.实验内容以及相关知识的综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。 2.运用实验方法和操作的综合 本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。本实验中滴定终点的判断,不同于分析化学中的大多数滴定。本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。 一.实验目的 1. 掌握相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。 二.实验原理 三组分体系K = 3,根据相律: f = K–φ+2 = 5–ф 式中ф为相数。恒定温度和压力时: f = 3–φ 当:φ= 1 则: f = 2 因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。一般用等边三角形的方法表示三元相图。 对共轭溶液的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC则不溶或部分互溶的相图,如图5-1所示。图中EK1K2K3DL3L2L1F是互溶度曲线;K1L1,K2L2是连结线。互溶度曲线下面是两相区,上面是一相区。 图5-1共轭溶液的三元相图(A:醋酸;B:水;C:氯仿) 三. 实验准备 1. 仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2. 药品:冰醋酸,氯仿,NaOH溶液(0.2mol·mol–3),酚酞指示剂。 四.操作要点(各实验步骤中的操作关键点)
