燃烧法制备SrAl2O4-Eu,Dy超长余辉发光材料实验报告

中南民族大学
实验报告
实验课名称:化学综合实验指导老师:唐万军
学生姓名:专业:班级:学号:
实验名称:燃烧法制备SrAl2O4:Eu,Dy超长余辉发光材料
实验日期:组别:实验成绩:
一、目的要求
1、了解稀土掺杂铝酸盐长余辉材料的合成方法与应用领域。
2、设计实验方案,采用燃烧法合成SrAl2O4:Eu2+,Dy3+,测试其发光特性。
3、学会使用LS-55光度计和屏幕亮度计,根据X射线粉末衍射谱图,分析鉴定多晶样品的物相。
二、基本原理
长余辉发光材料也被称作蓄光材料,或者夜光材料,指的是在自然光或其它人造光源照射下能够存储外界光辐照的能量,然后在某一温度下(指室温),缓慢地以可见光的形式释放这些存储能量的光致发光材料。
20 世纪90 年代以来,开发的以碱土铝酸盐为基质的稀土长余辉发光材料, 以其优异的长余辉发光性能,引起了人们对长余辉发光材料的广泛关注。目前稀土离子掺杂的碱土铝(硅)酸盐长余辉材料已进入实用阶段。国内较大的生产厂家有大连路明、济南伦博、重庆上游等。市场上可见的产品除了初级的荧光粉外,主要有夜光标牌、夜光油漆、夜光塑料、夜光胶带、夜光陶瓷、夜光纤维等, 主要用于暗环境下的弱光指示照明和工艺美术品等。随着长余辉材料的形态从粉末扩展至玻璃、单晶、薄膜和玻璃陶瓷,对长余辉材料应用的探讨也从弱光照明、指示等扩展到信息存储、高能射线探测等领域。长余辉材料受到人们越来越多的重视。
从基质成分的角度划分,目前长余辉发光材料主要包括硫化物型、碱土铝酸盐型、硅酸盐型及其它基质型长余辉发光材料。不同长余辉发光材料的发光性能见表1。
表1 不同长余辉发光材料的发光性能
发光材料发光颜色发光谱峰波长/nm 余辉时间/min
BaAl2O4:Eu,Dy 蓝绿色496 120
CaAl2O4:Eu,Nd 蓝紫色446 1000
Sr4Al14O25:Eu,Dy 蓝绿色490 2000
SrAl2O4:Eu,Dy 黄绿色520 4000
Sr2MgSi2O7:Eu,Dy 蓝色469 2000
Y2O2S:Eu3+,Ti4+,Mg2+红色626 500
CaTiO3:Pr3+红色613 40
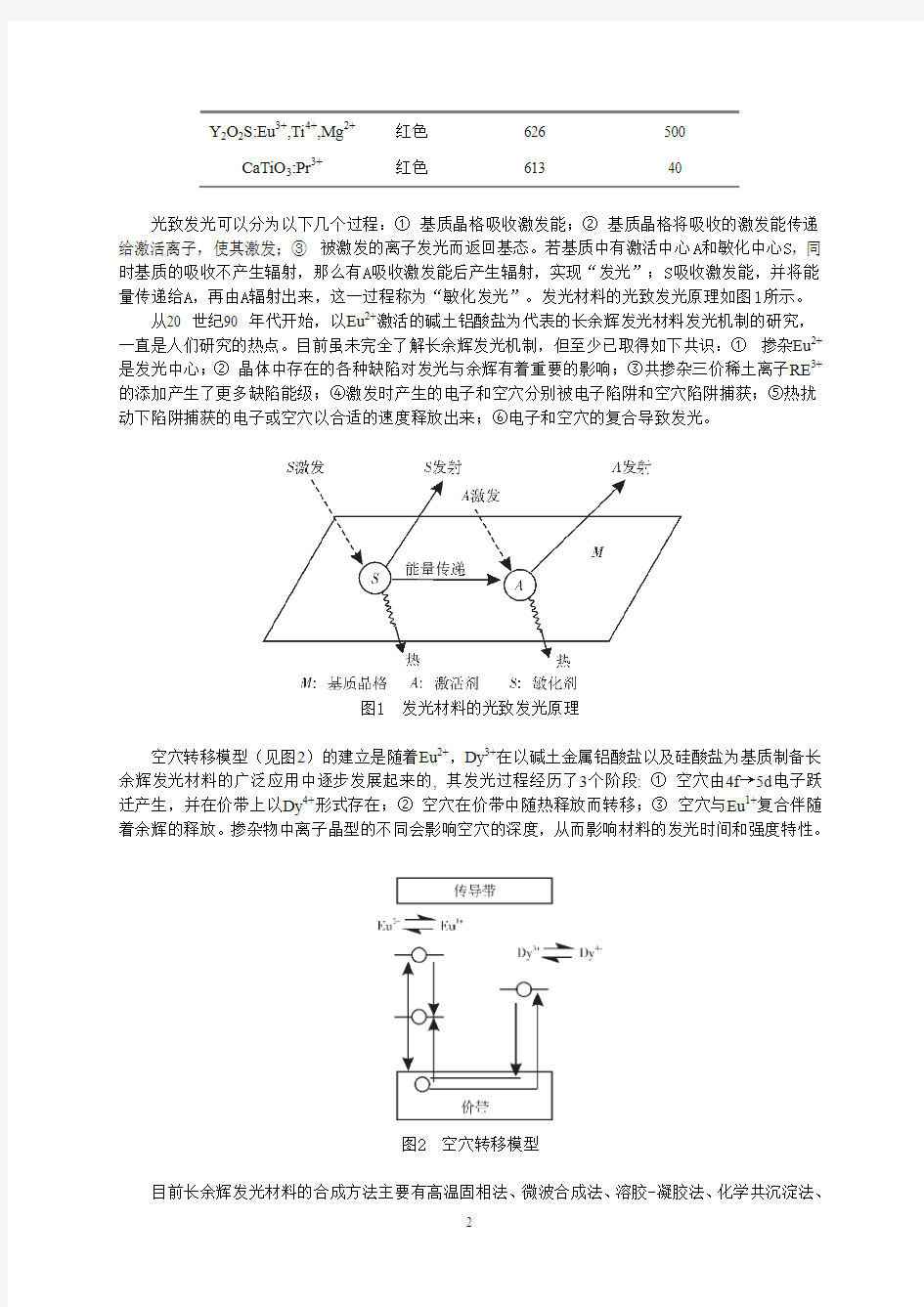
光致发光可以分为以下几个过程:①基质晶格吸收激发能;②基质晶格将吸收的激发能传递给激活离子,使其激发;③被激发的离子发光而返回基态。若基质中有激活中心A和敏化中心S,同时基质的吸收不产生辐射,那么有A吸收激发能后产生辐射,实现“发光”;S吸收激发能,并将能量传递给A,再由A辐射出来,这一过程称为“敏化发光”。发光材料的光致发光原理如图1所示。
从20 世纪90 年代开始,以Eu2+激活的碱土铝酸盐为代表的长余辉发光材料发光机制的研究,一直是人们研究的热点。目前虽未完全了解长余辉发光机制,但至少已取得如下共识:①掺杂Eu2+是发光中心;②晶体中存在的各种缺陷对发光与余辉有着重要的影响;③共掺杂三价稀土离子RE3+的添加产生了更多缺陷能级;④激发时产生的电子和空穴分别被电子陷阱和空穴陷阱捕获;⑤热扰动下陷阱捕获的电子或空穴以合适的速度释放出来;⑥电子和空穴的复合导致发光。
图1 发光材料的光致发光原理
空穴转移模型(见图2)的建立是随着Eu2+,Dy3+在以碱土金属铝酸盐以及硅酸盐为基质制备长余辉发光材料的广泛应用中逐步发展起来的, 其发光过程经历了3个阶段: ①空穴由4f→5d电子跃迁产生,并在价带上以Dy4+形式存在;②空穴在价带中随热释放而转移;③空穴与Eu1+复合伴随着余辉的释放。掺杂物中离子晶型的不同会影响空穴的深度,从而影响材料的发光时间和强度特性。
图2 空穴转移模型
燃烧法、水热合成法等,各自特点见表2。
SrAl 2O 4:Eu 2+,Dy 3+是一种最常见的长余辉发光材料,广泛应用于各种荧光粉和夜视显示。燃烧法(Combustion Method )是用金属硝酸盐和有机还原剂的混合水溶液,在较低的温度下燃烧,发生氧化还原反应来制备长余辉发光材料。本实验以金属硝酸盐为氧化剂,尿素为还原剂,在一定温度下可以发生爆炸性燃烧反应:
222422223323CO 3
20
O H 394N 332O SrAl )CO(NH 320O H 9)2Al(NO )Sr(NO +++→+
?+ 通过控制燃烧温度、氧化剂和还原剂配比可以实现氧化性气氛或还原性气氛,可以直接将Eu 3+
还原为Eu 2+,从而得到SrAl 2O 4:Eu 2+,Dy 3+长余辉发光材料。
表2 长余辉磷光体的合成方法优点和缺点
制备方法 优点
缺点
高温固相法
制得粉体稳定性好, 发光和余辉性能较高
经球磨处理, 晶体完整性受破坏, 发光亮度和效率降低
微波合成法
粉体粒径较小, 组分均匀分布, 发光
效率高
易生成杂相, 合成温度不易控制 溶胶- 凝胶法
组分均匀性好, 烧结温度低, 晶粒尺
寸易控制, 发光强度较高
原料成本高, 反应周期长, 合成所用的醇盐对人体有害
沉淀法
反应温度低, 样品纯度高, 晶粒尺寸
易控制, 发光强度较好
要求各组分具有相同或相似的水解或沉淀条件, 制备多组分时存在的问题较多 燃烧法
所得样品疏松, 易粉碎, 不需要气氛
保护, 节能
因添加有机物载体, 需要废气排放及产品的后处理较复杂
水热法
合成温度低, 制备条件温和, 体系稳
定 发光强度较低, 制备工艺技术复杂, 影响因素较多
三、仪器与试剂 电子天平 1台 马弗炉 1台 LS-55荧光光度计
1台 三色荧光灯
1台 Bruker D8多晶X 射线衍射仪 1台 ST-86LA 屏幕亮度计 1台 100mL 陶瓷坩埚
6只
100mL 烧杯
6只 Al(NO 3)3·9H 2O (分子量:375.13) 分析纯 Sr(NO 3)2(分子量:211.63) 分析纯 尿素 (分子量:60.06)
分析纯
硼酸 (分子量:61.83)
分析纯
Eu 3+硝酸溶液(10-4mol·L -1,已备) 光谱纯 Dy 3+硝酸溶液(10-4mol·L -1,已备) 光谱纯
四、实验步骤
1、设计方案(每一大组任选一个方案,其中一个小组选定一个实验条件)
(1) 以0.005mol 的Sr 0.98Al 2O 4:0.01Eu, 0.01Dy 为目标产物,助熔剂硼酸为20%,计算所需试剂的用量。分别以燃料/氧化剂过量0、50%、100%、150%、200%、250%和300%,计算所需燃料尿素的
试剂名称用量试剂名称用量备注
Sr(NO3)2 1.0370g Eu3+溶液0.5ml
Al(NO3)3·9H2O 3.7513g Dy3+溶液0.5ml
硼酸0.06183g
尿素过量/% 0 50 100 150 200 250 300
用量/g 2.002 3.003 4.004 5.005 6.006 7.007 8.008
(2) 以0.005mol 的Sr0.98Al2O4:0.01Eu, 0.01Dy为目标产物,燃料/氧化剂过量200%,计算所需试剂的用量。分别以助熔剂硼酸为0、5%、10%、15%、20%、30%和40%,计算所需助熔剂的用量。
试剂名称用量试剂名称用量备注
Sr(NO3)2 1.0370g Eu3+溶液0.5ml
Al(NO3)3·9H2O 3.7513g Dy3+溶液0.5ml
尿素 6.006g
硼酸/% 0 5 10 15 20 30 40
用量/mg 0 15.46 30.92 46.38 61.84 92.76 123.68
(3) 以0.005mol 的Sr0.98Al2O 4:0.01Eu, x Dy为目标产物,助熔剂硼酸为20%,燃料/氧化剂过量200%,改变Dy的用量为0、0.005、0.01、0.015、0.02、0.025和0.03,计算所需试剂的用量。
试剂名称用量试剂名称用量备注
Sr(NO3)2 1.031487g Eu3+溶液0.5ml
Al(NO3)3·9H2O 3.7513g 硼酸0.06183g
尿素 4.004g
Dy3+0 0.005 0.01 0.015 0.02 0.025 0.03
用量/mL 0 0.25 0.5 0.75 1.0 1.25 1.5
(4) 以0.005mol 的Sr0.98Al x O1+1.5x:0.01Eu, 0.01Dy为目标产物,燃料/氧化剂过量200%,助熔剂硼酸为20%,计算所需试剂的用量。Al/Sr组成,其中x = 1.6、2、3.5、4、6、10.6和12。
试剂名称用量试剂名称用量备注
硼酸0.06183g Eu3+溶液1ml
尿素 4.004g Dy3+溶液1ml
Al(NO)·9H O 3.7513g
组成/x 1.6 2 3.5 4 6 10.6 12
Sr(NO3)2/g 1.32268 1.05815 0.60466 0.52908 0.35272 0.19965 0.17636
2、燃烧反应将称取的各种试剂在烧杯中用少量蒸馏水溶解,搅拌均匀,转移至坩埚中。马弗炉升温至600℃,恒温10min钟后,将坩埚迅速移至马弗炉中,关上炉门,观察现象。马弗炉有白烟冒出后约五分钟,马弗炉温度返回至600℃后约1min,打开炉门,取出坩埚,在防火板上冷却至室温。观察坩埚中的样品在荧光灯下的发光情况并拍摄照片。将产物研磨成粉末装进样品袋保存。
3、样品表征XRD: Bruker D8多晶X射线衍射仪;扫描范围:10-80o
4、磷光测定条件:LS-55荧光光度计;扫描范围:350—650nm;入射光狭缝宽度:5nm;发生光狭缝宽度:15nm;激发波长:325nm;发射波长:520nm
余辉时间测定:紫外灯照射10min后记录亮度-时间曲线。
五.数据处理
表征结果
图1 X射线衍射图谱
图2 尿素过量—磷光分析图谱
图3 硼酸—磷光分析图谱
图4 Dy的用量—磷光分析图谱
图5 Al_Sr组成—磷光分析图谱
图6 荧光灯照射下的产品发光图
六.结果讨论
1.图1为燃烧法制备的SrAl204:Eu2+,Dy3+发光材料粉体的X射线衍射图谱
由图可知,x=1.6;2;3.5;4时,产物的衍射图谱与a-SrAl2O4的PDF标准卡片(30--1275)对应得非常吻合.结果表明,SrAl2O4:Eu2+,DyS+发光粉体属于单斜晶系(Monoclinic),其晶格常数:a=0.8447 nm;b= 0.8816 nm ;c=0.5163 nm;β=93.420°。
2.图2为尿素过量—磷光分析图谱
由图可知磷光吸收的最高峰位置在510nm处,尿素过量200%时磷光吸收峰最高,发光强度最好。尿素用量过高或过低时发光强度都比较弱。
3.图3为不同用量的硼酸对应的产物—磷光分析图谱
由图可见,随着硼酸用量的增加,产物的磷光吸收峰逐渐增高,峰形逐渐变好,磷光强度逐渐增大。
4.图4为Dy的用量对产物影响的Dy的用量—磷光分析图谱
由图可见,Dy的用量为0.01,0.025和0.03时,磷光吸收峰较高,峰形较好,磷光强度较大。
5.图5为Al_Sr组成—磷光分析图谱
由图可见,当x=2时,磷光吸收峰最高,峰形最好,说明此时发光强度最大,为最佳基质配比。6.图6为x=6时的产物磷光发光图
理论上此时的产物应该磷光发光极弱或无磷光现象,但图中依然可以观察到较强磷光。
可能影响SrAl2O4:Eu2+,Dy3+发光性能的主要因素有:
1、炉温
2、助熔剂用量H3BO3对磷光体发光亮度的影响试样中H3BO3的摩尔分数分别为0、0.05、0.10、
0.15、0 . 20、0. 30、0. 40、0. 60、1. 00, 在相同炉温等条件下用燃烧法合成磷光体。在前驱体溶液
相生成,便于稀土离子掺入晶格。硼酸用量对产物的晶相及余辉性能有重要影响。随着硼酸用量增加,杂质峰逐渐减弱,合成产物纯度升高。但是,硼酸含量过高会导致产物晶型混乱,有损产物余辉性能。
3、燃料用量用燃烧法合成SrO·x Al2O3:Eu2+,Dy3+长余辉材料时, 尿素既是反应的还原剂, 又是可燃物。可以通过改变尿素与硝酸盐的比值, 获得一系列不同温度的火焰, 从而合成出不同发光性能的磷光体。当尿素的加入量为理论加入量的2倍时,所制得发光体强度最大,粒度细小,燃烧产物具有较好的余辉性能。
4、基质Al/Sr组成在一定炉温( 600℃) 条件下, 稀土与硼酸的量保持不变, 尿素与硝酸盐的质量比固定为2, 改变Al/Sr 的摩尔比, 进行燃烧合成实验。当Al/Sr=2时为基质最佳配比,余辉性能最好。
5、激活离子Eu2+和辅助激活离子Dy3+的浓度随着n[Eu2+]/n[Dy3+]的比值逐渐增大,产物的余辉时间也逐渐增加,当n[Eu2+]/n[Dy3+]的比值为1:2时,燃烧产物的余辉时间最长。当n[Eu2+]/n[Dy3+]比值持续增大时,产物的余辉时间并不随着增加,反而有减少的趋势。而且Dy3+的量过大时,会导致合成产物的余辉消失。
6. 硝酸用量对产物的影响硝酸作为稀土溶剂,对产物的合成有较大影响。稀土溶解的越充分,在前躯体溶液中的扩散度就越好,强化产物的余辉性能。但是,过量硝酸会降低产物的纯度,不利于产物的合成。
综合结论采用燃烧法可以在较低炉温(600~620℃)下一次合成SrAl2O4:Eu2+,Dy3+长余辉发光材料。当n(尿素):n(硝酸盐)=12:1,硼酸摩尔分数为0.10%~0.12%,Eu2 +为0.2%,n[Eu2+]/n[Dy3+]=1:2,Al/Sr=2时,燃烧合成的产物具有稳定优良的余辉性能。
微纳米干粉体脉冲喷射燃烧法制备Y_2O_3_Eu_3_发光材料芯片
微纳米干粉体脉冲喷射燃烧法制备Y 2O3∶Eu3+ 发光材料芯片* 王 懿,侯丽雅,章维一 (南京理工大学机械工程学院,江苏南京210094) 摘 要: 采用基于微流体数字化技术的微纳米干粉 体脉冲喷射燃烧法制备了Y 2O3∶Eu3+发光材料芯 片,用紫外分析仪和荧光光谱仪对材料芯片进行了分析和表征。与组合液滴喷射法的间接作业不同,微纳米干粉体脉冲喷射燃烧法直接喷射原材料粉体进行材料芯片制备作业,无需配制溶液或悬浮液,简化了制备工艺流程、提高了材料芯片制备效率。 关键词: 组合材料学;发光材料;脉冲惯性力;粉体喷射;燃烧法 中图分类号: O482.31文献标识码:A文章编号:1001-9731(2010)11-2022-04 1 引 言 组合材料学(Combinatorial Materials Science)兴起于20世纪90年代中期[1-3],是组合方法与材料科学相结合而形成的一门新兴交叉学科,其目标是通过采用并行合成、高通量表征的研究策略,短时间内用有限步骤快速合成大量不同的样品,形成材料样品库(材料芯片)、并快速表征它们的性质,来实现新材料的高效筛选/优化。 发光材料是日常生活中不可缺少的材料,为了发展和推广高效、节能照明器具,迫切需要寻找具有高效、稳定、色纯度高等特点的新型发光材料。一般情况,材料工作者依靠经验和直觉,通过"炒菜法"或"试错法",采用一次一个组分的方法来寻找新型发光材料。这种研究模式由于周期长、成本高,难以满足社会高速发展的需求。 组合方法的运用有效促进了发光材料的开发,Sun等人采用溶液喷射技术制备了包含100个微型粉末样品的发光材料库[4];Wang等人采用四元物理掩膜与光刻相结合的技术制备了由1024个分立样品组成的薄膜样品库,并从中筛选出一种高效蓝色荧光复合材料Gd3Ga5O12/SiO2[5];Mordkovich等人采用二元及多元组分梯度技术制备样品库,发现并优化了4种低压阴极射线发光良好的ZnO基荧光粉[6];Chen等人拓展了组合液滴喷射合成技术的应用范围,以悬浮液为前驱体喷射合成的荧光材料库[7],但是悬浮液需要专用设备花费数小时制备[8];近年来,Gao等人采用组合溶液喷射法对平板显示技术(PDP/LED)所需的荧 光材料进行了研究[9-11]。这些材料芯片制备技术均是使用反应物的溶液点样和混合,挥发掉溶剂后再进行固相反应的间接作业,存在因反应物不同需寻找不同溶剂造成工作量大、甚至因溶解度过低溶液难配制等问题。 本文为提高材料芯片制备效率,采用基于微流体数字化技术的微纳米干粉体脉冲喷射燃烧法,进行Y2O3∶Eu3+发光材料芯片的制备实验研究,探索直接输送干粉体进行材料芯片合成的新方法。 2 原 理 2.1 微流体数字化技术 本课题研究起点是南京理工大学微系统研究室发明的、拥有自主知识产权的微流体数字化技术[12-14]。微流体数字化技术的原创技术特征如下:方法上以脉冲为微流动基本形态;以脉冲当地惯性力为主动力;以脉冲波形、频率、幅值、相位、波数、波序列为驱动-控制-扰动参量;装置上既无微可动件又无嵌入式微电路;以外部宏驱动器影响微流道内部流动。性能上:适用流体广,包括各种液体和粉体;流动分辨率高达飞升级;脉冲量规整、序列可控的数字化流动;可靠性高、抗固粒堵塞、气泡阻断;工作条件利于保持生物活性;结构简、成本低[13,14]。 2.2 微纳米干粉体脉冲喷射燃烧法 微纳米干粉体脉冲喷射燃烧法的材料芯片合成大致可分为两步:一是微量反应原料向微反应器的精确输送;二是微反应器中化学反应的控制。难点主要在第一步,而第二步则与传统的常规材料合成基本相同。微纳米干粉体脉冲喷射燃烧法采用微流体数字化技术输送微量粉体,之后在反应器内进行燃烧反应生成材料样品库。其输送特点为:直接使用原材料粉体,无需制备溶液或悬浮液。 3 Y2O3∶Eu3+发光材料芯片的制备 3.1 系统构成 本文以电磁铁为作动器搭建了微纳米干粉体脉冲喷射系统,通过撞击产生脉冲惯性力喷射微纳米干粉体至陶瓷点滴板各孔内,由脉冲频率和幅值控制喷射流量,之后经阵列燃烧[15]得到所需样品库。 220 22010年第11期(41)卷 *基金项目:国家自然科学基金资助项目(50975152);南京理工大学自主科研专项计划资助项目(2010GJPY006)收到初稿日期:2010-04-02收到修改稿日期:2010-09-15 通讯作者:侯丽雅 作者简介:王 懿 (1986-),男,安徽芜湖人,在读硕士,师承侯丽雅教授,从事组合材料芯片技术及应用研究。
发光材料的合成及发光材料制备技术(精)
1 02121289.9 一种有机电致发光材料及其应用 2 02134788. 3 稀土高分子光致发光材料及其合成方法 3 01124165.9 一种纳米级超长余辉硅铝复合盐类发光材料及其制备方法 4 01133301.4 电致发光材料包膜 5 02130973. 6 一种电致发光磷光材料及其应用 6 01136619.2 一种非放射性环保蓄能发光材料及其制备方法 7 02134210.5 含硒杂环化合物的聚合物及其在制备发光材料中的应用 8 02125386.2 一种合成长余辉发光材料的新方法 9 02155860.4 允许由给体转移有机材料以便在有机发光二极管器件内形成层的设备 10 02124569.X 亚甲基吡咯金属络合物、使用该络合物的发光元件材料以及发光元件 11 02132760.2 含有高可见发光效率的CdTe纳米晶透明聚合物体相材料的制备方法 12 01804068.3 发光元件材料和使用该材料的发光元件 13 99816847.5 光致发光的半导体材料 14 02124757.9 脂环式环氧化合物、其制造方法和组成物及发光二极管用密封材料 15 02135615.7 有机电致发光材料8-羟基喹啉铝的制备方法 16 01138882.X 超长余辉高亮度蓝紫色发光材料的制备方法 17 01138883.8 铝酸盐高亮度长余辉发光材料及其制备方法 18 02157031.0 用于转移有机材料以形成有机发光装置中的结构层的方法 19 03112784.3 纳米发光复合材料及其制备方法 20 03113677.X 含镉氧化物长余辉发光材料及其制备方法 21 02103614.4 基于纳米材料的发光气敏传感器及纳米材料的成膜工艺
蜡烛燃烧的实验报告
对蜡烛及其燃烧的探究 姓名:___班级:___第__组合作者:_____实验日期:__年_月_日
对蜡烛及其燃烧的探究的实验报告? ? 姓名:高唱????????????合作者:冯凌亢、古柏城、周全、杨松霖、邓皓? 班级:三(九)班??????日期:2007-8-26? ? 实验名称:对蜡烛及其燃烧的探究。? 实验目的:研究蜡烛在点燃前、燃着时、熄灭后三个阶段中所表现出的物理性质和化学性质。? 实验用品:蜡烛、玻璃杯、火柴、适量的水、适量的澄清石灰水? ? 备注:因为没有烧杯,故用玻璃杯替代,实验效果不变。? 步骤和方法? 现象? 结论? ①点燃前:观察蜡烛的颜色、状态、形状和硬度等,并嗅气味;从蜡烛上切下一块, 把它放入水中,观察它是否溶于水,是浮在水面还是沉入水底?说明蜡烛的密度比水小还是大。?? 1)?蜡烛呈白色,状态为固体,圆柱状,硬度较软,无气味。?2)?放入水中水中的部分蜡烛漂浮起来,且没有溶于。? 1.?蜡烛(实验中)呈白色,状态为固体,圆柱状,硬度较软,无气
味。?2.?蜡烛的密度比水小,且不溶于水。?②点燃时:点燃蜡烛?仔细观察蜡烛燃烧时发生了哪些变化,火焰分为几层?哪层最明亮?哪层最暗?取一根火柴梗,拿住一端迅速平放在火焰中,约1s后取出,观察并比较火柴梗在火焰的不同部位被烧焦的情况,说明火焰哪部分的温度最高,哪部分温度最低?分别在火焰上罩上一只干燥的小玻璃杯和一只用澄清石灰水润湿内壁小玻璃杯,仔细观察玻璃杯的内壁上分别有什么现象发生。推测出蜡烛燃烧生成什么物质?? 1)?火焰分为三层,最外层最亮,最内层最暗。?2)?平放入火焰中的火柴两端变黑,中间无明显变化,说明火焰的外焰温度最高,焰心温度最低。?3)?罩在火焰上的玻璃杯内壁有水雾生成。?4)?火焰使得玻璃杯壁上的澄清石灰水变混浊,产生了白色沉淀。? 1.?石蜡具有可燃性,其火焰 分为三层:外焰、内焰、焰心。其中外焰最亮,焰 心最暗。? 2.?外焰温度最高,加热效果最好;焰心温度最低,不宜用于加热。? 3.?蜡烛的燃烧生成了水和二氧化碳。? ③熄灭后:(3)熄灭蜡烛?观察有什么现象发生,用火柴点燃刚熄灭时的白烟,蜡烛能否继续燃?? 1)?蜡烛熄灭时,有白烟产 生,用燃着的火柴迅速靠近白烟,可使蜡烛重新被点燃。?? 1.?蜡烛熄灭时会产生漂浮 在空中的固态的石蜡小颗粒。它们是由固态石蜡在燃烧时融化后,再
纸张燃烧的制作方法
步骤1:首先建立一个720*576,长度为6秒的合成图像(comp),把它命名为“燃烧”。如图1。
步骤2:导入一段影片。此练习中导入heart.jpg。将heart拖动到合成图像中。按Ctrl+Alt+F,使图像与合成图像一样大。如图2。 步骤3:再建立一个720*576的名为“置换”的合成图像。建立一个和合成图像等大的固体层(solid),在该层上施加Fractal Noise效果(Effects/Render/Fractal Noise)。将contrast值设为205。在Transform卷展栏中取消“uniform scal
ing”的圈选,将高度缩放值设为200%(这样使火苗的长度增加,在原来的火球形状上产生更多的卷曲火舌)。如图3。
步骤4:在Fractal Noise的evolution项上,设定关键帧。0秒时为0,4秒时为旋转4圈。如图4。 接下来我们要使Fractal Noise产生向上的动画效果。 在分形噪波(Fractal Noise)的Transform项中的offset turbulence上,设定关键帧,0秒时值为360,288,4秒时为360,96。如图5。
把合成图像“置换”拖到合成图像“燃烧”中。关闭它的可视开关。(前面的小眼睛)。如图6。 步骤5:在合成图像“燃烧”中,创建一个720*576,名为“火焰”的固体层。在其上施加椭圆(Ellipse)效果(Effect/Rende r/Ellipse)。将Ellipse中的内圈颜色(inside color)设置为桔黄色(R255,G128,B0),外圈颜色(outer color)设为一种略深的桔黄色(R128,G64,B0)。柔和度(softness)设为0%。 在时间线窗口中,ellipse滤镜中选择高度(height),按下Shift+Alt+=,建立一个表达式。
燃烧法制备CaMoO4:Dy3+荧光粉
项目名称:燃烧法制备CaMoO4:Dy3+荧光粉 系别: 专业班级: 学号: 学生姓名: 指导老师: 时间: 2014年 12 月 30 日
材料专业综合设计实验报告 燃烧法制备CaMoO4:Dy3+荧光粉 1实验目的 1)熟悉和掌握CaMoO4:Dy3+材料制备工艺过程及原理及性能测试与结构表征; 2)理解共沉淀法工艺因素对材料性质与结构的影响; 3)培养学生的创新意识、创新能力、科学态度,使其具有较强动手实践能力、初步的科研开发能力和科技研究能力; 4)培养学生综合设计实验的能力,提高分析问题、解决问题和动手能力,为学生毕业后从事材料生产与检测奠定基础。 2 实验原理及步骤 2.1 概述 对稀土发光材料进行微/纳米级调控,使其具有一系列一般体相材料无法比拟的优异的物理化学性质和丰富的光谱性能,有望在传感器、光电器件、高分辨平板显示以及生物标识等多个领域存在广泛的潜在应用价值。一般来讲,微/纳米发光材料的性质及应用和它的晶体结构、化学组成、尺寸、形貌和维度等相关都很密切。只有精确地控制微/纳米材料的尺寸和形貌,才能使我们获得良好性能的发光材料。因此,调节和控制微/纳米发光材料的形貌,从而获得具有良好的发光性能的新材料,发展新应用,是目前科研工作的难点,也是重点。 半导体白色发光二极管(light emitting diodes,简称白光LED)作为一种新型固态照明器件,具有发光效率高、寿命长、体积小、反应速度快、稳定性好、无污染、节能环保等优点。目前比白炽灯省电80%,比荧光灯省电50%,被称为新一代照明光源。广泛应用于移动通讯.城市景观照明、汽车灯、交通信号灯、LCD 背光源、室内外普通照明等多种照明领域[1]。受到广泛关注,具有广阔的应用前景。但是目前的LED由蓝光和黄光组合得到白光,由于缺少红色光谱的成分,显色指数较低;因为红色荧光粉对调制白光的色温以及提高显色指数有重要作用。 为了获得稳定性高、发光强度高、发光效率高的红色荧光粉,本课题主要研究了钼酸盐红色荧光粉的燃烧法制备和性能表征,以钼酸钙为基质,以Eu3+为激活剂,研究了掺入Sr2+、Li+、Na+、K+时产物的荧光性质,通过不断调整原料的配比,寻求合成温度、反应时间等条件的最佳值,尝试不同的制备工艺,寻求最佳原料配比和最佳工艺条件,为适用于白光LED红色荧光粉的研究做出一定探索和贡献,促进白光LED的发展。 稀土发光材料的合成方法有传统高温固相法、溶胶-凝胶法、水热合成法、共沉淀法、燃烧法、微波辐射法等,其中高温固相法工艺较成熟,已经广泛应用。目前制备 CaMoO4:Dy3+的试验方法主要有高温固相法[2]沉淀法[3]溶胶-凝胶法[4] 而尚未见用燃烧法合成 CaMoO4:Dy3+的实验报到。 本实验采用燃烧法,燃烧合成 (Combustion Synthesis ,缩写 CS) ,也称自蔓延高温合成,是一高放热的化学体系经外部能量诱发局部化学反应(点燃),形成其前沿(燃烧波),使化学反应持续蔓延,直至整个反应体系,最后达到合成所需材料目的的技术 稀土掺杂的荧光材料历来是众多研究学者在发光领域关注的热点问题。由于其独特的电子构型和特殊的发光性质,使其在固态激光器,传感器,通讯,显示以及照明等领域具有广泛的应用。
发光材料制备方法
发光材料的制备方法 随着发光材料基质类型的不断发展,其制备方法也逐渐趋于多样化[7~10]针对各种基质的特点,相应发展出了溶胶-凝胶法、高温固相法、燃烧合成法、微波加热法、水热法、喷雾热解法、化学沉淀法、电弧法等制备技术。这些制备方法的基本原理有着显著的差别,适用性也有所不同,具有较强的针对性。 1、溶胶—凝胶法 溶胶一凝胶法(Sol-Gel)是低温合成材料的一种新工艺,它最早是用来合成玻璃的,但近十多年来,一直是玻璃陶瓷等先进材料合成技术研究的热点,其原理是将组成元素的金属无机或有机化合物作为先驱体,经过水解形成凝胶,这些凝胶经过烘干成为玻璃粉末并进行成型,再在较低温度下进行烧结,形成玻璃陶瓷。溶胶一凝胶法是应用前景非常广泛的合成方法。它是采用特定的材料前驱体在一定条件下水解,形成溶胶,然后经溶剂挥发及加热等处理,使溶胶转变成网状结构的凝胶,再经过适当的后处理工艺形成纳米材料的一种方法。 利用溶胶一凝胶法(Sol-Gel)制备发光材料时,把选好的基质材料制成溶液,配以激活剂、助溶剂等的有机化合物溶液或化合物的水溶液,混合均匀,溶液静化数小时后形成凝胶,经干燥、灼烧除去有机物后,再在一定气氛下烧结成产品,得到发光材料粉体。范恩荣[11]用溶胶一凝胶新工艺制备出硅酸锌、硅酸钙发光材料。 此方法制备发光材料具有均匀性好,烧结温度低,反应容易控制,材料的发光带窄,发光效率高等优点。但存在着要使用金属有机溶剂,成本高、操作繁琐、生产周期长,凝胶在烧结过程中收缩较大,制品易变形,对发光性能有一定影响等缺点。 溶胶-凝胶技术作为一种先进的工艺方法,具有反应温度低、对基材的尺寸与形状没有过高要求、仪器费用低、操作简单、材料性能调节余地大等特点,可以很方便地通过改变参与反应的有机与无机组分的含量来实现纳米涂层性能的调节。 溶胶是分散介质中基本单元尺寸为1~100 nm的固体粒子而形成的分散体系。在Sol-Gel涂层制备中,溶胶的制备可分为有机途径和无机途径两种。有机途径是通过有机醇盐的水解与缩聚而形成溶胶;无机途径则是通过某种方法制得
燃烧合成介绍
燃烧合成(combustion synthesis,简称CS)又称为自蔓延燃烧合成,是一种利用化学反应的自身放热使反应持续进行的合成方法。该方法的历史可以追溯到前苏联科学家对火箭固体推进剂燃烧问题的探讨。早在1967年,Merzhanov和Borovinskaya在研究Ti-B混合粉坯时就发现自蔓延燃烧现象,并提出自蔓延高温合成(self-propagating high- temperature synthesis,简称SHS)的概念[104]。SHS 最大的特点是合成反应的自发热和自维持,在合成过程中不需要外部能源供给[104,105]。采用SHS工艺可以合成陶瓷材料、金属基与陶瓷基复合材料、金属间化合物、梯度材料、高温超导等高技术结构材料与功能材料[106,107]。此项新的合成技术一出现就受到各国的重视并列入各国高技术材料发展的规划中。 然而,SHS技术工艺可控性较差。同时,由于燃烧温度一般高于2000 °C,合成的粉末粒度大,难以满足小粒径、大表面粉体材料合成的要求。因此,研究人员将SHS技术与湿化学方法相结合,发展出了低温燃烧合成(1ow-temperature combustion synthesis,LCS)新技术。相对于SHS工艺,LCS工艺中的燃烧温度大为降低,从而避免了产物的严重烧结。LCS技术具有以下特点:(1) 起燃温度低,一般在120-350 °C。(2) 反应自维持,合成时间短;(3) 反应产生的大量气体使产物具有疏松多孔的微观形貌;(4) 保留湿化学方法的优点,化学计量比准确,各组分间能达到分子或原子级均匀度;(5) 产物的烧成温度比传统固相反应有较大降低;(6) 合成所需设备简单,原材料成本低。因此,LCS技术被广泛应用于各种氧化物粉体[108-112],尤其是复合氧化物粉体材料的制备,例如各种固体氧化物燃料电池材料,BaTiO3、SrTiO3电子陶瓷,YBCO系高温超导体及多种其它功能陶瓷材料[113-116]。 燃烧合成中的燃烧反应本质上是一个氧化-还原反应。通常选取金属硝酸盐作氧化剂,有机物作还原剂(燃料)。金属硝酸盐在充当氧化剂的同时,还提供目标产物所需的金属离子。此外,硝酸盐还保证了金属粒子的良好溶解性。燃料的选取一般有两个要求。一是要求燃料与硝酸盐所发生的燃烧反应比较温和,产生气体无毒。二是选取的燃料最好对金属离子有络合作用,因为络合剂可以增加金属离子的溶解性,并阻止在前驱体溶液中金属盐的结晶析出。 燃烧合成所需氧化剂和还原剂(燃料)的量可根据推进剂化学原理进行计算。Jain等[117]提出了一种计算氧化剂和还原剂比例的简单方法,即分别计算两者的总还原价和总氧化价,按照总还原价和总氧化价相等的原则来确定它们的化学计量比。当燃料/硝酸盐的比例少于化学计量比时,燃烧反应称为“贫燃反应”。当燃料/硝酸盐的比例高于化学计量比时,称为“富燃反应”。为了保证目标产物的化学组成和燃烧反应的完全,有时需额外添加一定量的氧化剂。硝酸铵是常用的一种氧化剂。例如,在合成钛酸钡时,加柠檬酸的同时需要加入适量硝酸铵,既保证了Ba2+、Ti4+有足够的络合剂,又避免过量有机物燃烧不完全。另外,空气中的氧气也可作辅助氧化剂。
发光材料的制备和特性研究274(实验)
材料物理综合实验报告 实验题目:发光材料的制备和特性研究 物理与能源学院材料物理专业 ___2011___级____1___班 学号__106072011274______ 姓名__赖婷婷___________ 指导老师:__林林老师______
发光材料的制备和特性研究(实验报告) 摘要:本实验用高温固相法制备钼酸钇镝,通过紫外分光光度计对材料的激发强度和发射强度进行测试,结果发现钼酸钇镝在波长为353nm时激发峰最强,在波长为383.5nm时的发射峰最强 引言:发光是物质将某种方式吸收的能量转化为光辐射的过程,是热辐射之外的另一种辐射。要确定某一种材料是否发光并没有明显的界限,一般激发条件下不发光的材料在非常强的能量激发下有微弱的发光。有些材料需要提高纯度,发光才能变强,有些材料则需要掺入一定量的激活剂才能发光发光材料在信息、能源、材料、航天航空、生物技术和环境科学等领域有着广泛的应用前景,对全球信息高速公路的建设及国家经济和科技的发展有着举足轻重的推动作用。稀土离子掺杂材料的上转换发光,是一种吸收两个或两个以上的低能光子发射出一个高能光子的发光过程。掺杂在晶体或玻璃态物质基质中的稀土离子,可以通过激发态吸收和各种能量传递过程被激发至高于泵浦能量的能级而向下跃迁产生上转换发射。 发光材料种类和应用 对固体发光材料而言,发光材料主要包括无机材料和有机材料两大类,根据其被激发的方式不同可以具体划分为以下几种类型:
稀土发光材料的发光原理: 三价稀土离子:La3+: [Xe] 4f0------Lu3+:[Xe]4f14 [Xe]=[Kr]4d105s25p6,三价稀土离子,4f电子能量最高。三价稀土离子的发射和激发绝大多数是由4f电子在f组态内不同能级之间的跃迁而产生的,称为4f-4f跃迁,4f-4f跃迁种类丰富,谱线很多。4f电子能量高于5s和5p,但比5s和5p电子离核近,处于内层。5s25p6形成了良好的电屏蔽,三价稀土离子掺入晶体时,在晶体中比较独,4f能级位置受晶体的影响不大,在所有晶体中都差不多在+3价稀土离子中,Y3+和La3+无4f电子,Lu3+的4f亚层为全充满的,都具有密闭的壳层。因此是光学惰性的,适用于作基质材料。从Ce3+到Yb3+,电子依次填充在4f轨道,从f 1 到 f 13,其电子层中都具有未成对电子,其跃迁可产生发光。这些离子适于作为发光材料的激活离子。 Dieke图:三价稀土离子在LaCl3晶体中的4f电子能级图
实验活动一对蜡烛及其燃烧的探究的实验报告
对蜡烛及其燃烧的探究的实验报告 姓名:晨曦合作者:冯凌亢、古柏城、周全、杨松霖、邓皓班级:三(1)班日期:2010-4-26 实验名称:对蜡烛及其燃烧的探究。 实验目的:研究蜡烛在点燃前、燃着时、熄灭后三个阶段中所表现出的物理性质和化学性质。 实验用品:蜡烛、玻璃杯、火柴、适量的水、适量的澄清石灰水 备注:因为没有烧杯,故用玻璃杯替代,实验效果不变。 步骤和方法现象结论 ①点燃前:观察蜡烛的颜色、状态、形状和硬度等,并嗅气味;从蜡烛上切下一块,把它放入水中,观察它是否溶于水,是浮在水面还是沉入水底?说明蜡烛的密度比水小还是大。1)蜡烛呈白色,状态为 固体,圆柱状,硬度 较软,无气味。 2)放入水中水中的部分 蜡烛漂浮起来,且没 有溶于。 1.蜡烛(实验中)呈白 色,状态为固体,圆 柱状,硬度较软,无 气味。 2.蜡烛的密度比水小, 且不溶于水。 ②点燃时:点燃蜡烛仔细观察蜡烛燃烧时发生了哪些变化,火焰分为几层?哪层最明亮?哪层最暗?取一根火柴梗,拿住一端迅速平放在火焰中,约1s后取出,观察并比较火柴梗在火焰的不同部位被烧焦的情况,说明火焰哪部分的温度最高,哪部分温度最低?分别在火焰上罩上一只干燥的小玻璃杯和一只用澄清石灰水润湿内壁小玻璃杯,仔细观察玻璃杯的内壁上分别有什么现象发生。推测出蜡烛燃烧生成什么物质?1)火焰分为三层,最外 层最亮,最内层最 暗。 2)平放入火焰中的火柴 两端变黑,中间无明 显变化,说明火焰的 外焰温度最高,焰心 温度最低。 3)罩在火焰上的玻璃杯 内壁有水雾生成。 4)火焰使得玻璃杯壁上 的澄清石灰水变混 浊,产生了白色沉 淀。 1.石蜡具有可燃性,其 火焰分为三层:外 焰、内焰、焰心。其 中外焰最亮,焰心最 暗。 2.外焰温度最高,加热 效果最好;焰心温度 最低,不宜用于加 热。 3.蜡烛的燃烧生成了水 和二氧化碳。 ③熄灭后:(3)熄灭蜡烛观察有什么现象发生,用火柴点燃刚熄灭时的白烟,蜡烛能否继续燃1)蜡烛熄灭时,有白烟 产生,用燃着的火柴 迅速靠近白烟,可使 蜡烛重新被点燃。 1.蜡烛熄灭时会产生漂 浮在空中的固态的石 蜡小颗粒。它们是由 固态石蜡在燃烧时融 化后,再汽化,然后 液化并再次凝固生成 的。
发光材料的制备
实验三微波法制备蓝色荧光粉Ca1-x Sr x F2:Eu 一、实验目的 1. 掌握共沉淀-微波法制备荧光粉的方法 2. 熟悉微波反应装置以及具体的实验操作 3. 制备纳米复合荧光粉 二、主要仪器与药品 1、仪器 烧杯,胶头滴管,瓷坩埚(100ml、20ml)各一个,分析天平,离心机,烘箱,微波炉,紫外灯 2、药品 硝酸钙,硝酸锶,三氧化二铕(Eu2O3),氟化铵,硝酸,活性炭(炭粒) 三实验原理与技术 共沉淀法是将沉淀剂加入到混合金属盐溶液中,促使各组分均匀混合沉淀,然后加热分解以获得产物的方法。化学共沉淀法的优势在于它不仅可以将原料提纯与细化,而且可以在制备过程中完成反应及掺杂过程。这种方法具有工艺简单、经济,反应物混合均匀,焙烧温度较低、时间较短、产品性能良好等优点。但制备过程中仍有不少问题有待解决,例如过程中易引入杂质,形成的沉淀呈胶体状态导致洗涤和过滤方面的问题,如何选择适宜的沉淀剂和控制制备条件等。 微波合成法是近年来迅速发展起来的一种新合成方法,应用于光致发光材料的制备,已获得了多种粒度细小、分布均匀、色泽纯正、发光效率高的荧光粉。这种方法是将原料按比例混合后研磨,装入特定的反应器,在微波炉中加热反应20—40min,取出后进行简单的后处理即得成品。微波热合成法的显著优点是反应彻底、快速、高效、节能、洁净、经济,使用方法和设备简单,只需家用微波炉即可。用此法合成的产品疏松.粒度小。分布均匀,色泽纯正,发光效率高,有较好的应用价值; 氟化物性能稳定,不易潮解,透光率好,而且生产成本低,有着有机物和硫化物无法比拟的优点。通过对其进行稀土掺杂,可以制备出与植物光合作用所吸收光谱相匹配的新型高效转光剂。但是目前文献报道的大都是通过高温固相法
人教版九年级化学上册重庆市涪陵十四中马鞍校区练习题:第1课时对蜡烛及其燃烧的探究
【基础知识】 1.化学是一门以为基础的学科,许多重大发现和研究成果都是通过________得到的。通过________以及对________________的观察,记录和分析等,可以发现和验证________________,学习________________的方法并获得________________。 2.观察主要指用眼、鼻、耳、手等方式或借助仪器了解实验。 3.火焰分层,从内到外是、、。 4.点燃前,切一小块石蜡,把它放入水中,蜡烛,说明蜡烛的密度 ,且。 5.蜡烛燃烧生成了和。 6.蜡烛熄灭后的白烟是,可以点燃。 7.在实验探究中: 一要关注物质的,如颜色、气味、状态、硬度、密度、熔点、沸点等; 二要关注物质的,如石蜡燃烧时是否熔化等; 三要关注物质的及其,如发光、放热、有气体生成等。 8.科学探究的方法主要包括提出、做出猜想或、制定、进行(实验步骤)、收集证据(包括观察到的现象、测定到的数据或其他资料)、分析、解释与结论。 9.用元素名称或符号填空 H________ B________ O________ N________ Ne________ Na________ 镁________ 铝________ 硅________ 磷________ 硫________ 氯________ 【巩固练习】 10.蜡烛在空气中燃烧生成了() A.水 B.二氧化碳 C.水和二氧化碳 D.大量灰烬 11.下列有关蜡烛的叙述,错误的是() A.蜡烛燃烧时,火焰分为三层 B.蜡烛浮在水面,说明它的密度比水大 C.蜡烛在空气中燃烧有明亮的火焰,稍有黑烟,放出热量 D.蜡烛燃烧后的产物是水和二氧化塘 12.有关化学实验下列叙述不正确的是() A.化学实验要勤于动手 B.化学实验要善于观察 C.化学实验要少做少看 D.化学实验要互相协作 13.古代在炼丹术和炼金术为化学发展为一门科学做出了一定的贡献。下列有关炼丹术和炼 金术的说法中没有科学道理的是() A.“点石成金”使“贱金属”变为“贵金属”,追求“长生不老” B.发明了很多化学实验工具
发光材料的制备方法及制备的发光材料的制作流程
本技术涉及发光材料技术领域,提供一种发光材料的制备方法及制备的发光材料,所述方法包括:(1)按照化学计量比称取原材料La2O3、4MgCO3·Mg(OH)2·5H2O、H3BO3、Er2O3在研钵中充分研磨,使材料混合均匀;其中,Er3+掺杂的含量为330%;(2)放入坩埚中,在马弗炉中400600℃预烧结1.53h;(3)取出研磨2060min;(4)放入坩埚,置于马弗炉中9001000℃烧结610小时;(5)冷却后,取出烧结体,充分研磨,得到Er3+掺杂的 LaMgB5O10荧光材料。本技术方法简单、成本低廉,所制备的发光材料粒径小、稳定性好,而且发光效率得到了很大提高。 技术要求 1.一种发光材料的制备方法,其特征在于,包括: (1)按照化学计量比称取原材料La2O3、4MgCO3·Mg(OH)2·5H2O、H3BO3、Er2O3在研钵中充分研磨,使材料混合均匀;其中,不同化学计量使Er3+掺杂的含量为3-30%; (2)放入坩埚中,在马弗炉中400-600℃预烧结1.5-3h; (3)取出研磨20-60min; (4)放入坩埚,置于马弗炉中900-1000℃烧结6-10小时; (5)冷却后,取出烧结体,充分研磨,得到Er3+掺杂的LaMgB5O10荧光材料。 2.根据权利要求1所述的发光材料的制备方法,其特征在于,研磨时间为40-90min。 3.根据权利要求1所述的发光材料的制备方法,其特征在于,所述坩埚为氧化铝坩埚。 4.根据权利要求1所述的发光材料的制备方法,其特征在于,预烧结的温度为500℃。 5.根据权利要求1或4所述的发光材料的制备方法,其特征在于,预烧结的时间为2小时。 6.根据权利要求1所述的发光材料的制备方法,其特征在于,烧结的温度为900℃。 7.根据权利要求1或6所述的发光材料的制备方法,其特征在于,烧结时间为8小时。
无机合成方法知识点
第一部分无机合成的基础知识 知识点:溶剂的作用与分类 例如:根据溶剂分子中所含的化学基团,溶剂可以分为水系溶剂和氨系溶剂根据溶剂亲质子性能的不同,可将溶剂分为碱性溶剂、酸性溶剂、两性溶剂和质子惰性溶剂。 例如:丙酮属于()溶剂:A 氨系溶剂 B 水系溶剂 C 酸性溶剂 D 无机溶剂 进行无机合成,选择溶剂应遵循的原则: (1)使反应物在溶剂中充分溶解,形成均相溶液。 (2)反应产物不能同溶剂作用 (3)使副反应最少 (4)溶剂与产物易于分离 (5)溶剂的纯度要高、粘度要小、挥发要低、易于回收、价廉、安全等 试剂的等级及危险品的管理方法 例如酒精属于() A 一级易燃液体试剂B二级易燃液体试剂C三级易燃液体试剂D四级易燃液体试剂 真空的基本概念和获得真空的方法 低温的获得及测量 高温的获得及测量 第二部分溶胶-凝胶合成 溶胶-凝胶法:用含高化学活性组分的化合物作前驱体,在液相下将这些原料均匀混合,并进行水解/醇解、缩聚化学反应,在溶液中形成稳定的透明溶胶体系,溶胶经陈化胶粒间缓慢聚合,形成三维空间网络结构的凝胶,凝胶网络间充满了失去流动性的溶剂,形成凝胶。凝胶经过干燥、烧结固化制备出分子乃至纳米亚结构的材料。 金属醇盐是介于无机化合物和有机化合物之间的金属有机化合物的一部分,可用通式M(OR)n来表示。M是价态为n的金属,R代表烷基。 *金属醇盐可看作是醇ROH中羟基的H被金属M置换而形成的一种诱导体 *金属氢氧化物M(OH)n中羟基的H被烷基R置换而成的一种诱导体。 *金属醇盐具有很强的反应活性,能与众多试剂发生化学反应,尤其是含有羟基
的试剂。 例如:关于溶胶-凝胶合成法中常用的金属醇盐,以下说法错误的是(D ) A金属醇盐可看作是醇ROH中羟基的H被金属M置换而形成的一种诱导体 B金属醇盐可看作是金属氢氧化物M(OH)n中羟基的H被烷基R置换而成的一种诱导体。 C金属醇盐具有很强的反应活性,能与众多试剂发生化学反应,尤其是含有羟基的试剂。 D 异丙醇铝不属于金属醇盐 溶胶-凝胶合成法的应用 溶胶一凝胶法作为低温或温和条件下合成无机化合物或无机材料的重要方法,在软化学合成中占有重要地位。在制备玻璃、陶瓷、薄膜、纤维、复合材料等方面获得重要应用,更广泛用于制备纳米粒子。 溶胶与凝胶结构的主要区别: 溶胶(Sol)是具有液体特征的胶体体系,分散的粒子是固体或者大分子,粒子自由运动,分散的粒子大小在1~1000nm之间,,具有流动性、无固定形状。凝胶(Gel)是具有固体特征的胶体体系,被分散的物质形成连续的网状骨架,骨架空隙中充有液体或气体,无流动性,有固定形状。 溶胶-凝胶合成法的特点: (1)能与许多无机试剂及有机试剂兼容,通过各种反应物溶液的混合,很容易获得需要的均相多组分体系。反应过程及凝胶的微观结构都较易控制,大大减少了副反应,从而提高了转化率,即提高了生产效率。 (2)对材料制备所需温度可大幅降低,形成的凝胶均匀、稳定、分散性好,从而能在较温和条件下合成出陶瓷、玻璃、纳米复合材料等功能材料。 (3)由于溶胶的前驱体可以提纯而且溶胶-凝胶过程能在低温下可控制地进行,因此可制备高纯或超纯物质。 (4)溶胶或凝胶的流变性质有利于通过某些技术如喷射、旋涂、浸拉等加工成各种形状,容易制备出粉末、薄膜、纤维、块体等各种形状的材料。 (5)制品的均匀性好,尤其是多组分制品,其均匀度可达到分子或原子尺度,产品纯度高。
燃烧法制备SrAl2O4-Eu,Dy超长余辉发光材料实验报告教材
中南民族大学 实验报告 实验课名称:化学综合实验指导老师:唐万军 学生姓名:专业:班级:学号: 实验名称:燃烧法制备SrAl2O4:Eu,Dy超长余辉发光材料 实验日期:组别:实验成绩: 一、目的要求 1、了解稀土掺杂铝酸盐长余辉材料的合成方法与应用领域。 2、设计实验方案,采用燃烧法合成SrAl2O4:Eu2+,Dy3+,测试其发光特性。 3、学会使用LS-55光度计和屏幕亮度计,根据X射线粉末衍射谱图,分析鉴定多晶样品的物相。 二、基本原理 长余辉发光材料也被称作蓄光材料,或者夜光材料,指的是在自然光或其它人造光源照射下能够存储外界光辐照的能量,然后在某一温度下(指室温),缓慢地以可见光的形式释放这些存储能量的光致发光材料。 20 世纪90 年代以来,开发的以碱土铝酸盐为基质的稀土长余辉发光材料, 以其优异的长余辉发光性能,引起了人们对长余辉发光材料的广泛关注。目前稀土离子掺杂的碱土铝(硅)酸盐长余辉材料已进入实用阶段。国内较大的生产厂家有大连路明、济南伦博、重庆上游等。市场上可见的产品除了初级的荧光粉外,主要有夜光标牌、夜光油漆、夜光塑料、夜光胶带、夜光陶瓷、夜光纤维等, 主要用于暗环境下的弱光指示照明和工艺美术品等。随着长余辉材料的形态从粉末扩展至玻璃、单晶、薄膜和玻璃陶瓷,对长余辉材料应用的探讨也从弱光照明、指示等扩展到信息存储、高能射线探测等领域。长余辉材料受到人们越来越多的重视。 从基质成分的角度划分,目前长余辉发光材料主要包括硫化物型、碱土铝酸盐型、硅酸盐型及其它基质型长余辉发光材料。不同长余辉发光材料的发光性能见表1。 表1 不同长余辉发光材料的发光性能 发光材料发光颜色发光谱峰波长/nm 余辉时间/min BaAl2O4:Eu,Dy 蓝绿色496 120 CaAl2O4:Eu,Nd 蓝紫色446 1000 Sr4Al14O25:Eu,Dy 蓝绿色490 2000 SrAl2O4:Eu,Dy 黄绿色520 4000 Sr2MgSi2O7:Eu,Dy 蓝色469 2000
【2019年整理】上转换发光材料的合成与应用
上转换发光材料的合成与应用 杨志萍杜海燕孙家跃* (北京工商大学化工学院,北京100037) 摘要综述了目前国内外上转换发光材料的几种合成方法,包括传统的高温固相合成法、溶胶-凝胶法、水热合成 法、共沉淀法等。总结了不同方法的优缺点,对上转换材料合成方法的发展进行了展望。并介绍了上转换技术的一些应 用。 关键词上转换,发光材料,合成方法 Synthetic methods and application of upconversion luminescence materials Yang Zhiping Du Haiyan Sun Jiayue (School of Chemical Engineering,Beijing Technology and Business University, Beijing 100037) Abstract This paper generalized several synthetic methods of this materials used presently at home and abroad. The synthetic methods included high temperature solid method, so-l gel process, hydrothermal synthesis, co-precipitation method and so on. The advantages and disadvantages of every method were discussed. Moreover, the synthetic methods of upconversion luminescence materials for further development were prospected. The application of upconversion technology was introduced. Key words upconversion, luminescence material, synthetic methods
实验一 燃烧法合成红色发光材料Li2CaSiO4Eu3+ 完成
本科生实验报告 实验课程材料设计与制备综合实验 学院名称材料与化学化工学院 专业名称材料科学与工程 学生姓名冯有增 学生学号201202040223 指导教师邱克辉 实验地点C201 实验成绩 二〇一五年五月——二〇一五年六月
填写说明 1、适用于本科生所有的实验报告(印制实验报告册除外); 2、专业填写为专业全称,有专业方向的用小括号标明; 3、格式要求: ①用A4纸双面打印(封面双面打印)或在A4大小纸上用蓝黑色水笔书写。 ②打印排版:正文用宋体小四号,1.5倍行距,页边距采取默认形式(上下2.54cm,左右 2.54cm,页眉1.5cm,页脚1.75cm)。字符间距为默认值(缩放100%,间距:标准); 页码用小五号字底端居中。 ③具体要求: 题目(二号黑体居中); 摘要(“摘要”二字用小二号黑体居中,隔行书写摘要的文字部分,小4号宋体); 关键词(隔行顶格书写“关键词”三字,提炼3-5个关键词,用分号隔开,小4号黑体); 正文部分采用三级标题; 第1章××(小二号黑体居中,段前0.5行) 1.1 ×××××小三号黑体×××××(段前、段后0.5行) 1.1.1小四号黑体(段前、段后0.5行) 参考文献(黑体小二号居中,段前0.5行),参考文献用五号宋体,参照《参考文献著录规则(GB/T 7714-2005)》。
实验一燃烧法合成红色发光材料Li2CaSiO4:Eu3+ 一、实验名称:燃烧法合成红色发光材料Li2CaSiO4:Eu3+ 二、实验目的: 1、掌握燃烧法的实验原理和材料的基本测试方法; 2、掌握燃烧法合成Li2CaSiO4:Eu3+粉体的制备过程; 3、研究Eu3+浓度变化对荧光粉发光性能的影响; 三、实验原理 燃烧法是指通过前驱物的燃烧合成材料的一种方法。当反应物达到放热反应的点火温度时,以某种方法点燃,随后的反应即由放出的热量维持,燃烧产物就是拟制备的目标产物。其基本原理是将反应原料制成相应的硝酸盐,加入作为燃料的尿素(还原剂),在一定的温度下加热一定时间,经剧烈的氧化还原反应,溢出大量的气体,进而燃烧得到产物。 nSi(O2C2H5)4+nH2O== nSi(OH) 4+4nC2H5OH 6LiNO3+3Ca(NO3)2+ 3Si(OH) 4+ 12CO(NH2)2 ==3Li2CaSiO4+12CO2+4NH3+24H2O+16N2用燃烧法合成发光材料具有相当的适用性,燃烧过程产生的气体还可充当还原保护气氛,并具备不需要复杂的外部加热设备,工艺过程简便,反应迅速,产品纯度高,发光亮度不易受损,节省能源等优点,是一种很有意义的高效节能合成方法。 四、实验药品及仪器 药品:三氧化二铕(Eu2O3),硝酸钙(Ca(NO3)2·4H2O),尿素,正硅酸乙酯(Si(OC2H5)4),硝酸锂(LiNO3),浓HNO3,去离子水。 仪器:电子天平,量筒,烧杯,移液管,磁力搅拌器,恒温干燥箱,刚玉坩埚,马弗炉,X射线粉晶衍射仪(XRD),荧光光谱仪(FL)。 五、注意事项 1、准确称量样品; 2、严格按照实验流程操作; 3、注意安全;
探究蜡烛实验报告-实验报告
探究蜡烛实验报告-实验报告 探究实验名称:对蜡烛及其燃烧的探究 探究实验目的:对蜡烛在点燃前、点燃时和熄灭后的三个阶段进行细致的观察,学会完整地观察物质的变化过程及其现象。 实验用品:一支新蜡烛、火柴、一支干净烧杯、水、水槽、澄清的石灰水、一把小刀。 实验步骤与方法: 1.观察蜡烛的颜色、形状、状态、硬度;嗅其气味。 现象:蜡烛是白色、较软的圆柱状固体,无气味,由白色的棉线和石蜡组成。 2.用小刀切下一块石蜡,放入水槽,观察其在水中的现象。 现象:石蜡漂浮在水面上,不溶于水。 结论:石蜡是一种密度比水小,不溶于水的固体。 3.点燃蜡烛,观察其变化及其火焰和其各层温度的比较。 现象:石蜡受热时熔化、蜡烛燃烧时发光、冒黑烟、放热。 烛焰分三层:外焰、内焰、焰心,外焰温度最高,焰心最低。 结论:石蜡受热会熔化,燃烧时形成炭黑。 物理实验报告·化学实验报告·生物实验报告·实验报告格式·实验报告模板 4.干燥的烧杯罩在烛焰上方,观察烧杯壁上的现象片刻,取下
烧杯,倒入少量石灰水。振荡,观察其现象。 现象:干燥的烧杯壁上出现了许多小水珠。取下烧杯后迅速倒入澄清石灰水,振荡,石灰水变得浑浊。 结论:蜡烛燃烧时产生了水和能使石灰水变浑浊的二氧化碳两种物质。 5.熄灭蜡烛,观察其现象,用火柴点燃刚熄灭时的白烟,观察有什么现象发生。 现象:熔化的石蜡逐渐凝固,白色棉线烛心变黑,易碎。用火柴点燃刚熄灭时的白烟,蜡烛会重新燃烧。 结论:石蜡遇冷凝固,燃烧时产生炭黑,棉线炭化,白烟由细小的石蜡颗粒构成,有可燃性。 实验结论: 蜡烛在空气中能够燃烧,在燃烧过程中和过程后能产生许多新的物质。 问题和建议: 蜡烛为什么能够燃烧?蜡烛在什么样的条件下才能燃烧?像这样物质燃烧后产生新物质的变化是化学变化还是物理变化?
对蜡烛及其燃烧的探究 教案
对蜡烛及其燃烧的实验探究 一、教学目标 1.知识与能力 (1)了解在日常生活中存在着许多有探究价值的问题,并可以通过实验等手段解决这些问题。 (2)了解化学是一门以实验为基础的自然科学。培养观察、记录、描述和分析的能力,以及合作、交流和评价的能力。 2、过程与方法 (1)本课题主要以学生的探究实验为主,因此采用探究式教学方法比较合适。(2)在教学过程中,引导、指导和辅助学生,将学习的主动权留给学生,学生在实验学习中深刻理解化学是以实验为基础的。 3、情感、态度与价值观 培养学生学生求实的探索精神,培养学生以实验探究猜想的化学素养。 二、学情分析 本节课安排在物质的变化和性质的学习之后,充分运用对于物质变化和性质的知识学习本节课内容。并且依然以实验作为课堂引入,学生充分感受化学是一门以实验为基础的科学。 三、教学重难点 重点:对蜡烛燃烧实验的现象及结论表述、对蜡烛燃烧产物的检验 难点:运用物质的变化和性质的知识,对蜡烛产物的检验 四、教学方法:实验探究法、讲授教学法 教学准备:打火机、蜡烛1根、小刀1把、短木条一根、澄清石灰水、玻璃棒2个 五、教学过程设计
【课程导入】以生日蛋糕和生日蛋糕上面的蜡烛引入 板书:对蜡烛及其燃烧的探究 课前引入小知识:二氧化碳能使澄清石灰水变浑浊 【课程引导】引导学生对蜡烛的物理性质进行探讨 讲述:在点燃蜡烛前,请大家开动脑筋,运用各种手段仔细观察蜡烛的组成、形状、颜色、气味、质地、密度等,并做好详细的记录。(提示学生用水作为参照物来研究蜡烛的密度) 【引导学生回答】 (1)蜡烛由什么组成? 蜡烛是石蜡和棉线做的灯芯组成的; (2)蜡烛的颜色、状态、气味、形状? 一般蜡烛为圆柱形、乳白色、固体;特殊的蜡烛,如生日蜡烛,有多种颜色和形状,但那是添加染料后形成的;蜡烛一般都具有轻微的气味。 (3)如何探知蜡烛的硬度?密度?水溶性? (如果用小刀切下一块蜡烛放入水中,会发现蜡烛浮在水面上,说明蜡烛的密谋比水小。) 【板书】一、蜡烛物理性质 【课题小结1】对蜡烛的物理性质进行系统总结 【实验探讨】 1、对学生的回答表示充分的肯定,让学生结合蜡烛的这些性质,点燃蜡烛,观察燃烧着的蜡烛有哪些变化。 (1)燃烧着的蜡烛有没有声音?形状有没有什么改变? [蜡烛点燃后,可以持续安静地燃烧,不会发出响声音,且蜡烛在燃烧过程中缓慢地变短。] (2)蜡烛的火焰有什么特点? [蜡烛的火焰在轻微地闪烁,在火焰的上方有黑烟生成。
