四种晶体类型的比较教学文案
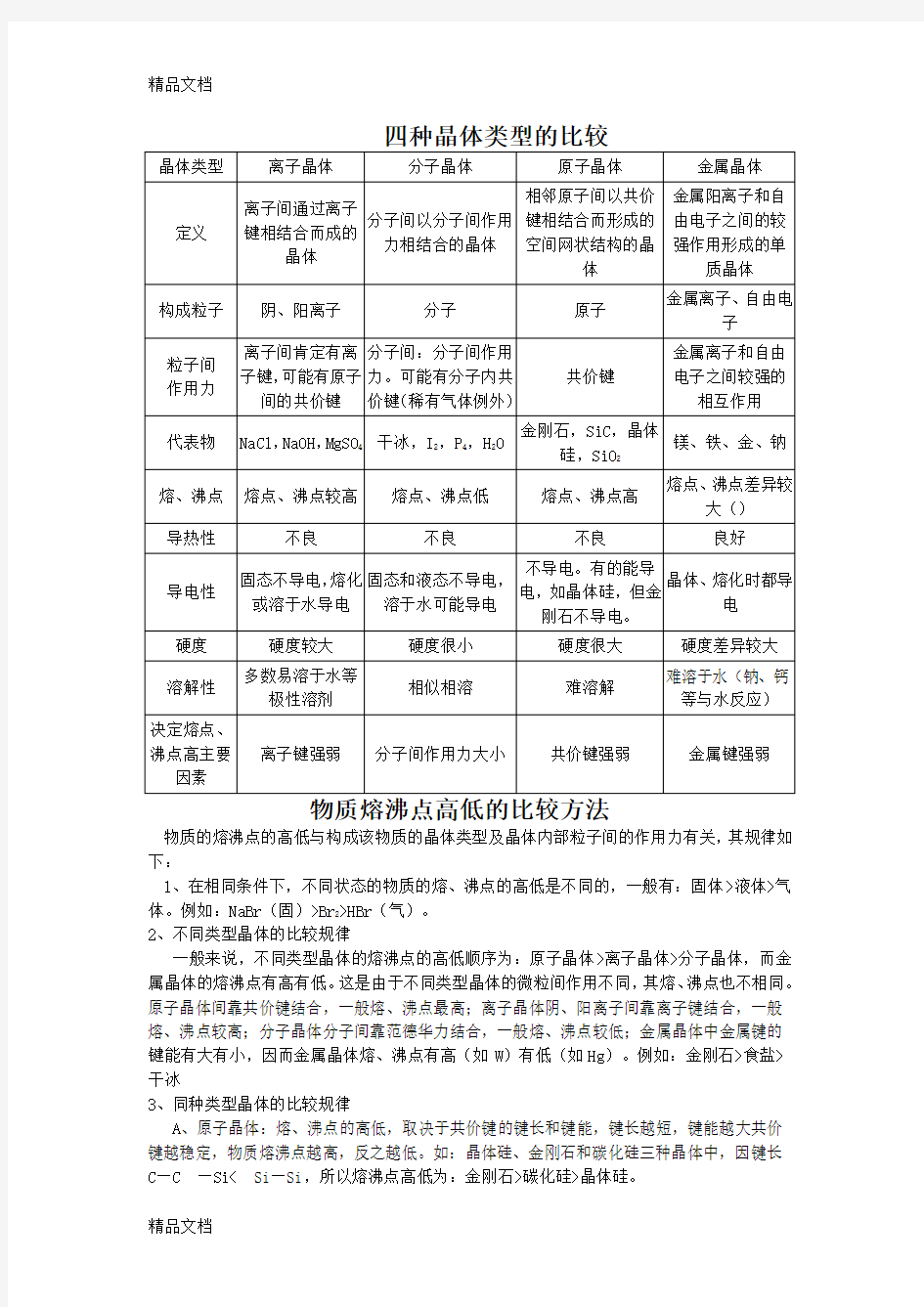

物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:
1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。
2、不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰
3、同种类型晶体的比较规律
A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
B 、离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。
C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。
D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高)
如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸
点升高,如C 2H 6>CH 4, C 2H 5Cl >CH 3Cl ,CH 3COOH >HCOOH 。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如:
CH 3(CH 2)3CH 3 (正)>CH 3CH 2CH(CH 3)2(异)>(CH 3)4C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低)
针对性训练
一、选择题
1.下列性质中,可以证明某化合物内一定存在离子键的是( )
(A )溶于水 (B )有较高的熔点 (C )水溶液能导电 (D )熔融状态能导电 2.下列物质中,含有极性键的离子化合是( )
(A )CaCl 2 (B )Na 2O 2 (C )NaOH (D )K 2S
3.Cs 是IA 族元素,F 是VIIA 族元素,估计Cs 和F 形成的化合物可能是( ) (A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体 4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( )
(A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3
6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( )
(A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体
7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( )
(A )3
8a N m A ?g·cm -3 (B )A
N Ma
83
g·cm -3 (C )3
a N M A ?g·cm -3
(D )A
N Ma 3
g·cm -3
(完整word版)四种晶体类型的比较
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
B 、离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。 例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。 C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高) 如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。 (2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。 (3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。 如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸 (4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸 点升高,如C 2H 6>CH 4, C 2H 5Cl >CH 3Cl ,CH 3COOH >HCOOH 。 (5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如: CH 3(CH 2)3CH 3 (正)>CH 3CH 2CH(CH 3)2(异)>(CH 3)4C(新)。 芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低) 针对性训练 一、选择题 1.下列性质中,可以证明某化合物内一定存在离子键的是( ) (A )溶于水 (B )有较高的熔点 (C )水溶液能导电 (D )熔融状态能导电 2.下列物质中,含有极性键的离子化合是( ) (A )CaCl 2 (B )Na 2O 2 (C )NaOH (D )K 2S 3.Cs 是IA 族元素,F 是VIIA 族元素,估计Cs 和F 形成的化合物可能是( ) (A )离子化合物 (B )化学式为CsF 2 (C )室温为固体 (D )室温为气体 4.某物质的晶体中含A 、B 、C 三种元素,其排列方式如图所示(其中前后两面心上的B 原子未能画出),晶体中A 、B 、C 的中原子个数之比依次为( ) (A )1:3:1 (B )2:3:1 (C )2:2:1 (D )1:3:3 6.在NaCl 晶体中与每个Na +距离等同且最近的几个Cl -所围成的空间几何构型为( ) (A )正四面体 (B )正六面体 (C )正八面体 (D )正十二面体 7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs +离子核间距为a cm ,氯化铯的式量为M ,NA 为阿伏加德罗常数,则氯化铯晶体的密度为( ) (A )3 8a N m A ?g·cm -3 (B )A N Ma 83 g·cm -3 (C )3 a N M A ?g·cm -3 (D )A N Ma 3 g·cm -3
四种晶体类型的比较
四种晶体类型的比较 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价
键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C —C
高中化学四种晶体类型的比较
四种晶体类型的比较
物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr (固)>Br2>HBr(气)。 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,原子半径越小,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
(完整版)教学模式的种类
教学模式的种类 由于教学实践依据的教学思想或理论不同,教学实践的形式就不同,从而形成不同的教学模式。 关于教学模式的种类,国内外不同研究者从不同角度有不同的分类。 一、从理论根源区分 乔以斯和韦尔依据教学模式的理论根源,归纳出4种教学模式: 第一种是社会互动教学模式。 这种类型的模式的依据是社会互动理论,强调教师与学生、学生与学生的相互影响和社会联系。属于这种类型的教学模式有; 杜威和塞林的小组探索模式, 奥利弗和夏沃尔的法理学教学模式, 马歇尔和考科斯的相互探索模式等。 第二种是信息加工教学模式。 这种类型的教学模式的依据是信息加工理论,把教学看做是一种创造性的信息加工过程,依据计算机、工人智能的运行规程确定教学的程序。 属于这种类型的教学模式有: 施沃德的科学探索教学模式, 布鲁纳的概念获得教学模式, 皮亚杰和西格尔的认知发展教学模式, 奥苏贝尔的先行组织者教学模式等。 第三种是个人教学模式。 这种类型的教学模式的依据是个别化教学的理论与人本主义的教学思想,强调个人有教学中的主观能动性,坚持个别化教学。 属于这种类型的教学模式有: 罗杰斯的无指导者教学模式, 格拉斯尔的教室集会教学模式等。 第四种是行为修正教学模式。 这种类型的教学模式的依据是行为主义心理学理论,它把教学看做是一种行为不断修正的过程。 属于这种类型的教学模式主要 有斯金纳的操作条件反射教学模式。 按照乔以斯和韦尔的分法, 在我国近年出现的一些依据不同思想或理论而建 立的教学模式有:依据结构主义心理学理论而建立的“结构一定向”教学模式,依据“教为主导,学为主体”的教学思想而建立的“学导式”教学模式、“自学辅导式”教学模式, 依据课程论和教学过程理论而建立的“六课型单元”教学模式, 依据认知心理学而建立的“四阶段式”课堂教学模式等等。
四种晶体类型的比较
四种晶体类型的比较 GE GROUP system office room 【GEIHUA16H-GEIHUA GEIHUA8Q8-
四种晶体类型的比较
物质熔沸点高低的比较方法 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体> >HBr(气)。 液体>气体。例如:NaBr(固)>Br 2 2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
例如:MgO>CaO ,NaF>NaCl>NaBr>NaI 。 KF >KCl >KBr >KI ,CaO >KCl 。 C 、金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na <Mg <Al ,Li>Na>K 。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 D 、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高) 如:H 2O >H 2Te >H 2Se >H 2S ,C 2H 5OH >CH 3—O —CH 3。 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH 4<SiH 4<GeH 4<SnH 4。 (2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如熔沸点 CO >N 2,CH 3OH >CH 3—CH 3。 (3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。 如:C 17H 35COOH >C 17H 33COOH ;硬脂酸 > 油酸
教学模式的概念
教学模式的概念 教学模式是在一定的教育思想、教学理论和学习理论指导下的,为完成特定的教学目标和内容,围绕某一主题形成的比较稳定且简明的教学结构理论框架及其具体可操作的教学活动方式,通常是两种以上方法策略的组合运用。 简而言之,教学模式可以概括为: 以一定的理论为指导; ?需要完成既定的教学目标和内容; ?表现一定的教学活动序列及其方法策略。 教学模式的特点 教学模式是教学理论与教学实践的桥梁,既是教学理论的应用,对教学实践起直接指导作用,又是教学实践的理论化、简约化概括,可以丰富和发展教学理论。 1.操作性 教学模式是一种具体化、操作性较强的教学思想或理论,它把某种教学理论或活动方式中最核心的部分用简化的形式反映出来,为人们提供了一个比抽象的理论具体得多的教学行为框架,教学模式比较清晰地呈现了教学程序,具体地规定了教师的教学行为,方便教师理解、把握和运用,教师在课堂教学中有章可循,便于教师理解、把握和运用,这是教学模式区别于一般教学理论的重要特点。 2.简约性 教学模式的另一个特点就是简约化了的教学结构理论框架及活动模式,大都以精练的语言、象征性的图式或明确的符号表达出来。一般说来,会用教学不同阶段的关键词进行总结,或者用流程图、框图来表达教学步骤间的逻辑关系和教学流程等。这些都能使复杂多样的教学
实践经验理论化,又有利于形成比抽象的理论更具体、简明的操作框架,从而便于教师理解、运用,也易于交流、传播。 3.指向性 任何一种教学模式都是围绕着一定的教学目标设计的,而且每种模式的有效运用也是需要一定的条件,因此,不存在适用于所有教学过程的万能模式,也谈不上哪一种教学模式是最佳教学模式,只存在一定情况下能达到特定目标的最有效的教学模式。因此,使用教学模式需要有鉴别不同类型的教学目标的能力,以便选用与特殊的目标相适应的特定模式。例如,发现式教学模式较适用于数理科教学,却不适用于文科教学;操练式教学模式利于知识技能训练,而对培养学生的探究精神却并不合适。因此,需要特别注意教学模式的指向性。 4.整体性 教学模式是教学现实和教学理论构想的统一,任何教学模式都是由各个要素有机构成的整体,本身都有一套比较完整的结构和机制,体现着理论上的自圆其说和过程上的有始有终。理论上的忽视或教学过程的缺失,都只能降低教学效果而不能发挥教学模式的应有功能。因此,在运用时,必须整体把握,既透彻了解其理论原理,又切实掌握其方式方法。那种无视教学模式的整体性,放弃理论学习而简单套用其程序步骤的做法,对提高教学水平有害无益。5.更新性 虽然教学模式一旦形成,其基本结构便保持相对稳定,但这并不意味着该教学模式就从此不变了。教学模式总是随着教学实践、观念和理论的不断发展变化,而不断地得到丰富、创新和发展而日臻完善的。教学模式是一个动态开放的系统,有一个产生、发展、完善的过程,它的不断变革与改革,正是其得以具有有效性的重要保证。 有意义接受学习教学模式
晶体类型
双基练习——————————————————— 1.科学家近年来发现一种新能源——“可燃冰”,它的主要成分是甲烷与水分子的结晶水合物(CH4·n H2O)。埋于海底地层深处的大量有机质在缺氧环境中,被厌氧性细菌分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温和高压条件下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是() A.离子晶体B.分子晶体 C.原子晶体D.金属晶体 解析:可燃冰是甲烷分子与水分子间通过分子间作用力形成的类似冰的透明晶体。 答案:B 2.共价键、离子键和分子间作用力都是微粒之间的作用力。有下列晶体:①NaOH、②SiO2、③氧气、④金刚石、⑤NaCl、⑥白磷,其中含有两种作用力的组合是() A.①②⑤B.①②④ C.②④⑥D.①③⑥ 解析:NaOH存在离子键和共价键;氧气、白磷分子内存在共价键,分子间存在分子间作用力。 答案:D 3.离子晶体不可能具有的性质是() A.较高的熔、沸点B.良好的导电性 C.溶于极性溶剂D.坚硬而易粉碎 解析:离子晶体固体不导电,熔化或溶于水后导电。 答案:B 4.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于() A.原子晶体B.分子晶体 C.金属晶体D.离子晶体 解析:原子晶体熔点高、硬度大,与“耐高温耐磨”吻合。 答案:A 5.下列各组物质中,按熔点由低到高排列正确的是() A.O2、I2、Hg B.CO2、BaCl2、SiO2 C.H2O、S、W D.SiO2、NaCl、S 解析:常温下Hg呈液态,不同类型晶体熔点高低规律一般有:分子晶体<离子晶体<原子晶体。 答案:BC 6.(1)指出下列物质的晶体类型: 金刚石__________,氯化氢__________,冰__________,二氧化硅__________,铜__________,固态氧__________,氯化钠__________,硫酸铜__________。 (2)在以上物质中,熔点最高的是__________,硬度最大的是__________,常温下能导电的是__________,水溶液能导电的是__________。
教学模式有哪些类别-课程模式有哪些
教学模式有哪些类别 教学模式从不同的基点出发有不同的分类。例如,美国学者乔伊斯和韦尔把众多教学模 式归纳为四种基本类型: 第一类是信息加工教学模式。 这类教学模式依据信息加工理论,把教学看作是一种创造性的信息加工过程。它着眼于知识的获得和智力的发展。主要有以信息处理能力的发展研究为基础的模式(皮亚杰);以学习理论为基础的模式(加涅);概念获得模式(布鲁纳)。 第二类是个性教学模式。 这类教学模式的理论依据是个别化教学理论与人本主义的教学思想。其核心是强调学生在教学中的主观能动性,着眼于个人潜力和人格的发展。如罗杰斯的非指导性教学模式,杜威的活动教学模式”。 第三类是合作教学模式。 这类教学模式依据的是社会互动理论,强调教师与学生、学生与学生的相互影响和人 际交往,着眼于人的社会性品格的培养,如前苏联戈盖巴维利等一批学者创立的合作教育学。 第四类是行为控制教学模式。 这类教学模式依据的是行为主义心理学理论,它把教育看作一种行为不断修正的过程。 它通过操作方法的自我控制并驾驭自己的环境,来提高目标行为质量和减少不适应的行为。 如程序教学模式(斯金纳),以智力行为多阶段形成理论”为基础的教学模式(加里培林)
在国内,教学模式的分类也有多种。有人按师生活动的不同强度把教学模式依次分为注 入式、启发式、问题式、范例式和放羊式等五类。第一类教师活动强度最大,学生最小,依 次递减(递增)至第五类则表现为教师活动强度最小,学生最大。 有人从教学意义的生成方式把教学模式分为三类,第一类是 通过 教师呈现教材来掌握现成知识的一种教学模式;第二类是 略倾向于建构 主义学习的理论观点, 认为学生是认知的主体, 师对教学意义的生成起帮助者和促进者的作用。 第三类是 指导性教学模式”,它是 折衷于前 两者之间的产物”,它在前两者之间取得平衡, 扬长避短,使前两者的优点相得益彰。 再如, 有人从教学活动特征可将模式分成以下五类: 指导一 受”模式;自学一甫导”模式;探 索一 现”模式;情趣一 冶”模式;示范一 仿”模式; 用分类的方法来考察教学模式,实际上有割裂各种相关理论和模式并勉强予以界定等缺 陷,但它毕竟有助于教师从整体上把握不同模式的特点, 有利于更好地认识和掌握现有的教 学模式。对每一个具体的教学模式,教师可以从纵向去追寻它的来龙去脉, 从横向去进行相 互间的比较分析和取长补短,从而有利于教师的理论素养和实践水平的提高。 (邱才训) 替代性教学模式”,即学生 生成性教学模式”,其教学策 是知识意义的主动建构者,教
如何判别晶体类型
如何判别晶体类型 1、根据物质的分类判断 ①离子晶体---金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体 ②分子晶体---卤素、氧气、氢气等大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、稀有气体、所有非金属氢化物、多数非金属氧化物(除SiO2外)、含氧酸(几乎所有的酸)、绝大多数有机物的晶体都是分子晶体 ③原子晶体常见的---某些非金属单质:金刚石、晶体硅(Si)、晶体硼(B),某些非金属化合物:二氧化硅(SiO2 )、碳化硅(SiC )、 Si3N4、BN、 AlN、( Al2O3 )等 ④金属晶体---金属单质(除汞外)与合金 2、依据组成晶体的微粒及微粒间的作用判断 (1)离子晶体的微粒是阴、阳离子,微粒间的作用是离子键; (2)分子晶体的微粒是分子,微粒间的作用为分子间作用力; (3)原子晶体的微粒是原子,微粒间的作用是共价键; (4)金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键。 3. 依据晶体的熔点判断 (1)离子晶体的熔点较高,常在数百度至一千余度; (2)分子晶体熔点低,常在数百度以下至很低温度; (3)原子晶体熔点高,常在一千度至几千度; (4)金属晶体熔点高低皆有。 4. 依据导电性判断 (1)离子晶体水溶液及熔化时能导电; (2)分子晶体为非导体,而分子晶体中的电解质(如酸和部分非金属气态氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电; (3)原子晶体一般为非导体,但有些能导电,如晶体硅(半导体); (4)金属晶体是电的良导体。 5. 依据硬度和机械性能判断 (1)离子晶体硬度较大或略硬而脆; (2)分子晶体硬度小且较脆; (3)原子晶体硬度大; (4)金属晶体多数硬度大,但也有较低的,且具有延展性。 *石墨可以看成混合型晶体或过渡晶体。因为石墨中C原子间为共价键连接而层与层间为分子间作用力连接小结:四种晶体类型与性质的比较
教学目标、知识类型和教学方法
教学目标的分类 ——知识领域 一、记忆 心理学认为记忆是人对经历过的事物在头脑中产生的反映。具体到生物教学领域来说,记忆就是指学生对学习过的各种生命现象在头脑中产生反映的过程。 也就是说,是指对各种事物的形态结构特点、发展变化过程的回忆;对学科中的普遍原理、基本理论、基本规律的回忆;对研究学科问题的各种方法的回忆;对事物与周围事物之间的关系的回忆。 1、再认 是指对当学习过的学科知识再次呈现到自己面前时,能够正确地辨别出这些知识,这类行为(这种水平的心理活动)就叫做对这些学科知识的再认。 2、再现 是指当学习过的学科知识没有呈现在自己面前时,能够在头脑中正确地回忆出这些知识。这类行为(这种水平的心理活动)就叫做对这些学科知识的再现。 二、理解 是指学生对各种关于学科语言或文字的信息中所表达的含义的把握;对其中所表达的外显行为的内在体验;并且能将其中所表达的含义正确传递出来的行为。(即能够在心理和行为上反应相关生物学的语言文字所表达的含义)这种水平的心理活动就叫做理解。 1、转化 是指个体能把交流内容转化为其他术语,或转化为另一种交流形式。 2、解释 是指对学习内容的说明或总括,即个体能在头脑中对交流材料重新排列、重新整理或用新的形式进行描述。 3、推断 是指根据对已有知识理解的基础上,从已知的知识中经过推理推测出新的知识。 三、运用 是指学生能在某些特定的或具体的情景中,(学生对于从没有见过的客观现象或问题,能够采用不曾使用过的方式、方法)使用所学过的各种学科知识,解释客观现象产生的原因;解决在个人生活或生产中遇到的与某学科相关的实际问题的行为。 “运用”的标志是:在没有说明为解决的模式的情况下,学生能正确地运用相关的学科知识于相应的情境中,对产生现象的原因做出解释,或者使问题得到解决。 “运用”就是使所学过的知识达到了“迁移”水平。 1、解释与学科相关的现象 是指用所学过的知识(形态结构、功能、关系、概念、原理规律等),经过推
四种晶体比较表
四种晶体比较表 注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。 晶体熔沸点的比较 一、看常态:1、常态:固>液>气。
2、一般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。 3、原子晶体:共价键(取决于原子半径)。 4、离子晶体:离子键(取决于离子半径和离子电荷) 5、金属晶体:金属键(取决于金属原子半径和价电子数) 6、分子晶体:①结构相似,分子量越大,熔沸点越高。 ②分子量相等,正>异>新。③氢键反常 二、看类型 三、分类比较 18.请完成下列各题: (1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。 (2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于晶体。 (3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。 19.生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式。 (2)根据等电子原理,写出CO分子结构式。 (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。 ①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子 中碳原子轨道的杂化类型为。 ②甲醛分子的空间构型是;1mol甲醛分子中σ键的数 目为。 ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。
最新教学模式的种类
教学模式的种类 1 2 由于教学实践依据的教学思想或理论不同,教学实践的形式就不同,从而形3 成不同的教学模式。关于教学模式的种类,国内外不同研究者从不同角度有不4 同的分类。 5 一、从理论根源区分 6 乔以斯和韦尔依据教学模式的理论根源,归纳出4种教学模式: 7 第一种是社会互动教学模式。这种类型的模式的依据是社会互动理论,强调8 教师与学生、学生与学生的相互影响和社会联系。属于这种类型的教学模式有;9 杜威和塞林的小组探索模式,奥利弗和夏沃尔的法理学教学模式,马歇尔和考10 科斯的相互探索模式等。 11 第二种是信息加工教学模式。这种类型的教学模式的依据是信息加工理论,12 把教学看做是一种创造性的信息加工过程,依据计算机、工人智能的运行规程13 确定教学的程序。属于这种类型的教学模式有:施沃德的科学探索教学模式,14 布鲁纳的概念获得教学模式,皮亚杰和西格尔的认知发展教学模式,奥苏贝尔15 的先行组织者教学模式等。 16 第三种是个人教学模式。这种类型的教学模式的依据是个别化教学的理论与17 人本主义的教学思想,强调个人有教学中的主观能动性,坚持个别化教学。属18 于这种类型的教学模式有:罗杰斯的无指导者教学模式,格拉斯尔的教室集会19 教学模式等。 20
第四种是行为修正教学模式。这种类型的教学模式的依据是行为主义心理学21 理论,它把教学看做是一种行为不断修正的过程。属于这种类型的教学模式主22 要有斯金纳的操作条件反射教学模式。 23 按照乔以斯和韦尔的分法,在我国近年出现的一些依据不同思想或理论而建24 立的教学模式有:依据结构主义心理学理论而建立的“结构一定向”教学模式,25 依据“教为主导,学为主体”的教学思想而建立的“学导式”教学模式、“自26 学辅导式”(数学)教学模式,依据课程论和教学过程理论而建立的“六课型27 单元”教学模式,依据认知心理学而建立的“四阶段式”课堂教学模式等等。 28 二、从师生活动关系区分 29 教学模式有的是直接从丰富的教学实践经验中概括和归纳出来的,也有的是30 在一定理论指导下先提出一种假设,经过多次实验而后形成的,所以教学模式31 既是理论体系的具体化又是教学经验的一种系统概括。每个教师无论他自己是32 否意识到,实际上总是在某种教学模式的框架下来开展教学活动的。例如在处33 理课堂教学中教和学这两个主体的关系上,由于不同教学思想的指导,教学模34 式就不相同。 35 按师生活动的关系水平将教学模式分为三大类别: 36 ①以教师活动为主的模式; 37 ②以学生活动为主的模式; 38 ③综合型模式(体现以教师为主导、学生为主体这一思想的教学模式)。 39 第一种模式处于最低一级的水平。在这种模式中,师生之间的关系是一种单40 向反馈的结构,它的表现形态就是记忆水平的教学。它单纯要求学生识记、再41 现教材,而不要求去理论和思考。学生对教师只是简单地模仿,他们完全处于42
教学模式六要素
教学模式有哪些 不同的教学理论、教学目标、教学策略及对师生活动不同安排,就构成不同的教学模式。 一个完整的教学模式,其基本结构应包含以下六个基本要素: 1.教学理论或教学思想 教学模式都是在一定的教学理论或教学思想指导下建立的。“每一个模式都有一个内在的理论基础”。教学模式的方向性和独特性是由一定的教学理论或思想决定的。例如:程序教学模式的理论基础是行为主义心理学;结构主义教学模式(布鲁纳的概念获得模式)的理论基础是认知心理学;非指导性教学模式的理论依据是人本主义心理学。 2.教学功能目标 任何教学模式都要指向一定的教学目标,即教学模式是为了完成特定的教学目标而设计构建的。教学目标是教学模式构成的核心要素,它影响着教学模式的操作程序和师生的组合方式,也是教学评价的标准和尺度。例如,合作教学模式的功能目标是使学生具有民主精神、独立人格、交往能力和创造才能。 3.教学结构及活动程序 任何教学模式都有一套独特的教学结构和体现教学活动的逻辑过程的操作顺序。教学模式的一个显著特征是合理处理
教学过程诸要素的相互关系和合理确定按照时间流程从逻辑上展开的各个教学步骤(即教学过程结构)例如,加涅的累积性教学模式的活动程序是:注意→知觉→获得→保持→提取→迁移→反馈→强化,八个步骤。它包含了教材内容的展开顺序、师生复杂心理活动顺序、教学方法的运用顺序这三个方面的整合。 4.师生交往系统 在教学中,师生交往的方式、方法、地位、角色、关系、相互作用等的不同配合是构成一定的教学模式的重要要素。主要有四种类型:⑴高度集中型(如讲授模式),即教师是活动的中心,是信息的来源,是教学的组织者和协调者。⑵温和型(如“探究──发现”模式、合作模式)。即教师与学生在教学活动中的作用相当,教学民主,教师通过启发引导学生自主进行意义建构,主动获取知识、发展能力。⑶放任型(即松散型,如自学辅导模式、活动教学模式),即以学生为中心,鼓励学生独立思考,教师只提供一些帮助和辅导,教学目标和教学内容具有较大的弹性。⑷管理型(如程序教学模式),这是高度集中型和温和型的中间类型。 5.反馈方式 反馈方式指教师如何看待学生,如何对学生的外显行为作出反应。不同的教学模式对教师的反馈方式有不同的要求。6.支持条件
几种常见晶体结构分析.
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话::: 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞) 中,处于不同位置的微粒在该单元中所占的份额也有 所不同,一般的规律是:顶点上的微粒属于该单元中 所占的份额为18 ,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12 ,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个C l -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的 Cl -围成的空间构型为正八面体。每个N a +周围与其最近且距离相等的Na + 有12个。见图1。 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4 因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。 2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与 一个Cs +距离最近且相等的Cs +有6个。晶胞中平均Cs +个数:1;晶胞中平 均Cl -个数:8×18 = 1。 因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4 个C 原子紧邻,因而整个晶体中无单个分子存在。由共价键构成的最小 环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环 共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6× 112 = 12 ,平均C —C 键数为6×16 = 1。 C 原子数: C —C 键键数 = 1:2; C 原子数: 六元环数 = 1:2。 2.二氧化硅晶体结构与金刚石相似,C 被Si 代替,C 与C 之间插氧,即为SiO 2晶体,则SiO 2晶体中最小环为12环(6个Si ,6个O ), 最小环的平均Si 原子个数:6×112 = 12;平均O 原子个数:6×16 = 1。 即Si : O = 1 : 2,用SiO 2表示。 在SiO 2晶体中每个Si 原子周围有4个氧原子,同时每个氧原子结合2个硅原子。一个Si 原子可形 图 1 图 2 NaCl 晶体 图3 CsCl 晶体 图4 金刚石晶体
四种晶体类型的比较
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。例如:NaBr(固)>Br2>HBr(气)。
2、不同类型晶体的比较规律 一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。例如:金刚石>食盐>干冰 3、同种类型晶体的比较规律 A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
教学模式的种类
教学模式的种类 The latest revision on November 22, 2020
教学模式的种类 由于教学实践依据的教学思想或理论不同,教学实践的形式就不同,从而形成不同的教学模式。 关于教学模式的种类,国内外不同研究者从不同角度有不同的分类。 一、从理论根源区分 乔以斯和韦尔依据教学模式的理论根源,归纳出4种教学模式: 第一种是社会互动教学模式。 这种类型的模式的依据是社会互动理论,强调教师与学生、学生与学生的相互影响和社会联系。属于这种类型的教学模式有; 杜威和塞林的小组探索模式, 奥利弗和夏沃尔的法理学教学模式, 马歇尔和考科斯的相互探索模式等。 第二种是信息加工教学模式。 这种类型的教学模式的依据是信息加工理论,把教学看做是一种创造性的信息加工过程,依据计算机、工人智能的运行规程确定教学的程序。 属于这种类型的教学模式有: 施沃德的科学探索教学模式, 布鲁纳的概念获得教学模式, 皮亚杰和西格尔的认知发展教学模式, 奥苏贝尔的先行组织者教学模式等。 第三种是个人教学模式。 这种类型的教学模式的依据是个别化教学的理论与人本主义的教学思想,强调个人有教学中的主观能动性,坚持个别化教学。 属于这种类型的教学模式有: 罗杰斯的无指导者教学模式, 格拉斯尔的教室集会教学模式等。 第四种是行为修正教学模式。 这种类型的教学模式的依据是行为主义心理学理论,它把教学看做是一种行为不断修正的过程。 属于这种类型的教学模式主要 有斯金纳的操作条件反射教学模式。 按照乔以斯和韦尔的分法, 在我国近年出现的一些依据不同思想或理论而建 立的教学模式有:依据结构主义心理学理论而建立的“结构一定向”教学模式,依据“教为主导,学为主体”的教学思想而建立的“学导式”教学模式、“自学辅导式”教学模式, 依据课程论和教学过程理论而建立的“六课型单元”教学模式, 依据认知心理学而建立的“四阶段式”课堂教学模式等等。 二、从师生活动关系区分 教学模式有的是直接从丰富的教学实践经验中概括和归纳出来的,也有的是
