蛋白免疫印迹杂交(Western Blot)技术手册

蛋白免疫印迹杂交(Western Blot)技术手册
蛋白免疫印迹杂交(Western Blot WB)是将蛋白样本通过聚丙烯酰胺电泳按分子量大小分离,再转移到杂交膜(blot)上,然后通过一抗/二抗复合物对靶蛋白进行特异性检测的方法。WB是进行蛋白质分析最流行和成熟的技术之一。本指南讨论Western Blot操作方法及常见问题分析,有助于成功完成WB。
A 蛋白样本提取制备
1 细胞或组织裂解
2 蛋白酶和磷酸酶抑制剂
3 蛋白定量
4 电泳上样样品的准备
B 电泳
1 PAGE胶的制备
2 蛋白分子量Marker
3 阳性对照
4 内参对照
5 上样与电泳
C 转膜与显色(Western Blot)
1 胶中蛋白的检测
2 蛋白转膜
3 膜上蛋白的检测:丽春红
4 膜的封闭
5 一抗的孵育
6 二抗的孵育
7 显色
D 常见问题分析与解决方案
附录1 WB实验试剂配制方法
附录2 SDS-PAGE胶的配制
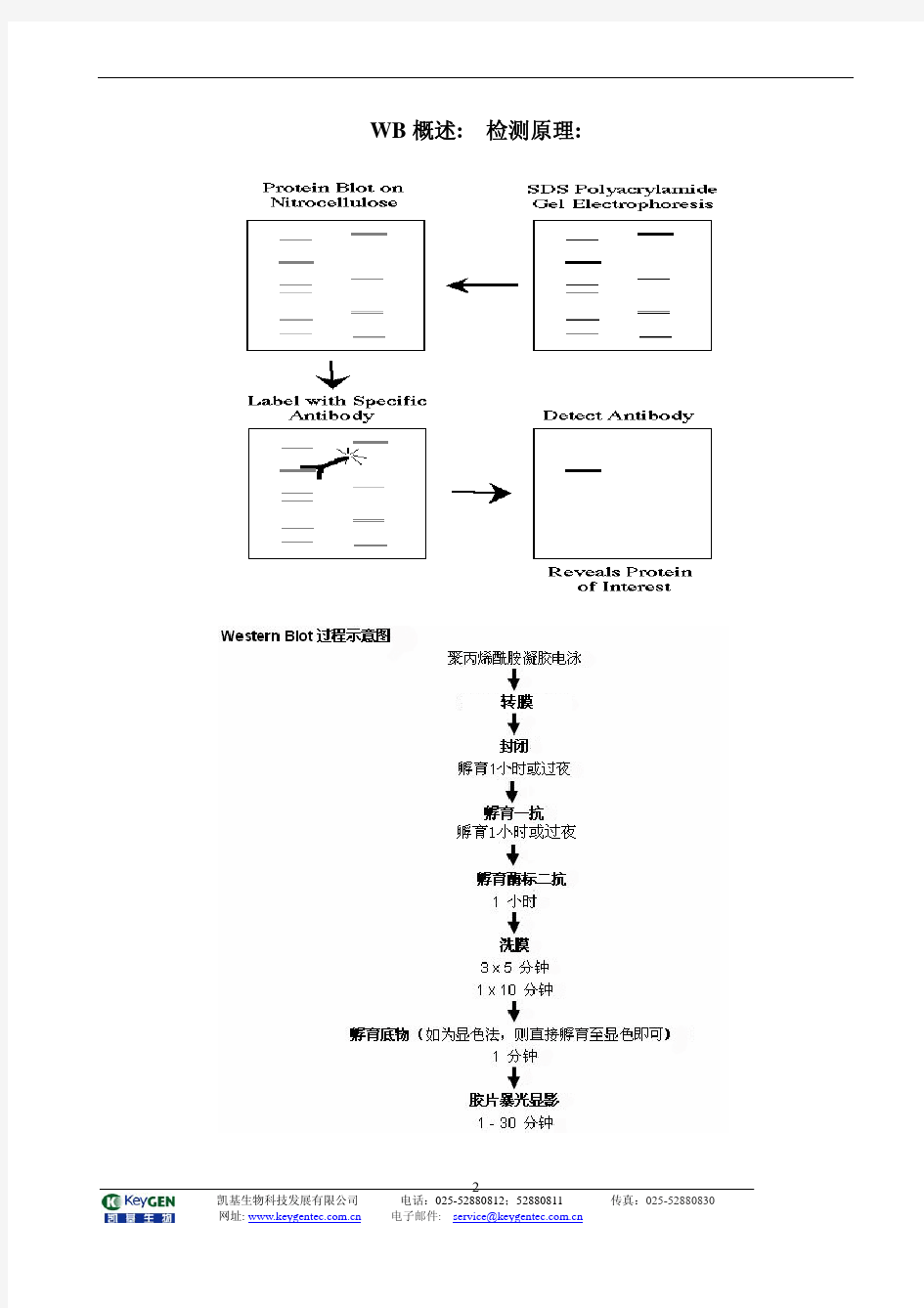
WB概述: 检测原理:
A 蛋白样本提取制备
蛋白样品制备是Western Blotting的第一步,更是决定WB成败的关键步骤,
总体原则和注意事项:
1:尽可能提取完全或降低样本复杂度只集中于提取目的蛋白
(通过采用不同提取方法或选择不同的试剂盒产品)
2:保持蛋白的处于溶解状态(通过裂解液的PH 盐浓度 表面活性剂、还原剂等的选择)
3:提取过程防止蛋白降解、聚集、沉淀、修饰等,(低温操作,加入合适的蛋白酶和磷酸酶抑制剂) 4:尽量去除核酸,多糖,脂类等干扰分子(通过加入核酸酶或采取不同提取策略)
5:样品分装,长期于-80℃中保存,避免反复冻融。
A-1 细胞或组织裂解
A-1-1 细胞裂解
裂解液Lysis buffer或商品化蛋白抽提试剂盒的选择*
目的蛋白分布定位推荐裂解液Lysis buffe 推荐试剂盒
全细胞NP-40 or RIPA(附录1)全蛋白抽提试剂盒
细胞质(可溶蛋白)Tris-HCl(附录1)胞浆蛋白和核蛋白抽提试剂盒
线粒体蛋白提取试剂盒
细胞质(细胞骨架等不溶蛋白)Tris-Triton(附录1)蛋白分级抽提试剂盒
细胞质(磷酸化蛋白)磷酸化蛋白抽提试剂盒
细胞膜NP-40 or RIPA(附录1)膜蛋白抽提试剂盒
蛋白分级抽提试剂盒
细胞核RIPA(附录1)核蛋白抽提试剂盒
线粒体RIPA(附录1)线粒体蛋白抽提试剂盒
亚细胞定位蛋白抽提试剂盒细胞裂解操作方法:
1 培养的细胞经预冷的PBS漂洗2次,裂解液中加入蛋白酶和磷酸酶抑制剂(种类与量见本节2)
2 吸净PBS,加入预冷的裂解液,((1 ml per 107 cells/100mm dish/150cm2 flask; 0.5ml per 5x106
cells/60mm dish/75cm2 flask).
3 用细胞刮子刮取贴壁细胞,将细胞及裂解液温和地转移至预冷的微量离心管中,
44℃摇动30 min
54℃离心12,000 rpm,20 min(根椐细胞种类不同调整离心力)
6 轻轻吸取上清,转移至新预冷的微量离心管中置于冰上,即为蛋白样本,弃沉淀.
A-1-2 组织裂解
1 用灭菌的预冷的工具分离目的组织,尽量置于冰上以防蛋白酶水解,
2 将组织块放在圆底的微量离心管或Eppendorf管中,加入液氮冻结组织于冰上均质研磨,长期可保存于
-80°C,
3 每约5 mg加入约300 μl 预冷的裂解液lysis buffer,冰浴匀浆后置于4℃摇动2小时,裂解液体积与组
织样本量有适当比例,(最终的蛋白浓度至少达到0.1 mg/ml, 理想的蛋白浓度应为1-5 mg/ml).
4 4℃离心12,000 rpm,20 min,轻轻吸取上清,转移至新预冷的微量离心管中置于冰上,即为蛋白样本,
弃沉淀,
A-2 蛋白酶和磷酸酶抑制剂
推荐购商品化蛋白酶和磷酸酶抑制剂复合试剂盒或COOKTAIL,或按下表配制:
备注:其中Sodium orthovanadate 配制活化方法如下:
所有步聚均需在通风橱中进行:
1. 用双蒸水配制100 mM 正矾酸钠溶液.
2. 用盐酸HCl 调至pH 9.0
3. 煮沸至溶液无色,尽量减少水分挥发.
4. 冷却至室温
5. 再调pH 至 9.0
6. 再煮沸至无色
7. 重复上述过程,直至溶液煮沸冷却后达pH 9.0
8. 用水定容至原体积
9. 分装保存于- 20°C. 溶液变黄则弃之不用.
A-3 蛋白定量
Bradford 法 Lowry 法或BCA 法(均有商品化试剂盒可选择,操作简单、需分光光度计或酶标仪),小牛血清白蛋白 (BSA) 作为标准曲线。如果裂解液中有NP40或其它表面活性剂,则推荐使用BCA 法。三种方法或产品比较列表如下:
方法 原理 灵敏性 干扰因素 应用
Lowry法 Folin-酚试剂法
蛋白质在碱性溶液中
肽键与Cu2+螯合,形成蛋白
质一铜复合物,还原酚磷
钼酸产生蓝色化合物,蓝
色深浅与蛋白质浓度呈线
性关系
较高约5μg/ml
对可达1-1500μg/ml
适用于脂类含量较
高的样品测定,也能
耐受相当浓度的去
垢剂如SDS。
受硫酸铵;Tris缓冲
液;甘氨酸;各种硫
醇干扰
耗费时间长40~
60分钟;操作要严
格计时;颜色深浅
随不同蛋白质变
化; 标准曲线不
是严格的直线形
式,且专一性差
Bradford法 考马斯亮蓝G-250与蛋白
质结合呈蓝色,在波长
595nm吸收峰,在一定的范
围内与蛋白质的含量呈线
性关系 高约1~5μg/ml,
微孔法测定范围为
1-25μg/ml
试管法测定范围为
100-1500μg/ml
易受强碱性缓冲液,
TritonX-100,SDS
等去污剂的影响
快速5~15分钟,
颜色稳定;深浅随
不同蛋白质变化;
标准曲线有轻微
的非线性
BCA法 BCA法基于双缩脲原理,碱
性条件下蛋白质将Cu2+还
原成Cu1+ ,BCA
(Bicinchoninic 酸)螯
合Cu1+ 作为显色剂,产
生兰紫色并在562 nm有吸
收峰单价Cu1+与蛋白呈剂
量相关性, 很高0.5-20μg/ml
试管法可测范围 20
2,000 μg/ml
微孔法为 0.5~10μ
g/ml
不易受一般浓度去
污剂的干扰
可受螯合剂;略高浓
度的还原剂的影响
较快40分钟内,
较好的方法;抗干
扰能力强
BCA测定方法如下:
A.酶标板操作
1.标准曲线的绘制:取一块酶标板,按照下表加入试剂
孔号0 1 2 3 4 5 6 7
蛋白标准溶液(μL)0 1 2 4 8 12 16 20
去离子水(μL)20 19 18 16 12 8 4 0
对应蛋白含量(μg)0 0.5 1.0 2.0 4.0 6.0 8.0 10.0
2.根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混
匀;
3.各孔加入200μL BCA工作液;
4.把酶标板放在振荡器上振荡30sec,37℃放置30分钟,然后在562nm下比色测定。以蛋白含量(μg)
为横坐标,吸光值为纵坐标,绘出标准曲线;
5.稀释待测样品至合适浓度,使样品稀释液总体积为20μL,加入BCA工作液200μL,充分混匀,37
℃放置30分钟后,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;
6.根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(20
μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
B.分光光度计测定
1.标准曲线的绘制:各管按照下表加入试剂
孔号0 1 2 3 4 5 6 7
蛋白标准溶液(μL)0 5 10 20 40 60 80 100
去离子水(μL)10095 90 80 60 40 20 0
对应蛋白含量(μg)0 2.5 5.0 10.020.030.040.0 50.0
2.根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混
匀;
3.各管加入1000μL BCA工作液;
4.各管充分混匀,37℃放置30分钟,然后在562nm下比色测定。以蛋白含量(μg)为横坐标,吸光
值为纵坐标,绘出标准曲线;
5.稀释待测样品至合适浓度,样品稀释液总体积为100μL,加入BCA工作液1000μL,充分混匀,37
℃放置30分钟后,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;
6.根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(100
μL),乘以样品稀释倍数即为样品实际浓度(单位:μg/μL)。
A-4 电泳上样样品的准备
A-4-1 变性、还原蛋白样本
一般的抗体只能识别抗原蛋白中的部份序列结构(表位),因此,为使抗体能够达到结合该表位而需要将蛋白样本进行变性,使之打开折叠的空间结构,
蛋白变性一般使用含阳离子变性去污剂如SDS的上样buffer (loading buffer),并于95-100°C 煮沸 5分钟,对于多次跨膜蛋白,可以于70°C 加热 5-10分钟,标准的上样buffer称为2X Laemmli buffer,上样时与样本!:!混合后变性上样即可:
2X Laemmli buffer
4% SDS
10% 2-mercaptoehtanol
20% glycerol
0.004% bromophenol blue
0.125 M Tris HCl
Check the pH and bring it to pH 6.8.
SDS的阴离子环绕蛋白肽键使之带负电荷,蛋白分子量不同,结合的SDS数量不同,所带负电荷也不同,电泳迁移速度不同,因此SDS-PAGE电泳可将不同分子量的蛋白分离开。
A-4-2天然和非还原样本
某些抗体识别的表位是非连续氨基酸构成的蛋白三维结构,此种情况则需要进行非变性的WB,抗体的说明书一般会标注,这种非变性电泳不加SDS,样本也不需煮沸。
某些抗体仅识别蛋白的非还原态,如某些cysteine基的氧化态,因此loading buffer和电泳液中不加入?-mercaptoethanol and DTT
蛋白状态 凝胶状态 loading buffer 电泳缓冲液
有SDS
还原—变性 还原和变性 有 ?-mercaptoethanol 或
DTT 和SDS
无SDS
还原—天然 还原和非变性 有?-mercaptoethanol 或
DTT ,无SDS
氧化-变性 非还原和变性 无?-mercaptoethanol 或
有SDS
DTT ,有SDS
无SDS
氧化-还原 非还原和天然 无?-mercaptoethanol 或
DTT ,无SDS
注:除说明书特别标注之外,一般情况下,均使用变性和还原电泳
B 电泳
B-1 PAGE胶的制备
聚丙酰胺凝胶PAGE电泳根椐蛋白分子量进行分离蛋白,PAGE胶是由两种化合物聚合而成的,即丙烯酰胺(acr)和N,N-甲叉双丙烯酰胺(Bis).,聚合需加入过硫酸铵及DMAP 或 TEMED,凝胶为中性、水溶性、三维网状结构。凝胶的孔径取决于总丙烯酰胺的百分含量(%T))和交联度(%C),T%=(a+b)/m*100%; 和
C%=a/(a+b)*100%,其中: a=双体(bis)的重量 ;b=单体(arc)的重量 ;m=溶液的体积(ml) 。丙烯酰胺总量增加,则孔径减小,5%C构成最小的孔径,任何的 %C增加或降低,孔径都增加,凝胶的百分浓度组成需两个参数,丙烯酰胺(acr)和N,N-甲叉双丙烯酰胺(Bis).的总量百分浓度(w/v)。
不同分子量的蛋白选择不同的凝胶浓度(参考下表》,原则上高分子量蛋白用低浓度胶,低分子量蛋白用高浓度胶分离。
蛋白分子量 (kDa)凝胶浓度 (%)
4-40 20
12-45 15
10-70 12.5
15-100 10
25-200 8
不同浓度的凝胶的配制方法见附录2首先配制各组分贮备液,然后分别配制浓缩胶和分离胶。
B-2 蛋白分子量Marker
预染或非预染各种分子量的蛋白,用于标示电泳中蛋白的大小和示踪
商业化产品:
非预染Marker (MW 116, 97.4, 66, 45, 36 29, 24, 20.1, 14.2KDa)
预染Marke r (MW 116, 97.4, 66, 45, 36 29, 24, 20.1, 14.2KDa)
B- 3 阳性对照
目的蛋白或明确表达目的蛋白的组织或细胞的蛋白提取物,用于检验整个实验体系和过程的正确性有效性/特别是一抗的质量和效率。建议使用该对照。可查阅文献或抗体说明书选择购买或自提该对照样本。 B-4 内参对照
管家基因编码的、很多组织和细胞中都稳定表达的蛋白,用于检测整个WB 实验过程及体系是否正常工作,并作为半定量检测目的蛋白表达量的标准对照。必须设立。
内参Beta-actin 抗体 at 1/5000 dilution, Lysates/proteins at 20 ug per lane Lane 1 : HeLa nuclear Lane 2 : HeLa whole
cell lysate Lane 3 : A431 cell lysate Lane 4 : Jurkat cell lysate Lane 5 : HEK293 cell lysate.
B-5 上样与电泳
每孔上样量为20-40 μg 蛋白,使用专用枪头或注射针头,勿溢出加样孔, 标准电泳缓冲液:1X Tris-glycine:
25 mM Tris base 190 mM glycine 0.1% SDS 调 pH;8.3.
电泳时间按电流仪说明书推荐方法使用,(1小时或过夜,取决于电压大小),当染料到达胶的底部,关电源停止电泳,胶不能存放,应立刻进行下一步的转膜。
C 转膜与显色(Western Blot )
C-1 胶中蛋白的检测
电泳后检测蛋白是否迁移正确与平均,可采用铜染或考马斯蓝染色检测,如果凝胶中的蛋白需要进行转膜则需可逆的铜染法,否则采用不可逆考马斯蓝法染色。
铜染法:电泳胶用蒸馏水洗数秒钟,加入0.3 M CuCl2染色5-10分钟,再用去离子水洗一次,在暗背景下观察在兰色胶背景下蛋白出现透明条带,胶置于0.1- 0.25 M Tris/0.25 M EDTA pH 8.0缓冲液中漂洗脱色两次,再置于电转缓冲液中开始转膜。
考马斯蓝法:用40%双蒸水, 10% 醋酸, 50%甲醇的溶液固定胶中蛋白,考马斯蓝R-250染液(凯基产品)室温染色4小时至过夜,保持摇匀,转入67.5%双蒸水, 7.5% 醋酸, 25%甲醇l 摇匀至脱去多余的染料,蛋白被染成深蓝色。
C-2 蛋白转膜
蛋白因结合SDS而带电荷,在电场下从胶中转至膜上,转膜操作根椐电转仪制造商的说明书进行转膜方式分为半干和湿转两种,半干式转膜速度快,而湿式成功率高并特别适合用于分子量大于100KD的蛋白。
湿式转膜三明治排列为:海绵/纸/胶/膜/纸/海绵,全部紧密排列,特别是胶/膜之间不能留有气泡,三明治安放的方向确认正确负极方为带负电的胶里的蛋白,向正极方(膜)电迁移。
标准的电转缓冲液为1X Tris-glycine buffer 不含SDS,但加入20%甲醇,如果转膜的蛋白分子量大于80KD,则推荐加入SDS使之终浓度为0。1%。
半干式转膜中,三明治的排列为:/纸/胶/膜/纸,用电转缓冲液浸湿后,直接置于电转仪的正负极之间。胶于负极而膜置于正极。半干式的电转缓冲液可不同于湿式的电转缓冲液,推荐为:48 mM Tris, 39 mM glycine, 0.04% SDS, 20%甲醇,
两类膜可供选择:硝酸纤维素膜和PVDF膜(正电荷尼龙膜),根据不同需要选择(下表),PVDF膜需要浸泡甲醇中1-2分钟,再孵育于冰冷的电转缓冲液中5分钟,胶也需在冰冷的电转缓冲液中平衡3-5分钟,否则转膜时会导致条带变形。
注:大蛋白和小蛋白的转膜
电转移缓冲液中SDS与甲醇的平衡、蛋白的大小、胶的浓度都会影响转膜效果,如下调整可以增加转膜效率:
大蛋白(大于100 KD)
1.对于大蛋白而言,其在凝胶电泳分离迁移较慢,而从凝胶转出也非常慢,因此对于这种大分子量蛋白应该用低浓度的凝胶,8%或更低,但因低浓度的胶非常易碎,所以操作时需十分小心,
2 大蛋白易在凝胶里形成聚集沉淀,因此;转膜时在电转移缓冲液加入终浓度为0.1%的SDS,以避免出现这种情况,甲醇易便SDS从蛋白上脱失,因此应降低电转移缓冲液中甲醇的浓度至10%或更低,以防止蛋白沉淀。
3 降低电转移缓冲液中甲醇的比例以促进凝胶的膨胀,易于大蛋白的转出。
4 如果使用硝酸纤维素膜,甲醇是必需的,但如果是PVDF膜,甲醇可以不必加入电转移缓冲液中,但转膜前PVDF需用甲醇活化。
5 选择湿式,4℃转膜过夜,以取代半干式转膜。
小蛋白(小于100 KD
1 SDS妨碍蛋白与膜的结合,特别是对小蛋白更是如此,因此,对于小分子的蛋白,电转移缓冲液中可以不加SDS。
2 保持20%的甲醇浓度
对于大于500KD的蛋白,请参考下述文献:Bolt and Mahoney, High-efficiency blotting of proteins of diverse sizes following sodium dodecyl sulfate–polyacrylamide, gel electrophoresis. Analytical Biochemistry 247, 185–192 (1997).
更多的转膜注意事项:
?避免用直接接触膜,应使用镊子,手指上的油脂与蛋白会封闭转膜效率并易产生背景污斑
?排列三明治时,尽量用移液器或15ml试管赶除胶与膜之间的气泡,或将三明治放在装有的培养皿中以防止气泡产生,请戴手套!
?确认裁剪的膜和滤纸与凝胶尺寸相同,否刚导致电流不能通过膜,从而转膜无效
?鸡抗体易于与PVDF膜和其它尼龙膜结合,导致高背景,请替换成硝酸纤维素膜以降低背景。
C-3 膜上蛋白的检测:丽春红
为检测转膜是否成功,可用丽春红染色,
2%的丽春红贮备液(20ML):: 2%丽春红(0.4克)溶于30%三氯乙酸(6克)和30%磺基水杨酸(6克)
丽春红染色工作液:2%的丽春红贮备液1:10稀释,即加9 倍的ddH2O
染色方法:
将膜放入TBST洗一次,再置于丽春红染色工作液中,在室温下摇动染色5分钟,大量的水洗膜直至水变清无色蛋白条带清晰,(膜也可以用TBST或水重新洗后再进行染色)PVDF膜需用甲醇再活化后用TBST 洗后进行封闭。
10x TBS的配制
24.23 g Trizma HCl
80.06 g NaCl
加约 800 ml 超纯水
用纯HCl调pH 至7.6
定容至 1 L.
TBST的配制
配制 1 L TBST:: 量取100 ml 10x TBS + 900超纯水+ 1ml Tween20
Tween20非常粘稠,用枪头不易吸取,请确定加入准确的量,最好用Tris buffer.配成10%的Tween20母液后使用。
C-4 膜的封闭
为防止一抗或/和二抗与膜的非特异性结合产生的高背景,因此需要进行膜的封闭,
传统上有两种封闭液:脱脂奶粉或BSA,脱脂奶粉成本低但不能用于磷酸化蛋白(因脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白),使用脱脂奶粉会结合磷酸化抗体从而易产生高背景。
某些抗体用BSA封闭时因不明原因可能会产生比脱脂奶粉更强的信号,,请仔细阅读说明书注明的注意事项和膜的特殊的封闭方法。
配制5%脱脂奶粉或 BSA 溶液:每100 ml TBST中加入5 g脱脂奶粉或 BSA,混匀后过滤,如不过滤会导致使膜污染上细微黑颗粒。
封闭时,4°C摇动,封闭1 hour ,再用TBST洗5秒,进入下一步抗体的孵育。
C-5 一抗的孵育
孵育Buffer:按抗体说明书建议的稀释倍数,用TBST稀释一抗,如果说明书没有建议的稀释倍数,则参照一般推荐的稀释倍数(1:100-1:3000),一抗浓度过高会导致产生非特异性条带。
某些实验室传统上在封闭液中孵育抗体,而有些实验室用不含封闭剂的TBST来孵育抗体,结果因抗体而异,有时两者结果相同,有时结果不同。
注:如果不存在高背景的问题,某些抗体用含低浓度(0.5 – 0.25%) 脱脂奶粉或 BSA的封闭液来,稀释,可产生相对更强的信号条带。
孵育时间:一抗的孵育时间可从几小时至过夜(一般不超过18小时)不等,取决于抗体与蛋白的亲和性和蛋白的含量丰度,建议使用较高的抗体稀释倍数和较长的孵育时间来保证特异性结合。
孵育温度:尽可能低温孵育,如果在封闭液中孵育一抗过夜,应在4o C进行否则会产生污染而破坏蛋白(降别是磷酸基团)。
孵育一抗时需保持适当的摇动使之均匀覆没膜,防止结合不均匀。
C-6 二抗的孵育
一抗孵育结束后,用TBST摇动洗膜数次,每次5min或更长,去除残留的一抗。
孵育Buffer和稀释倍数:用TBST按说明书推荐的倍数稀释二抗,如果说明书没有标出稀释倍数,则按常规的倍数稀释(1:1000- 1:20,000)预试,二抗的浓度过高也会导致非特异性条带。亦可以在封闭液中孵育二抗(和一抗),但可能在降低背景同时导致特异性条带的信号也减弱,可能是封闭剂阻碍了抗体与靶蛋白的结合。
孵育时间和温度:室温、1-2 hours,摇动
二抗连接物:推荐使用二抗连接HRP,不建议连接AP碱性磷酸酶,因其不够灵敏。
C-7显色
显色分为酶促底物发光和化学发光法或荧光法
酶促底物发光法代表为DAB显色法,与其它同类方法的比较如下图所示:
而现在最常用的是化学发光法:HRP化学发光底物 Luminol(ECL法 chemiluminescence)及其改良法,
对于 HRP 偶联的二抗,一般传统上使用ECL 和ECL+,推荐使用后者,更灵敏。其中不同商家的产品特点总结如下表:
SuperSignal? West Pico
化学发光底物
SuperSignal? West Femto 超灵敏型底物
SuperSignal? West Femto 增强型底物
主要优点
与ECL? 系统相比减半的价格、双倍的信号 适用于HRP 检测的最灵敏的化学发光底物 延长的信号持续时间使这种底物用于今天的成像设备最为理想 检测下限 10-12g 10-15g 10-14g 信号持续时间
6-8小时
8小时
24小时
首选检测方法
X 胶片 成像设备或X 胶片 成像设备或X 胶片
建议一抗稀释度 1:1000-1:5000 1:5,000-1:100,000 1:1000-1:50,000
建议二抗稀释度
1:20,000-1:100,000 1:100,000-1:500,000 1:50,000-1:250,000 产品保存期 室温1年 4℃1年或室温6个月 室温1年 建议印迹膜 硝化纤维
硝化纤维或PVDF
硝化纤维或PVDF
X-ray 胶片:传统上使用手工曝光的方法,可控制X-ray 胶片在曝光和在定影剂的时间调节。而全自动X-ray 胶片曝光器也广泛使用并操作简便。
注意不能过度曝光,特别不适于检测相对蛋白量,过度曝光导致全暗的背景没有反差和/或产生大量的非特异性条带。
数字图像显影:新一代的胶片显色方法是使用数码相机在暗室中拍摄膜上的化学发光,将其转成数字信号,再通过仪器自带的软件进行分析。 有些新一代商品化的数字成像仪器已不再检测HRP连接的抗体(如:ECL chemiluminescence),如STORM分析仪只检测荧光标记的抗体。
D 常见问题分析与解决方案
问题可能原因验证或解决办法
封闭不充分 延长封闭时间,
更换合适的封闭剂(脱脂奶粉,BSA,血清等)
一抗浓度过高 增加一抗稀释倍数,
抗体孵育温度过高 4℃孵育
二抗非特异性结合
或与封闭剂交叉反应
设置二抗对照(不加一抗),降低二抗浓度
一抗或二抗与封闭剂 有交叉反应 在孵育和洗涤液中加入Tween-20 以减少交叉反应.
洗膜不充分 增加洗涤次数
膜不合适 NC膜比PVDF膜背景低
背景高
膜干燥 保证充分的反应液,避免出现干膜现象
一抗、二抗等不匹配 订购试剂时认真选取一抗与组织种属,一抗与二抗或/和底物与酶系统之间相匹配的抗体及底物。可通过设置内参可以验证二级检测系统的有效性。
一抗或/和二抗浓度低 增加抗体浓度,延长孵育时间
封闭剂与一抗或二抗有交叉反应 封闭时使用温和的去污剂,如TWEEN20,或更换封闭剂(常用的脱脂奶、BSA、血清或明胶
一抗不识别目的物种的靶蛋白 检查说明书,或做ClustalW比对,设阳性对照
样本中无靶蛋白或靶蛋白含量过低(抗原无效) 设置阳性对照,如果阳性对照有结果,但标本没有则可能是标本中不含靶蛋白或靶蛋白含量太低。后者可增加标本上样量至少每孔20-30ug蛋白,样本制备时使用蛋白酶抑制剂,或分级提取目的蛋白。
转膜不充分,或洗膜过度 使用丽春红S检测转膜效果,PVDF膜需浸透,需正确的转膜操作,勿过度洗膜
过度封闭 使用含0.5%脱脂奶或无脱脂奶的抗体稀释液,或更换封闭剂,减少封闭时间
一抗失效 使用有效期内抗体,分装保存,避免反复冻融取用, 工作液现配现用
二抗受叠氮钠抑制 所用溶液和容器中避免含有叠氮钠(HRP的抑制剂)
酶和底物失效 直接将酶和底物进行混合,如果不显色则说明酶失活了。选择在有效期内、有活性的酶联物,使用新鲜的底物.
没有阳性条带
或很弱
曝光时间过短 延长曝光时间
多非特异性条带
细胞传代次数过多,使其蛋白表达模使用原始或传代少的细胞株,或平行实验
式的分化
体内表达的蛋白样本具有多种修饰
形式:乙酰化、磷酸化、甲基化、烷
基化、糖基化等
查文献,使用去修饰的试剂使蛋白恢复其正确的大小 蛋白样本降解 使用新鲜制备的标本,并使用蛋白酶抑制剂
新蛋白或同族蛋白的分享同种表位的不同剪接方式 查其它文献报导,或BLAST搜寻,使用说明书报导的细胞株或组织
一抗浓度过高 降低抗体浓度,可以减少非特异性条带
二抗浓度过高
产生非特异性结合 降低抗体浓度,增加二抗对照
选择特异性更强,只针对重链的二抗
抗体未纯化 使用单克隆或亲和纯化的抗体,减少非特异条带 或条带位置不对
蛋白存在二聚体或多聚体 SDS-PAGE电泳上样前,煮沸10 min, 以增强蛋白质解聚变性
转膜时有气泡或抗体分布不均 尽量去除气泡,抗体孵育时保持摇动 背景有白色/黑色斑
点 抗体与封闭剂结合 过滤封闭剂
暗片现白条带 一抗或二抗加入过多 稀释抗体的浓度
目的条带过低/过高 SDS-PAGE胶浓度选择不合适 调整胶浓度,分子量大的蛋白用低浓度胶,分子量小的蛋白用高浓度胶
“微笑”条带 迁移过快
电泳温度过高
降低电泳速度,低温电泳(冷室)
膜没有完全均匀湿透 使用100% methanol浸透膜
靶蛋白分子量小于10,000 选择小孔径的膜,缩短转移时间
靶蛋白等电点等于或接近转移缓冲
液pH值
可尝试使用其他缓冲液如CAPS缓冲液(pH 10.5)或使用低pH值
缓冲液如乙酸缓冲液
甲醇浓度过高
过高甲醇浓度会导致蛋白质与SDS分离,从而沉淀在凝胶中,同
时会使凝胶收缩或变硬,从而抑制高分子量蛋白的转移。降低甲
醇浓度或者使用乙醇或异丙醇代替
转膜不充分
转移时间不够Thick gel 对于厚的胶以及高分子量蛋白需要延长转移时间
附录1 WB 实验
试剂配方
1 Nonidet-P40 (NP40) buffer
150 mM sodium chloride 1.0% NP-40 (或Triton X-100 ) 50 mM Tris, pH 8.0
2 RIPA buffer (R adio I mmuno P recipitation A ssay buffer ) 150 mM sodium chloride 1.0% NP-40 or Triton X-100 0.5% sodium deoxycholate
0.1% SDS (sodium dodecyl sulphate) 50 mM Tris, pH 8.0
注:The 10% sodium deoxycholate stock solution (5 g into 50 ml) must be protected from light.
3 Tris-HCl buffer 20 mM Tris-HCl, pH 7.5
4 Tris-Triton buffer 10 mM Tris, pH 7.4 100 mM NaCl 1 mM EDTA 1 mM EGTA
1% Triton X-100
Optimization of secondary antibody dilution for immunodetection of ERK 1 with Immobilon Western Chemilumin-escent HRP Substrate. Two-fold dilutions of rat liver lysate samples were applied to each gel. Electroblotted proteins were probed with rabbit anti-ERK 1 antibody (1:1,000 dilution) and HRPconjugated goat anti-rabbit IgG (1:5,000,
1:20,000 and 1:100,000dilutions, left to right).
10% glycerol
0.1% SDS
0.5% deoxycholate
All four of these buffers will keep at 4o C for several weeks or for up to a year aliquotted and stored at -20o C.
5 TBS 10x (concentrated TBS)
24.23 g Trizma HCl
80.06 g NaCl
Mix in 800 ml ultra pure water.
pH to 7.6 with pure HCl.
Top up to 1 L.
TBST
For 1 L: 100 ml of TBS 10x + 900 ml ultra pure water + 1ml Tween20
6 PBS: 1.16 g Na2HPO4, 0.1 g KCl, 0.1 g K3PO4, 4 g NaCl (500 ml distilled water) pH 7.4
附录2 SDS-PAGE胶的配制
一30% (W/V) Acrylamide 的配制
1称量Acrylamide290g,Bis10 g下列试剂,置于1 L烧杯中
2向烧杯中加入约600 ml的去离子水,充分搅拌溶解。
3. 加去离子水将溶液定容至1 L,用0.45 ?μm滤膜滤去杂质。
4. 于棕色瓶中4℃保存。
注意:丙烯酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用具有积累性,配制时应戴手套等。聚丙烯酰胺无毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。
二 配制浓缩胶缓冲液: 1.0mol/L TrisHCl Ph6.8, 4℃保存
三 配制分离胶缓冲液: 1.5mol/L TrisHCl Ph8.8, 4℃保存
四 配制10%SDS(W/V):
五 配制10% W/V)过硫酸铵(AP):称1克过硫酸铵,加10mL去离子水搅拌溶解,贮存于4℃。(注意10%过 硫酸铵溶液在4℃保存可使用2周左右,超过期限会失去催化作用。
六 TEMED原溶液
七 电泳缓冲液(5×):Tris 15g+甘氨酸72g+SDS 5g+H2O至1L,临用时稀释5倍至1×SDS电泳缓冲液加入
电泳槽中。
八配制1 M Tris-HCl的方法
1. 称量121.1 g Tris置于1 L烧杯中。
2. 加入约800 ml的去离子水,充分搅拌溶解。
3. 加入浓盐酸调节所需要的pH值。
4 将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH 值,因为Tris 溶液的pH 值随温度的变化差异很大,温度每升高1℃,溶液的pH 值大约降低0.03个单位。 九: PAGE 浓缩胶(5% Acrylamide
)配方表
十 SDS-PAGE 分离胶配方表
接下页
凯基生物科技发展有限公司 电话:025-********;52880811 传真:025-********
网址: https://www.360docs.net/doc/4016417281.html, 电子邮件: service@https://www.360docs.net/doc/4016417281.html,
18
蛋白免疫印迹杂交技术手册
蛋白免疫印迹杂交(Western Blot)技术手册 蛋白免疫印迹杂交(Western Blot. WB)是将蛋白样本通过聚丙烯酰胺电泳按分子量大小分离,再转移到杂交膜(blot)上,然后通过一抗/二抗复合物对靶蛋白进行特异性检测的方法。WB是进行蛋白质分析最流行和成熟的技术之一。 本指南讨论Western Blot操作方法及常见问题分析,有助于成功完成WB。 A 蛋白样本提取制备 1 细胞或组织裂解 2 蛋白酶和磷酸酶抑制剂 3 蛋白定量 4 电泳上样样品的准备 B 电泳 1 PAGE胶的制备 2 蛋白分子量Marker 3 阳性对照 4 内参对照 5 上样与电泳 C 转膜与显色(Western Blot) 1 胶中蛋白的检测 2 蛋白转膜 3 膜上蛋白的检测:丽春红 4 膜的封闭 5 一抗的孵育 6 二抗的孵育 7 显色 D 常见问题分析与解决方案 附录1 WB实验试剂配制方法 附录2 SDS-PAGE胶的配制
WB概述:检测原理 Western Blot过程示意图 聚丙烯酰胺凝胶电泳 转膜 封闭 孵育1小时或过夜 孵育一抗 孵育1小时或过夜 孵育酶标二抗 1小时 洗膜 3×5min/1×10min 孵育底物(如为显色法,则直接孵育至显色即可) 1min 胶片曝光显影 1-30min
A 蛋白样本提取制备 蛋白样品制备是Western Blotting的第一步,更是决定WB成败的关键步骤,总体原则和注意事项: 1:尽可能提取完全或降低样本复杂度只集中于提取目的蛋白 (通过采用不同提取方法或选择不同的试剂盒产品) 2:保持蛋白的处于溶解状态(通过裂解液的PH 盐浓度表面活性剂、还原剂等的选择)3:提取过程防止蛋白降解、聚集、沉淀、修饰等,(低温操作,加入合适的蛋白酶和磷酸酶抑制剂) 4:尽量去除核酸,多糖,脂类等干扰分子(通过加入核酸酶或采取不同提取策略) 5:样品分装,长期于-80℃中保存,避免反复冻融。 A-1 细胞或组织裂解 A-1-1 细胞裂解 细胞裂解操作方法: 1. 培养的细胞经预冷的PBS漂洗2次,裂解液中加入蛋白酶和磷酸酶抑制剂(种类与量见本节2); 2. 吸净PBS,加入预冷的裂解液,(1 ml per 107 cells/100mm dish/150cm2 flask; 0.5ml per 5x106 cells/60mm dish/75cm2 flask); 3. 用细胞刮子刮取贴壁细胞,将细胞及裂解液温和地转移至预冷的微量离心管中; 4. 4℃摇动30 min; 5. 4℃离心12,000 rpm,20 min(根椐细胞种类不同调整离心力); 6. 弃沉淀,轻轻吸取上清,转移至新预冷的微量离心管中置于冰上,即为蛋白样本; A-1-2 组织裂解 1 用灭菌的预冷的工具分离目的组织,尽量置于冰上以防蛋白酶水解; 2 将组织块放在圆底的微量离心管或Eppendorf管中,加入液氮冻结组织于冰上均质研磨,长期可保存于-80°C;
(完整版)WesternBlot(免疫印迹法)实验方法步骤
Western Blot(免疫印迹法)实验方法步骤 发布日期:2008-8-25 热门指数:4360 Western Blot(免疫印迹法) 主要包括以下4个基本步骤: n 样品制备 n 电泳分离 n 蛋白的膜转移 n 免疫杂交与显色――蛋白检测 溶液和试剂 n 1X 磷酸盐缓冲液(PBS) n Modified RIPA buffer Tris-HCl: 50 mM, pH 7.4 ; NP-40: 1% ;Na-deoxycholate: 0.25% ;NaCl: 150 mM ;EDTA: 1 mM ;P MSF: 1 mM ;Aprotinin, leupeptin, pepstatin: 1 microgram/ml each ;Na3VO4: 1 mM ;NaF: 1 mM n 1X SDS 样品缓冲液 62.5 mM Tris-HCl (pH 6.8 于25°C), 2% w/v SDS, 10%甘油,50 mM DTT, 0.01% w/v溴酚蓝 n 转移缓冲液 25 mM Tris base, 0.2 M 甘氨酸, 20%甲醇(pH 8.3) n 10X Tris缓冲盐(TBS) 准备1L 10X TBS: 24.2 g Tris base, 80 g NaCl;用1N HCl调pH为7.6 n 脱脂奶粉或BSA n 甲醇 n TBS/T缓冲液 1X TBS, 0.1% Tween-20 n 封闭缓冲液(TBS/T)
1X TBS, 0.1% Tween-20加5% w/v脱脂奶粉或BSA n 一抗的稀释 1X TBS, 0.1% Tween-20 加5% BSA (多抗)或5%脱脂奶粉(单抗) Note:一般来说, BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。抗体的稀释度参考抗体说明书或根据实验确定。 n 预染的蛋白质Marker,可用于监测转膜的效率 样品制备 原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。 1.培养细胞或药物处理。 2.弃培养基,用1X PBS漂洗细胞2次,去尽残留培养基。 3.加入1X SDS样品缓冲液(6-well plate, 100 μl /w或75 cm2plate, 500-1000 μl/瓶),刮落细胞,转移到Ep管。注意:冰上操作。 4.超声10~15秒剪切DNA以减低样品粘性。 5.煮沸样品5 minutes。 6.离心12000g, 5 min,取上清。 7.电泳分离:上样15μl~20 μl 至SDS-PAGE 胶(10 cm x 10 cm)电泳。 如要定量检测某蛋白的表达水平,应用RIPA裂解液(1 ml per 107cells/100 mm dish/150 cm2flask)裂解细胞,收集裂解液至离心管中,在振荡器上混匀4~15min,14000g离心15min(4℃),弃沉淀,用B radford法或其它蛋白质测定方法测定上清中蛋白浓度以调整上样体积和上样量,进行Western杂交时还需设置内或外参照,通常用beta-actin。 注意:一般上样20~30 μg已足够,如待检蛋白为低丰度蛋白,可加大上样量至100μg,但电泳条带易拖尾,可制备亚细胞组份或采用更敏感的检测方法。 电泳分离(参照SDS-PAGE电泳方法) 转膜 杂交膜的选择是决定Western blot成败的重要环节。应根据杂交方案、被转移蛋白的特性以及分子大小等因素,选择合适材质、孔径和规格的杂交膜。用于Western blot的膜主要有两种:硝酸纤维素膜(NC) 和PVDF膜。NC膜是蛋白印迹实验的标准固相支持物,在低离子转移缓冲液的环境下,大多数带负电荷的蛋白质会与膜发生疏水作用而高亲和力的结合在一起,但在非离子型的去污剂作用下,结合的蛋白还可以被
蛋白质免疫印迹技术的实验研究
万方数据
万方数据
万方数据
蛋白质免疫印迹技术的实验研究 作者:张燕婉, 叶珏, 时那, 孟宪敏, 王来元, ZHANG Yan-wan, YE Jue, SHI Na, MENG Xian-min, WANG Lai-yuan 作者单位:中国医学科学院,阜外心血管病医院中心实验室,北京,100037 刊名: 实验技术与管理 英文刊名:EXPERIMENTAL TECHNOLOGY AND MANAGEMENT 年,卷(期):2008,25(10) 被引用次数:21次 参考文献(9条) 1.郭尧君蛋白质电泳实验技术 2006 2.Nieman T Detection based on solution-phase chemiluminescence systems 1989 3.李晓军,秦浚川,武建国蛋白印迹技术研究进展[期刊论文]-临床检验杂志 2004(3) 4.Towbin H;Staehelin T;Gordon Electrophoretic franker of proreins from polyacrylamide gels to nitrocellulose sheets.Procedure and some appHcations 1979(76) 5.Hauri H P;Bucher K Immunoblotting with monodonal antibodities:Importance of the blocking solution 1986(159) 6.高红,王贵新,王维林,张可仞用蛋白印迹技术初步评价肝母细胞瘤血管内皮生长因子表达的意义[期刊论文]-中华小儿外科杂志 2006(2) 7.Towbin H;Gordon J Immunoblotting and dot immunobinding:current status and outlook 1984(72) 8.Tovey ER;Baldo BA Characterisation of allergens by protein blotting 1987(08) 9.沈关心;龚非力抗体技术实验指南 2006 本文读者也读过(1条) 1.段勇.黄韬.袁育林.刘华.李娅.金克炜.DUAN Yong.HUANG Tao.YUAN Yulin.LIU Hua.LI Ya.JIN Kewei蛋白质免疫印迹技术检测肺癌组织上皮钙粘蛋白的表达[期刊论文]-检验医学2009,24(1) 引证文献(7条) 1.秦双立,徐玥蛋白质印迹法在氟中毒研究中的应用[期刊论文]-山东化工 2015(13) 2.马瑛,马明,沈辉,骆新荣,高庆华不孕奶牛宫颈黏液相关ASA免疫印迹分析[期刊论文]-中国奶牛 2013(06) 3.程娜娜,韩榕He-Ne激光和增强UV-B辐射对拟南芥叶片微管蛋白的影响[期刊论文]-激光生物学报 2013(04) 4.刘娇,华碧春,黄智锋蛋白表达检测技术在中药肝损伤机制研究中的应用进展[期刊论文]-浙江中医药大学学报2013(04) 5.韩继美胶体金免疫层析法对AFP、CEA和FN的快速检测[学位论文]硕士 2009 6.黄斌芳c-Jun基因启动子区的遗传变异与肺癌易感性的研究[学位论文]硕士 2012 7.程娜娜He-Ne激光和增强UV-B辐射对拟南芥叶片微管结合蛋白MAP65-1的影响[学位论文]硕士 2014 引用本文格式:张燕婉.叶珏.时那.孟宪敏.王来元.ZHANG Yan-wan.YE Jue.SHI Na.MENG Xian-min.WANG Lai-yuan 蛋白质免疫印迹技术的实验研究[期刊论文]-实验技术与管理 2008(10)
northern印迹杂交
northern印迹杂交 Northern印迹杂交(Northern blot)。这是一种将RNA从琼脂糖凝胶中转印到硝酸纤维素膜上的方法。DNA印迹技术由Southern于1975年创建,称为Southern 印迹技术,RNA印迹技术正好与DNA相对应,故被称为Northern印迹杂交,与此原理相似的蛋白质印迹技术则被称为Western blot。Northern 印迹杂交的RNA吸印与Southern印迹杂交的DNA吸印方法类似,只是在进样前用甲基氢氧化银、乙二醛或甲醛使RNA变性,而不用NaOH,因为它会水解RNA的2'-羟基基团。RNA变性后有利于在转印过程中与硝酸纤维素膜结合,它同样可在高盐中进行转印,但在烘烤前与膜结合得并不牢固,所以在转印后用低盐缓冲液洗脱,否则RNA会被洗脱。在胶中不能加EB,因为它会影响RNA与硝酸纤维素膜的结合。为测定片段大小,可在同一块胶上加分子量标记物一同电泳,之后将标记物切下、上色、照相,样品胶则进行Northern转印。标记物胶上色的方法是在暗室中将其浸在含5μg/ml EB的0.1mol/L醋酸铵中10min,光在水中就可脱色,在紫外光下用一次成像相机拍照时,上色的RNA胶要尽可能少接触紫外光,若接触太多或在白炽灯下暴露过久,会使RNA信号降低。琼脂糖凝胶中分离功能完整的mRNA时,甲基氢氧化银是一种强力、可逆变性剂,但是有毒,因而许多人喜用甲醛作为变性剂。所有操作均应避免RNase的污染。 RNA甲醛凝胶电泳和吸印方法。 <1>试剂: 10×MSE缓冲液:0.2mol/L吗啉代丙烷磺酸(MOPS),pH7.0,50mmol/L醋酸钠,1mmol/L EDTA pH8.0。 5×载样缓冲液:50%甘油,1mmol/L EDTA,0.4%溴酚蓝。 甲醛:用水配成37%浓度(12.3mol/L),应在通风柜中操作,pH高于4.0。 20×SSC; 去离子甲酰胺; 50mmol/L NaOH(含10mmol/L NaCl); 0.1mol/L Tris,pH7.5。 <2>步骤: [1]40ml水中加7g琼脂糖,煮沸溶解,冷却到60℃,加7ml10×MSE缓冲液,11.5ml 甲醛,加水定容至70ml,混匀后倒入盛胶槽。 [2]等胶凝固后,去掉梳子和胶布,将盛胶槽放入1×MSE缓冲液的电泳槽。 [3]使RNA变性(最多20μg),RNA4.5ml,10×MSE缓冲液20ml,甲醛3.5ml,去离子甲酰胺10ml。 [4]55℃加热15min,冰浴冷却。 [5]加2ml5×载样缓冲液。 [6]上样、同时加RNA标记物。
Southern 印迹杂交实验报告
Southern 印迹杂交实验报告 姓名:陆叶学号:14211020062 专业:公共卫生 实验时间:12.18;12.25 带教老师:潘銮凤 【实验目的】 学习核酸杂交的基本过程和操作 【实验原理】 将待检测的DNA分子用或不用限制性内切酶消化后,通过琼脂糖凝胶电泳进行分离,继而将其变性并按其在凝胶中的位置转移到硝酸纤维素薄膜或尼龙膜上,固定后再与同位素或其它标记物标记的DNA或RNA探针进行反应,检测靶DNA片段中是否存在与探针同源的序列。如果待检物中含有与探针互补的序列,则二者通过碱基互补的原理进行结合,游离探针洗涤后用自显影或其它合适的技术进行检测,从而显示出待检的片段及其相对大小。 用途:检测样品中的DNA及其含量,了解基因的状态, 如是否有点突变、扩增重排等。【实验步骤】 1、基因组DNA的限制性内切酶酶切 取1个1.5ml离心管按下列量依次加入基因组DNA、10X酶缓冲液,酶,做好标记。老师给的HL60基因组DNA 10μg(7.6μL);10×Buffer E(10.4μL);EcoR I(10 u/μL)(2μL)。总体积20μL。37℃保温1.5小时。 2、1%琼脂糖电泳 先制备凝胶,称取1.2 g Agarose放入三角烧瓶中,加入60 mL TAE溶液,微波炉中加热令其完全溶解,稍作冷却后加入GelRed核酸染液6μL(稀释10,000倍)。浇板,水平放置,待凝。胶凝后按照以下顺序加样。两组共用一块凝胶,共7个样。 ①基因组DNA10 20μl (自己的) ②基因组DNA10 μg(老师的) ③酶切样品 ④阳性对照(c-myc 4.7 kb线性片段,30pg/μl, 10μl) ⑤酶切样品 ⑥基因组DNA10 μg (老师的) ⑦基因组DNA10 20μl (自己的) 插上电源,负极在样品槽一边,DNA将向阳极跑,80V电泳2小时左右,直到溴酚蓝染料跑到接近凝胶尾部,在电泳期间做好胶变性和转移准备。 3、变性 切胶,2—6孔,宽4.5cm,长7cm(从顶部开始,可用尼龙膜保护纸作为标尺) ①将凝胶浸在5倍体积的胶变性液中, 慢慢摇动20分钟。 ②ddH2O洗2次。 ③在胶中和液中慢慢摇动15分钟。 4、转移 ①在搪瓷盘中加入300 ml 10×SSC,放上培养皿和小玻璃板。 ②将3张长滤纸浸湿,逐张放在玻璃板上,用移液管的滚动,赶走气泡。 ③切除多余凝胶,小心地将凝胶放在滤纸上(加样孔面向下),赶走滤纸与胶之间的气泡。 ④再将与胶大小相同的尼龙膜(浸湿)放在胶上,同样不能有气泡,然后放上三张浸湿的 滤纸,赶走气泡。 ⑤紧贴凝胶四周各放一张X光片。 ⑥小心蒙上一张比搪瓷盘大的保鲜膜。保鲜膜要紧贴滤纸,但不能让滤纸移动。
免疫印迹步骤
2.6 免疫印迹(Western blot) (1)裂解细胞,提取细胞总蛋白:收集细胞(约2×106),离心洗涤2次,加入100μL RIPA裂解液,置冰上反应30min,4℃12,000r/min离心15min,取上清,蛋白定量后分装,-80℃冻存备用; (2)蛋白定量:Bradford法测定蛋白质含量[35]: ①分别在微量离心管中各加入0.5mg/mL BSA 5μL、10μL、15μL及20μL, 以0.15mmol/L的NaCl补足至100μL,同时以两管100μL的 0.15mmol/L的NaCl作空白对照。 ②每管各加入900μL考马斯亮蓝G-250溶液,振荡混匀,室温放置2min。 ③用1cm光径的微量比色杯测A595吸光值,取A595吸光值对标准蛋白浓 度作图,画出标准曲线,并测量待测样品的A595吸光值,从BSA标 准曲线中确定待测样品的浓度。 (3)SDS-PAGE电泳 ①制胶 SDS丙稀酰胺凝胶 12%分离胶8%分离胶5%积层胶去离子水 3.3mL 4.6mL 2.7mL 1.5mol/L Tris-Cl(pH8.8) 2.5mL 2.5mL - 1.0mol/L Tris-Cl(pH6.8) --0.5mL 30%丙稀酰胺 4.0mL 2.7mL 0.67mL 10% SDS 0.1mL 0.1mL 0.04mL 10%APS 0.1mL 0.1mL 0.04mL TEMED 0.004mL 0.004mL 0.004mL Total 10mL 10mL 4mL 其中10%APS和TEMED需等临灌胶之前再加入。先配制好分离胶,在涡旋混合器上混匀,立刻用吸管将胶缓缓灌入到大小两块玻璃板之间,
(完整版)蛋白免疫印迹(westernblot)实验
蛋白免疫印迹(western blot)实验 实验步骤: 一、试剂准备 1. SDS-PAGE试剂:见聚丙烯酰胺凝胶电泳实验。 2. 匀浆缓冲液:1.0 M Tris-HCl(pH 6.8) 1.0 ml;10%SDS 6.0 ml;β-巯基乙醇 0.2 ml;ddH2O 2.8 ml。 3. 转膜缓冲液:甘氨酸 2.9 g;Tris 5.8 g;SDS 0.37 g;甲醇200 ml;加ddH2O定容至1000 ml。 4. 0.01 M PBS(pH7.4):NaCl 8.0 g;KCl 0.2 g;Na2HPO4 1.44 g;KH2PO4 0.24 g;加ddH2O至1000 ml。 5. 膜染色液:考马斯亮兰 0.2 g;甲醇80 ml;乙酸2 ml;ddH2O118 ml。包被液(5%脱脂奶粉,现配):脱脂奶粉1.0 g 溶于20 ml的0.01 M PBS中。 6. 显色液:DAB 6.0 mg;0.01 M PBS 10.0 ml;硫酸镍胺 0.1 ml;H202 1.0 μl。【晶莱生物】 二、蛋白样品制备 1.单层贴壁细胞总蛋白的提取 (1)倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。 (2)每瓶细胞加3 ml 4℃预冷的PBS(0.01M pH7.2~7.3)。平放轻轻摇动1 min洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将PBS弃净后把培养瓶置于冰上。 (3)按1ml裂解液加10 μl PMSF(100 mM),摇匀置于冰上。(PMSF要摇匀至无结晶时才可与裂解液混合。) (4)每瓶细胞加400 μl含PMSF的裂解液,于冰上裂解30 min,为使细胞充分裂解培养瓶要经常来回摇动。 (5)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5 ml离心管中。(整个操作尽量在冰上进行。) (6)于4℃下12000 rpm离心5 min。(提前开离心机预冷) (7)将离心后的上清分装转移倒0.5 ml的离心管中放于-20℃保存。
蛋白印迹实验报告
蛋白印迹实验报告 篇一:实验十二Western印迹鉴定目标蛋白 实验十二Western印迹鉴定目标蛋白 实验目的 1.了解Western blot的原理及其意义,掌握Western blot的操作方法; 2.应用Western blot 技术分析鉴定经SDS-PAGE分离后转移到尼龙膜上的重组蛋白。 实验原理 Western印迹法简称蛋白质印迹法。蛋白质样品经SDS-PAGE电泳后,凝胶所含的样品蛋白质区带通过电泳方法转移、固定到载体(如尼龙膜、硝酸纤维素膜)上,固相载体以非共价键的形式与蛋白质结合,从而固定住蛋白质;以膜上的蛋白或多肽为抗原,与相应的第一抗体起免疫反应,再和酶标记或同位
素标记的第二抗体反应,用适当的溶液漂洗去未结合抗体后,置含底物的溶液中温育,或通过放射自显影显出谱带,即可检测出样品中的特异蛋白组分。 试剂与器材 试剂 1.转移缓冲液:甘氨酸(39 mmol/L),Tris 碱(48mmol/L),SDS (%),200ml 甲醇(20%),定容至1,000mL; 2.封闭液:5% 脱脂奶粉,% 叠氮钠,溶于PBST溶液中; 3.丽春红S(Ponceaus)染液:丽春红S溶于1mL 冰乙酸中,加水至100mL; 洗膜液:PBS 缓冲液含% Tween 20; 5.DAB浓缩显色液(50X):DAB (二氨基联苯胺)是根过氧化物酶的底物之一,临用前稀释。 6.5 x PBS:在1600mL蒸馏水中溶解Na 2HPO4 , Na H2PO4, 40g Na Cl,
用/L NaOH调pH至,加水定容至2升。高压灭菌20 分钟,室温保存。用前稀释至1x 。 7.SDS-PAGE电泳用溶液和试剂。 器材 电泳装置一套; 2.电转移膜装置 3.抗体-酶反应摇床 操作方法 〈一〉电转移 1.将蛋白质样品进行SDS-PAGE,待溴酚蓝跑出胶后停止电泳(1)。 2.载手套切6-8张定性滤纸和一张尼龙膜,它们的大小应与凝胶的大小相同。在尼龙膜的一(左)角作一记号(或剪角),与滤纸和海棉(纤维)垫浸泡于转移缓冲液中。 3.剥胶,并将凝胶裁成合适大小,切角以做记号(2)。 4.按下图示制备“夹心饼”,打开电极板,在一边放上一块纤维垫,再依次往上叠加3-4张滤纸,将凝胶轻放于滤
SouthernBlot印记杂交常见问题解析
Southern Blot印记杂交常见问题解析 1、针对不同的实验材料,southern杂交实验难度有差异么?答:不同的实验材料,在进行试验过程中难度差异很大,例如玉米、 小麦、葡萄的Southern杂交检测难度要比普通的材料要大。 (1)、物种本身的基因组较大(例如小麦),检测操作难度大 (2)、材料本身含有高糖多酚(例如葡萄)严重影响酶切操作 (3)、物种品系复杂(例如玉米),在基因组信息研究层面还不透彻。 2、核酸质量对southern杂交实验的影响 答:核酸质量对实验的影响是直接的,既要求客户提供的总量足够——实验消耗(上样量),又要求保证质量——按要求准备材料。 上样量指的是基因组DNA酶切消化后,回收后的DNA片段的量。根据 不同物种的基因组大小不同,上样量也有所区别。基因组越大,上样 量越多。例如,拟南芥大概需要3ug ,酵母3ug,人8ug,小麦15ug。酶切消化之后不能直接上样,需要回收纯化。回收会有损失,最多能 损失一半,所以需要客户提供足够量的样品,一般要求至少20 ug的 基因组DNA。(以上上样量均为一个泳道) DNA 样品一般对 OD 值和浓度有如下要求:OD260/280=1.8~2.0, OD260/230>2.0,浓度≥100 ng/ul 。同时,需要对 DNA 样品进行琼 脂糖凝胶电泳,电泳结果显示该 DNA 样品无蛋白质和 RNA 等物质污染,无降解弥散,条带清晰。(如图所示)
3、探针设计是怎么回事,有哪些原则? 答:探针就是与待测目的基因序列同源的一段地高辛标记的DNA序列,可以和酶切后的基因组片段特异性的结合。探针设计有如下几个原则: (1)、长度适中。探针的片段长度一般控制在300-1000bp,探针太长时会导致非特异性结合的概率增加,探针太短时,探针结合的地高辛标 记物太少,会导致发光信号减弱。 (2)、特异性强。最佳的探针序列是仅与目的基因同源,与整个基因组 序列的同源片段低于30%。 (3)、ATGC含量均匀,无发卡结构和高度重复序列。
蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项
蛋白质免疫印迹(Western Blot )实验步骤和原理及注意事项 1.收集蛋白样品(Protein sample preparation) 可以使用适当的裂解液。收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。根据所使用的裂解液的不同,需要采用适当的蛋白浓度测定方法。因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。BCA法。 2. 电泳(Electrophoresis) (1) SDS-PAGE凝胶配制 (2) 样品处理 在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。例如2X或5X的SDS-PAGE蛋白上样缓冲液。使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。 100℃或沸水浴加热3-5分钟,以充分变性蛋白(根据蛋白分子的大小,煮沸时间可适当变化,一般不低于5min。煮沸只是变性蛋白,而不是分解,一般加了抑制酶不会分解。煮沸对于SDS-PAGE凝胶电泳是必须的,只有煮沸,才能消除蛋白质的立体二级结构,伸展为一维线性结构,所以一般来讲二聚体都会解体,才能完全按照分子量跑电泳,加的蛋白Marker才有指示分子量的意义。蛋白样品变性后与SDS充分结合,SDS使每个氨基酸带相同的电荷,使整个蛋白呈线性结构. 抗体因为要是线性表位结合的,100度煮10min 后13000,离心5分钟,取上清电泳,因为沉淀会导致拖尾.也可以取上清到另一管,4度可以放一周备再次电泳)。 (3)电泳
i.清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。 两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾 干。 ii.灌胶与上样 (1)玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶。 (操作时要使两玻璃对齐,以免漏胶。) (2)配10%分离胶,加入TEMED后立即摇匀即可灌胶。灌胶时,可用10 ml枪吸取5 ml胶沿玻璃放出,待胶面升到绿带中间线高度时即可。然后胶上加一层水,液封后的胶凝的更快。(灌胶时开始可快一些,胶面快到所需高度时要放慢速度。操作时胶一定要沿玻璃板流下,这样胶中才不会有气泡。加水液封时要很慢,否则胶会被冲变型。) (3)当水和胶之间有一条折射线时,说明胶已凝了。再等3 min使胶充分凝固就可倒去胶上层水并用吸水纸将水吸干。 (4)配4%的浓缩胶,加入TEMED(TEMED,中文名为四甲基乙二胺,是一种无色透明的液体,有微腥臭味,可以用于配制SDS-PAGE胶。TEMED可以催化APS产生自由基,从而加速聚丙烯酰胺凝胶的聚合,可作为一种促凝剂使用)后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。灌胶时也要使胶沿玻璃板流下以免胶中有气泡产生。插梳子时要使梳子保持水平。由于胶凝固时体积会收缩减小,从而使加样孔的上样体积减小,所以在浓缩胶凝固的过程中要经常在两边补胶。待到浓缩胶凝固后,两手分别捏住梳子的两边竖直向上轻轻将其拔出。
蛋白质免疫印记技术实验报告
蛋白质免疫印迹技术 曹学敏郭晓华谷中如古泽江 河北大学生命科学学院2010生物技术河北保定071002 摘要:目的:学习掌握动物抗血清的制备原理及技术,通过实际操作学会动物抗血清的制备,掌握Western-blotting的基本原理,熟悉Western-blotting的实验操作。方法:,使用鸡卵类粘蛋白对小白鼠进行常规免疫,获得抗血清,然后利用Western-blotting 检测抗血清。结果:纯化的鸡卵类粘蛋白能引起小鼠的免疫反应 关键词:常规免疫抗血清免疫印记 Abstract:objective:learn to master the theory and technology of preparing animals’ antiserum by operating the experiment in person ,learn to prepare the animals’antiserum , mastering the basic principles of Western-blotting, and being familiar with the experiment operation of Western-blotting. Methods : using chicken ovomucoid operating the routine immunization of laboratory rat, and obtain the antiserum, then detecting the antiserum through Western-blotting. Result: purified chicken ovomucoid can lead to the immunization of laboratory rat Keywords: routine immunization antiserum Western-blotting 前言 免疫印迹(Western blotting)是一种检测固定在固相基质上的蛋白质的免疫化学方法该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种常规技术,是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。进行免疫之前必须具备可特异性识别目的蛋白质的单抗或多抗,以及含有目的蛋白质的粗制或纯化的样品。因此,免疫印迹可以从复杂抗原中检出特定的抗原或者从多克隆抗体中检出单克隆抗体,又可以对转移到固相膜上的抗原或抗体进行连续分析,以取得目的蛋白的定位、定性或定量。现在,免疫印记技术,在对人的病理研究上,也有了很大的应用,免疫印记法检测细胞中癌基因的表达及其意义。 1、试剂与器材 1.1小鼠的常规免疫与抗血清的制备所需试剂与器材 注射器蜗旋混合器纯化的鸡卵类粘蛋白苦味酸(以75%乙醇配置)标记小鼠 佐剂(完全佐剂不完全佐剂)酒精棉球冰箱离心机 1.2 Western Blot 12%分离胶,3.6%浓缩胶马斯亮蓝脱色液PVDF膜甲醇电泳缓冲液封闭液(0.5%BSA、TBST溶液)一抗(自制多克隆抗血清以TBST按1:100比例稀释) 二抗(羊抗鼠,按1:1000比例用TBST稀释)DAB显色液蒸馏水镊子烧杯海绵垫 2 方法 2.1 小鼠的常规免疫和抗血清的制备 (1)抗原的提取与制备 1)抗原为纯化的鸡卵类粘蛋白 2)利用苦味酸(以75%乙醇配置)标记小鼠背部 (2)初级免疫:小鼠背部多点皮下注射,0.2mL/只小鼠 1)抗原与佐剂的混合:取1.5mL蛋白与1.5mL完全佐剂混合,震荡混匀,
蛋白质免疫印迹技术常见问题分析 (1)
常见问题分析 一.无信号 一抗和二抗不匹配:二抗需和一抗宿主的物种相同(如一抗来自兔,二抗为抗兔抗体)。没有足够的一抗或二抗结合目标蛋白:使用高浓度抗体。4 °C 延长孵育时间(如过夜)。封闭剂与一抗或二抗有交叉反应:使用温和的去污剂如吐温-20,或更换封闭剂(常用的脱脂奶粉、BSA、血清或明胶)。 一抗不识别待检物种的蛋白:参照说明书,比对免疫原序列和蛋白序列以确保抗体和目的蛋白会发生反应,设置阳性对照。 蛋白上样量不足:每条泳道蛋白上样量不低于20μg,使用蛋白酶抑制剂并设置阳性对照。组织中目的蛋白含量低:浓缩使信号最大化。 转膜不充分:使用可逆染色剂如丽春红检测转膜效果,检查转膜操作是否正确。PVDF 膜需预先浸在甲醇中,然后浸到转移缓冲液中。 洗膜过度:勿过度洗膜。 过度封闭使目标蛋白不能显色:使用0.5% 奶粉或无奶粉代替5% 奶粉的抗体稀释液,或更换封闭剂,减少封闭时间。 一抗失效:使用新鲜抗体,重复使用有效浓度会降低。 二抗受叠氮钠抑制:避免叠氮钠和HRP 标记抗体一起使用。 检测试剂盒过期和底物失活:使用新鲜的底物。 二.背景高 未进行非特异性封闭或封闭不充分:延长封闭时间,考虑更换合适的封闭剂。 一抗浓度过高:稀释抗体至合适浓度,以更高稀释度抗体延长孵育时间(耗时长但特异性结合最好)。 二抗与封闭剂非特异性结合或反应:设置二抗对照(不加一抗)。 未结合蛋白质洗涤不充分:增加洗涤次数。 选膜不当产生的高背景:硝酸纤维素膜比PVDF 膜背景低。 膜干燥:在孵育过程中防止膜变干,每一步都要保证膜有充分的反应液,可放入搅拌子不断搅动或轻轻振荡使膜浸在溶液里。 三.多带现象 细胞传代次数过多,蛋白表达不同:使用原始未传代的细胞株,和现在的细胞株一起做平行对照实验。 体内表达的蛋白样本具有多种修饰形式如乙酰化、甲基化、烷基化、磷酸化、糖基化等:参考文献,使用试剂使样品去磷酸化、去糖基化来证明翻译后的修饰。 蛋白样本降解(蛋白质分子量降低):在样品缓冲液中加入足够的蛋白酶抑制剂。 检测到未经报道过的新蛋白或同一蛋白家族中具有相似表位而结构不同的蛋白:查阅其它文献报道,或BLAST 搜寻,使用说明书推荐的细胞株或组织。 一抗浓度过高,高浓度时常出现多条蛋白带:降低抗体浓度和/或孵育时间。 二抗浓度过高,高浓度产生非特异性结合:降低抗体浓度,加入二抗对照(不加一抗)。抗体未经纯化:使用亲和纯化的抗体,减少非特异条带。 目标蛋白形成多聚体:SDS-PAGE 电泳加样前,煮沸10 分钟而不是5 分钟,使蛋白质解聚。 四.背景有不均匀的白色斑点 转膜时膜上有气泡或抗体在膜上分布不均:转膜过程中尽量除去气泡,抗体孵育时保持摇动。五.背景有黑色斑点 抗体结合了封闭剂:过滤封闭剂。
蛋白质免疫印迹(Western Blot,WB )
蛋白质免疫印迹(Western Blot,WB ) 标签: western-blot 免疫印迹 蛋白质 蛋白质免疫印迹可应用于:(1)从蛋白质混合物中检出目标蛋白质;(2)定量或定性确定细胞或组织中蛋白质的表达情况;(3)用于蛋白质-蛋白质、蛋白质-DNA、蛋白质-RNA相互作用后续分析。 实验材料 蛋白质样品 试剂、试剂盒 裂解液 PBS SDS上样缓冲液 电泳缓冲液 转移缓冲液 丽春红染液 TBST TBS 洗脱抗体缓冲液 抗体 仪器、耗材 电泳仪移液器脱色摇床显影仪 实验方法原理 Western免疫印迹,是将蛋白质转移到膜上,然后利用抗体进行检测的方法。对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。 与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,探针是抗体,显色用标记的二抗。 经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。
实验步骤 一、试剂准备 1. SDS-PAGE试剂:见聚丙烯酰胺凝胶电泳实验。 2. 匀浆缓冲液:1.0 M Tris-HCl(pH 6.8) 1.0 ml;10%SDS 6.0 ml;β-巯基乙醇 0.2 ml;ddH2O 2.8 ml。 3. 转膜缓冲液:甘氨酸 2.9 g;Tris 5.8 g;SDS 0.37 g;甲醇200 ml;加ddH2O定容至1000 ml。 4. 0.01 M PBS(pH7.4):NaCl 8.0 g;KCl 0.2 g;Na2HPO4 1.44 g;KH2PO40.24 g;加ddH2O至1000 ml。 5. 膜染色液:考马斯亮兰 0.2 g;甲醇80 ml;乙酸2 ml;ddH2O118 ml。包被液(5%脱脂奶粉,现配):脱脂奶粉1.0 g 溶于20 ml的0.01 M PBS中。 6. 显色液:DAB 6.0 mg;0.01 M PBS 10.0 ml;硫酸镍胺 0.1 ml;H202 1.0 ul。 二、蛋白样品制备 1. 单层贴壁细胞总蛋白的提取 (1) 倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。 (2) 每瓶细胞加3 ml 4℃预冷的PBS(0.01M pH7.2~7.3)。平放轻轻摇动1 min洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将PBS弃净后把培养瓶置于冰上。 (3)按1ml裂解液加10 ul PMSF(100 mM),摇匀置于冰上。(PMSF要摇匀至无结晶时才可与裂解液混合。)
southern印迹杂交基本方法及主要步骤
基本概念及原理 Southern印迹杂交是进行基因组DNA特定序列定位的通用方法。一般利用琼脂糖凝胶电泳分离经限制性内切酶消化的DN A片段,将胶上的DNA变性并在原位将单链DNA片段转移至尼龙膜或其他固相支持物上,经干烤或者紫外线照射固定,再与相对应结构的标记探针进行杂交,用放射自显影或酶反应显色,从而检测特定DNA分子的含量[1][2]。 基本方法及主要步骤 Southern印迹杂交的基本方法包括四部分,以下以植物southern印迹杂交为例。 (1)植物基因组DNA提取; (2)DNA的限制性内切酶酶解、电泳和Southern转移; (3)探针的标记和纯化; (4)杂交、洗膜、检测以及去除膜上探针。 主要操作步骤: 1.琼脂糖电泳 (1)取一定量的待测DNA样品,用适当的限制性内切酶酶切。DNA的量根据样品的种类及实验目的的不同而异,对于克隆片段的限制性内切酶图谱分析,取0.1-0.5μg即可;而对于鉴定基因组DNA中的单拷贝基因序列,则需要10~20μg;当采用寡核苷酸探针或探针的比放射性活性较低时,则需要30~50μg。 (2)酶切完毕,在琼脂糖凝胶中电泳。 (3)电泳结束后,EB染色,长波紫外线下观察电泳结果及照相。 2.印迹转移 (1)切胶并作标记(左下角切除),以便于定位,然后将凝胶置于一容器中。 Southern印迹杂交转膜示意图 (2)将凝胶浸泡于适量的变性液中,室温下放置1h 使之变性,不间断地轻轻摇动。 变性缓冲液:1.5mol/L Nacl 0.5 mol/L NaOH (3)将凝胶用去离子水漂洗1次,然后浸泡于适量的中和液中30 min,不间断地轻轻摇动。更换中和液,继续浸泡15 min。 (4)将滤纸,硝酸纤维素膜NC膜(以下简称NC膜)剪成与胶同样大小,NC膜浸入转移buffer中平衡30 min。 (5)按右图操作:逐层铺平,各层之间勿留有气泡和皱折。 (6)虹吸转移12-16h。 转膜液: 1.0mol/L Nacl 0.4 mol/L NaOH 3.固定DNA 碱性转移不需要固定,在中性缓冲液中室温15分钟。 (1.0mol/L Nacl 0.5 mol/L Tris-Cl 1) (1)取出转移后的NC膜,用滤纸吸干NC膜,NC膜光面朝上平铺于变性液中变性5min。 (2)用相同的方法将NC膜平铺在中性液上,中和两遍,每遍5min。 (3)将膜夹在两张干燥滤纸间,80℃烘烤1-2h。 4.预杂交
蛋白免疫印迹法(WB)试验结果与HIV感染关系的分析
蛋白免疫印迹法(WB)试验结果与HIV感染关系的分析 【摘要】目的通过对蛋白免疫印迹法(WB)试验结果的观察,确定个体是否感染HIV以及HIV感染的状况。方法对60份抗-HIV初筛阳性血清使用蛋白免疫印迹法(WB)进行确认实验。结果在被检测样品中,HIV-1型确认试验阳性54例,占90%;HIV-1型确认试验阳性,且提示HIV-2阳性感染1例,占1.6%;HIV-1型确认试验弱阳性(不确定)3例,占5%;HIV-1型确认试验阳性2例,占3.3%。结论蛋白免疫印迹法(WB)试验确定个体有无HIV感染以及HIV感染情况提供依据。 【Abstract】Objective Through to western blot assay observation of result of the test, confirm individual infect HIV and HIV infect the state.Methods Safe the positive serum and use western blot assay to confirm to cases of 60 persist-HIV positive for the first time.Results Being measured in the sample, HIV-1 types confirm testing 54 cases of positive,takes 90%.HIV-1 types confirms testing positive,and point outHIV-2 infect one positively,takes 1.6%.HIV-1 types confirm testing weak positive 3,takes 5% HIV-1 type confirm testing negative 2,take 3.3%.Conclusion Western Blot Assay test offers basis on confirm whether individuals have HIV is infected and HIV infect the state. 【Key words】HIV infect;Western Blot Assay;Strip 艾滋病(AIDS)是一种目前尚无有效治愈方法,病死率极高的传染病,它在全世界的广泛流行已经成为严重的公共卫生问题和社会问题。截止到2007年7月底,我们对60名抗-HIV初筛阳性者进行了蛋白免疫印迹法(WB)确认实验,通过实验结果(蛋白带条)的观察,探讨与HIV感染关系,并且还可以在监控病情进展,观察治疗结果,综合监测和行为干预等方面起到重要作用,现将结果报告如下。 1 试剂与方法 1.1 试剂人类免疫缺陷病毒(HIV 1+2)型抗体免疫印迹试剂盒(新加坡健利检验诊断私人有限公司提供)。 1.2 仪器脱色摇床:江苏TS-1。 1.3 方法过夜孵育法 1.3.1 试剂的配制 1.3.1.1 稀释洗涤缓冲液将1体积的浓缩洗涤缓冲液(20X)加入到19倍体积的双蒸馏水中,充分混匀。
Southern印迹杂交
Southern印迹杂交 实验原理 核酸分子杂交技术是分子生物学领域中最常用的具体方法之一。其基本原理是:具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则形成双链,此杂交过程是高度特异的。由于核酸分子的高度特异性及检测方法的灵敏性,综合凝胶电泳和核酸内切限制酶分析的结果,便可绘制出DNA分子的限制图谱。但为了进一步构建出DNA分子的遗传图,或进行目的基因序列的测定以满足基因克隆的特殊要求,还必须掌握DNA分子中基因编码区的大小和位置。有关这类数据资料可应用Southern印迹杂交技术获得。 Southern印迹杂交技术包括两个主要过程:一是将待测定核酸分子通过一定的方法转移并结合到一定的固相支持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);二是固定于膜上的核酸同位素标记的探针在一定的温度和离子强度下退火,即分子杂交过程。该技术是1975年英国爱丁堡大学的E.M.Southern首创的,Southern印迹杂交故因此而得名。早期的Southern印迹是将凝胶中的DNA变性后,经毛细管的虹吸作用,转移到硝酸纤维膜上。近年来印迹方法和固定支持滤膜都有了很大的改进,印迹方法如电转法、真空转移法;滤膜则发展了尼龙膜、化学活化膜(如AP T、ABM纤维素膜)等。利用Southern印迹法可进行克隆基因的酶切、图谱分析、基因组中某一基因的定性及定量分析、基因突变分析及限制性片断长度多态性分析(RFLP)等。 实验方法 本节以哺乳动物基因组DNA为例,介绍Southern印迹杂交的基本步骤。 一、待测核酸样品的制备 (一)制备待测DNA 基因组DNA是从动物组织(或)细胞制备。1. 采用适当的化学试剂裂解细胞,或者用组织匀浆器研磨破碎组织中的细胞;2. 用蛋白酶和RNA酶消化大部分蛋白质和RNA;3. 用有机试剂(酚/氯仿)抽提方法去除蛋白质。 (二)DNA限制酶消化 基因组DNA很长,需要将其切割成大小不同的片段之后才能用于杂交分析,通常用限制酶消化DNA。一般选择一种限制酶来切割DNA分子,但有时为了某些特殊的目的,分别用不同的限制酶消化基因组DNA。切割DNA的条件可根据不同目的设定,有时可采用部分和充分消化相结合的方法获得一些具有交叉顺序的DNA片段。 消化DNA后,加入E DTA,65℃加热灭活限制酶,样品即可直接进行电泳分离,必要时可进行乙醇沉淀,浓缩DNA样品后再进行电泳分离。 二、琼脂糖凝胶电泳分离待测DNA样品 (一)基本原理
