三类医疗器械经营许可相关要求一览表
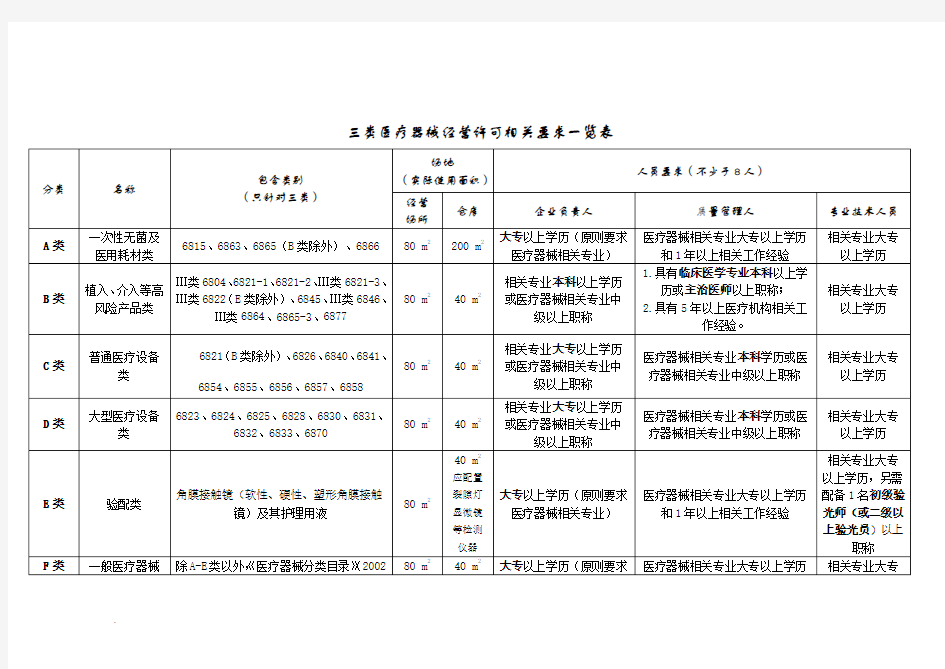
三类医疗器械经营许可相关要求一览表
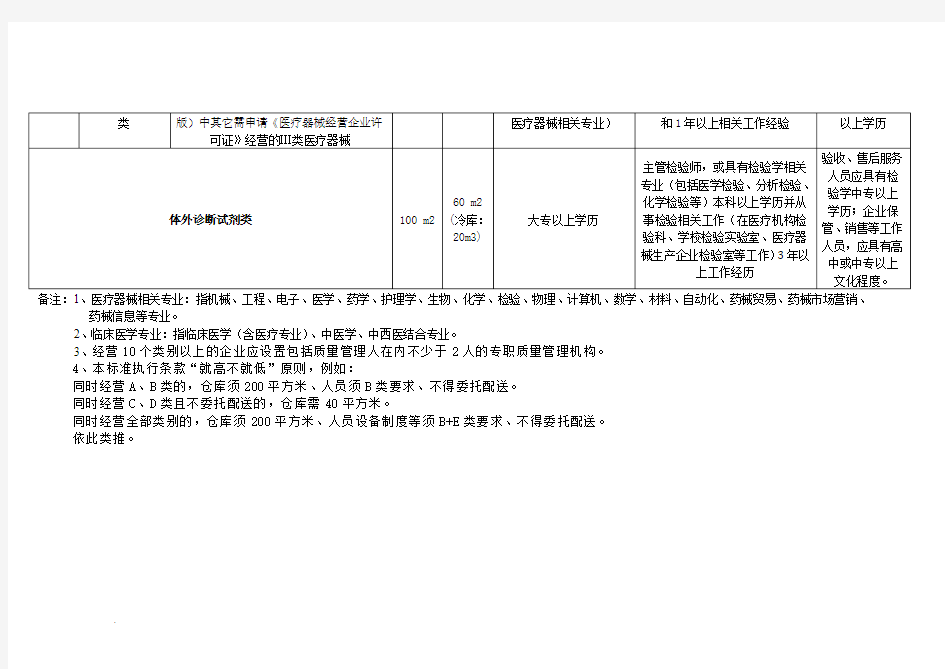
药械信息等专业。
2、临床医学专业:指临床医学(含医疗专业)、中医学、中西医结合专业。
3、经营10个类别以上的企业应设置包括质量管理人在内不少于2人的专职质量管理机构。
4、本标准执行条款“就高不就低”原则,例如:
同时经营A、B类的,仓库须200平方米、人员须B类要求、不得委托配送。
同时经营C、D类且不委托配送的,仓库需40平方米。
同时经营全部类别的,仓库须200平方米、人员设备制度等须B+E类要求、不得委托配送。
依此类推。
三类医疗器械法律法规考核试题及答案
法律法规考核一 一、填空题 1.从事医疗器械经营活动。应当有与经营规模和经营范围相适应的和,以及与经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。 2.从事第三类医疗器械经营的,经营企业应当向所地社区的人民政府食品药品监督管理部门申请经营许可并提交其符合本条例第二十九条规定条件的证明资料。 二、判断题 1.省级以上人民政府食品药品监督管理部门责令暂停生产、销售、进口和使用的医疗器械,在暂停期间不得发布涉及该医疗器械的广告。( ) 2.医疗器械广告应当真实合法,可以有一点虚假、夸大、误导性的内容。()
三、简答题 医疗器械广告管理条例的内容 法律法规考核二 一、填空题 1.医疗器械经营许可证有效期为。有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。 2.医疗器械经营企业,使用单位购进医疗器械,应当查验供货者的资质和医疗器械的,建立进货查验记录制度。 二、判断题 1.从事第二类、第三类医疗器械批发业务以及第三类医疗零售业务的经营企业,还应当建立销售记录制度。() 2. 运输、贮存医疗器械,应当符合医疗器械说明书和标签标示的要求;对温度、湿度等环境条件有特殊要求的,应当采取相应措施,保证医疗器械的安全、有效。()
三、简答题 医疗器械使用单位对医疗器械的储存和工作人员有什么要求。 法律法规考核三 一、填空题 1.医疗器械使用单位对重复使用的医疗器械,应当按照 制定的消毒和管理的规范进行处理。 2.一次性使用的医疗器械不得重复使用,对使用过的应当按照国家有关规定。 二、判断题 1.医疗器械使用单位应当妥善保存购入第三类医疗器械的原始资料,并确保信息具有可追溯性。() 2.发现使用的医疗器械存在安全隐患的,医疗器械使用单位应当立即停止使用,不用通知生产企业或者其他负责产品质量的机构进行检修;经检修仍不能
医疗器械产品技术要求
医疗器械产品技术要求 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
医疗器械产品技术要求编号: XXXXXX 1产品型号/规格及其划分说明 型号命名 P200 设计序号 产品代号 结构组成(不同型号如有结构组成的差异,应分型号列明) XXXXXX(以下简称XX)主要有X射线管组件(组合式)、限束器、操作台、影像处理系统、C形臂及可移动机架、医用X射线影像增强器组成。 型号说明(如有多个型号此条适用,列表标明型号间差异) 表1型号说明 工作条件 a)环境温度:10℃-40℃; b)相对湿度:30%-75%; c)大气压力:700hPa-1060hPa。 d)电源:AC220V±22V;50Hz±1Hz e)额定输入功率:xxVA。 2性能指标 外观 ………. 安全要求 XXX安全要求应符合的要求,产品主要特征见附录C。(适用设备) XXX安全要求应符合的要求,产品主要特征见附录C。(适用设备) 电磁兼容(适用设备) 电磁兼容应符合YY0505-2012的要求。 电磁兼容(适用设备) 电磁兼容应符合GB/的要求。 电磁兼容(体外诊断类适用设备)
电磁兼容应符合GB/及GB/的要求。 环境试验 按GB/T14710-2009中规定的气候环境Ⅱ组、机械环境Ⅱ组的要求及表X进行试验,应符合要求。 表X试验要求及检验项目 3检验方法 外观 用正常或矫正视力观察以及用手感检查,结果应符合的要求。 ………………. 安全要求 按—2007中的规定进行。(适用设备) 按中的规定进行。(适用设备) 电磁兼容(适用设备) 电磁兼容试验按YY0505-2012的要求进行。 电磁兼容(适用设备) 电磁兼容试验按GB/的要求进行。
二_三类医疗器械经营范围.
《医疗器械经营企业许可证》经营范围填写规范 Ⅲ类: 6804 眼科手术器械 6815 注射穿刺器械 6821 医用电子仪器 6822 医用光学器具、仪器及内窥镜设备 6823 医用超声仪器及有关设备6824 医用激光仪器设备 6825 医用高频仪器设备 6826 物理治疗及康复设备 6828 医用磁共振设备 6830 医用X射线设备 6832 医用高能射线设备6833 医用核素设备 6840 临床检验分析仪器 6845 体外循环及血液处理设备6846 植入材料和人工器官 6854 手术室、急救室、诊疗室设备及器具 6858 医用冷疗、低温、冷藏设备及器具 6863 口腔科材料 6864 医用卫生材料及敷料 6865 医用缝合材料及粘合剂6866 医用高分子材料及制品6870 软件 6877 介入器材
Ⅱ类: 6803 神经外科手术器械 6807 胸脑心血管外科手术器械6809 泌尿肛肠外科手术器械6810 矫形外科(骨科)手术6815 注射穿刺器械 6820 普通诊察器械 6821 医用电子仪器设备 6822 医用光学器具、仪器及内窥镜设备 6823 医用超声仪器及有关设备6824 医用激光仪器设备 6825 医用高频仪器设备 6826 物理治疗及康复设备 6827 中医器械 6830 医用X射线设备 6831 医用X射线附属设备及部件6833 医用核素设备 6840 临床检验分析仪器 6841 医用化验和基础设备器具6845 体外循环及血液处理设备6846 植入材料和人工器官 6854 手术室、急救室、诊疗室设备及器具 6855 口腔科设备及器具 6856 病房护理设备及器具 6857 消毒和灭菌设备及器具6858 医用冷疗、低温、冷藏设备及器具 6863 口腔科材料 6864 医用缝合材料及粘合剂6866 医用高分子材料及制品6870 软件 一、《医疗器械分类目录》核定的第一类医疗器械产品 6801 基础外科手术器械 编号代码 名称 品名举例 6801-2 基础外科用刀手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲刀、剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲刀、解剖刀 6801-3 基础外科用剪 普通手术剪、组织剪、综合组织剪、拆线剪、石膏剪、解剖剪、纱布绷带剪、教育用手术剪6801-4 基础外科用钳 普通止血钳、小血管止血钳、蚊式止血钳、组织钳、硬质合金镶片持针钳、普通持针钳、创夹缝拆钳、皮肤轧钳、子弹钳、纱布剥离钳、海绵钳、帕巾钳、皮管钳、器械钳 6801-5 基础外科用镊夹小血管镊、无损伤镊、组织镊、整形镊、持针镊、保健镊(简易镊)、拔毛镊、帕巾镊、敷料镊、解剖镊、止血夹 6801-6 基础外科用针、钩 动脉瘤针、探针、推毛针、植毛针、挑针、教学用直尖针、静脉拉钩、创口钩、扁平拉钩、双头
医疗器械法律法规整理
类型名称发布日期实施日期通用国务院令第650号《医疗器械监督管理条例》2014/3/72014/6/1通用主席令第22号 《中华人民共和国广告法》2015/4/242015/9/1通用卫生部令第82号《医疗器械召回管理办法(试行)》2011/5/202011/7/1通用局令第3号《食品药品行政处罚程序规定》2014/4/282014/6/1通用局令第14号《药品医疗器械飞行检查办法》2015/6/292015/9/1通用局令第15号《医疗器械分类规则》2015/7/142016/1/1通用局令6号《医疗器械说明书和标签管理规定》2014/7/302014/10/1通用总局令第19号《医疗器械通用名称命名规则》2015/12/21 通用国食药监械[2011]425号 《医疗器械不良事件监测工作指南》(试行)的通知 2011/9/16 通用食药监办械监函〔2015〕723号 征求医疗器械不良事件监测和再评价管理办法(征求意见稿)意见的函 2015/11/12 通用征求医疗器械分类目录(修订稿)意见的函 2016/9/30 通用食药监械管便函〔2014〕66号 征求《医疗器械标准管理办法》(修订草案征求意见稿)意见的通知2014/10/24 通用食药监办械监〔2016〕9进一步加强医疗器械抽验工作的通知2016/2/4 通用食药监办械监〔2016〕76号印发2016年国家医疗器械抽验产品检验方案的通知2016/6/3 通用食药监械监〔2014〕235号 印发国家重点监管医疗器械目录的通知 2014/9/30 通用征求《医疗器械监督检查员管理办法》意见的函 2014/12/30 类型名称发布日期实施日期临床总局令第25号《医疗器械临床试验质量管理规范》2016/3/232016/6/1临床食药监械管〔2014〕13号《创新医疗器械特别审批程序(试行)》2014/2/102014/3/1临床2014年第14号关于发布需进行临床试验审批的第三类医疗器械目录的通告2014/8/25 临床2014年 第12号 关于发布免于进行临床试验的第二类医疗器械目录的通告2014/8/21 临床2014年 第13号 关于发布免于进行临床试验的第三类医疗器械目录的通告2014/8/21 临床2016年第133号关于发布第二批免于进行临床试验医疗器械目录的通告(二类、三类)2016/9/30 临床2016年第98号关于开展医疗器械临床试验监督抽查工作的通告2016/6/8 临床2015年第117号关于开展药物临床试验数据自查核查工作的公告2015/7/22 临床征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知2015/7/20 临床 临床食药监械管便函〔2014〕44号 关于《体外诊断试剂临床试验技术指导原则》和《体外诊断试剂说明书编写指导原则》征求意见的通知 临床2014年第16号关于发布体外诊断试剂临床试验技术指导原则的通告2014/9/11 临床体外诊断试剂临床试验技术指导原则 2014/9/11 临床发布医疗器械临床评价技术指导原则2015/6/12 临床医疗器械临床评价技术指导原则 2015/5/19 类型名称发布日期实施日期注册局令4号《医疗器械注册管理办法》2014/7/302014/10/1注册局令5号《体外诊断试剂注册办法》 2014/7/302014/10/1注册医疗器械产品技术要求编写指导原则 2014/5/30 注册医疗器械软件注册技术审查指导原则2015/8/5 注册总局2015年度医疗器械注册工作报告 2016/4/1
二三类医疗器械经营范围.docx
精品文档 《医疗器械经营企业许可证》经营范围填写规范 6833医用核素设备Ⅲ类: 6840临床检验分析仪器 6845体外循环及血液处理设备 6804眼科手术器械 6846植入材料和人工器官6815注射穿刺器械 6854手术室、急救室、诊疗室设 6821医用电子仪器 备及器具 6822医用光学器具、仪器及内窥 6858医用冷疗、低温、冷藏设备镜设备 及器具 6823医用超声仪器及有关设备 6863口腔科材料6824医用激光仪器设备 6864医用卫生材料及敷料6825医用高频仪器设备 6865医用缝合材料及粘合剂6826物理治疗及康复设备 6866医用高分子材料及制品6828医用磁共振设备 6870软件 6830医用 X 射线设备 6877介入器材 6832医用高能射线设备
精品文档 Ⅱ类: 6803神经外科手术器械 6807胸脑心血管外科手术器械6809泌尿肛肠外科手术器械6810矫形外科(骨科)手术6815注射穿刺器械 6820普通诊察器械 6821医用电子仪器设备 6822医用光学器具、仪器及内窥镜设备 6823医用超声仪器及有关设备6824医用激光仪器设备 6825医用高频仪器设备 6826物理治疗及康复设备 6827中医器械 6830医用 X 射线设备 6831医用 X 射线附属设备及部件6833医用核素设备 6840临床检验分析仪器 6841医用化验和基础设备器具6845体外循环及血液处理设备6846植入材料和人工器官 6854手术室、急救室、诊疗室设备及器具 6855口腔科设备及器具 6856病房护理设备及器具 6857消毒和灭菌设备及器具6858医用冷疗、低温、冷藏设备及器具 6863口腔科材料 6864医用缝合材料及粘合剂6866医用高分子材料及制品6870软件 一、《医疗器械分类目录》核定的第一类医疗器械产品 6801 基础外科手术器械 编号代码 名称 品名举例 6801-2 基础外科用刀手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲刀、剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲刀、解剖刀 6801-3 基础外科用剪 普通手术剪、组织剪、综合组织剪、拆线剪、石膏剪、解剖剪、纱布绷带剪、教育用手术剪 6801-4 基础外科用钳 普通止血钳、小血管止血钳、蚊式止血钳、组织钳、硬质合金镶片持针钳、普通持针钳、创夹缝 拆钳、皮肤轧钳、子弹钳、纱布剥离钳、海绵钳、帕巾钳、皮管钳、器械钳 6801-5 基础外科用镊夹小血管镊、无损伤镊、组织镊、整形镊、持针镊、保健镊(简易镊)、 拔毛镊、帕巾镊、敷料镊、解剖镊、止血夹 6801-6 基础外科用针、钩 动脉瘤针、探针、推毛针、植毛针、挑针、教学用直尖针、静脉拉钩、创口钩、扁平拉钩、双头
医疗器械相关法律法规知识培训材料
医疗器械相关法律法规知识培训 医疗器械监督管理条例 第一章总则 第一条为了加强对医疗器械的监督管理,保证医疗器械的安全、有效、保障人体健康的生命安全,制定本条例。 第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用、监督管理的单位或者个人,应当遵守本条例。 第三条本条例所称医疗器械,是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的的软件;其用于人体体表及体内 的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手 段参与并一定的辅助作用;其作用旨在达到目的下更预期目的;(一)对疾病的预防、诊断、治疗、监护、缓解; (二)对操作或者残疾的诊断、治疗、监护、缓解、补偿; (三)对解剖或者生理过程的研究、替代、调节; (四)妊娠控制。 第四条国务院药品监督管理部门负责全国的医疗器械监督管理工作。 第五条国家对医疗器械实行分类管理。 第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。 第二类是指,对其安全性、有效性应当加以控制的医疗器械。 第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。 第六条生产和使用以提供具体量值为目的的医疗器械,应当符合计量法的规
定。具体产品目录由国务院药品监督管理部门会同国务院计量行政管理 部门制定并公布。 第二章医疗器械的管理 第七条国家鼓励研制医疗器械新产品,医疗器械新产品,是指国内市场尚未出现过的或者安全性、有效性及产品机理未得到国内认可的全新的品种。第八条国家对医疗器械实行产品生产注册制度。 生产第一类医疗器械,由设区的市级人民政府药品监督管理部门审查批准,并发给产品生产注册证书。 生产第二类医疗器械,由省、自治区、直辖市人民政府药品监督管理部门审查批准,并发给产品生产注册证书。 生产第三类医疗器械,由国务院药品监督管理部门审查批准,并发给产品生产注册证书。 生产第二类、第三类医疗器械,应当通过临床验证。 第九条省、自治区、直辖市人民政府药品监督管理部门负责审批本行政区域内的第二类医疗器械的临床试用或者临床验证。国务院药品监督管理部门负责审批第三类医疗器械的临床试用或者临床验证。 临床试用或者临床验证应当在省级以上人民政府药品监督管理部门指定的医疗机构进行。医疗机构进地临床试用或者临床验证,应当符合国务院药品监督管理部门的规定。 进行临床试用或者临床验证的医疗机构的资格,由国务院药品监督管理部门会同国务院卫生行政部门认定。 第十条医疗机构根据本单位的临床需要,可以研制医疗器械,在执业医师
三类医疗器械技术要求模板
竭诚为您提供优质文档/双击可除三类医疗器械技术要求模板 篇一:医疗器械产品技术要求模板 医疗器械产品技术要求编号: 产品名称 1.产品型号/规格及其划分说明 1.1……(宋体小四号) 1.1.1…… …… 2.性能指标 2.1…… 2.1.1…… …… 3.检验方法 3.1……(宋体小四号) 3.1.1…… …… 4.术语 4.1……(宋体小四号)
4.2…… …… (分页) 附录a 1.……(宋体小四号) 1.1…… —1— 篇二:医疗器械产品技术要求格式 国家食品药品监督管理总局 通告 20xx年第9号 关于发布医疗器械产品技术要求编写指导原则的通告 为规范医疗器械注册管理工作,根据《医疗器械监督管理条例》(国务院令第650号),国家食品药品监督管理总局组织制定了《医疗器械产品技术要求编写指导原则》,现予发布。特此通告。 国家食品药品监督管理总局20xx年5月30日 医疗器械产品技术要求编写指导原则 根据《医疗器械监督管理条例》等相关规定,制定本指导原则。 一、基本要求 (一)医疗器械产品技术要求的编制应符合国家相关法
律法规。 —5— (二)医疗器械产品技术要求中应采用规范、通用的术语。如涉及特殊的术语,需提供明确定义,并写到“4.术语”部分。 (三)医疗器械产品技术要求中的检验方法各项内容的编号原则上应和性能指标各项内容的编号相对应。 (四)医疗器械产品技术要求中的文字、数字、公式、单位、符号、图表等应符合标准化要求。 (五)如医疗器械产品技术要求中的内容引用国家标准、行业标准或中国药典,应保证其有效性,并注明相应标准的编号和年号以及中国药典的版本号。 二、内容要求 医疗器械产品技术要求的内容应符合以下要求: (一)产品名称。产品技术要求中的产品名称应使用中文,并与申请注册(备案)的中文产品名称相一致。 (二)产品型号/规格及其划分说明。产品技术要求中应明确产品型号和/或规格,以及其划分的说明。 对同一注册单元中存在多种型号和/或规格的产品,应明确各型号及各规格之间的所有区别(必要时可附相应图示进行说明)。 对于型号/规格的表述文本较大的可以附录形式提供。
三类医疗器械法规制度
三类医疗器械条例法规题库 (条例、流通办法、注册办法) 一、单项选择题 1、经国务院第39次常务会议修订通过的《医疗器械监督管理条例》的施行时间为__B_ A、2014年7月30日 B、2014年6月1日 C、2014年6月5日 D、2014年8月1日 2、国家对医疗器械实行产品分类注册制度,共分成__C__类医疗器 械。 A、一 B、二 C、三 D、四 3、医疗器械注册证有效期为___B____年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。 A、3 B、5 C、10 D、15 4、第三类医疗器械具有__A__风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。 A、较高 B、中度 C、低度 D、高度 5、受理注册申请的食品药品监督管理部门应当自收到审评意见之日起 C 个工作日内作出决定
A、5 B、10 C、20 D、25 6、受理经营许可申请的食品药品监督管理部门应当自受理之日起__C_个工作日内进行审查,必要时组织核查。 A、10 B、20 C、30 D、40 7、国家对医疗器械实行分类管理,境内第一类医疗器械由__A__核发注册证。 A、由设区的市级(食品)药品监督管理部门。 B、由省、自治区、直辖市(食品)药品监督管理部门。 C、由国家食品药品监督管理局 D、国务院食品药品监督管理部门 8、第三类医疗器械经营企业自行停业 A 以上,重新经营时,应当提前书面报告所在地设区的市级食品药品监督管理部门,经核查符合要求后方可恢复经营。 A、一年 B、二年 C、三年 D、四年 9、医疗器械经营企业擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房的,处以_D___罚款。 A、5000元 B、5000元以下 C、1万元以下 D、1万元以上3万元以下 10、第三类医疗器械进行临床试验对人体具有较高风险的应当经___A___批准。 A、国务院食品药品监督管理部门 B、国家卫生计生委
医疗器械产品技术要求(参考)
医疗器械产品技术要求编号: xxxxxxx电动手术台 1.产品型号/规格及其划分说明 1.1 型号 xx-x-x 设计序号 产品分类x电动 xx汉字拼音字头 1.2 组成 手术台由多节式台面(头板、背板、臀板、腿板) 、立柱、底座、液压传动系统、控制器和配套件组成。 配套件有搁臂板、肩托板、腿托架 2.性能指标 2.1 工作条件: a)环境温度 -20℃~+50℃; b)相对湿度 30%~80%; c)大气压力 700 hPa~1060hPa; d)电源电压 AC220V±22V; e)频率 50Hz±1Hz。 2.2 外观 2.2.1 手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。无露底、起泡、裂纹、流挂、脱落等现象。 2.2.2 手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹; 2.2.3 手动机构应灵活可靠。手术台移动灵活,刹车制动可靠。
2.3 基本参数详见表1。 表1 手术台面均载135Kg.,各功能动作应平稳。 2.5. 渗漏 手术台液压系统应无渗漏现象。手术台台面按照3.2规定方法检验,液压系统历时5h(气压系统历时1h),手术台下降距离不得大于8mm。 2.6 动作平稳性 手术台各种动作变换应该平稳,不得产生抖动现象。 2.7 台面摆动量 空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求: 纵向摆动量应不大于15mm; 横向摆动量应不大于10mm; 水平侧向摆动量应不大于18mm。 2.8 拆装 头板、搁臂板,腿板和所有配套件装卸应方便、锁止应可靠。
2.9 材料 台面和台垫应选用能透过X射线的材料制成,便于透视摄影。 2.10 噪声 手术台在载有按全工作负荷时,其运动噪声在一米距离处,不得大于65dB(A)。 2.11 电磁兼容性 应符合YY 0505—2012的要求和0570-2005中36.101的要求. 2.12 电气安全要求 手术台电气安全应符合GB9706.1-2007的要求,产品主要特征见附录A。 2.13 环境 手术台应符合GB/T14710-2009中气候环境试验II组、机械环境II组的要求见附录B. 3.检验方法 3.1 外观 用手感目力检查,其结果应符合2.2的规定。 3.2 基本参数 用通用量具测量,其结果应符合2.3的规定。 3.3 安全工作载荷 按YY0570-2005中图102所示安全工作载荷,应符合2.4的规定。 3.4 渗漏 手术台在20℃±5℃的条件下,按照YY1106-2008中5.2的规定进行实验,其结果应符合4.3的规定。 3.5 动作平稳性 手术床在变换动作时,以手触摸台面实验,其结果应符合2.6的规定 3.6 台面摆动量 按照YY1106-2008中5.4的规定进行实验,其结果应符合2.7的规定。 3.7 拆装
医疗器械产品技术要求(参考)
医疗器械产品技术要求编号: xxxxxxx电动手术台 1.产品型号/规格及其划分说明 1.1 型号 xx-x-x 设计序号 产品分类x电动 xx汉字拼音字头 1.2 组成 手术台由多节式台面(头板、背板、臀板、腿板) 、立柱、底座、液压传动系统、控制器和配套件组成。 配套件有搁臂板、肩托板、腿托架 2.性能指标 2.1 工作条件: a)环境温度 -20℃~+50℃; b)相对湿度 30%~80%; c)大气压力 700 hPa~1060hPa;
d)电源电压AC220V±22V; e)频率50Hz±1Hz。 2.2 外观 2.2.1 手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。无露底、起泡、裂纹、流挂、脱落等现象。 2.2.2 手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹; 2.2.3 手动机构应灵活可靠。手术台移动灵活,刹车制动可靠。 2.3 基本参数详见表1。 表1 手术台面均载135Kg.,各功能动作应平稳。 2.5. 渗漏 手术台液压系统应无渗漏现象。手术台台面按照3.2规定方法检验,液压系统历时5h(气压系统历时1h),手术台下降距离不得大于8mm。
2.6 动作平稳性 手术台各种动作变换应该平稳,不得产生抖动现象。 2.7 台面摆动量 空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求: 纵向摆动量应不大于15mm; 横向摆动量应不大于10mm; 水平侧向摆动量应不大于18mm。 2.8 拆装 头板、搁臂板,腿板和所有配套件装卸应方便、锁止应可靠。 2.9 材料 台面和台垫应选用能透过X射线的材料制成,便于透视摄影。 2.10 噪声 手术台在载有按全工作负荷时,其运动噪声在一米距离处,不得大于 65dB(A)。 2.11 电磁兼容性 应符合YY 0505—2012的要求和0570-2005中36.101的要求. 2.12 电气安全要求
医疗器械产品技术要求
医疗器械产品技术要求编号 微压舱 1、产品型号/规格及其划分说明 1.1本公司所有生产医用空气微压舱的产品型号及规格应符合表1的规定。 表1 规格型号金属材料制舱体压力 《0.08Mpa 非金属材料制舱体压力 《0.03Mpa WY-01 WYM-01 WYNM-01 1.2产品型号编写规则 本公司微压舱产品的型号由3部分组成,其中;大写汉语字母“WY”表示“微压”之意,左起第一组阿拉伯数字表示保健人数,第二组阿拉伯数字表示规格系列。 2、性能指标 2.1.1 本标准规定了由潍坊华信氧业有限公司生产的加压介质为空气、最高工作压力不大于0.08MPa的微压舱。 2.1.2 本标准规定了微压舱产品的分类、要求、试验方法、检验规则和标志、包装、运输、贮存。 2.1.3 在个人保健方面主要为全身皮肤细胞补氧,修复受损细胞,延缓老化、对抗衰老,舒缓压力、改善亚健康状态等功能。 2.1.4 产品结构组成和分类 2.1.4.1 微压舱主要由舱体和供排气系统、供氧系统、空调系统,电气控制系统组成。 2.1.4.2 微压舱按舱体所采用的主要材料不同分为:金属材料制和非金属材料制微压舱,规格型号见表1。 2.2 舱体 舱体主要由壳体、舱门、观察窗、安全阀等组成。 2.2.1 壳体 2.2.2 金属材料制壳体结构的设计、制造、检验应符合NB/T 47003《钢制焊接常压容器》的有关规定。 2.2.3 非金属材料壳体结构的设计以型式试验的结果来作为选材依据。 2.3 舱门 2.3.1矩形门的透光宽度应不小于600mm。
2.3.2 舱门配有电动或气动锁紧装置应配置手动解锁(或手动泄压阀门)机构。 2.4 观察窗 2.4.1 舱体应设置透明观察窗,数量不少于2个,设置位置应满足舱外人员可 以观察到舱内人员的治疗及保健状态。 2.4.2 观察窗的透明材料应选用浇铸型有机玻璃板材,并应符合GB/T 7134中 合格品的要求。 2.5 安全阀 2.5.1 微压舱应设置至少1只弹簧式安全阀。舱室安全阀的排放能力的计算和 安装要求,应符合应符合《容规》第七章的有关规定。(钢制焊接常压容器中没 有找到关于安全阀的计算及安装要求) 2.5.2 安全阀的整定压力应符合GB/T 12243 弹簧直接载荷式安全阀中第五章 的规定。 2.5.3 舱内装饰隔层、地板的构架应选用 GB 50222—95《建筑内部装修设计 防火规范》中规定的B级材料。(是否改写参考标准中红颜色的三种标准,待定) 2.5.4 微压舱舱室的气密性应符合表2的规定。 表2 试验部位试验压力/MPa 泄漏率/%/h 0.05 ≤15 舱室气密性 舱室最高工作压力≤5.0 注:外开门的舱室气密性仅做舱室最高工作压力的试验。 2.6 微压舱出入口处应在显著位置标注“严禁烟火”等的醒目标记。 2.7 供、排气系统 2.7.1 微压舱供气系统的空压机应选用无油润滑空压机。 2.7.2 空压机的进气口应避开各种污染源。供气系统应设置空气过滤器。 2.7.3 舱内外均应设置机械式快速开启的应急排气阀,并配以红色警示标记和 标示应急排气阀手柄开、关方向的标记。应急卸压时间不大于2分钟。 2.7.4 舱内进气口与排气口应有效隔离,避免气体短路;舱内进气口应设有消 音器,舱内供气时的噪声应不大于65dB(A)。 2.7.5 控制面板上应配置舱内压力数值显示,精度不低于5‰(0.4级)。 2.8 供氧系统 2.8.1 供氧系统采用微型分离式分子筛制氧系统。制氧系统输出的氧气浓度不 低于70%;流量不低于3升/分钟。 2.8.2 供氧系统的管路采用无毒抗氧化的PU软管、紫铜材质,软管材料宜选用 聚氨酯、聚乙烯、聚氯乙烯或橡胶。 2.8.3 舱内氧浓度值应不大于30%。 2.8.4 在控制面板上配置舱内氧气浓度检测装置,当舱内氧气浓度越限时,能 动态调节舱内氧气浓度。 2.9 空调系统 2.9.1.1 微压舱舱室应在控制台下方配置舱内温度监视仪表。
医疗器械产品技术要求
产品技术要求 医疗器械产品技术要求编号: 6864-I(检查手套) 检查用手套/指套 1.0产品型号/规格及其划分说明: 产品型号:检查用手套,以“非无菌形式提供”。 产品规格: 产品按使用人的手型大小分为两个规格: a)L(大码):29mm×27mm×15.5mm,适用于男性医护人员使用; b)M(中码):28mm×24mm×14.7mm,适用于女性医护人员使用; 产品标志: 产品标记分别由品牌代号(WX)、产品名称代号(ST)、规格(L、M)三部分组成。如下所示: WX—ST—□ 规格:按中字母L、M……或参数29mm×27mm×15.5mm ……标记; 产品名称代号:用“ST”表示,是检查手套简称“手套”的汉语拼音首写字母; 品牌代号:用“WX”表示,是“文兴”汉语拼音首写字母。 示例: 佛山市中德容桂文兴五金塑料厂生产的检查用手套: 检查手套 WX/粤×××—2016 WX-ST-L(29mm×27mm×15.5mm) 产品材料: 检查手所选用的原材料应符合相应的产品质量标准。 2.0性能指标: GB/T191-2008包装储运图示标志; GB/计数抽样检验程序第1部分:按接收质量限(AQL)检查的逐批
检查及抽样计划; GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验); GB/T 9969-2008工业产品使用说明书总则; GB/T 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验; YY0466-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求。 3.0检验方法: 要求: 3.1.1 产品外观:表面应平整、洁净、无破损,表面材料为聚乙烯环保材料、背贴纸不得有脱离现象; 3.1.2 外形尺寸:应符合的规定,正负偏差为±1.2mm; 3.1.3残留物:通检查手的背贴纸剥离后,目测背贴纸,用手触摸背贴纸黏胶面,不应有可见残余胶体; 3.1.6 生物安全性: a.致敏性试验:按GB/T 中第7章规定的方法进行,应无致敏反应; b.皮肤刺激性试验:按GB/T 中第6章规定的方法进行,应不大于极 轻微刺激反应。 试验方法: a.外观:用目力检查,应符合3.1.1的规定; b.规格尺寸:用带表卡尺检测符合3.1.2的规定; c.粘着力试验: 取样品1片,将试样一端的粘贴面与不锈钢板的清洁表面接触,使试样的端部的整个宽度与距钢板端面以外,粘贴试样时要确保试样与钢板之间没有气泡,用滚子向试样粘贴部分施加压力,以约 60 cm /m in 的速度沿试样长度方向滚压四次,并使其在标准大气压下停放 10 m in ,在试样端线部做一标记线,在试样的悬挂端按每厘米宽度 N (80 g)贴一重物,施力要均匀分布与整个带宽上,将钢板悬挂于 36℃ - 38℃热空气烘箱内30 m in ,使钢板与垂直面呈 2°倾斜,以防止试样与钢板剥离,并能使重物悬挂,应符合3.1.3的规定; d.剥离强度试验:
医用防护口罩--医疗器械产品技术要求模板
附件3 医疗器械产品技术要求 医疗器械产品技术要求编号/国家标准:XXXXXXXXX/ GB19083-2010 医用防护口罩 1 产品型号/规格及其划分说明 1.1 组成 医用防护口罩(以下简称:口罩)由口罩体、鼻夹和口罩带经超声波热合而成,口罩体至少有三层:内层(纺粘层)、中间层(熔喷层)、外层(纺粘层),鼻夹由可弯折的可塑性聚丙烯材料制成,口罩带通常由涤纶线和少量氨纶线针织而成。 1.2 型号/规格划分说明 口罩按佩戴方式可分为面罩式、拱形、折叠式等;也可按企业设计的产品外形及规格尺寸划分,举例见表1。 表1:医用防护口罩型号规格单位(厘米) 备注:尺寸企业可自行设计,允差不超过±5%。 口罩常见型式见图1: 精品
图1 口罩常见型式 2 性能指标 2.1口罩基本要求 口罩应覆盖佩戴者的口鼻部,应具有良好的面部密合性。表面不得有破洞、污渍,不应有呼吸阀。 2.2 规格尺寸 口罩规格尺寸应符合1.2的要求。 2.3 企业应标明口罩单层无纺布的每平方米质量。 2.4 鼻夹 2.4.1 口罩上应配有鼻夹。 2.4.2 鼻夹应具有可调节性。 2.5 口罩带 2.5.1 口罩带应调节方便。 2.5.2 应有足够强度固定口罩位置。每根口罩带与口罩体连接点处的断裂强力应不小于10N。 2.6 过滤效率 精品
在气体流量为85L/min的情况下,口罩对非油性颗粒过滤效率应符合表2的要求。 企业应明确口罩过滤效率等级 表2 过滤效率等级 2.7气流阻力 在气体流量为85L/min的情况下,口罩的吸气阻力不得超过343.2Pa(35mmH2O)。 2.8合成血液穿透 将2mL合成血液以10.7kPa(80mmHg)压力喷向口罩外侧面后,口罩内侧不应出现渗透。 2.9表面抗湿性 口罩外表面沾水等级应不低于GB/T4745-2012中3级的要求。 2.10阻燃性能 口罩所用材料不应为易燃性,续燃时间应不超过5s。 2.11密合性 口罩设计应提供良好的密合性,总适合因数应不低于100。 精品
第三类医疗器械法律法规考核试题及答案
第三类医疗器械法律法规试题 1、企业质量负责人负责医疗器械质量管理工作,应当独立履行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的质量管理责任。( A ) A、对 B、错 2、企业质量管理机构或者质量管理人员应当履行哪些职责?( C ) ①组织制订质量管理制度,指导、监督制度的执行,并对质量管理制度的执行情况进行检查、纠正与持续改进; ②负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理; ③督促相关部门与岗位人员执行医疗器械的法规、规章及规范; ④负责对医疗器械供货者、产品、购货者资质的审核; ⑤负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督; ⑥负责医疗器械质量投诉与质量事故的调查、处理及报告; ⑦组织验证、校准相关设施设备; ⑧组织医疗器械不良事件的收集与报告; ⑨负责医疗器械召回的管理; ⑩组织对受托运输的承运方运输条件与质量保障能力的审核; ?组织或者协助开展质量管理培训; ?其她应当由质量管理机构或者质量管理人员履行的职责。 A、①②⑤⑨ B、①②③④⑦⑨⑩ C、以上?点均就是 3、从事第二类、第三类医疗器械批发业务与第三类医疗器械零售业务的企业还应当制定购货者资格审核、医疗器械追踪溯源、质量管理制度执行情况考核的规定。( A ) A、对 B、错 4、从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业应当建立销售记录制度与进货查验记录制度。( A ) A、对 B、错 5、《医疗器械经营监督管理办法》从( C )施行。 A、2014年5月1日 B、2014年6月1日 C、2014年10月1日 6、医疗器械经营质量管理规范由( C )制定。 A、浙江省食品药品监督管理局 B、国家食品药品认证中心 C、国家食品药品监督管理总局 7、医疗器械经营企业第三类医疗器械经营许可申请在( B )。 A、省级食品药品监督管理部门 B、设区的市级食品药品监督管理部门
27.医疗器械产品技术要求
医疗器械产品技术要求编号: 血液透析浓缩物 1. 产品型号/规格及其划分说明 本品由A液、B粉两种组分构成。规格型号:LEK-TXW-1。A液装量为桶、桶、桶、桶;B粉装量为570g/袋、588g/袋、1140g/袋、1176g/袋、2850g/袋、2940g/袋、5700g/袋、5880g/袋。 LEK — TXW - 1 产品型号:根据组分区分。(产品组分见下表) 产品名称:“血液透析浓缩物”的缩写。 公司名称:“山东利尔康医疗科技股份有限公司”的缩写。
注:稀释用水为血液透析和相关治疗用水。 2. 结构组成 本品A液由氯化钠、氯化钾、氯化镁、氯化钙、冰醋酸等原料组成;B粉由碳酸氢钠组成。 氯化钠 别名:食盐化学式:NaCl 相对分子质量: 管制类型:不管制 CAS号:7647-14-5 EINECS号:231-598-3 本品为无色、透明的立方形结晶或白色结晶性粉末;无臭,味咸。 生产血液透析浓缩物所采购的医用级氯化钠的各项技术指标均符合《中华人民共和国药典》四部(2015年版)药用辅料氯化钠项下的各项技术指标要求。 氯化钾 别名:- 化学式:KCl 相对分子质量: 管制类型:不管制 CAS号:7447-40-7 EINECS号:231-211-8 本品为无色长棱形、立方形结晶或白色结晶性粉末;无臭。 生产血液透析浓缩物所采购的医用级氯化钾的各项技术指标均符合《中华人民共和国药典》四部(2015年版)药用辅料氯化钾项下的各项技术指标要求。 氯化钙 别名:- 化学式:CaCl 2·2H 2 O 相对分子质量: 管制类型:不管制 CAS号:10043-52-4 EINECS号:233-140-8本品为白色、坚硬的碎块或颗粒;无臭;极易潮解。
医疗器械经营企业法律法规
医疗器械经营企业法律法规考试试题 一、填空题(共20分,每空2分) 1、按照医疗器械风险程度,医疗器械经营实施分类管理。经营第一类医疗器械不需许可和备案,经营第二类医疗器械实行管理,经营第三类医疗器械实行管理。 2、《医疗器械经营许可证》有效期为年,载明许可证编号、企业名称、法定代表人、企业负责人、住所、经营场所、经营方式、经营范围、库房地址、发证部门、发证日期和有效期限等事项。 3、《医疗器械经营许可证》事项的变更分为许可事项变更和登记事项变更。许可事项变更包括、、、的变更。登记事项变更是指上述事项以外其他事项的变更。 4、登记事项变更的,医疗器械经营企业应当及时向设区的办理变更手续。 5、医疗器械注册人、备案人或者生产企业在其住所或者销售医疗器械,不需办理经营许可或者备案;医疗器械的,应当按照规定办理经营许可或者备案。 二、单项选择题(共25分,每题5分) 6、《医疗器械经营许可证》有效期届满需要延续的,医疗器械经营企业应当在有效期届满()个月前,向原发证部门提出《医疗器械经营许可证》延续申请。 A、1个月 B、4个月 C、5个月 D、6个月 7、医疗器械经营企业对其办事机构或者销售人员以本企业名义从事的医疗器械购销行为 承担法律责任。医疗器械经营企业销售人员销售医疗器械,应当提供加盖本企业公章的授权书。授权书应当载明()。 A、授权销售的品种、地域、期限,注明销售人员的身份证号码 B、授权销售的品种即可 C、授权销售品种、地域、期限 D、授权销售人员的身份证号码
8、从事医疗器械批发业务的企业,其购进、贮存、销售等记录应当符合可追溯要求。进货查验记录和销售记录应当保存至医疗器械有效期后()年;无有效期的,不得少于()年。植入类医疗器械进货查验记录和销售记录应当()。 A、1年;2年;10年 B、2年;5年;永久保存 C、3年;2年;永久保存 D、3年;1年;10年 9、医疗器械经营企业应当从具有资质的生产企业或者经营企业购进医疗器械。医疗器械经营企业应当与供货者约定()责任,保证医疗器械售后的安全使用。 A、质量责任和售后服务责任 B、质量责任 C、售后服务责任 D、安全责任 10、医疗器械经营企业应当配备()人员负责售后管理,对客户投诉的质量问题应当查明原因,采取有效措施及时处理和反馈,并做好记录,必要时应当通知供货者及医疗器械生产企业。 A、专职 B、兼职 C、专职或者兼职 三、判断题(共5题,每题2分) 11、第三类医疗器械经营企业应当建立质量管理自查制度,并按照医疗器械经营质量管理规范要求进行全项目自查,于每年年底前向所在地设区的市级食品药品监督管理部门提交年度自查报告。() 12、第三类医疗器械经营企业自行停业一年以上,重新经营时,不需要书面报告所在地设区的市级食品药品监督管理部门,直接可恢复经营。()
医疗器械产品技术要求
医疗器械产品技术要求编号: XXXXXX 1产品型号/规格及其划分说明 1.1型号命名 P 2 0 0 设计序号 产品代号 1.2结构组成(不同型号如有结构组成的差异,应分型号列明) XXXXXX(以下简称XX)主要有X射线管组件(组合式)、限束器、操作台、影像处理系统、C形臂及可移动机架、医用X射线影像增强器组成。 1.3型号说明(如有多个型号此条适用,列表标明型号间差异) 表1 型号说明 1.4工作条件 a)环境温度:10℃-40℃; b)相对湿度:30%-75%; c)大气压力:700 hPa-1060 hPa。 d)电源:AC 220V±22V;50Hz±1Hz e)额定输入功率:xxVA。 2性能指标 2.1外观 2.2XXX ………. 2. X安全要求 XXX安全要求应符合GB 9706.1-2007的要求,产品主要特征见附录C。(9706.1适用设备) XXX安全要求应符合GB 4793.1-2007的要求,产品主要特征见附录C。(4793.1适用设备) 2. X电磁兼容(9706.1适用设备)
电磁兼容应符合YY 0505-2012的要求。 2. X电磁兼容(479 3.1适用设备) 电磁兼容应符合GB/T 18268.1-2010的要求。 2. X电磁兼容(体外诊断类适用设备) 电磁兼容应符合GB/T 18268.1-2010及GB/T 18268.26-2010的要求。2. X环境试验 按GB/T 14710-2009中规定的气候环境Ⅱ组、机械环境Ⅱ组的要求及表X 进行试验,应符合要求。 表X 试验要求及检验项目 3检验方法 3.1外观 用正常或矫正视力观察以及用手感检查,结果应符合2.1的要求。 ……………….
二_三类医疗器械经营范围
二_三类医疗器械经营 范围
《医疗器械经营企业许可证》经营范围填写规范 Ⅲ类: 6804 眼科手术器械 6815 注射穿刺器械 6821 医用电子仪器 6822 医用光学器具、仪器及内窥镜设备 6823 医用超声仪器及有关设备 6824 医用激光仪器设备6825 医用高频仪器设备6826 物理治疗及康复设备6828 医用磁共振设备 6830 医用X射线设备 6832 医用高能射线设备6833 医用核素设备 6840 临床检验分析仪器6845 体外循环及血液处理设备 6846 植入材料和人工器官6854 手术室、急救室、诊疗室设备及器具 6858 医用冷疗、低温、冷藏设备及器具 6863 口腔科材料 6864 医用卫生材料及敷料6865 医用缝合材料及粘合剂6866 医用高分子材料及制品6870 软件 6877 介入器材
Ⅱ类: 6803 神经外科手术器械6807 胸脑心血管外科手术器械 6809 泌尿肛肠外科手术器械6810 矫形外科(骨科)手术6815 注射穿刺器械 6820 普通诊察器械 6821 医用电子仪器设备6822 医用光学器具、仪器及内窥镜设备 6823 医用超声仪器及有关设备 6824 医用激光仪器设备6825 医用高频仪器设备6826 物理治疗及康复设备6827 中医器械 6830 医用X射线设备 6831 医用X射线附属设备及部件6833 医用核素设备 6840 临床检验分析仪器6841 医用化验和基础设备器具 6845 体外循环及血液处理设备 6846 植入材料和人工器官6854 手术室、急救室、诊疗室设备及器具 6855 口腔科设备及器具6856 病房护理设备及器具6857 消毒和灭菌设备及器具6858 医用冷疗、低温、冷藏设备及器具 6863 口腔科材料 6864 医用缝合材料及粘合剂6866 医用高分子材料及制品6870 软件
