大肠菌群检验原始记录
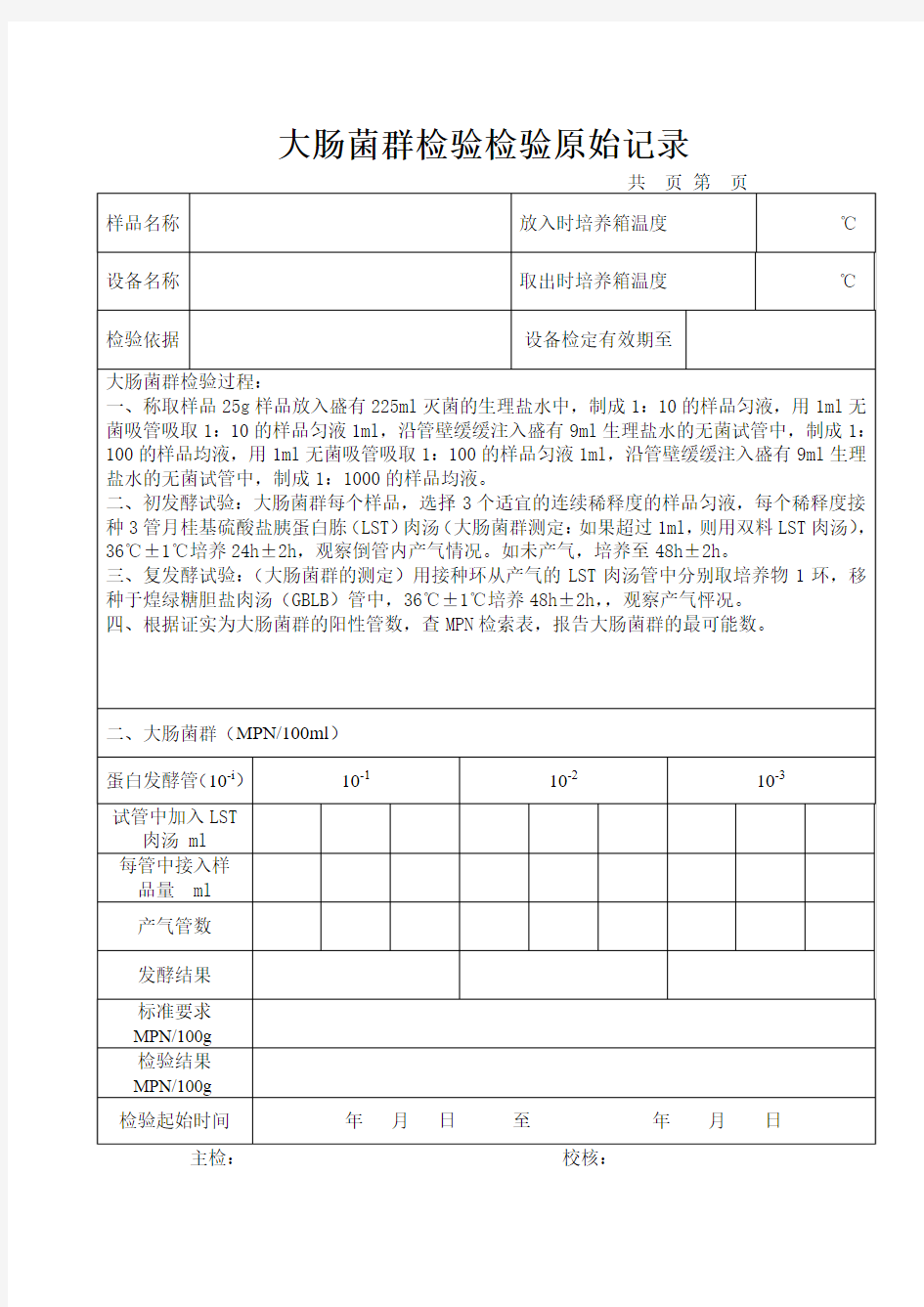
大肠菌群检验检验原始记录
质量检验操作规程
重庆卡顿尔食品有限公司 产品质量检验操作规程 部门:品控部 编制:范昌勇 文件编号:KDRQC018 日期:2015年1月12日 一、菌落总数检测操作规程 检测国标:GB 4789.2-2010食品安全国家标准食品微生物学检验菌落总数测定 样品:卡顿尔蛋糕、卡曲、西点类产品 产品国标:GB/T 20977-2007糕点通则;GB/T 20980-2007饼干 产品卫生标准:GB 7099-2003糕点、面包卫生标准; GB 7100-2003饼干卫生标准 菌落总数指标:糕点:热加工≤1500cfu/g,冷加工≤10000cfu/g
饼干:≤750cfu/g 试剂:生理盐水(约8.5%)(磷酸盐缓冲溶液);营养琼脂培养基(或平板计数琼脂培养基);75%消毒酒精 设备:电子称(0.01g)、电子万用炉、灭菌锅、恒温水浴锅、超净工作台、电热恒温培养箱 器具:250ml三角瓶、玻璃棒、烧杯(500ml)、试管(15*150或者18*180)、试管架、培养皿、镊子、钥匙、刻度吸量管(1ml、10ml)、移液器(100-1000ul)、酒精灯 操作步骤: 1.药品配制 营养琼脂培养基(配比:32g+1000ml蒸馏水);生理盐水(8.5gNaCl+1000蒸馏水)(或磷酸盐缓冲溶液);75%消毒酒精(500ml95%纯酒精+133ml蒸馏水)。 2.灭菌消毒准备 ⑴往灭菌锅外层锅内加适量的水(水位刚好没过加热管,最好用硬度较低的水,避免结垢而缩短加热管的寿命)。 ⑵培养皿成套同向整齐排列叠放,用干燥的牛皮纸(或者报纸)包裹卷紧,放入灭菌锅内套中。 ⑶将准备好的试管、培养基、刻度吸量管、移液器枪头、生理盐水放入锅内,注意不要放置过于密集紧凑,以免影响蒸汽循环造成灭菌不彻底。 ⑷盖好锅盖并对称地扭紧螺旋。 ⑸加热使锅内产生蒸汽,当压力表指针达到 33.78kPa时,打开排气阀,将冷空气排出,此时压力表指针下降,当指针下降至零时,即将排气阀关好。注意冷空气必须充分排除,否则锅内温度达不到规定温度,影响灭菌效果。 ⑹继续加热,锅内蒸汽增加,压力表指针又上升,当锅内压力增加到所需压力时,将火力减小(自动控制则无需手动操作,老式灭菌锅需手动切断电源来调节),使蒸汽压力升至103.4kPa,温度达121.3°C,维持15~20分钟,然后将灭菌器断电或断火,让其自然冷后再慢慢打开排气阀以排除余气,然后才能开盖取物。 ⑺无菌操作间和超净工作台紫外灯开启,关闭通道门,灭菌30-60分钟。 ⑻更衣进入无菌间,操作前用75%消毒酒精对手部、样品盒表面、操作台、试管架等进行喷洒消毒。 3.样品处理 卡顿尔产品(含半成品)均为固体和半固体样品,样品处理方法如下: 称取25 g 样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1 min~2 min,或放入盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 1:100样品液稀释方法:用1 mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。按此操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次,换用1次1 mL无菌吸管或吸头。 4.接种培养
微生物检验操作规程
微生物检验操作规程 1.目的 为规范微生物检验员的工作流程及检验方法,确保检测数据的准确性及生产环境的卫生条件符和前提方案的要求,特制订本规程。 2.职责 微生物检验员负责按本规程进行微生物检验及记录的填写整理。 3.商业无菌检测 3.1抽样方法 以《成品留样管理规定》商业无菌检测留样。 3.2检测范围 公司生产各品类产品(发酵核桃乳除外)。 3.3检测方法 GB4789.26-2013 《食品微生物学检验商业无菌检验》。 3.3.1操作 样品准备:每个批次取3听样品,在包装容器表面用防水油性记号笔标注样品编号,观察并记录时否有泄露、包装是否有小孔,锈蚀,压痕、膨胀及其它异常情况。 称重:准备好的样品每个批次取2听称重,精确到1g,并记录。 保温:准备好的样品每个批次取剩下的1听置于2℃~5℃冰箱保存作为对照,称重后样品于36±1℃的恒温箱中保温10天,每日观察,保温期间如有胖听、泄漏及时剔除并开罐检查。
保温结束后,再次称重并记录,比较保温前后有无变化。如变轻,表明样品发生泄漏,并记录。将所有包装物置于室温直至开启检查。 开启:如有膨胀的样品,将样品先置于2℃~5℃冰箱冷藏数小时后开启。 如有膨胀样品用冷水和洗涤剂清洗待检样品光滑面,水冲洗后用无菌纱布擦干。以含4%碘的乙醇溶液浸泡消毒光滑面15min后用无菌纱布擦干,用酒精灯将表面残余的碘乙醇溶液全部燃烧完。 在百级洁净实验室内将保温后样品摇匀,用无菌镊子开启,开罐时不得伤及卷边结构,在开启下一个样品前应将镊子在火焰下灼烧灭菌。 留样:开启后用灭菌移液器无菌取出至少30ml至灭菌容器中,做好标记了,保存2-5℃冰箱中,有需要可用于进一步实验,待该批样品得出检验结论后可弃去。 感官检查:开启后,将样品内容物倒入透明玻璃瓶中,观察其组织形态,色泽和气味有无腐败变质迹象并记录。 pH测定:被测液温度应调到20±2℃,与对照样品比较是否有显著差异,pH 相差0.5及以上为显著差异。 涂片:用无菌接种环挑取样液涂于载玻片上,待干后用酒精灯火焰固定,然后向载玻片上滴一滴结晶紫,覆盖固定的料液1min,用蒸馏水小流沿载玻片一端冲洗,待冲洗后水不为紫色为止,自然干燥。 镜检:至少观察5个视野,记录菌体形态特征及每个视野的菌数,与同批冷藏对照样比较,判断是否有明显微生物增殖现象,菌数有百倍或百倍以上增长判为明显增殖。 3.3.2判定
环境监测原始记录表
环境监测原始记录表 环境保护监测中心站 2012年
目录 1. 地表水采样原始记录表19.离子选择电极原始记录表 2. 大气采样原始记录表20.分光光度法分析原始记录表 3. 降水采样原始记录表21.原子吸收分光光度法分析原始记录表 4. 降尘采样原始记录表22.气相色谱分析原始记录表 5. 土壤采样原始记录表23.离子色谱分析原始记录表 6. 底质(底泥、沉积物)采样原始记录表24.细菌总数测定原始记录表 7. 污染源废水采样原始记录表25.粪大肠菌群测定原始记录表 8. 固定污染源排气中气态污染物采样原始记录表26.区域环境噪声监测原始记录表 9. 固定污染源排气中颗粒物采样原始记录表27.城市交通噪声监测原始记录表 10.烟气烟色监测现场记录表28.污染源噪声监测原始记录表 11.pH值分析原始记录表29.机动车排气路检原始记录表 12.电导率分析原始记录表30.一般试剂配制原始记录表 13.色度分析原始记录表(铂钴比色法)31.校准曲线配制原始记录表 14.色度分析原始记录表(稀释倍数法)32.标准溶液配制与标定原始记录表 15.重量分析原始记录表33.样品交接记录表 16.容量法分析原始记录表34.样品分析任务表 17.五日生化需氧量分析原始记录表35.样品前处理原始记录表 18.一氧化碳分析原始记录表36.大气采样器流量校准原始记录表
xx 省环境监测原始记录表( 1 ) 地表水采样原始记录表 采样目的: 方法依据:GB12998-91 采样日期: 年 月 日 枯 丰 平 pH 计型号及编号: DO 仪型号及编号: 电导仪型号及编号: 采样: 送样: 接样: .第 页 共 页
10游泳池水微生物检验方法大肠菌群测定操作规程
1、目的 依据GB/T18204.10—2000游泳池水微生物检验方法大肠菌群测定,熟练掌握此规程,保证检验结果的准确性。 2、适用范围 本标准规定了游泳池水大肠菌群的测定方法。 3、责任 使操作者熟悉本规程,并在具体样品检验中严格遵照操作,确保检测结果准确性。 4、内容: 4.1定义:大肠菌群 指一群在36℃±1℃培养24h能发酵乳糖、产酸、产气的需氧和兼性厌痒的革兰氏阴性无芽胞杆菌。 第一法多管发酵法 4.2 仪器: 高压蒸汽灭菌器。 干热灭菌箱。 培养箱:36℃±1℃。 冰箱。 电炉。 天平。 灭菌平皿:直径9cm. 灭菌刻度吸管:1mL,10mL 灭菌棉拭子。 灭菌剪刀。 放大镜。 PH计或精密PH试纸。 4.3 培养基和试剂: 4.3.1乳糖胆盐发酵培养液
4.3.1.1成分:蛋白胨20g 牛肉膏3g 乳糖5g 氯化钠5g 1.6%(v/v)溴甲酚紫乙醇溶液1ml 蒸馏水1000ml 三倍浓缩乳糖蛋白胨培养液按上述乳糖蛋白胨培养液浓缩三倍配制。 4.3.1.2制法:将蛋白胨、牛肉膏、乳糖及氯化钠置于1000ml蒸馏水中加热溶解,调pH 值至7.2~7.4,再加入1ml 1.6%溴甲酚指示剂,充分混匀,分装到含有带有倒管的试管中,在115℃高压灭菌15分钟。 4.3.2伊红美兰琼脂 4.3.2.1成分:蛋白胨10g 乳糖10g 磷酸氢二钾2g 琼脂17g 2%伊红水溶液20ml 0.65%美蓝溶液10ml 蒸馏水1000ml 4.3.2.2制法:将蛋白胨、磷酸盐和琼脂溶解于蒸馏水中,调pH值至7.1,分装到烧瓶内。121℃高压灭菌15分钟备用,临用时加入乳糖并加热溶化琼脂,冷至50~55℃,加入伊红和美篮溶液,摇匀,倾注平板。 4.3.3革兰氏染色液 4.3.3.1结晶紫染色液: 结晶紫1g 95%乙醇20ml 1%草酸铵水溶液80ml 将结晶紫溶于乙醇中,然后与草酸铵溶液混合。
大肠菌群检验操作规程
大肠菌群计数检验操作规程 一、目的 建立大肠菌群计数检验的标准操作程序,使操作过程规范化。 二、适用范围 适用于大肠菌群计数的检验操作。 三、职责 1.检验人员 严格按检验操作规程进行检验。 2.QC主管 监督检查执行情况。 四、程序 1.范围 本方法适用于大肠菌群计数(coliforms)的测定 2.术语和定义 2.1 大肠菌群:在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性 无芽胞杆菌。 3. 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 3.1 恒温培养箱:36℃±1℃,30℃±1℃。 3.2冰箱:2℃~5℃。 3.3 恒温水浴箱:46℃±1℃。 3.4天平:感量为0.1 g。 3.5均质器。 3.6振荡器。 3.7无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸
头。 3.8 无菌锥形瓶:容量500 mL。 3.9无菌培养皿:直径90 mm。 3.10 pH计或pH比色管或精密pH试纸。 3.11菌落计数器。 4.培养基和试剂 4.1 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤:见附录A中A.1。 4.2 煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤:见附录A中A.2 4.3磷酸盐缓冲液:见附录 A中 A.3。 4.4无菌生理盐水:见附录 A中 A.4。 4.5无菌 1 mol/L NaOH:见附录 A中 A.5。 4.6无菌 1 mol/L HCl:见附录 A中 A.6。
5.检验程序 大肠菌群MPN计数的检验程序见图1。 图1大肠菌群MPN计数法检验程序 6.操作步骤 6.1 样品的稀释 6.1.1 固体和半固体样品:称取25 g 样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有225 mL 稀释液的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成1:10 的样品匀液。 6.1.2 液体样品:以无菌吸管吸取25 mL 样品置盛有225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10 的样品匀液。 6.1.3样品匀液的pH值应在6.5~ 7.5 之间,必要时分别用1 mol/L NaOH或1 mol/L HCl 调
水质粪大肠菌群(一般水样)测定作业指导书
水质 粪大肠菌群(一般水样)测定作业指导书 1 含义及执行标准 含义 粪大肠菌群基本性状与总大肠菌群相似, 属于总大肠菌群的一部分。在培养温度为37 C 时可检出总大肠菌群的存在, 为区别存在于自然环境和温血动物肠道内的粪源性大肠菌群细 菌,将培养温度提高倒 44.5C,仍能使乳糖发酵产酸产气的总大肠菌群为粪大肠菌群。 水样特指除医院污水外的各种水样。本实验通过定性区别实验产酸产气,检索 出定量的粪大肠菌群结果。 多管发酵技术是以最可能数( most probable number ,简称MPN )来表示试验结果的。 它是根据统计学理论,通过水样不同稀释浓度多组重复生物培养阳性结果估计水体中被测生 加工、烹调及去皮蔬菜 b 生食类蔬菜、瓜类及草本水果 方法名称:多管发酵法 方法来源:水质粪大肠菌群的测定多管发酵法和滤膜法(试行) (HJ/T 347 — 2007) 方法适用范围:此法适用于地表水、地下水及废水中粪大肠菌群的测定。 仪器 高压蒸汽灭菌器 表1-3粪大肠菌群畜禽养殖污染物排放标准 (GB 18596-2001 ) 方法名称、方法来源及适用范围 2.1 MPN 表,导 1.2 方法原理 2.2
电热干燥箱 恒温培养箱 冰箱 采样瓶、三角烧瓶、试管、平皿(直径9cm)、刻度吸管等器皿121 C(20min)高压 蒸汽灭菌后于电热干燥箱中烘干。 2.3 标准菌株制备 将标准菌株的母种或稳定工作种接种到单倍乳糖蛋白胨培养液中培养对照控制。必须包括大肠埃希氏菌、产气场杆菌和山夫登堡沙门氏菌三种对照。接种完后需记录: 母种的来源, 母种和工作种的保存方法、保存温度、传代间隔时间、生长培养基及孵育条件, 确认试验(存活度、纯度、关键诊断指标等),母种到工作种的传代代数。 2.4 培养基 2.4.1单倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基,按铭牌配制,用定量加液器分 装每个试管10ml,加塞,在115C灭菌20min,贮存于暗处备用。 242三倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基, 按铭牌比例,三倍配制(蒸馏 水除外),用定量加液器分装每个试管5ml或每个大试管50mL,加塞,在115C灭菌20min , 贮存于暗处备用。 243 EC培养液:市售EC培养基,按铭牌配制,在115C灭菌20min,用定量加液器 分装每个试管10ml,加塞,贮存于暗处备用。 2.4.4培养基存放于带紫外灯的灭菌物品专用贮藏柜中, 显变化 当培养基颜色变化,或体积明 时废弃不用。 2.5 分析步骤 2.5.1水样接种量 将水样充分混匀后,根据水样污染的程度确定水样接种量。每个样品至少用三个不同的水 样量接种。同一接种水样量要有五管。相对未受污染的水样接种量为10mL、1mL、O.ImL。受污染水样接种量根据污染程度接种1mL、0.1mL、0.01mL或0.1mL、0.01mL、0.001mL等。 使用的水样量可参考下表2。 表2接种用水量参考表
SN出口食品中大肠菌群粪大肠菌群和大肠杆菌检验方法
SN0169-92代替ZBX09002一88 Methodforexaminationofcoliform,fecalcoliformandescherichiacoliinfoodforexport 1、主题内容与适用范围 本标准规定了出口食品中大肠菌群、粪大肠菌群和大肠杆菌的检验方法。 本标准适用于出口食品的检验。 2、设备和材料 2.1 吸管:1mL,具0.1mL刻度;5mL和10mL,具1mL刻度。 2.2 水浴箱:44.5±0.5℃。 2.3 培养箱:36±1℃,44.5±0.5℃。 2.4 冰箱:0~5℃和-15~-20℃。 2.5 均质器。 2.6 乳钵和研棒。 2.7 平皿:直径90mm。 2.8 天平:感量0.1g。 2.9 显微镜。 2.10稀释瓶:100mL、200mL和500mL三角烧瓶及广口瓶。 2.11玻璃珠:直径约5mm。 2.12菌落计数器。 3、培养基及试剂 3.1 月桂基硫酸盐胰蛋白(胨)(LST)肉汤。 3.2 煌绿乳糖胆盐(BGLB)肉汤。 3.3EC肉汤。 3.4 伊红美蓝琼脂(EMB)。 3.5 营养琼脂斜面。
3.6 色氨酸肉汤。 3.7MR-VP培养基。 3.8Korser氏枸椽酸盐肉汤。 3.9 结晶紫中性红胆盐琼脂(VRBA)。 3.10 Butterfield氏磷酸盐缓冲稀释液。 3.11生理盐水。 3.12革兰氏染色液。 3.13Kovacs氏靛基质试剂。 3.14甲基红指示剂。 3.15Voges-proskauer(V-P)试剂。 4、样品制备 4.1 以无菌操作取有代表性的样品。如有包装则用75%乙醇在开口处擦拭后取样。若不能及时检验,应将冷冻样品置于-15℃保存;非冷冻而易腐的食品,应置于4℃冰箱保存。检验前冷冻样品可于2~5℃18h内解冻,或在45℃以下15min内解冻。 4.2 不同食品样品匀液的制备 4.2.1 液体食品以灭菌吸管取样25mL放入装有225mL稀释剂的灭菌玻璃瓶(瓶内预置适当数量的玻璃珠),以30cm幅度、于7s内振摇25次(或以机械振荡器振摇),制成1:10的样品匀液。 4.2.2 固体和半固体食品 以无菌操作取25g样品,放入装有225mL稀释剂的灭菌均质杯内,于8000r/min均质1~2min,制成1:10样品匀液(也可用灭菌乳钵研磨的方法代替)。 4.3 稀释样品匀液根据对样品污染情况的估计,用稀释剂将样品匀液制成一系列十倍递增的样品稀释液,如10-2、10-3、10-4……。从制备样品匀液至稀释完毕,全过程不得超过15min。 5、大肠菌群的测定 5.1 大肠菌群MPN值的测定 5.1.1 对每个样品,选择适宜的三个连续稀释度的样品稀释液。每个稀释度接种三管月桂基硫酸盐胰蛋白(月示)(LST)肉汤,每管接种1mL。 5.1.2 将接种管置于36±1℃培养48±2h。
公共场所茶具微生物检验方法大肠菌群测定操作规程
1、目的 依据GB/T18204.3—2000公共场所茶具微生物检验方法大肠菌群测定,熟练掌握此规程,保证检验结果的准确性。 2、适用范围 本标准规定了公共场所内公用茶具大肠菌群的测定方法。 3、责任 使操作者熟悉本规程,并在具体样品检验中严格遵照操作,确保检测结果准确性。 4、内容: 4.1定义:大肠菌群 指一群在37℃、24h培养能发酵乳糖、产酸、产气、需氧和兼性厌痒的革兰氏阴性无芽胞杆菌。 该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价被检物的卫生质量。 4.2 仪器: 高压蒸汽灭菌器。 干热灭菌箱。 培养箱:36℃±1℃。 冰箱。 电炉。 天平。 灭菌平皿:直径9cm。 灭菌刻度吸管:1mL,10mL。 灭菌棉拭子。 灭菌剪刀。 PH计或精密PH试纸。 4.3 培养基和试剂: 4.3.1乳糖胆盐发酵培养液 4.3.1.1成分:
蛋白胨20g 猪胆盐(或牛、羊胆盐)5g 乳糖10g 0.04%溴甲酚紫水溶液25ml 蒸馏水1000ml 4.3.1.2制法:将蛋白胨、胆盐及乳糖溶于蒸馏水中,调pH值至7.4,加溴甲酚紫溶液,混匀,分装到带有倒管的试管中,每管10ml,在115℃高压灭菌15分钟。(注:双料乳糖胆盐发酵管除蒸馏水外,其他成分加倍) 4.3.2伊红美兰琼脂 4.3.2.1成分: 蛋白胨10g 乳糖10g 磷酸氢二钾2g 琼脂17g 2.0%伊红水溶液20ml 0.65%美蓝溶液10ml 蒸馏水1000ml 4.3.2.2制法:将蛋白胨、磷酸盐和琼脂溶解于蒸馏水中,调pH值至7.1,分装到烧瓶内。121℃高压灭菌15分钟备用,临用时加入乳糖并加热溶化琼脂,冷至50~55℃,加入伊红和美篮溶液,摇匀,倾注平板。 4.3.3乳糖发酵管 4.3.3.1成分: 蛋白胨20g 乳糖10g 0.04%溴甲酚紫水溶液25ml 蒸馏水1000ml 4.3.3.2制法:将蛋白胨和乳糖溶于水中,调pH值至7.4,加入指示剂,分装到带有倒管
水质 总大肠菌群测定作业指导书
水质 总大肠菌群测定作业指导书 1 含义及执行标准 1.1 含义 总大肠菌群系指一群需氧及兼性厌氧的,在37℃生长时能使乳糖发酵,在24小时内产酸产气的革兰氏阴性无芽孢杆菌。 1.2 方法原理 多管发酵技术是以最可能数(most probable number ,简称MPN )来表示试验结果的。它是根据统计学理论,通过水样不同稀释浓度多组重复生物培养阳性结果估计水体中被测生物密度的一种方法,具体是通过查MPN 表获得结果的。 1.3 水环境质量标准 表1-1 总大肠菌群地下水质量分类指标 (GB/T 14848-93) 表1-2 总大肠菌群生活饮用水卫生标准 (GB 5749-2006) 表1-3 总大肠菌群渔业水质标准 (GB 11607-89) 1.4 水污染物排放标准 表1-4 总大肠菌群船舶污染物排放标准 (GB 3552-83) 2 分析方法 2.1 方法名称、方法来源及适用范围
方法名称:多管发酵法 方法来源:《水和废水监测分析方法》(第四版)国家环保总局2002年第五篇第二 章五(一) 方法适用范围:此法适用于各种水样(包括底泥)的总大肠菌群测定。 2.2仪器 高压蒸汽灭菌器 电热干燥箱 恒温培养箱 显微镜 冰箱 采样瓶、三角烧瓶、试管、平皿(直径9cm)、刻度吸管等器皿121℃(20min)高压 蒸汽灭菌后于电热干燥箱中烘干。 2.3 标准菌株制备 将标准菌株的母种或稳定工作种接种到单倍乳糖蛋白胨培养液中培养对照控制。必须包 括大肠埃希氏菌和山夫登堡沙门氏菌两种对照。接种完后需记录:母种的来源,母种和工作 种的保存方法、保存温度、传代间隔时间、生长培养基及孵育条件,确认试验(存活度、纯 度、关键诊断指标等),母种到工作种的传代代数。 2.4 培养基 2.4.1 单倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基,按铭牌配制,用定量加液器分装每个试管10ml,加塞,在115℃灭菌20min,贮存于暗处备用。 2.4.2 三倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基,按铭牌比例,三倍配制(蒸馏水除外),用定量加液器分装每个试管5ml或每个大试管50mL,加塞,在115℃灭菌20min,贮存于暗处备用。 2.4.3 品红亚硫酸钠培养基:市售品红亚硫酸钠培养基,按铭牌配制,分装于三角烧杯内,加塞,在115℃灭菌20min,贮存于冷暗处备用。 2.4.4 伊红美蓝培养基:市售伊红美蓝培养基,按铭牌配制,分装于三角烧杯内,加塞,在115℃灭菌20min,贮存于冷暗处备用。 2.3.5培养基存放于带紫外灯的灭菌物品专用贮藏柜中,当培养基颜色变化,或体积明 显变化时废弃不用。 2.5分析步骤 2.5.1 生活饮用水 ①初发酵实验:在二个装有已灭菌的50ml三倍浓缩乳糖蛋白胨培养基的大试管中(内有倒 管),以无菌操作各加入已充分混匀的水样100ml;在10支装有已灭菌的5ml三倍浓缩乳糖 蛋白胨培养液的试管中(内有倒管),以无菌操作加入充分混匀的水样10ml,混匀后置于 37℃恒温箱培养24h。 ②平板分离:经初发酵试验培养24h后,发酵试管颜色变黄为产酸,小玻璃倒管内有气泡为
水质 粪大肠菌群(一般水样)测定作业指导书
水质粪大肠菌群(一般水样)测定作业指导书 1含义及执行标准 1.1含义 粪大肠菌群基本性状与总大肠菌群相似,属于总大肠菌群的一部分。在培养温度为37℃时可检出总大肠菌群的存在,为区别存在于自然环境和温血动物肠道内的粪源性大肠菌群细菌,将培养温度提高倒44.5℃,仍能使乳糖发酵产酸产气的总大肠菌群为粪大肠菌群。一般水样特指除医院污水外的各种水样。本实验通过定性区别实验产酸产气,检索MPN表,导出定量的粪大肠菌群结果。 1.2方法原理 多管发酵技术是以最可能数(most probable number,简称MPN)来表示试验结果的。它是根据统计学理论,通过水样不同稀释浓度多组重复生物培养阳性结果估计水体中被测生物密度的一种方法,具体是通过查MPN表获得结果的。 1.3水环境质量标准 表1-1 粪大肠菌群地表水环境质量标准(GB 3838-2002) 表1-2 粪大肠菌群农田灌溉水质标准(GB 5084-2005) a 加工、烹调及去皮蔬菜 b 生食类蔬菜、瓜类及草本水果 表1-3 粪大肠菌群畜禽养殖污染物排放标准(GB 18596-2001) 2分析方法 2.1方法名称、方法来源及适用范围 方法名称:多管发酵法 方法来源:水质粪大肠菌群的测定多管发酵法和滤膜法(试行)(HJ/T 347─ 2007) 方法适用范围:此法适用于地表水、地下水及废水中粪大肠菌群的测定。 2.2仪器 高压蒸汽灭菌器
电热干燥箱 恒温培养箱 冰箱 采样瓶、三角烧瓶、试管、平皿(直径9cm)、刻度吸管等器皿121℃(20min)高压蒸汽灭菌后于电热干燥箱中烘干。 2.3 标准菌株制备 将标准菌株的母种或稳定工作种接种到单倍乳糖蛋白胨培养液中培养对照控制。必须包括大肠埃希氏菌、产气场杆菌和山夫登堡沙门氏菌三种对照。接种完后需记录:母种的来源,母种和工作种的保存方法、保存温度、传代间隔时间、生长培养基及孵育条件,确认试验(存活度、纯度、关键诊断指标等),母种到工作种的传代代数。 2.4培养基 2.4.1 单倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基,按铭牌配制,用定量加液器分装每个试管10ml,加塞,在115℃灭菌20min,贮存于暗处备用。 2.4.2 三倍乳糖蛋白胨培养液:市售乳糖蛋白胨培养基,按铭牌比例,三倍配制(蒸馏水除外),用定量加液器分装每个试管5ml或每个大试管50mL,加塞,在115℃灭菌20min,贮存于暗处备用。 2.4.3 EC培养液:市售EC培养基,按铭牌配制,在115℃灭菌20min,用定量加液器分装每个试管10ml,加塞,贮存于暗处备用。 2.4.4 培养基存放于带紫外灯的灭菌物品专用贮藏柜中,当培养基颜色变化,或体积明显变化时废弃不用。 2.5分析步骤 2.5.1 水样接种量 将水样充分混匀后,根据水样污染的程度确定水样接种量。每个样品至少用三个不同的水样量接种。同一接种水样量要有五管。相对未受污染的水样接种量为10mL、1mL、0.1mL。受污染水样接种量根据污染程度接种1mL、0.1mL、0.01mL 或0.1mL、0.01mL、0.001mL 等。使用的水样量可参考下表2。 表2 接种用水量参考表
食品中大肠菌群计数测定的标准操作规程
规范食品中大肠菌群计数测定的标准操作规程。 2范围 本标准规定了食品中大肠菌群(Coliforms)计数的方法。 本标准适用于食品中大肠菌群的计数。 3术语和定义 大肠菌群coliforms 在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。 最可能数most probable number,MPN 基于泊松分布的一种间接计数方法。 4责任 质量部组织制订、化验室负责实施。 5内容 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 恒温培养箱:36 ℃±1 ℃。 冰箱:2 ℃~5 ℃。 恒温水浴箱:46 ℃±1 ℃。 天平:感量 g。 均质器。 振荡器。 无菌吸管:1 mL(具 mL 刻度)、10 mL(具 mL 刻度)或微量移液器及吸头。无菌锥形瓶:容量500 mL。 无菌培养皿:直径90 mm。
pH 计或pH 比色管或精密pH 试纸。 菌落计数器。 培养基和试剂 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤:见附录A 中。煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤:见附录A 中。结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA):见附录A 中。 磷酸盐缓冲液:见附录A 中。 无菌生理盐水:见附录A 中。 无菌1 mol/L NaOH:见附录A 中。 无菌1 mol/L HCl:见附录A 中。 大肠菌群MPN 计数法 检验程序
大肠菌群MPN计数的检验程序见图1。 图1 大肠菌群MPN 计数法检验程序 操作步骤 样品的稀释 .1 固体和半固体样品:称取25 g 样品,放入盛有225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1 min~2 min,或放入盛有225 mL 磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1 min~2
口罩微生物检验操作规程
口罩微生物检验操作规程 1 目的 为了使口罩产品的微生物检验规范化,制定此操作规程,以保证最终产品质量。 2 范围 本程序适用于我司的口罩。 3 职责 质量部微生物实验员对此规范负责。 4 取样 4.1取样频次 在生产环境及各道生产工序未发生变化,每周对口罩的微生物检验进行一次抽样检测。 4.2取样采集 于同一批号的三个运输包装中至少抽取12个最小销售包装样品,1/4样品用于检测,1/4样品用于留样,另1/2样品(可就地封存)必要时用于复检。抽样的最小销售包装不应有破裂,检验前不得启开。 4.3样品处理 在100级净化条件下用无菌方法打开用于检测的至少3个包装,从每个包装中取样,准确称取10 g±1g样品,剪碎后加入到200 mL灭菌生理盐水中,充分混匀,得到一个生理盐水样液。 注:如被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释液量可按每次50mL递增,直到能吸出足够测试用样液。在计算细菌菌落总数与真菌菌落总数时应调整稀释度。 5 操作程序 5.1细菌菌落总数测试方法 本方法适用于产品细菌菌落总数(以下统称为细菌菌落总数)检测。 5.1.1 操作步骤 待上述生理盐水样液自然沉降后取上清液作菌落计数。共接种5个平皿,每个平皿中加入1 mL样液,然后用冷却至45℃左右的熔化的营养琼脂培养基15 ~20mL倒入每个平皿内混合均匀。待琼脂凝固后翻转平皿置35℃±2℃培养48h后,计算平板上的菌落数。 5.1.2 结果报告 菌落呈片状生长的平板不宜采用;计数符合要求的平板上的菌落,按式(1)计算结果:
)1....(51K A X ?= 式中:X 1――细菌菌落总数,cfu/g 或cfu/mL ; A――5块营养琼脂培养基平板上的细菌菌落总数; K――稀释度。 当菌落数在100以内,按实有数报告,大于100时采用二位有效数字。 如果样品菌落总数超过产品标准的规定,按5.1.3进行复检和结果报告。 5.1.3 复检方法 将留存的复检样品依前法复测2次,2次结果平均值都达到本标准的规定,则判定被检样品合格;其中有任何1次结果平均值超过本标准规定,则判定被检样品不合格。 5.2 大肠菌群检测方法 5.2.1 操作步骤 5.2.1.1取样液5mL 接种50mL 乳糖胆盐发酵管,置35℃±2℃ 培养24 h ,如不产酸也不产气,则报告 为大肠菌群阴性。 5.2.1.2如产酸产气,则划线接种伊红美蓝琼脂平板,置35℃±2℃培养18~24 h ,观察平板上菌落形 态。典型的大肠菌落为黑紫色或红紫色,圆形,边缘整齐,表面光滑湿润,常具有金属光泽,也有的呈紫黑色,不带或略带金属光泽,或粉红色,中心较深的菌落。 5.2.1.3取疑似大肠菌落1~2个作革兰氏染色镜检,同时接种乳糖发酵管,置35℃±2℃培养24 h ,观 察产气情况。 5.2.2 结果报告 凡乳糖胆盐发酵管产酸产气,乳糖发酵管产酸产气,在伊红美蓝平板上有典型大肠菌落,革兰氏染色为阴性无芽胞杆菌,可报告被检样品检出大肠杆菌。 5.3 绿脓杆菌检测方法 5.3.1 操作步骤 5.3.1.1取样液5 mL ,加入到50 mL SCDLP 培养液中,充分混匀,置35℃±2℃培养18~24 h 。 5.3.1.2如有绿脓杆菌生长,培养液表面呈现一层薄菌膜,培养液常呈黄绿色或蓝绿色。从培养液的薄 菌膜处挑取培养物,划线接种十六烷三甲基溴化铵琼脂平板,置35℃±2℃培养18~24 h ,观察菌落特征。绿脓杆菌在此培养基上生长良好,菌落扁平,边缘不整,菌落周围培养基略带粉红色,其他菌不长。 5.3.1.3取可疑菌落涂片作革兰氏染色,镜检为革兰氏阴性菌者应进行下列试验:
实验四 大肠菌群和粪大肠菌的检验
实验四大肠菌群和粪大肠菌的检验 一、实验目的要求 1、了解大肠菌群在食品卫生检验中的意义。 2、学习并掌握大肠菌群检验的原理和方法。 二、原理 大肠菌群系指一群能发酵乳糖,产酸产气,需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。一般认为该菌群细菌可包括:大肠埃希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,具有广泛的卫生学意义。它反映了食品是否被粪便污染,同时间接地指出食品是否有肠道致病菌污染的可能性。 食品中大肠菌群数系以每100g(或ml)检样内大肠菌群最近似数(the most probable number-简称MPN)表示。 三、试剂和仪器 (一)最先准备的器材 规格名称数量用途 1、500ml广口瓶 1个稀释样品 2、500ml三角瓶 2个制生理盐水 3、250ml三角瓶 1个制EMB琼脂 4、18×180mm试管 8支稀释及制双料乳糖胆盐发酵管 5、18×150mm试管20~25支单料乳糖胆盐发酵管、乳糖发酵管 6、13×130mm试管20支制蛋白胨水、EC肉汤 7、1ml移液管 5 支 8、10ml移液管 3 支 9、直径为90mm平皿12套制EMB平板 10、250ml量筒1支 (二)应灭菌消毒的器材 剪刀1把开瓶器不锈钢药匙1把滴管胶头4只称量纸适量 (三)应制备的培养基 培养基总量所用容器 1、0.85%NaCl生理盐水300ml 500ml三角瓶 2、乳糖胆盐发酵管 双料:10ml/支 5支 60ml 18×180mm试管(装有导管) 单料:10ml/ 8支 90ml 18×150mm试管(装有导管) 3、EMB琼脂: 1瓶 120ml 250ml三角瓶 4、乳糖发酵管: 3ml/支 5支20ml 13×130mm试管(装有导管) 5、EC肉汤: 3ml/支 6支20ml 13×130mm试管(装有导管)
菌落计数检测操作规程
1. 目的:规范菌落计数检测操作 2. 范围:适用于抗菌肽、沃土元活菌数检测 3. 职责:实验室人员对本操作规程的实施负责。 4. 内容: 4.1 系列稀释 待测液V 0取1ml加入9ml无菌水(或生理盐水)中,充分混匀,即成母液菌悬液V 1 (基 础液)。 用灭菌过移液枪头分别吸取1.0ml上述母液菌悬液,加入9ml无菌水(或生理盐水)中,安1→10进行系列稀释,分别得到1→1*101、1→1*102、1→1*103、1→1*104……稀释的菌悬液(每个稀释度应更换灭菌枪头)。 4.2 加样及培养 每个样品取3个连续适宜的稀释度,用无菌移液管分别吸取不同稀释度菌悬液V 2 =0.1ml,加至预先制备好的固定培养基平板上,分别用无菌玻璃珠将不同稀释度的菌悬液均匀地涂于琼脂表面。 每个稀释度重复3次,同时以无菌水(或生理盐水)作为空白对照,于28℃下培养24h。 4.3 菌落计数 以出现20个~300个菌落数的稀释度的平板为技术标准,分别统计有效活菌数目和杂菌数目。当只有一个稀释度,其平均菌落数在20个~300个之间时,则以该平均菌落数计算。若有两个稀释度,其平均菌落数均在20个~300个之间时,应按两者菌落总数之比值决定。若其比值小于等于2应计算两者的平均数;若大于2则以稀释度小的菌落平均数计算 4.4 计算公式 N v =xkV1 V0V2 ?10?8 式中: x——菌落平均数,单位为个; k——稀释倍数; V 1 ——基础液体积,单位为毫升(mL); V 2 ——菌悬液加入量,单位未毫升(mL); N v ——体积有效活菌数,单位为亿每毫升(亿/mL); V ——样品量,单位为毫升(mL) 5. 注意事项 5.1 注意无菌操作
水中大肠杆菌的检测方法
附件 水中大肠杆菌群检测方法-多管发酵法 NIEA E201.54B 一、方法概要 本方法系用以检测水中革兰氏染色阴性,不产生内生孢子之杆状好氧或兼性厌氧菌,且能在35 ± 1 ℃、 48 ± 3小时发酵乳糖并产生酸及气体之大肠杆菌群(Coliform group);在不同体积或不同稀释度之水样所 产生之结果,以「100 mL水中最大可能数(MPN/100 mL)」表示100 mL水中存在之大肠杆菌群数目。二、适用范围 本方法适用地面水体、地下水体、废水、污水及水源水质水样中大肠杆菌群之检验。 三、干扰 (一) 水样中含有抑制或促进大肠杆菌群细菌生长之物质。 (二) 检测使用的玻璃器皿及设备含有抑制或促进大肠杆菌群细菌生长的物质。 四、设备 (一) 量筒:100至1000 mL之量筒。 (二) 吸管:有0.1刻度之10 mL灭菌玻璃吸管或市售无菌塑料吸管,或无菌微量吸管(micropipet)。 (三) 试管:大小约150 × 15 mm之试管或有盖螺旋试管。 (四) 发酵管(fermentation tube):大小约22 × 9 mm之玻璃管。 (五) 稀释瓶:容量约100 mL可灭菌之硼硅玻璃制品。 (六) 锥形瓶:200至2000 mL之可灭菌硼硅玻璃制品。 (七) 采样容器:容量120 mL以上无菌之硼硅玻璃瓶或无菌塑料有盖容器,或市售无菌袋。 (八) 冰箱:温度能保持在4 ± 2℃者。 (九) 天平:待测物重量大于2 g时,须能精秤至0.01 g;待测物重量不大于2 g时,须能精秤至0.001 g。 (十) 培养箱:温度能保持在35 ± 1℃者。 (十一) 高压灭菌釜:温度能维持在121℃(压力约15 lb/in2或 1.1 Kg/cm2)灭菌15分钟以上者。
微生物检验操作规程
微生物检验操作规程 为规范检验程序,提高检验结果的准确性,要求微生物检验员严格按照本操作规程检验。 样品准备: 准确称取10g±1g样品,剪碎后加入到200ml已灭菌的生理盐水中,充分混匀,静置10分钟,待生理盐水样液自然沉降后取上清液作菌落计数,液体样品可用原液直接做样液。 如果被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释量可按每次50ml递增,直至能吸出足够测试用样液。在计算细菌菌落总数与真菌菌落总数时相应调整稀释度。 1.细菌菌落总数检测方法 1)仪器: 培养箱35℃±2℃、天平(精确至0.1g)、医用剪刀、吸球、移液管1ml、250ml锥形瓶、平皿、酒精灯。 2)试液: 0.9%生理盐水、营养琼脂。 3)步骤: 用已灭菌的1ml移液管移取1ml样液,均匀地洒在平皿上,共接种5个平皿。然后用冷却至45℃左右熔化的营养琼脂培养基15~20ml倒入每个平皿内混合均匀。待琼脂凝固后翻转平皿做好记号并置35℃±2℃培养48h后,计算平板上的菌落数。
结果计算:X1=A*K/5 式中:X1→细菌菌落总数,cfu/g或cfu/ml A→5块营养琼脂培养基平板上的细菌菌落总数 K→稀释度 4)如果样品菌落总数超过标准的规定,应进行复检。 将留存的复检样品依前法复测2次,2次结果平均值都达到标准规定,则判定被检样品合格,其中有任何1次结果平均值超过标准规定,则判定被检样品不合格。 2.真菌菌落总数检测方法 1)仪器: 培养箱25℃±2℃、天平(精确至0.1g)、医用剪刀、吸球、移液管1ml、250ml锥形瓶、平皿、酒精灯。 2)试液: 0.9%生理盐水、玫瑰红钠琼脂。 3)步骤: 用已灭菌的1ml移液管移取1ml样液,均匀地洒在平皿上,共接种5个平皿。然后用冷却至45℃左右熔化的玫瑰红钠琼脂培养基15~20ml 倒入每个平皿内混合均匀。待琼脂凝固后翻转平皿做好记号并置25℃±2℃培养7天,分别于3、5、7天观察,计算平板上的菌落数,如果发现菌落蔓延,以前一次的菌落计数为准。 结果计算:X2=B*K/5 式中:X2→真菌菌落总数,cfu/g或cfu/ml
国标法检测食品中大肠菌群2015技术文件(赛项规程)
2015年黑龙江省高职院校“食品类专业”(国标法检测食品中大肠菌群)学生技 能大赛赛项规程 二〇一五年九月
一、赛项名称 2015年黑龙江省高职院校“食品类专业”(国标法检测食品中大肠菌群)学生技能大赛。 二、参赛对象与比赛方式 (一)参赛对象 参赛选手为黑龙江省高职院校食品类专业的在校学生(三二连读与五年制高职应为4-5年级学生),年龄25周岁以下(1990年10月7日后出生);往届省级以上(含省级)本赛项获三等奖以上(含三等奖)的选手不能参加本次比赛。指导教师须是同校在职专任教师。 (二)比赛方式 本次竞赛中每个参赛队由1名参赛选手组成,每名选手独立完成现场操作比赛,每所学校可报1-2个参赛队,每名选手限1名指导教师,1名教师可同时指导2名选手。选手与指导教师的对应关系一旦确定,不得随意更改。 三、比赛时间与比赛地点 (一)比赛时间 2015年10月17日。 (二)比赛地点 黑龙江职业学院第二校区(黑龙江省哈尔滨市双城区迎宾路162号)。 四、竞赛内容与说明
1、竞赛内容 根据食品微生物检测的常规检测项目和社会关注热点,选择具有代表性的检测项目“国标法检测食品中大肠菌群”作为操作考核内容,在国标中有两种法—大肠菌群MPN计数法和大肠菌群平板计数法,根据本次大赛的指导思想和竞赛原则,同时考虑到竞赛项目的可操作性,本次大赛选择“大肠菌群MPN计数法”作为竞赛项目。检验程序及操作技术依照《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3-2010)进行考核评判。 本项目主要考察学生在食品微生物学检验实施过程中所涉及的样品稀释液的制备、样品的接种、无菌操作、发酵结果的判断及数据处理等环节的基本操作技能,以及在整个实验过程中的操作文明和操作安全意识。 竞赛内容具体分为两个环节,第一环节为初发酵试验,主要包括采样、制备样品稀释液、样液接种;第二环节为复发酵试验,包括初发酵结果观察判断、转接种、复发酵结果观察、出具检验报告。 2、竞赛说明 本赛项由一名选手独立完成整个操作过程,并要求参赛选手在0.5个小时内完成初发酵试验(15分种)和复发酵试验(15分钟)的各步操作内容,如超时,将按超出时间的长短酌情扣分。另外参赛选手还应明确一点,竞赛过程中用到的初发酵管、初发酵结
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数 实验目的 实验原理:国标法操作的原理 实验器材: 培养箱,10只移液管,1只250ml锥形瓶,5只大试管,试管架,4个平皿,500ml 大烧杯1个,电子天平,纱布,脱脂棉,灭菌锅,PH计或PH试纸,100ml量筒,橡皮手套,超净台 实验药品: 磷酸盐缓冲液,蒸馏水,LB培养基,琼脂,5%NaOH,5%HCl 实验步骤: 一: 10只移液管,1只250ml锥形瓶,5只大试管,4个平皿,500ml大烧杯1个,100ml量筒进行洗涤,然后一起放入高压蒸汽灭菌锅中在121摄氏度条件下灭菌20min。灭完菌后烘干,完成后放入超净台中。 用酒精擦拭超净台,紫外消毒30min 二: 1:用电子天平称取成品LB 3.1241g和琼脂1.8756g放入250ml的洁净锥形瓶中。 2:用量筒量取125ml的蒸馏水加入该锥形瓶中,制成培养基。 3:用棉花堵住该锥形瓶的瓶口,用牛皮纸包住瓶口,用橡皮筋扎牢,再将培养基放入灭菌锅中在121摄氏度之下灭菌20min。 4:灭完菌后放入超净台中备用。 三: 1:取1只无菌250ml锥形瓶,用量筒向其中加入49ml PBS 2:将1ml样品加入到该锥形瓶中,摇匀制成1:50的细菌溶液。 3:取4只试管,编号1—4 4:用无菌移液管分别向4只试管中加入9ml的PBS 5:用1ml无菌移液管从样品中移取1ml菌液加入到1中.震荡试管使菌液均匀。 6:用1ml无菌移液管从1号试管中移取1ml的细菌溶液加入2号试管中,摇匀 7:用另一只1ml无菌移液管从2号试管中移取1ml细菌溶液,加入3中,摇匀......以此类推直至4只试管中均加入了细菌溶液。 9:取4只平皿,编号1—4 10:分别用4只无菌移液管从这4只试管中移取1ml的菌液置于4只平皿中,加入45—50摄氏度温度下的培养基,约15mm厚度。缓慢旋转平皿使菌液与培养基混合均匀;待培养基冷凝后倒置。 11:将培养基在36摄氏度条件下培养12小时。 12:取出培养皿,选择细菌个数在30至300个之间的平皿数细菌的个数。 四:实验结果(记得在操作过程和得到结果时拍照) 1号,2号菌落个数多不可计,舍弃 4号平皿中菌落数目小于10 cfu ,舍弃 3号平皿中菌落分布较均匀,数3号中的菌落数,一共有210个cfu 。 计算样品中细菌浓度为:1.05× 105 Cfu/ml
