大肠菌群检测原始记录
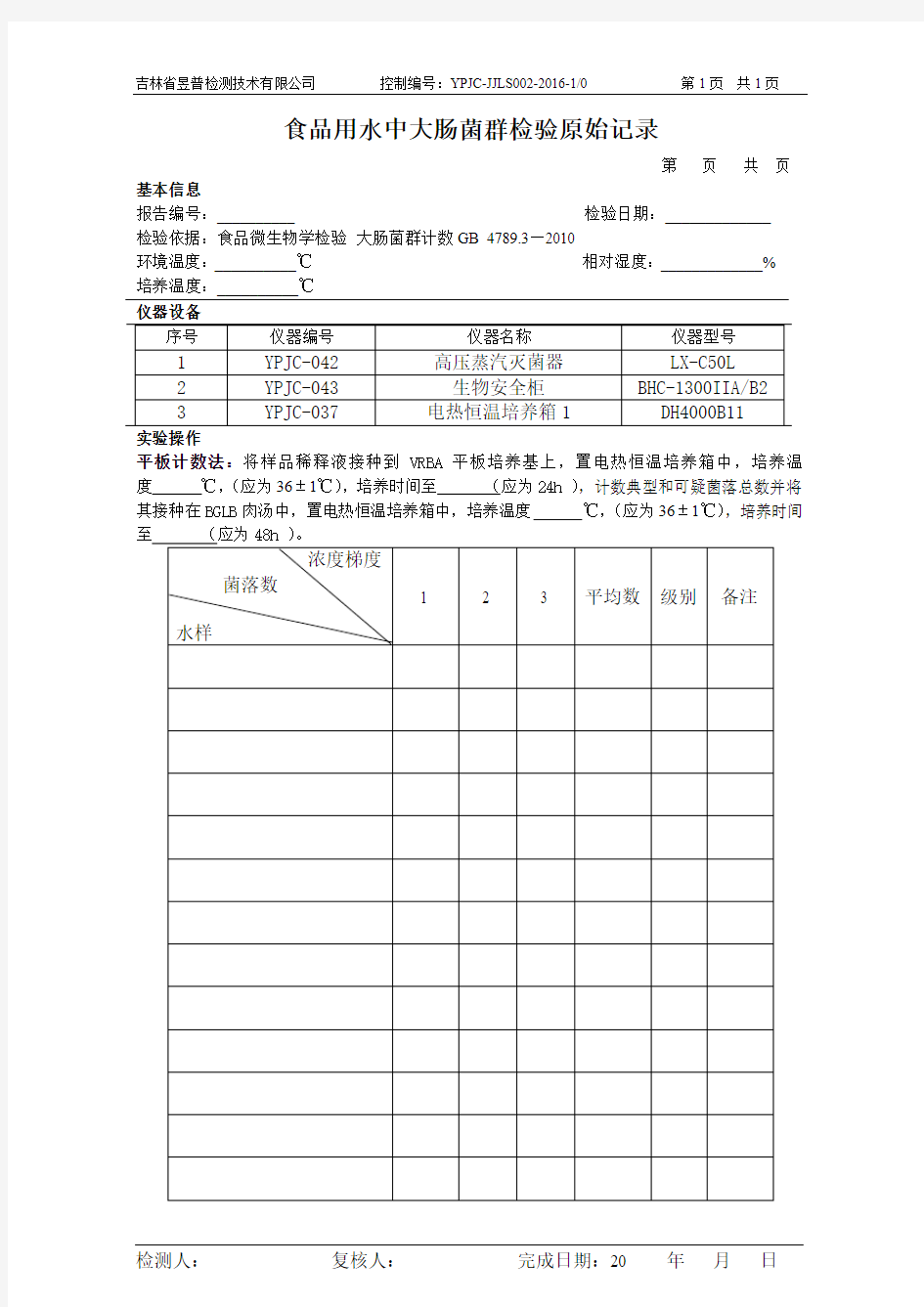
吉林省昱普检测技术有限公司控制编号:YPJC-JJLS002-2016-1/0 第1页共1页
食品用水中大肠菌群检验原始记录
第页共页基本信息
报告编号:__________ 检验日期:_____________
检验依据:食品微生物学检验大肠菌群计数GB 4789.3—2010
环境温度:__________℃相对湿度:_____________%
培养温度:__________℃
实验操作
平板计数法:将样品稀释液接种到VRBA平板培养基上,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间至(应为24h ),计数典型和可疑菌落总数并将其接种在BGLB肉汤中,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间
检测人:复核人:完成日期:20 年月日
大肠菌群测定方法
大肠菌群及检验 一、大肠菌群介绍 大肠菌群并非细菌学分类命名,而是卫生细菌领域的用语,它不代表某一个或某一属细菌,而指的是具有某些特性的一组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致,其定义为:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。一般认为该菌群细菌可包括大肠埃希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。大肠菌群分布较广,在温血动物粪便和自然界广泛存在。调查研究表明,大肠菌群细菌多存在于温血动物粪便、人类经常活动的场所以及有粪便污染的地方,人、畜粪便对外界环境的污染是大肠菌群在自然界存在的主要原因。粪便中多以典型大肠杆菌为主,而外界环境中则以大肠菌群其他型别较多。大肠菌群是作为粪便污染指标菌提出来的,主要是以该菌群的检出情况来表示食品中有否粪便污染。大肠菌群数的高低,表明了粪便污染的程度,也反映了对人体健康危害性的大小。粪便是人类肠道排泄物,其中有健康人粪便,也有肠道患者或带菌者的粪便,所以粪便内除一般正常细菌外,同时也会有一些肠道致病菌存在(如沙门氏菌、志贺氏菌等),因而食品中有粪便污染,则可以推测该食品中存在着肠道致病菌污染的可能性,潜伏着食物中毒和流行病的威胁,必须看作对人体健康具有潜在的危险性。大肠菌群是评价食品卫生质量的重要指标之一,目前已被国内外广泛应用于食品卫生工
作中。 二、大肠菌群检验方法:由于大肠菌群指的是具有某些特性的一组与粪便污染有关的细菌,即:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。因此大肠菌群的检测一般都是按照它的定义进行。目前国内采用的进出口食品大肠菌群检测方法主要有国家标准和原国家商检局制订的行业标准。两个标准方法在检测程序上略有不同。 (一)国家标准:国家标准采用三步法,即:乳糖发酵试验、分离培养和证实试验。乳糖发酵试验:样品稀释后,选择三个稀释度,每个稀释度接种三管乳糖胆盐发酵管。36±1℃培养48±2h,观察是否产气。分离培养:将产气发酵管培养物转种于伊红美蓝琼脂平板上,36±1℃培养18-24h,观察菌落形态。证实试验:挑取平板上的可疑菌落,进行革兰氏染色观察。同时接种乳糖发酵管36±1℃培养24±2h,观察产气情况。报告:根据证实为大肠杆菌阳性的管数,查MPN表,报告每100ml(g)大肠菌群的MPN值。 具体操作参见GB4789.3-94 《中华人民共和国国家标准食品卫生微生物学检验大肠菌群测定》 (二)原国家商检局制订的行业标准,等效采用美国FDA的标准方法,用于对出口食品中的大肠杆菌进行检测。本方法采用两步法:推测试验:样品稀释后,选择三个稀释度,每个稀释度接种三管LST肉汤。36±1℃培养48±2h,观察是否产气。证
环境监测原始记录表
环境监测原始记录表 环境保护监测中心站 2012年
目录 1. 地表水采样原始记录表19.离子选择电极原始记录表 2. 大气采样原始记录表20.分光光度法分析原始记录表 3. 降水采样原始记录表21.原子吸收分光光度法分析原始记录表 4. 降尘采样原始记录表22.气相色谱分析原始记录表 5. 土壤采样原始记录表23.离子色谱分析原始记录表 6. 底质(底泥、沉积物)采样原始记录表24.细菌总数测定原始记录表 7. 污染源废水采样原始记录表25.粪大肠菌群测定原始记录表 8. 固定污染源排气中气态污染物采样原始记录表26.区域环境噪声监测原始记录表 9. 固定污染源排气中颗粒物采样原始记录表27.城市交通噪声监测原始记录表 10.烟气烟色监测现场记录表28.污染源噪声监测原始记录表 11.pH值分析原始记录表29.机动车排气路检原始记录表 12.电导率分析原始记录表30.一般试剂配制原始记录表 13.色度分析原始记录表(铂钴比色法)31.校准曲线配制原始记录表 14.色度分析原始记录表(稀释倍数法)32.标准溶液配制与标定原始记录表 15.重量分析原始记录表33.样品交接记录表 16.容量法分析原始记录表34.样品分析任务表 17.五日生化需氧量分析原始记录表35.样品前处理原始记录表 18.一氧化碳分析原始记录表36.大气采样器流量校准原始记录表
xx 省环境监测原始记录表( 1 ) 地表水采样原始记录表 采样目的: 方法依据:GB12998-91 采样日期: 年 月 日 枯 丰 平 pH 计型号及编号: DO 仪型号及编号: 电导仪型号及编号: 采样: 送样: 接样: .第 页 共 页
总大肠菌群数量测定
总大肠菌群 在饮用水的微生物安全监测中,普遍采用正常的肠道细菌作为粪便污染指标,而不是直接测定肠道致病菌。 总大肠菌群系指一群需氧及兼性厌氧的,在37℃生长时能使乳糖发酵,在24h内产酸产气的革氏阴性无芽胞杆菌。总大肠菌群系指每升水样中所含有的总大肠菌群的数目。 总大肠菌群可用多管发酵法或滤膜法检验。 一多管发酵法 1应用范围 1.1本法适用于饮用水、水源水,特别是浑浊度含量高的水质中总大肠菌群的测定。 1.2水样中总大肠菌群数的含量,表明水被粪便污染程度,而且间接地表明有肠道致病菌存在。 2原理 根据总大肠菌群应具有的生物特性, 产气,能在选择性培养基上产生典型菌落。 3仪器 3.1显微镜 3.2革兰氏染色用有关器材。 3.3高压蒸汽灭菌器。 3.4干热灭菌箱。 3.5恒温箱。
3.6冰箱。 3.7放大镜。 3.8试管、平皿(直径 4培养基 4.1乳糖蛋白胨培养液 4.1.1成分 蛋白胨10g 牛肉膏3g 乳糖5g 氯化钠5g 1.6%溴甲酚紫乙醇溶液 蒸馏水1000ml 4.1.2制法 将蛋白胨、牛肉膏、 1.6%溴甲酚紫乙醇溶液, 灭菌20min,贮存于冷暗处备用。 4.2三倍浓缩乳糖蛋白胨培养液 按上述乳糖蛋白胨培养液浓缩三倍配制。4.3品红亚硫酸钠培养基(供多管发酵法用)4.3.1成分 蛋白胨10g
乳糖10g 磷酸氢二钾3.5g 琼脂15~30g 蒸馏水1000ml 无水亚硫酸钠5g左右 5%碱性品红乙醇溶液 4.3.2储备培养基的制备如革兰氏阴性无芽胞杆菌, 9cm)、刻度吸管等,置于干热灭菌箱中 1ml 1000ml蒸馏水中加热溶解, 充分混匀,分装于装有倒管的试管中,在37℃24h内能发酵乳糖并产酸160℃灭菌2h 调整pH为7.2~7.4,再加入1ml置高压蒸汽灭菌器中,以115℃乳糖及氯化钠置于 20ml 先将琼脂加至900蒸馏水中,加热溶解,然后加入磷酸氢二钾及蛋白胨,混匀使之溶解,再以蒸馏水补足至1000ml,调整PH值为7.2~7.4,趁热用脱脂棉或绒布过滤,再加入乳糖,混匀后定量分装于烧瓶内,置高压蒸汽灭菌中以115℃灭菌20min,贮存于冷暗处备用。 4.3.3平皿培养基的配制 将上法制备的储备培养基加热融化,根据烧瓶内培养基的容量,用灭菌吸管按比例吸取一定量的5%碱性品红乙醇溶液,置于灭菌空试管中。再按比例称取所需的无水亚硫酸钠置于另一个灭菌空试管内,加灭菌水少许使其溶解后,置于沸水浴中煮沸10min以灭菌。
大肠菌群检测方法
大肠菌群检测方法 进入无菌室步骤 1.进入无菌室前应打开紫光灯进行灭菌,时间为0。5—1小时。 2.关灯后0?5小时后放可进入。 3.进入更衣间更换衣服,佩带口罩、帽子、鞋套 实验步骤 1,进入无菌室后,先把酒精灯点燃,然后在用酒精棉进行手部消毒。(酒精棉是用75%的酒精加入脱脂棉中制成) 2,准备双料管3根,单料管6根,培养皿7个。 3,直接从原液中吸取10ml放入双料管,(3根每根各10ml) 4,再吸取原液1ml放入单料管中(3根每根各1ml) 5,再吸取原液1ml放入培养皿中(2个培养皿各1ml) 6,再吸取原液1ml放入盐水管中制成-1梯度的样液 7,更换一根吸管,从-1梯度的样液吸取1ml样液放入单料管中(3根每根各1ml) 8,再吸取-1梯度样液1ml放入培养皿中(2个培养皿各1ml) 9,再把每个培养皿中到入营养琼脂平铺底部摇允(注另作3个培养皿:空气空白,把培养皿打开十分钟倒入营养琼脂平铺底部摇匀。琼脂空白,把培养皿中倒入营养琼脂平铺底部摇匀。盐水空白,吸1ml生理盐水放入培养皿中,倒入营养琼脂平铺底部摇匀。) 10,把全部作好的放入培养箱中,温度36C+-1×C,大肠24H+-2H,菌落48H+-2H,(待培养皿中的琼脂凝固后反转过来放入培养箱中) 11,梯度:-1梯度为1ml原液加入9ml生理盐水配成 -2梯度为1ml-1梯度样液加入9ml生理盐水配成 -3梯度-4梯度配制方法和-1、-2梯度的配制方法一样 12,如果大肠初发酵产生气泡,用接种笔沾一个产气的液在伊红美兰平板上画之字形然后放入培养箱中36C,24H+-2H 。(接种笔在每次使用前必须在酒精灯上消毒。所画之形不能划破伊红美兰琼脂表面) 13,取出后在用接种笔在伊红美兰平板之字形上挑菌,放入乳糖复发酵管中,然后再培养36C+-1C,24H++-2H。 14,再在伊红美兰平板之字形上挑菌,放到载玻片上作镜检。(方法见标准) 15,只有镜检成紫红色和乳糖复发酵管产气同时成立的情况下,才能断定这根管是不合格。16,清洗消毒这根试管前必须进行消毒霉菌,121C,0。5小时同时不能放气。
食品中大肠菌群的测定附mpn检索表)
实验六食品中大肠菌群的测定一、概述 (一)大肠菌群的定义及范围 根据国家1994年颁布的食品卫生检验方法微生物学部分,大肠菌群(coliform bacteria)系指一群在37℃、24h能发酵乳糖,产酸、产气,需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。 大肠菌群主要是由肠杆菌科中四个菌属内的一些细菌所组成,即艾希氏菌届、拘橼酸杆菌属、克雷伯氏菌属及肠杆菌属,其生化特性分类见表5-4。 表5-4 大肠菌群生化特性分类表
注:+,表示阳性;—,表示阴性;+/-,表示多数阳性,少数阴性。 由上表可以看出,大肠菌群中大肠艾希氏菌I型和Ⅲ型的特点是,对靛基质、甲基红、v-P和拘橼酸盐利用四个生化反应分别为“十十一一”,通常称为典型大肠杆菌;而其他类大肠杆菌则披称为非典型大肠杆菌。 (二)大肠菌群的测定意义 1、粪便污染的指标细菌 早在1892年,沙尔丁格(Schardinger)氏首先提出大肠杆菌作为水源中病原菌污染的指标菌的意见,因为大肠杆菌是存在于人和动物的肠道内的常见细菌。一年后,塞乌博耳德“斯密斯(Theobold.Smith)氏指出,大肠杆菌因普遍存在于肠道内,若在肠道以外的环境中发现,就可以认为这是由于人或动物的粪便污染造成的;从此,就开始应用大肠杆菌作为水源中粪便污染的指标菌。 据研究发现,成人粪便中的大肠菌群的含量为:108个/g一109个/g。若水中或食品中发现有大肠菌群,即可证实已被粪便污染,有粪便污染也就有可能有肠道病原菌存在。根据这个理由,就可以认为这种含有大肠菌群的水或食品供食用是不安全的。所以目前为评定食品的卫生质量而进行检验时,也都采用大肠菌群或大肠杆菌作为粪便污染的指标细菌。当然,有粪便污染,不一定就有肠道病原菌存在,但即使无病原菌,只要被粪便污染的水或食品,也是不卫生的,不受人喜欢的。 2.粪便污染指标菌的选择 作为理想的粪便污染的指标菌应具备以下几个特性,才能起到比较正确
食品中大肠菌群的测定(附MPN检索表)
实验六食品中大肠菌群的测定 一、概述 (一)大肠菌群的定义及范围 根据国家1994年颁布的食品卫生检验方法微生物学部分,大肠菌群(coliform bacteria)系指一群在37℃、24h能发酵乳糖,产酸、产气,需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。 大肠菌群主要是由肠杆菌科中四个菌属内的一些细菌所组成,即艾希氏菌届、拘橼酸杆菌属、克雷伯氏菌属及肠杆菌属,其生化特性分类见表5-4。 表5-4 大肠菌群生化特性分类表 由上表可以看出,大肠菌群中大肠艾希氏菌I型和Ⅲ型的特点是,对靛基质、甲基红、v-P和拘橼酸盐利用四个生化反应分别为“十十一一”,通常称为典型大肠杆菌;而其他类大肠杆菌则披称为非典型大肠杆菌。 (二)大肠菌群的测定意义 1、粪便污染的指标细菌 早在1892年,沙尔丁格(Schardinger)氏首先提出大肠杆菌作为水源中病原菌污染的指标菌的意见,因为大肠杆菌是存在于人和动物的肠道内的常见细菌。一年后,塞乌博耳德“斯密斯(Theobold.Smith)氏指出,大肠杆菌因普遍存在于肠道内,若在肠道以外的环境中发现,就可以认为这是由于人或动物的粪便污染造成的;从此,就开始应用大肠杆菌作为水源中粪便污染的指标菌。 据研究发现,成人粪便中的大肠菌群的含量为:108个/g一109个/g。若水中或食品中发现有大肠菌群,即可证实已被粪便污染,有粪便污染也就有可能有肠道病原菌存在。根据这个理由,就可以认为这种含有大肠菌群的水或食品供食用是不安全的。所以目前为评定
食品的卫生质量而进行检验时,也都采用大肠菌群或大肠杆菌作为粪便污染的指标细菌。当然,有粪便污染,不一定就有肠道病原菌存在,但即使无病原菌,只要被粪便污染的水或食品,也是不卫生的,不受人喜欢的。 2.粪便污染指标菌的选择 作为理想的粪便污染的指标菌应具备以下几个特性,才能起到比较正确的指标作用。 ①存在于肠道内持有的细菌,才能显示出指标的特异性。 ⑧在肠道内占有极高的数量,即使被高度稀释后,也能被检出。 ⑧在肠道以外的环境中,其抵抗力大于肠道致病菌或相似,进入水中不再繁殖。 ④检验方法简便,易于检出和计数。 在食品卫生微生物检验中,可作为粪便污染指标菌依据的上述条件,粪便中数量最多的是大肠菌群,而且大肠菌群随粪便排出体外后,其存活时间与肠道主要致病菌大致相似,在检验方法上,也以大肠菌群的检验计数简便易行。因此,我国选用大肠菌群作为粪便污染指标菌是比较适宜的。 另外,作为粪便污染的指标细菌还有:分叉杆菌(Bifidobacterium)、拟杆菌(Bacteroides)、乳酸菌、肠杆菌科中的梭状芽胞和底群链球菌等,据报道,拟杆菌是人体肠道内第二个较大的菌群;厌气性乳酸菌占人体肠道内细菌组分的50%以上,一般粪便中该菌量为109个/g —1010个/g。肠道内属于肠杆菌科的细菌,除上述的细菌外,还有克雷伯氏菌属(Klebsiella)、变形杆菌和副大肠杆菌等,也可以充当粪便污染指标菌。很多研究者认为,在冷踪食品或冷冻状态照射处理过的食品中,大肠杆菌可比其他多种病原菌容易死亡,因此,像这类食品,用大肠菌群作为指标菌就不够理想,而底群链球菌对低温抵抗力强,作为这类食品的粪便污染指标菌就比较适宜。上述的这些肠道内的其他细菌,虽与粪便有关,因均比不上大肠菌群所具备的指标特异性,所以目前还没有列入作为公认的粪便污染的指标细菌。 当然,大肠菌群作为粪便污染指标菌也有一些不足之处: ①饮用水中含有较少量大肠菌群的情况下,有时仍能引起肠道传染病的流行。 ⑧大肠菌群在一定条件下能在水中生长繁殖。 ②在外界环境中,有的沙门氏菌比大肠菌群更有耐受力。 3.大肠菌群作为粪便污染指标菌的意义 粪便污染的食品,往往是肠道传染病发生的主要原因,因此检查食品中有无肠道菌,这对控制肠道传染病的发生和流行,具有十分重要的意义。 许多研究者的调查证明,人、畜粪便对外界环境的污染是大肠菌群在自然界存在的主
RBT214-2017版检验检测机构内审全套资料(含检查表)
2018年*** 月内部审核计划 受控编号:****************** 共页第页
内部审核实施计划表 受控编号:********* 共2页第1页 ********质量检测有限公司 *****(****)第****号 实验室各科室: 根据《检验检测机构资质认定能力评价检验检测机构通用要求》(RBT 214-2017)和本实验室质量体系计划的安排,拟于2018年***月***日至***日进行2018年度****月份内部质量体系审核。现将内审实施计划发给你们,请按照计划表内容结合质量手册、程序文件、记录、报告等体系资料做好准备,迎接内审。 审核目的:审核2018年本公司的检验检测活动是否符合本公司质量管理体系的要求,确保质量体系持续、有效的运行,并为质量体系的改进提供依据。 审核要求:采用集中式审核,要求实事求是、不徇私舞弊、做到严格、公正、客观。 审核范围:检验检测机构资质认定评审准则各要素涉及的实验室各部门。 审核依据:《检验检测机构资质认定能力评价检验检测机构通用要求》(RBT 214-2017),质量体系文件【例如:《质量手册》、《程序文件》】,相关法律、法规和试验标准等。 审核时间:2018年****月****日至***日 审核组:组长:**** 审核组成员:*****(技术负责人、*****)、*****(检测一室主任、内审员、监督员)、*****(检测二室主任、内审员、监督员)、****(业务室主任、内审员)、******(内审员)。
首、末次会议参加人员:质量负责人、技术负责人、各科室负责人、办公室成员、设备管理员、内审组成员。
大肠菌群测定的操作细则
大肠菌群测定的操作细则 大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。该菌主要来于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。 食品中大肠菌群数系以100mL(g)检样内大肠菌群最可能数(MPN)表示。 1 设备和材料 1.1 温箱:36±1℃。 1.2 冰箱:0~4℃。 1.3 恒温水浴:44.5±0.5℃。 1.4 天平。 1.5 显微镜。 1.6 均质器或乳钵。 1.7 平皿:直径为90mm。 1.8 试管。 1.9 吸管。 1.10 广口瓶或三角烧瓶:容量为500mL。 1.11 玻璃珠:直径约5mm。 1.12 载玻片。 1.13 酒精灯。 1.14 试管架。 2 培养基和试剂 2.1 乳糖胆盐发酵管:按GB 4789.28中4.9规定。 2.2 伊红美蓝琼脂平板:按GB 4789.28中4.25规定。 2.3 乳糖发酵管:按GB 4789.28中4.10规定。 2.4 EC 肉汤:按GB 4789.28中4.11规定。 2.5 磷酸盐缓冲稀释液:按GB 4789.28中 3.22规定。 2.6 生理盐水。 2.7 革兰氏染色液:按GB 4789.28中2.2规定。 3 操作步骤 3.1 检样稀释 3.1.1 以无菌操作将检样25mL(或g)放于有225mL灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内予置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做成1:10的均匀稀释液。固体检样最好用均质器,以8 000-10 000 r/min的速度处理1min,做成1:10的均匀稀释液。3.1.2 用1mL灭菌吸管吸取1:10稀释液1mL,注入含有9mL灭菌生理盐水或其他稀释液的试管内,振摇试管混匀,做成1:100的稀释液。 3.1.3 另取1mL灭菌吸管,按上条操作依次做10倍递增稀释液,每递增稀释一次,换用1支1mL 灭菌吸管。 3.1.4 根据食品卫生标准要求或对检样污染情况的估计,选择三个稀释度,每个稀释度,接种3管。 3.2 乳糖发酵试验 将待检样品接种于乳糖胆盐发酵管内,接种量在1mL以上者,用双料乳糖胆盐发酵管,1mL及1mL以下者,用单料乳糖胆盐发酵管。每一稀释度接种3管,置36±1℃温箱内,培养24±2h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数 实验目的 实验原理:国标法操作的原理 实验器材: 培养箱,10只移液管,1只250ml锥形瓶,5只大试管,试管架,4个平皿,500ml 大烧杯1个,电子天平,纱布,脱脂棉,灭菌锅,PH计或PH试纸,100ml量筒,橡皮手套,超净台 实验药品: 磷酸盐缓冲液,蒸馏水,LB培养基,琼脂,5%NaOH,5%HCl 实验步骤: 一: 10只移液管,1只250ml锥形瓶,5只大试管,4个平皿,500ml大烧杯1个,100ml量筒进行洗涤,然后一起放入高压蒸汽灭菌锅中在121摄氏度条件下灭菌20min。灭完菌后烘干,完成后放入超净台中。 用酒精擦拭超净台,紫外消毒30min 二: 1:用电子天平称取成品LB 3.1241g和琼脂1.8756g放入250ml的洁净锥形瓶中。 2:用量筒量取125ml的蒸馏水加入该锥形瓶中,制成培养基。 3:用棉花堵住该锥形瓶的瓶口,用牛皮纸包住瓶口,用橡皮筋扎牢,再将培养基放入灭菌锅中在121摄氏度之下灭菌20min。 4:灭完菌后放入超净台中备用。 三: 1:取1只无菌250ml锥形瓶,用量筒向其中加入49ml PBS 2:将1ml样品加入到该锥形瓶中,摇匀制成1:50的细菌溶液。 3:取4只试管,编号1—4 4:用无菌移液管分别向4只试管中加入9ml的PBS 5:用1ml无菌移液管从样品中移取1ml菌液加入到1中.震荡试管使菌液均匀。 6:用1ml无菌移液管从1号试管中移取1ml的细菌溶液加入2号试管中,摇匀 7:用另一只1ml无菌移液管从2号试管中移取1ml细菌溶液,加入3中,摇匀......以此类推直至4只试管中均加入了细菌溶液。 9:取4只平皿,编号1—4 10:分别用4只无菌移液管从这4只试管中移取1ml的菌液置于4只平皿中,加入45—50摄氏度温度下的培养基,约15mm厚度。缓慢旋转平皿使菌液与培养基混合均匀;待培养基冷凝后倒置。 11:将培养基在36摄氏度条件下培养12小时。 12:取出培养皿,选择细菌个数在30至300个之间的平皿数细菌的个数。 四:实验结果(记得在操作过程和得到结果时拍照) 1号,2号菌落个数多不可计,舍弃 4号平皿中菌落数目小于10 cfu ,舍弃 3号平皿中菌落分布较均匀,数3号中的菌落数,一共有210个cfu 。 计算样品中细菌浓度为:1.05× 105 Cfu/ml
水中大肠菌群的测定上课讲义
水中大肠菌群的测定
水中大肠菌群的测定 报告题目水中大肠菌群的测定作者姓名 班级生科1104班 指导教师 完成时间2013年6月 生物学实验教学中心
目录 引言 (2) 1 实验材料 (2) 2 实验步骤 (2) 2.1 (3) 2.2 (4) 2.3 (4) 2.4 (5) 2.5数据分析与结果处理 ...................................... 错误!未定义书签。 3 结果与分析 (5) 3.1图片.................................................................. 错误!未定义书签。 3.2........................................................................... 错误!未定义书签。总结 .. (6) 参考文献 (10)
水中大肠菌群的测定 (指导老师:) (湖北师范学院生命科学学院生物技术1104班湖北黄石 435002) 摘要:测定青山湖水中的大肠菌群的含量。将待测水分别稀释10倍、100倍、1000倍3种梯度在三倍浓缩培养基 37℃培养24h后挑选出产酸或产气的 菌画线接种到伊红美蓝平板中37℃培养24h,将培养基中表现为阳性的菌 落做革兰氏染色镜检为阴性的菌种接种到乳糖蛋白胨培养基中37℃培养 24h,挑选大肠杆菌阳性菌。结果稀释10倍的水有3管大肠杆菌阳性菌, 稀释100倍的水有3管,稀释1000倍的有2管,即青山湖水中大肠杆菌 的含量为MPN=11000. 关键词:大肠杆菌、多管发酵法青山湖水
大肠杆菌的测定
水中总大肠杆菌的测定 来源:加入时间:2010-3-30 12:15:51 1 原理 总大肠杆菌群可用多管发酵法或滤膜法检测。多管发酵法的原理是根据大肠菌群细菌能发酵乳糖,产酸产气以及具备革兰氏染色阴性,无芽孢,呈杆状等有关特性,通过三个步骤进行检验,求得水样中的总大肠菌群数,实验结果以最可能数(most probable number),简称MPN表示。 2仪器 2.1 高压蒸汽灭菌器。 2.2 恒温培养箱,冰箱。 2.3 生物显微镜,载玻片。 2.4 酒精灯,镍铬丝接种棒。 2.5 培养皿(直径100mm),试管(5×150mm),小倒管,吸管(1,5,10ml),烧杯(200,500,2000ml),锥形瓶(500,1000ml),采样瓶。 3 培养基及染色剂的制备 3.1 乳糖蛋白胨培养液: 将10g蛋白胨、3g牛肉浸膏、3g乳糖和5g氯化钠加热溶于1000mL蒸馏水中,调节pH为7.2-7.4,再加入1.6%溴甲酚紫乙醇溶液1mL,充分混匀,分装于试管(内有倒管)中,于121℃高压灭菌器中灭菌15min,贮存于冷暗处备用。 3.2 三倍浓缩蛋白胨溶液: 按上述乳糖蛋白胨培养液的制备方法制备。除蒸馏水外,各组分用量增加至三倍。 3.3 品红亚硫酸钠培养基 3.3.1 贮备培养基的制备 于2000mL烧杯中,先将20-30g琼脂加到900mL蒸馏水中,加热溶解,然后加入3.5g磷酸氢二钾及10g蛋白胨,混匀,使其溶解,再用蒸馏水补充到1000mL调节溶液pH至7.2-7.4。趁热用脱脂棉或绒布过滤,再加10g乳糖,混匀,定量分装于250或500mL锥形瓶内,置于高压灭菌器中,在121℃灭菌15min,贮存与冷暗处备用。 3.3.2 平皿培养基的制备 将上法制备的贮备培养基加热融化。根据锥形瓶内培养基的容量,用灭菌吸管按1:50比例吸取5%碱性品红乙醇溶液,置于灭菌空试管中;再按1:200比例称取无水亚硫酸钠,置于另一灭菌空试管内,加灭菌水少许使其溶解,再置于沸水浴中煮沸10min(灭菌)。用灭菌吸管吸取已灭菌的亚硫酸钠溶液,滴加于碱性品红乙醇溶液内至深红色再褪至淡红色为止(不宜加多)。将此混合液全部加入已融化的贮备培
大肠菌群检测方法(中文翻译)
大肠菌群检测方法(中文翻译)
3 定义和简介 3.1 定义 所有的大肠菌群均是发酵乳糖,革兰氏阴性,无牙孢的杆菌。官方的对大肠菌群的定义可能以培养温度(30、32、35、37)不同作评价;或以确定是否发酵乳糖产气作为定义的一个特征.大多数ISO和其他官方标准是利用发酵乳糖产气作为一个定义特征。而在ISO 4832 中则利用了在VRBL上的菌落大小作为其唯一的定义特征。 鉴于这些定义的不同,建议实验室根据相关定义用相应的适当方法。 ●国际标准:样品分析是否符合国际交易规范 ●官方主市场调整定义:样品分析是否符合地方标准 ●一般定义:样品分析是否符合一般规范。 任何必要方法的调改必须通过市场实验室质量确认中心和雀巢研究中心食品安全微生物组的协助。 以下为一些官方定义例子: *ISO 4831大肠菌群是通过其在选择性肉汤上的生长和发酵乳糖产气能力来定义*AOAC INTERNATIONAL, APHA/FDA定义大肠菌是指发酵乳糖产酸产气(T=32或35度)革兰氏阴性杆菌 *ISO 4832大肠菌群定义是根据其在VRBL-agar(30or35or37度)的菌落大小(最小5mm直径)和产酸情况。(T=30或35或37℃) 3.1.1 液体培养基中 ISO 4831 大肠菌群是根据其在选择性肉汤中生长能力和发酵乳糖产气情况来定义.(T=30或35或37℃) AOAC INTERMATIONAL,APHA/FA中大肠菌群是指发酵乳糖产酸产气革兰氏阴性杆菌。(T=32或35℃) 由LI第一章概述,大肠菌群是指发酵乳糖气微生物群。 3.1.2 固体培养基中 IOS 4832大肠菌群定义是根据其在VRBL-agar(30or35or37度)的菌落大小(最小5mm直径)和产酸情况。(T=30或35或37℃) AOAC INTERMATIONAL,APHA/FA中大肠菌群是指发酵乳糖产酸产气革兰氏阴性杆菌。基于以上定义可知大肠菌群在VRBL培养基上会形成5mm以上直径的红色菌落且在确认试验中发酵乳糖产气 由LI第二章概述,大肠菌群是指在VRBL琼脂培养基上会形成特征性菌落且在确认试验中发酵乳糖产气微生物群。 3.2 简注 BGLB:亮绿乳糖胆盐培养基肉汤 LST:月桂基硫酸盐胰蛋白胨肉汤 MPN:最可能数 VRBL:紫红胆汁琼脂 4 安全防范 大肠菌群不表现为无害,注意实验室的良好操作。 5 参考资料 5.1 LIs中提到的及其它心要文件 LI-00.700 LI-00.702
实验一 食品中大肠菌群的测定
大肠菌群(M.R.N.)的测定 一、实验目的: (1)了解大肠菌群在食品卫生检验中的意义 (2)学习并掌握大肠菌群的检验原理和方法,以判别食品的卫生质量 二、实验原理: 大肠菌群系指一群能在37℃经24h能发酵乳糖,产酸产气,需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,具有广泛的卫生学意义。它反映了食品是否被粪便污染,同时间接地指出食品是否有肠道致病菌污染的可能性。 食品中大肠菌群数系以每100g(或ml)检样内大肠菌群最近似数(the mos t probable number-简称MPN)表示。最近似数(most probable number-简称MP N)法是一种将样品“多次(管)稀释至无菌”的计数方法。将3个稀释梯度的检样稀释液接种于9支或15支试管培养基中,每个稀释度接种3支或5支。经培养后,根据结果查阅MPN检索表,就可得到原样品中微生物的估计数量。M PN测定方法尤其适用于带菌量极少、其他方法不能检测的食品。如水、乳制品及其他食品中大肠菌群的计数。 三、材料 1、样品 乳、肉、禽蛋制品、饮料、糕点、发酵调味品或其他食品。 2、菌种 大肠埃希氏菌(Escherichia coli) 产气肠杆菌(Enterobacteria aerogenes) 3、培养基及试剂 单料乳糖胆盐发酵管、双料乳糖胆盐发酵管、乳糖胆盐发酵管、伊红美蓝琼脂(EMB)、革兰氏染色液、蛋白陈水、靛基质试剂、麦康凯(MA) 4、其它设备和材料 温箱(36土1)℃、水浴锅(44土0.5)℃、天平、显微镜、均质器或乳钵、温度计、平皿、试管、发酵管、吸管、载玻片、接种针。 四、实验步骤 (一)检验程序
大肠杆菌的检测
大肠杆菌的检测:大肠菌群测定的操作细则 大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。该菌主要来于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。 食品中大肠菌群数系以100mL(g)检样内大肠菌群最可能数(MPN)表示。 1 设备和材料 1.1 温箱:36±1℃。1.2 冰箱:0~4℃。1.3 恒温水浴:44.5±0.5℃。1.4 天平。1.5 显微镜。1.6 均质器或乳钵。1.7 平皿:直径为90mm。1.8 试管。1.9 吸管。1.10 广口瓶或三角烧瓶:容量为500mL。 1.11 玻璃珠:直径约5mm。 1.12 载玻片。1.13 酒精灯。1.14 试管架。 2 培养基和试剂 2.1 乳糖胆盐发酵管:按GB 4789.28中4.9规定。 2.2 伊红美蓝琼脂平板:按GB 4789.28中4.25规定。 2.3 乳糖发酵管:按GB 4789.28中4.10规定。 2.4 EC 肉汤:按GB 4789.28中4.11规定。 2.5 磷酸盐缓冲稀释液:按GB 4789.28中 3.22规定。 2.6 生理盐水。 2.7 革兰氏染色液:按GB 4789.28中2.2规定。 3.1 检样稀释 3.1.1 以无菌操作将检样25mL(或g)放于有225mL灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内予置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨做成1:10的均匀稀释液。固体检样最好用均质器,以8 000-10 000 r/min的速度处理1min,做成1:10的均匀稀释液。 3.1.2 用1mL灭菌吸管吸取1:10稀释液1mL,注入含有9mL灭菌生理盐水或其他稀释液的试管内,振摇试管混匀,做成1:100的稀释液。 3.1.3 另取1mL灭菌吸管,按上条操作依次做10倍递增稀释液,每递增稀释一次,换用1支1mL灭菌吸管。 3.1.4 根据食品卫生标准要求或对检样污染情况的估计,选择三个稀释度,每个稀释度,接种3管。 3.2 乳糖发酵试验 将待检样品接种于乳糖胆盐发酵管内,接种量在1mL以上者,用双料乳糖胆盐发酵管,1mL及1mL以下者,用单料乳糖胆盐发酵管。每一稀释度接种3管,置 36±1℃温箱内,培养24±2h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。 3.3 分离培养 将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36±1℃温箱内,培养 18-24h,然后取出,观察菌落形态,并做革兰氏染色和证实试验。 3.4 证实试验 在上述平板上,挑取可疑大肠菌群菌落1-2个进行革兰氏染色,同时接种乳糖发酵管,置36±1℃温箱内培养24±2h,观察产气情况。凡乳糖管产气、革兰氏染色为阴性的无芽胞杆菌,即可报告为大肠菌群阳性。 3.5 报告 根据证实为大肠菌群阳性的管数,查MPN检索表,报告每100mL(g)大肠菌群的MPN值。
GBT肥料中粪大肠菌群的测定
G B T肥料中粪大肠菌群 的测定 集团标准化工作小组 #Q8QGGQT-GX8G08Q8-GNQGJ8-MHHGN#
GB/ 肥料中粪大肠菌群的测定 1 范围 本标准规定了肥料中粪大肠菌群的测定方法。 2 定义 粪大肠菌群 fecal coliforms 系指一群在℃±℃条件能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。 粪大肠菌群数为每克(毫升)肥料样品中粪大肠菌群的最可能数(MPN)。 3 设备和材料(内容略) 4 培养基和试剂 培养基:遵照附录A的规定。 革兰氏染色液:遵照附录B的规定(略)。 5 检验步骤 样品稀释 在无菌操作下称取样品g或吸取样品10mL,加入到带玻璃珠的90 mL无菌水中,置于摇床上200 r/min充分振荡30min,即成10-1稀释液。 用无菌移液管吸取 mL上述稀释液加入到45 mL无菌水中,混匀成10-2稀释液。这样依次稀释,分别得到10-3,10-4等浓度稀释液(每个稀释度须更换无菌移液管)。 乳糖发酵试验 选取三个连续适宜稀释液,分别吸取不同稀释液mL加入到乳糖胆盐发酵管内,每一稀释度接种3支发酵管,置℃±℃恒温水浴或隔水式培养箱内,培养24h±2h。如果所有乳糖胆盐发酵管都不产酸不产气,则为粪大肠菌群阴性;如果有产酸产气或只产酸的发酵管,则按进行。 分离培养 从产酸产气或只产酸的发酵管中分别挑取发酵液在伊红美蓝琼脂平板上划线,置36℃±1℃条件下培养18h~24h。 证实试验 从分离平板上挑取可疑菌落,进行革兰氏染色。染色反应阳性者为粪大肠菌群阴性;如果为革兰氏阴性无芽胞杆菌则挑取同样菌落接种在乳糖发酵管中,置℃±℃条件下培养24h ±2h。观察产气情况,不产气为粪大肠菌群阴性;产气为粪大肠菌群阳性。 结果 证实实验为粪大肠菌群阳性的,根据粪大肠菌群阳性发酵管数,查MPN检索表,得出每克(毫升)肥料样品中的粪大肠菌群数。 附录 A (规范性附录) 培养基 乳糖胆盐发酵培养基 蛋白胨g 猪胆盐g 乳糖g %溴甲酚紫水溶液m L 蒸馏水1000m L
大肠菌群测定方法
大肠菌群测定方法 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
大肠菌群及检验 一、大肠菌群介绍 大肠菌群并非细菌学分类命名,而是卫生细菌领域的用语,它不代表某一个或某一属细菌,而指的是具有某些特性的一组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致,其定义为:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。一般认为该菌群细菌可包括大肠埃希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。大肠菌群分布较广,在温血动物粪便和自然界广泛存在。调查研究表明,大肠菌群细菌多存在于温血动物粪便、人类经常活动的场所以及有粪便污染的地方,人、畜粪便对外界环境的污染是大肠菌群在自然界存在的主要原因。粪便中多以典型大肠杆菌为主,而外界环境中则以大肠菌群其他型别较多。大肠菌群是作为粪便污染指标菌提出来的,主要是以该菌群的检出情况来表示食品中有否粪便污染。大肠菌群数的高低,表明了粪便污染的程度,也反映了对人体健康危害性的大小。粪便是人类肠道排泄物,其中有健康人粪便,也有肠道患者或带菌者的粪便,所以粪便内除一般正常细菌外,同时也会有一些肠道致病菌存在(如沙门氏菌、志贺氏菌等),因而食品中有粪便污染,则可以推测该食品中存在着肠道致病菌污染的可能性,潜伏着食物中毒和流行病的威胁,必须看作对人体健康具有潜在的危险性。大肠菌群是评价食品卫生质量的重要指标之一,目前已被国内外广泛应用于食品卫生工 作中。 二、大肠菌群检验方法:由于大肠菌群指的是具有某些特性的一组与粪便污染有关的细菌,即:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。因此大肠菌群的检测一般都是按照它的定义进行。 目前国内采用的进出口食品大肠菌群检测方法主要有国家标准和原国家商检局制订的行业标准。两个标准方法在检测程序上略有不同。 (一)国家标准:国家标准采用三步法,即:乳糖发酵试验、分离培养和证实试验。乳糖发酵试验:样品稀释后,选择三个稀释度,每个稀释度接种三管乳糖胆盐发酵管。36±1℃培养48±2h,观察是否产气。分离培养:将产气发酵管培养物转种于伊红美蓝琼脂平板上,36±1℃培养18-24h,观察菌落形态。证实试验:挑取平板上的可疑菌落,进行革兰氏染色观察。同时接种乳糖发酵管36±1℃培养24±2h,观察产气情况。报告:根据证实为大肠杆菌阳性的管数,查MP N表,报告每100ml(g)大肠菌群的M PN值。 具体操作参见《中华人民共和国国家标准食品卫生微生物学检验大肠菌群测定》 (二)原国家商检局制订的行业标准,等效采用美国FDA的标准方法,用于对出口食品中的大肠杆菌进行检测。本方法采用两步法:推测试验:样品稀释后,选择三个稀释度,每个稀释度接种三管LST肉汤。36±1℃培养48± 2h,观察是否产气。证实试验:将产气管培养物接种煌绿乳糖胆盐(BGLB)肉汤管中,36±1℃培养48±2h,观察是否产气。以BGLB产气为阳性。查MPN表,报告每ml(g)样品中大肠菌群的MPN值。具体操作参见SN0169-92《中华人民共和国进出口商品检验行业标准出口食品中大肠菌群、粪大肠菌群和大肠杆菌检验方法》三、说明:
大肠菌群检测方法中文翻译
大肠菌群检测方法 中文翻译
3 定义和简介 3.1 定义 所有的大肠菌群均是发酵乳糖,革兰氏阴性,无牙孢的杆菌。官方的对大肠菌群的定义可能以培养温度(30、32、35、37)不同作评价;或以确定是否发酵乳糖产气作为定义的一个特征.大多数ISO和其它官方标准是利用发酵乳糖产气作为一个定义特征。而在ISO 4832 中则利用了在VRBL上的菌落大小作为其唯一的定义特征。 鉴于这些定义的不同,建议实验室根据相关定义用相应的适当方法。 ●国际标准:样品分析是否符合国际交易规范 ●官方主市场调整定义:样品分析是否符合地方标准 ●一般定义:样品分析是否符合一般规范。 任何必要方法的调改必须经过市场实验室质量确认中心和雀巢研究中心食品安全微生物组的协助。 以下为一些官方定义例子: *ISO 4831大肠菌群是经过其在选择性肉汤上的生长和发酵乳糖产气能力来定义 *AOAC INTERNATIONAL, APHA/FDA定义大肠菌是指发酵乳糖产酸产气(T=32或35度)革兰氏阴性杆菌 *ISO 4832大肠菌群定义是根据其在VRBL-agar(30or35or37度)的菌落大小(最小5mm直径)和产酸情况。(T=30或35或37℃)
3.1.1 液体培养基中 ISO 4831 大肠菌群是根据其在选择性肉汤中生长能力和发酵乳糖产气情况来定义.(T=30或35或37℃) AOAC INTERMATIONAL,APHA/FA中大肠菌群是指发酵乳糖产酸产气革兰氏阴性杆菌。(T=32或35℃) 由LI第一章概述,大肠菌群是指发酵乳糖气微生物群。 3.1.2 固体培养基中 IOS 4832大肠菌群定义是根据其在VRBL-agar(30or35or37度)的菌落大小(最小5mm直径)和产酸情况。(T=30或35或37℃) AOAC INTERMATIONAL,APHA/FA中大肠菌群是指发酵乳糖产酸产气革兰氏阴性杆菌。基于以上定义可知大肠菌群在VRBL培养基上会形成5mm以上直径的红色菌落且在确认试验中发酵乳糖产气 由LI第二章概述,大肠菌群是指在VRBL琼脂培养基上会形成特征性菌落且在确认试验中发酵乳糖产气微生物群。 3.2 简注 BGLB:亮绿乳糖胆盐培养基肉汤 LST:月桂基硫酸盐胰蛋白胨肉汤 MPN:最可能数 VRBL:紫红胆汁琼脂 4 安全防范 大肠菌群不表现为无害,注意实验室的良好操作。 5 参考资料
微生物检验原始记录(大肠菌群)
微生物检验原始记录(大肠菌群)
检验原始记录 编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点: 样品名称:样品编号: 样品状态:符合检验要求;其他境条件: 实验依据及步骤GB4789.3-2016 样品稀释 固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。依次进行10倍递增稀释。 液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。 样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。 取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。 按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。从样品匀液制备到样品接种完毕,全过程不得超过15min。 初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤) 36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。 产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。未产气者为大肠菌群阴性。 复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。 数据分析与结果一、菌落计数
大肠菌群_菌落总数检验报告原始记录
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 微生物实验原始记录 粤珍小厨餐饮管理有限公司 样品名称样品编号放入时培养 箱温度 ℃ 设备名称电热恒温培养箱(±1℃) 设备编号DHP-9082取出时培养 箱温度 ℃ 检验依据GB/T4789.2-2010 GB/T4789.3-2010 样品状态 一、菌落总数(cfu/g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。待营养琼脂凝固后,翻转平板于36℃培养48h。同时做空白对照。 样品匀液 (10-i) 10-110-2 10-3 观察结果(C) 计算结果N 报告结果 CFU/g 二、大肠菌群(MPN/100g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释梯度取1ml注入9mlLST接种试管,36℃培养48h。 样品匀液 (10-i) 10-110-210-3
主检:审核:检验日期:年月日 邹平县产品质量监督检验所检验原始记 录 共页
主检:校核:检验日期:年月日 邹平县产品质量监督检验所检验原始记录 共页
主检:校核:检验日期:年月日 创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王*
