实验=利用正交试验优化最适培养基

实验利用正交试验设计选择和优化最适培养基
一、实验目的
1.掌握单正交试验选择微生物最适发酵条件和培养基的基本方法;
2.掌握微生物摇瓶发酵实验的基本操作技术;
3.初步掌握用正交表试安排试验及对实验结果进行分析的方法。
二、实验原理
对于一个生物作用过程,其结果或产物的得到受到多种因素的影响。
如发酵中,菌种接入量、酶的浓度、底物浓度、培养温度、pH 值、菌种
生长环境中的氧气、二氧化碳浓度、各种营养成分种类及其比例等。对
于这种多因素的实验,如何合理地设计实验,提高效率,以达到所预期
的目的是需要进行认真考虑和周密准备的。
正交实验法是安排多因素、多水平的一种实验方法,即借助正交表的表格来计划安排实验,并正确地分析结果,找到实验的最佳条件,分
清因素和水平的主次,这就能通过比较少的实验次数达到好的实验效果。
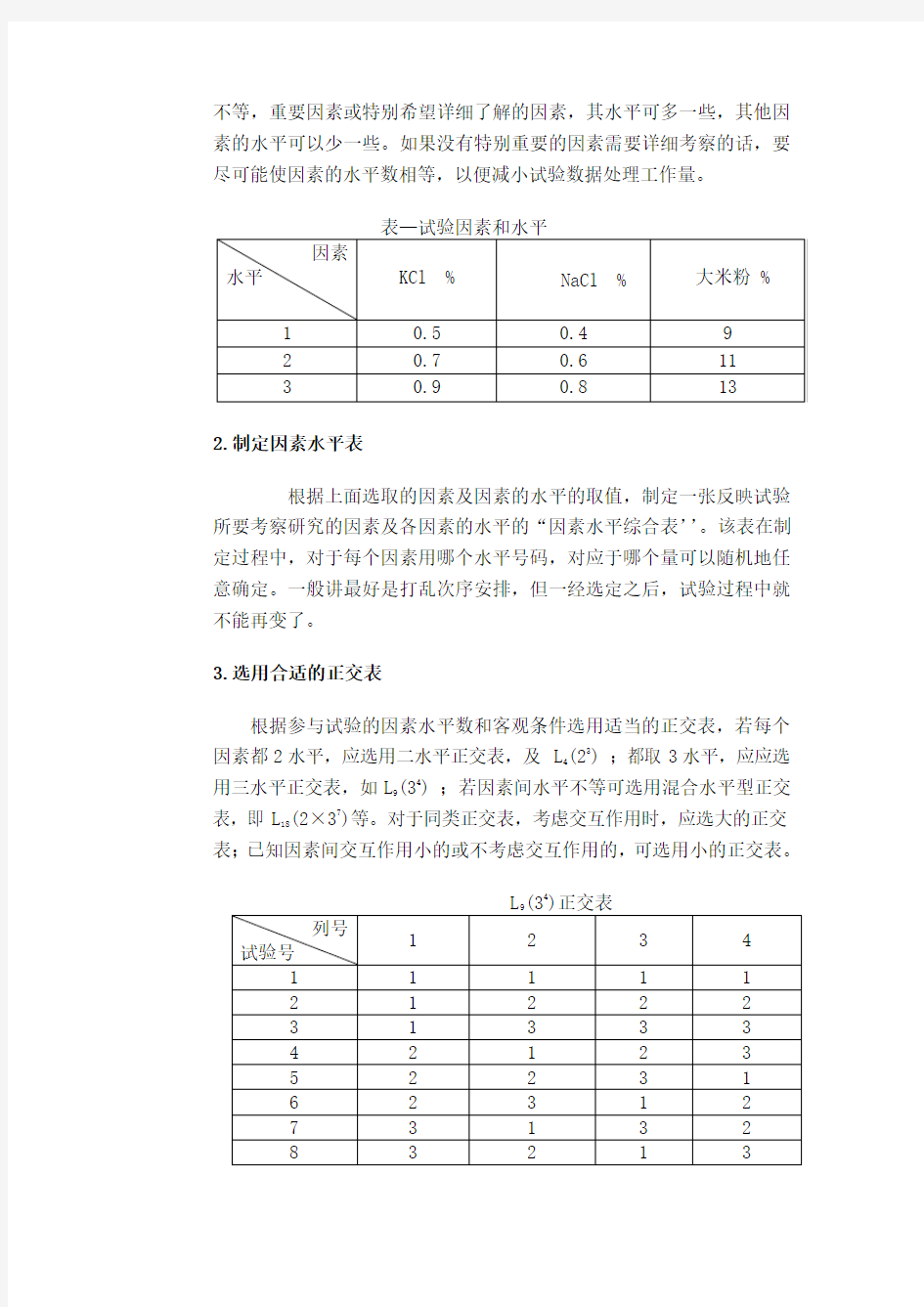
现以灰黄霉素产生菌D-756为例,研究不同氯化物浓度及大米粉配比对灰黄霉素产生菌D-756变种发酵特性的影响。试验共三个因素,每
个因素取三个水平。
1.确定试验的培养基组成成分(因素)和每种组成成分的含量(水平)
影响试验指标的因素很多,由于试验条件的限制,不可能逐一或全面地加以研究,因此要根据已有的专业知识及有关文献资料和实际情况,固定一些因素于最佳水平,排除一些次要的因素,而挑选一些主要因素。
正交试验设计法正是安排多因素试验的有利工具。当因素较多时,除非
事先根据专业知识或经验等,能肯定某因素作用很小而不选取外,对于
凡是可能起作用或情况不明或看法不一的因素,都应当选入进行考察。
因素的水平分为定性与定量两种,水平的确定包含两个含义,即水平个数的确定和各个水平数量的确定。对定性因素,要根据试验具体内
容,赋予该因素每个水平以具体含义。定量因素的量大多是连续变化的,
这就要求试验者根据相关知识或经验、或者文献资料首先确定该因素的
数量变化范围,而后根据试验的目的及性质,并结合正交表的选用来确
定因素的水平数和各水平的取值。每个因素的水平数可以相等,也可以
不等,重要因素或特别希望详细了解的因素,其水平可多一些,其他因素的水平可以少一些。如果没有特别重要的因素需要详细考察的话,要尽可能使因素的水平数相等,以便减小试验数据处理工作量。
2.制定因素水平表
根据上面选取的因素及因素的水平的取值,制定一张反映试验所要考察研究的因素及各因素的水平的“因素水平综合表’’。该表在制定过程中,对于每个因素用哪个水平号码,对应于哪个量可以随机地任意确定。一般讲最好是打乱次序安排,但一经选定之后,试验过程中就不能再变了。
3.选用合适的正交表
根据参与试验的因素水平数和客观条件选用适当的正交表,若每个因素都2水平,应选用二水平正交表,及 L
(23) ;都取3水平,应应选
4
(34) ;若因素间水平不等可选用混合水平型正交用三水平正交表,如L
9
表,即L
(2×37)等。对于同类正交表,考虑交互作用时,应选大的正交18
表;已知因素间交互作用小的或不考虑交互作用的,可选用小的正交表。
L(34)正交表
4.列出试验方案(表头设计)
把各列按照表头设计排上培养基组成成分,各列对应的水平数字换上各组成成分所对应的实际水平,每一行就构成一个处理(一个培养基配方的主要成分),各个培养基配方便组成整个试验方案。
5.实施实验方案
根据所定试验方案,按照规定试验内容,以常规操作制备培养基。一般一个培养基要重复2-4瓶。各个培养基应采用同一细胞浓度的菌悬液接种,以相同转速摇瓶培养3天,测定产物活性,最后按照正交表进行实验结果的统计分析。在整个方案实施过程中要精心操作,试验条件尽量力求一致,以便取得正确的合乎实际的试验结果。
6.正交试验结果分析
正交试验结果的直观分析与正交试验结果的方差分析相比,具有计算量小、计算简单、分析速度快、一目了然等特点,但分析结果的精确性与严密性相对于方差分析来说稍差。直观分析步骤如下:
(1)计算K值
其中,以A因子为例:
K1= y1+ y2+ y3=42168 A因子1水平的3个试验结果之和;K2= y4+ y5+ y6=43540 A因子2水平的3个试验结果之和;K3= y7+ y8+ y9=43447 A因子3水平的3个试验结果之和;k1= K1/3 =14056
k2= K2/3 =14513
k3= K3/3 =14482
R= k[max]- k[min]= k2- k1=14513-14056=457 称为极差
对于B、C因子,依次类推。
(2)作用因素与试验结果的关系图
以因素的不同水平作横坐标,以k值作纵坐标,把每个因素不同水平与所对应的k值作曲线图。
(3)判断各因素主次关系及其显著性
根据极差R的大小,可判断各因素对试验结果影响的大小。判断的原则是:凡是R越大,所对应的因子越重要。根据图表可知,第二列的
极差最大,为1191,所以B因素(NaCl)对试验结果的影响是最主要的。
影响度依次为B(NaCl)→C(大米粉)→A(KCl)。
对于空列来说三个因素的极差本应为零。但是在实际实验中,总是有误差的,极差不能正好为零。它的大小正好反映了误差的大小。本例
中三个因素的极差都比空列的极差大的多,说明这三个因素的影响都是
显著的。
(4)确定优水平组合:
根据k1、k2、k3值的大小来确定A、B、C各因子取决于哪个水平好。
确定的原则根据对指标值的要求而定:如果要求指标值越大越好,则取
最大的k所对应的那个水平;如果要求指标值越小越好,则取最小的k
所对应的那个水平。本例中根据图表可知,我们要求NaCl和大米粉浓度
越大越好,KCl浓度取0.7%时最好;因而,选择A
2B
3
C
3
,即得到一个好条
件,即:KCl 0.7%,NaCl 0.8%,大米粉13%。这个组合是在原试验方案中没有做过的。由此可见,利用正交设计,其最优处理组合即使没有做过,也能计算出来,作为参考。
三、材料和方法
菌种:大肠杆菌Escherichia coli
发酵基础培养基:见实验内容。四、实验方法
本实验运用正交法测定将葡萄糖作为碳源,蛋白胨、酵母膏作为氮源,KH
2PO
4
为磷源对Escherichia coli生长的影响,并求得各营养物在什么样的配比时生物量最大。通过本实验初步掌握正交法的使用。
(一)单因素发酵条件实验(略)
1、不同碳源对发酵的影响:
基础培养基:(NH
4)
2
SO
4
0.3%,KH
2
PO
4
0.2%,MgSO
4
0.05%,分别加入4%
不同碳源。
2、不同氮源对发酵的影响:
基础培养基:碳源 4%,KH
2PO
4
0.2%,MgSO
4
0.05%,分别加入不同氮源
pH7.2。
3、不同无机盐对发酵的影响:
基础培养基:碳源 4%,氮源 0.3%,MgSO
4
0.02%,pH7.2,分别加入不同量无机盐。
(二)正交实验——最佳发酵培养基的确定
将以上因素实验的结果综合起来,还不能认为是最佳条件,特别是在碳、氮源、无机盐的用量上,必须通过正交实验和验证实验才能确定最佳配方。本实验
中的无机盐类中,MgSO
4影响不大,而KH
2
PO
4
起着决定性作用,因素采用三因素
三水平的正交设计。
1)确定试验的培养基组成成分(因素)和每种组成成分的含量(水平)
2)进行表头设计
3)配制培养基:按照试验设计方案,分别配制不同培养基,250ml三角瓶
每瓶装量50ml,121℃灭菌20分钟。
4)接菌、摇瓶培养:将活化菌种接种到新鲜的LB培养基中过夜,再按1%
接种量转接到不同的培养基中,37℃下180rpm/min摇床振荡培养24hr。
5)菌体量测定:离心收集菌体,用无菌水悬浮并作适当稀释,在660nm 下
测浊度。
6)数据记录及分析:把测定数据填入分析表的试验结果栏内,按表中数据
计算出各因素的一水平试验结果总和、二水平试验结果总和、三水下试验结果总和,再取平均值(各自被 3 除)。最后计算极差。从极差的大小确定那个因素对酶活力影响最大,那个影响最小。找出在何种条件下生物量最高。
7)以 k 值为纵坐标,因素的水平数为横坐标,作作用因素与试验结果的关
系图。最后作一直观分析的结论。
表Ⅱ表头设计
实验室常用培养基的配制方法
实验室常用培养基的配制方法 Ampicillin (100 mg/ml) IPTG (24 mg/ml) X-Gal (20 mg/ml) LB培养基■组份浓度 100 mg/ml Ampicillin ■配制量 50 ml ■配制方法 1. 称量5 g Ampicillin置于50 ml离心管中。 2. 加入40 ml灭菌水,充分混合溶解后,定容至50 ml。 3. 用0.22 μm滤器过滤除菌。 4. 小份分装(1 ml/份)后,-20℃保存。 ■组份浓度 24 mg/ml IPTG ■配制量 50 ml ■配制方法 1. 称量1.2 g IPTG置于50 ml离心管中。 2. 加入40 ml灭菌水,充分混合溶解后,定容至50 ml。 3. 用0.22 μm滤器过滤除菌。 4. 小份分装(1 ml/份)后,-20℃保存。 ■组份浓度 20 mg/ml X-Gal ■配制量 50 ml ■配制方法 1. 称量1 g X-Gal置于50 ml离心管中。 2. 加入40 ml DMF(二甲基甲酰胺),充分混合溶解后, 定容至50 ml。 3. 小份分装(1 ml/份)后,-20℃避光保存。 ■组份浓度 1%(W/V)Tryptone,0.5%(W/V)Yeast Extract, 1%(W/V)NaCl ■配制量 1 L ■配制方法 1. 称量下列试剂,置于1 L烧杯中。 Tryptone 10 g Yeast Extract 5 g NaCl 10 g 2. 加入约800 ml的去离子水,充分搅拌溶解。 3. 滴加5 N NaOH(约0.2 ml),调节pH值至7.0。 4. 加去离子水将培养基定容至1 L。 5. 高温高压灭菌后,4℃保存。
正交实验优化工艺参数-2
正交试验优化工艺参数 组员:刘亮(V201241228)张龙伟(201341205) 1.正交试验设计简介 1.1正交试验设计的基本概念 人们在长期的实践中发现,要得到理想的结果,并不需要进行全面试验,即使因素个数、水平都不太多,也不必做全面试验.尤其对那些试验费用很高,或是具有破坏性的试验,更不要做全面试验.我们应当在不影响试验效果的前提下,尽可能地减少试验次数,正交设计就是解决这个问题的有效方法。正交试验设计是研究多因素多水平的又一种设计方法,它是利用正交表来安排与分析多因素试验的一种设计方法。它是由试验因素的全部水平组合中,挑选部分有代表性的水平组合进行试验的,通过对这部分试验结果的分析了解全面试验的情况,找出最优的水平组合。 正交实验设计方法的三个基本概念即:指标、因素和水平。 1) 指标 在试验中需要考查的效果的特性值,简称为指标。指标与试验目的是相对应的。例如,试验目的是提高产量,则产量就是试验要考查的指标:如果试验目的是降低成本,则成本就成了试验要考查的指标。总之,试验目的多种多样,而对应的指标也各不相同。指标一般分为定量指标和定性指标,正交试验需要通过量化指标以提高可比性,所以,通常把定性指标通过评分定级等方法转化为定量指标。 2) 因素 因素也称因子,是试验中考查对试验指标可能有影响的原因或要素,它是试验当中重点要考查的内容。通常用大写字母A,B,C等来表示。一个字母表示一个因素,因素又分为可控因素和不可控因素。可控因素指在现有科学技术条件下,能人为控制调节的因素;不可控因素指在现有科学技术条件下,暂时还无法控制和调节的因素。正交试验中,首先要选择可控因素列入到试验当中,而对不可控因素,要尽量保持一致,即在每个方案中,要对试验指标可能有影响的不可控因素,尽量要保持相同状态。这样,在进行试验结果数据的处理过程中就可以忽略不可控因素对试验造成的影响。 3) 水平 试验中选定的因素所处的状态和条件称为水平或位级。例如:加热温度为700℃,800℃,900℃这3个状态,可分别用1、2、3来表示。又如1个因素分为2水平,用1和2来表示。同理,一个因素也可分为4水平、5水平或更多水平,以此类推。
正交试验设计及其方差分析
第三节正交试验设计及其方差分析 在工农业生产和科学实验中,为改革旧工艺,寻求最优生产条件等,经常要做许多试验,而影响这些试验结果的因素很多,我们把含有两个以上因素的试验称为多因素试验.前两节讨论的单因素试验和双因素试验均属于全面试验(即每一个因素的各种水平的相互搭配都要进行试验),多因素试验由于要考虑的因素较多,当每个因素的水平数较大时,若进行全面试验,则试验次数将会更大.因此,对于多因素试验,存在一个如何安排好试验的问题.正交试验设计是研究和处理多因素试验的一种科学方法,它利用一套现存规格化的表——正交表,来安排试验,通过少量的试验,获得满意的试验结果. 1.正交试验设计的基本方法 正交试验设计包含两个内容:(1)怎样安排试验方案;(2)如何分析试验结果.先介绍正交表. 正交表是预先编制好的一种表格.比如表9-17即为正交表L4(23),其中字母L表示正交,它的3个数字有3种不同的含义: (1) L4(23)表的结构:有4行、3列,表中出现2个反映水平的数码1,2. 列数 ↓ L4 (23) ↑↑ 行数水平数 (2)L4(23)表的用法:做4次试验,最多可安排2水平的因素3个. 最多能安排的因素数 ↓ L4 (23) ↑↑ 试验次数水平数 (3) L4(23)表的效率:3个2水平的因素.它的全面试验数为23=8次,使用正交表只需从8次试验中选出4次来做试验,效率是高的. L4 (23) ↑↑ 实际试验数理论上的试验数 正交表的特点: (1)表中任一列,不同数字出现的次数相同.如正交表L4(23)中,数字1,2在每列中均出现2次. (2)表中任两列,其横向形成的有序数对出现的次数相同.如表L4(23)中任意两列,数字1,2间的搭配是均衡的.
常用细菌培养基配方
常用抗生素 氨苄青霉素(ampicillin)(100mg/ml) 溶解1g氨苄青霉素钠盐于足量的水中,最后定容至10ml。分装成小份于-20℃贮存。常以25ug/ml~50ug/ml的终浓度添加于生长培养基。 羧苄青霉素(carbenicillin)(50mg/ml) 溶解0.5g羧苄青霉素二钠盐于足量的水中,最后定容至10ml。分装成小份于-20℃贮存。常以25ug/ml~50ug/ml的终浓度添加于生长培养基。 甲氧西林(methicillin)(100mg/ml) 溶解1g甲氧西林钠于足量的水中,最后定容至10ml。分装成小份于-20℃贮存。常以37.5ug/ml终浓度与100ug/ml氨苄青霉素一起添加于生长培养基。 卡那霉素(kanamycin)(10mg/ml) 溶解100mg卡那霉素于足量的水中,最后定容至10ml。分装成小份于-20℃贮存。常以10ug/ml~50ug/ml的终浓度添加于生长培养基。 氯霉素(chloramphenicol)(25mg/ml) 溶解250mg氯霉素足量的无水乙醇中,最后定容至10ml。分装成小份于-20℃贮存。常以12.5ug/ml~25ug/ml的终浓度添加于生长培养基。 链霉素(streptomycin)(50mg/ml) 溶解0.5g链霉素硫酸盐于足量的无水乙醇中,最后定容至10ml。分装成小份于-20℃贮存。常以10ug/ml~50ug/ml的终浓度添加于生长培养基。 萘啶酮酸(nalidixic acid)(5mg/ml) 溶解50mg萘啶酮酸钠盐于足量的水中,最后定容至10ml。分装成小份于-20℃贮存。常以15ug/ml的终浓度添加于生长培养基。 四环素(tetracyyline)(10mg/ml) 溶解100mg四环素盐酸盐于足量的水中,或者将无碱的四环素溶于无水乙醇,定容至10ml。分装成小份用铝箔包裹装液管以免溶液见光,于-20℃贮存。常以10ug/ml~50ug/ml的终浓度添加于生长培养基。 常用培养基 LB培养基 将下列组分溶解在0.9L水中: 蛋白胨10g 酵母提取物5g 氯化钠10g 如果需要用1N NaOH(~1ml)调整pH至7.0,再补足水至1L。注:琼脂平板需添加琼脂粉12g/L,上层琼脂平板添加琼脂粉7g/L。(实验室一般都不调PH) SOB培养基 将下列组分溶解在0.9L水中: 蛋白胨20g 酵母提取物5g 氯化钠0.5g 1 mol/L 氯化钾2.5ml
正交实验法及其应用
正交实验法及其应用 为了研制新产品,提高产品的质量和数量,降低原材料消耗,都需要做试验。一项试验如何安排,就得选择方法。一个好的试验方法,只要用少量试验既能得到较好的效果和分析出较为正确的结论;如果试验方法不好,不但试验次数多,而且结果还不一定理想。正交试验法就是利用一套规格化的表(正交表)来安排试验方案,使得试验次数尽可能地少;并通过对试验数据的简单分析,有助于我们在复杂的影响因素中抓住主要因素,从而找出较好的实验方案。“正交试验法”应用的范围非常广泛,现已成为比较简便、易行的一种应用数学方法。这里分两部分:简单介绍正交试验的基本方法和利用该方法对芦荟多糖提取条件进行优化。其中第一部分包括:正交试验法解决的问题;涉及的相关术语;如何用正交表安排试验以及怎样分析试验结果。另外,有时试验过程中不仅因素的水平变化对指标有影响,而且,有些因素间各水平的联合搭配对指标也产生影响,这种联合搭配作用称为交互作用,这里不作介绍。第二部分应用正交实验法对芦荟多糖提取条件进行了优化,得到很好的试验结果,大大加快了试验的进程,并节约了试验的耗材。 第一部分正交试验的基本方法 一、什么是“正交试验法” 采用什么样的实验设计方案能够做到优质、高产、低稍耗?要使实验顺利进行应该改进哪些实验条件……?由于实验结果是受许多方面的因素的影响,往往需要进行试验来增加对具体实验的认识,以便摸索其中的规律性。 凡是要做试验就存在着如何安排试验和如何分析试验结果的问题。科学的实验安排应能做到两点:1)在试验安排上尽可能地减少试验次数2)在进行较少次数试验的基础上,能够利用所得到的试验数据,分析出指导下一步实验的正确结论,并得到较好的结果。 “正交试验法”就是一种科学地安排与分析多因素试验的方法。下面通过一个例子初步说明一下它是解决什么问题的。 例. 研究人参皂苷的提取工艺试验。 根据经验,乙醇用量、乙醇浓度、提取时间、回流次数等对人参皂苷的提取有显著影响。所以在提取过程中需要考察乙醇用量(A)、乙醇浓度(B)、回流时间(C)、回流次数(D)这四个因素。每个因素比较三种不同的条件(见表) 类似这样的问题,在实验中经常遇到。这类问题称之为多因素试验问题。“正交试验法”正是解决这类问题的行之有效的一种方法。 为了叙述的方便,下面介绍一下涉及到的术语和符号。一般,把试验需要考察的结果称为指标。如产品的性能、质量、成本、产量等均可做为衡量试验效果的指标。本例中的人参皂苷的量就是试验的指标。把在试验中要考察的对试验指标可能有影响的因素简称为因素。本例中的乙醇用量(A)、乙醇浓度(B)、回流时间(C)、回流次数(D)就是四个因素。把
培养基设计与优化
培养基的设计与优化 原料:碳源,氮源 十大元素: 碳, 氢, 氧, 氮, 磷, 钾, 硫, 钙, 镁 微量元素: 硼, 锰, 锌, 钼, 钴, 碘, 铜, 等 生长因子、前体和产物促进剂 生长因子 从广义上讲,凡是微生物生长不可缺少的微量的有机物质,如氨基酸、嘌呤、嘧啶、维生素等均称生长因子。如以糖质原料为碳源的谷氨酸生产菌均为生物素缺陷型,以生物素为生长因子,生长因子对发酵的调控起到重要的作用。有机氮源是这些生长因子的重要来源,多数有机氮源含有较多的B簇维生素和微量元素及一些微生物生长不可缺少的生长因子。 前体 前体指某些化合物加入到发酵培养基中,能直接为微生物在生物合成过程中合成到产物物分子中去,而其自身的结构并没有多大变化,但是产物的产量却因加入前体而有较大的提高。产物促进剂 指那些非细胞生长所必须的营养物,又非前体,但加入后却能提高产量的添加剂。其提高产量的机制还不完全清楚,其原因可能是多方面的,主要包括:有些促进剂本身是酶的诱导物;有些促进剂是表面活性剂,可改善细胞的透性,改善细胞与氧的接触从而促进酶的分泌与生产,也有人认为表面活性剂对酶的表面失活有保护作用;有些促进剂的作用是沉淀或螯合有害的重金属离子。 水 对于发酵工厂来说,恒定的水源是至关重要的,因为在不同水源中存在的各种因素对微生物发酵代谢影响甚大。水源质量的主要考虑参数包括pH值、溶解氧、可溶性固体、污染程度以及矿物质组成和含量。 培养基的设计与优化 目前还不能完全从生化反应的基本原理来推断和计算出适合某一菌种的培养基配方,只能用生物化学、细胞生物学、微生物学等的基本理论,参照前人所使用的较适合某一类菌种的经验配方,再结合所用菌种和产品的特性,采用摇瓶、玻璃罐等小型发酵设备,按照一定的实验设计和实验方法选择出较为适合的培养基。 培养基设计的基本步骤是: 1.根据前人的经验和培养基成分确定时一些必须考虑的问题,初步确定可能的培养基成分. 2.通过单因子实验最终确定出最为适宜的培养基成分。 3.当培养基成分确定后,剩下的问题就是各成分最适的浓度,由于培养基成分很多,为减少实验次数常采用一些合理的实验设计方法。这些实验往往基于多因子实验,包含均匀设计、正交实验设计、响应面分析等。
正交设计助手II 3.1 软件介绍及使用实例说明
正交设计助手II 3.1 软件介绍及使用实例说明 一、软件各模块介绍 1.软件简介 正交设计助手II 3.1 是一款针对正交实验设计及结果分析而制作的专业软件。正交设计方法是我们常用的实验设计方法,它让我们以较少的实验次数得到科学的实验结论。但是我们经常不得不重复一些机械的工作,比如填实验安排表,计算各个水平的均值等等。正交设计助手可以帮助您完成这些繁琐的工作。此款软件支持混合水平实验,支持结果输出到RTF、CVS、HTML页面和直接打印。 2.创建与管理工程 打开软件后,在文件菜单项下可以“新建工程”或“打开工程”,工程文件以lat作为扩展名。如下图所示 注意:在"实验项目树"区域,右键点击当前的工程名,可修改工程名称。 3.设计实验 新建实验:在当前工程文件中新增一个实验项目,一个工程可包含多个实验项目。 每个实验项目包括有 (1)实验名称、实验描述(实验编号及简要说明)、选用的正交表类型(是标准正交表还是混合水平表) (2)选用的正交表(如L27_3_13或x_L2-3_8等) (3)表头设计结果(每个实验因素的名称、所在列及各水平的描述)。 单击实验—新建实验,如下图所示
该软件支持混合水平实验设计,你将可以选择一个更为合适您的实验的混合水平表(使用工具blend.exe - 混合水平表编辑器 - 改造系统提供的标准正交表)。如果是混合水平实验,要注意每列所能支持的最大水平数。 注意:右键点击当前的实验名称,可以修改实验信息或删除当前实验。 4.分析实验结果 (1)直观分析:根据所选用的正交表对当前实验数据作出基本的直观分析表。 (2)因素指标:以直观分析表的结果,作出当前的因素指标图(即效应曲线图)。 (3)交互作用:选择两个因素进行交互作用分析,作出交互作用表。 (4)方差分析:设定数据中的误差所在列,并选择所要采用的F检验临界值表。计算出偏差平方和(S值)和F比。并给出显著性指标。 注意:如果实验数据未正确输入,系统不能进行分析操作。
实验室常用培养基的配制方法
五、实验室常用培养基的配制方法 Ampicillin(氨卡青霉素)(100 mg/ml) 组份浓度100 mg/ml Ampicillin 配制量50 ml 配制方法 1.称量5 g Ampicillin置于50 ml离心管中。 2.加入40 ml灭菌水,充分混合溶解后,定容至50 ml。 3.用0.22 μm过滤膜过滤除菌。 4.小份分装(1 ml/份)后,-20℃保存。 IPTG(异丙基-β-D-硫代半乳糖苷)(24 mg/ml) 组份浓度24 mg/mL IPTG 配制量50 mL 配制方法 1.称1.2 g IPTG置于50 ml离心管中。 2.加入40 ml灭菌水,充分混合溶解后,定容至50 ml。 3.用0 22 μm过滤膜过滤除菌。 4小份分装(1 ml,份)后,-20℃保存。 X-Gal (20 mg/ml) 组份浓度20 mg/ml X-Gal 配制量50 ml 配制方法 1.称量l g X-Gal置于50 ml离心管中。 2.加入40 ml DMF(二甲基甲酰胺),充分混合溶解后,定容至50 ml。 3.小份分装(1 ml/份)后,-20℃避光保存。 LB培养基 组份浓度1%(W/V)Tryptone(胰蛋白胨),0.5%(W/V)Yeast Extract(酵母提取物),1%(W/V)NaCl 配制量 1 L 配制方法 1.称取下列试剂,置于l L烧杯中。 Tryptone 10 g Yeast Extract 5 g NaCl 10 g 2.加入约800 ml的去离子水,充分搅拌溶解。 3.滴加5 N NaOH(约0.2 m1),调节pH值至7.0。 4.加去离子水将培养基定容至1 L。 5高温高压灭菌后,4。C保存。 LB/Amp培养基 组份浓度 1%(W/V) Tryptone 0.5%(W/V) Yeast Extract 1%(W/V) NaCl 0.1 mg/ml Ampicillin
正交实验方法在传感器数字化参数优化中应用-last
正交实验方法在传感器数字化参数优化中应用* (华南理工大学机械与汽车工程学院,广东广州 510640) 摘要:针对传感器数字化参数配置优化比较复杂的问题,以称重传感器的数字化为例,提出以测量值有效比特位作为优化综合指标,采用正交试验法分析了数字化过程中的主要配置参数,包括电源激励方式、ADC斩波方式、滤波器阶数以及50/60Hz工频抑制功能设置。确定了各因素对测量值影响的主次顺序,找出了最优参数配置。验证实验结果表明,优化参数配置方案具有可行性和有效性。 关键词:正交实验;参数设置;有效比特;传感器;数字化 中图分类号:TP212文献标识码:A 文章编号: Application of Orthogonal Experiment Method in Sensors Digitization Parameters Optimization* (School of Mechanical & Automotive Engineering, South China University of Technology, Guangzhou, Guangdong 510640, China) Abstract:Aiming to the problem that optimization of sensors digitization parameters configuration is complex, digitization of load cell is taken as an example, and orthogonal experiment method is adopted to analyze main configuration parameters of digitization process, including power excitation, ADC chopper, filter order and 50/60Hz power frequency rejection setting, while the measurement results effective number of bits (ENOB) is proposed to be optimization comprehensive index. The important order that various factors affect on the measurement results is determined, and the optimal parameters configuration is found out. The verify experiment results show that the parameters configuration optimization scheme is feasible and effective. Key words:orthogonal experiment;parameters setting;ENOB;sensor;digitization 0 引言 数字化、智能化是传感器技术发展的重要趋势之一[1]。为获取高准确度、高稳定性的数字化效果,各厂家不断推出功能丰富的新器件(如模数转换器件、数字信号处理器件、微处理器)与传感器进行配套,以提高传感器的整体性能[2-3]。但实际应用中,这些器件的参数配置比较复杂,有时甚至相矛盾,要获得理想的参数配置方案需要通过大量的分析与实验,工作效率低。正交实验法适用于多因素、多水平和具有随机误差的各种实验,是解决多因素实验问题的有效统计方法。通过对正交实验结果分析,可以确定各因素及其交互作用对实验指标影响的主次关系,用比较少的实验次数获得最优或较优的一组方案[4-5]。在本文中,将以称重传感器的数字化为例,探讨如何应用正交实验方法,去完成传感器数字化优化参数的配置。1配置参数及优化综合指标 图1为一种数字式称重传感器的原理图。该传感器采用某厂家型号为YZC-1B的平行梁式应变传感单元,灵敏度为2mV/V,量程为5k g,可直接用ADC(如AD7190、ADS1232和CS5532)和MCU对电桥的模拟输出信号进行数字化[6-8],通过MCU可对数字称重传感器的各个参数进行配置。 数字称重传感器配置参数的设置对传感器测量准确度影响比较大。这些配置参数主要有:激励方式、斩波方式、滤波器阶数和50/60Hz工频抑制。不同的电源激励方式会影响传感器的输出信号范围和电源噪声抑制能力;斩波方式能减小ADC输入端的输入失调电压;输出更新频率一定时,数字滤波器的阶数会影响滤波效果;50/60Hz工频抑制可同时滤除50Hz 与60Hz附近频带的噪声。 *基金项目:广东省科技厅工业攻关项目(No.2008B010400043);珠海市科技局产学研项目(No.PC20082020);教育部新世纪优秀人
培养基设计中的正交设计法
培养基设计中的正交设计法 正交试验设计是研究多因素多水平的一种设计方法,它是根据正交性从全面试验中挑选出部分有代表性的点进行试验,这些有代表性的点具备了“均匀分散,齐整可比”的特点。正交试验设计是分式析因设计的主要方法,是一种高效率、快速、经济的实验设计方法。日本著名的统计学家田口玄一最先将正交试验选择的水平组合列成表格,称为正交表。例如作一个三因素三水平的实验,若按全面实验要求,须进行33=27种组合的实验,且尚未考虑每一组合的重复数;若按L9(33)正交表安排实验,只需作9次,显然大大减少了工作量。因而正交实验设计在培养基的研究中已经得到广泛应用。 正交表是一整套规则的设计表格,可表示为Ln(t c)。其中L表示正交表,n 为试验的次数,t为水平数,c为列数,也就是可能安排最多的因素个数。例如L9(34),它表示需做9次实验,最多可观察4个因素,每个因素均为3水平。一个正交表中也可以各列的水平数不相等,称它为混合型正交表,如L8(4×24),此表的5列中,有1列为4水平,4列为2水平。根据正交表的数据结构看出,正交表是一个n行c列的表,其中第j列由数码1,2,…S组成,这些数码均各出现N/S 次。 正交表具有以下两项性质: (1)每一列中,不同的数字出现的次数相等。例如在两水平正交表中,任何一列都有数码“1”与“2”,且任何一列中它们出现的次数是相等的;如在三水平正交表中,任何一列都有“1”、“2”、“3”,且在任一列的出现数均相等。 (2)任意两列中数字的排列方式齐全而且均衡。例如在两水平正交表中,任何两列(同一横行内)有序对子共有4种:(1,1)、(1,2)、(2,1)、(2,2)。每种对数出现次数相等。在三水平情况下,任何两列(同一横行内)有序对共有9种,1.1、1.2、1.3、2.1、2.2、2.3、3.1、3.2、3.3,且每对出现数也均相等。 以上两点充分的体现了正交表的两大优越性,即“均匀分散性,整齐可比”。通俗的说,每个因素的每个水平与另一个因素各水平各碰一次,这就是正交性。 应用正交设计法时,首先需要选择一张和实验因素水平相对应的正交表,已经有数学家制好了很多相应的表,只需找到对应需要的就可以了。正交表实际上是一套经过周密计算得出的现成的实验方案,可以告诉我们每次实验时,用那几个水平互相匹配进行实验,这套方案的总实验次数是远小于每种情况都考虑后的实验次数的。建立好实验表后,根据表格做实验,然后就是数据处理了。由于试验次数大大减少,使得试验数据处理非常重要。首先可以从所有的实验数据中找到最优的一个数据,当然,这个组数据不一定是最佳匹配数据,但是肯定是最接近最佳的了,这是最直观的一组最佳因素。接下来将各个因素当中同水平的实验值加和,就得到了各个水平的实验结果表,从这个表当中又可以得到一组最优的因素,通过比较前一个因素,可以获得因素变化的趋势,以指导更进一步的试验。各个因素中不同水平试验值之间也可以进行如极差、方差等计算,可以获知这个因素的敏感度等。然后再根据统计数据,确定下一步的试验,这次实验的范围就很小了,目的就是确定最终的最优值。 下面举例说明正交设计法在培养基设计中的应用。如已知植物生长调节剂2,4-D、NAA和KT均对黄独脱毒苗生长具有相应作用,但现在需要对黄独脱毒苗的快繁培养基进行优化。因此,首先找一张相应的正交表,按照正交表的提示设计好实验表,并进行实验,得到相应结果。如下图:
实验一常用器皿包扎与培养基的配制和灭菌
实验一常用器皿包扎与培养基的配制和灭菌 一、实验目的 1学会常用器皿包扎方法 2学习和掌握配制培养基的一般方法和步骤 3学会实验室灭菌锅的使用方法 二、常用器具和仪器 试管(testtube),德汉氏小管(Durhamtube),玻璃吸管 (glasspipette),吸器,微量加样器(micropipette),吸嘴(tip),培养皿(petri dish),三角瓶(erlenmeyer flask),接种铲(inoculatingshovel),玻璃涂布器(glassspreade),接种环(inoculatingloop),接种钩(inoculating hook),接种针(inoculating needle),小塑料离心管(Eppendorf tube),滴瓶(dropper bottle ),双层瓶(double bottle),酒精灯⑻ cohol burner),煤气喷头(coal gas sprinklerhead,试剂瓶,量筒,烧杯,温度计,石棉网,漏斗,烘箱,卧式灭菌锅,手提式灭菌锅,无菌操作台/ 室,过滤除菌设备,厌氧操作设备,小型发酵罐,离心机,培养箱/摇床,冷冻干燥机,蒸馏水器,超声波清洗仪,磁力搅拌器。 三、玻璃器皿的包装 1、培养皿的包装方法一:用旧报纸密密包紧,一般以5-8 套培养皿作一包。包好后用干热或湿热灭菌(见无菌操作技术)。 方法二:将培养皿放入金属(不锈钢)筒内,干热灭菌。金属筒配有盖子,内部还有一个可以放培养皿的带底框架。框架可以从筒内提出,以便装取培养皿。 包好的培养皿 金属筒和内部的框架 塑料培养皿架 2、吸管的包装
第三章 发酵培养基
第三章发酵培养基 培养基:广义上讲培养基是指一切可供微生物细胞生长繁殖所需的一组营养物质和原料。同时培养基也为微生物培养提供除营养外的其它所必须的条件。 作用:促进产物的形成、满足菌体的生长 发酵培养基的要求: ①培养基能够满足产物最经济的合成; ②发酵后所形成的副产物尽可能的少; ③培养基的原料应因地制宜,价格低廉,且性能稳定,资源丰富,便于采购运输,适合大规模储藏,能保证生产上的供应; ④所选用的培养基应能满足总体工艺的要求,如不应该影响通气、提取、纯化及废物处理等。 培养基的类型及功能 一、按组成物质的纯度 合成培养基: 所用的原料其化学成分明确、稳定 ◆适合于研究菌种基本代谢和过程的物质变化等科研工作; ◆培养基营养单一,价格较高,不适合用于大规模工业生产。 天然培养基: 采用天然原料,其成分不那么“纯” ◆发酵培养基普遍使用天然培养基; ◆原料来源丰富(大多为农副产品)、价格低廉、适合于工业化生产; ◆由于其成分复杂,不易重复,如果对原料质量等方面不加控制会影响生产稳定性。 二、按状态 固体培养基:适合于菌种和孢子的培养和保存,也广泛应用于有子实体的真菌类,如香菇、白木耳等的生产。 半固体培养基:琼脂用量为0.5%~0.8% ,主要用于微生物的鉴定。 液体培养基:发酵工业大规模使用的培养基。 三、按用途(从发酵生产应用考虑) 孢子(斜面)培养基:菌体迅速生长,产较多优质孢子,不易引起菌种变异。要求:营养不太丰富、无机盐浓度适量、合适pH和湿度。常用:麸皮培养基、小米、大米、玉米碎屑、琼脂斜面培养基。 种子培养基:孢子发芽、生长和大量繁殖菌丝体。要求:营养丰富完全、最后一级接近发酵培养基。 发酵培养基:供菌体生长、繁殖和合成产物。 发酵培养基的成分及来源 碳源 1、作用 提供微生物菌种的生长繁殖所需的能源和合成菌体所必需的碳成分;提供合成目的产物所必须的碳成分。 2、来源 糖类、油脂、有机酸、正烷烃
实验室常用培养基配方
031*-2./4,+ 5 86779\_V_[_PUY\RQTXYWYS^QO\OWYS YXWUXR:bkkiNIIlllHk_d_j_H`hfH`g Ofic`ceecg EKJJ faIfeF rqq 74p 76z 7:5256658vq 76 ro Jf v 4z 7:5256658-}vq 76eyU .A so ]q uq 76icuEKRZXoaYEQp ,vq 76A to |qoss 17hkWhLcA uo xSR /C r 76p SDYE nsq BGMA UZ\S ELM faIfeF su 74p 76*./}vq 76 ro Jf ros 4*./}-}vq 76eyU .A so ]q uq 76icuEKRZXoaYEQp ,vq 76A to |qoss 17hkWhLcA uo xSR /C r 76p SDYE nsq BGMA ]GS_e ELJ faIfeF nsq BIVGMA r + ro Jlwgt\E -} r +rH .A so ]q~yqq 76Nme 0uEKR_FoaA to O]v ,,1-~C~qos 76@EP`:~+,xoq A uo ]me 0u^j{[Qp ,r +A vo TvTzicYEdn ,svA wo ]q r 76z 7:5256658C rqq 74p 76DYb *ZXA xo u BGMA
031*-2./4,+ 5 9678 :UWPWTW JOSULKNRSQSMV KIUIQSM SRQORL;Y``^HGGaaaF`WZW_WFX][FX\ i x if ]wZjnOFp>hfio y wv j |{l @hfoj y w j v|{l ?ihh 21< aU jfki /wv j |{l M ijfml /w j v|{l r qh 21I_Xyix@TAaUN@R_Xy iJbu ihh 21@LkLm[V 正交实验法 正交实验法就是利用排列整齐的表 -正交表来对试验进行整体设计、综合比较、统计分析,实现通过少数的实验次数找到较好的生产条件,以达到最高生产工艺效果。正交表能够在因素变化范围内均衡抽样,使每次试验都具有较强的代表性,由于正交表具备均衡分散的特点,保证了全面实验的某些要求,这些试验往往能够较好或更好的达到实验的目的。正交实验设计包括两部分内容:第一,是怎样安排实验;第二,是怎样分析实验结果。 目录 试验方法 我们知道如果有很多的因素变化制约着一个事件的变化,那么为了弄明白哪些因素重要,哪些不重要,什么样的因素搭配会产生极值,必须通过做实验验证(仿真也可以说是实验,只不过试验设备是计算机),如果因素很多,而且每种因素又有多种变化(专业称法是:水平),那么实验量会非常的大,显然是不可能每一个实验都做的。能够大幅度减少试验次数而且并不会降低试验可行度的方法就是使用正交试验法。首先需要选择一张和你的实验因素水平相对应的正交表,已经有数学家制好了很多相应的表,你只需找到对应你需要的就可以了。所谓正交表,也就是一套经过周密计算得出的现成的实验方案,他告诉你每次实验时,用那几个水平互相匹配进行实验,这套方案的总实验次数是远小于每种情况都考虑后的实验次数的。比如3水平4因素表就只有9行,远小于遍历试验的81次;我们同理可推算出如果因素水平越多,试验的精简程度会越高。 建立好实验表后,根据表格做实验,然后就是数据处理了。由于试验次数大大减少,使得试验数据处理非常重要。首先可以从所有的实验数据中找到最优的一个数据,当然,这个数据肯定不是最佳匹配数据,但是肯定是最接近最佳的了。这是你能得到一组因素,这是最直观的一组最佳因素。接下来将各个因素当中同水平的实验值加和(注:正交表的一个特点就是每个水平在整个实验中出现的次数是相同的),就得到了各个水平的实验结果表,从这个表当中又可以得到一组最优的因素,通过比较前一个因素,可以获得因素变化的趋势,指导更进一步的试验。各个因素中不同水平试验值之间也可以进行如极差、方差等计算,可以获知这个因素的敏感度,等等等等,还有很多处理数据的方法。然后再根据统计数据,确定下一步 实验用培养基配制 > 1 .牛肉膏蛋白胨培养基(用于细菌培养)7.6 ~1000mL ,pH7.4 10g ,NaCl 5g ,水牛肉膏3g ,蛋白胨) 用于放线菌培养号培养基 ( 2. 高氏 1 可溶性淀粉20g ,KNO 3 1g ,NaCl 0.5g ,K 2 HPO 4-·3H 2 O 0.5g ,MgSO 。~7.6 ,水1000mL ,pH7.4 7H 2 O 0.5g, 4 ·,FeSO4 ·7H 2 O 0.01g 配制时注意,可溶性淀粉要先用冷水调匀后再加入到以上培养基中。)培养基(用于从土壤中分离真菌).马丁氏( Martin 3 K 2 HPO 4 1g ,MgSO 4 ·7H 2 O 0.5g ,蛋白胨5g ,葡萄糖10g ,1/3000 孟。30min 121 ℃湿热灭菌100mL, 水900mL ,自然pH ,加拉红水溶液 30 μg/mL). 链霉素含量为时加入链霉素( 待培养基融化后冷却55 ~60 ℃) 用于霉菌或酵母菌培养马铃薯培养基(PDA)( 4. 1000mL ) 20g, 水去皮)200g, 蔗糖( 或葡萄糖马铃薯( 配制方法如下: 将马铃署去皮, 切成约2cm 2 的小块, 放入1500mL 的烧杯中煮沸30min, 注意用玻棒搅拌以防糊底, 然后用双层纱布过滤, 取其滤液. 酵母菌用葡萄糖霉菌用蔗糖, 1000mL, 加糖, 再补足至自然pH. ) )( 用于霉菌培养 5. 察氏培养基 ( 蔗糖硝酸钠培养基蔗糖30g, NaNO 3 2g, K 2 HPO 4 1g, MgSO 4 ·7H 2 O 0.5g, KCl 0.5g, FeSO4 ·7H 7.2 ~2 O 0.1g, 水1000mL, pH7.0 ) ( 用于支原体培养培养基6. Hayflik ~15g, pH7.8 琼脂10g, NaCl 5g, 蛋白胨)1000mL, 或浸出液( 牛心消化液. 8.0, 分装每瓶70mL, 121 ℃湿热灭菌15min, 待冷却至80 ℃左右, 每70mL 中加入马血清 20mL,25% 鲜酵母浸出液10mL, 15 醋酸铊水溶液2.5mL, 青霉素 G 钾盐水溶液(20 万单位以上)0.5mL, 以上混合后倾注平板. 注意: 醋酸铊. , 需特别注意安全操作是极毒的药品 ) 醋酸钠培养基培养基 (McCLary) ( 7 .麦氏葡萄糖0.1g, KCl 0.18g ,酵母膏0.25g ,醋酸钠0.82g, 琼脂l.5g ,蒸馏水 15min 。℃湿热灭菌l00mL 。溶解后分装试管,1l5 ) .反应和甲基红试验用于 V.P 8 .葡萄糖蛋白胨水培养基 ( 蛋白胨0.5g ,葡萄糖0.5g ,K 2 HPO 4 0.2g ,水100mL, pH7.2, 1l5 ℃湿热20min 。灭菌 ) ( 用于吲哚试验9 .蛋白胨水培养基。湿热灭菌20min ~7.4, 121 ℃蛋白胨10g, NaCl 5g, 水1000mL ,pH7.2 ) ( 用于细菌糖发酵试验10 .糖发酵培养基蛋白胨0.2g, NaCl 0.5g, K 2 HPO 4 0.02g ,水100mL ,溴麝香草酚蓝( 质量分数1% 水溶液) 0.3mL ,糖类lg 。分别称取蛋白胨和NaCl 溶于热水中,调pH 至7.4 ,再加入溴麝香草酚蓝( 先用少量质量分数95% 乙醇溶解后,再加水配成质量分数1% 水溶液) ,加入糖类,分装试管,装量 4 ~5cm 高,并倒放入一杜氏 实验五青霉素发酵培养基正交优化试验 [实验目的] 1、掌握培养基的原理 2、了解培养基优化的原理和试验设计方法 3、通过实验确定青霉素发酵的较适培养基 [实验原理] 1、掌握培养基的原理 a碳源、氮源 许多碳源和氮源都是复杂的有机物大分子,如淀粉、黄豆饼粉等,用这类原料作为培养基时,微生物必须要具备分泌胞外淀粉酶和蛋白酶的能力,但不是所有的微生物都具备这种能力的. 相应的酶水解/葡萄糖:成本高 b代谢的阻遏和诱导 碳源、氮源:根据微生物的特性和培养的目的,注意快速利用的碳(氮)源和慢速利用的碳(氮)源的相互配合 葡萄糖:具体利用葡萄糖产生的分解代谢产物会阻遏或抑制某些产物合成所需的酶系的形成或酶的活性. 氮源的诱导或阻遏:蛋白酶类,受培养基中蛋白质或多肽的诱导,而受铵盐、硝酸盐的阻遏;应以有机氮源为主 c合适的C、N比 碳氮:过多则容易形成较低的pH;不足则容易引起菌体的衰老和自溶,显著影响微生物生长繁殖和产物合成。 氮源:过多,菌体生长过于旺盛,pH偏高,不利于代谢产物的积累;不足则菌体繁殖量少,从而影响产量。 碳氮比:菌丝体生长阶段氮源需求高;孢子生长阶段氮源需求低.100:(0.2~2.0) d pH的要求 微生物在利用营养物质后,由于酸碱物质的积累或代谢酸碱物质的形成会造成培养体 系的pH的波动.因而在配制培养基选取营养成分时,除了要考虑营养的需求外,还要考虑其代谢后对培养体系pH缓冲体系的影响 2、培养基优化的原理和试验设计方法 a培养基优化的基本原理 一个批发酵(流加发酵):可以分为生长期和产物形成期两个阶段。 第一阶段:控制菌体的生长,目的是使长好的菌体能够处于最佳的产物合成状态,即如何控制有利于微生物催化产物合成所需酶系的形成。 第二阶段:控制产物的合成;找出影响反应速度变化的主要因素并加以控制使产物的形成速度处于最佳或底物的消耗最经济。 b实验设计方法 单因子实验确定培养基的成分:多因子实验确定各成分对培养基的影响大小及适宜浓度 多因子:通过较少的实验次数获得所需的结果,正交实验设计、相应面分析等 为了追求可比性,正交表中的每个水平都要有适当的重复。正交实验所需的实验次数(NL)是有实验需要的水平数(q)决定的:NL=nq2。n为自然数。 正交表具有3个主要特点:(1)任何两因素之间的都是全面实验,从而保持了可比性。即任何两个因素的各种不同水平的搭配在实验中都出现了,并且出现了相同的次数。(2)任一因素个水平的重复次数相等。(3)绝大多数正交表中各列是等价的,可以任意取用。因此,正交表的实验结果非常易于分析,以至于不需要进行复杂的统计计算,就可直接求出各因素影响的大小、效应的变化趋势等。 正交实验: 1、根据问题的要求确定因子和水平,列出因子水平表 2、根据因子和水平数选用合适的正交表,设计表头,安排实验 3、根据正交表给出的实验方案,进行实验 4、对实验结果进行分析,选出较优的“实验条件”以及对结果有显著影响的因子 [实验材料] 1、菌种:产黄青霉菌(Pencillium chrysogenum);金黄色葡萄球菌(Staphyloco ccusauoreus) 2、培养基 正交实验设计案例分析 45120611戴杰 摘要:正交实验设计法在工业生产中具有广阔的应用领域,但由 于推广不够,在实践少有应用,除了观念上的影响外,对操作方 法的疑惑和不熟悉,也是重要因素。我们小组选取了两个典型案 例,对正交实验设计法的操作方法和步骤进行了介绍。 正交实验设计法在工业生产中具有广阔的应用领域。作为一种科学的实验方法,它以投资少、易操作见效快的特点而为人们所关注,在已经试点过的单位都不同程度地取得了明显效果,受到企业的普遍欢迎。正交实验设计法虽然已经取得了骄人的业绩,但它的推广并不普遍。原因主要是许多企业科学意识差,对正交法缺乏正确认识,不懂操作程序,甚至怕麻烦。鉴于此,我们选择了两个典型案例,对正交法的应用程序和方法做出了说明。 一、双氰胺生产工艺的优化研究 1.1 立项背景 山西省双氰胺厂。1989年引进技术,设计能力为年产双氰胺500t,1990年投产,1991年全年生产双氰胺300t。虽然当时双氰胺出厂价为15000元/t,市场供不应求,但由于该企业产量达不到设计能力,成本很高,年亏损30多万元,企业处于非常困难的境地。 1.2 经诊断发现的问题 (1)双氰胺的主要原材料质量差,有效含氮量低。调查结果:石灰氮最好是一级品占一半,其余为二级品以下。石灰氮产品的行业标准(有效含氮量)是:优级品>=20%,一级品>18%,二级品>17%,次品<17%。经过对比,该厂石灰氮有效含氮量低,是双氰胺消耗高、成本高、产量低的主要原因。 (2)石灰窑CO2气体浓度太低且很不稳定,是制约双氰胺生产的关键因素。经调查发现,CO2气体浓度一般在17%以下,有时12%左右,致使双氰胺车间第一道工序(即水解工序)脱钙速度慢、时间长,是制约双氰胺产量的关键。 (3)双氰胺的生产工艺影响因素多,优化潜力大。经分析认为:水解投料量、水解pH 值、聚合工序的聚合温度、聚合pH值、结晶温度等因素,均对产品质量和消耗有影响。多因素影响正好适用正交法。 1.3 正交法在各生产车间的应用及效果 (1)提高白灰窑CO2气体浓度的正交实验。经调查,投入的煤和石头的比例是由人工估计的,并不计量,每天加料总量和分配的层次随意性很大。由于没有固定的工艺标准,CO2气体浓度既不可能稳定,生产效果也不可能提高。故采取了以下措施:一是安装地磅,投入的煤和石头要求过磅计量;二是实施正交优化。 经计算,石灰窑优化方案的因素水平及实验结果(选用L9(3^4)正交表安排实验)分别如表1、表2所示。 表1 因素水平表正交优化法
实验室常用培养基
青霉素发酵培养基正交优化试验_百替生物
重磅正交试验设计典型案例
