碳碳双键的加成反应
第四章 碳碳双键的加成反应
加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。 4.1催化氢化
催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。 4.1.1多相催化氢化
氢分子和烯烃吸附在催化剂表面,使π键和H-H 键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。
H H C C
H H C C
C C
H H
H
C H
C C H C H
解吸
C H C H
+
有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。 4.1.2影响催化氢化反应的因素 1.温度
(1)升高温度有利于氢化反应,但氢化反应的选择降低。
Ph CH=CH CH=CHCCH 2CH 3
O
H 2
25℃Ph(CH 2)4COCH 2CH 3120℃
260℃
Ph(CH 2)4CHCH 2CH 3
OH
(CH 2
)
4CHCH 2CH 3
OH
(2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。 (3)升温加速催化剂的失活,增加副反应。
因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。 2.压力
增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如Lindlar 催化剂,常压生成烯,加压为烷烃。 3.催化剂
不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。 催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。助催化剂能提高催化剂活性,而抑制剂可部分降低催化剂活性。
C C
+H 2
Pd,BaSO 4C=C
OH
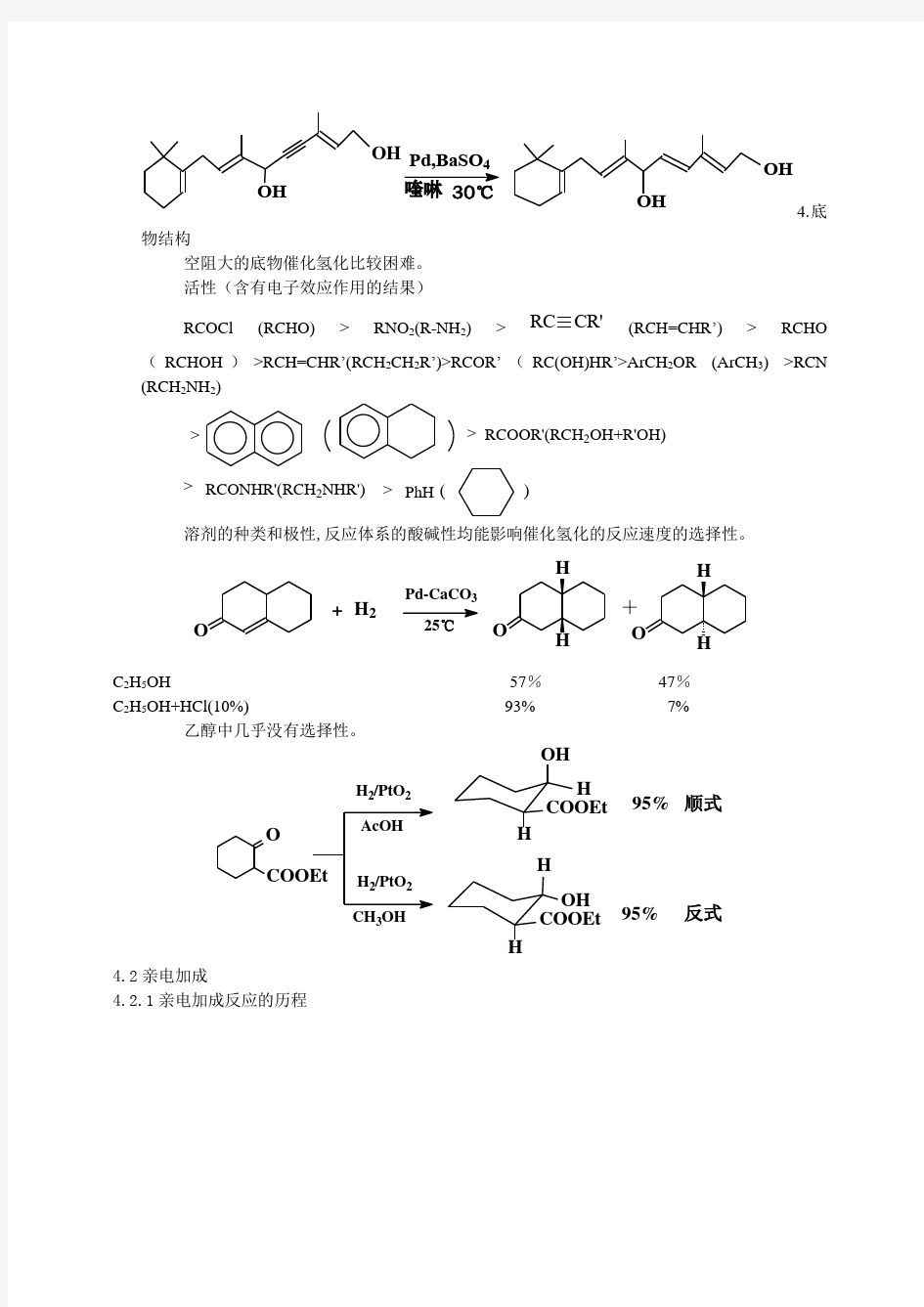
OH 4
喹啉30℃
OH
OH
4.底
物结构
空阻大的底物催化氢化比较困难。 活性(含有电子效应作用的结果)
RCOCl
(RCHO)
>
RNO 2(R-NH 2)
>
RC CR' (RCH=CHR ’)
> RCHO
(RCHOH )>RCH=CHR ’(RCH 2CH 2R ’)>RCOR ’
(RC(OH)HR ’>ArCH 2OR (ArCH 3) >RCN (RCH 2
NH
2
)
>
>RCOOR'(RCH 2OH+R'OH)
>RCONHR'(RCH 2NHR')
>PhH (
)
溶剂的种类和极性,反应体系的酸碱性均能影响催化氢化的反应速度的选择性。
Pd-CaCO 3
+O
+H 2
C 2H 5OH 57% 47% C 2H 5OH+HCl(10%) 93%
7%
乙醇中几乎没有选择性。
O H 2/PtO 2
3OH
H H COOEt H OH H
COOEt 95%95%
顺式
反式
4.2亲电加成
4.2.1亲电加成反应的历程
C C
+E +Nu -慢-
C +
π络合物C E C
+
σ-络合物(碳正离子)
亲电中心C E C
+Nu -C E C
Nu
实验事实:1. 乙烯和溴在NaCl 水溶液中发生了混杂加成,说明反应是分步进行。而且有C +中间体。
CH 2CH 2
+Br 2
H O CH 2BrCH
2
Br -
CH 2BrCH 2Br CH 2BrCH 2Cl CH 2BrCHOH 2
+
CH 2BrCH 2OH
2. 2,3-二甲醛丁烯二酸钠水溶液与Br 2作用得溴代苹果酸的β-内酯,说明C +
中间体存在,反应是分步。
C C
CH 3
COO -
CH 3
COO -
Br 2
C
-CH 3
COO
σ
C-C 转动
C C CH 3
--
OOC CH 3
Br -
3
3
+
CH
4.2.2 亲电加成的立体化学 1.通过溴鎓离子的反式加成
C C +Br Br
C C Br
Br C C COOH
H
H
COOH Br
Br
H COOH Br H
COOH
+H
COOH
Br Br H
COOH dl 外消旋体反式加成
Br
①
②
Br ②
C C
COOH
H
H HOOC
Br H
COOH Br H HOOC H
COOH
Br Br
H HOOC
meso 反式加成
Br ①
②
meso
2.通过碳正离子的反式加成为主的历程 (这时的碳正离子较稳定)
C C Ph
H
CH 3
H +Br 2
CCl 3H
C-C σ转动
C
3H Br
3H 苏式(83%)3H 赤式(17%)
苏式产物相当于反式加成,赤式产物相当于顺式加成。
C C Ph
H
CH 3H
+Br 2
CCl
3
C
3
Br
33
赤式(88%)
苏式(12%)
C-C σ键转动
3. 通过平面碳正离子中间体的非立体选择性加成
CH 3
CH 3
CH 3OH H CH 3
CH 3OH CH 3H
+
2HNO 3
反式(dl ) 顺式(dl )
50%
50%
4.2.3 不对称加成规则
不对称烯烃与不对称试剂的加成是具有区域选择性,为马氏加成。形成了较稳定的碳正离子。 试剂中带部分正电的部分加到具有较多负电荷双键碳上。
CH CH 3
CH 3
CHCH 3HO -
C
OH CH 3CHCH 33C C H
CH 3
CH 3CH 3+HO-Cl
δ+δ-δ-δ+
CF 3
2+
H Br
CF 3CH 2CH 2Br
δ+
δ+δ-
H 2C
+H Br
H 3C
H
C Br
CH 2Br
δ+δ-
供电子基:+C ’>-I
4.2.4 烯烃的羟汞化-脱汞反应
加成方向为马氏加成,是合成醇一种常用方法。 历程
2+Hg(OAc)2
R CH CH
OAc
-
δ-RCHCH 2
HgOAc
OH NaBH 4RCHCH 3OH
++HOAc
CH 3
CH 3
OH
Hg(OAc)H 2
O.EtOH
NaBH 74%
特点是不含发生重排反应。
(CH 3)3CCH=CH 2+H 2O
+
(CH 3)2C CH(CH 3)2
OH
①②Hg(OAc)2
NaBH 4.OH
-(CH 3)3CCHCH 3
OH
94%
重排
4.2.5硼氢化反应
顺式的反马氏加成(形成与结果),事实上是马氏加成。
C
C H +C
H
H BH 2C C
H
H BH 2δ
+
δ-π-络合物
C C
H BH 2H
C C
H H 3
B
H 2O 2OH -
C C
H OH H
δ+
δ-H BH 2
醚
((CH 3)2CHCH 2)3B CH 3+(CH 3CH 2C CH 3CH 3)3B
98%
2%
(CH 3)2C=CHCH 3+BH 3
用这种方法,可以用末端烯烃来合成伯醇。 另一个特点是不会发生重排反应。
CH 2=CH(CH 2)8COOCH 3
BH 3
B(CH 2(CH 2)9COOCH 3)3
I 23ICH 2(CH 2)9COOCH 3
90%
(CH 3)3CCH=CH 2+H 2O
+
(CH 3)2CCH OH
CH 3
CH
3
①②BH 3
H 2O 2.OH -(CH 3)3CCH 2CH 2OH
4.2.6烯烃与卡宾的加成反应
卡宾又叫碳烯,它是价电子层中只有6个电子的二价碳原子,它是一种亲电试剂,与烯烃反应得环丙烷衍生物,分为单线态和三线态。
sp 2
杂化轨道杂化
p 轨道
2
杂化
单线态卡宾
三线态卡宾
三线态为双自由基形式
单线态与烯烃加成时的立体化学为顺式加成(立体专一性)。
Et
H
H Et +
CCl
C H Et
Cl
顺式
一步协同反应 反式
C CH 3
H
C CH 3H
C C
CH 3
H
H
CH 3
CH Me H
Me
Me
H
H Me
+
23%77%双自由基
H CH 3
2CH meso
dl
三线态
卡宾的加成反应为分步反应,几乎无立体选择性。 4.3 自由基加成
4.3.1自由基的产生与自由基加成历程 一、自由基的产生
1、 光解
Ph
C O O O C
Ph
O
hv
2PhCO
O 碎裂
2Ph +2CO 2
过氧化苯甲酰
Me 3C O O CMe 3
hv
2Me 3CO
CH 3CCH 3
O hv
λ=320nm
CH 3CCH 3
O*
+CO
CH
C
O
+CH 3CH 3
激发态 2、 热解
温度一般为50-150℃,共价键发生均裂。
Br
Br
△
2Br
(CH 3)2C CN
N N C(CH 3)2
CN
60-1002(CH 3)2CCN +N 2
C
偶氮二异丁晴
3、 氧化还原反应(发生单电子转移)
ArCOOCAr O O
+Cu
+
ArCO
O -CO 2+ArCO -O
+Cu 2+
二、自由基加成历程
包括链引发、链增长和链传递,在链增长阶段要消耗一个自由基就产生一个自由基,活化能很小。 4.3.2自由基加成反应的方向
CH 3CH CH 2+HBr
过氧化物
CH 3CH 2CH 2Br
稳定性:
>CH 3CH 32
烯烃的自由基加成无立体选择性,中间体可绕C-C σ键旋转,而三键的加成是反式加成(反马氏)
CH 3CH 2C CH +HBr
过氧化物
CH 3CH 2CH 2
C C Br H
H
4.3.3烯烃的自由基加成 1、 加卤素
在非极性溶剂或气相条件下,卤素在光照下与烯烃发生自由基加成。
链引发:Cl Cl
hv
2Cl
链增长
Cl 2C=CCl 2Cl 2C CCl 3+Cl 2
Cl 3C CCl 3+Cl
Cl 2C CCl 3+Cl
链终止:
2Cl 2C CCl 3
Cl 3CCCl 2CCl 2CCl 3
X 2
+RCH 2CH=CH 2hv
RCHCH CH 2
X
(主要)
选择性试剂NBS 、NBC 可避免加成反应,发生 -H 的卤代反应。
+NBS
CCl 4
△
Br
PhCH 2CH 3+NBS
4PhCHBrCH 3
2、 加多卤甲烷
多卤甲烷CCl 4,CBr 4,CBrCl 3,CHCl 3,CHBr 3,CHBrCl 2,CHI 3等均与烯烷发生自由基加成。 历程,链引发
CBrCl 3Br
+
CCl 3C-Br 键弱或CBrCl 3+R
R
Br +
CCl 3
链增长
R'CH=CH 2+CCl 3+BrCCl 3
R'CHCH 2CCl 3Br
+R'CH CH 2CCl 3
32CCl 3
链终止
Cl 3CCCl 3
2CCl 3
而CHBr 3是C-Br 断裂,CHCl 3中是C-H 键断裂,CCl 3是共轭稳定。
3、 加醛
RC H O 引发剂或 hv
RC
O +H +CH 2CHR'
RCCH 2+RC H
O
RCCH 2CH 2R'O
+RCO
RC
O RCCH 2CHR'O
合成酮 4.4烯烃的亲核加成反应
当烯烃的双键碳上带有强的吸电基时可以发生亲核加成。
CH 2CH
2+CH 3Li
不反应
+
CH 3CH 2C
Li
NO 2NO 2
CH 2
C NO 2
NO 2δ+
-CH 3Li
历程
C C
+E Nu
C C
Nu
+E +
碳负离子无立体选择性
+E +
C C
Nu
C C
Nu
E
烯烃双键碳上带有的吸电基越多,中间体碳负离子越稳定,反应越容易发生,反应无立体选择性。
Cl 3C
CH 2
EtOH Cl 3C CH 2CH 2OEt
δδ-+
Michael 加成:
(CH 3)2CH NO 2
(CH 3)2C CH 2
CN
NO 2
+-①②KCN +
+PhCCH CHPh O
CH 2(CO 2C 2H 5)2
PhCCH 2CHCHCO 2C 2H 5
Ph
CO 2C 2H 5
O
δδ
-吡啶3
CH3 O
CH3
O
CHO
CH3
O
CHO
CH2
CH2
C
CH2
CH3
O
C2H5O-
225
CH CH
O
33
OH-CH
3
CH3
O
有机化合物中碳原子的成键特点
第二节有机化合物的结构特点 第1课时有机化合物中碳原子的成键特点??见学生用书P004学习目标练法指导 1.了解碳原子的成键方式。2.能正确使用化学用语,能够书写有机物的结构式、结构简式、电子式等。1.明确原子结构与形成的化学键的关系,进而理解有机化合物种类繁多的原因。 2.由甲烷的结构推出甲烷分子中碳原子与4个氢原子间的空间结构关系。 1.以下有关碳原子的成键特点的说法正确的是() A.在有机化合物中,碳原子一般以4个共用电子对与另外的原子形成4个极性共价键 B.在有机化合物中,碳元素只显-4价 C.在烃中,碳原子之间只形成链状 D.碳原子既可形成有机化合物,也可形成无机物 答案 D 解析碳原子与其他原子可以形成4个共价键,但不一定均为极性键,如碳碳键为非极性键,A错误;在有机化合物中,碳元素不一定只显-4价,如在CH3Cl中,碳显-2价,B项错误;在烃中碳原子之间也可以形成环状,如环己烷,C项错误。 2.下列化学用语正确的是() A.乙烯的结构简式可表示为CH2CH2 B.乙醇的分子式:CH3CH2OH C.甲烷的结构式:CH4 D.甲苯的键线式可表示为
答案 D 解析A项,乙烯的结构简式为CH2===CH2,双键不能省略;B中为乙醇的结构简式,分子式应是C2H6O;C项,甲烷的结构式应 为;D项正确。 3.科学实验表明,在甲烷分子中,4个碳氢键是完全等同的。下面的选项中错误的是() A.键的方向一致B.键长相等 C.键角相等 D.键能相等 答案 A 解析甲烷分子具有正四面体的立体结构,所以它的四个碳氢键的方向不可能一致。 4.下面各种结构都是表示乙醇分子的,其中不正确的是() 答案 A 解析A是键线式,但有3个碳原子,所以是错误的。B、D是乙醇的结构简式,C是乙醇的结构式。 5.下列取代基或微粒中,碳原子最外层电子数均满足8电子结构的是() 答案 C 解析甲基的电子式是;碳正离子中,中心碳原子失去一个电子而带正电荷,中心碳原子周围有6个电子;
精品课件!《高等有机化学》_碳碳双键的加成反应
第四章 习题 1. 写出下列反应的主产物。 (1) CH 2+ NBS ? (2)H 2C CH COOH + HI ? (3) C C H H 3C 3 (4) (CH 3)2C CH 2+ PhSCl ? ? + HOCl 2. 完成下列反应。 RCH 2CH 2 ????2? 3. 把下列各组烯烃按与HOCl 加成的活性大小排列成序。 (1)乙烯、丙烯、2-丁烯 (2)乙烯、溴乙烯、氯乙烯 (3)1-丁烯、2-丁烯、异丁烯 (4)氯乙烯、溴乙烯、1,2-二氯乙烯 (5)1-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯 (6)乙烯、丙烯、丙烯酸 (7)丙烯、异丁烯、2-氯-1-丙烯、3-氯-1-丙烯 4. 完成反应,写出第一步所生成的活性中间体。 (1)CH 2CH COOH + HCl ? (2)CH 2CH CF 3+ HCl ? (3)CH 2CH N(CH 3)3+ HCl ?
(CH 3)2C CH OEt + HCl ? (4)(5)CH 3COCl +CH 2CH 2?3(6)(CH 3)3CCl +CH 2CH 2? 3(7)CH 3OCH 2Cl +CH 2CH 2? 3 CH 3CH 2CH CH (8)?3(9)CH 3CH 2CH CH ?500~7000C CH 3CH 2CH CH ? NBS (10) 5. 写出下列产物的立体结构。 C CH H C CH 2(1)+ Br CCl 4C CH 25CH 2+ Br 2hv (2) (3) C H 3C H C C H C CCH 33(4)Br CH 3CH 2+ HBr (5)+ CCl 2? ? ??? 6. 写出下列反应可能的历程。 (2)(5)CH 2CHCH(CH 3)2+ HBr CH 3CHBrCH(CH 3)2 + CH 3CH 2CBr(CH 3)2(1)CH 2CHC(CH 3)3+ HBr 3CHBrC(CH 3)3 + CH 3CH(CH 3)CBr(CH 3)2(3) 2(CH 3)2C CH 2 + (CH 3)3CCH C(CH 3)2+(CH 3)3CCH 2C CH 2 CH 3 (4)CH 2=CH 2 + Br 2 2BrCH 2CH 2Br + BrCH 2CH 2OH + BrCH 2CH 2Cl CH 2=CH-CH=CH 2 + Cl 2CH OH CH 3OCH 2CH=CHCH 2Cl + CH 2=CHCH(OCH 3)CH 2Cl (6) CH 3CH=CH 2 H +2CH 3 CH 3OH 7. 完成下列转变。
有机化合物中碳原子的成键特点
有机化合物中碳子的成键特点 教学目标 :1、碳原子的成键特点 2、有机分子的空间构型和有机物中碳原子的成键特点的关系 3、有机化合物结构的表示方法:结构式、结构简式、键线式 知识分析 (一)有机物的特点: ①构成有机物质元素少(C、H、O N、S、P),但有机物种类繁多,结构复杂。 ②大多数有机物难溶于水而易溶于汽油、酒精、苯等有机溶剂。 ③绝大多数有机物受热易分解,而且容易燃烧。 ④绝大多数有机物是非电解质,不易导电,熔点低。 ⑤有机物所起的化学反应比较复杂,一般比较慢,并且还常伴随有副反应发生。 (二)有机物中碳原子的成键特点 碳原子位于周期表第W主族第二周期,碳原子最外层有4个电子,碳原子既不易失电子、也不易得电子。有机物种类繁多的原因,主要是由C原子的结构决定的。其成键特点是:(1)在有机物中,碳原子有4 个价电子,碳呈四价,价键总数为4。(成键数目多) (2)碳原子既可与其它原子形成共价键,碳原子之间也可相互成键,既可以形成单键,也可以形成双键或三键。(成键方式多) ①碳原子间的成键方式:C-C、C=C A C ②有机物中常见的共价键:C— C、C=C AC、C-H、C-O C—X、C=O C= N、C—N、苯环。 ③在有机物分子中,仅以单键方式成键的碳原子称为饱和碳原子;连接在双键、叁键或在苯环上的碳原子(所连原子的数目少于4)称为不饱和碳原子。 ④C-C单键可以旋转而C= C不能旋转(或三键) (3)多个碳原子可以相互结合成长短不一的碳链和碳环,碳链和碳环还可以相互结合。{知识回顾} 1共价键的定义:原子间通过共用电子对所形成的相互作用
2、共价键的类型: ①非极性键:由同种非金属原子组成,共用电子对处在成键原子中间。如: ②极性键:由不同种非金属原子组成,电子对偏向于成键原子非金属性强的一方。如:H-CH 3、H3C-OH [小结] 由于乙烯分子中双键的键能小于C-C单键键能的2倍,同时双键中的两个键键能也不相等,即双键中一个键的键能不等于双键键能的1/2,其中一个键的 键能小于另一个键的键能。因此,只需要较少的能量,就能使双键里的一个键断裂。同理乙炔分子中有两个化学键易断裂。 (二)碳原子的成键方式与分子空间构型的关系 当一个碳原子与其它4个原子连接时,这个碳原子将米取四面体取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于同一平面上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于同一直线上。 有机物的代表物基本空间结构:甲烷是正四面体结构(5个原子不在一个平面上);乙烯是平面结构(6个原子位于一个平面);乙炔是直线型结构(4个原子位于一条直线);苯环是平面结构(12个原子位于一个平面)。判断原子是否在同一平面上的关键是判断分子中是否存在饱和碳原子。 四面体型:CH、CH3CI、CCI4 平面型:CH=CH>苯 直线型:CH^ CH [练习]观察以下有机物结构:
加成反应介绍
加成反应 (addition reaction) ?定义 烯烃或炔烃分子中存在键,键键能较小,容易断裂形成两个键。即能在含双键或三键的两个碳原子上各加上一个原子或原子团的反应即为加成反应(多为放热,是烯烃和炔烃的特征反应)。不稳定的环烷烃的开环反应也属于加成反应。 (1)催化加氢 在Pt、Pd、Ni等催化剂存在下,烯烃和炔烃与氢进行加成反应,生成相应的烷烃,并放出热量,称为氢化热(heat of hydrogenation,1mol不饱和烃氢化时放出的热量) ?催化加氢的机理(改变反应途径,降低活化能) 吸附在催化剂上的氢分子生成活泼的氢原子与被催化剂削弱了键的烯、炔加成。 ?氢化热与烯烃的稳定性 乙烯丙烯 1-丁烯顺-2-丁烯反-2-丁烯 氢化热/kJ?mol-1 -137.2 -125.9 -126.8 -119.7 -115.5 (1)双键碳原子上烷基越多,氢化热越低,烯烃越稳定: R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CH2 > CH2=CH2 (2)反式异构体比顺式稳定: (3)乙炔氢化热为-313.8kJ?mol-1,比乙烯的两倍(-274.4kJ?mol-1)大,故乙炔稳定性小于乙烯。 ?炔烃加氢的控制 ——使用活性较低的催化剂,可使炔烃加氢停留在烯烃阶段。
——使用不同的催化剂和条件,可控制烯烃的构型: 如使钯/碳酸钙催化剂被少量醋酸铅或喹啉钝化,即得林德拉(Lindlar)催化剂,它催化炔烃加氢成为顺式烯烃;炔烃在液氨中用金属钠或锂还原,能得到反式烯烃: ?炔烃催化加氢的意义: ——定向制备顺式或反式烯烃,从而达到定向合成的目的; ——提高烷烃(由粗汽油变为加氢汽油)或烯烃的含量和质量。 ?环烷烃的催化加氢 环烷烃催化加氢后生成烷烃,比较加氢条件知,环丙烷、环丁烷、环戊烷、环己烷开环难度依次增加,环的稳定性依次增大。 (2)与卤化氢加成 (a)对称烯烃和炔烃与卤化氢加成对称烯烃和炔烃与卤化氢进行加成反应,生成相应的卤化物: 卤化氢的活性次序:HI HBr HCl (b)不对称烯烃和炔烃与卤化氢加成不对称烯烃和炔烃与卤化氢加成,可能生成两种产物。(Ⅰ)为主要产物。
碳碳双键的加成反应
第四章 碳碳双键的加成反应 加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。 4.1催化氢化 催化氢化分为非均相催化(多相催化)和均相催化。 非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。 4.1.1多相催化氢化 氢分子和烯烃吸附在催化剂表面,使π键和H-H 键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。 H H C C H H C C C C H H H C H C C H C H 解吸 C H C H + 有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。 4.1.2影响催化氢化反应的因素 1.温度 (1)升高温度有利于氢化反应,但氢化反应的选择降低。 Ph CH=CH CH=CHCCH 2CH 3 O H 2 25℃Ph(CH 2)4COCH 2CH 3120℃ 260℃ Ph(CH 2)4CHCH 2CH 3 OH (CH 2 ) 4CHCH 2CH 3 OH (2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。 (3)升温加速催化剂的失活,增加副反应。 因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。 2.压力 增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如Lindlar 催化剂,常压生成烯,加压为烷烃。 3.催化剂 不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。 催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。助催化剂能提高催化剂活性,而抑制剂可部分降低催化剂活性。 C C +H 2 Pd,BaSO 4C=C
烯烃的亲电加成反应
烯烃的亲电加成反应 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
烯烃的亲电加成反应 烯烃的亲电加成反应 与烯烃发生亲电加成的试剂,常见的有下列几种:卤素(Br2,Cl2)、无机酸(H2SO4,HCl,HBr,HI,HOCl,HOBr)及有机酸等。 1.与卤素加成 主要是溴和氯对烯烃加成。氟太活泼,反应非常激烈,放出大量的热,使烯烃分解,所以反应需在特殊条件下进行。碘与烯烃不进行离子型加成。 (1)加溴:在实验室中常用溴与烯烃的加成反应对烯烃进行定性和定量分析,如用5%溴的四氯化碳溶液和烯烃反应,当在烯烃中滴入溴溶液后,红棕色马上消失,表明发生了加成反应,一般双键均可进行此反应。 CH 2=CH 2 +Br 2 →BrCH 2 CH 2 Br 卤素与烯烃的加成反应是亲电加成,反应机制是二步的,是通过环正离子过渡态的反式加成,主要根据以下实验事实: (a)反应是亲电加成:是通过溴与一些典型的烯烃加成的相对反应速率了解的: 可以看到,双键碳上烷基增加,反应速率加快,因此反应速率与空间效应关系不大,与电子效应有关,烷基有给电子的诱导效应与超共轭效应,使双键电子云密度增大,烷基取代越多,反应速率越快,因此这个反应是亲电加成反应。当双键与苯环相连时,苯环通过共轭体系,起了给电子效应,因此加成速率比乙烯快。当双键与溴相连时,溴的吸电子诱导效应超过给电子共轭效应,总的结果起了吸电子的作用,因此加成速率大大降低。
(b)反应是分二步的:如用烯烃与溴在不同介质中进行反应,可得如下结果:上述三个反应,反应速率相同,但产物的比例不同,而且每一个反应中均有 BrCH 2CH 2 Br产生,说明反应的第一步均为Br+与CH2=CH2的加成,同时这是决定反应速率 的一步;第二步是反应体系中各种负离子进行加成,是快的一步。(上述三个反应,如溴的浓度较稀,主要产物为溴乙醇和醚。) (c)反应是通过环正离子过渡态的反式加成,而且是立体选择性的反应(stereoselectivereaction)。所谓环正离子过渡态,是试剂带正电荷或带部分正电荷部位与烯烃接近,与烯烃形成碳正离子,与烯烃结合的试剂上的孤电子对所占轨道,与碳正离子轨道,可以重叠形成环正离子,如 形成活性中间体环正离子,这是决定反应速率的一步。所谓反式加成,是试剂带负电荷部分从环正离子背后进攻碳,发生 S N2反应,总的结果是试剂的二个部分在烯烃平面的两边发生反应,得到反式加成的产物。如下所示: 所谓立体选择性反应是指一个反应可能产生几个立体异构式(如顺式加成产物与反式加成产物),优先(但不是百分之一百)得到其中一个立体异构体(或一对对映体),这种反应称立体选择性反应(参看3.21,5)。上述溴与烯烃的加成,是立体选择的反式加成反应。 以上结果是通过很多实验事实总结得到的。如溴与(Z)-2-丁烯加成,得到>99%的一对苏型外消旋体: 如反应是顺式加成则得到以下产物: 实验结果,顺式加成得到的赤型产物<1%。因此溴与(Z)-2-丁烯的加成是通过环正离子过渡态的反式加成。 习题5-4写出溴与(E)-2-丁烯加成的反应机制、主要产物,并用费歇尔投影式表示,主要产物是苏型的还是赤型的?
