五种核酸提取仪的比较
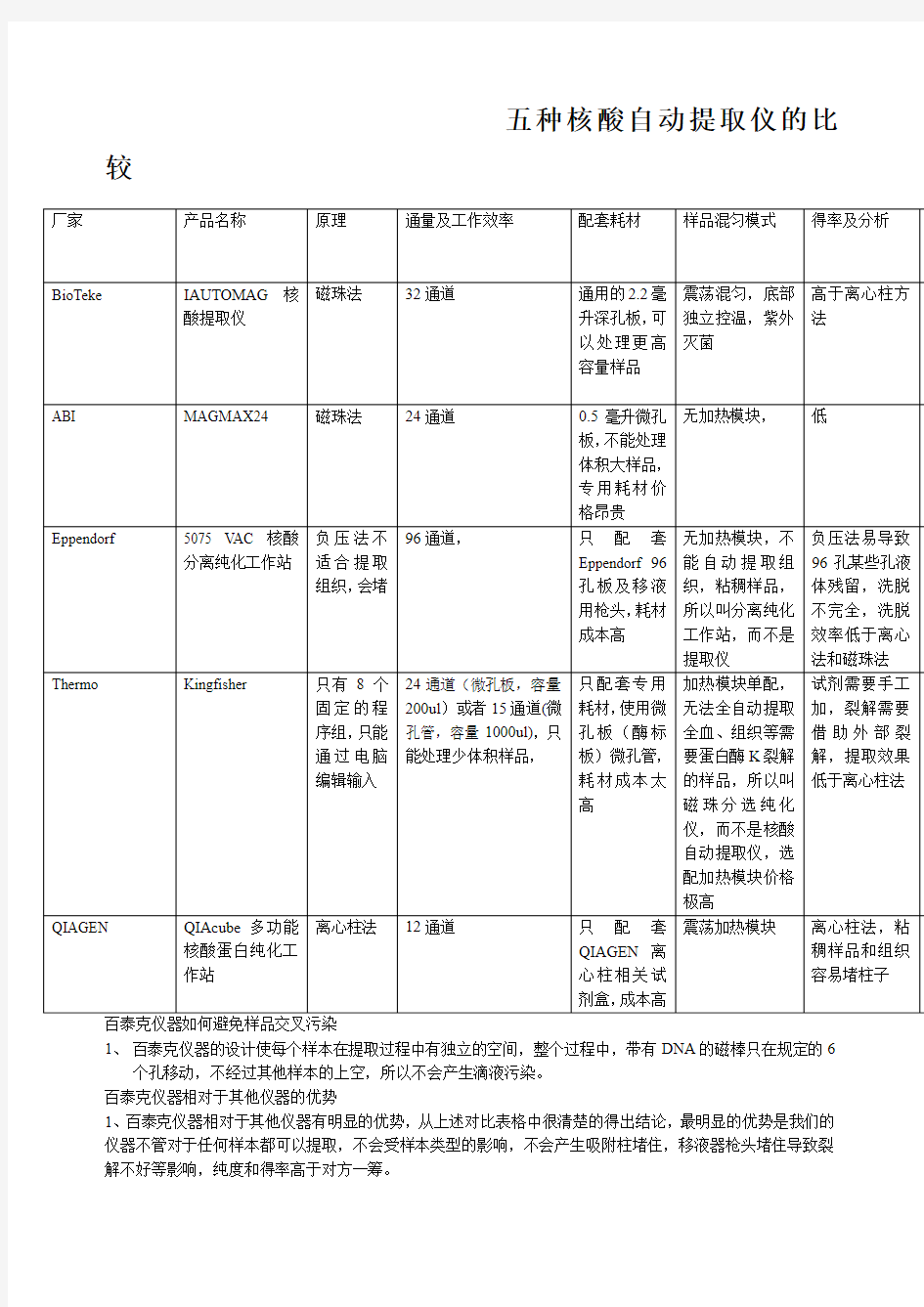
五种核酸自动提取仪的比较
百泰克仪器如何避免样品交叉污染
1、百泰克仪器的设计使每个样本在提取过程中有独立的空间,整个过程中,带有DNA的磁棒只在规定的6
个孔移动,不经过其他样本的上空,所以不会产生滴液污染。
百泰克仪器相对于其他仪器的优势
1、百泰克仪器相对于其他仪器有明显的优势,从上述对比表格中很清楚的得出结论,最明显的优势是我们的仪器不管对于任何样本都可以提取,不会受样本类型的影响,不会产生吸附柱堵住,移液器枪头堵住导致裂解不好等影响,纯度和得率高于对方一筹。
核酸提取新技术
核酸提取新技术 核酸提取被用于许多分子生物化学试验和诊断,是克隆、转化、酶切、体外转录、扩增、测序等试验的第一个步骤。然而由于细胞内存在大量蛋白质、碳水化合物、原始样品中的代谢物以及其它污染物,提取高质量的核酸并非易事。现阶段的层析柱核酸提取方法有: 1、一种新的层析柱技术-双层柱技术 时间:2012年 人物: 美国科学家丁少峰教授和刘强教授 事件: 发明了一种新的层析柱技术-双层柱技术,以及基于该新双层柱的核酸提取方法,用来克服常用的基于硅胶提取和基于阴离子交换提取核酸两者的缺点,使核酸提取方法更加简单、快速、高效、可靠,特别是在血浆和尿液的液体活检中具有非常重要的应用价值13-14。 结构: 双层柱由2种膜组成:第一层为阴离子交换膜二乙胺(DEAE),第二层为二氧化硅膜 (Fig.1)。 原理: (1)样品中的核酸结合到第一层阴离子交换膜上,起核酸浓缩器的作用, (2)已结合的核酸从第一层膜洗脱, 然后结合到第二层二氧化硅膜, 这是因为采用了双功能洗脱/结合液, 也称为耦联液, (3)最终使用低盐缓冲液将游离核酸从第二层膜洗脱,获得目的产物 (Fig.2)。 优点: (1)特别适用于分离和纯化含有极度稀释的大容量的核酸样品,例如10mL血浆或50mL尿液; (2)游离的小片段DNA(80~250bp)回收率高,可比常规硅胶提取法高出4倍, 适用于血浆及尿液游离核酸的提取; (3)不需要蛋白酶处理; (4)提供更高纯度和更少抑制剂的核酸样品; (5)洗脱的核酸可直接用于下游应用, 包括焦磷酸化激活的聚合反应(Pyrophosphorolysis Activated Polymerization,PAP)和聚合酶链式反应(Polymerase Chain Reaction,PCR)、及二代测序等; (6)此外,本方法快速、简便,无需接触苯酚及氯仿等毒性强烈的有机溶剂,无需复杂繁琐的实验操作,操作全程可在短时间内完成。 以下为常用的两种方法。
c16全自动核酸提取仪操作说明
c16全自动核酸提取仪操作说明 仪器构造简介: 1 触控屏HID-Pro 320 2 仪器前门 3 样品盘适配器 4 LED指示灯 5 触摸感应器 1 带滤芯的枪头 2 收集管 3 枪头、洗脱管放置架 4 压板 5 样品槽(可直接放置试 剂板或加装适配器后放置 试剂条) 6 传送轨道 7 试剂条适配器
样品架穿孔工具 1 InnuPure接口 2 网络接口 3 USB接口 简易操作说明: 1.插上仪器电源线,打开仪器背部的电源开关,仪器前面LED指示灯显示红色,此时仪器 为待机状态。用手指轻触触摸感应器圆形键一秒钟(注意,不要使劲按),手指拿开后LED指示灯由红色变为绿色,此时仪器为工作状态。 开机后界面如下图所示:
Menu:菜单 Select protocol:选择程序 Tools:工具 Settings:一般设置 2.样品准备和纯化 1)样品盘放入样品架,打开夹板。 2)将试剂板放入样品槽。试剂板上的红线要 与样品槽上的红点对齐。 3)将条管适配器放入样品槽。同样适配器上 的红点要与样品槽上的红点对齐。
4)将试剂条放入样品槽。注意:有“AJ”字样的一头朝向样品盘上刻字的一边。 5)试剂条管放完后,放下压板。 6)放入枪头和收集管。注意:没放试剂条的位 置不要放。 7)将试剂条管第一和第三孔刺穿,可以使用穿 孔工具也可以使用干净的枪头。(“AJ”字样边为第一 孔) 8)将裂解后的样品加入第一孔。(具体操作详见 试剂盒说明) 9)准备好的样品盘放入仪器内,轻推,样品盘 会自动进入。
10) 根据起始样本选择合适的程序,点击开始即可。 11) 纯化完成后样品盘会自动退出,盖子盖好纯化产物放冰箱保存待用。 3. 软件功能介绍 ① 菜单: 设置新用户、设置开机密码等 ② 日期时间: 设置日期 时间 ③ 选择程序: 开始、导入、删除程序 ④ 工具: 自动校正、仪器初始化、磁力测试等仪器自检功能 ⑤ 一般设置: 用户管理、语言、更新等 ⑥ 版本信息
核酸提取的一些常规方法
1. 乙醇沉淀乙醇沉淀乙醇沉淀乙醇沉淀DNA原理是什么原理是什么原理是什么原理是什么????乙醇能够消除核酸的水化层,使带负电荷的磷酸基团暴露出来。Na+之类的平衡离子能够与这些带电基团结合,在沉淀形成部位降低多核苷酸链之间的排斥作用。因此只有在阳离子的量足以中和暴露的磷酸残基的电荷时才会发生乙醇沉淀。 最常用的阳离子:1)醋酸铵:贮存液10.0mol/L 终浓度 2.0~2.5mol/L 常用于减少多余的杂质(如DNTP及多糖)与核酸的共沉淀。例如在2mol/L醋酸铵存在的情况下连续两次DNA沉淀可从DNA制品中除去>99%的dNTP。在通过琼脂糖酶消化琼脂糖之后沉淀核酸时,使用醋酸铵也是最佳选择,这种阳离子可以减少寡糖消化产物共沉淀的可能性。然而若用沉淀的核酸进行磷酸化时,就不要用醋酸铵沉淀核酸,因为铵离子能够抑制T4噬菌体多核苷酸激酶。2)氯化锂:贮存液8.0mol/L 终浓度0.8mol/L 常用于需高浓度乙醇进行的沉淀(如沉淀RNA)。LiCl在乙醇溶液中的溶解度很高而且不随核酸共沉淀。小分子RNA(如tRNA及5S RNA)在高离子强度下(没有乙醇时)是可溶的,而大分子RNA则不溶。可以利用这个差异在高浓度LiCl(0.8mol/L)中纯化大分子RNA。3)氯化钠:贮存液 5.0mol/L 终浓度0.2 mol/L (0.2 mol/L)用于DNA样品中存在SDS时。这种去污剂在70%乙醇中仍为可溶。4)醋酸钠:贮存液 3.0mol/L(ph5.2)终浓度0.3 mol/L (0.3mol/L,ph5.2)在DNA和RNA的常规沉淀中最为常用。 2. 乙醇沉淀乙醇沉淀乙醇沉淀乙醇沉淀DNA和异丙醇沉淀和异丙醇沉淀和异丙醇沉淀和异丙醇沉淀DNA的区别是什么的区别是什么的区别是什么的区别是什么???? 异丙醇和酒精都是有机溶剂,一般来讲,提取质粒的时候一开始都要用异丙醇沉淀,因为异丙醇沉淀的效果要好一些,如二楼所讲,但最后大多用酒精沉淀,因为酒精容易挥发,对下游的实验影响小。异丙醇比较疏水,能很更好地沉淀核酸,用乙醇的目的是去盐,它比异丙醇更亲水,所以能去掉一些盐离子。有时还用70%的乙醇洗样品也是为了增加盐的溶解度。在沉淀核酸时可用乙醇与异丙醇,乙醇的极性要强于异丙醇,所以一般用2倍体积乙醇沉淀,但在多糖、蛋白含量高时,用异丙醇沉淀可部分克服这种污染,尤其用异丙醇在室温下沉淀对摆脱多糖、杂蛋白污染更为有效。异丙醇沉淀核酸时,高浓度盐存在将使大量多糖存在在溶液中,从而可达到去多糖的作用。但高浓度的盐存在会影响核酸的进一步操作,因此必须用乙醇多次洗涤脱盐。 异丙醇沉淀核酸:优点:为所需容积小且速度快,适用于浓度低,而体积大DNA样品的沉淀。0.54~1.0倍体积的异丙醇可选择性沉淀DNA和大分子rRNA和mRNA;但对5sRNA、tRNA和多糖产物不产生沉淀,一般不需要在低温条件下长时间放置。缺点:易使盐类(如NaCl、蔗糖)与DNA共沉淀;在DNA沉淀中异丙醇难以挥发除去,所以常规需要用70%的乙醇漂洗DNA沉淀数次。 乙醇沉淀核酸:沉淀DNA乙醇是首选的有机溶剂,对盐类沉淀少,DNA沉淀中所含的衡量乙醇易蒸发去处,不影响以后的实验。在适当的盐浓度下,2倍样品容积的95%乙醇可有效沉淀DNA,对于RNA则需要将乙醇量增加至2.5倍. 缺点是总体积较大。需在-20度放置很长时间,30分钟-1小时。同样需要70%乙醇洗涤 “蛋白质的变性”是指蛋白质分子中的次级键被破坏。主要是氢键和离子键。甲醇、乙醇、丙酮等有机溶剂可以提供自己的羟基或羰基上的氢或氧去形成氢键,从而破坏了蛋白质中原有的氢键,使蛋白质变性。而引起蛋白质沉淀的原因一方面是由于甲醇、乙醇、丙酮等有机溶剂加入水中使溶剂介电常数降低,增加了相反电荷的吸引力,另一方面是因为这些有机溶剂是强亲水试剂,争夺蛋白质分子表面的水化水,破坏蛋白质胶体分子表面的水化层而使分子聚集沉淀。
核酸提取仪如何选择及常见误区
核酸提取仪如何选择及常见误区 伴随着大健康基因检测时代的来临以及分子生物学技术的大发展,核酸是分子实验最基本的模板,如何选择一款合适的核酸提取仪就成为了分子实验室最关心的事情,很多人容易陷入选择误区,下面举例说明最常见的二种选择误区: 误区一、核酸提取仪和工作站的区别及选择误区 很多工作站的厂家在推销工作站的时候经常和客户说,工作站提核酸是全自动的,而核酸提取仪是半自动的,客户也主观认为工作站可以移液,提取,什么都能干,好像只要把样本放进去,什么都不用管就可以得到想要的核酸了,等到工作站到位的时候发现,实际情况并不是那样,不仅没想象中的那么好,甚至连基本的提取核酸都困难,那么原因是什么呢? 第一个问题,开盖问题,采血管、唾液保存管、二维码冻存管等的盖子结构都不一样,大小也不一样,厂家也不一样,工作站如何自动化开盖?这个问题就解决不了。 第二个问题,条码录入问题,条形码和二维码,还有一些手动贴的标签和手写的标签,所以扫码还是手动为主,很难自动化。 第三个问题,加液自动化,工作站可以实现自动加试剂,好像是个优势,但是加一个96深孔板需要花15~30分钟左右的时间,而提取一般需要六种试剂,也就是六个板子,大约1.5小时时间,提取试剂很多含有高浓度的乙醇,这么长时间,乙醇浓度会发生改变,影响提取效率和灵敏度,再说了,很多提取仪的厂家(比如百泰克,百源基因等)都有配套预装试剂盒,不需要加液,自动加试剂这个功能就是个鸡肋。提取仪加自动移液工作站的配置就是个套路,通常见某飞公司为了弥补没有预装试剂盒的缺陷,而给客户做的方案。 第N个问题,工作站提取核酸还要解决比如加热,震荡,混匀,磁吸等等问题,每个都是一个模块,你先确定你买的工作站有没有这个模块,还要考虑震荡是否能达到充分混匀的效果,磁珠回收率的问题,有没有配套试剂盒的问题,仪器编程是否简单以及是否有应用工程师能帮你优化提取条件等等问题,毕竟提取高质量的核酸不仅仅需要硬件还需要试剂配套和程序优化。
核酸提取常见试剂的作用原理复习课程
核酸提取常见试剂的 作用原理
异硫氰酸胍 强用力的蛋白质变性剂,能迅速溶解蛋白质,导致细胞结构破碎,核蛋白由于其二级结构的破坏消失而迅速与核酸分离。胍盐是破坏蛋白质三维结构的离液剂,在通常使用的蛋白质变性剂中作用最强的是异硫氰酸胍,它们可以使多数蛋白质转换成一随机的卷曲状态。含有强力的阴离子和阳离子基团,它们可以形成较强的氢键。在还原剂存在的情况下,异硫氰酸胍可以断裂氢键,而去垢剂,如SDS存在的情况下,可以破坏疏水作用。 盐酸胍、尿素 盐酸胍是一个核酸酶的强抑制剂,它并不是一种足够强的变性剂,可以允许完整的RNA从富含RNase的组织中提取出来。 4-8M可断裂氢键,有两种可能机制:1变性蛋白和盐酸胍、尿素优先结合,形成变性蛋白-变性剂复合物,当复合物被除去,从而引起N-D反应平衡向右移动,随着变性剂浓度增加,天然状态的蛋白不断转变为复合物,最终导致蛋白质完全变性;2盐酸胍、尿素对氨基酸的增溶作用,能形成氢键,当浓度高时,能破坏水的氢键结构,结果盐酸胍、尿素就称为非极性残基的较好溶剂,使蛋白质内部的疏水残基伸展和溶解性加强,盐酸胍、尿素引起的变性往往是不可逆的。 高浓度尿素使蛋白质变性并抑制Rnase活性 十二烷基肌氨酸钠 使蛋白质解体变性 巯基试剂 1防止蛋白质或酶等(如辅酶A)分子中SH基团氧化成二硫键,2在某些酶反应过程中维持体系的还原环境。DTT,DDTE、巯基乙醇应用最广,谷胱甘肽也常应用,由于他是生物体内的还原剂,同时氧化后能被谷胱甘肽还原酶原位释放。DNA提取中,常使用巯基乙醇,维持缓冲液的还原环境,防止多酚类氧化,由于具有一定的毒性,浓度不应高于2%。 巯基乙醇 β-巯基乙醇的主要作用是破坏RNase蛋白质中的二硫键(肽和蛋白质分子中的半胱氨酸残基中的键)。
核酸提取仪
核酸提取仪 关键词:核酸提取、核酸提取仪、纳米生物磁珠、核酸提取试剂盒 洛阳惠尔纳米科技有限公司 狄光辉 QQ:625006192 目录
第1章核酸提取技术 (4) 1.1 核酸提取技术的发展 (4) 1.2 核酸提取方法 (6) 1.2.1 CTAB法 (6) 1.2.2 离心柱子法(质粒为例) (7) 1.2.3 碱裂解法(质粒为例) (8) 1.2.4 胍盐裂解法(植物为例) (10) 1.2.5 酚抽提法(全血为例) (12) 1.2.6 Trizol法(动物组织为例) (13) 1.2.7 磁珠法(植物为例) (16) 1.3 核酸提取下游实验 (17) 1.3.1 PCR (17) 1.3.2 转基因 (18) 1.3.3 构建基因文库 (18) 1.3.4 分子测序 (18) 1.3.5 分子诊断 (19) 1.3.6 亲子鉴定 (19) 1.3.7 法医鉴定 (19) 1.3.8 基因敲除 (20) 1.3.9 基因芯片 (20) 1.3.10 动植物资源保存鉴定 (20) 第2章核酸提取仪 (21) 2.1 核酸提取仪的应用领域 (21) 2.1.1 基因组学 (21) 2.1.2 CDC (21) 2.1.3 临床样品的分子诊断 (21) 2.1.4 畜牧兽医 (21) 2.1.5 法医学的应用 (22) 2.2 核酸提取仪的结构 (22) 2.2.1 磁棒式提取仪 (22) 2.2.2 工作站提取仪 (24) 2.3 核酸提取的步骤 (26) 2.4 国外核酸提取仪的巨头公司 (26) 2.4.1 美国贝克曼库尔特有限公司 (27) 2.4.2 雅培 (27) 2.4.3 罗氏 (27) 2.4.4 QIAGEN (27) 2.4.5 Thermo (28) 2.4.6 贝克曼 (28) 2.4.7 ABI (29) 2.4.8 Promega (31) 第3章国内核酸提取仪厂家及型号介绍 (33) 3.1 台灣圓點奈米技術股份有限公司 (33)
abi自动核酸提取仪简明用户手册
MagMAX TM Express简明用户手册 Nov 2009
一、MagMAX Express TM 简介 MagMAX Express24用于在微孔板中自动转移和处理磁珠,依靠套有一次性使用、特别设计的磁头套的磁力棒和微孔条来完成。使用96孔板格式可以方便地与已有的液体操作工具相匹配。根据相应的试剂盒指导,样品、试剂、磁珠被放置在孔中。在提取过程中,仪器不需吸取液体。用户通过面板选用的操作流程预先储存在仪器中。 二、功能描述 1。结构(图2-1,图2-2,图2-3,图2-4) 图2-1 MME24前视图 图2-2 MME24前视图(开盖) 图2-3 MME24后视图 图2-4 MME24内视图 2。功能 MME24可同时操作两块96孔板和与磁头套相匹配的微孔条。运行时,托板不动,只有固定磁力棒和磁头套的部分移动。该部分由可上下移动的两个框架组成,一个用于固定磁力棒(12个× 2 开关 电源 风扇 串口RS-232C 托板 磁头套支架磁头套滑槽 磁力棒支架
组),另一个用于固定塑料磁头套(图2-5)。 一个样品板可容纳12条单独的微孔条;处理一个样品用一条带8个孔的微孔条。带12个头的一个磁头套用于在一块板上同时处理12个样品。 在开始仪器程序前,先把样品和试剂分配到不同的孔中(各成分在孔中的具体分配参考附录1),并把磁头套安装到滑槽上,然后把板子放到可移动的托板的相应位置并推回原位。在程序运行过程中,顶盖和前盖可以打开或关闭(图2-1,图2-2)。关闭盖板可以保护处理的样品不受环境污染。 提取基于反向磁珠处理(MPP )技术(图2-6)。不同于一般的移动液体,而是把磁珠依次从含有不同试剂的一个微孔中移动到另一个。磁珠借助于包着一次性特殊设计的塑料磁头套的磁力棒来移动。 图2-5 MagMAX TM Express 图2-6 反向磁珠处理(MPP )技术 磁力棒 磁头套 转移 收集前悬浮 磁珠 收集磁珠 磁珠附在 磁头套表面 磁珠释放
A包全自动核酸提取仪技术参数要求如下
A包全自动核酸提取仪技术参数要求如下: 主要技术参数: ★1、移液针数≥8通道。 2、可自动一次性连续处理≥32个样本。单个样品可独立进行处理。 3、针对病毒样本,同时处理1—32个内参样本。 4、配有枪头缺失和凝块感应系统。 ★5、可以从动植物、昆虫、血清、血浆、组织、粪便、培养细胞等样本中纯化病原体(包括细菌和病毒)基因组DNA/RNA、mRNA,可以从痕量样本中纯化基因组DNA; 6、系统具有后处理功能,能按照用户设定程序完成,稀释、分装、配试剂等操作无需手工、避免污染。 7、试剂盒未完全使用,可暂时封存,有效期内仍可正常使用,避免多余试剂的浪费。 8、可兼容多种上样方式,包括1.5/2.0ml离心管、IC毛细管、离心适配器、1—4块96孔板等。 9、可以快速、灵活地对各种格式的样品条形码进行自动识别与纪录,并自动生成信息文件。可以兼容整合进入实验室信息管理系统。 ★10、上样体积最小为10ul。洗脱体积可选择。 11、洗脱方式可分装至1.5/2.0ml离心管、96孔板、毛细管等多种实验室常用耗材中。 12、配有加热位,样本裂解步骤在机内完成。 13、配备有冷却洗脱位,保证纯化得到的核酸不致降解。 一般技术参数: 1.应用程序可永久免费在线升级。 2.内置USB接口以及100M网卡接口,可直接网络连通。 3.高通量组织研磨仪,配以适当的适配器,可以在3分钟同时完成48-192个样本的研磨前处理。可处理样本种类包括动植物、昆虫组织等,研磨频率10-30Hz。 4、有紫外消毒装置,可对全仪器进行消毒杀菌。 5、有防滴液装置,防止液体滴落污染台面;全封闭仪器设计。 6、软件自动计算所需实验试剂的体积。 配置要求: 1.主机一台,电脑一台。 2.样品前处理:高通量组织研磨仪一台;冷冻研磨附件。 B包SPR生物检测仪技术参数要求如下: 主要技术参数: ★1. 检测通道:矩阵式多通道检测,最多可同时检测≥300个以上相互作用。 2. 分析物与探针矩阵作用方式: 分析物与矩阵内所有生物探针同时作用。 3. 检测样品范围:样品无需标记,可检测任何生物大分子,包括核酸、蛋白质、多糖及其他化合物。 ★4. 检测灵敏度:≥8 pg/mm2。 ★5.线性检测范围: 0.05%-10% 反射变化 6. 数据采集方式:实时数据-图像采集,监控动力学曲线;可选择连续或断续收集数据。同时采集所有作用点的图像数据. 7. 检测模式:高敏感度近红外CCD摄像机。 8. 偏振控制模式:S-偏振光反应。 一般技术参数: 1.光源波长:750nm-850nm 2.最小静止样品量:≤8.5μL。 3.最小流动样品量:≤ 95μL。 4.循环样品流速:0-650μL 可调。 5.样品池温度可调:最高≥60°C.
QIAcube全自动核酸提取仪技术参数
QIAcube技术参数 1、主要用途: 1)可从动物,植物组织,全血中的白细胞组分及以下法医特殊检材中纯化总DNA(基因组DNA和线粒体DNA):表面和口腔拭子,FTA和Guthrie,体液斑,口香糖,烟蒂,指甲和毛发,纸质材料,小体积血液或唾液,组织,激光显微切割标本,骨头和牙齿,性侵犯样品等; *2)可对性侵犯混合样本进行精子细胞和女性上皮成分全自动化差异洗涤,得到单一男性组分; 3)可对STR产物进行净化,达到纯化和浓缩STR产物的目的,进而大幅度提高毛细管电泳步骤中检测的信噪比。 2、工件条件: 温度:18-28℃,湿度:15-75%,电压:220-240V。 3、技术指标: 1、*基于硅胶膜离心法的全自动样品制备装置。可实现样品裂解、裂解液转移、离心柱清洗、洗脱液回收等实验步骤的全自动操作,无需人工介入; 2、无需专用的自动化试剂盒,只需普通手工试剂盒即可实现自动化; 3、*有专门应用于法医领域的体液和血液、法医案件、FTA及Guthrie卡、表面及口腔拭子等检材纯化程序; 4、*有专门针对性侵犯混合斑检材的全自动化处理程序,无需手工进行女性成分洗涤去除工作; 5、每次可对1-12个样品进行纯化,样品数目可按需设置; 6、内置控制系统,无需电脑; 7、程序的选择和设置通过触摸屏完成; 8、*配备自动裂解模块,具有加热和震荡功能,最高加热温70℃,兼容圆底离心管和锥形底离心管; 9、配备自动离心模块,离心机安全盖可自动开合; 10、配备自动液体转移机械臂,可使用一次性带滤芯枪头进行液体转移;配备离心柱转移机械臂,可对离心柱进行夹放、旋转、丢弃操作; 11、*配备光学感应器和超声液面探测器,能够自动感应检查样品数目、移液枪头数目、移液枪头类型、离心管数目及摆放状态、试剂液面高度等,防止人为摆放错误; 12、预装有各种应用的纯化程序,并可通过网络免费下载不断开发的新程序,使用USB接
法医实验室几种常用DNA提取方法及比较
法医实验室几种常用DNA提取方法及比较 (一)Chelex100法 原理:Chelex100是一种螯合树脂,由苯乙烯、二乙烯苯共聚体组成,含有成对的亚氨基二乙酸盐离子,起着螯合基团作用,对多价金属离子有极强亲和力。在低离子强度、碱性及100℃煮沸条件下,可以使细胞膜裂解,并使与DNA结合的蛋白质变性,DNA游离。检材基质中一般含有大量金属离子,在低离子强度及加热条件下,金属离子可以辅助脱氧核糖核酸酶降解DNA,也可以抑制PCR反应,所以在提取DNA时,加入Chelex100,螯合了金属离子,防止了DNA降解,提高了PCR扩增成功率。 方法:剪取适量血斑、精斑、汗斑、鼻涕斑、指甲、毛根、软组织等等生物检材,置于0.5ml 离心管内,加入适量纯水,室温浸泡,13,000rpm离心5min,上清丢弃,管底留约20μl左右液体及检材基质,加入100-200μl 5%Chelex100(有时需加适量PK)56℃15min至数10小时不等,100℃8min,13,000rpm离心5mim,上清备用。 评述: Chelex100法已经成为DNA提取的基本方法,Chelex100法是万能的。目前,我们一切纯化方法都在Chelex100法的基础上进行,Chelex100法又不是万能的。 Chelex100法提取前的检材清洗非常重要,因为现场检材往往均较脏,脏东西可以抑制PCR 反应,所以往往不止清洗一次,清洗检材时可能损失部分DNA。所以应平衡清洗抑制剂与损失DNA之间的关系。特别强调清洗时应“把根留住”,很多情况下已知样本DNA检验失败的原因是把根没有留住。DNA检验时还有另外一句名言:“一个萝卜一个坑”,防止混乱检材。肝素抑制PCR反应,血红素抑制PCR反应,所以长时的浸泡、多次清洗往往可能洗除肝素及血红素。在已知样本多次无检验结果疑为肝素抗凝的情况下,多洗是检验成功所必须的。血红素对普通Taq酶的抑制作用是明显的,而目前mtDNA扩增一般用普通Taq酶,所以同一样品除进行STR检验外尚需进行mtDNA检测时,尽量去除干净血红素,显得尤为重要。现场提取毛发或样本毛发,用毛根进行STR检验时,纯水清洗也非常重要,如果没有清洗干净,毛根DNA本身很少,很易检出为混合型。因为现场毛发及样本毛发很易粘附另一人成份。毛根清洗的特点为振荡洗涤,不离心,多换水。 清洗后检材中加入5%Chelex100量视检材而定。检材参考加入量 0.5×0.5cm血斑150ul-200ul 二步法精斑100ul 毛根10ul 烟头30-50ul 对于组织,难溶检材,有疑问检材,均可加入终浓度为100ug/ml左右PK,有时间隔一段时间,补加适量PK,PK(蛋白水解酶K)作用最佳pH为8.0。 5、加入Chelex100后,56℃浸泡时间,血斑≥15min;组织≥30min,二步法精斑≥1h。 6、PCR扩增前应离心。PCR扩增时不应吸入Chelex100,因为Chelex100为PCR抑制剂。 7、Chelex100使用浓度5%,有些人用10%,有些人用20%,各人爱好。配制好5%Chelex100 pH应在10—11之间,否则应丢弃,不应人为调整Chelex100悬液pH值。 (二)有机法 原理:有机法提取DNA一般是指用平衡酚(又叫饱和酚)、氯仿等按不同比例混合,采用不同方法提取DNA。DNA易溶于水,不溶于有机溶剂,蛋白质分子表面带有亲水性基因,很容易进行水合作用,并在表面形成一层水化层,使蛋白质分子能够顺利地进入到水溶液中,形
核酸自动提取仪
核算提取仪 北京贝尔生物工程有限公司 PCR室 一.核酸提取技术
随着近年来分子生物学技术的高速发展,核酸扩增,核酸杂交将成为进行病原菌微生物检测,物种鉴定,物种起源、多样性评估及其亲缘关系、系统计划等常用研究手段之一。这样的分子检测和分子诊断技术在人体健康体检、视频法医等领域中具有至关重要的作用。而在所有的现代分子生物学检测技术首先面临的问题就是如何从样品中快速有效的分离提取所需的基因组核酸,并且大规模高质量的提取核酸分子也成为了一个挑战。 自1869年人类首次发现核酸分为脱氧核当核酸(DNA)和核糖核酸(RNA),核酸的提取方法包括各种实验材料和试剂都一直在进行着改进,柠檬酸钠、RNase、SDS、硫氰酸胍等先后应用于核酸的提取。现今核酸的提取方法中主要有一些传统的方法比如CTAB法、Trizol法、氯化锂法、以及一些新兴的方法比如旋转离心柱提取法、玻璃粉吸附法、二氧化硅基质法、阴离子交换法、纳米磁珠提取法。总的来讲,不管采用什么样的方式方法进行核酸的提取以及纯化,主要可以分为以下三步: 第一步为利用物理或化学的方式促进细胞破裂,使细胞中的核酸释放出来。 第二步是初步的将核酸与细胞内部的蛋白质、多糖、脂类分离。新兴的方法比如旋转离心柱提取法是利用特定的载体,将释放的核酸吸附在特定的载体上,这种载体有且仅对于核酸具有较强的亲和力和吸附力。 第三步则是将核酸进行最后的洗脱与富集。 虽然具有相通的原理,对比传统的核酸提取法与新兴的核酸提取法,传统的核酸提取技术中包含的沉淀和离心等操作需要用到大量的生物样本,而且传统提取步骤较为繁杂,费时长,效率低下,很难实现自动化以及规模化,大部分方法涉及到有机试剂的使用,对于操作人员具有潜在的威胁,其应用的范围受到了明显的局限。因此,随着时间的推移,传统的从液相系统中分离提取核酸的方式逐步的被以固相吸附物载体为基础的新方法所取代。 二、磁珠核酸提取法 20世纪90年代,磁珠提取核酸的方法是为了适应现代分子生物学检测实验高通量、高灵敏度、自动化的操作需要所打造的方法。该方法是纳米技术与生物
五种核酸提取仪的比较.doc
五种核酸自动提取仪的比较 厂家产品名称原理通量及工作效率配套耗材样品混匀模式得率及分析样本裂解单个样品样本是否需要预 方式提取成本处理 (人民币 ) BioTeke IAUTOMAG核酸磁珠法32 通道通用的毫升震荡混匀,底部高于离心柱方组织块直10-15 元不需要提取仪深孔板,可独立控温,紫外法接加入,不 以处理更高灭菌需要预先 容量样品研磨过夜 消化 ABI MAGMAX24 磁珠法24 通道毫升微孔无加热模块,低需要样品20-30 元预消化 5 小时或 板,不能处预先研磨者过夜 理体积大样过夜消化 品,专用耗 材价格昂贵 Eppendorf 5075 VAC 核酸分负压法不96 通道,只配套无加热模块,不负压法易导致需要样品20-30 元预消化 5 小时或
离纯化工作站适合提取Eppendorf 能自动提取组96 孔某些孔预先研磨者过夜 组织,会96 孔板及移织,粘稠样品,液体残留,洗过夜消化 堵液用枪头,所以叫分离纯脱不完全,洗 耗材成本高化工作站,而不脱效率低于离 是提取仪心法和磁珠法 Thermo Kingfisher 只有 8个24 通道(微孔板,容只配套专用加热模块单配,试剂需要手工需要样品20-30 元预消化 5 小时或固定的程量 200ul )或者 15 通耗材,使用无法全自动提加,裂解需要预先研磨者过夜 序组,只道(微孔管,容量微孔板(酶取全血、组织等借助外部裂过夜消化 能通过电1000ul) ,只能处理少标板)微孔需要蛋白酶 K裂解,提取效果 脑编辑输体积样品,管,耗材成解的样品,所以低于离心柱法 入本太高叫磁珠分选纯 化仪,而不是核 酸自动提取仪, 选配加热模块 价格极高
核酸自动提取仪
北京贝尔生物工程有限公司 核算提取仪 北京贝尔生物工程有限公司 PCR室 1
北京贝尔生物工程有限公司 一.核酸提取技术 随着近年来分子生物学技术的高速发展,核酸扩增,核酸杂交将成为进行病原菌微生物检测,物种鉴定,物种起源、多样性评估及其亲缘关系、系统计划等常用研究手段之一。这样的分子检测和分子诊断技术在人体健康体检、视频法医等领域中具有至关重要的作用。而在所有的现代分子生物学检测技术首先面临的问题就是如何从样品中快速有效的分离提取所需的基因组核酸,并且大规模高质量的提取核酸分子也成为了一个挑战。 自1869年人类首次发现核酸分为脱氧核当核酸(DNA)和核糖核酸(RNA),核酸的提取方法包括各种实验材料和试剂都一直在进行着改进,柠檬酸钠、RNase、SDS、硫氰酸胍等先后应用于核酸的提取。现今核酸的提取方法中主要有一些传统的方法比如CTAB法、Trizol法、氯化锂法、以及一些新兴的方法比如旋转离心柱提取法、玻璃粉吸附法、二氧化硅基质法、阴离子交换法、纳米磁珠提取法。总的来讲,不管采用什么样的方式方法进行核酸的提取以及纯化,主要可以分为以下三步: 第一步为利用物理或化学的方式促进细胞破裂,使细胞中的核酸释放出来。 第二步是初步的将核酸与细胞内部的蛋白质、多糖、脂类分离。新兴的方法比如旋转离心柱提取法是利用特定的载体,将释放的核酸吸附在特定的载体上,这种载体有且仅对于核酸具有较强的亲和力和吸附力。 第三步则是将核酸进行最后的洗脱与富集。 虽然具有相通的原理,对比传统的核酸提取法与新兴的核酸提取法,传统的核酸提取技术中包含的沉淀和离心等操作需要用到大量的生物样本,而且传统提取步骤较为繁杂,费时长,效率低下,很难实现自动化以及规模化,大部分方法涉及到有机试剂的使用,对于操作人员具有潜在的威胁,其应用的范围受到了明显的局限。因此,随着时间的推移,传统的从液相系统中分离提取核酸的方式逐步的被以固相吸附物载体为基础的新方法所取代。 二、磁珠核酸提取法 20世纪90年代,磁珠提取核酸的方法是为了适应现代分子生物学检测实验高通量、高灵敏度、自动化的操作需要所打造的方法。该方法是纳米技术与生物 2
