初中化学相对原子质量表
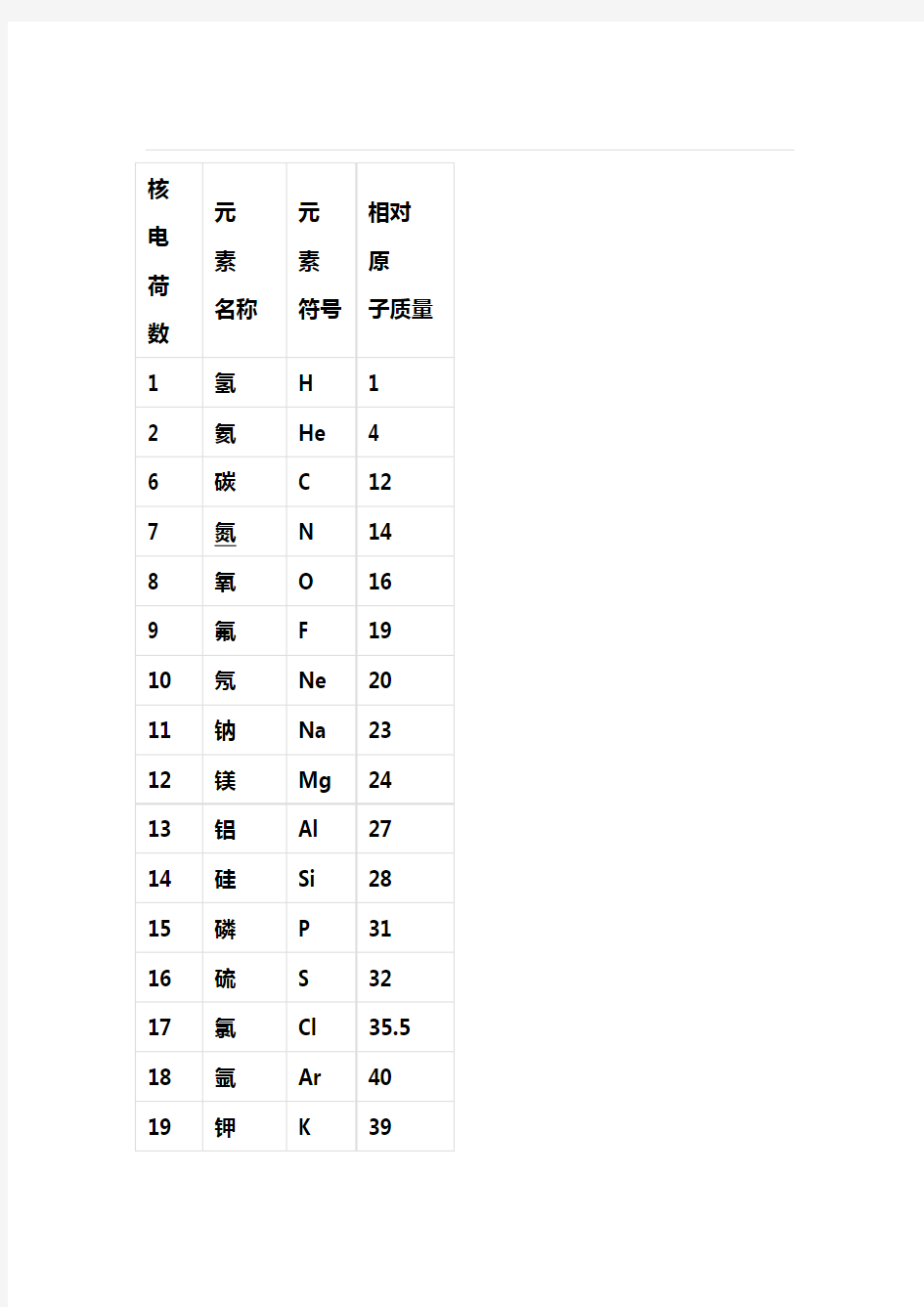

相对原子质量表
相对原子质量表 ——(1-56H-Ba)—— 原子序数元素名称元素符号相对原子质量1氢H1 2氦He4 3锂Li7 4铍Be9 5硼B10.8 6碳C12 7氮N14 8氧O16 9氟F19 10氖Ne20 11钠Na23 12镁Mg24.3 13铝Al27 14硅Si28 15磷P31 16硫S32
17氯Cl35.4 18氩Ar40 19钾K39 20钙Ca40 21钪Sc50 22钛Ti47.8 23钒V51 24铬Cr52 25锰Mn55 26铁Fe55.8 27钴Co59 28镍Ni58.6 29铜Cu63.5 30锌Zn65.4 31镓Ga69.7 32锗Ge72.6 33砷As75 34硒Se79 35溴Br80 36氪Kr83.798(2) 37铷Rb85.4678(3) 38锶Sr87.62(1)
40锆Zr91.224(2) 41铌Nb92.90638(2) 42钼Mo95.94(2) 43锝Tc[97.9072] 44钌Ru101.07(2) 45铑Rh102.90550(2) 46钯Pd106.42(1) 47银Ag107.8 48镉Cd112.411(8) 49铟In114.818(3) 50锡Sn118.7 51锑Sb121.760(1) 52碲Te127.60(3) 53碘I127 54氙Xe131.293(6) 55铯Cs132.9054519(2) 56钡Ba137.3——(57-71La-Lu镧系)—— 原子序数元素名称元素符号相对原子质量57镧La138.90547(7) 58铈Ce140.116(1) 59镨Pr140.90765(2)
元素相对原子质量表
原子序数元素名称元素符号相对原子质量 1 氢 H 1.007 94(7) 2 氦 He 4.002 602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012 182(3) 5 硼 B 10.811(7) 6 碳 C 12.017(8) 7 氮 N 14.006 7(2) 8 氧 O 15.999 4(3) 9 氟 F 18.998 403 2(5) 10 氖 Ne 20.179 7(6) 11 钠 Na 22.989 769 28(2) 12 镁 Mg 24.305 0(6) 13 铝 Al 26.981 538 6(8) 14 硅 Si 28.085 5(3) 15 磷 P 30.973 762(2) 16 硫 S 32.065(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.098 3(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955 912(6) 22 钛 Ti 47.867(1) 23 钒 V 50.941 5(1) 24 铬 Cr 51.996 1(6) 25 锰 Mn 54.938 045(5) 26 铁 Fe 55.845(2) 27 钴 Co 58.933 195(5) 28 镍 Ni 58.693 4(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1) 32 锗 Ge 72.64(1) 33 砷 As 74.921 60(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.467 8(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.905 85(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.906 38(2) 42 钼 Mo 95.94(2) 43 锝 Tc [97.9072]
九年级化学中考相对原子质量相对分子质量专题.全国通用
相对原子质量相对分子质量 1 2、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量比、 1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。 2、相对分子质量:表示物质的化学式里所有原子的总和。相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1” 1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得 2、硫酸(H2SO4)的相对分子质量是98克,对吗? 3、为什么质子数和中子数的和近似等于相对原子质量? 4、如何计算胆矾(CuSO4·5H2O) 相对分子质量? 5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么? 例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,求
例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( ) A、 72 B、 160 C、 232 D、 256 思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。本题求化学式的方法有两种,请同学们自己推出。 例题3 一种含氧化铁的铁矿石,经测定含铁49%。求矿石中氧化铁的质量分数。 思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。 矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数 巩固知识 1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。 2、晶碱(Na2CO3·10H20)的相对分子质量是,晶碱中结晶水的质量分数为。 3、已知XgR2O中含有YgR,则表示R的相对原子质量的代数式为( ) A、(X-Y)/16 B、8Y/(X-Y) C、16/(X-Y) D、(X-Y)/8Y 4、原子中决定相对原子质量大小的主要微粒 ..是( ) A、质子 B、质子数 C、质子和中子 D、质子数和中子数 5、下列物质中,铁元素的质量分数最大的是() A、Fe2O3 B、FeO C、FeS D、Fe3O4 6、质量相等的CO和CO2中,氧元素的质量比为() A、1:1 B、11:14 C、1:2 D、2:1
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5142 氧气O232 氢氧化钙(熟石灰)Ca(OH)274 氯气Cl271 氢氧化铜Cu(OH)298 氨气NH317 氢氧化钠NaOH 40 氮气N228 过氧化氢(双氧水)H2O234 一氧化碳CO 28 碱式碳酸铜(绿)Cu2(OH)2CO3222 二氧化碳CO244 盐酸(氯化氢)HCl 36.5 一氧化硫SO 48 氯化钙CaCl2111 二氧化硫SO264 氯化钾KCl 74.5 三氧化硫SO380 氯化铁(淡黄 FeCl3162.5 溶) 二氧化锰MnO287 氯酸钾KClO3122.5 碳酸H2CO362 高锰酸钾(灰锰氧)KMnO4158 碳酸钙CaCO3100 硫酸铜(白固蓝 CuSO4160 溶) 碳酸氢铵NH4HCO379 硫酸钠Na2SO4142 硝酸HNO363 硝酸铵NH4NO380 硫酸H2SO498 甲烷CH416 亚硫酸H2SO382 尿素CO(NH2)260 磷酸H3PO498 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H226 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO 72
硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
常见物质的相对原子质量分别是多少
常见物质的相对原子质量分别是多少 由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为1.674×10?2?千克,一个氧原子的质量为2.657×10?2?千克。一个碳-12原子的质量为1.993×10?2?千克。元素的相对原子质量是其各种同位素相对原子质量的加权平均值。元素周期表中最下面的数字为相对原子质量。今天小编就来介绍一下我们初中阶段常见物质的相对原子质量分别是多少。 常见物质的相对原子质量:
相对原子质量的易错点: 1. 如果在元素符号前面添上系数,就只表示该元素原子个数,不能表示该元素。如:H既表示氢元素,又表示一个氢原子;2H只能表示两个氢原子。 2. 相对原子质量只是一个比,不是原子的实际质量。 3. 在相对原子质量计算中,所选用的一种碳原子是碳12,是含6个质子和6个中子的碳原子,它的质量的1/12约等于1.66×10-27 kg。 常见物质的相对原子质量记忆方法: 1.相对原子质量等于质子数与中子数的和。H没有中子,那么原子质量就是1.。随着原子序数的增加,质量也增加。 2.第二周期记住C、N、O即可。C为12,N为14,O为16。 3.接下来是第三周期,相对更重要一些Na为23,Mg为24, Al为27,Si为28,P为31, S为32,Cl为35.5。这几个是常用的,所以在用的时候多看看书,或者拿一张纸专门记这几个原子质量,需要用的时候看看,看的多了自然就记住了。还有K为39,Ca为40,Fe为56, Cu为6 4.这几个也是同样的道理。 4.至于其他的一些,通常都是在某一种专有的化合物中出现,如KMnO4等,这些就只要记住化合物的质量就行,不必专门记Mn了。
相对原子质量表模板
相对原子质量表
相对原子质量
物质与氧气的反应: (1)单质与氧气的反应(化合反应): 镁在空气中燃烧:2Mg+O2点燃 2MgO 铁在氧气中燃烧: 3Fe+2O2点燃 Fe3O4 铜在空气中加热: 2Cu+O2△ 2CuO 铝在空气中燃烧: 4Al+3O2点燃 2Al2O3 氢气在空气中燃烧: 2H2+O2点燃 2H2O 红磷在空气中燃烧: 4P+5O2点燃 2P2O5 硫粉在空气中燃烧: S+O2点燃 SO2 碳在空气中燃烧: C+O2点燃 CO2 碳在空气中不充分燃烧: 2C+O2点燃 2CO ( 2) 化合物与氧气的反应: 一氧化碳在氧气中燃烧: 2CO+O2点燃 2CO2(化合反应) 甲烷在空气中燃烧: CH4+2O2点燃 CO2+2H2O 酒精在空气中燃烧: C2H5OH+3O2点燃 2CO2+3H2O 二.几个分解反应: 水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑ 加热高锰酸钾:2KMnO4△ 2MnO4+MnO2+O2↑ 碳酸不稳定分解:H2CO3==H2O+CO2↑ 加热氧化汞: 2HgO △ 2Hg+O2↑ 分解过氧化氢制取氧气: 2H2O2 2H2O+O2↑
高温煅烧石灰石:CaCO3高温 CaO+CO2↑ 三.几个氧化还原反应: 氢气还原氧化铜:H2+CuO △ Cu+H2O 木炭还原氧化铜:C+2CuO 高温 2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3高温 4Fe+3CO2↑ 一氧化碳还原氧化铜:CO+CuO △ Cu+CuO 一氧化碳还原氧化铁:3CO+Fe2O3高温 2Fe+3CO2 四.单质氧化物酸碱盐的相互关系: (1)金属单质+酸==盐+氢气(置换反应) 锌和稀硫酸反应:Zn+H2SO4==ZnSO4+H2↑ 铁和稀硫酸反应:Fe+H2SO4==FeSO4+H2↑ 27镁和稀硫酸反应:Mg+H2SO4==MgSO4+H2↑ 28铝和稀硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑29锌和稀盐酸反应:Zn+2HCl==ZnCl2+H2↑ 30铁和稀盐酸反应:Fe+2HCl==FeCl2+H2↑ 31镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑ 32铝和稀盐酸反应:2Al+6HCl==2AlCl3+3H2↑ (2)金属单质+盐(溶液)==另一种金属+另一种盐 33铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu 34锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu 35铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg
高中化学计算专题一 相对原子质量及分子式的确定
化学计算专题一——相对原子质量及分子式的确定 [考点扫描] 有关相对原子质量、相对分子质量及确定化学式的计算。 [知识指津] 1.气体物质相对分子质量的求法 应用气体摩尔体积及阿伏加德罗定律等基本概念,依据气态物质在标准状况下的密度和气态方程式求相对分子质量,也可以根据气体的相对密度求相对分子质量。 2.确定物质化学式的方法 (1)根据元素的质量分数求物质的化学式 方法一: 先计算出相对分子质量,求出元素的质量,然后直接求出各元素原子在化合物中的个数,即求得化学式。 方法二: 同样先计算出相对分子质量,由元素的质量分数求出化合物中各元素的原子个数最简整数比即得到最简式,再求出分子式。 (2)根据物质的通式求有机物的分子式 已知相对分子质量,根据各类有机物的通式求出有机物分子中的碳原子个数确定分子式。 (3)根据物质化学性质写出有关的化学方程式,利用质量守恒等,计算推导物质的化学式(包括根据燃烧产物确定化学式)。 3.确定复杂化学式的计算。 该类题目的特点是:常给出一种成分较为复杂的化合物及其发生某些化学反应时产生的现象,通过分析、推理、计算,确定其化学式。此类题目将计算、推断融为一体,计算类型灵活多变,具有较高的综合性,在能力层次上要求较高。其解题的方法思路:一是依据题目所给化学事实,分析判断化合物的成分;二是以物质的量为中心,通过计算确定各成分的物质的量之比。 确定化学式的计算,关键在于理解化学式的意义,准确计算相对分子质量及元素的种类、个数,书写化学式还要符合化合价原则,防止出现不切合实际的化学式。 [范例点击] 例1固体A在一定温度下分解生成B、C、D三种气体:2A=B+2C+3D,若测得生成气体的质量是相同体积的H2的15倍,则固体A的摩尔质量是() A.30g·mol-1 B.60g·mol-1 C.90g·mol-1 D.20g·mol-1 解析 本题着重考查质量守恒和有关气体摩尔质量的计算。根据质量守衡:2mol A的质量=1mol B的质量+2mol C的质量
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5 142 氧气O2 32 氢氧化钙(熟石灰a(OH)2 74 氯气Cl2 71 氢氧化铜C U(OH)2 98 氨气NH3 17 氢氧化钠NaOH 40 氮气N2 28 过氧化氢(双氧水)2 34 一氧化碳CO 28 碱式碳酸铜绿)CU2(OH) CO 222 二氧化碳CO2 44 盐酸(氯化氢)HCI 36.5 一氧化硫SO 48 氯化钙CaCl2 111 二氧化硫SO2 64 氯化钾KCl 74.5 三氧化硫SO3 80 氯化铁(淡黄FeCl3 162.5 溶) 二氧化锰MnO2 87 氯酸钾KCIO3 122.5 碳酸H2CO3 62 高锰酸钾(灰锰氧MnO4 158 碳酸钙CaCQ 100 硫酸铜(白1 蓝CuSO4 160 溶 碳酸氢铵NH4HCO3 79 硫酸钠Na2SO4 142 硝酸HNO3 63 硝酸铵NH4NO3 80 硫酸H2SO4 98 甲烷CH4 16 亚硫酸H2SO3 82 尿素CO(NH2)2 60 磷酸H3PO4 98 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H2 26 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁黑)FmO4 232 氧化铁(红)Fe2O3 160 氧化亚铁(黑)FeO 72
硫酸亚(淡绿)eSO 152 硫酸锌(白无)ZnSO4 161 初中化学常用计算公式 一.常用计算公式: (1)相对原子质量=某元素一个原子的质量/ 一个碳原子质量的 1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量Xm+ B的相对原子质量X ②A元素与B元素的质量比=A的相对原子质量X m: B的相对原子质量X n ③A元素的质量分数3 =A的相对原子质量X m /AmBn 的相对分 子质量
化学中常用相对原子质量和相对分子质量.
常用的相对原子质量 元素名称元素符号相对原子质量氢H 1 碳 C 12 氮N 14 氧O 16 钠Na 23 镁Mg 24 铝Al 27 硅Si 28 磷P 31 硫S 32 氯Cl 35.5 钾K 39 钙Ca 40 锰Mn 55 铁Fe 56 铜Cu 64 锌Zn 65 银Ag 108 碘I 127 钡Ba 137
常用的相对分子质量 物质名称化学式相对分子质量 氢气H2 2 氨气NH3 17 氮气N228 氧气O232 水H2O 18 过氧化氢H2O234 一氧化碳CO 28 二氧化碳CO244 一氧化硫SO 48 二氧化硫SO264 三氧化硫SO380 二氧化锰MnO287 二氧化硅SiO260 一氧化氮NO 30 二氧化氮NO246 五氧化二磷P2O5142 氧化铁Fe2O3160 氧化亚铁FeO 72 四氧化三铁Fe3O4232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO 40 氧化钙CaO 56 氧化铝Al2O3 102 氧化锌ZnO 81 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223
氯气Cl271 氯化氢HCl 36.5 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl295 氯化钙CaCl2111 氯化铜CuCl2135 氯化锌ZnCl2136 氯化钡BaCl2208 氯化铝AlCl3133.5 氯化铁FeCl3162.5 氯化银AgCl 143.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5 氯化亚铁FeCl2 127 物质名称化学式相对分子质量硫酸H2SO498 硫酸锌ZnSO4161 硫酸铵(NH4)2SO4132 硫酸铜CuSO4160 硫酸钡BaSO4233 硫酸钙CaSO4136 硫酸钾K2SO4174 硫酸钠Na2SO4142 硫酸镁MgSO4120 硫酸铁Fe2(SO4)3400 硫酸亚铁FeSO4152 硫酸铝Al2(SO4)3342 硫酸氢钠NaHSO4120 硫酸氢钾KHSO4136 亚硫酸H2SO382 亚硫酸钠Na2SO3126
相对原子质量表大全
H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KCl FeCl3 三氧化硫SO380氯化铁(淡黄 溶) 二氧化锰MnO287氯酸钾KClO3 碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158 CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝 溶) 碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)260磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO72 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161
初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量 / 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B 的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量 (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100%
初中常用相对分子质量及常用化学计算公式
初中常见分子量总结(根据颜色和可溶性,可以组合分离和除杂题自测) 氢气(无无)H2 2 硝酸HNO363 氧气(无无)O232 硝酸根离子团NO3-62 氨气(刺透)NH317 硝酸铵(白/无)NH4NO380 硝酸银Ag NO3170 水H2O 18 盐酸(氯化氢)HCl 36.5 二氧化碳(无无)CO244 两个氯化氢分子 2 HCl73 氧化钙(生石灰)白CaO 56 氯离子Cl1-35.5 一氧化碳(无无)CO 28 氯化钠(食盐)白NaCl 58.5 氧化镁(白)MgO 40 氯化铁(淡黄溶)FeCl3162.5 氧化铁(红)Fe2O3160 氯化钙(白/无)CaCl2111 氧化铜(黑)CuO 80 氯化钡(白/无)BaCl2208 四氧化三铁(黑)Fe3O4232 氯化银AgCl 143.5 氧化亚铁(黑)FeO 72 二氧化锰(黑)MnO287 二氧化硫(刺透)SO264 硫酸H2SO498 硫酸根离子团SO42-96 碳酸H2CO362 硫酸铜(白固蓝溶)CuSO4160 碳酸根CO32—60 硫酸钠(白/无)Na2SO4142 碳酸钙(白沉酸溶)CaCO3100 硫酸钡(白不溶沉)BaSO4233 碳酸钠(白/无)Na2CO3106 硫酸镁(白/无)MgSO4120 碳酸钡(白沉酸溶)BaCO3197 硫酸亚铁(淡绿)FeSO4152 碳酸氢铵(白/无)NH4HCO379 硫酸锌(白/无)ZnSO4161 碱式碳酸铜(绿)Cu2(OH)2CO3222 五水硫酸铜(蓝固蓝溶)Cu SO4 5H2O 250 ? 氯酸钾KClO3122.5 氢氧化钠NaOH 40 高锰酸钾(灰锰氧)KMnO4158 氢氧化钙(熟石灰微溶)Ca(OH)274 甲烷CH416 氢氧根 OH17 尿素CO(NH 2)260 氢氧化镁(白/无)Mg(OH)258 乙醇(酒精)C2H5OH 46 氢氧化铜(蓝沉酸溶)Cu(OH)298 乙酸(醋酸)CH3COOH 60 氨水NH3 H2O35 蔗糖C6H12O6180 ?
相对原子质量--高中化学
1. 以下是人们对原子结构的认识所经历的几个重要历史阶段,其中先后顺序正确的是 ( ) ①道尔顿提出的原子论 ②汤姆生提出的葡萄干面包原子模型 ③德谟克利特的古典原子论 ④卢瑟福的原子结构行星模型 A .①②③④ B .③①②④ C .③②①④ D .③④②① 2. 下列各组互为同位素的是 ( ) A .3517 Cl 和3717Cl B .4019 K 和40 20Ca C .O 2和O 3 D .H 2O 和D 2O 3. 用“质子数”“中子数”或“电子数”等填空: (1)决定元素是否属于同一种类的是原子中的__________; (2)决定同种元素是否有同位素的是原子中的__________; (3)决定某种元素的原子的质量数是原子中的__________; (4)决定整个原子显电中性的是原子中的__________。 4. 原子是由居于________________带正电荷的________________和________________带负电荷的 ________________构成的。 5. 原子中的守恒关系: (1)电性守恒:质子数=________________=核电荷数=________________; (2)质量守恒:质量数=________________+________________。 相对原子质量 知识温习
原子非常小,要直接取一个原子测量是十分困难的,因为我们还无法制造出如此精密的天平和砝码。在研究化学反应时,科学家注意到各元素原子间的质量有一定的比例关系,于是他们便想到一个间接称量原子的好办法——相对原子质量。这是一个相对原子质量之比,好比是采用了一种特殊的砝码,用它就可以比较方便的“称量”各种原子。 1803年,英国化学家道尔顿提出相对原子质量的概念,他提出将最轻的元素氢中一种氢原子的质量定一个基本单位,并以此计算出氧、氮等14中元素的相对原子质量。1860年,比利时化学家施塔尔又提出了 16 O 为基准的更精确的相对原子质量,赢得整个科学界的公认,他提出将一个 16 O 原子的1/16作为标准,以此为“砝码”的一个单位来测定其他原子的相对质量,而“天平”则是应用了化学反应和化学分析的方法。比如要测定某元素的相对原子质量,就将一定量含有该元素的物质与一摩尔氧原子(或其他已知相对原子质量的原子)充分反应,根据它们反应的质量比就可算出该元素的相对原子质量。 此后科学家不断的探索测定相对原子质量的方法,1961年,化学家和物理学家一致同意采用新“砝码”-----12C ,把这种原子质量的1/12作为基本单位,至于“天平”也有了许多产品,如目前使用最多的质谱仪。 一、相对原子质量 1.概念: 相对原子质量是以一个碳-12原子(126C )质量的1/12作为标准,任何一个原子的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。 相对原子质量是一个比值,其符号为Ar ,在SI 制中单位为1,通常省略。 2.同位素的相对原子质量 同位素的相对原子质量是_____________________________________________________ ___________________________________________________________________________ 计算公式:_________________________________________________________________ 注意: 新知精讲 每识每课
相对原子质量表
相对原子质量表 1~56号元素 原子序数元素名称元素符号相对原子质量 1 氢H 1.00794 2 氦He 4.002602 3 锂Li 6.941 4 铍Be9.012 182 5 硼B10.811 6 碳C12.0107 7 氮N14.006 7 8 氧O15.999 4 9 氟F18.998 403 2 10 氖Ne20.179 7(6) 11 钠Na22.989 769 28 12 镁Mg24.305 0 13 铝Al26.981 538 6 14 硅Si28.085 5 15 磷P30.973 762 16 硫S32.065 17 氯Cl35.453 18 氩Ar39.948 19 钾K39.098 3 20 钙Ca40.078 21 钪Sc44.955 912 22 钛Ti47.867 23 钒V50.941 5 24 铬Cr51.996 1 25 锰Mn54.938 045 26 铁Fe55.845 27 钴Co58.933 195 28 镍Ni58.693 4 29 铜Cu63.546 30 锌Zn65.39 31 镓Ga69.723 32 锗Ge72.64 33 砷As74.921 60 34 硒Se78.96 35 溴Br79.904 36 氪Kr83.798 37 铷Rb85.467 8 38 锶Sr87.62 39 钇Y88.905 85 40 锆Zr91.224 41 铌Nb92.906 38
42 钼Mo95.94 43 锝Tc(97.9072) 44 钌Ru101.07 45 铑Rh102.905 50 46 钯Pd106.42 47 银Ag107.868 2 48 镉Cd112.411 49 铟In114.818 50 锡Sn118.710 51 锑Sb121.760 52 碲Te127.60 53 碘I126.904 47 54 氙Xe131.293 55 铯Cs132.905 451 9 56 钡Ba137.327 57~71号元素(镧系) 原子序号元素名称元素符号相对原子质量 57 镧La138.905 47 58 铈Ce140.116 59 镨Pr140.907 65 60 钕Nd144.242 61 钷Pm(145) 62 钐Sm150.36 63 铕Eu151.964 64 钆Gd157.25 65 铽Tb158.925 35 66 镝Dy162.500 67 钬Ho164.930 32 68 铒Er167.259 69 铥Tm168.934 21 70 镱Yb173.04 71 镥Lu174.967 72~88号元素 原子序号元素名称元素符号相对原子质量 72 铪Hf178.49 73 钽Ta180.947 88 74 钨W183.84 75 铼Re186.207 76 锇Os190.23 77 铱Ir192.217 78 铂Pt195.084 79 金Au196.966 569 80 汞Hg200.59
初中化学相对分子质量
初中常用相对原子量 氢 H 1 氦 He 4 锂 Li 7 铍 Be 9 碳 C 12 氮 N 14 氧 O 16 钠 Na 23 镁 Mg 24 铝Al 27 硅 Si 28 磷 P 31 硫S 32 氯 Cl 35.5 钾 K 39 钙 Ca 40 锰 Mn 55 铁 Fe 56 铜 Cu 64 锌 Zn 65 银 Ag 108 锡 Sn 119 钡 Ba 137 铂 Pt 195 金 Au 197 汞 Hg 201 铅 Pb 207 初中常用相对分子量 单质:H 2:2 O 2 :32 N 2 :28 Cl 2 :71 氧化物:H 2O:18 CO 2 :44 CO:28 CuO:80 MgO:40 SO 2:64 SO 3 :80 Fe 2 O 3 :160 FeO:72 CaO:56 Al 2O 3 :102 酸:HCl:36.5 H 2SO 4 :98 H 2 CO 3 :62 HNO 3 :63 碱:NaOH:40 Ca(OH) 2:74 NH 3 ·H 2 O:35 KOH:56 Mg(OH) 2:58 Cu(OH) 2 :98 Fe(OH) 3 :107 盐:Na 2CO 3 :106 NaHCO 3 :84 CaCO 3 :100 CuSO 4 :160 Na 2SO 4 :142 BaSO 4 :233 FeSO 4 :152 Fe 2 (SO 4 ) 3 :400 NaCl:58.5 KCl:74.5 CuCl 2:135 BaCl 2 :208 BaCO 3:197 AgCl:143.5 MgCl 2 :95 ZnCl 2 :136 K 2CO 3 :138 AgNO 3 :170 NH 4 NO 3 :80 NaNO 3 :85 一般化合物:NH 3:17 CH 4 :16 C 2 H 5 OH:46 CO(NH 2 ) 2 :60
相对原子质量表大全
氢气H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KCl FeCl3 三氧化硫SO380氯化铁(淡黄 溶) 二氧化锰MnO287氯酸钾KClO3 碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158 CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝 溶) 碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)260磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO72 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161
初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量 / 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B 的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量 (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100%
初中化学中考复习专题4 相对原子质量 相对分子质量
专题4 相对原子质量相对分子质量 一、中考复习要求 1 2、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量 二、基础知识回顾 1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。 2、相对分子质量:表示物质的化学式里所有原子的总和。相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1” 三、重点疑点讨论 1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而 2、硫酸(H2SO4)的相对分子质量是98克,对吗? 3、为什么质子数和中子数的和近似等于相对原子质量? 4、如何计算胆矾(CuSO4·5H2O) 相对分子质量? 5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么? 四、解题方法指导 例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24, 例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分
子质量为( ) A、 72 B、 160 C、 232 D、 256 思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。本题求化学式的方法有两种,请同学们自己推出。 例题3 一种含氧化铁的铁矿石,经测定含铁49%。求矿石中氧化铁的质量分数。 思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。 矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数 五、知识能力训练 巩固知识 1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。 2、晶碱(Na2CO3·10H20)的相对分子质量是,晶碱中结晶水的质量分数为。 3、已知XgR2O中含有YgR,则表示R的相对原子质量的代数式为( ) A、(X-Y)/16 B、8Y/(X-Y) C、16/(X-Y) D、(X-Y)/8Y 4、原子中决定相对原子质量大小的主要微粒 ..是( ) A、质子 B、质子数 C、质子和中子 D、质子数和中子数 5、下列物质中,铁元素的质量分数最大的是() A、Fe2O3 B、FeO C、FeS D、Fe3O4 6、质量相等的CO和CO2中,氧元素的质量比为() A、1:1 B、11:14 C、1:2 D、2:1 7、某含氮氧化物中氮与氧的质量比为7:4,该氧化中氮元素的化合价为() A、+1价 B、+2价 C、+3价 D、+4价 E、+5价 8、某元素的相对原子质量为27,其硝酸盐的相对分子质量为213,则该金属元素的化合价为() A、+3价 B、+2价 C、+1价 D、-1价 9、一种不纯的硝酸铵氮肥,经测定含氮37%,则其中混入的另一种氮肥是() A、NH4Cl B、NH4HCO3 C、(NH4)2SO4 D、CO(NH2)2 10、三种化合物CH4、C2H5OH、C2H2中若含有碳元素的质量相同,则含有氢元素的质量比为( )
相对原子质量表大全
氢气H22五氧化二磷P2O5142 74氧气O232氢氧化钙(熟石灰).Ca(OH) 2 氯气Cl271氢氧化铜Cu(OH)298氨气NH3~17氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234 # 一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)?HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO2,64氯化钾KCl FeCl3 三氧化硫SO380氯化铁(淡黄 溶) 【 二氧化锰MnO287氯酸钾KClO3 158碳酸H2CO362高锰酸钾(灰锰氧)}KMnO 4 CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝 溶) 碳酸氢铵NH4HCO3—79硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380 ) 硫酸H2SO498甲烷CH416 亚硫酸H2SO382尿素!CO(NH )260 2 磷酸H3PO498甲醇CH3OH32水H2O、18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226 | 氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56] 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3—160
氧化亚铁(黑)FeO72 ! 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161》 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn " ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
化学中常用相对原子质量和相对分子质量
元素名称元素符号相对原子质量氢H 1 碳 C 12 氮N 14 氧O 16 钠Na 23 镁Mg 24 铝Al 27 硅Si 28 磷P 31 硫S 32 氯Cl 35.5 钾K 39 钙Ca 40 锰Mn 55 铁Fe 56 铜Cu 64 锌Zn 65 银Ag 108 碘I 127 钡Ba 137
物质名称化学式相对分子质量氢气H2 2 氨气NH3 17 氮气N228 氧气O232 水H2O 18 过氧化氢H2O234 一氧化碳CO 28 二氧化碳CO244 一氧化硫SO 48 二氧化硫SO264 三氧化硫SO380 二氧化锰MnO287 二氧化硅SiO260 一氧化氮NO 30 二氧化氮NO246 五氧化二磷P2O5142 氧化铁Fe2O3160 氧化亚铁FeO 72 四氧化三铁Fe3O4232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO 40 氧化钙CaO 56 氧化铝Al2O3 102 氧化锌ZnO 81 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223
氯气Cl271 氯化氢HCl 36.5 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl295 氯化钙CaCl2111 氯化铜CuCl2135 氯化锌ZnCl2136 氯化钡BaCl2208 氯化铝AlCl3133.5 氯化铁FeCl3162.5 氯化银AgCl 143.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5 氯化亚铁FeCl2 127 物质名称化学式相对分子质量硫酸H2SO498 硫酸锌ZnSO4161 硫酸铵(NH4)2SO4132 硫酸铜CuSO4160 硫酸钡BaSO4233 硫酸钙CaSO4136 硫酸钾K2SO4174 硫酸钠Na2SO4142 硫酸镁MgSO4120 硫酸铁Fe2(SO4)3400 硫酸亚铁FeSO4152 硫酸铝Al2(SO4)3342 硫酸氢钠NaHSO4120 硫酸氢钾KHSO4136 亚硫酸H2SO382 亚硫酸钠Na2SO3126
国际相对原子质量表_
国际相对原子质量表 U IPAC2001 以12C=12为基准,末位数准确度加注在其后括号内 1 氢 H 1.00794(7) 2 氦 He 4.002602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012182(3) 5 硼 B 10.811(7) 6 碳 C 12.0107(8) 7 氮 N 14.00674(2) 8 氧 O 15.9994(3) 9 氟 F 18.9984032(5) 10 氖 Ne 20.1797(6) 11 钠 Na 22.989770(2) 12 镁 M g 24.3050(6) 13 铝 Al 26.981538(2) 14 硅 Si 28.0855(3) 15 磷 P 30.973761(2) 16 硫 S 32.06(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.0983(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955910(8) 22 钛 Ti 47.867(1) 23 钒 V 50.9415 24 铬 Cr 51.9961(6) 25 锰 M n 54.938049(9) 26 铁 Fe 55.845(2) 27 钴 Co 58.933200(9) 28 镍 Ni 58.6934(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1)32 锗 Ge 72.64(1) 33 砷 As 74.92160(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.4678(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.90585(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.90638(2) 42 钼 Mo 95.94(2) 43 锝 Tc 97.907* 44 钌 Ru 101.07(2) 45 铑 Rh 102.90550(2) 46 钯 Pd 106.42(1) 47 银 Ag 107.8682(2) 48 镉 Cd 112.411(8) 49 铟 In 114.818(3) 50 锡 Sn 118.710(7) 51 锑 Sb 121.760(1) 52 碲 Te 127.60(3) 53 碘 I 126.90447(3) 54 氙 Xe 131.293(6) 55 铯 Cs 132.90545(2) 56 钡 Ba 137.327(7) 57 镧 La 138.9055(2) 58 铈 Ce 140.116(1) 59 镨 Pr 140.90765(2) 60 钕 Nd 144.24(3) 61 钷 Pm 144.91* 62 钐 Sm 150.36(3) 63 铕 Eu 151.964(1) 64 钆 Gd 157.25(3) 65 铽 Tb 158.92534(2) 66 镝 Dy 162.500(1) 67 钬 Ho 164.93032(2) 68 铒 Er 167.259(3) 69 铥 Tm 168.93421(2) 70 镱 Yb 173.04(3) 71 镥 Lu 174.967(1) 72 铪 Hf 178.49(2) 73 钽 Ta 180.9479(1) 74 钨 W 183.84(1) 75 铼 Re 186.207(1) 76 锇 Os 190.23(3) 77 铱 Ir 192.217(3) 78 铂 Pt 195.078(2) 79 金 Au 196.96655(2) 80 汞 Hg 200.59(2) 81 铊 Tl 204.3833(2) 82 铅 Pb 207.2(1) 83 铋 Bi 208.98038(2) 84 钋 Po 208.98* 85 砹 At 209.99* 86 氡 Rn 222.02* 87 钫 Fr 223.02* 88 镭 Ra 226.03* (以下略) 注:(1)加*为半衰期最长 元素相对原子质量。 48 化工标准·计量·质量 2004.4
