下一代DNA测序技术研究进展综述

深度DNA测序技术在基因组测序中的研究策略和进展
摘要:回顾了经典DNA测序技术原理,重点阐述了深度测序技术在基因组测序中的研究策略,并结合目前比较常见的二代测序仪来分析比较相互之间的特点和优势,最后,对即将到来的三代测序法的研究进展给予了简单的介绍。
关键词:深度DNA测序基因组测序仪
DNA测序技术的发展过程漫长而艰辛,然而,我们现在获取的大部分DNA序列信息还是依靠基于Sanger在1977年建立的“DNA双脱氧链末端终止测序法”的DNA测序技术获得的。另外就是Maxam和Gilbert建立的“化学降解测序法”。在过去的七年当中,DNA测序技术的发展至少受到来自四个方面的影响:首先是人类基因组计划的出现,这项计划的实施过程中,科学家们面临了巨大的经费问题,因为传统的Sanger测序法无论怎么优化,都无法大幅度降低测序的成本,这很大程度促进了人们对在测序过程中如何降低成本的技术方面的研究。第二,人类以及其他主要模式生物参考序列数据库的建立使得短片段阅读(short-read)成为可能,这极大的促进了短片段测序技术的发展。第三,新型分子生物学技术的不断涌现导致了越来越多的诸如RNA表达染色体构象等生物现象的出现,这就需要有高通量DNA测序手段去解释这些问题,这也极大的促进了新型测序技术的发展。第四,其他学科领域的技术的发展,例如计算机技术,数据存储及分析技术,聚合酶工程技术等,极大地支持了DNA测序技术的应用。本文主要是对目前新一代DNA测序(也叫深度测序)技术(Next-generation DNA sequencing technologies)的研究策略及目前国际DNA测序最新进展做一简要的综述。
1.Sanger测序法
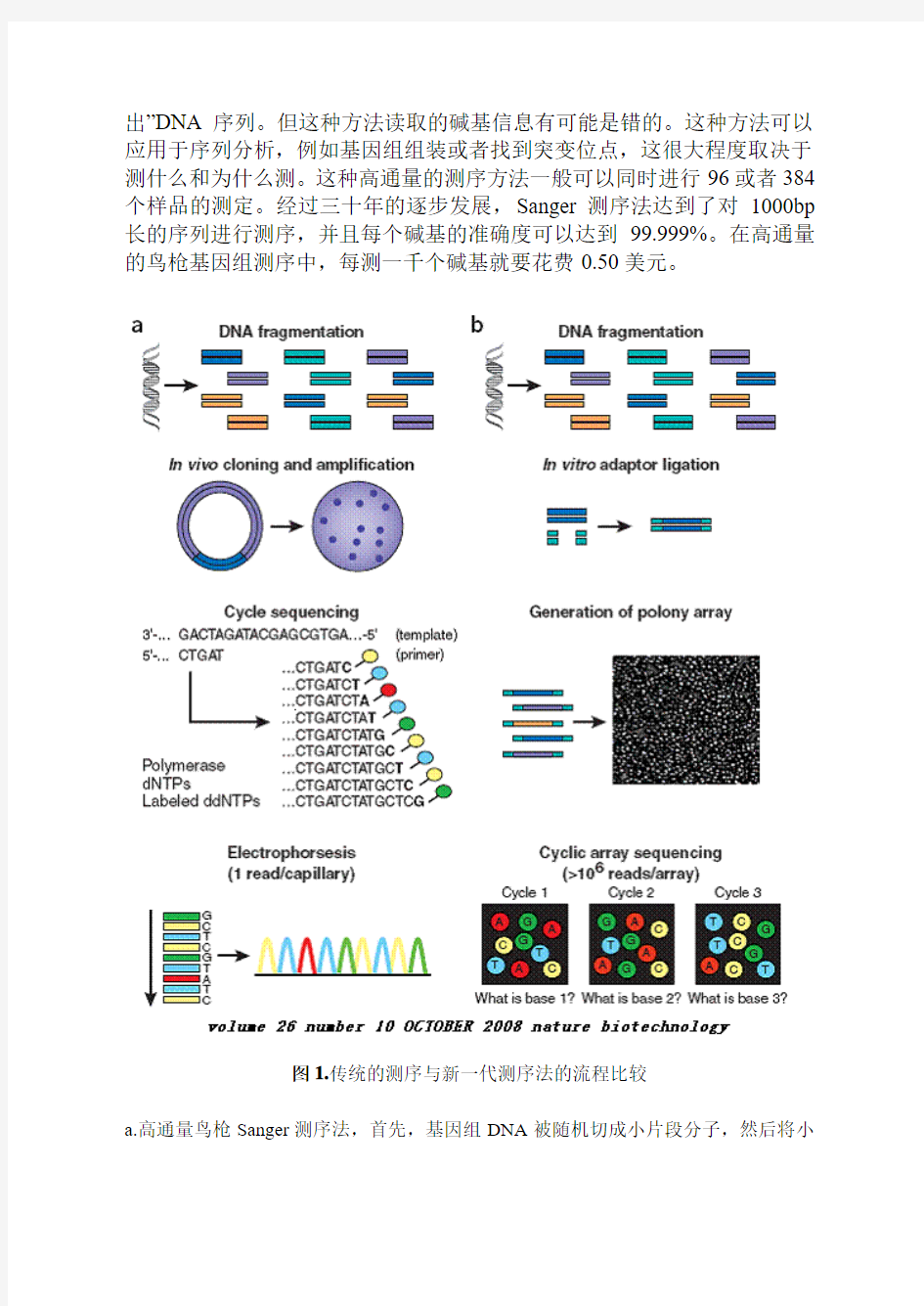
先来回顾一下经典的DNA测序法,从上世纪九十年代早期开始,几乎所有的DNA测序都是利用半自动化的毛细管电泳Sanger测序技术完成的(图1-a)。后来出现了高通量测序法,这种方法首先要对DNA预处理,获取大量的待测序模板即质粒或PCR产物。然后在测序一种发生测序生化反应,这个过程会产生大量长短不一(因为终止位点不一样),末端被荧光标记的延伸产物。再用分辨率高的毛细管凝胶电泳分离这些延伸产物,通过对延伸产物末端四种不同荧光颜色的区分,利用计算机软件自动“读
出”DNA序列。但这种方法读取的碱基信息有可能是错的。这种方法可以应用于序列分析,例如基因组组装或者找到突变位点,这很大程度取决于测什么和为什么测。这种高通量的测序方法一般可以同时进行96或者384个样品的测定。经过三十年的逐步发展,Sanger测序法达到了对1000bp 长的序列进行测序,并且每个碱基的准确度可以达到99.999%。在高通量的鸟枪基因组测序中,每测一千个碱基就要花费0.50美元。
图1.传统的测序与新一代测序法的流程比较
a.高通量鸟枪Sanger测序法,首先,基因组DNA被随机切成小片段分子,然后将小
片段DNA克隆进质粒载体,再转化到大肠杆菌中,最后从培养的大肠杆菌中提取质粒测序。在几微升的反应体系中完成测序反应,然后通过延伸产物的末端荧光标记进行识别来进行DNA序列读取。b.鸟枪循环芯片测序法。同样先将基因组DNA随机切割成小片段,然后在这些小片段DNA分子的末端连接上普通接头,制成polony芯片,每一个polony都含有一个小片段DNA分子的多个拷贝,很多个polony集合在一起就形成了一个polony芯片。这样的话,一次测序反应中就可以同时对多个polony进行测序,后面就与Sanger测序法一样,获得完整的DNA序列。
2. 深度DNA测序法
各种不同的DNA测序策略可以被归为以下四类:a.微电泳方法,b.杂交法,c.单个分子的实时观测测序法,d.循环阵列测序法。在此,主要以二代测序法对照在各种商业产品(如454测序法(主要应用在454基因组测序仪中),Solexa技术(用于Illumina测序仪中),SOLiD平台(Applied Biosystems),Polonator测序仪Heliscope单分子测序仪。)(表1)的循环阵列测序法简述一下。循环阵列测序法可以简单的描述为:对充满DNA样品的芯片重复进行基于DNA的聚合酶反应操作和碱基成像数据收集。2005年Science和Nature各有一篇文章详细报道了这种方法,由于这种方法相对于传统的测序方法速度更快,成本更低,因此,在之后的几年中,这种方法被人们广泛的应用。
表1.各种测序技术
Annu.Rev.Genomics Hum.Genet.2009.10:135–51
尽管这些测序平台在在实际的生产及操作过程很不相同,而且各有特点,但他们的背后的工作原理是很相似的(图1-b)。新一代测序法第一步
也是将基因组DNA随机切割成小片段DNA,然后在这些小片段DNA分子的末端连接上普通接头,也可以制成跨步文库(jumping library),然后使用原位polony(situ polonies),微乳液PCR(Emulsion PCR)或桥式PCR(Bridge PCR)等方法获取测序模板(图2)。这些方法的共同点就是任何一个小片段DNA分子的PCR扩增产物在空间上都是聚集的:桥式PCR和原位polony 测序法中的产物都是集中在平板的某处,而Emulsion PCR的产物则集中在微珠的表面。而事实上,这些方法的测序反应则与传统的测序反应是一样的。下面就简单介绍几种目前前沿的测序仪的工作模式及优缺点。
图2.克隆扩增模板片段
a.广泛应用于454测序仪,polonator测序仪和SOLID测序仪上的用来扩增模板片
段的微乳液PCR技术示意图。第一步,体外构建好两端连接有接头(途中金色和绿色所示)的DNA文库,置于一个油包水的乳液环境中。第二步,在此环境中进行PCR扩增,因为这里只是用了一对接头的引物,因此进行的是多模板PCR(muti-template PCR),而不是多重PCR,加之由于在模板浓度很低的情况下,大部分微珠的微乳液中最多只能有一条引物,因此经过PCR扩增后,每一个微珠表面上都只会连接上一种模板分子的扩增产物。最后,打破微乳液滴,收集有大量模板分子的微珠制成芯片。b.Illumina测序仪中使用桥式PCR技术示意图。首先,体外构建好两端有接头的DNA文库(如图中金色和绿色所示)。然后通过密集固定在载体上的引物(引物的5’端利用一个柔性接头连接在载体上)进行PCR 扩增,这样扩增产物也会在载体上。PCR反应结束之后,每一个模板克隆都包含有1000个模板,精确的测量模板浓度对保证模板簇的密度最大化以及避免拥挤是
非常关键的。
2.1 454测序仪
454测序仪的最基本的原理是焦磷酸盐检测的原理,这是在1985年首先提出来的,然后1988年就有报道利用这个原理形成一个系统来进行DNA 测序。在随后的很多年里,这个原理在M. Ronaghi等人的努力下在技术上取得长足的进步,并于2005年454基因组测序仪器正式问世。在这个系统中(图3),其基本的流程在之前已有所叙述,因此此处不再赘述。只说说其在DNA测序发展历程中的地位及现状。
454测序仪的出现极大地促进了测序业务的开展,454测序技术问世后,很快就成为科学家们解决科学问题的利器,他突破了传统测序法在文库制备,模板制备,测序上的瓶颈。454测序仪的优点在于:第一,解决了高通量测序的问题;第二,缩小了测序反应的体积,降低了试剂的使用量,因此,这种测序方法成本相对传统测序法是极其低廉的。而目前的454测序仪读取DNA片段的长度已达到400bp-500bp之间。而接下来即将升级的454测序仪的数据输出将达到100Mb到500Mb左右。
454测序仪技术是继Sanger测序技术之后出现的第一个用于对细菌基因组进行从头测序的新技术,也是第一个被用来对人类基因组进行测序的非Sanger测序技术。有关其具体的信息可以在https://www.360docs.net/doc/344633323.html,上查阅。
图3. A. GS454 DNA测序仪的流程图。B.454测序的基本原理示意图。
2.2 Illumina 测序仪
Illumina 测序仪通常也称为Solexa 测序仪,最早是由Turcatti ,他的同事2005年报道的,由四家公司—Solexa(Essex,UK), Lynx Therapeutics(Hayward,CA,USA), Manteia Predictive Medicine(Cionsins ,Swizerland)和Illumina 的合并公司生产出来的。Illumina 测序仪的特点是:
1.对于检测同聚物来说,Illumina 测序仪要比454测序仪好很多;
2.Illumina 测序仪的平均出错率是1%-1.5%,不过可以通过质量优化将错误率降低到不倒0.1%,其在36bp 的准确里极高;
3.与其他测序仪一样,经过改进后,Illumina 测序仪也能进行配对检测;
4. Illumina 测序仪在测序长度方面有所缺陷,因为核苷酸上标记的荧光基因或终止基因切除不完全导致测序信号发生了衰减和相移;
5. Illumina 测序仪在检测碱基替换突变中易出错,另外还有检测插入或缺失突变时都容易出错。Illumina 测序仪可以利用桥式PCR ,但与传统的桥式PCR 不同,这种桥式PCR 交替使用Bst 聚合酶进行延伸反应,并使用甲酰胺进行变性反应。Illumina 测序仪经过PCR 扩增以后,所有的模板都会被线性化形成单链模板,后面的步骤基本与454测序法相似。
图4.Solexa 测序仪使用桥式PCR 直接在芯片进行模板片段扩增然后同时加入四种经过修饰的脱氧核苷酸,每一个核苷酸都携带一种荧光基因和一个可被取去除的终止基因,经过修饰的DNA 聚合酶催化引物延伸测序反应,采集图像然后切除荧光标记基团和终止基团,重复上述反应,完成测序。
2.3 AB SOLiD 测序仪
这个平台最开始是由J.S 及其同事在2005年报道的,然后于2006年首次应用Mckernan 的实验室,是由Applied Biosystems
公司生产的,也是Nature biotechnology volume 26 number 10 OCTOBER 2008
使用微乳液PCR方法扩增模板片段的,但是使用的是直径1微米的小磁珠。AB SOLiD测序仪可以对任何方法制备的DNA文库进行测序,它可以将富集有模板片段的微珠进行高度可控的任意排列。AB SOLiD测序仪后期的合成测序法是由DNA连接酶完成的,并不像其他测序法一样,是由DNA 聚合酶完成的。基本步骤如下图(图5)所示。AB SOLiD测序仪还有一个特点,即运用了双碱基编码技术,这种技术可以校准误差,因为它是用两个碱基来对应一个荧光,因此,出错的概率会大大降低。
Nature Reviews Genetics Volume 11 January 2010 37
图5.在SOLiD 测序仪中,每一次反应都会在引物末端加上一个荧光标记的的8bp 的探针,在探针中央的两个碱基上标有荧光基因,探针被连接上之后发出荧光,随后荧光部分被切除,重新进行下一轮反应。经过几轮这样的反应后可得到一段不连续的碱基序列,然后变性去掉已被延伸引物,重新结合上新的引物进行新一轮反应。
另外,Polonator 测序仪的测序原理与AB SOLiD 测序仪,454测序仪相似。Polonator 测序仪成本相对较低,并且是一个开源设备,用户可以自己编程来设计合适的测序条件。但该设备的缺点也很明显,就是可测序的长度很有限。同时我们注意到,这三种测序仪因为都是使用微乳PCR 扩增的,因此实验是比较麻烦的,实验要求也比较高,但它们是最有可能实验高通量测序的方法。
2.4 Heliscope 测序仪
Heliscope 测序仪是基于Quake 团队的工作,也是一种循环芯片测序设备。但是,这个平台的最独特的地方在于它不需要扩增DNA 模板。相反,他利用了高灵敏度的荧光探测仪直接对单链DNA 模板进行合成法测序。首先是将基因组DNA 进行随机切割,形成小片段DNA 并在其尾部添加一个Poly-A(没有用PCR 扩增),再通过Poly-A 与Poly-T 相互作用从而将待测模板固定在芯片上,制成测序芯片。之后的过程见图6。Heliscope 测序仪的特点有:1.测序不同步,这与454测序仪一样;2.在荧光标记的核苷酸上没有终止基因;3.可以通过两次测序法通告测序的精确度;4.在检测确实突变时出错率较高,因为它有大量的未标记碱基、不发荧光的碱基或污染碱基。但其在检测碱基替换突变中出错率极低,两次错误率为0.001%,这是目前测序仪中准确率最高的。
图6.Heliscope 测序仪,单核苷酸分子不经扩增直接测序,Poly-A 尾被添加到DNA
文Nature biotechnology volume 26 number 10 OCTOBER 2008
库片段末端,通过与固定在芯片上的Poly-T互补杂交将模板链固定在芯片上,制成测序芯片。模板上标有Cy3仪表指出他们在芯片上的位置。DNA聚合酶将荧光标记的单核苷酸导入到引物上,采集荧光信号获取序列信息,切除荧光基团,重复上述步骤,完成测序。
事实上,Heliscope测序仪采用的方法也可以归为单分子DNA测序技术。这种测序技术是近几年才兴起的。它包括Heliscope测序法(也叫True Single-Molecule Sequencing),单分子实时测序法,电子显微测序法,纳米孔测序法,扫描电镜法测序,Nano-Knife-Edge探针测序法。
3.纳米孔测序技术及半导体在测序技术中的应用
纳米孔测序技术采用电泳技术,借助电泳驱动单个分子逐一通过纳米孔来实现测序的。由于其直径极小,仅能使单个核酸聚合物通过。因此,可以在此基础上结合多种方法进行高通量测序,同时也保证了测序的精确度。其对已1000bp的单链DNA分子,RNA分子都无需进行标记或扩增。这使得快速廉价的进行测序成为可能,虽然目前这种方法还存在一些瓶颈,但如果得到进一步改善,将很可能成为第三代测序技术(也称为Next-next Sequencing Technology)。具体方法见图7。目前纳米孔测序技术的瓶颈有如何控制DNA通过纳米孔,生物纳米孔的稳定性问题和固态纳米孔的制造问题。虽然问题很多,但其样品准备及其简单,不需要借助碱基,酶等就能进行测序并且测序长度长。
2010年3月5日Science杂志以“Semiconductors Inspire New Sequencing Technologies”为题,点评了第三代测序技术,文章重点提到了纳米孔测序中的半导体技术。离子激流公司(Ion Torrent)的测序仪就是一种硅芯片,是利用与半导体一样的方式构建的,利用这种技术,科学家们在Science杂志上公布了三个低成本的完整人类基因组序列。
目前第三代基因测序技术竞争激烈,美国宣称要在2012年推出成熟的第三代基因测序仪。日本和欧洲也有相关的研发计划。我国也有这方面的计划,中科院北京基因组研究所是国内权威的基因组学研究机构,他们已和浪潮集团成立了“中科院北京基因组研究所—浪潮基因组科学联合实验室”,这一实验室将研发国产第三代基因测序仪,第一台样机预计2013年问世。
图7.四种纳米孔测序技术示意图
a.接组核酸链堵塞纳米孔是引起的电流强度改变来测序。图左侧是典型的电流强度图,从图中可见,纳米孔通道畅通时(右上图)和被DNA 链堵塞时(右下图)的电流强度是有明显区别的,但是无法区分纳米孔通道的12bp 核苷酸的组成。
b.核酸外切酶测序。途中淡蓝色的核酸外切酶通过深蓝色的街头连接AFA 溶血素纳米孔顶端,外切酶逐个切下DNA 链末端的dNMP (金色),然后dNMP 进入纳米孔中,通过红色的氨基化环糊精配体,引起相应的电流改变,从而被检测出来。
c.使用合成DNA 和光读取技术测序。待测DNA 链中的每一个核苷酸都被替换成更长的有橙色和蓝色碱基组成的寡聚体,每一个待测核苷酸都被12bp 的寡聚体替代,将这种转换后的DNA 链与分子信号标记物杂交,杂交链通过纳米孔是分子信号标记物会脱落,
释放出荧光,Volume 26 number 10 OCTOBER 2008 nature biotechnology
读取这些荧光就可以推测原始DNA链的序列。d.借助横向电流测序。纳米孔中装载有橙色的电极和黑色的后门,当DNA链通过纳米孔时,横向的电流会发生变化,并且每一种核苷酸都有其各自独特的横向电流,因此可以借助这些横向电流来测序。
5 MARCH 2010 VOL 327 SCIENCE
图8:半导体应用于DNA测序
参考文献:
[1] Mardis, E. R. "Next-generation DNA sequencing methods." Annu Rev
Genomics Hum Genet, 2008, 9: 387-402.
[2]MacLean, D., J. D. Jones, et al. "Application of 'next-generation' sequencing
technologies to microbial genetics." Nat Rev Microbiol, 2009, 7(4): 287-296.
[3]Morozova, O., M. Hirst, et al. "Applications of new sequencing technologies
for transcriptome analysis." Annu Rev Genomics Hum Genet, 2009, 10: 135-151.
[4]Metzker, M. L. "Sequencing technologies - the next generation." Nat Rev
Genet, 2010, 11(1): 31-46.
[5]Ansorge, W. J. "Next-generation DNA sequencing techniques." N
Biotechnol, 2009, 25(4): 195-203.
[6]Treffer, R. and V. Deckert. "Recent advances in single-molecule
sequencing." Curr Opin Biotechnol, 2010, 21(1):4-11.
[7]Xu, M., D. Fujita, et al. "Perspectives and challenges of emerging
single-molecule DNA sequencing technologies." Small, 2009, 5(23): 2638-2649.
[8]Branton, D., D. W. Deamer, et al. "The potential and challenges of nanopore
sequencing." Nat Biotechnol, 2008, 26(10): 1146-1153.
[9]Karger, B. L. and A. Guttman (2009). "DNA sequencing by CE."
Electrophoresis, 30 Suppl 1: S196-202.
[10]Shendure, J. and H. Ji "Next-generation DNA sequencing." Nat
Biotechnol, 2008, 26(10): 1135-1145.
[11]Mamanova, L., A. J. Coffey, et al. "Target-enrichment strategies for
next-generation sequencing." Nat Methods, 2010, 7(2): 111-118.
[12]Reis-Filho, J. S. "Next-generation sequencing." Breast Cancer Res, 2009,
11 Suppl 3: S12.
[13]Snyder, M., J. Du, et al. "Personal genome sequencing: current approaches
and challenges." Genes Dev, 2010, 24(5): 423-431.
[14]]Pennisi, E. "Genomics. Semiconductors inspire new sequencing
technologies." Science,2010, 327(5970): 1190.
DNA测序原理和方法.
DNA测序原理和方法 DNA序列测定分手工测序和自动测序,手工测序包括Sanger双脱氧链终止法和Maxam-Gilbert化学降解法。自动化测序实际上已成为当今DNA序列分析的主流。美国PE ABI公司已生产出373型、377型、310型、3700和3100型等DNA测序仪,其中310型是临床检测实验室中使用最多的一种型号。本实验介绍的是ABI PRISM 310型DNA测序仪的测序原理和操作规程。 【原理】ABI PRISM 310型基因分析仪(即DNA测序仪),采用毛细管电泳技术取代传统的聚丙烯酰胺平板电泳,应用该公司专利的四色荧光染料标记的ddNTP(标记终止物法),因此通过单引物PCR测序反应,生成的PCR产物则是相差1个碱基的3''''末端为4种不同荧光染料的单链DNA混合物,使得四种荧光染料的测序PCR产物可在一根毛细管内电泳,从而避免了泳道间迁移率差异的影响,大大提高了测序的精确度。由于分子大小不同,在毛细管电泳中的迁移率也不同,当其通过毛细管读数窗口段时,激光检测器窗口中的CCD(charge-coupled device)摄影机检测器就可对荧光分子逐个进行检测,激发的荧光经光栅分光,以区分代表不同碱基信息的不同颜色的荧光,并在CCD摄影机上同步成像,分析软件可自动将不同荧光转变为DNA序列,从而达到DNA测序的目的。分析结果能以凝胶电泳图谱、荧光吸收峰图或碱基排列顺序等多种形式输出。 它是一台能自动灌胶、自动进样、自动数据收集分析等全自动电脑控制的测定DNA片段的碱基顺序或大小和定量的高档精密仪器。PE公司还提供凝胶高分子聚合物,包括DNA测序胶(POP 6)和GeneScan胶(POP 4)。这些凝胶颗粒孔径均一,避免了配胶条件不一致对测序精度的影响。它主要由毛细管电泳装置、Macintosh电脑、彩色打印机和电泳等附件组成。电脑中则包括资料收集,分析和仪器运行等软件。它使用最新的CCD摄影机检测器,使DNA 测序缩短至2.5h,PCR片段大小分析和定量分析为10~40min。 由于该仪器具有DNA测序,PCR片段大小分析和定量分析等功能,因此可进行DNA测序、杂合子分析、单链构象多态性分析(SSCP)、微卫星序列分析、长片段PCR、RT-PCR(定量PCR)等分析,临床上可除进行常规DNA测序外,还可进行单核苷酸多态性(SNP)分析、基因突变检测、HLA配型、法医学上的亲子和个体鉴定、微生物与病毒的分型与鉴定等。【试剂与器材】 1.BigDye测序反应试剂盒主要试剂是BigDye Mix,内含PE专利四色荧光标记的ddNTP 和普通dNTP,AmpliTaq DNA polymerase FS,反应缓冲液等。 2.pGEM-3Zf (+) 双链DNA对照模板0.2g/L,试剂盒配套试剂。 3.M13(-21)引物TGTAAAACGACGGCCAGT,3.2μmol/L,即3.2pmol/μl,试剂盒配套试剂。 4.DNA测序模板可以是PCR产物、单链DNA和质粒DNA等。模板浓度应调整在PCR 反应时取量1μl为宜。本实验测定的质粒DNA,浓度为0.2g/L,即200ng/μl。 5.引物需根据所要测定的DNA片段设计正向或反向引物,配制成3.2μmol/L,即3.2pmol/μl。如重组质粒中含通用引物序列也可用通用引物,如M13(-21)引物,T7引物等。 6.灭菌去离子水或三蒸水。 7.0.2ml或和0.5ml的PCR管盖体分离,PE公司产品。 8.3mol/L 醋酸钠(pH5.2) 称取40.8g NaAc·3H2O溶于70ml蒸馏水中,冰醋酸调pH至5.2,定容至100ml,高压灭菌后分装。 9.70%乙醇和无水乙醇。 10.NaAc/乙醇混合液取37.5ml无水乙醇和2.5ml 3mol/L NaAc混匀,室温可保存1年。11.POP 6测序胶ABI产品。
基因中常见的名词解释
基因组拼接中常见的名词解释 Read:高通量测序平台产生的序列就称为reads。 Contig:拼接软件基于reads之间的overlap区,拼接获得的序列称为Contig (重叠群)。 Scaffold:基因组de novo测序,通过reads拼接获得Contigs后,往往还需要构建454 Paired-end库或Illumina Mate-pair库,以获得一定大小片段(如3Kb、6Kb、10Kb、20Kb)两端的序列。基于这些序列,可以确定一些Contig之间的顺序关系,这些先后顺序已知的Contigs组成Scaffold。 Contig N50:Reads拼接后会获得一些不同长度的Contigs。将所有的Contig 长度相加,能获得一个Contig总长度。然后将所有的Contigs按照从长到短进行排序,如获得Contig 1,Contig 2,Contig 3...………Contig 25。将Contig按照这个顺序依次相加,当相加的长度达到Contig总长度的一半时,最后一个加上的Contig长度即为Contig N50。举例:Contig 1+Contig 2+ Contig 3 +Contig 4=Contig总长度*1/2时,Contig 4的长度即为Contig N50。Contig N50可以作为基因组拼接的结果好坏的一个判断标准。 Scaffold N50:Scaffold N50与Contig N50的定义类似。Contigs拼接组装获得一些不同长度的Scaffolds。将所有的Scaffold长度相加,能获得一个Scaffold 总长度。然后将所有的Scaffolds按照从长到短进行排序,如获得Scaffold 1,Scaffold 2,Scaffold 3...………Scaffold 25。将Scaffold按照这个顺序依次相加,当相加的长度达到Scaffold总长度的一半时,最后一个加上的Scaffold长度即为Scaffold N50。举例:Scaffold 1+Scaffold 2+ Scaffold 3 +Scaffold 4 +Scaffold 5=Scaffold总长度*1/2时,Scaffold 5的长度即为Scaffold N50。Scaffold N50可以作为基因组拼接的结果好坏的一个判断标准。 测序深度和覆盖度: 测序深度是指测序得到的总碱基数与待测基因组大小的比值。假设一个基因大小为2M,测序深度为10X,那么获得的总数据量为20M。 覆盖度是指测序获得的序列占整个基因组的比例。由于基因组中的高GC、重复序列等复杂结构的存在,测序最终拼接组装获得的序列往往无法覆盖有所的区域,这部分没有获得的区域就称为Gap。例如一个细菌基因组测序,覆盖度是98%,那么还有2%的序列区域是没有通过测序获得的。
几种常见的基因测序技术的优缺点及应用复习过程
几种常见的基因测序技术的优缺点及应用
随着人类基因组计划的完成,人类对自身遗传信息的了解和掌握有了前所未有的进步。与此同时,分子水平的基因检测技术平台不断发展和完善,使得基因检测技术得到了迅猛发展,基因检测效率不断提高。从最初第一代以 Sanger 测序为代表的直接检测技术和以连锁分析为代表的间接测序技术,到 2005 年,以 Illumina 公司的 Solexa技术和 ABI 公司的 SOLiD 技术为标志的新一代测序(next-generation sequencing,NGS) 的相继出现,测序效率明显提升,时间明显缩短,费用明显降低,基因检测手段有了革命性的变化。其技术正向着大规模、工业化的方向发展,极大地提高了基因检测的检出率,并扩展了疾病在基因水平的研究范围。2009 年 3 月,约翰霍普金斯大学的研究人员在《Science》杂志上发表了通过 NGS外显子测序技术,发现了一个新的遗传性胰腺癌的致病基因PALB2,标志着 NGS 测序技术成功应用于致病基因的鉴定研究。同年,《Nature》发表了采用 NGS 技术发现罕见弗里曼谢尔登综合征MYH3 致病基因突变和《Nat Genet》发表了遗传疾病米勒综合征致病基因。此后,通过 NGS 技术,与遗传相关的致病基因不断被发现,NGS 技术已成为里程碑式的进步。2010 年,《Science》杂志将这一技术评选为当年“十大科学进展”。 近两年,基因检测成为临床诊断和科学研究的热点,得到了突飞猛进和日新月异的发展,越来越多的临床和科研成果不断涌现出来。同时,基因检测已经从单一的遗传疾病专业范畴扩展到复杂疾病和个体化应用更加广阔的领域,其临床检测范围包括高危疾病的新生儿筛查、遗传疾病的诊断和基因携带的检测以及基因药物检测用于指导个体化用药剂量、选择和药物反应等诸多方面的研究。目前,基因检测在临床诊断和医学研究的应用正越来越受到医生的普遍重视和引起研究人员的极大的兴趣。 本文介绍了几种 DNA 水平基因检测常见的方法,比较其优缺点和在临床诊断和科学研究中的应用,对指导研究生和临床医生课外学习,推进临床科研工作和提升科研教学水平有着指导意义。 1、第一代测序 1.1 Sanger 测序采用的是直接测序法。1977年,Frederick Sanger 等发明了双脱氧链末端终止法,这一技术随后成为最为常用的基因测序技术。2001 年,Allan Maxam 和 Walter Gibert 发明了 Sanger 测序法,并在此后的 10 年里成为基因检测的金标准。其基本原理即双脱氧核苷三磷酸(dideoxyribonucleoside triphosphate,ddNTP) 缺乏PCR 延伸所需的 3'-OH,因此每当 DNA 链加入分子 ddNTP,延伸便终止。每一次 DNA 测序是由 4个独立的反应组成,将模板、引物和 4 种含有不
DNA测序技术的发展和其最新进展
DNA测序技术的发展及其最新进展 摘要:自从诺贝尔奖得主桑格于1977年发明了第一代DN测序技术以来,DNA测序技术已经作为重要的实验技术广泛的应用于现代生物学研究当中。经过了几十年的发展,DNA测序技术日臻成熟,并且以单分子测序为特点的第三代测序技术也已经诞生。本文主要就每一代测序技术原理和特点及其最新进展做简要介绍。 关键词:DNA测序技术;第三代DNA测序技术;最新进展 The Development and New Progress of DNA Sequencing Technology Abstract: Since Nobel Prize Winner Sanger have founded the first generation of DNA Sequence technology in 1977, DNA sequencing technology has been widely used in modern biological researches as an important experimental. Over decades of year’s development, DNA sequence technology mature gradually and the third generation sequencing technologies characterized by single-molecule sequencing have also emerged. The mechanisms and features of each generation of sequencing technology and their latest progress will be discussed here. Key Words: DNA Sequence technology ; third generation DNA sequencing ;latest development 1.引言 DNA测序技术是分子生物学研究中最常用的技术,它的出现极大地推动了生物学的发展。自从1953年Watson和Crick发现DNA双螺旋结构后[1],人类就开始了对DNA序列的探索,在世界各地掀起了DNA测序技术的热潮。1977年Maxam和Gilbert报道了通过化学降解测定DNA序列的方法[2]。同一时期,Sanger发明了双脱氧链终止法[3]。20世纪90年代初出现的荧光自动测序技术将DNA测序带入自动化测序的时代。这些技术统称为第一代DNA测序技术。最近几年发展起来的第二代DNA测序技术则使得DNA测序进入了高通量、低成本的时代。目前,基于单分子读取技术的第三代测序技术已经出现,该技术测定DNA序列更快,并有望进一步降低测序成本,推进相关领域生物学研究。本文主要介绍DNA测序技术的发展历史及不同发展阶段各种主要测序技术的特点,并针对目前新一代DNA测序技术及目前国际DNA测序最新进展做简要综述。
高通量测序常用名词解释
什么是高通量测序? 高通量测序技术(High-throughput sequencing,HTS)是对传统Sanger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next generation sequencing,NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing)。 什么是Sanger法测序(一代测序) Sanger法测序利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。直到掺入一种链终止核苷酸为止。每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。由于ddNTP 缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。终止点由反应中相应的双脱氧而定。每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。 什么是基因组重测序(Genome Re-sequencing) 全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。 什么是de novo测序 de novo测序也称为从头测序:其不需要任何现有的序列资料就可以对某个物种进行测序,利用生物信息学分析手段对序列进行拼接,组装,从而获得该物种的基因组图谱。获得一个物种的全基因组序列是加快对此物种了解的重要捷径。随着新一代测序技术的飞速发展,基因组测序所需的成本和时间较传统技术都大大降低,大规模基因组测序渐入佳境,基因组学研究也迎来新的发展契机和革命性突破。利用新一代高通量、高效率测序技术以及强大的生物信息分析能力,可以高效、低成本地测定并分析所有生物的基因组序列。 什么是外显子测序(whole exon sequencing) 外显子组测序是指利用序列捕获技术将全基因组外显子区域DNA捕捉并富集后进行高通量测序的基因组分析方法。外显子测序相对于基因组重测序成本较低,对研究已知基因的SNP、Indel等具有较大的优势,但无法研究基因组结构变异如染色体断裂重组等。 什么是mRNA测序(RNA-seq) 转录组学(transcriptomics)是在基因组学后新兴的一门学科,即研究特定细胞在某一功能状态下所能转录出来的所有RNA(包括mRNA和非编码RNA)的类型与拷贝数。Illumina 提供的mRNA测序技术可在整个mRNA领域进行各种相关研究和新的发现。mRNA测序不对引物或探针进行设计,可自由提供关于转录的客观和权威信息。研究人员仅需要一次试验即可快速生成完整的poly-A尾的RNA完整序列信息,并分析基因表达、cSNP、全新的转录、全新异构体、剪接位点、等位基因特异性表达和罕见转录等最全面的转录组信息。简单的样
基因测序技术的优缺点及应用
基因测序技术的优缺点及应用 随着人类基因组计划的完成,人类对自身遗传信息的了解和掌握有了前所未有的进步。与此同时,分子水平的基因检测技术平台不断发展和完善,使得基因检测技术得到了迅猛发展,基因检测效率不断提高。从最初第一代以 Sanger 测序为代表的直接检测技术和以连锁分析为代表的间接测序技术,到 2005 年,以Illumina 公司的 Solexa技术和 ABI 公司的 SOLiD 技术为标志的新一代测序 (next-generation sequencing,NGS) 的相继出现,测序效率明显提升,时间明显缩短,费用明显降低,基因检测手段有了革命性的变化。其技术正向着大规模、工业化的方向发展,极大地提高了基因检测的检出率,并扩展了疾病在基因水平的研究范围。2009 年 3 月,约翰霍普金斯大学的研究人员在《Science》杂志上发表了通过 NGS外显子测序技术,发现了一个新的遗传性胰腺癌的致病基因PALB2,标志着 NGS 测序技术成功应用于致病基因的鉴定研究。同年,《Nature》发表了采用 NGS 技术发现罕见弗里曼谢尔登综合征MYH3 致病基因突变和《Nat Genet》发表了遗传疾病米勒综合征致病基因。此后,通过 NGS 技术,与遗传相关的致病基因不断被发现,NGS 技术已成为里程碑式的进步。2010 年,《Science》杂志将这一技术评选为当年“十大科学进展”。 近两年,基因检测成为临床诊断和科学研究的热点,得到了突飞猛进和日新月异的发展,越来越多的临床和科研成果不断涌现出来。同时,基因检测已经从单一的遗传疾病专业范畴扩展到复杂疾病和个体化应用更加广阔的领域,其临床检测范围包括高危疾病的新生儿筛查、遗传疾病的诊断和基因携带的检测以及基因药物检测用于指导个体化用药剂量、选择和药物反应等诸多方面的研究。目前,基因检测在临床诊断和医学研究的应用正越来越受到医生的普遍重视和引起研究人员的极大的兴趣。 本文介绍了几种 DNA 水平基因检测常见的方法,比较其优缺点和在临床诊断和科学研究中的应用,对指导研究生和临床医生课外学习,推进临床科研工作和提升科研教学水平有着指导意义。 1、第一代测序 1.1 Sanger 测序采用的是直接测序法。1977年,Frederick Sanger 等发明了双脱氧链末端终止法,这一技术随后成为最为常用的基因测序技术。2001 年,Allan Maxam 和 Walter Gibert 发明了 Sanger 测序法,并在此后的 10 年里成为基因检测的金标准。其基本原理即双脱氧核苷三磷酸(dideoxyribonucleoside triphosphate,ddNTP) 缺乏PCR 延伸所需的 3'-OH,因此每当 DNA 链加入分子 ddNTP,延伸便终止。每一次 DNA 测序是由 4个独立的反应组成,将模板、引物和 4 种含有不同的放射性同位素标记的核苷酸的ddNTP 分别与DNA 聚合酶混合形成长短不一的片段,大量起始点相同、终止点不同的 DNA 片段存在于反应体系中,具有单个碱基差别的 DNA 序列可以被聚丙烯酰胺变性凝胶电泳分离出来,得到放射性同位素自显影条带。依据电泳条带读取DNA 双链的碱基序列。 人类基因组的测序正是基于该技术完成的。Sanger 测序这种直接测序方法具有高度的准确性和简单、快捷等特点。目前,依然对于一些临床上小样本遗传疾病基因的鉴定具有很高的实用价值。例如,临床上采用 Sanger 直接测序 FGFR 2 基因证实单基因 Apert 综合征和直接测序 TCOF1 基因可以检出多达 90% 的
高通量测序 名词解释
高通量测序基础知识汇总 一代测序技术:即传统的Sanger测序法,Sanger法是根据核苷酸在待定序列模板上的引物点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以A、T、C、G结束的四组不同长度的一系列核苷酸,每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。由于ddNTP缺乏延伸所需要的3-OH 基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止,使反应得到一组长几百至几千碱基的链终止产物。它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,通过检测得到DNA碱基序列。 二代测序技术:next generation sequencing(NGS)又称为高通量测序技术,与传统测序相比,二代测序技术可以一次对几十万到几百万条核酸分子同时进行序列测定,从而使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(Deep sequencing)。NGS主要的平台有Roche(454 & 454+),Illumina(HiSeq 2000/2500、GA IIx、MiSeq),ABI SOLiD等。 基因:Gene,是遗传的物质基础,是DNA或RNA分子上具有遗传信息的特定核苷酸序列。基因通过复制把遗传信息传递给下一代,使后代出现与亲代相似的性状。 DNA:Deoxyribonucleic acid,脱氧核糖核酸,一个脱氧核苷酸分子由三部分组成:含氮碱基、脱氧核糖、磷酸。脱氧核糖核酸通过3',5'-磷酸二酯键按一定的顺序彼此相连构成长链,即DNA链,DNA链上特定的核苷酸序列包含有生物的遗传信息,是绝大部分生物遗传信息的载体。
新一代测序技术的发展及应用前景
2010年第10期杨晓玲等:新一代测序技术的发展及应用前景 等交叉学科的迅猛发展。 1.1第二代测序——高通量低成本齐头并进以高通量低成本为主要特征的第二代测序,不再需要大肠杆菌进行体内扩增,而是直接通过聚合酶或者连接酶进行体外合成测序¨】。根据其原理又可分为两类:聚合酶合成测序和连接酶合成测序。1.1.1聚合酶合成测序法Roche公司推出的454技术开辟了高通量测序的先河。该技术通量可达Sangcr测序的几百倍,而成本却只有几十分之一,因此一经推出,便受到了国际上基因组学专家的广泛关注。454采用焦磷酸合成测序法HJ,避免了传统测序进行荧光标记以及跑胶等繁琐步骤,同时利用乳胶系统对DNA分子进行扩增,实现了大规模并行测序。截止到2010年4月,已有700多篇文献是采用了454测序技术(http://454.com/publications.and—resources/publications.asp),对该技术是一个极大的肯定。 Illumina公司推出的Solexa遗传分析仪是合成技术的进一步发展与延伸。该技术借助高密度的DNA单分子阵列,使得测序成本和效率均有了较大改善。同时Solexa公司提出的可逆终止子”1也是该技术获得认可的原因之一。与454相比。Solexa拥有更高的通量,更低的成本。虽然片段长度较短仍是主要的技术瓶颈,但是对于已有基因组的物种来说,Solexa理所当然成为第二代测序技术的首选。2008年以来,利用该技术开展的研究大幅度上升,报道文献达400多篇(http://www.illumina.com/systems/genome—analyzer_iix.ilmn)o 1.1.2连接酶合成测序法2007年ABI公司在Church小组拍1研究成果的基础上推出了SOLID测序仪。该技术的创新之处在于双碱基编码…的应用,即每个碱基被阅读两次,因此大大减少了测序带来的错误率,同时可以方便的区分SNP和测序错误。在测序过程中,仪器自动加入4种荧光标记的寡核苷酸探针,探针与引物发生连接反应,通过激发末端的荧光标记识别结合上的碱基类型。目前SOLID3.0测序通量可达20G,而测序片段仅有35—50bp,这使得该技术与Solexa相比,应用范围还不够广泛。ABI公司正加快研发进度,争取在片段长度方面做出重大突破。 DanaherMotion公司推出Polonator¨1测序仪同样也是基于Church小组的研究成果,但是该设备的成本要低很多,同时用户在使用时可以根据自己的研究目的设置不同的测序条件。而CompleteGe—nomics公司推出的DNA纳米阵列与组合探针锚定连接测序法"1则具有更高的容错能力,试剂的消耗也进一步减少,目前已顺利完成3个个体基因组的测序工作。 1.2第三代测序——单分子长片段有望实现第二代测序技术虽然在各方面都有了较大的突破,但是仍然建立在PCR扩增的基础上。为了避免PCR扩增带来的偏差,科学家目前正在研制对DNA单个分子直接测序的第三代测序仪。最具代表性的包括Heliscope单分子测序仪,单分子实时合成测序法,纳米孔测序技术等。 Helicos技术仍然是基于合成测序原理¨…,它采用了一种新的荧光类似物和灵敏的监测系统,能够直接记录到单个碱基的荧光,从而克服了其他方法须同时测数千个相同基因片段以增加信号亮度的缺陷。PacificBioscienees公司研发的单分子实时合成测序法充分利用了DNA聚合酶的特性,可以形象的描述为通过显微镜实时观测DNA聚合酶,并记录DNA合成的整个过程。纳米孔测序技术[11’121则是利用不同碱基在通过纳米小孔时引起的静电感应稍有不同,或者不同碱基通过小孔的能力各有差异,来加以区分不同的碱基信号。 2应用与实践 Kahvejian在2008年的一篇综述中提到¨“:“如果你可以随心所欲地测序,你会开展哪些研究?”。人类基因组计划的完成和近年来高通量测序的兴起,使越来越多的科研工作者认识到,我们对于生物界的认识才刚刚起步。基因图谱的绘制并不意味着所有遗传密码的破解,癌症基因组的开展也没有解决所有的医学难题。DNA变异的模式和进化机制,基因调控网络的结构和相互作用方式,复杂性状及疾病的分子遗传基础等,仍是困扰生物学家和医学家的难题,而高通量测序的广泛应用,也许可以让我们知道的更多。 2.1DNA水平的应用 2.1.1全基因组测序新一代测序技术极大地推
微生物基因组研究进展及意义
微生物基因组研究进展及其意义 近年来,病原微生物的基因组研究取得了飞速的进展。所谓基因组研究是指对微生物的全基因进行核苷酸测序,在了解全基因的结构基础上,研究各个基因单独或数个基因间相互作用的功能。由于过去人们大多从表型分析入手,寻找已知功能的编码基因,实际只了解微生物中极少数的基因,如链球菌的链激酶基因、结核杆菌编码的热休克蛋白基因等。还有大量未知基因未被发现。通过基因组研究,则从根本上揭示了微生物的全部基因,不仅可发现新的基因,还可发现新的基因间相互作用、新的调控因子等。这一研究将使人类从更高层次上掌握病原微生物的致病机制及其规律,从而得以发展新的诊断、预防及治疗微生物感染的制剂、疫苗及药品。此外,新发现的微生物酶及蛋白还可能有在工农业生产上的应用价值。因此,全球除已完成了70余株覆盖重要病毒科的病毒代表株全基因组研究外,据美国基因组研究所(The Institute for Genomic Research, TIGR)报道,目前已完成了19种微生物基因组测序,其中11种与人类及疾病相关(嗜血流感杆菌,生殖道支原体,肺炎支原体,幽门螺杆菌,枯草杆菌,伯氏疏螺旋体,结核杆菌,梅毒螺旋体,沙眼衣原体,普氏立克次体)。另外,还有40余种微生物已被登记正在进行测序,预计在1999~2000年完成〔1〕。 病毒基因组研究进展 病毒因其基因组小,是进行基因组研究最早的生物体。早在1977 年已完成了噬菌体DNA的全基因测序。存在于脊髓灰质炎疫苗中的SV40,是最早完成全基因测序的与疾病相关的病毒;此后,许多病毒均已完成了全基因测序,并根据序列的开放阅读框架(ORF)对编码蛋白进行了推导。已对相当一些病毒蛋白进行了重组表达,还对一些病毒基因编码的调控序列进行了研究。除一般大小的病毒已完成了基因组测序,对大基因组病毒,疱疹病毒科,如水痘病毒基因组为0.125Mb(Mega-basepair,兆碱基对)〔2〕。巨细胞病毒,基因组为0.229Mb〔3〕。我国已对痘苗病毒天坛株(约0.2Mb)进行了全基因测序,发现与国外的痘苗毒株序列有明显的差异〔4〕。我国还对甲、乙、丙、丁、戊、庚型肝炎病毒进行了国内毒株的全基因测序。近来还对国内2株发现的虫媒病毒毒株完成了全基因测序。我国从不同来源的标本中发现了不少乙肝病毒变异株,有的具有特殊的生物学特性〔5〕。对病毒基因中调控因子的分析,发现了与乙肝病毒增强子作用的新细胞核因子〔6〕。 因此,目前对病毒的基因组研究已进入了后基因组阶段,即从全基因水平研究病毒的生物学功能,同时发现新的基因功能。对于医学病毒学当前主要方向是研究病毒基因组中与致病及诱生免疫应答相关的基因,从而揭示和解决迄今尚未解决的问题,以达到控制或消灭一些重要病毒感染的目的。 建议目前可进行后基因组研究的领域为: 1.病毒持续性感染:基因组中与持续性感染相关的基因,基因变异或调控因子研究。已报道的乙肝病毒的前核心基因出现终止密码突变,
(完整版)测序常用名词解释整理
高通量测序领域常用名词解释大全 什么是高通量测序? 高通量测序技术(High-throughput sequencing,HTS)是对传统Sanger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next generation sequencing,NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing)。 什么是Sanger法测序(一代测序) Sanger法测序利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。直到掺入一种链终止核苷酸为止。每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。由于ddNTP缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。终止点由反应中相应的双脱氧而定。每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
什么是基因组重测序(Genome Re-sequencing) 全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。 什么是de novo测序 de novo测序也称为从头测序:其不需要任何现有的序列资料就可以对某个物种进行测序,利用生物信息学分析手段对序列进行拼接,组装,从而获得该物种的基因组图谱。获得一个物种的全基因组序列是加快对此物种了解的重要捷径。随着新一代测序技术的飞速发展,基因组测序所需的成本和时间较传统技术都大大降低,大规模基因组测序渐入佳境,基因组学研究也迎来新的发展契机和革命性突破。利用新一代高通量、高效率测序技术以及强大的生物信息分析能力,可以高效、低成本地测定并分析所有生物的基因组序列。
下一代DNA测序技术研究进展综述
深度DNA测序技术在基因组测序中的研究策略和进展 摘要:回顾了经典DNA测序技术原理,重点阐述了深度测序技术在基因组测序中的研究策略,并结合目前比较常见的二代测序仪来分析比较相互之间的特点和优势,最后,对即将到来的三代测序法的研究进展给予了简单的介绍。 关键词:深度DNA测序基因组测序仪 DNA测序技术的发展过程漫长而艰辛,然而,我们现在获取的大部分DNA序列信息还是依靠基于Sanger在1977年建立的“DNA双脱氧链末端终止测序法”的DNA测序技术获得的。另外就是Maxam和Gilbert建立的“化学降解测序法”。在过去的七年当中,DNA测序技术的发展至少受到来自四个方面的影响:首先是人类基因组计划的出现,这项计划的实施过程中,科学家们面临了巨大的经费问题,因为传统的Sanger测序法无论怎么优化,都无法大幅度降低测序的成本,这很大程度促进了人们对在测序过程中如何降低成本的技术方面的研究。第二,人类以及其他主要模式生物参考序列数据库的建立使得短片段阅读(short-read)成为可能,这极大的促进了短片段测序技术的发展。第三,新型分子生物学技术的不断涌现导致了越来越多的诸如RNA表达染色体构象等生物现象的出现,这就需要有高通量DNA测序手段去解释这些问题,这也极大的促进了新型测序技术的发展。第四,其他学科领域的技术的发展,例如计算机技术,数据存储及分析技术,聚合酶工程技术等,极大地支持了DNA测序技术的应用。本文主要是对目前新一代DNA测序(也叫深度测序)技术(Next-generation DNA sequencing technologies)的研究策略及目前国际DNA测序最新进展做一简要的综述。 1.Sanger测序法 先来回顾一下经典的DNA测序法,从上世纪九十年代早期开始,几乎所有的DNA测序都是利用半自动化的毛细管电泳Sanger测序技术完成的(图1-a)。后来出现了高通量测序法,这种方法首先要对DNA预处理,获取大量的待测序模板即质粒或PCR产物。然后在测序一种发生测序生化反应,这个过程会产生大量长短不一(因为终止位点不一样),末端被荧光标记的延伸产物。再用分辨率高的毛细管凝胶电泳分离这些延伸产物,通过对延伸产物末端四种不同荧光颜色的区分,利用计算机软件自动“读
DNA测序技术发展简史
DNA测序技术发展简史 摘要:本文回顾了1965年一来DNA测序技术的发展,重点介绍了双脱氧链终止测序法及Maxam-Gillbert DNA化学降解法的出现,以及其他的一些相关技术的发展,以简练清晰的脉络梳理了DNA测序技术的发展史。 关键词:DNA测序;双脱氧链终止测序法;Maxam-Gillbert DNA化学降解法 l953年,Watson和Crick提出DNA双螺旋结构模型以后,人们就开始探索研究DNA 一级结构的方法。1965年,美国Cornell大学以Rober Holley为首的科学家小组,第一次完成了长度为75个核苦酸的酵母丙氨酸tRNA的全序列测定并将结果发表在Science杂志上。其办法是利用各种RNA酶把tRNA降解成寡核苷酸,经分离纯化之后,再分别测定这些寡核苷酸短片段的核苷酸顺序掀开了DNA测序技术研究的序幕[1]。但那时由于没有找到分别降解四种脱氧核糖核酸的专一酶,只能通过测定RNA 的序列来推测DNA的序列,即先将RNA用酸水解或外切酶降解,再经双向电泳同系层析将其分开(小片段重叠法)。 1971年,华裔分子生物学家吴瑞博士(Dr.Ray Wu)在1968年独创性地设计了一种崭新的引物-延伸测序策略,发展出了测定DNA核苷酸序列的第一个方法,提高了DNA序列分析的速度,并于1971年首次成功地测定了λ噬菌体两个粘性末端的完整序列[2]。 l977年,英国剑桥大学分子生物学实验室的Fred Sanger领导的研究小组在吴瑞博士的基础上分别在Nature和PNAS发表文章,提出DNA聚合酶的双脱氧链终止原理测定核苷酸序列的方法,Sanger作为世界上第一个解决DNA测序的科学家,再一次荣获诺贝尔奖(1980年)[3]。DNA双脱氧链终止测序法,也称酶法或末端终止法,是利用2’,3’-双脱氧三磷酸核苷(2’,3’-ddNTP或简称ddNTP)来终止DNA的复制反应。ddNTP可以在DNA聚合酶作用下通过其5’-磷酸基团掺入到正在增长的DNA链中,但由于ddNTP在脱氧核糖的3’位置缺少一个羟基,它们不能同后续的dNTP形成磷酸二酯键(由M.R.Atkinson等人于1969年发现),从而中断延伸反应。该法将待测DNA样品分成四组,在每组DNA合成反应混合物的四种普通dNTP中加入少量的一种ddNTP,这样一来,链延伸将与偶然发生但却十分特异的链终止展开竞争,最终得到反应一系列的核苷酸链,其长度取决于从用以起始DNA合成的引物末端到出现过早链终止的位置之间的距离,由于这四组独立的酶反应中分别采用四种不同的ddNTP,将产生四组分别终止于模板链的每一个A、G、C或T的位置上的寡核苷酸,使用变性测序凝胶电泳分析这四组反应的产物,即可从放射自显影片上直接读出DNA的序列[4]。 而美国哈佛的Alan Maxam和Walter Gilbert领导的研究小组也几乎同时发明出DNA序列测定方法——Maxam-Gillbert DNA化学降解法测序,其基本原理是用特异的化学试剂修饰DNA分子中的不同碱基,然后用哌啶切断反应碱基的多核苷酸链。该法设计四组特异的反应:①G反应,用硫酸二甲酯使鸟嘌呤上的N7甲基化,加热引起甲基化鸟嘌呤脱落,导致多核苷酸链可在该处断裂;②G+A反应,用甲酸使A和G嘌呤环上的N原子质子化,从而使其糖苷键变得不稳定,再用哌啶使键断裂;③T+C反应,用肼使T和C的嘧啶环断裂,再用哌啶除去碱基;④C反应,在有盐存在时,只有C与肼反应,并被哌啶除去。这样一来,同一个末端标记的DNA片段在四组互相独立的化学反应中分别得到部分降解,每一组反应特异地针对某一种或某一类碱基,生成四组放射性标记的分子,从共同起点(放射性标记末端)延续到发生化学降解的位点,每组混合物中均含有长短不一的DNA分子,其长度取决于该组反应所针对的碱基在原DNA全片段上的位置。最后,通过聚丙烯酰胺凝胶电泳进行分离此后组产物,再从放射自显影片上即可读出序列[5]。
几种常见的基因测序技术的优缺点及应用
几种常见的基因测序技术的优缺点及应用 发布时间:2014-07-19 来源:毕业论文网 随着人类基因组计划的完成,人类对自身遗传信息的了解和掌握有了前所未有的进步。与此同时,分子水平的基因检测技术平台不断发展和完善,使得基因检测技术得到了迅猛发展,基因检测效率不断提高。从最初第一代以Sanger 测序为代表的直接检测技术和以连锁分析为代表的间接测序技术,到2005 年,以Illumina 公司的Solexa技术和ABI 公司的SOLiD 技术为标志的新一代测序(next-generation sequencing,NGS) 的相继出现,测序效率明显提升,时间明显缩短,费用明显降低,基因检测手段有了革命性的变化。其技术正向着大规模、工业化的方向发展,极大地提高了基因检测的检出率,并扩展了疾病在基因水平的研究范围。2009 年 3 月,约翰霍普金斯大学的研究人员在《Science》杂志上发表了通过NGS外显子测序技术,发现了一个新的遗传性胰腺癌的致病基因PALB2,标志着NGS 测序技术成功应用于致病基因的鉴定研究。同年,《Nature》发表了采用NGS 技术发现罕见弗里曼谢尔登综合征MYH3 致病基因突变和《Nat Genet》发表了遗传疾病米勒综合征致病基因。此后,通过NGS 技术,与遗传相关的致病基因不断被发现,NGS 技术已成为里程碑式的进步。2010 年,《Science》杂志将这一技术评选为当年“十大科学进展”。 近两年,基因检测成为临床诊断和科学研究的热点,得到了突飞猛进和日新月异的发展,越来越多的临床和科研成果不断涌现出来。同时,基因检测已经从单一的遗传疾病专业范畴扩展到复杂疾病和个体化应用更加广阔的领域,其临床检测范围包括高危疾病的新生儿筛查、遗传疾病的诊断和基因携带的检测以及基因药物检测用于指导个体化用药剂量、选择和药物反应等诸多方面的研究。目前,基因检测在临床诊断和医学研究的应用正越来越受到医生的普遍重视和引起研究人员的极大的兴趣。 本文介绍了几种DNA 水平基因检测常见的方法,比较其优缺点和在临床诊断和科学研究中的应用,对指导研究生和临床医生课外学习,推进临床科研工作和提升科研教学水平有着指导意义。 1、第一代测序 1.1 Sanger 测序采用的是直接测序法。1977年,Frederick Sanger 等发明了双脱氧链末端终止法,这一技术随后成为最为常用的基因测序技术。2001 年,Allan Maxam 和Walter Gibert 发明了Sanger 测序法,并在此后的10 年里成为基因检测的金标准。其基本原理即双脱氧核苷三磷酸(dideoxyribonucleoside triphosphate,ddNTP) 缺乏PCR 延伸所需的 3'-OH,因此每当DNA 链加入分子ddNTP,延伸便终止。每一次DNA 测序是由4个独立的反应组成,将模板、引物和 4 种含有不同的放射性同位素标记的核苷酸的ddNTP 分别与DNA 聚合酶混合形成长短不一的片段,大量起始点相同、终止点不同的DNA 片段存在于反应体系中,具有单个碱基差别的DNA 序列可以被聚丙烯酰胺变性凝胶电泳分离出来,得到放射性同位素自显影条带。依据电泳条带读取DNA 双链的碱基序列。 人类基因组的测序正是基于该技术完成的。Sanger 测序这种直接测序方法具有高度的准确性和简单、快捷等特点。目前,依然对于一些临床上小样本遗传疾病基因的鉴定具有很高的实用价值。例如,临床上采用Sanger 直接测序FGFR 2 基因证实单基因Apert 综合征和直接测序TCOF1 基因可以检出多达90% 的与Treacher Collins 综合征相关的突变。值得注意的是,Sanger 测序是针对已知致病基因的突变位点设计引物,进行PCR 直接扩增测序。
植物基因组学的的研究进展
基因组学课程论文 题目:植物基因组学的的研究进展姓名:秦冉 学号:11316040
植物基因组学的的研究进展 摘要:随着模式植物——拟南芥和水稻基因组测序的完成,近年来关于植物基因组学的研究越来越多。本文主要对拟南芥、水稻2种重要的模式植物在结构基因组学、比较基因组学、功能基因组学等领域的研究进展以及研究所使用的技术方法进行简单介绍。 关键词:植物;基因组学;研究进展 The recent progress in plant genomics research Abstract: With the completion of genome sequencing ofthe model plant-- Arabid opsis and rice,more and more researches on plant genomics emerge in recent yea rs. The research progress of the 2 important model plant--Arabidopsis and rice in structural genomics,comparative genomics,functional genomics and technology methods used in this research are introduced briefly in this paper. Keywords:plant; genomics; research advances 前言 基因组是1924年提出用于描述生物的全部基因和染色体组成的概念。1986年由美国科学家Thomas Roderick提出的基因组学是指对所有基因进行基因组作图(包括遗传图谱、物理图谱、转录本图谱)、核苷酸序列分析、基因定位和基因功能分析的一门科学。自从1990年人类基因组计划实施以来,基因组学发生了翻天覆地的变化,已发展成了一门生命科学的前沿和热点领域。而植物基因组研究与其他真核生物和人类基因组研究有很大的不同。首先,不同植物的基因组大小即使在亲缘关系非常近的种类之间差别也很大; 其次,很多植物是异源多倍体,即便是二倍体植物中有些种类也存在较为广泛的体细胞内多倍化( endopolyp loidy)现象[1]。基因组研究主要包括三个层次:①结构基因组学,以全序列测序为目标,构建高分辨率的以染色体重组交换为基础的遗传图谱和以DNA 的核苷酸序列为基础的物理图谱。②功能基因组学,即“后基因组计划”,是结构基因组研究的延伸,利用结构基因组提供的遗传信息,利用表达序列标签,建立以转录图谱为基础的功能图谱( 基因组表达图谱),系统研究基因的功能,植物功能基因组学是当前植物学最前沿的领域之一。③蛋白质组学,是功能基因组学的深入,因为基因的功能最终将以蛋白质的形式体现。 近来,以水稻( Oryza sativa)和拟南芥(Arabadopsis thaliana)为代表的植物基因组研究取得了很大进展,如植物分子连锁遗传图谱的构建,在此基础上,已经在植物基因组的组织结构和基因组进化等方面得到了有重要价值的结论; 植物基因组物理作图和序列测定的研究集中于拟南芥和水稻上; 植物比较基因组作图证实在许多近缘植物甚至整个植物界的部分染色体区段或整个基因组中都存在着广泛的基因共线性,使得我们可以利用同源性对各种植物的基因组结构进行研究、分析和利用。本文主要对拟南芥、水稻2种重要的模
