第15章 s区元素

第十五章 s区元素
一、教学基本要求
1. 了解s区元素的物理性质和化学性质,能解释碱金属与水、醇和液氨反应的不同;
2. 了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同;
3. 了解s区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化
规律;
4. 了解s区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释;
5. 会用离子极化理论解释碳酸盐分解规律;
6. 了解对角线规则和锂、铍的特殊性。
二、要点
1. 汞齐(amalgam )
又称汞合金,汞的特性之一是能溶解除铁以外的许多金属而生成汞齐。汞与一种
或几种金属形成汞齐时,含汞少时是固体,含汞多时是液体。天然的有金汞齐,银
汞齐,人工制备的有:钠汞齐、钾汞齐、锌汞齐、锡汞齐、铅汞齐等。
2. 熔盐电解法(Molten-salt electrolysis)
指以熔融态盐类为原料的电解方法,常用于制备不能由水溶液中制备的金属,如碱金属、碱土金属以及钍、钽混合稀土金属的生产。有时为降低熔体的熔点,节
省电能,须加入一定量的助熔剂。
3. 热还原法(Thermo-deoxidization)
用化学活性较强的金属,将被还原的金属从其化合物中置换出来,以制备金属或其
合金的方法。
4. 冠醚(Crown ether)
分子结构类似皇冠的“大环多醚”。最常用的有18-冠-6 (如下图中的a)、二环己基
-18-冠-6及二苯基18-冠-6等。冠醚对K+、Na+及其他阳离子有很强的选择性络合
,F- ),提
K + X- 表示( X=MnO
4高了裸阴离子的活性。冠醚在有机合成中常用作“相转移反应的催化剂”。
5.穴醚(Cryptant)
分子结构类似地穴的“大环多醚”。穴醚几乎能够实现对K+和Na+离子的完全
分离,选择性可高达105:1。如下图中的(b) (c)所示。
(a) (b) (c)
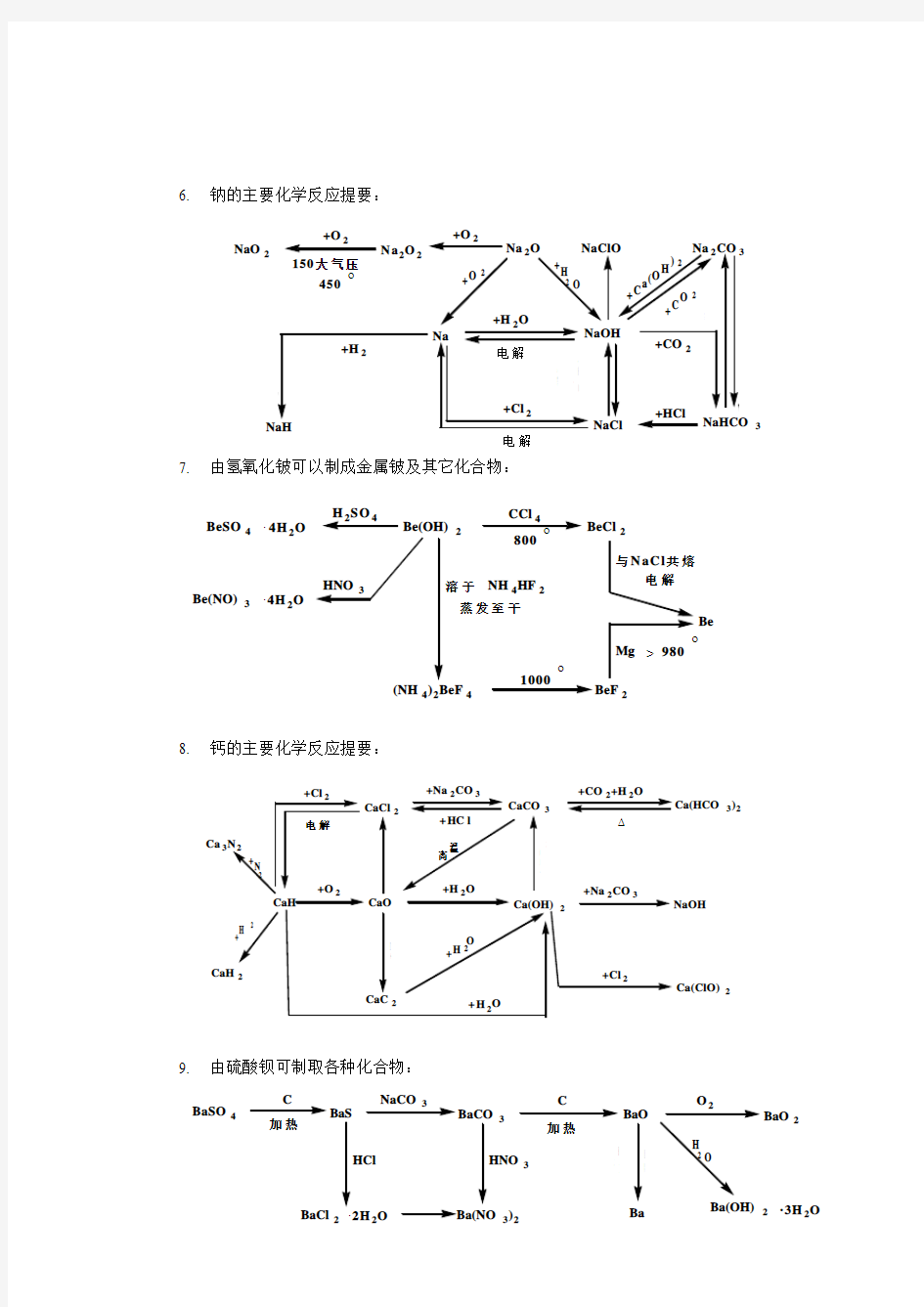
6. 钠的主要化学反应提要:
7. 由氢氧化铍可以制成金属铍及其它化合物:
8. 钙的主要化学反应提要:
9. 由硫酸钡可制取各种化合物:
Ca 3Ca(HCO
3)2
Ca(ClO)
2
BaSO
4
C
BaCl
2
2O
NaCO
3
3
3
2
Ba(OH)
2
3H 2O
2Ba(NO
3)2
C
加热
加热
·
Ba
BeSO
4
4H 2O
24
2
Be(NO)
3
4H 2O
(NH 4)2BeF 4
1000
2
Be
于
蒸发至干
·CCl 4
800
BeCl ·NH 4HF 2
o
o
NaO
2
+C O +H O
3
电解
10. 对角线规则(diagonal rule)
在周期表的二、三周期中,某一元素的性质和它左上方或右下方的元素性质的相似性,称为对角线规则。这种相似性比较明显的表现在Li和Mg、Be和Al、B和Si三对元素之间,但C和P以及其它元素之间也存在某些对角线效应。
12.1单质
s区第1族的6个金属元素锂、钠、钾、铷、铯、钫和第2族的
6个金属元素铍、镁、钙、锶、钡、镭分别被称之为碱金属(alkali metals)
和碱土金属(alkaline earth metals)元素,最外层电子组态分别为ns1和
ns2。由于受到内层电子的强烈屏蔽, 核对最外层电子的控制较松弛。
因而单质的化学性质都非常活泼, 容易失去各自的ns电子分别形成
+1价和+2价阳离子, 其氧化态与各自的族号相对应。长期以来, 这
两族元素难以引起化学家的强烈兴趣, 这是因为:各类化合物中很少
存在族氧化态以外的其他氧化态; 元素和化合物的性质随半径发生
单调变化,形成配位化合物的能力极弱,长时期内没有出人预料的新发现。本章的内容主要仍属经典无机化学范畴,但仍然给出了强烈的信息:一个发展的活跃期正在到来。
1 物理和化学性质
物理性质单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。它们在密度、熔点、沸点和硬度方面往往差别较大。
化学性质
1.它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化台物。如可与卤素、硫、氧、磷、氮和氢等元素相化合。一般均形成离子化台物(除Li、Be及Mg的卤化物外)。
2.单质与水反应放出氢气。其中Be和Mg由于表面形成致密的氧化膜因而对水稳定。
3.标准电极电势均很负,是很强的还原剂。它们的还原性在于态及有机反应中有广泛的应用。如高温下Na、Mg、Ca能把其它一些金属从氧化物或氯化物中还原出来.
4.单质制备
由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。单质的制备多数采用电解它们的熔盐。
表1和表2分别给出碱金属和碱土金属的某些性质。
表1 碱金属和碱金属离子的某些性质
性质
Li Na K Rb Cs 基态电子组态 金属半径, r (M)/pm 离子半径, r (M +)/pm 熔点, t /℃ 沸点, t /℃
第一电离能, I 1/kJ·mol -1 密度(20℃), ρ/(g·cm -3) 硬度 a 火焰颜色
标准电极电势, E ○一/V
[He]2s 1 152 59 180.54 1347 520.2 0.534 0.6 洋红色 -3.040
[Ne]3s 1 186 99 97.81 883.0 495.8 0.971 0.4 黄色 -2.713
[Ar]4s 1 227 138 63.65 773.9 418.8 0.862 0.5 紫色 -2.924
[Kr]5s 1 248 149 39.05 687.9 403.0 1.532 0.3 带蓝的红色 -2.924
[Xe]6s 1 265 170 28.4 678.5 375.7 1.873 0.2 蓝色 -2.923
a Mohs 硬度, 滑石定为0, 金刚石定为10.
表2 碱土金属和碱土金属离子的某些性质
性质
Be Mg Ca Sr Ba 基态电子组态 金属半径, r (M)/pm 离子半径, r (M 2+)/pm 熔点, t /℃ 沸点, t /℃
第一电离能, I 1/kJ·mol -1 密度(20℃), ρ/(g·cm -3) 硬度 a 火焰颜色
标准电极电势, E ○一
/V [He]2s 2 111 27 1278 2970 899.4 1.85 ~5 无色 -1.85
[Ne]3s 2 160 72 648.8 1090 737.7 1.74 2.0 无色 -2.356
[Ar]4s 2 197 100 839 1483.6 589.7 1.55 1.5 橙红色 -2.84
[Kr]5s 2 215 113 769 1383.9 549.50 2.54 1.8 鲜红色 -2.89
[Xe]6s 2 222 136 729 1637 502.8 3.60 ~2 绿色 -2.92
a 见表1的脚注.
与其他金属一样,两族金属单质具有金属光泽以及良好的导电性、导热性和延展性。除铍和镁外的其他金属的质地都较软,可用小刀切开。锂、钠、钾的密度小于水, 因而能浮在水面上。碱金属易熔化而且容易转化为蒸气, 后一性质用于它们的蒸馏提纯。碱金属和碱土金属是活泼或非常活泼的金属,能直接或间接与电负性较高的非金属单质如卤素、氧、硫、磷、氢等反应形成化合物。单质的化学以其还原性为特征,图1和图2给出一些典型反应。
NH (l)
NH (aq or g)
Amalgam
(X = halogens)
Figure 1 Selected reactions of the alkali metals.
两族金属被水氧化的反应分别为:
2 M(s) + 2 H2O(l) =2 M+(aq) + 2 OH-(aq) + H2(g) (M = 碱金属)
M(s) + 2 H2O(l) =M2+(aq) + 2 OH-(aq) + H2(g) (M = 碱土金属) 钠和钠下方的同族元素与H2O的反应十分激烈, 反应中生成的H2能自燃。反应剧烈的原因之一是金属的熔点低,反应中放出的热量足以使金属熔化,H2O分子容易通过熔体的清洁表面与金属相接触。熔点相对较高的金属锂在反应过程中不熔化,生成溶解度较小的LiOH 覆盖于表面使反应变得较缓和。实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂, 为了提高干燥效率, 金属钠通常被挤压成条状使用。需要指出, 金属钠不能用来干燥醇类溶剂。这是因为钠的还原性是如此之强, 以致能将醇羟基中的氢原子还原为H2,例如与乙醇的反应:
steam
Figure 2 Selected reactions of the alkaline earth metals.
2 CH3CH2OH(l) + 2 Na(s) 2 NaOCH2CH3(sln) + H2(g)
金属钠与卤代溶剂发生的反应十分猛烈, 因而也不能用来干燥这类溶剂。例如, 与CCl4发生的反应为:
CCl4(l) + 4 Na(s) 4 NaCl(s) + C(s) △r G○一m = -249 kJ·mol-1
您也许不会想到, 我国化学家竞通过这一反应在相对温和的条件下制得了金刚石两族元素的单质都是强还原剂,表1和表2给出了相关电对的标准电极电势。从表1的数据不难发现两个特点:
1) 5种碱金属的标准电极电势相差无几,其数值都在–2.9 V左右。这一现象没有反映碱金属原子电离能的变化趋势。碱金属原子的电离能自Cs至Li依次增大, 化学家本可指望标准电极电势按同一顺序上升(负值减小)。
这一现象与碱金属阳离子的水合作用有关。碱金属阳离子的水合能自Cs+至Li+依次增大, 标准电极电势相互接近的事实是两种能量变化趋势的总体现。
2) Li的标准电极电势(-3.040 V)明显低于其它几种碱金属。这意味着,锂这个原子半径最小、电离能最高的元素倒成了水溶液中最强的还原剂。
这一现象同样可由水合作用得到解释。Li+是第1族中最小的阳离子, 其水合程度(表现为水合分子数的多少)和水合强度(表现为水合焓的高低)都是最大的。虽然每个Li+离子只直接键合4个H2O分子,但还有20个左右的H2O分子处于第2水合层, 总配位数高达25。如此强的水合作用使锂比同族其他元素高出的水合能(数值为负值)补偿高出的电离能(数值为正值)之后还有余。
碱金属与汞一起研磨时发生强放热反应生成汞齐(amalgam)。有人将汞齐看作合金,例如钠汞齐被看作金属钠(固体)和汞(液体)的合金。随着钠含量的增加, 钠汞齐由液体变成固体。与金属钠本身相比, 钠汞齐与水的反应要平稳得多:
2 NaHg(s or l) + 2 H2O(l) 2 NaOH(aq) + H2(g) + 2 Hg(l)
传统的氯碱工业中利用汞阴极电解形成的钠汞齐与水反应制烧碱。由于带来严重的Hg 污染,这一方法正在被淘汰。
金属钠与液氨之间发生非常独特的反应。碱金属在液氨中的溶解度达到超出人们想象的程度,39.8 g的液氨在-50℃时溶解的金属铯高达132.9 g。有趣的是, 不论溶解的是何种金属, 稀溶液都具有同一吸收波长的蓝色。这暗示各种金属的溶液中存在着某一共同具有的物种, 后来的实验证实这个物种为氨合电子。钠溶于液氨的反应如下:
Na(s) + x NH3(l) Na+(am) + e-(am)
式中和图1中的“am”代表氨,表示相关的物种为氨合物种。只要液氨保持干燥和足够高的纯度(特别是没有过渡金属离子存在),这种蓝色溶液就相当稳定。碱金属的氨溶液被广泛用作有机合成中的还原剂,以实现那些用其他方法无法实现的还原反应。钠溶于某些干燥的有机溶剂(如醚)也会产生溶剂合电子的颜色。用钠回流干燥这些溶剂时, 蓝色的出现可看作溶剂处于干燥状态的标志。
2 矿物资源和金属单质制备
由于对水和氧的高度活泼性, s区金属元素只能以化合物形式存在于自然界。其中有些元素在地壳中的丰度相当高,例如钙、钠、镁、钾的丰度分别排在第5,第6,第7和第8位。
最具工业价值的锂矿物是锂辉石(Li2O·Al2O3·SiO2),盐湖卤水也是重要的锂资源。海水(含NaCl约2.7%)和盐湖中的氯化钠是最重要的钠资源。重要的钾矿包括钾石盐(KCl)和盐卤, 青海省察尔汗盐湖的盐卤是我国目前钾盐生产的主要支柱。我国钾肥需求量的80%仍靠进口,几年前在罗布泊发现了一个超大型钾盐资源,将会大大缓解这种局面。
最重要的铍矿物为绿柱石(3BeO·Al2O3·6SiO2)。海水是镁的重要来源, 每1 km3海水中含镁1.3×106t,而海水总量高达1018km3。此外, 菱镁矿(MgCO3)、白云石(CaCO3·MgCO3)和光卤石(KCl·MgCl2·6H2O)也是重要的镁矿物。有工业价值的钙资源包括钙的碳酸盐(如石灰石, 大理石, 方解石)、硫酸盐(如石膏CaSO4·2H2O)、磷酸盐[如氟磷灰石Ca5(F)(PO4)3]、氟化物(如萤石CaF2)和钙镁碳酸盐(如白云石),其中以石灰石最重要。
表1和表2的数据表明, 碱金属和碱土金属单质不能用水溶液电解的方法制备。相关电对的标准电极电势比H3O+/H2电对负得多,电解时是H3O+离子而不是金属离子在阴极放电。要使金属离子还原为金属,通常使用熔盐电解法或热还原法。
金属锂、金属钠和占总产量80%的金属镁用熔盐电解法生产。电解质通常采用无水氯化物的混合物, 这样不但可以降低电解质的熔化温度以节约能源, 并减少了金属的挥发。以锂的生产为例, 电解质为LiCl与KCl的混合物(质量比约1:1), 采用钢制电解槽,阴极和阳极材料分别为钢和石墨。电解反应如下:
阳极: 2 Cl-Cl2 + 2 e -
阴极: 2 Li+ + 2 e - 2 Li
总反应:2 LiCl(l) 2 Li(l) + Cl2(g) (12.7)热还原法用来生产金属钾和金属钙。钾熔于熔融的KCl而难以分离, 因而熔盐电解法不能用于生产金属钾。钾的生产是用金属钠在760~880℃还原KCl熔体, 得到的钾钠合金再经分级蒸馏法分离提纯。生产金属钙的主要方法是在1 200℃和真空条件下用金属铝还原CaO,产生的钙蒸气收集在冷凝装置中。这一方法能用来生产金属钙,是因为钙蒸气挥发的同时, 另一个反应产物(Al2O3)形成没有挥发性的熔渣:
1200℃
6 CaO(s) + 2 Al(l) 3CaO·Al2O3(s) + 3 Ca(g) (12.8) 3 用途概述
金属锂主要用在4个方面:
1. 制造氢化锂、氨基锂和合成有机锂化合物, 后者用作有机化学中的还原剂和聚合反应的催化剂。
2. 制造Al-Li合金(含锂2%~3%),这种合金因质量轻和强度大而用于空间飞行器。
3. 制造高功率长效电池, 例如心脏起搏器电池和装在您的笔记本电脑中的锂离子电池。
4. 63Li同位素(在天然锂中约占7.5%)受中子轰击产生氚:
6
Li + 10n 31H + 42He
3
氚是制造热核武器(氢弹)的主要原料, 也是核聚变反应堆的增殖材料。
钠的一个重要用途是作为还原剂生产某些难熔的金属, 如钛、铀、钍、锆、钽等, 还原TiCl4制备钛的反应为:
TiCl4(l) +4 Na(l) Ti(s) + 4 NaCl(s)
金属钠的具有高导热性和低的中子吸收能力, 故被用作快速增殖反应堆的冷却剂。1980年代以前, 市场上的金属钠主要被用来制备钠铅合金(PbNa), 后者与氯乙烷(C2H5Cl)反应生产汽油抗震剂四乙基铅(C2H5)4Pb。1970年代中期以来,随着无铅汽油的推广,钠的年产量逐年在下降。科学家们正倾心于开发钠的新用途。
金属钾在工业上的应用范围小得多,世界年产量只及钠的0.1%! 钾主要用于制造KO2(生氧剂)和低熔点钠钾合金(通常为液体), 后者与钠和钾一样, 可被用来干燥有机溶剂或不与其起反应的气体。钠钾合金的比热容较高, 因而而用作传热介质,例如用作核反应堆的冷却剂。
铍(与镁和铝)属于所谓的“轻金属”。世界铍耗量的70%~80%用来制造铍铜合金, 这种合金主要用在各种电器设备上。金属铍和铍基合金的弹性-质量比、拉伸应力和导热性都较高,因而用于各种空间飞行器。约有6%~8%的铍以BeO形式消耗,氧化铍用于制造氧化物陶瓷,这种陶瓷因具有高熔点和高化学稳定性而用来制造印刷电路板。航空工业、航天工业和电子工业的发展对金属铍和氧化铍的需求不断增大, 但由于价格太高、加工程序复杂以及铍尘和铍蒸气被认为有毒(参见副篇)而使应用受到限制。
镁是最轻的一种结构金属,也是用途最大的碱土金属。20世纪90年代初期, 全世界镁耗量估计高达400×103 t,70%用于制造各种合金。除了质轻和机械强度高之外, 镁合金还有其他许多优良性能,因而广泛应用于航空和宇航工业。目前发射到空间轨道上的飞行器中, 镁比其他任何金属都要多。
全世界钙的年产量不到镁的1% 。金属钙很少用于制合金,在某些特殊金属(如锆、钍、铀、镧系金属)和钐钴永磁合金(SmCo5)的制造中用作还原剂。
12.2 化合物
1 氧化物和氢氧化物
(1)碱金属的氧化物比碱土金属的氧化物种类多。它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li的主要产物是Li2O(正常氧化物),而Na、K、Rb、Cs的主要产物分别是Na2O2(过氧化物)、KO2(超氧化物)、RbO2(超氧化物)和Cs2O2(过氧化物)。
(2)氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
2 盐类
(1).碱金属的盐类
有MX(卤化物)、MNO3、M2SO4、M2CO3、M3PO4等。它们的共性如下:
①都是离子晶体(Li盐除外);
②都易溶解。除Li盐和极少数大阴离子组成的盐以外,例如LiF、Li2CO3、Li3PO4、Na[Sb(OH)6]、NaZn(UO2)3(CH3COO)9·6H2O等均难溶。
③热稳定性均很高,但Li 2CO3和硝酸盐除外,它们加热会分解:
④易形成复盐。
光卤石类通式:M+Cl·MgCl2·6H2O (M+=K+,Rb+,Cs+)
矾类通式:M2+SO4·MgSO4·6H2O (M+=K+,Rb+,Cs+)
(2)碱土金属盐类
其溶解度与碱金属盐有些差别。它们的碳酸盐、磷酸盐和草酸盐均难溶。BaSO4、BaCrO4
的溶解度亦很小。
它们的碳酸盐在常温下均较稳定(BeCO3例外),但加热可分解:
热稳定性由Mg到Ba顺序增强。
碱金属和碱土金属在通常条件下与氧形成的二元化合物可分为四大类,其通式是:
碱金属碱土金属
氧化物M2O (M = Li,Na) MO (M = Be, Mg, Ca, Sr, Ba)
过氧化物M2O2 (M = Na,K,Rb,Cs) MO2 (M = Ba)
超氧化物MO2 (M = K,Rb,Cs)
臭氧化物MO3 (M = K,Rb,Cs)
在四类化合物中, 金属都处于各自的族氧化态。氧的存在形式分别为O2-, O22-, O2-和O3-离子。原子半径最小的两个金属(Li和Be)显示出它们的个性, 与氧直接化合只生成氧化物。这里遇到一个有趣的现象:体积较大的过氧阴离子、超氧阴离子和臭氧阴离子更易被体积较大的金属阳离子所稳定。这里体现了适用于离子型化合物的一条规律: 大阳离子稳定大阴离子, 小阳离子稳定小阴离子。
锂在某种程度上表现出的“另类”于其它碱金属元素的性格。例如锂的碳酸盐难溶于水,在高温下容易分解为Li2O和CO2,金属锂在空气中容易生成氮化物(Li3N)等。在这些方面,它的性质更像镁。锂和镁处于周期表中对角线的位置上,化学上将这种相似性叫作对角线关系(diagonal relationship)。这种关系也存在于Be-Al和B-Si两对元素之间(图3)。
(a). 溶解性碱土金属的硝酸盐、醋酸盐、高氯酸盐以及除氟化物之外的其他卤化物都是易溶的,而碳酸盐、草酸盐和磷酸盐都是难溶的。硫酸盐和铬酸盐的溶解度递变规律是“相差溶解”现象的极好实例。对SO42-和CrO42-两个大阴离子而言,阳离子半径较小的铍盐和镁盐都是易溶盐,而阳离子半径较大的BaSO4和BaCrO4溶解度都很小。化学分析中经常用到下列几个沉淀反应进行离子的鉴定或分离:
Ba2+(aq) + SO42-(aq) BaSO4(s)
2 Ba2+(aq) + Cr2O72-(aq) +
3 H2O(l) 2 BaCrO4(s) + 2 H3O+(aq)
Ca2+(aq) + C2O42-(aq) CaC2O4(s)
与BaSO4不同,铬酸钡和草酸钙均能溶于稀的强酸(如盐酸)溶液中:
2 BaCrO4(s) + 2 H3O+(aq) 2 Ba2+(aq) + Cr2O72-(aq) +
3 H2O(l)
CaC2O4(s) + H3O+(aq) Ca2+(aq) + HC2O4-(aq) + H2O(l)
这意味着, 不能在酸性太强的溶液中沉淀BaCrO4和CaC2O4。
(b)碳酸盐的热稳定性碱土金属碳酸盐加热时按下式分解:
MCO3(s) MO(s) + CO2(g)
如果MCO3中的M分别为Mg、Ca、Sr和Ba, 加热使CO2分压升至1.0×105 Pa所需的温度如下:
化合物MgCO3CaCO3SrCO3BaCO3
分解温度(℃) 300 840 1 100 1 300
即,分解温度随阳离子半径的增大而上升。化学家常常需要根据他们熟悉的一些概念(例如离子半径、电荷等)对化合物的性质做出定性判断, 判断无机离子晶体化合物热稳定性的一条规律是:大阳离子能稳定大阴离子。或者说,含大阴离子(如CO32-)的化合物的热分解温
度随阳离子半径的增大而增高。
3 大环配位化合物
碱金属的配位化学过去研究得很少, 金属离子的低电荷和大体积使其接受配位体的能力比较弱。大环效应的发现使人们对该领域的兴趣和系统研究迅速发展了起来,新化合物的多样性几乎可以使过渡金属配合物的多样性面临挑战了。
第1族阳离子和第2族大阳离子最著名的配合物是与大环配体形成的配合物。一类叫作冠醚(crown ether)的配位体是美国化学家佩德森(Pederson C J)于1967年首次报导的, 这类具有大环结构的聚醚化合物因形似皇冠而得名。图12.4(a)给出的一个例子叫18-冠-6, 18和6
分别表示环原子数和环氧原子数,距离最近的O 原子间以“-CH 2-CH 2-”相桥联。冠醚与碱金属离子形成相对稳定的配合物,碱金属的18-冠-6配合物在非水溶液中几乎能无限期稳定存在。就在佩德森报道冠醚化合物的第二年,法国化学家莱恩(Lehn J M)报道了另一类叫作穴醚(cryptand)的大环化合物。这类化合物中含有O 和N 两种杂原子,由于分子结构形似地穴而得名。碱金属阳离子的穴醚配合物比冠醚配合物更稳定,甚至能存在于水溶液中。这显然与穴醚更接近于实现对金属离子的完全包封有关。图4(b)给出的例子叫穴醚2.2.1,结构中存在3个氮-氮链节, “2.2.1”表示每个链节中氧原子的数目。图4(c)给出的例子叫穴醚2.2.2,与穴醚2.2.1不同的是,中间的氮-氮链节中有2个氧原子。可以想象,穴醚2.2.2的穴腔大于穴醚2.2.1。
作为配位体, 冠醚和穴醚显示一种十分有趣的性质。即,不同大小、不同形状的穴腔对碱金属离子具有选择性。穴醚几乎能够实现对K +和Na +离子的完全分离, 选择性可高达105:1。对Na +/K +的选择性具有非常重要的意义,许多生理功能是靠这种选择性支持的。 大环化学的发展导致一个化学新领域的诞生,即美国化学家克拉姆(Cram D J)提出的主-客体化学(host-guest chemistry)。上述大环配体和金属离子分别是“主体”(host)和“客体”(guest),主体根据客体的大小、分子构型等性质对客体进行“识别”(即选择配位)形成“主-客体配合物”。图12.5(也见本教材封面图案)给出主-客体化学概念的示意。 主-客体之间这种像锁钥一样的专属性被化学家用来模拟生物体中酶(enzyme)与底物(substrate)之间的作用(参见图5)。1987年诺贝尔化学奖授予佩德森、莱恩和克拉姆这三位化学家,以表彰他们在大环配位化学领域进行的开创性研究工作。
host
guest host-guest complex
Figure .5 Host-guest chemistry
(a) (b)
(b)
第12章 S区元素(第一套)
第12章 S区元素(第一套) 一、单选题 1. 重晶石的化学式是 (A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO3 2. 下列碳酸盐,溶解度最小的是 (A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO3 3. NaNO3受热分解的产物是 (A)Na2O,NO2,O2;(B)NaNO2,O2; (C)NaNO2,NO2,O2;(D)Na2O,NO,O2。 4. 下列哪对元素的化学性质最相似 (A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al 5. 下列元素中第一电离能最小的是 (A) Li (B) Be (C) Na (D) Mg 6. 下列最稳定的氮化物是 (A) Li3N (B) Na3N (C) K3N (D) Ba3N2 7. 下列水合离子生成时放出热量最少的是 (A) Li+ (B) Na+ (C) K+ (D) Mg2+ 8. 下列最稳定的过氧化物是 (A) Li2O2 (B) Na2O2 (C) K2O2 (D) Rb2O2
9. 下列化合物中键的离子性最小的是 (A) LiCl (B) NaCl (C) KCl (D) BaCl2 10. 下列碳酸盐中热稳定性最差的是 (A) BaCO3 (B) CaCO3 (C) K2CO3 (D) Na2CO3 11. 下列化合物中具有磁性的是 (A) Na2O2 (B) SrO (C) KO2 (D) BaO2 12. 关于s 区元素的性质下列叙述中不正确的是 (A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物 (B) 在s 区元素中,Be、 Mg 因表面形成致密的氧化物保护膜而对水较稳定 (C) s 区元素的单质都有很强的还原性 (D) 除Be、 Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料 13. 关于Mg , Ca , Sr , Ba 及其化合物的性质下列叙述中不正确的是 (A) 单质都可以在氮气中燃烧生成氮化物M3N2 (B) 单质都易与水水蒸气反应得到氢气 (C) M(HCO3)2在水中的溶解度大MCO3的溶解度 (D) 这些元素几乎总是生成+2 价离子 二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”错的填“×”) 1. 因为氢可以形成H+,所以可以把它划分为碱金属
s区元素
第9章 s 区元素 【9-1】试说明碱金属和碱土金属在同一族从上到下,同一周期从左到右下列性质递变的情况:(1)离子半径, (2)电离能,(3)离子水和能。并解释原因。 解:(1)碱金属和碱土金属从上到下离子半径增大,这是因为随着主量子数的增加,外层电子在核外出现概率最大的距离明显增加;在同一周期中,从左到右离子半径减小,这是因为随着核电荷的增加,核对于核外电子的吸引力(即有效核电荷)增强的缘故。 (2)碱金属和碱土金属从上到下电离能减小,是因为随着原子半径的增加,原子核对外层电子的束缚力减小;在同一周期中,从左到右电离能增大,这是因为随着有效核电荷的增加,和对外层电子的束缚力增加的缘故。 (3)碱金属和碱土金属从上到下水合能减小,这是因为随着原子序数增加,离子半径增加,正离子与水分子相互作用力减小的缘故。。在同一周期中,从左到右水合能增加,碱土金属离子在水溶液中,均为正二价离子,所以电荷高于正一价碱金属离子的缘故。 【9-2】锂、钠、钾在氧气中燃烧生成何种氧化物?这些氧化物与水反应情况如何?以化学方程式来说明。 解:分别生成Li 2O 、Na 2O 2、KO 2 ; 【9-3】写出下列反应方程式: (1)Al 溶于NaOH 溶液中 (2)Ba(NO 3)2加热分解 (3)Na 2O 2+CO 2 (4)CaH 2+H 2O (5)Na 2O 2+Cr 2O 3 (6)K+KNO 3 解:(1) 2Al + 2NaOH + 6H 2O = 2NaAl(OH)4 + 3H 2↑(2)Ba(NO 3)2 = Ba(NO 2)2 + O 2↑(3) 2Na 2O 2 + 2CO 2 =2NaCO 3 + O 2(4) CaH 2 + 2H 2O =Ca(OH)2 + 2H 2↑(5) 3Na 2O 2 + Cr 2O 3 = 2Na 2CrO 4 + Na 2O (6) 10K + 2KNO 3 = 6K 2O + N 2↑ 【9-4】比较下列性之的大小: (1)溶解度:CsI ,LiI ,CsF ,LiF ,LiClO 4,KClO 4 (2)碱性的强弱:Be(OH)2, Mg(OH)2,Ca(OH)2, NaOH (3)分解温度:Na 2CO 3,NaHCO 3,MgCO 3, K2CO 3 (4)水和能:Na +, K +,Mg 2+,Be 2+ 解:(1)溶解度:CsI
第十六章 氧族元素习题参考
第十六章氧族元素习题参考 7. 少量Mn2+可以催化分解H2O2,其反应机理解释如下:H2O2能氧化Mn2+为MnO2,后者又能使H2O2氧化。试从电极电势说明上述解释是否合理,并写出离子反应方程式。 解:H2O2+2H++2e-=2H2O φ01=1.77V MnO2+4H++2e-=Mn2++2H2O φ02=1.23V O2+2H++2e-=H2O2φ03=0.692V ①-②H2O2+Mn2+ =MnO2+2H+ E0=φ01-φ02=0.54V>0 ②-③MnO2+H2O2+2H+=Mn2++O2+2H2O E0=φ02-φ03=1.23-0.68=0.55V>0 8. 写出H2O2与下列化合物的反应方程式:KMnO4(在H2SO4介质中),Cr(OH)3(在NaOH介质中)。 解:3H2O2 + 2Cr(OH)3 + 4NaOH→2Na2CrO4 + 8H2O 5H2O2 + 2KMnO4 + 3H2SO4→2MnSO4 + K2SO4 +8H2O + 5O2 14. 完成下列反应方程式,并解释在反应(1)过程中为什么出现由白到黑的颜色变化。 (1)Ag++S2O32-(少量)→ (2)Ag++S2O32-(过量)→ 解:2Ag+ + S2O32- (少量)→Ag2S2O3 (白色) Ag2S2O3 + H2O→Ag2S↓(黑色) + 2H+ + SO42-
第一个反应首先形成白色硫代硫酸银沉淀,随后经历黄色、棕色至黑色的硫化银。 Ag+ + 2S2O32- (足量)→[Ag(S2O3)2]3- 16. 写出下列各题的生成物并配平反应方程式: (1)Na2O2与过量冷水反应。Na2O2 + 2H2O→2NaOH + O2(2)在Na2O2固体上滴加几滴热水。2Na2O2+ 2H2O →4NaOH + O2 (3)在Na2CO3溶液中通入SO2至溶液的PH=5左右。Na2CO3+2SO2+H2O→2NaHSO3+CO2 (4)H2S通入FeCl3溶液中。H2S+2FeCl3→S+2FeCl2+2HCl (5)Cr2S3加水。Cr2S3+H2O→Cr(OH)3+H2S (6)用盐酸酸化多硫化铵溶液。2HCl + (NH4)2S x→H2S + (x-1)S + 2NH4Cl (7)Se和HNO3反应。3Se+4HNO3+H2O→3H2SeO3+4NO 18. 将SO2(g)通入纯碱溶液中,有无色无味气体A逸出,所得溶液经烧碱中和,再加入硫化钠溶液除去杂质,过滤后得溶液B。将某非金属单质C加入溶液(B)中加热,反应后再经过过滤、除杂等过程后,得溶液D。取3mL溶液D加入HCl溶液,其反应产物之一为沉淀C。另取3mL溶液D,加入少量AgBr(s),则其溶解,生成配离子E。再取第3份3mL溶液D,在其中加入几滴溴水,溴水颜色消失,再加入BaCl2溶液,得到不溶于稀盐酸的白色沉淀F。试确定A~F的化学
第十二章 s区元素复习提纲,及试题
第十二章s区元素预习提纲 1、碱金属和碱土金属的概述。 2、单质的存在及制备,物理和化学性质。 3、掌握碱金属和碱土金属的重要氢化物,氧化物,过氧化物,超氧化物的生成和基本性质。 4、碱金属和碱土今生缘氢氧化物碱性强弱的变化规律。 5、重要的盐类的溶解性和稳定性。 6、锂和铍的特殊性。 第十二章s区元素复习题 一、是非题: 1、碱金属或碱土金属的原子电离势都是自上而下降低,但它们生成离子M+或M2+的标准电极电势并不是自上而下减小的。 2、Na在蒸气状态下可以形成双原子分子,而Be在蒸气状态下仅能形成单原子分子。 3、除LiOH外,所有碱金属氢氧化物都可加热到熔化,甚至蒸发而不分解。 4、在空气中燃烧Ca或Mg,燃烧的产物遇水可生成氨。 5 碱土金属的碳酸盐和硫酸盐在中性水溶液中的溶解度都是自上而下的减小。 二、选择题: 1、下列金属中最软的是 A、Li B、Na C、Cs D、Be 2、与同族元素相比,有关铍的下列性质中描述不正确的是 A、有高熔点 B、有最大密度 C、有最小的原子半径 D、硬度最大 3、下列方法中适合制备金属铯的是 A、熔融盐电解法 B、热还原法 C、金属置换法 D、热分解法 5、金属锂应存放在A、水中B、煤油中C、石蜡中D、液氨中 6、碱金属在过量的空气中燃烧时,生成 A、都是普通的氧化物M2O B、钠钾是过氧化物M2O2 C、钾铷铯是超氧化物MO2 D、铷铯是臭氧化物MO3 7、下列物质中碱性最强的是 A、LiOH B、Mg(OH)2 C、Be(OH)2 D、Ca(OH)2 8、下列物质中溶解度最小的是 A、Be(OH)2 B、Ca(OH)2 C、Sr(OH)2 D、Ba(OH)2 9、芒硝和元明粉的化学式分别为 A、Na2 SO4·10H2 O Na2 SO4 B、CaSO4·2H2 O Na2 SO4·10H2 O C、Na2 S Na2 S2O3·5H2O D、NaNO3 Na2SO4 10、下列碳酸盐的热稳定性顺序是 A、BeCO3 > MgCO3 > CaCO3 > SrCO3 > BaCO3
氮族元素习题及答案
第十五章氮族元素一选择题 1. 氮气制备的方法是() A. 将硝酸氨NHNO加热 B. 将亚硝酸氨NHNO加热 4342 C. 将氯气与氨气混合 D. B和C 2. 下列化合物中与水反 应放出HCl的是() A. CCl B. NCl C. POCl D. ClO 433273. NO溶解在NaOH溶液中可得到() 2A. NaNO和 HO B. NaNO、O和HO 22222C. NaNO、NO和 HO D. NaNO、NaNO和HO 3252322 4. 硝酸盐加热分 解可以得到单质的是() A. AgNO B. Pb(NO) C. Zn (NO) D. NaNO 332323 5. 下列分子中具有顺磁性的是() A. NO B. NO C. NO D. NO 22234 6. 下列分 子中,不存在离域键的是() (吉林大学《无机化学例题与 习题》) 3 A. HNO B. HNO C. NO D. N322 3 7. 分子中含d—p反馈键的是() (吉林大学《无机化学例题与 习题》) A. HNO B. HNO C. HPO D. NH 32323 8. 下 列物质中酸性最强的是() A. NH B. NHOH C. NH D. HN 242 33 9. 下列酸中为一元酸的是() (吉林大学 《无机化学例题与习题》) A. HPO B. HPO C. HPO D. HPO 427323334 10. 下列各物质按酸性排列顺序正确的是() (吉林大学《无机化学例题与习题》) A. HNO>HPO>HPO B. HPO>HPO>HNO 234427427342C. HPO>HNO>HPO D. HPO>HPO>HNO 427234344272 11. 下列物质中,不溶于氢氧 化钠溶液的是()(吉林大学《无机化学例题与习题》) A.
第12章-d区元素和f区元素
第12章 d区元素和f区元素 【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。 解:d区元素最后一个电子填充到d轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB-ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。同副族过渡元素的电离能递变不很规则。熔点、沸点高,密度大,导电性、导热性、延展性好。在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。 或:d区元素价电子层结构是(n-1)d1-8ns1-2。它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d轨道上的电子数不同。又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。大多具有可变的氧化态。由于d轨道有未成对电子,水合离子一般具有颜色。由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。 【12-2】完成下列反应式: (1)TiO2+H2SO4(浓)→ (2)TiO2++Zn+H+→ (3)TiO2+C+Cl2→ (4)V2O5+NaOH→ (5)V2O5+H2SO4→ (6)V2O5+HCl→ (7)VO2++H2C2O4+H+→ 解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O (2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O (3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO (4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O (5)V2O5 + H2SO4 = (VO2)2SO4 + H2O (6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O
s区元素
第十二章s区元素 教学重点:1.氢的物理和化学性质; 2.碱金属的钠与钾,碱土金属的镁、钙、钡的性质。 3.其氢氧化物的溶解性和碱性。 4.碱金属和碱土金属盐类的一些重要性质。 第一节氢 一、物理性质 氢(hydrogen)是太阳大气的主要成分,如果以原子百分数计,氢占81.75%,氢是太阳发生热核反应的主要原料。是供给地球上生物生存的最大能源。 氢在地壳(包括大气、水、岩石圈)中的含量,若以原子百分数计占17%,若以质量百分数计约占1%。氢虽存在量不大,但分布却十分广泛。自然界中,氢主要以化合态存在,如在水中、有机物中、生物体中等,仅只在天然气等少数物质中有少量单质氢存在。 已知氢有三种同位素,自然界 氢或氕(用11H或H表示)99.98% 重氢或氘(deuterium)(用21H或D表示)0.02% 氚(tritium)(用31H或T表示)107个普通氢原子才有1个氚原子 氢的同位素之间由于电子结构相同,故化学性质基本相同,但是它们的原子质量相差较大,从而引起物理性质上的差异。 如:H2的沸点为20.4K,熔点为14.0K D2的沸点为23.5K,熔点为18.65K 氘的重要性在于它与原子反应堆中的重水有关,并广泛地应用于反应机理的研究和光谱分析。氚的重要性在于和核聚变反应有关,也可用作示踪原子(tracer element)。 单质氢是以双原子分子形式存在,它是一种无色无嗅的气体,是空气密度的1/14.38,是所有气体中密度最低的。用它的密度小的性质,可以填充氢气球,但有易于着火的缺点。 如将氢气进行深度冷冻并加压,氢气可转变成液体,利用液态氢的低温,可以将除氢以外的其它气体变成固体,在14.0K时可转变为透明固体。 氢在水中微微溶解,273K时1体积水仅能溶解0.02体积的氢气,但氢气可被某些金属(如镍、钯、铂)吸附,如室温时1体积细钯粉,大约吸收900 233
第12章 s区元素及其重要化合物
176 第12章s区元素及其重要化合物 第12章 s区元素及其重要化合物 s区元素包括周期表中ⅠA和ⅡA族元素,是最活泼的金属元素。ⅠA族是由锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种金属元素组成。由于它们氧化物的水溶液显碱性,所以称为碱金属(Alkali metals)。ⅡA族是由铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)及镭(Ra)六种元素组成,由于钙、锶、钡的氧化物难溶,难熔(类似于土),且呈碱性而得名碱土金属(Alkaline earth metals)。 ⅠA、ⅡA族元素中、钠、钾、镁、钙、锶、钡、发现较早,在1807-1808年由美国年轻科学家戴维(H,Davy)首次制得。它们以化合物形式广泛存在于自然界,如人们与钠、钾的化合物(如食盐)打交道已有几千年的历史。锂、铍、铷和铯的发现和游离制得相对稍晚些(1821-1861)年,它们在自然界存在较少,属于稀有金属。钫和镭是放射性元素,钫(Fr)是1939年法国Marguerite perey发现的,元素名由France而来。钫是有强放射性,半衰期很短的金属元素,在天然放射性衰变系(锕系)以及核反应(中子轰击镭)中形成微量的钫。镭是1898年法国皮尔(pierre)和马利亚居里(Marie Curie)发现。他们首先从沥青铀矿中分离出来。镭的所有同位素都有放射性且寿命最长,如226Ra 的半衰期为1602年。它是在238U的天然衰变系中生成。 12.1 碱金属、碱土金属单质 碱金属、碱土金属元素的价层电子构型分别为ns1,ns2,它们的原子最外层有1~2个s电子,所以这些元素称为s区元素。s区元素能失去1个或2个电子形成氧化态为+1、+2 的离子型化合物(Li、Be除外)。 12.1.1 通性 碱金属,碱土金属的基本性质列于表12-1和表12-2中。 表12-1碱金属的基本性质 碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),
(完整word版)大学无机化学第十四章试题及答案
第十五章氮族元素 总体目标: 1.掌握氮和磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备和用途 2.了解砷、锑、铋单质及其化合物的性质递变规律 各节目标: 第一节氮的单质 掌握N 2 的结构;氮与非金属、金属的反应;氮气的实验室制法和工业制法 第二节氮的成键特征 通过氮的价层电子结构,了解它的成键特征 第三节氮的氢氧化物 1.掌握NH 3 的工业制法和实验室制法以及它的结构 2.了解NH 3 的物理性质;掌握它的配位反应、取代反应、氨解反应和氧化反应以及用途;铵盐的水解性和热稳定性。 3.了解联氨、羟胺、叠氨酸的结构和性质 第四节氮的氧化物 1.掌握氮元素的自由能—氧化图 2.掌握氮的氧化物(N 2O、NO、N 2 O 3 、NO 2 、N 2 O 4 、N 2 O 5 )的结构和重要性质 3.了解HNO 2 及其盐的制备、结构、性质 4.掌握HNO 3 及其盐的结构和性质;硝酸盐热分解的一般规律;王水的成分和性质5.掌握硝酸盐和亚硝酸盐的鉴别方法 第五节磷单质 1.掌握磷原子的价电子层结构;磷的成键特征 2.掌握磷的工业制法、同素异形体、化学性质及用途 第六节磷的化合物 1.掌握磷化氢的制备方法和性质 2.掌握P 4O 6 、P 4 O 10 和H 3 PO 4 的结构、制备、性质和用途;磷酸盐的溶解性 3.了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名和主要性质;卤化磷、硫化磷的重要性质
第七节砷、锑、铋 了解砷、锑、铋单质及其化合物的性质递变规律 习题 一选择题 1. 氮气制备的方法是() A. 将硝酸氨NH4NO3加热 B. 将亚硝酸氨NH4NO2加热 C. 将氯气与氨气混合 D. B和C 2. 下列化合物中与水反应放出HCl的是() A. CCl4 B. NCl3 C. POCl3 D. Cl2O7 3. NO2溶解在NaOH溶液中可得到() A. NaNO2和H2O B. NaNO2、O2和H2O C. NaNO3、N2O5和H2O D. NaNO3、NaNO2和H2O 4. 硝酸盐加热分解可以得到单质的是() A. AgNO3 B. Pb(NO3)2 C. Zn(NO3)2 D. NaNO3 5. 下列分子中具有顺磁性的是() A. N2O B. NO C. NO2 D. N2O3 π离域键的是()(吉林大学《无机化学例题与习题》) 6. 下列分子中,不存在4 3 N A. HNO3 B. HNO2 C. N2O D. - 3 7. 分子中含d—p反馈π键的是()(吉林大学《无机化学例题与习题》) A. HNO3 B. HNO2 C. H3PO2 D. NH3 8. 下列物质中酸性最强的是() A. N2H4 B. NH2OH C. NH3 D. HN3 9. 下列酸中为一元酸的是()(吉林大学《无机化学例题与习题》) A. H4P2O7 B. H3PO2 C. H3PO3 D. H3PO4 10. 下列各物质按酸性排列顺序正确的是()(吉林大学《无机化学例题与习题》) A. HNO2>H3PO4>H4P2O7 B. H4P2O7>H3PO4>HNO2 C. H4P2O7>HNO2>H3PO4 D. H3PO4>H4P2O7>HNO2 11. 下列物质中,不溶于氢氧化钠溶液的是()(吉林大学《无机化学例题与习题》) A. Sb(OH)3 B. Sb(OH)5 C. H3AsO4 D. Bi(OH)3
大学无机化学第十五章试题及答案
第十二章氧族元素 总体目标: 1.了解氧化物的分类 2. 握氧、臭氧、过氧化氢的结构、性质和用途 3.掌握硫的多种氧化态所形成的重要化合物的结构、性质、用途以及它们之间的相互转化关系。 各节目标: 第一节氧及其化合物 1.掌握氧、臭氧的结构、性质、制备和用途;氧的成键特征 2.了解氧化物的分类;掌握主要氧化物的结构、制备和性质(与水的作用、酸碱性) 3.掌握过氧化氢的结构、实验室和工业制法、性质和用途 第二节硫及其化合物 1.了解硫的同素异形体、制备、性质和用途 2.掌握硫化氢的制备、结构和性质;了解金属硫化物的主要性质 3.掌握SO 2、SO 3 、H 2 SO 3 、H 2 SO 4 和它们相应的盐、硫代硫酸及其盐、过二硫酸及其盐 的结构、性质、制备和用途以及它们之间的相互转化关系第三节硒、碲及其化合物 了解硒、碲及其化合物的结构和性质 习题 一选择题 1.H 2O 2 熔、沸点较高(分别为273K和423K),其主要原因是() A .H 2O 2 相对分子质量大 B. H 2 O 2 分子极性大 C. H 2O 2 分子间氢键很强,在固液时均有存在缔和现象 D. H 2 O 2 分子内键能大 2.气态SO 3 分子的几何构型是() A.线性 B.平面三角形 C.弯曲形 D.三角锥 3.在293K,101.3KPa压力下,1体积水可溶解H 2 S气体2.6体积即饱和, 此H 2 S饱和溶液pH值约为() A.2.5 B.3.8 C.3.5 D.4.0
4.在分别含有0.1mol/L的Hg2+,Cu2+,Cr3+,Zn2+,Fe2+的溶液中,在酸度为0.3mol/L条件下,通H 2 S至饱和都能生成硫化物沉淀的是()(吴成鉴《无机化学学习指导》) A.Cu2+,Hg2+ B.Fe2+,Cr3+ C.Cr3+,Hg2+ D.Zn2+,Fe2+ 5.既能溶于Na 2S又能溶于Na 2 S 2 的硫化物是()(吉林大学《无机化学例题与习题》) A.ZnS B.As 2S 3 C. HgS D.CuS 6.在空气中长期放置后,会产生多硫物的是() A.H 2S B.Na 2 S C.Na 2 SO 3 D.Na 2 S 2 O 4 7.热分解硫酸亚铁的最终产物是() A.FeO+SO 3 B.FeO+SO 2 +1/2O 2 C.Fe 2O 3 +SO 2 D.Fe 2 O 3 +SO 3 +SO 2 8.用于制备K 2S 2 O 8 的方法是() A.在过量硫酸存在下,用KMnO 4使K 2 SO 4 氧化 B.在K+离子存在下,往发烟H 2SO 4 中通入空气 C.在K+离子存在下,电解使H 2SO 4 反发生阳极氧化反应 D.用Cl 2氧化K 2 S 2 O 3 9.下列含氧酸中酸性最弱的是() A.HClO 3 B.HBrO 3 C.H 2 SeO 4 D.H 6 TeO 6 10.硫的含氧酸酸性递变规律是() A.H 2SO 4 >H 2 SO 3 >H 2 S 2 O 7 >H 2 S 2 O 4 B.H 2 SO 4 >H 2 S 2 O 7 >H 2 SO 3 >H 2 S 2 O 4 C.H 2S 2 O 7 >H 2 SO 4 >H 2 SO 3 >H 2 S 2 O 4 D.H 2S 2 O 7 >H 2 SO 4 >H 2 S 2 O 4 >H 2 SO 3 11.下列四种硫的含氧酸盐中,氧化能力最强的是();还原能力最强的是() A.Na 2SO 4 B.Na 2 S 2 O 3 C.Na 2 S 4 O 6 D. K 2 S 2 O 8 12.下列各种硫的含氧酸,可以是同多酸的是() A.H 2S 3 O 6 B.H 2 S 2 O 7 C.H 2 S 3 O 10 D.H 2 S 6 O 6 13.下列叙述中错误的是()(吉林大学《无机化学例题与习题》) A.自然界中只存在单质氧而没有单质硫 B.氧既有正氧化态的化合物,又有负氧化态的化合物 C.由H和18O组成的水叫做重氧水
2012级第1章S区元素自测题及答案
《元素化学》 第1章 《S 区元素》自测题 班级:应用化学1201B 姓名: 学号: 得分: 一、选择题(75分) 1 在下列性质中,碱金属比碱土金属高(或大)的是 ( D ) A. 熔点 B. 沸点 C. 硬度 D. 半径 2 下列性质中,碱金属和碱土金属都不具有的是 ( D ) A. 与水剧烈反应 B. 与酸反应 C. 与碱反应 D. 与强还原剂反应 3ⅠA,ⅡA 族元素的电离势,电负性和M 2分子中共价键的强度随着原子序数的增加而 (B ) A. 逐渐增大 B. 逐渐减小 C. 无法推测 D. 变化不大 4 下列原子中哪一种原子第一电离势最大 (C ) A. Na B. Li C. Be D. Mg 5 碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了一个 单位的核电荷,所以 (B ) A. 碱土金属原子半径比相邻的碱金属大些 B. 电离势大 C. 较易失去第一个电子 D. 比碱金属更活泼 6 下列元素中形成化合物时,共价倾向最小的是 (D) A. Be B. Li C. Ba D. Cs 7 最轻的金属是以下金属中的 (B ) A. Be B. Li C. Na D. Mg 8 下列金属单质不能保存在煤油里的是 (A ) A. Li B. Na C. K D. Rb 9 金属钠应保存在 (C ) A. 酒精中 B. 液氨中 C. 煤油中 D. 空气中 10 下列金属单质表现两性的是 (D ) A. Li B. Mg C. Ba D. Be 11 因为E ?(Na +/Na) 第十五章氮族元素 总体目标: 1、掌握氮与磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备与用途 2、了解砷、锑、铋单质及其化合物的性质递变规律 各节目标: 第一节氮的单质 掌握N 2 的结构;氮与非金属、金属的反应;氮气的实验室制法与工业制法 第二节氮的成键特征 通过氮的价层电子结构,了解它的成键特征 第三节氮的氢氧化物 1、掌握NH 3 的工业制法与实验室制法以及它的结构 2、了解NH 3 的物理性质;掌握它的配位反应、取代反应、氨解反应与氧化反应以及用途;铵盐的水解性与热稳定性。 3、了解联氨、羟胺、叠氨酸的结构与性质 第四节氮的氧化物 1、掌握氮元素的自由能—氧化图 2、掌握氮的氧化物(N 2O、NO、N 2 O 3 、NO 2 、N 2 O 4 、N 2 O 5 )的结构与重要性质 3、了解HNO 2 及其盐的制备、结构、性质 4、掌握HNO 3 及其盐的结构与性质;硝酸盐热分解的一般规律;王水的成分与性质5、掌握硝酸盐与亚硝酸盐的鉴别方法 第五节磷单质 1、掌握磷原子的价电子层结构;磷的成键特征 2、掌握磷的工业制法、同素异形体、化学性质及用途 第六节磷的化合物 1、掌握磷化氢的制备方法与性质 2、掌握P 4O 6 、P 4 O 10 与H 3 PO 4 的结构、制备、性质与用途;磷酸盐的溶解性 3、了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名与主要性质;卤化磷、硫化磷的重要性质 第七节砷、锑、铋 了解砷、锑、铋单质及其化合物的性质递变规律 习题 一选择题 1、氮气制备的方法就是( ) A、将硝酸氨NH4NO3加热 B、将亚硝酸氨NH4NO2加热 C、将氯气与氨气混合 D、B与C 2、下列化合物中与水反应放出HCl的就是( ) A、CCl4 B、NCl3 C、POCl3 D、Cl2O7 3、NO2溶解在NaOH溶液中可得到( ) A、NaNO2与H2O B、NaNO2、O2与H2O C、NaNO3、N2O5与H2O D、NaNO3、NaNO2与H2O 4、硝酸盐加热分解可以得到单质的就是( ) A、AgNO3 B、Pb(NO3)2 C、Zn(NO3)2 D、NaNO3 5、下列分子中具有顺磁性的就是( ) A、N2O B、NO C、NO2 D、N2O3 π离域键的就是( ) (吉林大学《无机化学例题与习题》) 6、下列分子中,不存在4 3 N A、HNO3 B、HNO2 C、N2O D、- 3 7、分子中含d—p反馈π键的就是( ) (吉林大学《无机化学例题与习题》) A、HNO3 B、HNO2 C、H3PO2 D、NH3 8、下列物质中酸性最强的就是( ) A、N2H4 B、NH2OH C、NH3 D、HN3 9、下列酸中为一元酸的就是( ) (吉林大学《无机化学例题与习题》) A、H4P2O7 B、H3PO2 C、H3PO3 D、H3PO4 10、下列各物质按酸性排列顺序正确的就是( ) (吉林大学《无机化学例题与习题》) A、HNO2>H3PO4>H4P2O7 B、H4P2O7>H3PO4>HNO2 C、H4P2O7>HNO2>H3PO4 D、H3PO4>H4P2O7>HNO2 11、下列物质中,不溶于氢氧化钠溶液的就是( ) (吉林大学《无机化学例题与习题》) A、Sb(OH)3 B、Sb(OH)5 C、H3AsO4 D、Bi(OH)3 第15章氮族元素 15-1 给出下列物质的化学式。 (1)雄黄;(2)雌黄;(3)辉锑矿;(4)锑硫镍矿;(5)辉铋矿;(6)砷华;(7)锑华;(8)铋华 解: (1)As4S4;(2)As2S3;(3)Sb2S3;(4)NiSbS;(5)Bi2S3;(6)As2O3;(7)Sb2O3;(8)Bi2O3 15-2 在稀硫酸介质中完成并配平下列反应的方程式。 (1)I-+NO2- ------ (2)NH4++NO2- ------ (3)MnO4-+NO2- ------ (4)MnO4-+As2O3------ (5)NaBiO3+Mn2+ ------ (6)H3PO3+NO2- ------ (7)I-+AsO43- ------ (8)N2H4+NO2- ------ (9)N2H4+AgCl------ (10)As2O3+Zn------ 解: (1)2I-+2NO2-+4H+ ═== I2+2NO↑+2H2O (2)NH4++NO2- ? ===N 2 +2H2O (3)4MnO4-+5NO2-+6H+ === 2Mn2++5NO3-+5H2O (4)4MnO4-+5As2O3+9H2O+2H+ ===4 Mn2++10H2AsO4-(5)5NaBiO3+2Mn2++14H+ === 5Bi3++2MnO4-+5Na++7H2O (6)H3PO3+NO2-+2H+ === H3PO4+2NO↑+H2O (7)2I-+AsO43-+2H+ === I2+AsO33-+H2O (8)N2H4+NO2-+H+ === HN3+2H2O (9)N2H4+4AgCl === 4Ag+N2↑+4HCl (10)As2O3+6Zn+12H+ === 2AsH3↑+6Zn2++H2O 15-3 完成并配平下列NaOH溶液参与的反应。 (1)NaOH+P4------ (2)NaOH(过量)+H3PO2------ (3)NaOH+As2S3------ (4)NaOH+Sb(OH)3------ (5)NaOH+NCl3------ (6)NaOH+NO2------ 第12章s区元素课后习题答案: 1. 写出周期表s 区元素的化学符号并回答下列各种性质的变化规律 (1) 金属的熔点; (2) 族氧化态阳离子的半径; (3) 过氧化物热分解生成氧化物的趋势; 解答 (1)参见表12.1,总的规律是各族由上至下熔点降低,因为价电子数相同,半径递增,金属键逐渐减弱。碱土金属比对应碱金属熔点高,是因为:①每个碱土金属原子中有两个价电子,而碱金属只有一个价子;②碱土金属的晶格结构多是属于配位数为12的最密堆积(六方密堆积或立方面心密堆积),而碱金属的结构是属于体心立方晶格,配位数为8,是次密堆积。因而金属键强弱不同。碱土金属中不完全是由大到小,是由于其晶格类型不同所致。 (2) 表2.2,半径自上而下增大。 (3) 随阳离子半径的增大热分热温度增高。 2. 解释 (1)钡能形成过氧化物而铍则不能,钠能形成过氧化物而锂则不能。 (2) 第2族元素自上而下氢氧化物在水中的溶解性增大,而硫酸盐则有相反的变化趋势。 (3) 碱金属元素中以锂的标准还原电势最低,而锂与水之间的反应却最缓和。 (4) 锂和铍的卤化物较之各自同族元素的卤化物易溶于某些有机溶剂。 (5) 钠的钴亚硝酸盐、四苯硼酸盐和氯铂酸盐易溶于水而相应的钾盐则难溶。 (6) Be(OH)2既可溶于酸又可溶于碱,而同族其他元素的氢氧化物只能溶于酸。 (7) 冠醚和穴醚配体对不同大小碱金属离子的选择性配位。 解答 (1)Be、Li 的半径太小。 (2)由于OH-是个体积小的阳离子,而SO体积大,根据相差溶解规律而知之。 (3)电极电势属热力学范畴,而反应的剧烈程度属动力学范畴,两者之间并无直接联系。锂与水反应缓和的原因有二:①锂的熔点较高(180℃),与水反应产生的热量不足以使其熔化,是固一液反应,不象钠、钾熔点低(分别为98℃和63.5℃)是液-液反应;②锂与水反应的产物LiOH溶解度小,一旦产生,就覆盖在锂的表面上,阻碍反应继续进行。 (4) 锂和铍的离子半径特别小,离子势大,极化力强和半径较大的X-(变形性大)结合有较多的共价性,因而易溶于某些有机溶剂,而其它同族元素则为离子性化合物。 (5)三个酸根均为大阴离子,K+比Na+半径大,自然前者形成的盐比后者形成的盐稳定而在水中的溶解度小,仍是相差溶解规律的典型例子。 (6)根据ROH 规则,Be(OH)2 为两性化合物,故既可溶于酸又可溶于碱,而同族其他元素的氢氧化物碱性都很强,故只能溶于酸。 (7) 参见节12.2.4。 3. 回答下列用途所依据的性质,可能情况下并写出相关的反应式 (1) 锂用做生产热核武器的一种原料。 (2) 铯用于制造光电池和原子钟。 (3) 钠用于干燥醚类溶剂时,能显示出溶剂的干燥状态。 (4) 钠用于钛和其他一些难熔金属的高温冶炼。 (5) 钠钾合金用做核反应堆的冷却剂。 第十五章 s区元素 一、教学基本要求 1. 了解s区元素的物理性质和化学性质,能解释碱金属与水、醇和液氨反应的不同; 2. 了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3. 了解s区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化 规律; 4. 了解s区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5. 会用离子极化理论解释碳酸盐分解规律; 6. 了解对角线规则和锂、铍的特殊性。 二、要点 1. 汞齐(amalgam ) 又称汞合金,汞的特性之一是能溶解除铁以外的许多金属而生成汞齐。汞与一种 或几种金属形成汞齐时,含汞少时是固体,含汞多时是液体。天然的有金汞齐,银 汞齐,人工制备的有:钠汞齐、钾汞齐、锌汞齐、锡汞齐、铅汞齐等。 2. 熔盐电解法(Molten-salt electrolysis) 指以熔融态盐类为原料的电解方法,常用于制备不能由水溶液中制备的金属,如碱金属、碱土金属以及钍、钽混合稀土金属的生产。有时为降低熔体的熔点,节 省电能,须加入一定量的助熔剂。 3. 热还原法(Thermo-deoxidization) 用化学活性较强的金属,将被还原的金属从其化合物中置换出来,以制备金属或其 合金的方法。 4. 冠醚(Crown ether) 分子结构类似皇冠的“大环多醚”。最常用的有18-冠-6 (如下图中的a)、二环己基 -18-冠-6及二苯基18-冠-6等。冠醚对K+、Na+及其他阳离子有很强的选择性络合 ,F- ),提 K + X- 表示( X=MnO 4高了裸阴离子的活性。冠醚在有机合成中常用作“相转移反应的催化剂”。 5.穴醚(Cryptant) 分子结构类似地穴的“大环多醚”。穴醚几乎能够实现对K+和Na+离子的完全 分离,选择性可高达105:1。如下图中的(b) (c)所示。 (a) (b) (c) 第12章s区元素(第二套) 一是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”) 1. CaH2便于携带,与水分解放出H2,故野外常用它来制取氢气。() 2. 碱金属和碱土金属很活泼,因此在自然界中没有它们的游离状态。() 3. 碱金属的熔点、沸点随原子序数增加而降低,可见碱土金属的熔点沸点也具有这变化规律。() 4. 碱金属是很强的还原剂,所以碱金属的水溶液也是很强的还原剂。() 5. 碱金属的氢氧化物都是强碱性的。() 6. 氧化数为+2的碱土金属离子,在过量碱性溶液中都是以氢氧化物的形式存在。() 7. 铍和其同组元素相比,离子半径小,极化作用强,所以形成键具有较多共价性。() 8. 因为氢可以形成H+,所以可以把它划分为碱金属。() 9.某溶液共存有Na+,K+,Al3+,NO,HCO,SO,并无任何反应发生。() 10. 由Li至Cs的原子半径逐渐增大,所以其第一电离能也逐渐增大。() 二选择题(选择正确答案的题号填入) 1. 下列哪对元素的化学性质最相似 (A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al 2. 下列元素中,第一电离能最小的是 (A) Li (B) Be (C) Na (D) Mg 3. 下列最稳定的氮化物是 (A) Li3N (B) Na3N (C) K3N (D) Ba3N2 4. 下列水合离子生成时,放出热量最少的是 (A) Li+ (B) Na+ (C) K+(D) Mg2+ 5. 下列最稳定的过氧化物是 (A) Li2O2 (B) Na2O2(C) K2O2(D) Rb2O2 6. 下列化合物中,键的离子性最小的是 (A) LiCl (B) NaCl (C) KCl (D) BaCl2 7. 下列碳酸盐中,热稳定性最差的是 (A) BaCO3(B) CaCO3 (C) K2 (D) Na2CO3 8. 下列化合物中,在水中溶解度最小的是 (A) NaF (B) KF (C) CaF2 (D) BaF2 9. 下列各组化合物中,用煤气灯加热时分解产物类型不同的一组是 (A) NaNO3, KNO3 (B) LiNO3 , NaNO3 (C) LiNO3, Mg(NO3)2(D) Mg(NO3)2 , Cu(NO3)2 10. 下列化物中,溶解度最大的是 (A) LiF (B) NaClO4 (C) KClO4 (D) K2PtCl6 11. 下列化合物中,具有磁性的是 (A) Na2O2 (B) SrO (C) KO2(D) BaO2 12. 下列钡盐中,在酸中溶解度最小的是 无机化学s区元素练习题 S区元素练习题 一、完成并配平下列反应方程式 1、Na +H2→ 2、LiH → 3、CaH+H2O→ 4、Na2O+ CO→ 5、 Na2O+ MnO4- + H+→ 6、BaO+ H2SO4 → 7、纯氧中加热氧化钡 8、唯一能生产氮化物的碱金属与氮气反应 9、铍与氢氧化钠溶液反应 10、金属钙在空气中燃烧,将燃烧产物再与水反应 11、写出氢氧化锂和过氧化钡的常用制取方法的化学方程式 二、请用热力学数据计算碱金属的过氧化物的稳定性增强 请用热力学数据计算碱金属超氧化物的稳定性也在逐渐增强 三、已知r=227pmr=197pm,Ar=39.0Ar=40.078,计算钾和钙的密度。 四、写出Ca2与氯化镁溶液反应的离子方程式,计算 该反应在298K下的标准平衡常数K? 五、已知NaH晶体中,Na与H的核间距离为245pm,试用Born-Lande公式计算NaH的晶格能。再用波恩-哈伯循环计算NaH的标准摩尔生成焓。 ????六、计算反应MgO + C?的?rHm,?rSm和???CO +Mg+- ?rGm,以及该反应可以自发进行的最低温度。 ? 七、已知镁的升华焓?SubHm=147.70kJ·mol,第一,第二电离分别为I1=743.94 ?2?kJ·mol-1,I2=1456.8kJ·mol-1,?fHm=-466.8kJ·mol-1,?-1 ?fGm=-454.kJ·mol,试计算?fHm,计算E和Mg的水合热2+2?/Mg)。 八、s区某金属A与水反应剧烈,生成的产物之一溶液呈碱性。B与溶液C反应可得到中性溶液D,D在无色火焰中的焰色反应呈现为黄色。在D中加入硝酸银溶液有白色沉淀E生成,E可溶于氨水中。一淡黄色粉末物质F与金属A反应生成G,G溶于水得到B溶液,F溶于水则得到B和H的混合溶液,H的酸性溶液可使高锰酸钾溶液退色,并放出气体I。试确定各字母所代表物质的化学式,写出有关的反应方程式。 某碱土金属A在空气中燃烧时火焰呈橙红色,反应产大学无机化学第十四章试题及答案
无机化学第15章 氮族元素习题演示教学
第12章s区元素课后习题答案
第15章 s区元素
湖南理工学院无机化学习题库第12章 s区元素(第二套)
无机化学s区元素练习题
