PH缓冲溶液配制方法
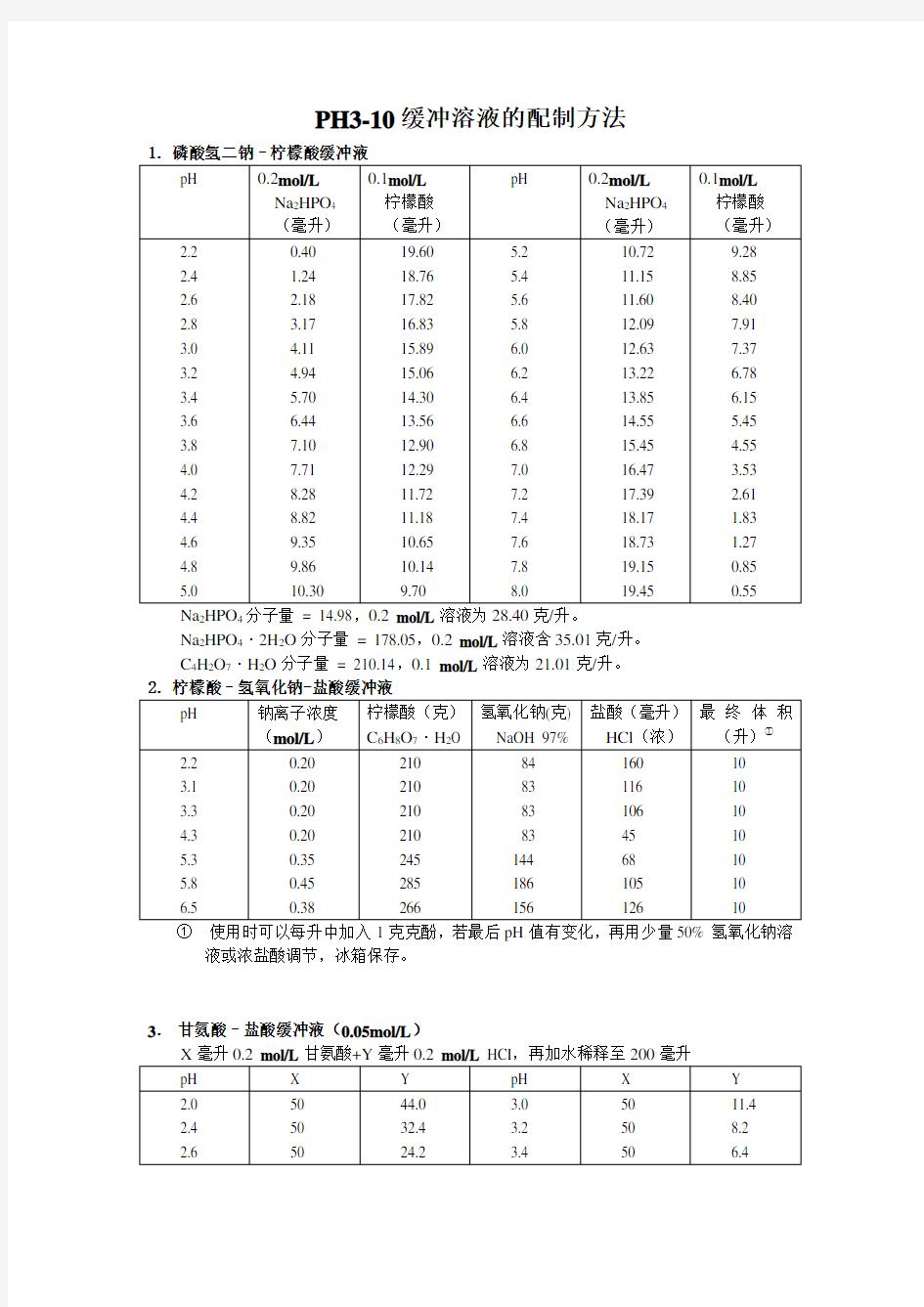
PH3-10缓冲溶液的配制方法
Na 2HPO 4分子量 = 14.98,0.2 mol/L 溶液为28.40克
/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。 C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶
液或浓盐酸调节,冰箱保存。
3. 甘氨酸–盐酸缓冲液(0.05mol/L )
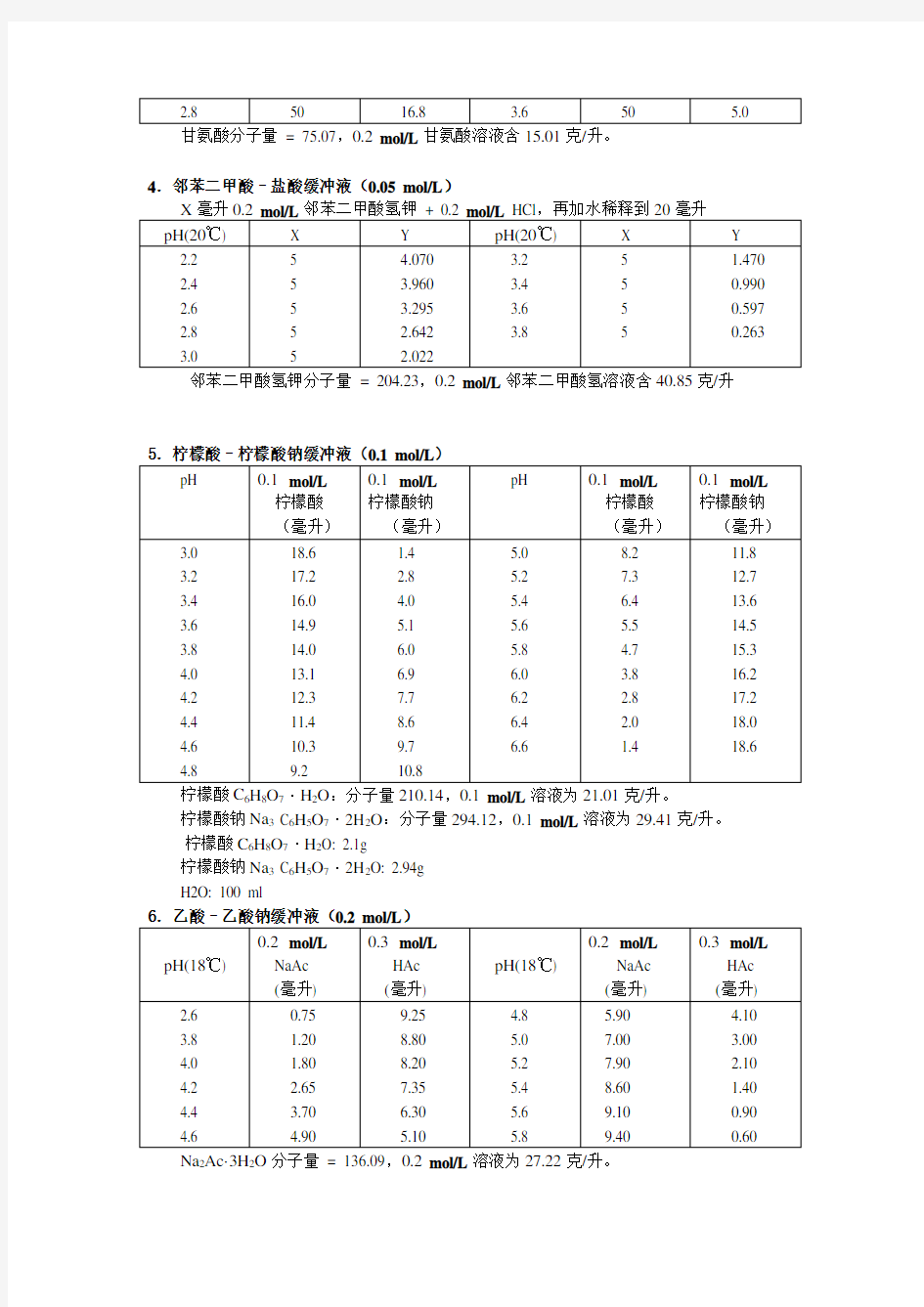
4.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升
柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/升。
柠檬酸C6H8O7·H2O: 2.1g
柠檬酸钠Na3 C6H5O7·2H2O: 2.94g
H2O: 100 ml
6.乙酸–乙酸钠缓冲液(0.2 mol/L)
Na2Ac·3H2O分子量= 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液
Na 2HPO 4·2H 2O 分子量 = 178.05
,0.2 mol/L 溶液为85.61克/升。 Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。 Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。 KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )
巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升
10.Tris–盐酸缓冲液(0.05M,25℃)
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100毫升。
三羟甲基氨基甲烷(Tris)HOCH2 CH2OH
C
HOCH2 NH2
分子量=121.14;
0.1M溶液为12.114克/升。Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
硼砂Na2B4O7·H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。
硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
2472
硼酸H2BO3,分子量=61.84, 0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M)
甘氨酸分子量=75.07;0.2M溶液含15.01克/升。
13.硼砂-氢氧化钠缓冲液(0.05M硼酸根)
硼砂Na2B4O7·10H2O,分子量=381.43;0.05M溶液为19.07克/升。
14.碳酸钠-碳酸氢钠缓冲液(0.1M)
2+2+
Na2CO2·10H2O分子量=286.2;0.1M溶液为28.62克/升。N2HCO3分子量=84.0;0.1M溶液为8.40克/升。
15.“PBS”缓冲液
常见缓冲溶液配制方法
常见缓冲溶液配制方法 乙醇-醋酸铵缓冲液:取5mol/L醋酸溶液,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至,用水稀释至1000ml。 三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至。 三羟甲基氨基甲烷缓冲液:取氯化钙0.294g,加L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L 盐酸溶液调节pH值至,加水稀释至100ml。 三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至。 乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液,再用水稀释至250ml。 巴比妥缓冲液:取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至,滤过。 巴比妥缓冲液:取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。 巴比妥-氯化钠缓冲液:取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用L盐酸溶液调节pH值至,再用水稀释至500ml。 甲酸钠缓冲液:取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至~。 邻苯二甲酸盐缓冲液:取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至,加水稀释至1000ml,混匀。 枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。 枸橼酸盐缓冲液:取%枸橼酸水溶液,用50%氢氧化钠溶液调节pH值至。 枸橼酸-磷酸氢二钠缓冲液:甲液:取枸橼酸21g或无水枸橼酸19.2g,加水使溶解成1000ml,置冰箱内保存。乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。取上述甲液与乙液混合,摇匀。 氨-氯化铵缓冲液:取氯化铵1.07g,加水使溶解成100ml,再加稀氨溶液(1→30)调节pH值至。 氨-氯化铵缓冲液:取氯化铵5.4g,加水20ml溶解后,加浓氯溶液35ml,再加水稀释至100ml。 硼砂-氯化钙缓冲液:取硼砂0.572g与氯化钙2.94g,加水约800ml溶解后,用1mol/L盐酸溶液约调节pH值至,加水稀释至1000ml。 硼砂-碳酸钠缓冲液~:取无水碳酸钠5.30g,加水使溶解成1000ml;另取硼砂1.91g,加水使溶解成100ml。临用前取碳酸钠溶液973ml与硼砂溶液27ml,混匀。 硼酸-氯化钾缓冲液:取硼酸3.09g,加L氯化钾溶液500ml使溶解,再加L氢氧化钠溶液210ml。 醋酸盐缓冲液:取醋酸铵25g,加水25ml溶解后,加7mol/L盐酸溶液38ml,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至(电位法指示),用水稀释至100ml,即得。 醋酸-锂盐缓冲液:取冰醋酸50ml,加水800ml混合后,用氢氧化锂调节pH值至,再加水稀释至1000ml。 醋酸-醋酸钠缓冲液:取醋酸钠5.1g,加冰醋酸20ml,再加水稀释至250ml。 醋酸-醋酸钠缓冲液:取无水醋酸钠20g,加水300ml溶解后,加溴酚蓝指示液1ml及冰醋酸60~80ml,至溶液从蓝色转变为纯绿色,再加水稀释至1000ml。 醋酸-醋酸钠缓冲液:取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液,再加水稀释至1000ml。 醋酸-醋酸钠缓冲液:取醋酸钠18g,加冰醋酸,再加水稀释至1000ml。 醋酸-醋酸钠缓冲液:取醋酸钠5.4g,加水50ml使溶解,用冰醋酸调节pH值至,再加水稀释至100ml。 醋酸-醋酸钠缓冲液:取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加水稀释至500ml。 醋酸-醋酸钾缓冲液:取醋酸钾14g,加冰醋酸,再加水稀释至1000ml。 醋酸-醋酸铵缓冲液:取醋酸铵7.7g,加水50ml溶解后,加冰醋酸6ml与适量的水使成100ml。
标准溶液配制方法
中华人民共和国国家标准 UDC543.06:54—41 GB601—88 化学试剂 滴定分析(容量分析)用标准溶液的制备 Chemicalreagent Preparationsofstandardvolumetriesolutions 1主题内容与适用范围 本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。 本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。 2引用标准 GB603化学试剂试验方法中所用制剂及制品的制备 GB6682实验室用水规格 GB9725化学试剂电位滴定法通则 3一般规定 3.1本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标 准。 3.2本标准中所用试剂的纯度应在分析纯以上。 3.3工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。3.4本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是 所用的试剂为分析纯以上试剂。 3.5本标准中所制备的标准溶液的浓度均指20c时的浓度。在标定和使用时,如 温度有差异,应只能附录A(补充件)补正。 3.6“标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4 平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 3.7本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中 的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。 3.8制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 3.9配制浓度等于或低于0.02mol/L标准溶液时乙二胺四乙酸二钠标准滴定溶液 除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 3.10碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 3.11滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不 得超过两个月。
标准溶液的配制
标准溶液的配制 盐酸标准溶液的配制和标定: 使用市售盐酸(密度为1.19g/ml,约含37%HCL)配制盐酸标准溶液,选用优基纯盐酸先以水配制成HCL(1+1),再以水稀释成所需浓度。 例如配制c(HCL)=0.10mol/L溶液,则需要吸取18mlHCL(1+1)溶液于100ml 容量瓶中,用水稀释至刻度,混匀。这样配制的标准溶液必须进行标定。标定HCL溶液最常用的是无水碳酸钠和硼酸两种方法。 (1.)无水碳酸钠法标定。选用碳酸钠作基准物质,其优点是容易制得纯品,价格低廉,缺点是摩尔质量较小,易吸水。以甲基橙、甲基红或甲基橙——靛蓝二磺酸钠作指示剂,用HCL溶液滴定Na2CO3溶液,其化学反应式为: Na2CO3 +2HCL = 2NCL + H2O + CO2↑ 用此进行标定时应当注意: 1.)Na2CO3有强烈的吸水性,使用前必须在高温炉270——3000C加热约1h,然后置于干燥器中冷却备用。 2.)计量点时PH值为3.9突跃范围PH值为5.0——5.3,可选用甲基橙作指示剂,选用甲基橙-靛蓝二磺酸钠作指示剂其变色点接近于计量点,终点更敏锐。 3.)选用甲基红作指示剂,滴定至终点时,应煮沸溶液2-3min,以消除CO2的影响。 (2)硼砂法标定。硼砂吸水性小,易制得纯品,摩尔质量大,是标定酸溶液较好的基准物质。硼砂在水中重结晶两次(结晶析出的温度在500C以下)可得到合乎要求的硼砂。由于硼砂含有结晶水。当空气中相对湿度小于39%时会明显风化形成水合物。所以,用作标定的硼砂应保存在相对湿度为60%左右的恒温中。用HCL滴定硼砂的计量点的产物为很弱的硼砂K a=5.7ⅹ10-10,PH=5.1.因此甲基红是适宜的指示剂,其滴定反应式为: B4O72-+2H++5H2O =4H3BO3 氢氧化钠标准溶液的配制与标定 氢氧化钠标准溶液的配制方法根据不同的要求有不同的方法,因氢氧化钠具有强烈的吸水性,且易吸收空气中的CO2.生成NaCO3,NaOH中常含有少量硫酸盐、氯化物和硅酸盐等,因此配制NaOH标准溶液只能用标定法。 不含CO32-的碱标准溶液通常有两种方法配制。一是称取一份NaOH置于带橡皮塞的试剂瓶中,加入一份H2O,搅拌溶解,配制NaOH(1+1)溶液,在这种浓碱溶液中,Na2CO3的溶解都很小,待Na2CO3沉淀完全,吸取上层澄清溶液,稀释成所需浓度的溶液。二是利用Ca(OH)2或BaCL2来沉淀溶液中的CO32-使之转化为Ca2CO3或BaCO3,由于Ca(OH)2在水溶液中溶解度相当的小。因此过量的Ca(OH)2将和Ca2CO3一起沉淀下来。若用BaCL2,则过量的BaCL2可加入少许Na2SO4使之与BaCO3一起沉淀,这样待完全沉淀后吸取上清液,稀释成所需浓度的溶液。 如果碱标准溶液中含有少许碳酸盐并无妨碍时,则可用简易的方法配制。称取较多的国体氢氧化钠,例如配制1L0.1mol/LNaOH溶液,可称取5——6g固体NaOH置于烧杯中,以水迅速洗涤2——3次,每次用少量水,倾去洗涤液,留下固体NaOH,再用水溶解,稀至1L用这种方法可以洗涤在固体NaOH表面上的大部分碳酸盐。 配制不含CO32-的碱标准溶液的用水均应预先除去其中的CO2,一般将水煮沸数分
PBS缓冲液的配制方法
PBS缓冲液配方 不管是免疫组化,还是细胞培养中,常用到PBS缓冲液,下面是常用配方,供大家参考。 用于细胞培养的PBS需含有氯化钾 称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L,灭菌即可。0.01M PBS缓冲液 称取NaCl 8g,KCl 0.2g,Na2HPO4?12H2O 3.63g, KH2PO4 0.24g,溶于900ml 双蒸水中,用盐酸调pH值至7.4,加水定容至1L,常温保存备用。 一般免疫组化用PBS,主要用来清洗,都只包含Na2HPO4?12H2O(磷酸氢二钠)和NaH2PO4?2H2O(磷酸二氢钠)两种组分,母液的配制: 0.2M Na2HPO4:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 水 0.2M NaH2PO4:称取 31.2g NaH2PO4-2H2O,溶于1000ml 水 各种浓度PB(pH=7.4)的配制: 先配 0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L 的 NaH2PO4, 81ml 0.2mol/L 的 Na2HPO4, 即可。 然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如: 0.1M PB(PH=7.4):取 500ml 0.2M PB,加水稀释至 1000ml 即可。 0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至 1000ml 即可。 0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至 1000ml 即可。 若需要 NaCL 的话,加入 NaCL 至0.9%(g/100ml)即可。
各种PH值的磷酸盐缓冲液配制
各种PH值的磷酸盐缓冲液配制 2011-07-12 18:34:35 来源:生物秀知道浏览次数:1196 网友评论0 条 磷酸盐缓冲液 取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。 磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。 磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。 磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。 磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。 磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。 磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
pH标准溶液(pH6.86525) 分别称取先在110~130干燥2~3h的磷酸二氢钾(KH2PO4)3.388g和磷酸氢二钠(Na2HPO4)3.533g溶于水并在容量瓶中稀释至1L 磷酸盐缓冲液(pH7.0) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH7.2) 取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。磷酸盐缓冲液(pH7.3) 取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。 磷酸盐缓冲液(pH7.4) 取磷酸二氢钾1.36g,加0.1mol/L氢氧化钠溶液79ml,用水稀释至200ml,即得。 磷酸盐缓冲液(pH7.6) 取磷酸二氢钾27.22g,加水使溶解成1000ml,取50ml,加0.2mol/L氢氧化钠溶液42.4ml,再加水稀释至200ml,即得。 磷酸盐缓冲液(pH7.8) 甲液:取磷酸氢二钠35.9g,加水溶解,并稀释至500ml。 乙液:取磷酸二氢钠2.76g,加水溶解,并稀释至100ml。取上述甲液91.5ml与乙液8.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH7.8~8.0) 取磷酸氢二钾5.59g与磷酸二氢钾0.41g,加水使溶解成1000ml,即得。 pH标准溶液(pH9.18025) 为了使晶体具有一定的组成应称取与饱和溴化钠(或氯化钠加蔗糖)溶液(室温)共同放置在干燥器中平衡两昼夜的硼砂3.80g溶于水并在容量瓶中稀释至lL。磷酸氢二钠应该用PH基准级的,是无水的.现在有卖现成的PH基准级混合磷酸盐
ph计标准溶液配制
中国PH计校正溶液配置的标准方法 一、引言:根据目前市场的应用情况看来,中国即我国国内使用的PH计校正的缓冲溶液有三种,即标称pH4 ,pH7 和pH9的三种缓冲溶液,分别学名为如下,笔者根据多项资料整理可得,为的是您能方便快速弄明白这些问题,详情: 1)pH4:邻苯二甲酸氢钾溶液; 2)pH7:磷酸二氢钾和磷酸氢二钠混合盐溶液; 3)pH9:硼砂溶液; 接下来介绍以上3种溶液的主要配置简单方法。 二、PH计校正溶液配置的标准方法 1)pH4,邻苯二甲酸氢钾标准缓冲液: 精密称取在115±5℃干燥2~3小时的邻苯二甲酸氢钾[KHC8H4O4],加水使溶解并稀释至1000ml。 2)pH7,磷酸盐标准缓冲液: 精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠与磷酸二氢钾,加水使溶解并稀释至1000ml。 另补充:磷酸盐标准缓冲液精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠与磷酸二氢钾,加水使溶解并稀释至1000ml。 3)pH9,硼砂标准缓冲液: 精密称取硼砂[Na2B4O7·10H2O](注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。 总结:从现在使用PH计来看,中国境内即国产的PH计或者是酸度计,它的校正缓冲液拥有的情况有两种: 1)即标准溶液是可以在市场上买到的,一般是在聚乙烯瓶中密闭保存的。在室温条件下标准溶液一般以保存1~2个月为宜,当发现有浑浊、发霉或沉淀现象时,不能继续使用。在4℃冰箱内存放,且用过的标准溶液不允许再倒回。 2)还可以自己买缓冲剂回去配置得。但一般厂家发货时,由于国家规定发货时有的不准有液体或药物存在,所以只能是带有的是干燥的PH缓冲剂,客户使用时需要自己配置,只
常用标准溶液的配制和标定
标准溶液的配制与标定 实训一氢氧化钠标准溶液的配制和标定 一、目的要求 1.掌握NaOH标准溶液的配制和标定。 2.掌握碱式滴定管的使用,掌握酚酞指示剂的滴定终点的判断。 二、方法原理 NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。 反应方程式:2NaOH + CO2→Na2CO3+ H2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。 标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH →C6H4COONaCOOK + H2O 计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。 三、仪器和试剂 仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。 试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)、10g/L酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。 四、操作步骤 1.0.1mol/L NaOH标准溶液的配制 用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。 准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。 2.0.1mol/L NaOH标准溶液的标定 将基准邻苯二甲酸氢钾加入干燥的称量瓶,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。同时做空白试验。 要求做三个平行样品。
各种缓冲液配制方法
不同缓冲液的缓冲范围 pH缓冲液 六十一秒的常用缓冲溶液的配制&缓冲溶液原理(2007年6月16日更新)(一)甘氨酸-盐酸缓冲液(0.05 mol/L) 甘氨酸分子量=75.07。 0.2 mol/L甘氨酸溶液含15.01 g/L。 (二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L) 邻苯二甲酸氢钾分子量=204.23。0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。(三)磷酸氢二钠-柠檬酸缓冲液 Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。 Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。 Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。 ①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。 柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。 (六)醋酸-醋酸钠缓冲液(0.2 mol/L) NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。冰乙酸11.8 mL稀释至1 L(需标定)。 (七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L) X 毫升0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
(八)磷酸盐缓冲液磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L) Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。 Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。 NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。 NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。 (九)巴比妥纳-盐酸缓冲液 巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。 (十)Tris-HCl缓冲液(0.05 mol/L) 50毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶液与X毫升0.1mol/L盐酸混匀并稀释至100
原子吸收标准溶液的配制
原子吸收常用的标准溶液配制方法 点击次数:1081 发布时间:2012-5-17 标准溶液的配备方法 钙元素符号-Ca 相对原子量 -40.08 仪器操作条件 波长 422.7nm 狭缝 0.4nm 灯电流 3.0毫安 燃烧器高度 8毫米 空气压力 0.3兆帕 乙炔压力 0.09兆帕 空气流量 7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性兰色焰 钙Ca 标准溶液的配置 钙标准溶液浓度1000微克/毫升 称取经灼烧后的高纯氧化钙1.3992克,置于250毫升烧杯中,加入盐酸20毫升,低温加热溶解,冷却后移入1000毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克Ca。 或购置国家标准GBW(E)080261 1000微克/毫升Ca(基体5%盐酸) 标准系列与线性工作范围 配置每毫升含钙0.0, 1.0, 2.0,3.0,4.0,5.0微克2%盐酸溶液和0.2%氯化锶溶液。 钙标准使用液:吸取1毫升=1000微克钙标准溶液10.0毫升于100毫升容量瓶中,加入2毫升盐酸,用去离子水定容刻度,摇匀。此溶液1毫升=100微克钙。 氯化锶应为GR试剂 在仪器推荐条件下,标准曲线线性范围:0.0-5.0微克/毫升。 特征浓度 在仪器推荐条件下,钙的特征浓度约为:0.080微克/毫升(1%吸收)。 浓度为2微克/毫升的钙标准溶液,通常可获得0.110左右的吸光度值。 其他分析线
波长(nm) 狭缝(nm) 特征浓度之比 422.7 0.4 1.0 239.9 0.4 120 干扰及分析提示 据文献报道,在空气-乙炔焰中,铝、Be、硅、钛、钒、锆、磷酸盐、硫酸盐都会干扰钙的测定。将0.1-1%的镧或锶加进样品和标准中,能抑制上述干扰。硫酸、磷酸干扰钙的测定,测定时,样品和标准中酸的浓度应该一致,同样一份样品,酸的浓度不同所测吸光度值也不相同。要严格控制水和试剂空白,仪器喷雾系统注意防止沾污。钙有轻微的电离干扰。 试验表明,钙的吸光度与燃气和助燃气的比例、燃烧器的高度有关。在开始分析以前,应用该得标准溶液调节吸光度到最大,然后进行分析。 标准溶液的配备方法 镉元素符号-Cd 相对原子量—112.4仪器操作条件 波长228.8 nm 狭缝0.4 nm 灯电流 3.0毫安 燃烧器高度 6.5毫米 空气压力0.3兆帕 乙炔压力0.09兆帕 空气流量7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性蓝色焰 镉 标准溶液的配置 镉标准溶液浓度1000微克/毫升 称取高纯镉(99.9%)0.1000克,置于250毫升烧杯中,加入10毫升盐酸,在低温电热板上加热溶解。移入100毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克镉。或购置国家标准GBW 08612 1000微克/毫升镉 (基体1%硝酸) 标准系列与线性工作范围 配置每毫升含镉0.0,0.2,0.4,0.6,0.8,1.0微克2%盐酸溶液。
常用标准溶液配制方法
常用标准溶液配制方法
1
2一般规定 本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。 本标准中所用试剂的纯度应在分析纯以上。 工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。 本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。 本标准中所制备的标准溶液的浓度均指20c 时的浓度。在标定和使用时,如温度有差异,应只能附录A(补充件)补正。 “标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。
制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。 3标准溶液的制备和标定 4.1 氢氧化钠标准溶液(使用期:2个月) c(NaOH) = 1 mol/L c(NaOH) =0.5 mol/L c(NaOH) =0.1 mol/L 4.1.1 配制 称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。用塑料管吸下述规定体积的上层清夜,用无二氧化碳的水稀释至1000ml,摇匀。 c(NaOH) ,mol/L 氢氧化钠饱和溶
常用缓冲溶液的配制方法
常用缓冲溶液的配制方法 磷酸氢二钠–柠檬酸缓冲液 24Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/ 升。 C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。 pH 4.0 20mL :Na2HPO4 0.219g + C4H2O7·H2O 0.258g 柠檬酸–柠檬酸钠缓冲液(0.1 mol/L ) 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 pH 4.0 20mL : C4H2O7·H2O 0.275g + Na3 C6H5O7·2H2O 0.203g
乙酸–乙酸钠缓冲液(0.2 mol/L ) Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。 pH 4.0 20mL :NaAc 0.098g + HAc 0.282mL 甘氨酸–氢氧化钠缓冲液(0.05M ) 甘氨酸分子量=75.07; 0.2M 溶液含15.01克/升。 pH 10.0 20mL :甘氨酸0.075g + NaOH 0.013g 碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+ 无水Na 2CO 2分子量=105.99;0.1M 溶液为10.60克/升。 Na 2CO 2·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升。 Na 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。 pH 10.0 20mL :无水碳酸钠 0.127g +碳酸氢钠0.067g
pH缓冲液的配制
【引用】常用pH缓冲溶液的配制和pH值 2011-05-13 20:01:24| 分类:生物|字号订阅 本文引用自DSC《常用pH缓冲溶液的配制和pH值》
一、常用溶液的配制(文章来自:医药园(https://www.360docs.net/doc/515586862.html,) 整理:zfg) (一)溶液配制注意事项 1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。 2.药品称量要精确。 3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。 4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。 (二)0.067(1/15)Mol/L磷酸缓冲液 1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。 2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g (或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。 3.按附表的比例,配制成不同pH值的缓冲溶液。
标准溶液的配制方法及基准物质
标准溶液的配制方法及基准物质 标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。不论采用何种滴定方法,都离不开标准溶液。因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。配制标准溶液的方法一般有以下两种: 直接配制法 用分析天平准确地称取一定量的物质,溶于适量水后定量转入容量瓶中,稀释至标线,定容并摇匀。根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。 能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。作为基准物质必须符合下列要求: (1)试剂必须具有足够高的纯度,一般要求其纯度在%以上,所含的杂质应不影响滴定反应的准确度。 (2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na 2B 4 O 7 ?10H2O),其结晶水的数目也应与化学式完全相符。 (3)试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。 (4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的基准物质 有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K 2Cr 2 O 7 ,Na 2 CO 3 , MgO , K BrO 3 等,它们的含量一般在%以上,甚至可达% 。 应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到%,这时就不能用作基准物质。一些常用的基准物质及其应用范围列于表中。
表常用基准物质的干燥条件和应用
常用缓冲溶液的配制和PH计校正溶液配置方法
常用缓冲溶液的配制方法 1.甘氨酸–盐酸缓冲液(0.05mol/L) 2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液 24 Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液 ① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶 液或浓盐酸调节,冰箱保存。 5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L ) 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 6.乙酸–乙酸钠缓冲液(0.2 mol/L ) Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。 7.磷酸盐缓冲液
242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为 71.64克/升。 Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。 (2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L ) 242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。 8.磷酸二氢钾–氢氧化钠缓冲液(0.05M ) 9.巴比妥钠-盐酸缓冲液(18℃)
标准溶液配制
1.目的:建立一个标准溶液配制的方法。 2.范围:适用于标准溶液的配制。 3.责任:质检科检验员对实施本规程负责。 4.程序 4.1试剂和溶液 4.1.1所用溶剂“水”,除另有规定外,系指纯化水。 4.1.2所用试剂,除另有规定外,系指分析纯。 4.2配制 4.2.1标准氯化钠溶液 称取氯化钠0.165g,置1000ml量瓶中,加水适量使溶解,并稀释至刻度,摇匀,作为贮备液。(每1ml相当于100μg的Cl)。临用前,精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得。(每1ml相当于10μg的cl) 4.2.2标准硫酸钾溶液 称取硫酸钾0.181g,置1000ml量瓶中,加水适量使溶解,并稀释至刻度,摇匀,即得。(每1ml相当于100μg的SO4)4.2.3标准铁溶液 称取硫酸铁铵[FeNH4(SO4)2·12H2O]0.863g, 置1000ml量瓶中,加水溶解后,加硫酸2.5ml,用水稀释至刻度,摇匀,作为贮备液。(每1ml相当于100μg的Fe)。临用前,精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得。(每1ml 相当于10μg的Fe)
4.2.4标准铅溶液 称取硝酸铅0.160g,置1000ml量瓶中,加硝酸5ml与水50ml 溶解后,用水稀释至刻度,摇匀,作为贮备液。(每1ml相当于100μg的Pb)。临用前,精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得。(每1ml相当于10μg的Pb) 注:配制与贮存用的玻璃容器均不得含铅。 4.2.5标准砷溶液 称取三氧化二砷0.132g,置1000ml量瓶中,加20%氢氧化钠溶液5ml溶解后,用适量的稀硫酸中和,再加稀硫酸10ml,用水稀释至刻度,摇匀,作为贮备液。(每1ml相当于100μg的As)。临用前,精密量取贮备液10ml,置1000ml量瓶中,加稀硫酸10ml,用水稀释至刻度,摇匀,即得。(每1ml相当于1μg的As) 4.2.6氟对照溶液的制备 精密称取经105℃干燥1小时的氟化钠22.1mg,置100ml容量瓶中,加水溶解并稀释至刻度,摇匀;精密量取20ml,置另一100 ml 容量瓶中,加水稀释至刻度,摇匀,即得。(每1ml相当于20μg的 F) 4.2.7标准氯化铵溶液 称取氯化铵31.5mg,置1000ml量瓶中,加水适量使溶解,并稀释至刻度,摇匀,即得。(每1ml相当于10μg的NH4) 4.2.8标准溴化钾溶液 精密称取在105℃干燥至恒重的溴化钾0.1485g,加水使溶解成
缓冲溶液【(最全)常见缓冲溶液配制方法】
缓冲溶液【(最全)常见缓冲溶液配制方法】常见缓冲溶液配制 乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。 三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。 三羟甲基氨基甲烷缓冲液(pH8.1):取氯化钙0.294g,加 0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液 调节pH值至8.1,加水稀释至100ml。 三羟甲基氨基甲烷缓冲液(pH9.0):取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。 乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过。 巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。 巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。 甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。 邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。 枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
常用缓冲溶液配制
1、选择合适的缓冲对:原则是所选缓冲对弱酸的pKa尽量接近于所需pH,并尽量在缓冲对的 缓冲范围内(pH= pKa±1)。二是所选缓冲对不能与溶液中主物质发生作用。 2、缓冲溶液的总浓度要适当,一般0.1-0.5 mol·L-1之间 3、计算所需缓冲对的量,为方便计算和配制,常用相同浓度的共轭酸、碱溶液,分别取不同体 积混合即可 4、校正,实际pH值与计算pH值常有出入,用pH计或精密pH纸校正。 表1. 常用pH缓冲溶液的配制和pH值 Preparation and pH Values of Common pH Buffer Solutions
表2. pH标准缓冲溶液Standard pH Buffer Solutions
表3. 标准缓冲液pH值与温度对照表
表4。常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L) 2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 24 Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
溶液或浓盐酸调节,冰箱保存。 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 22
7.磷酸盐缓冲液 242 Na2HPO4·2H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。 Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。 242 KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。 8.磷酸二氢钾–氢氧化钠缓冲液(0.05M) X毫升0.2M K2PO4 + Y毫升0.2N NaOH加水稀释至29毫升
PH计校准及缓冲液配置 (1)
标准缓冲溶液(均用pH标准缓冲物质配制) 1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。 苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下: a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。保存于聚乙烯瓶中。 b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。保存于聚乙烯瓶中。 1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864): 磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。配制方法如下: a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。 b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。 1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413): 磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。保存于聚乙烯瓶中。 1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。 硼砂的pH标准缓冲物质也有塑料袋装和瓶装两种,配制方法如下: a)袋装配制法: 在500 mL量瓶中,按袋上说明配制成所需浓度后,分装于5个100 mL聚乙烯瓶中,瓶口用石蜡熔封。 b)瓶装配制法: 称取1.91 g硼砂(预先在盛有蔗糖饱和溶液的干燥器中平衡两昼夜),溶于刚煮沸冷却的蒸馏水,全量转入500 mL量瓶中,加水至标线,混匀。分装于5个100 mL聚乙烯瓶中,瓶口用石蜡熔封,有效期为三个月,经常使用的缓冲溶液,每周更换一次。 各种标准缓冲溶液的pH值随温度的变化而变化。0~45℃的pH值列于表21中。 1.5 饱和氯化钾溶液: 称取40 g氯化钾,加100 mL水,充分搅拌后盛于试剂瓶中(此溶液应与氯化钾固体共存)。 温度,℃苯二甲酸氢钾混合磷酸盐磷酸盐硼砂 0 4.006 6.981 7.534 7.534 5 3.999 6.949 7.500 9.391 10 3.996 6.921 7.472 9.330 20 3.998 6.879 7.429 9.226 25 4.003 6.864 7.413 9.182 30 4.010 6.852 7.400 9.142 35 4.019 6.844 7.389 9.105 40 4.029 6.838 7.380 9.072
