各种金属在海水中之电位排列顺序
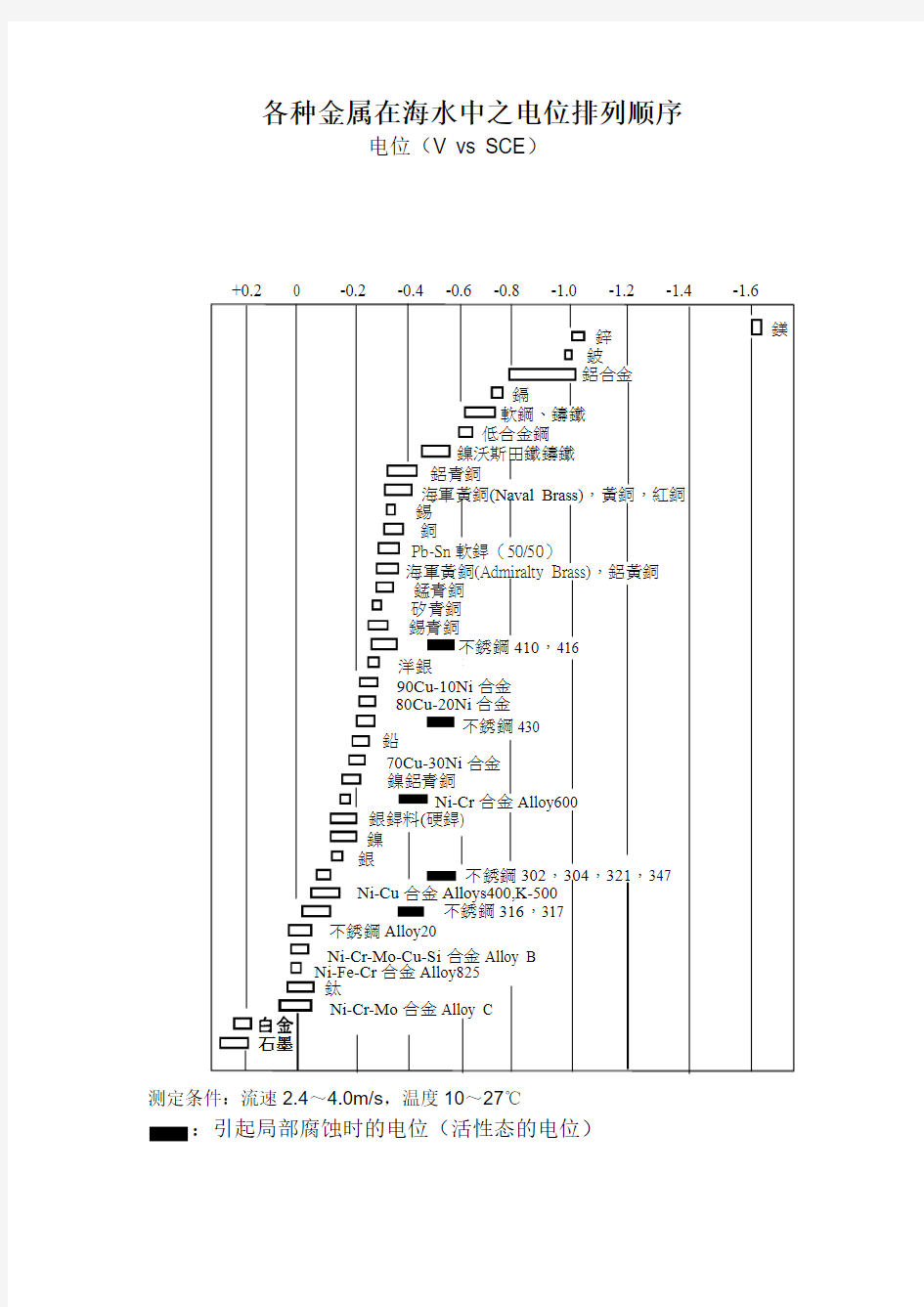

各种金属在海水中之电位排列顺序
电位(V vs SCE )
测定条件:流速2.4~4.0m/s ,温度10~27℃
标准电极电位
https://www.360docs.net/doc/6410870612.html,/view/439955.htm 标准电极电位 科技名词定义 中文名称:标准电极电位 英文名称:standard electrode potential 定义:半电池的所有反应物质活度为1mol时,电极相对于标准氢电极电位的电位值,即该电极与标准氢电极组成的电池的电动势。对给定的电极说,其标准电极电位是一个常数。 应用学科:机械工程(一级学科);分析仪器(二级学科);电化学式分析仪器-电化学式分析仪器一般名词(三级学科) 本内容由全国科学技术名词审定委员会审定公布 目录 概况 概念 相关问题 概况 标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。如氢的标准电极电位H2←→H+ 为0.000V,锌标准电极电位Zn ←→Zn2+ 为-0.762V,铜的标准电极电位Cu ←→Cu2+为+0.337V。 金属浸在只含有该金属盐的电解溶液中,达到平衡时所具有的电极电位,叫做该金属的平衡电极电位。当温度为25℃,金属离子的有效浓度为1mol/L(即活度为1)时测得的平衡电位,叫做标准电极电位。 概念 什么叫标准电极电位
电极电位是表示某种离子或原子获得电子而放还原的趋势。如将某一金属放入它的溶液中(规定溶液中金属离子的浓度为lm),在25℃时,金属电极与标准氢电极(电极电位指定为零)之间的电位差,叫做该金属的标准电极电位。表7-2列出一些金属、非金属以及同一种金属具有不同价态的离子的标准电极电位,这些数值都是与标准氢电极比较而得出的。 相关问题 为了能正确使用标准电极电位表(课本或化学手册上均有较详细的表),现将有关的一些问题叙述如下: (1)在M+ + ne-→ M电极反应中,M叫做物质的还原态。M+ 叫做物质的氧化态,物质的还原态和氧化态构成氧化还原电对。电对也常用符号来表示,例如Zn/Zn是一个电对,Cu/Cu也是一个电对等。 (2)在表中所列的标准电极电位的正、负数值,不因电极反应进行的方向而改变。例如,不管电极反应是按Zn+2e=Zn,还是按Zn=Zn+2e的方式进行,电对(Zn/Zn 或Zn/Zn)的标准电极电位总是负号, (3)在表中,物质的还原态的还原能力自下而上依次增强;物质的氧化态的氧化能力自上而下依次增强。具体地说,电对的电极电位数值越小,在表中的位置越高,物质的还原态的还原能力越强,电对的电极电位数值越大,在表中的位置越低,物质的氧化态的氧化能力越强。例如电对Zn/Zn的标准电极电位的数值为-0.76伏较Cu数值+0.34伏为小,所以Zn原子较Cu原子容易失去电子,即Zn是较强的还原剂。 (4)物质的还原态的还原能力越强,其对应的氧化态的氧化能力就越弱;物质氧化态的氧化能力越强,其对应的还原态的还原能力就越弱。例如表7—2中K是最强的还原剂,其对应的K则是最弱的氧化剂,F2是最强的氧化剂,其对应的F则是最弱的还原剂。 (5)只有电极电位数值较小的物质的还原态与电极电位数值较大的物质的氧化态之 间才能发生氧化还原反应,两者电极电位的差别越大,反应就进行得越完全。
常用金属的电极电位
标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。如氢的标准电极电位H2←→H+ 为 一般标准电极电位以298K(即25摄氏度) 常见金属的标准电极电位: 石墨的标准电极电位为 + V 一价金Au+ +e = Au原子价标准电极电位为 + 1.692 V 三价金Au3+ + 3e=Au原子价标准电极电位为 + 1.498 V 钯Pd2+2e=Pd的标准电极电位为 + 0.830 V 三价铑 Rh3+ + 3e=Rh 的标准电极电位为 + 0.800 V 银 Ag+ +e=Ag的标准电极电位为 + 0.799 V 钌Rh3+ + 3e = Rh的标准电极电位为 + 0.790 V 汞 Hg2/2+ + 2e 的标准电极电位为 + 0. 789 V 铜 Cu2+ + 2e 的标准电极电位为 + V 氯化银的标准电极电位为 + 0. 222 V 氢2H+ + 2e = H2的标准电极电位为V
铁Fe3++3e=Fe的标准电极电位为- V 铅 Pb2+ + 2e=Pb 的标准电极电位为- V 锡 Sn2+ + 2e=Sn 的标准电极电位为- V 钼 Mo3+ + 3e=Mo 的标准电极电位为- V 镍 Ni2+ + 2e=Ni 的标准电极电位为- V 钴 Co2+ + 2e=Co 的标准电极电位为- V 铟 In3+ + 3e=In 的标准电极电位为- V 镉 Cd2+ + 2e 的标准电极电位为- V 铁 Fe2+ + 2e=Fe的标准电极电位为- V 镍硼Ni-B镀层的自腐蚀电位为,比Ni-B-PTFE的自腐蚀电位要高,而Ni-B-PTFE复合镀层的自腐蚀电位为左右 铬 Cr3+ + 3e = Cr 的标准电极电位为-0. 74 V 锌Zn2+ + 2e 的标准电极电位为-0. 763 V 钨 W 的标准电极电位为- 1. 05 V 锰 Mn2+ + 2e 的标准电极电位为- V 钛 Ti2+ + 2e 的标准电极电位为- V 铝 Al3+ + 3e 的标准电极电位为- V 镁 Mg2+ + 2e 的标准电极电位为- V 钕 Nd 是一种活性极强的金属,标准平衡电位为- V 1氢 H 3锂Li 4铍Be 5硼 B 6碳 C
金属腐蚀与防护
第一章绪论 腐蚀:由于材料与其介质相互作用(化学与电化学)而导致的变质和破坏。 腐蚀控制的方法: 1)、改换材料 2)、表面涂漆/覆盖层 3)、改变腐蚀介质和环境 4)、合理的结构设计 5)、电化学保护 均匀腐蚀速率的评定方法: 失重法和增重法;深度法; 容量法(析氢腐蚀);电流密度; 机械性能(晶间腐蚀);电阻性. 第二章电化学腐蚀热力学 热力学第零定律状态函数(温度) 热力学第一定律(能量守恒定律) 状态函数(内能) 热力学第二定律状态函数(熵) 热力学第三定律绝对零度不可能达到 2.1、腐蚀的倾向性的热力学原理 腐蚀反应自发性及倾向性的判据: ?G:反应自发进行 < ?G:反应达到平衡 = ?G:反应不能自发进行 > 注:ΔG的负值的绝对值越大,该腐蚀的自发倾向性越大. 热力学上不稳定金属,也有许多在适当条件下能发生钝化而变得耐蚀. 2.2、腐蚀电池 2.2.1、电化学腐蚀现象与腐蚀电池 电化学腐蚀:即金属材料与电解质接触时,由于腐蚀电池作用而引起金属材料腐蚀破坏. 腐蚀电池(或腐蚀原电池):即只能导致金属材料破坏而不能对外做工的短路原电 池. 注:1)、通过直接接触也能形成原电池而不一定要有导线的连接; 2)、一块金属不与其他金属接触,在电解质溶液中也会产生腐蚀电池. 丹尼尔电池:(只要有电势差存在) a)、电极反应具有热力学上的可逆性; b)、电极反应在无限接近电化学平衡条件下进行; c)、电池中进行的其它过程也必须是可逆的. 电极电势略高者为阴极 电极电势略低者为阳极 电化学不均匀性微观阴、阳极微观、亚微观腐蚀电池均匀腐蚀
2.2.2、金属腐蚀的电化学历程 腐蚀电池: 四个部分:阴极、阳极、电解质溶液、连接两极的电子导体(即电路) 三个环节:阴极过程、阳极过程、电荷转移过程(即电子流动) 1)、阳极过程氧化反应 ++ - M n M →ne 金属变为金属离子进入电解液,电子通过电路向阴极转移. 2)、阴极过程还原反应 []- -? D D ne +ne → 电解液中能接受电子的物质捕获电子生成新物质. (即去极化剂) 3)、金属的腐蚀将集中出现在阳极区,阴极区不发生可察觉的金属损失,只起到了传递电荷的作用 金属电化学腐蚀能够持续进行的条件是溶液中存在可使金属氧化的去极化剂,而且这些去极化剂的阳极还原反应的电极电位比金属阴极氧化反应的电位高2.2.3、电化学腐蚀的次生过程 难溶性产物称二次产物或次生物质由于扩散作用形成,且形成于一次产物相遇的地方 阳极——[]+n M(金属阳离子浓度) (形成致密对金属起保护作用) 阴极——pH高 2.3、腐蚀电池类型 宏观腐蚀电池、微观腐蚀电池、超微观腐蚀电池 2.3.1、宏观腐蚀电池 特点:a)、阴、阳极用肉眼可看到; b)、阴、阳极区能长时间保持稳定; c)、产生明显的局部腐蚀 1)、异金属(电偶)腐蚀电池——保护电位低的阴极区域 2)浓差电池由于同一金属的不同部位所接触的介质浓度不同所致 a、氧浓差电池——与富氧溶液接触的金属表面电位高而成为阳极区 eg:水线腐蚀——靠近水线的下部区域极易腐蚀 b、盐浓差电池——稀溶液中的金属电位低成为阴极区 c、温差电池——不同材料在不同温度下电位不同 eg:碳钢——高温阳极低温阴极 铜——高温阴极低温阳极 2.3.2、微观腐蚀电池 特点:a)、电极尺寸与晶粒尺寸相近(0.1mm-0.1μm); b)、阴、阳极区能长时间保持稳定; c)、引起微观局部腐蚀(如孔蚀、晶间腐蚀)
常用金属的电极电位
标准电极电位的概念 标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。如氢的标准电极电位H2←→H+ 为0.000 一般标准电极电位以298K(即25摄氏度) 常见金属的标准电极电位: 石墨的标准电极电位为 + 3.700 V 一价金Au+ +e = Au原子价标准电极电位为 + 1.692V 三价金Au3+ + 3e=Au原子价标准电极电位为 + 1.498 V 钯Pd2+2e=Pd的标准电极电位为 + 0.830V 三价铑 Rh3+ + 3e=Rh 的标准电极电位为 + 0.800V 银 Ag++e=Ag的标准电极电位为 + 0.799 V 钌Rh3+ + 3e = Rh的标准电极电位为 + 0.790V 汞Hg2/2+ + 2e 的标准电极电位为+ 0. 789 V 铜Cu2++ 2e 的标准电极电位为 + 0.337 V 氯化银的标准电极电位为 + 0. 222 V 氢2H+ + 2e = H2的标准电极电位为0.000V
铁Fe3++3e=Fe的标准电极电位为- 0.037V 铅 Pb2+ + 2e=Pb 的标准电极电位为- 0.126 V 锡 Sn2+ + 2e=Sn 的标准电极电位为- 0.136 V 钼 Mo3+ + 3e=Mo 的标准电极电位为-0.220V 镍 Ni2+ + 2e=Ni 的标准电极电位为-0.250V 钴 Co2+ + 2e=Co 的标准电极电位为-0.277 V 铟 In3+ + 3e=In 的标准电极电位为-0.342V 镉 Cd2+ + 2e 的标准电极电位为-0.403V 铁Fe2+ + 2e=Fe的标准电极电位为- 0.440V 镍硼Ni-B镀层的自腐蚀电位为-0.5V,比Ni-B-PTFE的自腐蚀电位要高,而Ni-B-PTFE复合镀层的自腐蚀电位为-0.63V左右 铬 Cr3+ + 3e = Cr 的标准电极电位为-0. 74 V 锌Zn2++ 2e 的标准电极电位为- 0. 763 V 钨 W 的标准电极电位为- 1. 05 V 锰 Mn2+ + 2e的标准电极电位为- 1.179V 钛 Ti2+ + 2e 的标准电极电位为- 1.630 V 铝 Al3+ + 3e 的标准电极电位为- 1.663V 镁 Mg2+ + 2e 的标准电极电位为- 2.363 V 钕 Nd 是一种活性极强的金属,标准平衡电位为- 2.431 V 1氢 H 3锂Li 4铍Be 5硼 B 6碳 C
(完整版)金属腐蚀与防护课后习题答案
腐蚀与防护试题 1化学腐蚀的概念、及特点 答案:化学腐蚀:介质与金属直接发生化学反应而引起的变质或损坏现象称为金属的化学腐蚀。 是一种纯氧化-还原反应过程,即腐蚀介质中的氧化剂直接与金属表面上的原子相互作用而形成腐蚀产物。在腐蚀过程中,电子的传递是在介质与金属之间直接进行的,没有腐蚀电流产生,反应速度受多项化学反应动力学控制。 归纳化学腐蚀的特点 在不电离、不导电的介质环境下 反应中没有电流产生,直接完成氧化还原反应 腐蚀速度与程度与外界电位变化无关 2、金属氧化膜具有保护作用条件,举例说明哪些金属氧化膜有保护作用,那些没有保护作用,为什么? 答案:氧化膜保护作用条件: ①氧化膜致密完整程度;②氧化膜本身化学与物理稳定性质;③氧化膜与基体结合能力;④氧化膜有足够的强度 氧化膜完整性的必要条件:PB原理:生成的氧化物的体积大于消耗掉的金属的体积,是形成致密氧化膜的前提。 PB原理的数学表示: 反应的金属体积:V M = m/ρ m-摩尔质量 氧化物的体积: V MO = m'/ ρ ' 用? = V MO/ V M = m' ρ /( m ρ ' ) 当? > 1 金属氧化膜具备完整性条件 部分金属的?值 氧化物?氧化物?氧化物? MoO3 3.4 WO3 3.4 V2O5 3.2 Nb2O5 2.7 Sb2O5 2.4 Bi2O5 2.3 Cr2O3 2.0 TiO2 1.9 MnO 1.8 FeO 1.8 Cu2O 1.7 ZnO 1.6 Ag2O 1.6 NiO 1.5 PbO2 1.4 SnO2 1.3 Al2O3 1.3 CdO 1.2 MgO 1.0 CaO 0.7 MoO3 WO3 V2O5这三种氧化物在高温下易挥发,在常温下由于?值太大会使体积膨胀,当超过金属膜的本身强度、塑性时,会发生氧化膜鼓泡、破裂、剥离、脱落。 Cr2O3 TiO2 MnO FeO Cu2O ZnO Ag2O NiO PbO2 SnO2 Al2O3 这些氧化物在一定温度范围内稳定存在,?值适中。这些金属的氧化膜致密、稳定,有较好的保护作用。 MgO CaO ?值较小,氧化膜不致密,不起保护作用。 3、电化学腐蚀的概念,与化学腐蚀的区别 答案:电化学腐蚀:金属与介质发生电化学反应而引起的变质与损坏。 与化学腐蚀比较: ①是“湿”腐蚀 ②氧化还原发生在不同部位 ③有电流产生 ④与环境电位密切相关
标准电极电位表
标准电极电位表 电极反应E0(V)F2(g) + 2H+ + 2e = 2HF 3.06 O3 + 2H+ + 2e = O2 + 2H2O 2.07 S2O82– + 2e = 2SO42– 2.01 H2O2 + 2H+ + 2e = 2H2O 1.77 MnO4– + 4H+ + 3e = MnO2(s) + 2H2O 1.695 PbO2(s) + SO42– + 4H+ + 2e = PbSO4(s) + 2H2O 1.685 HClO2 + H+ + e = HClO + H2O 1.64 HClO + H+ + e = 1/2 Cl2 + H2O 1.63 Ce4+ + e = Ce3+ 1.61 H5IO6 + H+ + 2e = IO3– + 3H2O 1.60 HBrO + H+ + e = 1/2 Br2 + H2O 1.59 BrO3– + 6H+ + 5e = 1/2 Br2 + 3H2O 1.52 MnO4– + 8H+ + 5e = Mn2+ + 4H2O 1.51 Au(III) + 3e = Au 1.50 HClO + H+ + 2e = Cl– + H2O 1.49 ClO3– + 6H+ + 5e = 1/2 Cl2 + 3H2O 1.47 PbO2(s) + 4H+ + 2e = Pb2+ + 2H2O 1.455 HIO + H+ + e = 1/2 I2 + H2O 1.45 ClO3– + 6H+ + 6e = Cl– + 3H2O 1.45 BrO3– + 6H+ + 6e =Br – + 3H2O 1.44 Au(III) + 2e = Au(I) 1.41 Cl2(g) + 2e = 2Cl- 1.3595
金属腐蚀及控制
第一章电化学腐蚀 1、何为腐蚀原电池?(外电路短路,画图) 腐蚀原电池:外电路短路原电池。 2、何为次生腐蚀反应?举例说明(Fe) 次生腐蚀反应:阳极、阴极腐蚀产物之间发生反应。 如:Fe,Cu,3%NaCl溶液中; 阳极:Fe - 2e = Fe2+ 阴极:O2 + 2H2O + 4e =4OH-次生腐蚀过程:Fe2++ 2OH- = Fe(OH)2 Fe(OH)2 沉积阳、极阴交界处形成致密膜起保护作用,若Fe(OH)2 进一步反应:Fe(OH)2 + O2 + 2H2O =4Fe(OH)3,脱水成铁锈xFeO.yFe2O3.2H2O 疏松不起保护作用。 3、微电池的种类有哪些? 定义:人眼不可辨,指阳极区和阴极区尺寸小,很难区分。 (1)成分不均匀钢或铸铁中的Fe、Fe3C或石墨,Fe为阳极,Fe3C或石墨为阴极;(2)组织不均匀晶界与晶粒内部,一般晶界为阳极,晶粒内部为阴极; (3)物理状态不均匀应力大晶格畸变为阳极,应力小为阴极。 4、双电层有哪几种? (1)金属+ H2O Mn +.ne + mH2O = Mn+ .mH2O + ne (2)金属+ 金属盐溶液
CuSO4溶液中的Cu2+由于被Cu吸引沉积到Cu上。Cu2 + + 2e = Cu (3)非金属+ 电解质溶液 氧电极:Pt吸附O2或O,得到Pt上的e。Pt =Pt + + e 氢电极:Pt吸附H2或H,得到Pt上的e。Pt =Pt + + e 5、简述阴极和阳极化学极化、浓差极化、电阻极化的原因。 (1)阳极极化原因 A.化学极化(活化极化):金属溶解速度<电子迁移速度,电子迁移到阴极,失电子Mn+还未迁移到溶液中,导致阳极带正电荷,电位升高,ηa>0; B.浓差极化:阳极周围Mn+向外扩散速度较慢,使阳极附近Mn+活度升高,ηc>0; M - ne =Mn+;ε↑=ε0+RT/nF ln(a Mn↑/1) C. 电阻极化:阳极形成保护膜,使M→Mn+过程受阻,ηr>0; (2)阴极极化原因
金属腐蚀与防护课后习题答案(精选)
第二章2. 某腐蚀体系的参数为: E 0a = -0.4V ,E 0c = 0.8V ,E cor = -0.2V 。当R = 0时,I cor = 10mA ,该腐蚀电池属于什么控制类型?如果欧姆电阻R = 90Ω,那么I 'cor =? 腐蚀电池又属于什么控制类型? 解:由题可知:当R=0时有: Icor=(Eoc-Eoa)/ (Pc+Pa ) Pc+Pa=(Eoc-Eoa)/ Icor=(0.8+0.4)/10×210 -=120Ω Pc=(Eoc-Ec)/ Icor=(0.8+0.2)/10× 310-=100Ω 则有 Pa=120-100=20Ω 因为Pc>>Pa ,所以该电池属于阳极极化控制。 当欧姆电阻R=90Ω时有: ' Icor =(Eoc-Eoa)/(Pc+Pa+R)=(0.8+0.4)/(120+90)=5.71mA 因为R 与Pc 接近,所以该腐蚀电池为欧姆电阻和阳极极化共同控制。 第四章5. 一个活化极化控制腐蚀体系,阴极反应和阳极反应的交换电流密度为0c i 、0a i ;Tafel 斜率为b c 、b a ;腐蚀电位满足条件E ea < 标准电极电位表 半反应E0(伏) F2(气) + 2H+ + 2e = 2HF 3.06 O3 + 2H+ + 2e = O2 + 2H2O 2.07 S2O82– + 2e = 2SO42– 2.01 H2O2 + 2H+ + 2e = 2H2O 1.77 MnO4– + 4H+ + 3e = MnO2(固) + 2H2O 1.695 PbO2(固) + SO42– + 4H+ + 2e = PbSO4(固) + 2H2O 1.685 HClO2 + H+ + e = HClO + H2O 1.64 HClO + H+ + e = 1/2 Cl2 + H2O 1.63 Ce4+ + e = Ce3+ 1.61 H5IO6 + H+ + 2e = IO3– + 3H2O 1.60 HBrO + H+ + e = 1/2 Br2 + H2O 1.59 BrO3– + 6H+ + 5e = 1/2 Br2 + 3H2O 1.52 MnO4– + 8H+ + 5e = Mn2+ + 4H2O 1.51 Au(III) + 3e = Au 1.50 HClO + H+ + 2e = Cl– + H2O 1.49 ClO3– + 6H+ + 5e = 1/2 Cl2 + 3H2O 1.47 PbO2(固) + 4H+ + 2e = Pb2+ + 2H2O 1.455 HIO + H+ + e = 1/2 I2 + H2O 1.45 ClO3– + 6H+ + 6e = Cl– + 3H2O 1.45 BrO3– + 6H+ + 6e =Br – + 3H2O 1.44 Au(III) + 2e = Au(I) 1.41 Cl2(气) + 2e = 2Cl 1.3595 ClO4– + 8H+ + 7e = 1/2 Cl2 + 4H2O 1.34 Cr2O72– + 14H+ + 6e =2Cr3+ + 7H2O 1.33 MnO2(固) + 4H+ + 2e = Mn2+ + 2H2O 1.23 O2(气) + 4H+ + 4e = 2H2O 1.229 IO3– + 6H+ + 5e = 1/2 I2 + 3H2O 1.20 ClO4– + 2H+ + 2e = ClO3– + H2O 1.19 Br2(水) + 2e = 2Br – 1.087 NO2 + H+ + e = HNO2 1.07 Br3– + 2e = 3Br – 1.05 HNO2 + H+ + e = NO(气) + H2O 1.00 VO2+ + 2H+ + e = VO2+ + H2O 1.00 HIO + H+ + 2e = I– + H2O 0.99 NO3– + 3H+ + 2e = HNO2 + H2O 0.94 ClO– + H2O + 2e = Cl– + 2OH– 0.89 H2O2 + 2e = 2OH– 0.88 Cu2+ + I– + e = CuI(固) 0.86 Hg2+ + 2e = Hg 0.845 NO3– + 2H+ + e = NO2 + H2O 0.80 Ag+ + e = Ag 0.7995 Hg22+ + 2e = 2Hg 0.793 腐蚀学第一章习题 1、导出腐蚀速度mm/a与mg/dm2·d间的一般关系式。 思考题 2、什么是腐蚀?为何提出几种不同的腐蚀定义? 3、举例说明研究腐蚀的意义. 4、化学腐蚀和电化学腐蚀的区别是什么? 5、金属的主要腐蚀形态有哪些? 10、表示均匀腐蚀速度的方法有哪些?它们之间有什么联系?这些腐蚀速度表达式中,哪些是量方程式?哪些是数值方程式?它们之间的主要区别是什么? 腐蚀学第二章习题 1、计算在25℃和50℃下的2.3RT/F值。 2、计算Zn在0.3mol/L ZnSO4溶液中的电极电位(相对于SHE),换算成SCE电位值是多少? 3、计算离子活度为10-6mol/L时,Ag/Ag+、Cu/Cu2+和Fe/Fe2O3/H+的平衡电极电位以及第三个电极的pH值。(已知:uoAg=0 , uoCu=0 , uoFe=0, uoFe2O3=-742.200KJ/mol , uoAg+= 77.12KJ/mol , uoCu2+=65.52 KJ/mol, uoH+=0) 4、计算25℃时,下列电极的标准电极电位 a)、Cu在氰化物溶液中(注意铜为1价) b)、Ni在氨溶液中 c)、Zn在碱溶液中 5、计算Ag/AgCl电极在1mol/L NaCl溶液中的电位。 6、计算40℃氢分压P H2=0.5atm时氢电极在PH=7的溶液中电极电位。 7、计算25℃时,铁在pH=9.2的0.5mol/L NaCl溶液中的电极电位。 10、Zn(阳极)与氢电极(阴极)在0.5mol/L ZnCl2溶液中组成电池的电动势为+0.590V,求溶液的pH值。 11、把Zn浸入pH=2的0.001 mol/LZnCl2溶液中,计算该金属发生析氢腐蚀的理论倾向。(以电位表示) 12、计算镍在pH =7的充空气的水中的理论腐蚀倾向。假定腐蚀产物为H2和Ni(OH)2, Ni(OH)2的溶度积为1.6×10-16。 13、铜电极和氢电极(P H2=0.2MPa)浸在Cu2+活度为1且pH=1的硫酸铜溶液中组成电池,求该电池的电动势,并判断电池的极性。 14、计算在pH=0的充空气的CuSO4溶液中铜是否因腐蚀而生成Cu2+(活度为1)和H2(0.1MPa),并以电位差表示腐蚀倾向的大小。 类似的,计算在pH=10的充空气的KCN溶液中(CN- 活度为0.5)是否腐蚀,假定生成Cu(CN)2– 离子,其活度为10-4;且下列反应的E0 =–0.446V。 Cu(CN)2–+ e =2 CN–+ Cu 15、计算下列电池的电动势:Pt∣Fe3+ (αFe3+ = 0.1),Fe2+(αFe2+ = 0.001)‖Ag+(αAg+ = 0.01)∣Ag,并写出该电池的自发反应,判定哪个电极为阳极? 附表5 一些半反应的标准电极电势(298.15K) 1. 在酸性溶液中 电极反应E/V Ag2+(aq) + e-═Ag+(aq) 1.98 AgBr(s) + e-═Ag(s) + Br- (aq) 0.071 AgCl(s) + e-═Ag(s) + Cl- (aq) 0.222 AgI(s) + e-═Ag(s) + I-(aq) -0.152 Ag2CrO4(aq) + 2e-═2Ag(s) + CrO42- (aq) * 0.447 Al Al3+(aq) + 3e-═Al(s) -1.676 As HAsO2(aq) + 3H+(aq) + 3e-═As(s) + 2H2O(l) 0.240 H3AsO4(aq) + 2H+(aq) + 2e-═HAsO2(aq) + 2H2O(l) *0.560 Au Au3+(aq) + 3e-═Au(s) 1.52 Au3+(aq) + 2e-═Au+(aq) 1.36 AuCl4- (aq) + 3e-═Au(s) + 4Cl -(aq) 1.002 Ba Ba2+(aq) + 2e-═Ba(s) -2.92 Br Br2(l) + 2e-═2Br -(aq) 1.065 2BrO3- (aq) + 12H+(aq) + 10e-═Br2(l) + 6H2O(l) 1.478 C 2CO2(g) + 2H+(aq) + 2e-═H2C2O4(aq) -0.49 Ca Ca2+(aq) + 2e-═Ca(s) -2.84 Cd Cd2+(aq) + 2e-═Cd(s) -0.403 Cl Cl2(g) + 2e-═2Cl -(aq) 1.358 ClO3- (aq) + 6H+(aq) + 6e-═Cl -(aq) + 3H2O(l) 1.450 2ClO3- (aq) + 12H+(aq) + 10e-═Cl2(g) + 6H2O(l) * 1.47 ClO4-(aq) + 2H+(aq) + 2e-═ClO3- (aq) + H2O(l) 1.189 2HClO(aq) + 2H+(aq) + 2e-═Cl2(g) + 2H2O(l) * 1.611 Co Co2+(aq) + 2e-═Co(s) -0.277 Co3+(aq) + e-═Co2+(aq) * 1.92 Cr Cr2+(aq) + 2e-═Cr(s) -0.90 Cr3+(aq) + e-═Cr2+(aq) -0.424 Cr2O72-(aq) + 14H+(aq) + 6e-═2Cr3+(aq) + 7H2O(l) 1.33 Cs Cs+(aq) + e-═Cs(s) -2.923 Cu Cu+(aq) + e-═Cu(s) 0.52 Cu2+(aq) + e-═Cu+(aq) 0.159 Cu2+(aq) + 2e-═Cu(s) 0.34 Cu2+(aq) + I -(aq) + e-═CuI(s) 0.86 标准电极电势表 目录[隐藏] 电极电势的产生—双电层理论 定义 公式 电极电势内容 标准电极电势表 [编辑本段] 电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 [编辑本段] 定义 标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势. 标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向. [编辑本段] 公式 腐蚀与防护试题 1、Fe—H2O的E—pH图说明该钢铁的防腐应用。 金属的E—pH图的应用 预计一定条件下的金属腐蚀行为;反应金属自发腐蚀热力学倾向;指明金属实施保护的可能性与方向。总结E—pH图的规律:上腐蚀、下稳定、两边(左右)腐蚀、中间钝化。常见金属在中性介质中都比较稳定。应用举例:当一定环境条件时,通过调整酸度可使其进入钝化区;实行阴极保护可使其进入保护区。 3、大阴极小阳极会加速腐蚀速率 如钢管的氧化膜是金属热轧后与空气反应生成蓝黑色氧化铁层。该氧化层不仅比金属目材还硬,而且相对于目材金属他是阴极,而目材纯金属相对是阳极。腐蚀纯金属阳极来保护相对是阴极氧化皮地坪漆。如果大面积氧化皮之中有破损,破损部位是阳极,周围的氧化皮就是阴极,这就形成了大阴极小阳极。大阴极小阳极会加速腐蚀速率。 如果储罐的底部有泥沙沉积,泥沙和钢接触的部位氧气含量就很低,而泥沙周围的钢的表面氧气含量就相对很高。氧气含量高的区域相对其他氧气含量低位置是阴极,氧气含量低的位置就相对是阳极,从而形成氧气浓度电池,促进氧气含量低的位置的腐蚀。 相互搭接的表面,开裂涂层的下面阴极保护,空洞位置等都会形成氧气浓度腐蚀电池,腐蚀也都很快,因为在他们四周氧气含量相对都很高。 4、腐蚀极化图说明其应用。 腐蚀极化图是一种电位—电流图,它是把表征腐蚀电池特征的阴、阳极极化曲线画在同一张图上构成的。腐蚀极化图的应用 (1)极化图用于分析腐蚀速度的影响因素 (a)腐蚀速度与腐蚀电池初始电位差的关系:腐蚀电池的初始电位差(EO,C- EO,A ),是腐蚀的原动力;(例氧化性酸对铁的腐蚀;不同金属平衡电位对腐蚀电流的影响) (b)极化性能对腐蚀速度的影响:若腐蚀电池的欧姆电阻很小,则极化性能对腐蚀电流有很大的影响;(例钢在非氧化酸中的腐蚀极化图) (c)溶液中含氧且及络合剂对腐蚀速度的影响;(例铜在含氧酸及氰化物中腐蚀极化图) (d)其他影响腐蚀速度的因素,如阴、阳极面积比和溶液电阻等。 (2)腐蚀速度控制因素:阳极控制、阴极控制、混合控制和欧姆控制。 5、阳极型缓蚀剂 阳极型缓蚀剂多为无机强氧化剂,如铬酸盐、钼酸盐、钨酸盐、钒酸盐、亚硝酸盐、硼酸盐等。它们的作用是在金属表面阳极区与金属离子作用,生成氧化物或氢氧化物氧化膜覆盖在阳极上形成保护膜。这样就抑制了金属向水中溶解。阳极反应被控制,阳极被钝化。硅酸盐也可归到此类,它也是通过抑制腐蚀反应的阳极过程来达到缓蚀目的的。因此有时又被称作阳极型缓蚀剂或危险型缓蚀剂,阳极型缓蚀剂要求有较高的浓度,以使全部阳极都被钝化,一旦剂量不足,将在未被钝化的部位造成点蚀。 1化学腐蚀的概念、及特点 答案:化学腐蚀:介质与金属直接发生化学反应而引起的变质或损坏现象称为金属的化学腐蚀。 是一种纯氧化-还原反应过程,即腐蚀介质中的氧化剂直接与金属表面上的原子相互作用而形成腐蚀产物。在腐蚀过程中,电子的传递是在介质与金属之间直接进行的,没有腐蚀电流产生,反应速度受多项化学反应动力学控制。 归纳化学腐蚀的特点 在不电离、不导电的介质环境下 反应中没有电流产生,直接完成氧化还原反应 腐蚀速度与程度与外界电位变化无关 2、金属氧化膜具有保护作用条件,举例说明哪些金属氧化膜有保护作用,那些没有保护作用,为什么? 标准电极电位表 半反应E0(伏)半反应E0(伏)半反应E0(伏)F2(气) + 2H+ + 2e = 2HF 3.06 HClO + H+ + 2e = Cl– + H2O 1.49 Br2(水) + 2e = 2Br– 1.087 O3 + 2H+ + 2e = O2 + 2H2O 2.07 ClO3– + 6H+ + 5e = 1/2 Cl2 + 3H2O 1.47 NO2 + H+ + e = HNO2 1.07 S2O82– + 2e = 2SO42– 2.01 PbO2(固) + 4H+ + 2e = Pb2+ + 2H2O 1.455 Br3– + 2e = 3Br– 1.05 H2O2 + 2H+ + 2e = 2H2O 1.77 HIO + H+ + e = 1/2 I2 + H2O 1.45 HNO2 + H+ + e = NO(气) + H2O 1.00 MnO4– + 4H+ + 3e = MnO2(固) + 2H2O 1.695 ClO3– + 6H+ + 6e = Cl– + 3H2O 1.45 VO2+ + 2H+ + e = VO2+ + H2O 1.00 PbO2(固) + SO42– + 4H+ + 2e = PbSO4(固) + 2H2O 1.685 BrO3– + 6H+ + 6e =Br – + 3H2O 1.44 HIO + H+ + 2e = I– + H2O 0.99 HClO2 + H+ + e = HClO + H2O 1.64 Au(III) + 2e = Au(I) 1.41 NO3– + 3H+ + 2e = HNO2 + H2O 0.94 HClO + H+ + e = 1/2 Cl2 + H2O 1.63 Cl2(气) + 2e = 2Cl 1.3595 ClO– + H2O + 2e = Cl– + 2OH–0.89 Ce4+ + e = Ce3+ 1.61 ClO4– + 8H+ + 7e = 1/2 Cl2 + 4H2O 1.34 H2O2 + 2e = 2OH–0.88 H5IO6 + H+ + 2e = IO3– + 3H2O 1.60 Cr2O72– + 14H+ + 6e =2Cr3+ + 7H2O 1.33 Cu2+ + I– + e = CuI(固) 0.86 HBrO + H+ + e = 1/2 Br2 + H2O 1.59 MnO2(固) + 4H+ + 2e = Mn2+ + 2H2O 1.23 Hg2+ + 2e = Hg 0.845 BrO3– + 6H+ + 5e = 1/2 Br2 + 3H2O 1.52 O2(气) + 4H+ + 4e = 2H2O 1.229 NO3– + 2H+ + e = NO2 + H2O 0.80 MnO4– + 8H+ + 5e = Mn2+ + 4H2O 1.51 IO3– + 6H+ + 5e = 1/2 I2 + 3H2O 1.20 Ag+ + e = Ag 0.7995 Au(III) + 3e = Au 1.50 ClO4– + 2H+ + 2e = ClO3– + H2O 1.19 Hg22+ + 2e = 2Hg 0.793 Fe3+ + e = Fe2+0.771 2SO2(水) + 2H+ + 4e = S2O32– + H2O 0.40 S4O62– + 2e = 2S2O32–0.08 BrO– + H2O + 2e = Br– + 2OH–0.76 Fe(CN)63– + e = Fe(CN)64–0.36 AgBr(固) + e = Ag + Br–0.071 O2(气) + 2H+ + 2e = H2O20.682 Cu2+ + 2e = Cu 0.337 2H+ + 2e = H20.000 AsO8– + 2H2O + 3e = As + 4OH–0.68 VO2+ + 2H+ + 2e = V3+ + H2O 0.337 O2 + H2O + 2e = HO2– + OH–-0.067 2HgCl2 + 2e = Hg2Cl2(固) + 2Cl–0.63 BiO+ + 2H+ + 3e = Bi + H2O 0.32 TiOCl+ + 2H+ + 3Cl– + e = TiCl4– + H2O -0.09 Hg2SO4(固) + 2e = 2Hg + SO42–0.6151 Hg2CI2(固)+ 2e = 2Hg + 2Cl–0.2676 Pb2+ + 2e = Pb -0.126 MnO4– + 2H2O + 3e = MnO2 + 4OH–0.588 HAsO2 + 3H+ + 3e = As + 2H2O 0.248 Sn2+ + 2e = Sn -0.136 MnO4– + e = MnO42–0.564 AgCI(固)+ e = Ag + Cl–0.2223 AgI(固) + e = Ag + I–-0.152 标准电极电势表 标准电极电势能够用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极, 溶液中离子有效浓度为1mol/L, 气体分压为100kPa, 温度为298K, 所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注: (s) –固体; (l) –液体; (g) –气体; (aq) –水溶液; (Hg) –汞齐。 半反应E°(V)[注 1]来源 Ba++ e?Ba(s) ?4.38 [10][1][3] Sr++ e?Sr(s) ?4.10 [11][1][3] Ca++ e?Ca(s) ?3.8 [11][1][3] Pr3++ e?Pr2+?3.1 [11] ?N2(g) + H++ e?HN3(aq) ?3.09 [6] Li++ e?Li(s) ?3.0401 [5] N2(g) + 4?H2O + 2?e?2?NH2OH(aq) + 2?OH??3.04 [6] Cs++ e?Cs(s) ?3.026 [5] 半反应E°(V)[注 1]来源Ca(OH)2(s) + 2?e?Ca(s) + 2 OH??3.02 [11] Rb++ e?Rb(s) ?2.98 [4] K++ e?K(s) ?2.931 [5] Mg++ e?Mg(s) ?2.93 [10] Ba2++ 2?e?Ba(s) ?2.912 [5] La(OH)3(s) + 3?e?La(s) + 3OH??2.90 [5] Fr++ e?Fr(s) ?2.9 [11] Sr2++ 2?e?Sr(s) ?2.899 [5] Sr(OH)2(s) + 2?e?Sr(s) + 2?OH??2.88 [11] Ca2++ 2?e?Ca(s) ?2.868 [5] Eu2++ 2?e?Eu(s) ?2.812 [5] Ra2++ 2?e?Ra(s) ?2.8 [5] Yb2++ 2?e?Yb(s) ?2.76 [11][1] Na++ e?Na(s) ?2.71 [5][9] 电极电位 科技名词定义 中文名称:电极电位 英文名称:electrode potential 定义:一个包含标准氢电极和所研究的半电池的原电池的电动势。 所属学科:机械工程(一级学科);分析仪器(二级学科);电化学式分析仪器-电化学式分析仪器一般名词(三级学科) 本内容由全国科学技术名词审定委员会审定公布 电极电位 金属浸于电解质溶液中,显示出电的效应,即金属的表面与溶液间产生电位差,这种电位差称为金属在此溶液中的电位或电极电位。 目录 编辑本段 判断氧化还原反应自发进行的方向 电池反应都是自发进行的氧化还原反应。因此电池反应的方向即氧化还原反应自发进行的方向。判断氧化还原反应进行的方向时,可将反应拆为两个半反应,求出电极电位。然后根据电位高的为正极起还原反应,电位低的为负极起氧化反应的原则,就可以确定反应自发进行的方向。如果两个电对的值相差较大(即Eφ),浓度的变化对电位的影响不大,不至于使反应改变方向。因此,当Eφ>0.2V 时,即使不处于标准状态,也可直接用值的大小确定反应方向。否则,必须考虑浓度和酸度的影响,用能斯特方程式计算出电对的值,用E>0作为判断确定反应进行的方向,若E>0,正向反应能自发进行;E<0,正向反应不能自发进行,其逆向反应能自发进行。 例9 判断298K时下列反应进行的方向: 解:将上述反应写成两个半反应,并查出它们的标准电极是位: 标准电动势为:Eφ=2-1=0.4402-(-0.4402) =0.7804(V)。 因为Eφ>0.2V,可直接用值判断反应进行的方向。2>1,表明Cu2+是比Fe2+更强的氧化剂,Fe是比Cu更强的还原剂所以上述反应可自发地向右进行。 为了证明这个结论的正确性,我们可以按非标准态的电池反应计算电动势。 电池电动势为:E=2-1=0.1923-(-0.4402) =0.6325(V) 因为E>0,上述反应可自发地向右进行。 例10 判断298K时反应 当[HAsO2]=[H3AsO4]=1mol.L-1,[I-]=1mol.L-1,在中性和酸性 ([H+]=1mol.L-1)溶液中反应进行的方向。 解:将上述反应写成两个半反应,并查出它们的标准电极电位: 在中性溶液中,[H+]=1.0*10-71mol.L-1。 1=1=+0.535V =0.559+0.059161g[H+] =0.559+0.059161g10-7 =0.559+0.414 =0.145(V)标准电极电位表
金属腐蚀学习题
一些半反应的标准电极电势
标准电极电势表
金属腐蚀与防护课后习题
标准电极电位表
标准电极电势表样本
电极电位
