化学平衡状态标志的判断及近年高考化学平衡大题

化学平衡状态标志的判断
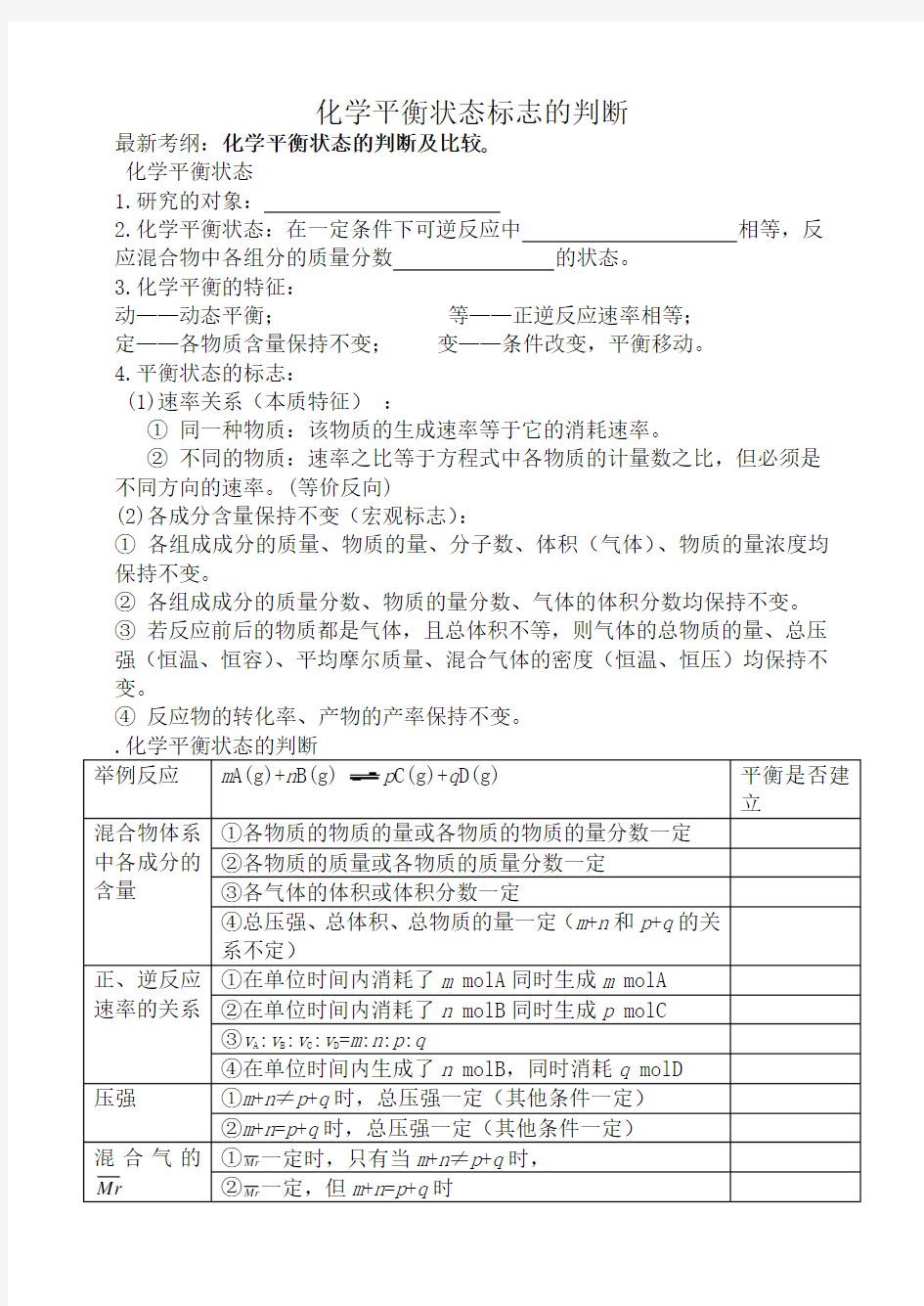
最新考纲:化学平衡状态的判断及比较?
化学平衡状态
1.研究的对象:
2.化学平衡状态:在一定条件下可逆反应中相等,反应混合物中各组分的质量分数的状态。
3.化学平衡的特征:
动——动态平衡;等——正逆反应速率相等;
定——各物质含量保持不变;变——条件改变,平衡移动。
4.平衡状态的标志:
(1)速率关系(本质特征):
①同一种物质:该物质的生成速率等于它的消耗速率。
②不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。(等价反向)
(2)各成分含量保持不变(宏观标志):
①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
②各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④反应物的转化率、产物的产率保持不变。
p
1.在恒温下的密闭容器中,有可逆反应2NO (g )+O 2(g )2NO 2
(g );ΔΗ<0,不能说明已达到平衡状态的是
A .正反应生成NO2的速率和逆反应生成O2的速率相等
B .反应器中压强不随时间变化而变化
C .混合气体颜色深浅保持不变
D .混合气体平均分子量保持不变
2.在一定温度下,反应A 2(g )+ B 2(g )2AB (g )达到平衡的标志是
A .单位时间生成的n mol 的A 2同时生成n mol 的AB
B .容器内的总压强不随时间变化
C .单位时间生成2n mol 的AB 同时生成n mo l 的B 2
D .单位时间生成n mol 的A 2同时生成n mol 的B 2
3.下列叙述表示可逆反应N 2 + 3H 2 2NH 3一定处于平衡状态的是
A .N 2、H 2、NH 3的百分含量相等
B .单位时间,消耗a mol N 2的同时消耗3a mol H 2
C .单位时间,消耗a molN2的同时生成3a mol H2
D .反应若在定容的密器中进行,温度一定时,压强不随时间改变
4.对于固定体积的密闭容器中进行的气体反应可以说明
A(g) + B (g ) C (g )+D (g )在恒温下已达到平衡的是
A .反应容器的压强不随时间而变化
B .A 气体和B 气体的生成速率相等
C .A 、B 、C 三种气体的生成速率相等
D .反应混合气体的密度不随时间而变化
5.下列说法中,可以表明反应N 2+3H 22NH 3已达到平衡状态的是
A .1molN≡N 键断裂的同时,有3molH —H 键形成
B .1molN≡N 键断裂的同时,有3molH —H 键断裂
C .1molN≡N 键断裂的同时,有6molN —H 键形成
D .1molN≡N 键断裂的同时,有6mol N —H 键断裂
6.可逆反应N 2+3H 22NH 3的正、逆反应速率可用各反应物或生成物浓度的
变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.3v 正(N 2)=v 正(H 2)
B.v 正(N 2)=v 逆(NH 3)
C .2v 正(H 2)=3v 逆(NH3) D.v 正(N 2)=3v 逆(H 2)
7.在2NO 2(红棕色)N 2O 4(无色)的可逆反应中,下列状态说明达到平衡
标志的是
A .c(N 2O 4)=c(NO 2)的状态
B .N 2O 4处于不再分解的状态
C .NO 2的分子数与N 2O 4分子数比为2∶1的状态
D.体系的颜色不再发生改变的状态
8、可逆反应 H
2 (气)+I
2
(气)=2HI (气)达到平衡时的标志是()
A、混合气体的密度恒定不变 B. 混合气体的颜色不再改变
C. H
2、I
2
、HI的浓度相等 D. I2在混合气体中体积分数不再改变
9、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g) 2C(g)达到平衡的标志是
A、C的生成速率与C的分解速率相等
B.、单位时间生成n molA,同时生成3n molB
C、A、B、C的物质的量浓度保持不变
D、A、B、C的分子数之比为1 :3 :2
E、容器中气体的密度保持不变
F、混合气体的平均摩尔质量保持不变
G、容器中气体的总压强保持不变
10.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的
A 、A(气)+B(气)C(气)
B 、A(气)+2B(气)3C(气)
C 、A(气)+B(气)C(气)+D(气)
D 、以上都达到平衡
11.能够充分说明在恒温下的密闭容器中反应:2SO
2+O
2
2SO
3
,已经达到平
衡的标志是
A、容器中SO
2、O
2
、SO
3
共存
B、容器中SO
2和SO
3
的浓度相同
C、容器中SO
2、O
2
、SO
3
的物质的量为2:1:2
D、容器中压强不随时间的变化而改变
12、可逆反应∶2NO
22NO+O
2
在密闭容器中反应,达到平衡状态的标志是:
()
①单位时间内生成n molO
2的同时生成2n molNO
2
②单位时间内生成n
molO
2的同时,生成2n mol NO ③用NO
2
、NO、O
2
的物质的量浓度变化表示
的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥
B.②③⑤
C.①③④
D. ①②③④⑤⑥
13、下列说法中可以充分说明反应:
P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是
()
A. 反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
14. 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g) 2C(g)+D(g) 已达平衡状态的是
A.混合气体的压强
B. 混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量
15、下列方法中可以证明2HI(g)?H2(g)+I2(g)已达平衡状态的是
__________?
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有两个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)=v(HI)/2时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化?
化学平衡高考题集锦(近几年来高考题)
1. 在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0某研究
小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作
出下列关系图:
下列判断一定错误
....的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
2. 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)3C(g),若反应开始
时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按
下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A、2 mol C
B、2 mol A、1 mol B和1 mol He(不参加反
应)
C、1 mol B和1 mol C
D、2 mol A、3 mol B和3 mol C
1.3. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到
如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是
A .反应Ⅰ:△H >0,P 2>P 1
B .反应Ⅱ:△H <0,T 1>T 2
C .反应Ⅲ:△H >0,T 2>T 1;或△H <0,T 2<T 1
D .反应Ⅳ:△H <0,T 2>T 1
4. 在一定温度下,反应A 2(气)+ B 2(气)2AB (气)达到平衡的标志是
A.单位时间生成 n mol 的A 2同时生成n mol 的AB
B.容器内的总压不随时间变化
C.单位时间生成2n mol 的AB 同时生成n mol 的B 2
D.单位时间生成n mol 的A 2同时生成 n mol 的B 2
5. 反应2A(g)+B(g)2C(g);△H >0。下列反应条件有利于生成C 的是
A 低温、低压
B 低温、高压
C 高温、高压
D 高温、低压
6. 可逆反应N 2+3H 2 2NH 3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A .)()(322H v N v 正正=
B .)()(32NH v N v 正正=
C .)(3)(232NH v H v 正正=
D .)(3)(22H v N v 正正= 7. 在一密闭容器中,a A (气)bB (气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B 的浓度是原来的60k ,则
A .平衡向正反应方向移动了
B .物质A 的转化率减少了
C .物质B 的质量分数增加了
D .a>b
8. 已知反应A+3B 2C+D 在某段时间内以A 的浓度变化表示的化学反应速度为
,则此段时间内以C 的浓度变化表示的化学反应速率为
A .0.5
B .
C .2
D .3
9.
A.H 2(气)+I 2(气) 气)
B. 3H 2(气)+N 2(3(气)
C.2SO 2(气)+O 2(气) 3(气)
D. C(固)+CO 2(气) 气)
10. 在体积可变的密闭容器中,反应mA (气)+nB (固)pC (气)达到平衡后,压缩容器的体积,发现A 的转化率随之降低。下列说法中,正确的是
A (m +n )必定小于p
B (m +n )必定大于p
C m 必定小于p
D n 必定大于p
11. 在0.1mol -1溶液中存在如下电离平衡:
CH 33COO -+H +
对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
12. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲
线如下图所示:
下列描述正确的是
A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B、反应开始到10s,X的物质的量浓度减少了0.79mol/L
C、反应开始到10s时,Y的转化率为79.0%
D、反应的化学方程式为:X(g)+ Y(g)Z(g)
13. 某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)Z(g)+W(s):△H>0
下列叙述正确的是
A 加入少量W,逆反应速率增大
B 当容器中气体压强不变时,反应达到平衡
C 升高温度,平衡逆向移动
D 平衡后加入X,上述反应的△H增大
14. 图是温度和压强对X+Y 2Z反应影
响的示意图。图中横坐标表示温度,纵坐标
表示平衡混合气体中Z的体积分数。下列叙
述正确的是()
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态D.上述反应的逆反应的△H>0
15.已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
16. I .恒温、恒压下,在一个可变容积的容器中发生如下发应:A (气)+B (气)C (气)
(1)若开始时放入1molA 和1molB ,到达平衡后,生成a molC ,这时A 的物质的量为 mol 。
(2)若开始时放入3molA 和3molB ,到达平衡后,生成C 的物质的量为 mol 。
(3)若开始时放入x molA ,2molB 和1molC ,到达平衡后,A 和C 的物质的量分别是ymol 和3a mol ,则x = mol ,y = mol 。
平衡时,B 的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC ,待再次到达平衡后,C 的物质的量分数是 。
II .若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA 和1molB 到达平衡后生成b molC 。将b 与(1)小题中的a 进行比较 (选填一个编号)。
(甲)a <b (乙)a >b (丙)a =b (丁)不能比较a 和b 的大小
作出此判断的理由是 。
17. 在一定条件下,二氧化碳和氧气发生如下反应:
2SO 2(g )+ O 2 (g) 2SO 3(g) + Q (Q>0)
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K 值 ,
二氧化碳转化率
,化学反应速度 (以上均填增大、减小或不变)(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间
是 。(4)据图判断,反应进行至
20min 时,曲线发生变化的原因是 (用文字表达)10min 到15min 的曲线变化的原因可能是 (填写编号)。
a .加了催化剂
b .缩小容器体积
c .降低温度
d .增加SO 3的物质的量
18. 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为: Na(I)+KCl(I) NaCl(I)+K(g)-Q
该反应的平衡常数可表示为:K=C (K ) 各物质的沸点与压强的关系见右表。 (1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施
是 。
(3)常压下,当反应温度升高至900℃时,该反应的平衡常数可表示为:
19.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol
的I2,在一定的条件下发生如下反应:
(g) + I2(g) 2HI(g) + Q (Q>0)
H Array 2
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)
为。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增
大、减小或不变)
H I浓度的变化正确的是(用图2中a-c的编
号回答)
②若加入I2,H2浓度的变化正确的是,(用图2中d-f
的编号回答)
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一
倍,请在图3中画出8分钟后HI浓度的变化情况
20.
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表
示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
O(g) CO2(g)十H2 (g)十Q(Q>0)
CO(g)十H Array 2
CO和H2O浓度变化如下图,则0—4min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;
C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气b.降低温度
c.使用催化剂d.增加氢气浓度
13(2011四川).可逆反应○1X(g)+ 2Z(g) 、○22M(g N(g)+P(g)
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反
应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是
A 反应○
1的正反应式吸热反应 B 达平衡(I )时体系的压强与反应开始时体系的压强之比为14:15
C 达平衡(I )时,X 的转化率为
11
5 D 在平衡(I )和平衡(II )中M 的体积分数相等
(1)1-a (2)3a 3)2 3(1-a ) 丁 若3a >1,B 的物质的量小于2mol ;若 ,B 的物质的量等于2mol ; 若3a <1,B 的物质的量大于2mol
(4)a /(2-a ) (5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a >b 。
17. 1) (2)增大 增大 减小
(3)15—20min 和25—30min (4)增加了O2的最 a b
18. ⑴770℃ 890℃ ⑵减压或将钾蒸气抽走 19. (1)K = c2(HI)c(H2)?c(I2) (2)0.167mol/L ?min (3)① 减小 c ② f (4)见
图
20.(1) 可逆反应的进行程度越大可能增大也可能减小
(2) 0.03
(3) ①平衡> ②d a
化学平衡状态标志的判断方法及习题
化学平衡状态判断方法及其习题 最新考纲:化学平衡状态的判断及比较? 化学平衡状态 1.研究的对象: 2.化学平衡状态:在一定条件下可逆反应中相等,反应混合物中各组分的质量分数的状态。 3.化学平衡的特征: 动——动态平衡;等——正逆反应速率相等; 定——各物质含量保持不变;变——条件改变,平衡移动。 4.平衡状态的标志: (1)速率关系(本质特征): ①同一种物质:该物质的生成速率等于它的消耗速率。 ②不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。(等价反向) (2)各成分含量保持不变(宏观标志): ①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。 ②各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。 ③若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。 ④反应物的转化率、产物的产率保持不变。 p
【升华】“变”到“不变”。“变”就是到达平衡过程中量“变”,而到达平衡后“不变”,一定平衡? 【巩固练习】 1.在恒温下的密闭容器中,有可逆反应2NO (g )+O 2(g )2NO 2 (g );ΔΗ<0,不能说明已达到平衡状态的是 A .正反应生成NO 2的速率和逆反应生成O 2的速率相等 B .反应器中压强不随时间变化而变化 C .混合气体颜色深浅保持不变 D .混合气体平均分子量保持不变 2.在一定温度下,反应A 2(g )+ B 2(g )2AB (g )达到平衡的标志是 A .单位时间生成的n mol 的A 2同时生成n mol 的A B B .容器内的总压强不随时间变化 C .单位时间生成2n mol 的AB 同时生成n mol 的B 2 D .单位时间生成n mol 的A 2同时生成n mol 的B 2 3.下列叙述表示可逆反应N 2 + 3H 2 2NH 3一定处于平衡状态的是 A .N 2、H 2、NH 3的百分含量相等 B .单位时间,消耗a mol N 2的同时消耗3a mol H 2 C .单位时间,消耗a molN 2的同时生成3a mol H 2 D .反应若在定容的密器中进行,温度一定时,压强不随时间改变 4.对于固定体积的密闭容器中进行的气体反应可以说明 A(g) + B (g ) C (g )+D (g )在恒温下已达到平衡的是 A .反应容器的压强不随时间而变化 B .A 气体和B 气体的生成速率相等 C .A 、B 、C 三种气体的生成速率相等 D .反应混合气体的密度不随时间而变化 5.下列说法中,可以表明反应N 2+3H 22NH 3已达到平衡状态的是 A .1molN≡N 键断裂的同时,有3molH —H 键形成 B .1molN≡N 键断裂的同时,有3molH —H 键断裂 C .1molN≡N 键断裂的同时,有6molN —H 键形成 D .1molN≡N 键断裂的同时,有6molN —H 键断裂 6.可逆反应N 2+3H 22NH 3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 A.3v 正(N 2)=v 正(H 2) B.v 正(N 2)=v 逆(NH 3) C.2v 正(H 2)=3v 逆(NH 3) D.v 正(N 2)=3v 逆(H 2) 7.在2NO 2(红棕色)N 2O 4(无色)的可逆反应中,下列状态说明达到平衡标志的是
高中化学可逆反应达到平衡状态的标志及判断
高中化学可逆反应达到平衡状态的标志及判断 在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡 状态。其特点有: (1)“逆”:化学平衡研究的对象是可逆反应。 (2)“等”:化学平衡的实质是正、逆反应速率相等,即: v(正)=v(逆)。 (3)“动”:v(正)=v(逆)≠0 (4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数 保持一定(但不一定相等),不随时间的变化而变化。 (5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。 (6)“同”:在外界条件不变的前提下,可逆反应不论采取何种 途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状 态是相同的,即同一平衡状态。 可逆反应达到平衡状态的标志及判断方法如下: 以mA(g)+nB(g)pC(g)+qD(g)为例: 一、直接标志: ①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与 A的生成速率相等,A消耗速率与C的消耗速率之比等于m:p; ②反应体系中各物质的百分含量保持不变。 二、间接标志: ①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);
②各物质的浓度、物质的量不随时间的改变而改变; ③各气体的体积、各气体的分压不随时间的改变而改变。 对于密闭容器中的可逆反应:mA(g)+nB(g)pC(g)+qD(g)是否达到平衡还可以归纳如下表: 【例题1】可逆反应:2NO2(g)2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是 ①单位时间内生成nmolO2的同时生成2nmolNO2 ②单位时间内生成nmolO2的同时生成2nmolNO ③用NO2、NO、O2表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部 解析:①单位时间内生成nmolO2必消耗2nmolNO2,而生成 2nmolNO2时,必消耗nmolO2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V≠0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V≠0,能说明该反应达到平衡。 答案:A
化学平衡的标志和判断习题
化学平衡的标志和判断 化学平衡状态的判断:具体表现为“一等六定”: 一等:正逆反应速率相等; 六定:①物质的量一定,②平衡浓度一定,③百分含量保持一定,④反应的转化率一定,⑤产物的产率一定,⑥正反应和逆反应速率一定。 除了上述的“一等六定”外,还可考虑以下几点: ①同一物质单位时间内的消耗量与生成量相等。 ②不同物质间消耗物质的量与生成物质的量之比符合化学方程 式中各物质的化学计量数比。 ③在一定的条件下,反应物的转化率最大,或产物的产率最大。 ④对于有颜色变化的可逆反应,颜色不再改变时。 对于反应前后气体总体积变的可逆反应,还可考虑以下几点: ①反应混合物的平均相对分子量不再改变。 ②反应混合物的密度不再改变。 ③反应混合物的压强不再改变。 还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。 1、等速标志: 指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。 即V(正)= V(逆) 2、各组分浓度不变标志: 因为V(正)= V(逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。 3.有气体参与的可逆反应: (1)从反应混合气体的平均相对分子质量(M)考虑:M=m(总)/n(总) ①若各物质均为气体: 当气体△n(g)≠0时,若M一定时,则标志达平衡。如2SO 2(g)+O 2 (g)2SO 3 (g) 当气体△n(g)=0时,若M为恒值,无法判断是否平衡。如H 2(g)+I 2 (g)2HI(g) ②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M一定时,则标志
化学平衡习题集(含答案及解析)
化学平衡习题集 1.把 M和 N混合于的恒容密闭容器中,发生反应 3M (g) + N (g) x P (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P 的反应速率为·L-1·min-1,则下列说法正确的是() A.方程式中x=2 B.达平衡后,容器内压强是反应起始时的2倍 C.向容器中再充入和,达新平衡时Q 的体积分数减小 D.容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 2.向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+x B(g) 2C(g)。 各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示: 下列说法正确的是 A.10min内甲容器中反应的平均速率v(A)=(L·min) B.由图可知:T1 Cr (OH )3(s )Cr 3+(aq )+3OH 一 (aq ) (3)常温下,Cr (OH )3 的溶度积K sp =10-32 ;且当溶液中离子浓度小于10-5 mol·L -1 时 可视作该离子不存在下列有关说法中,正确的是:( ) A .步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO 42— 离子浓度增大 B .步骤①中当2v (CrO 4 2 一 )=v (Cr 2O 72—)时,说明反应2CrO 42—(黄色)+2H + Cr 2O 7 2— (橙色)+H 2O 达到平衡状态 C .步骤②中,若要还原1 mol Cr 2O 72一 离子,需要12 mol (NH 4)2Fe (SO 4)2·6H 2O 。 D .步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽 4.可逆反应A(g)+3B(g) 2C(g);△H= -QkJ/mol 。有甲、乙两个容积相同且不变的密闭 容器,向甲容器中加入1molA 和3molB ,在一定条件下达到平衡时放出热量为Q 1kJ ;在 相同的条件下,向乙容器中加入2molC 达到平衡后吸收热量为Q 2kJ ,已知Q 1=3Q 2。下列 叙述不正确的是( ) A .甲中A 的转化率为75% B .Q 1+Q 2=Q C .达到平衡后,再向乙中加入、、,平衡向正反应方向移 动 D .乙中的热化学方程式为2C(g) A(g)+3B(g);△H= +Q 2kJ/mol 5.已知某可逆反应mA (g )+ nB (g ) pC (g ),在密闭容器中进行,下图表示在不 同反应时间t 、温度T 和压强P 与反应物B 在混合气体中的百分含量B%的关系曲线,由 曲线分析,下列判断正确的是( ) A 、T 1 p ,⊿H >0; C 、T 1>T 2、P 1 0; D 、T 1 《化学平衡状态的判断》学案 一、化学平衡状态的直接标志: 1、等速标志:v正 = v逆(本质特征) ①同一种物质 ②不同的物质: 例1.在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是() (A) 正反应速度 v A=2mol/(L·min)逆反应速度v B=2 mol/(L·min) (B) 正反应速度 v A=2mol/(L·min)逆反应速度v C=2 mol/(L·min) (C) 正反应速度 v A=1mol/(L·min)逆反应速度v B=1.5 mol/(L·min) (D) 正反应速度 v A=1mol/(L·min)逆反应速度v C=1.5mol/(L·min) 例2.在一定温度下反应A 2(气)+B2(气)2AB(气)达到平衡的标志是() A、单位时间内生成nmolA2的同时,生成nmolB2 B、单位时间内生成2nmolAB的同时,生成nmolB2 C、单位时间内生成了nmolB2的同时,减少了nmolA2 D、单位时间生成nmolA2,同时生成nmolAB E、单位时间内消耗了nmolA2,同时消耗了2nmolAB 例3、下列说法中,可以证明N 2+3H22NH3已达到平衡状态的是() A.1个N≡N键断裂的同时,有3个H—H键形成 B.1个N≡N键断裂的同时,有3个H—H键断裂 C.1个N≡N键断裂的同时,有6个N—H键断裂 D.1个N≡N键断裂的同时,有6个N—H键形成 2、恒浓标志:反应混合物中各组成成分的浓度保持不变(外部表现) 例4、在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是() A.C生成的速率与C分解的速率相等 B.A、B、C的浓度不再变化 C.单位时间内生成n mol A,同时生成3n mol B D.A、B、C的分子数之比为1︰3︰2 二、化学平衡状态的间接标志: 1、各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。 2、各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。 3、反应物的转化率、产物的产率保持不变。 三、化学平衡状态的特殊标志: 1、对于全气体体系:如mA(g)+nB(g)pC(g)+qD(g) ①、m+n=p+q时:P总、n总、V总、M(平均)在任何时刻均不变,故不能作为平衡判断的依据。 ②、当m+n╪p+q时: a、定T、V时:P总、n总、、M(平均)只有在平衡时才为定值,故可作为平衡判断的依据。 b、定T、P时:V总、n总、、M(平均)只有在平衡时才为定值,故可作为平衡判断的依据。 2、对于全气体体系:若V一定,密度在任何时刻均不发生变化,故不能作为平衡判断的依据。 3、因任何化学反应均据热效应,故温度恒定可作为平衡判断的依据。 4、体系颜色不变可作为平衡判断的依据。 课后阅读: 一、化学平衡状态的一般标志:化学平衡状态的标志可概括为“一等五不变”。 以mA(g)+nB(g)pC(g)+qD(g)为例。 化学课外辅导专题四 ——化学平衡状态 一、知识提要 1、化学平衡状态可用五个字概括: 2、填写下表: 二、能力提高练习题 1、如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不.相符合... 的是( ) 反应速率 A .反应达平衡时,正反应速率和逆反应速率相等 B .该反应达到平衡态I 后,增大反应物浓度,平衡发生移动,达到平衡态II C .该反应达到平衡态I 后,减小反应物浓度,平衡发生移动,达到平衡态II D.同一种反应物在平衡态I和平衡态II时浓度不相等 2、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g)2C(g)达到平衡的标志是() A、C的生成速率与C的分解速率相等 B.、单位时间生成n molA,同时生成3n molB C、A、B、C的物质的量浓度保持不变 D、A、B、C的分子数之比为1 :3 :2 3、X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生 如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于() A、33% B、40% C、50% D、65% 4、在酸性条件下,高锰酸钾溶液可以氧化草酸溶液,用于酸化的酸可用 (硫酸、硝酸、盐酸)。判断该反应快慢的现象是。 1)该反应的离子方程式为:。 2)若反应中用4ml 0.01mol/L的KMnO4溶液与2ml 0.2mol/L的草酸溶液反应,褪色用时45S,用草酸表示的反应速率是。该反应转移的电子数目是。 3)在上反应滴加几滴MnSO4溶液,反应速率明显加快,分析原因是: 5、硫代硫酸钠溶液中滴加稀硫酸,现象是。写出化学方程式,用双 线桥法表示电子转移方向和数为: 在该反应中,每转移1mol电子,反应的硫代硫酸钠质量为。 6、在一定条件下,2A(g)+2B(g)3C(g)+D(g)达到平衡状态的标志是() A.单位时间生成2n mol A,同时生成n mol D B.容器的压强不随时间而变化 C.单位时间生成n mol B,同时消耗1.5n mol C D.容器混合气体密度不随时间而变化 E、容器的温度不再发生变化 F、v(A)=2/3 v(C) G、A的转化率不再发生变化 7、在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应: A(固)+2B(气) C(气)+D(气)已达平衡的是() A、混合气体的压强 B、混合气体的密度 C、B的物质的量浓度 D、气体总物质的量 8、在一定温度下,容器中加入CO和水蒸气各1mol,发生反应生成CO2和H2,达到平衡后 生成0.7mol,若其它条件不变,一开始充入4mol水蒸气,则达平衡时可能生成CO2的为 A、0.6 mol B、0.95 mol C、1 mol D、1.5 mol 0习题 例4. 可逆反应N2+3H2= 2NH3 的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的 是() A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3) C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2) 【模拟试题】(不定项选择) 1. 在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(固)+2B(气)= C(气)+D(气)已达平衡的是() A. 混合气体的压强 B.混合气体的密度 C. B的物质的量浓度 D. 气体总物质的量 2. 在一定温度下,可逆反应:A2(气)+B2(气)2AB(气),达到平衡的标志是() A. 容器的总压强不随时间而变化 B. 单位时间内有n mol A2生成的同时有n mol B2生成 C. 单位时间内有n mol B2发生反应的同时有n mol AB分解 D. 单位时间内生成n mol A2同时就有2n mol AB生成 3. 下列反应在密闭容器中进行,aA (g)+bB(g)mC(g )+nD(g),表示其已达到平衡状态的叙述中正 确的是() A. 平衡时的压强与反应起始的压强之比为m+n/a+b B. 用物质A表示的反应速度与物质C表示的反应速度之比为a/m C. 物质B的浓度不随时间而改变 D. 单位时间内x mol B参加反应同时有x mol B生成 4. 在一定条件下,可逆反应2A B +3C在下列4种状态中,处于平衡状态的是() A. 正反应速度vA=2mol/(L·min)逆反应速度vB=2 mol/(L·min) B. 正反应速度vA=2mol/(L·min)逆反应速度vC=2 mol/(L·min) C. 正反应速度vA=1mol/(L·min)逆反应速度vB=1.5 mol/(L·min) D. 正反应速度vA=1mol/(L·min)逆反应速度vC=1.5mol/(L·min)5. 在一定温度下反应A2(气)+B2(气)= 2AB(气)达到平衡的标志是() A. 单位时间内生成n mol A2的同时,生成n mol B2 B. 单位时间内生成2n mol AB的同时,生成n mol B2 化学平衡的标志和判断 1.判断可逆反应达到平衡状态方法: (1) 第一特征:V正=V逆: ①同一物质生成速率等于消耗速率; ②在方程式同一边的不同物质生成速率与消耗速率之比等于方程式系数之比 或消耗速率与生成速率之比,前后比较项必须相反; ③方程式不同一边的不同物质生成速率与生成速率之比等于方程式系数之比 或消耗速率与消耗速率之比,前后比较项必须相同; ④反应放出的热量与吸收的热量相等,体系温度不变。 (2) 第二特征:各组成成分百分含量保持不变 ①各组分的质量分数不变; ②各气体组分的体积分数不变; ③各组分的物质的量分数不变; ④各组分的分子数之比不变; ⑤各组分的物质的量浓度不变时一定平衡(变化时不一定); ⑥各组分的转化率或产率不变; ⑦若某组分有色,体系的颜色不再改变时一定平衡(变化时不一定)。 2.反应类型 (1)对于反应:mA2(气)+nB2(气) pC(气)+Q,下述特征标志表示可逆反应达到平衡状态: ①生成A2的速率与消耗A2的速率相等;生成B2的速率与消耗B2的速率相等; 生成C的速率与分解C的速率相等;生成C的分子数与分解C的分子数相等; 生成A2的速率:消耗B2的速率= m:n;消耗A2的速率:生成B2的速率=m:n 消耗A2的速率:消耗C的速率=m:p;消耗B2的速率:消耗C的速率=n:p 生成A2的速率:生成C的速率=m:p;生成B2的速率:生成C的速率=n:p 单位时间内,每生成pmolC的同时生成了mmolA2和n molB2;每消耗pmolC的同时消耗了mmolA2和n molB2 ②A2、B2、C的 (质量、体积、物质的量)百分组成、分子数之比不变; ③A2、B2、C的物质的量浓度不变; ④A2、B2的转化率不变; ⑤C的产率不变; ⑥气体的颜色不变; ⑦隔热条件下,体系温度不变; (2)当反应前后气体的体积相等时,即m+n = p时: ①A2、B2、C物质的量浓度不变或物质的量浓度之比不变,也标志反应达到了平衡状态; 但物质的量浓度大小、气体颜色深浅因外界压强改变而改变,平衡不移动,平衡状态不变。这两项发生改变时,不能作为判断反应是否达到了平衡状态或平衡是否发生了移动标志。 ②气体的总物质的量、总压强、总体积、单位体积内分子总数、气体密度、平均分子量大小因反应前后始终不变,有的随外加压强改变而变化但平衡不移动。不能判断反应是否达到了平衡状态或平衡是否发生了移动,通常不作为平衡标志。 (3)当反应前后气体的体积不相等时,即m+n≠p时,下列各项也可作为判断反应达到了平衡状态或平衡不再发生移动的标志: A2、B2、C的物质的量不变时;单位体积内分子总数不变时;恒容下体系压强不变时;恒压下体系的总体积不变时; 平均分子量不变时;混合物的密度不变时。 化学平衡状态提升 1、在一定条件下,化学反应N2+3H2 ? 2NH3达到平衡状态的标志为() A.容器内平均相对分子质量不随时间变化 B.N2、H2、NH3的浓度之比为1:3:2 C.N2减少的速率和NH3生成的速率之比为1:2 D.混合气体密度不变 2、在一定温度某容积可变密闭容器,建立下列化学平衡:C(s)+H2O(g)? CO(g)+H2(g),不 能确定上述可逆反应在一定条件下已达到化学平衡状态的是() A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O) C. 生成n mol CO的同时生成n mol H2 D. 1mol H-H键断裂的同时断裂2mol H-O键 3、在温度不变的条件下,恒容密闭容器中发生如下反应2SO2(g)+O2(g)?2SO3(g),下列叙述能 够说明反应已经达到平衡状态的是() A.容器中SO2、O2、SO3共存 B.单位时间内生成2mol SO2的同时消耗2mol SO3 C.容器中SO2、O2、SO3的物质的量之比为2:1:2 D.反应容器中压强不随时间变化4、在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)? C(g) +D(g)已达平衡的标志是() A.混合气体的压强 B.混合气体的密度 C.B的物质的量浓度 D.混合气体的总物质的量5、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 下列说法错误的是() A 反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动 D平衡常数增大改变温度可以改变此反应的平衡常数6、在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质 的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变. (1)能说明反应N2(g)+3H2(g)? 2NH3(g)达到平衡状态的有 (2)能说明反应H2(g)+I2(g)? 2HI(g)达到平衡状态的有 (3)能说明反应2NO2(g)? N2O4(g)达到平衡状态的有 7、在密闭容器中进行如下反应:X2(g)+Y2(g) ?2Z(g)已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( ) A.Z为0.3 mol·L-1 B.Y2为0.35 mol·L-1 C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1 化学平衡状态的判断标志 湖北省巴东县第二高级中学444324 谭贤凤 化学平衡状态的判断是化学平衡教学中的难点,为了帮助同学们有效地掌握这方面的知识,笔者对化学平衡的概念深入剖析,总结规律,从不同侧面认识化学平衡,以化解难点,提高对知识的应用能力。 一.剖析概念,把握标志 化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。从其概念可知,判断一个可逆反应在一定条件下是否达到平衡状态主要根据两点:一是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等;二是根据化学平衡状态的宏观表现——各组分的浓度保持不变。 二.深入理解,把握规律 ㈠化学平衡状态的一般标志 化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。 1.一等 “一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。 在试题中可有以下几种具体形式出现: ⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。 ⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗): υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。 ⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。 ⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。 2.五不变 “五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q 时,混合气体总物质的量不变。 在试题中可有以下几种具体形式出现: ⑴各组分的物质的量不变,如一定温度的密闭容器中,A、B、C、D的分子数不再改变。 ⑵各组分的浓度不变,如外界条件不变时,对于有颜色的物质参加或生成的可逆反应,混合气体的颜色不随时间发生变化。 ⑶各组分的百分含量不变,如各组分的体积分数、物质的量分数、质量分数保持不变。 ⑷反应物的转化率不变,如在一定条件下,A或B的转化率不再改变。 以上各项既适用于反应前后气体化学计量数之和不相等的可逆反应,又适用反应前后气体化学计量数之和相等的可逆反应。 ⑸对于全为气体参加的前后化学计量数改变的可逆反应,混合气体总物质的量不变。如当m+n╪p +q时,恒温恒容时,体系的总压强不发生变化;当m+n╪p+q时,恒温恒压时,体系的总体积不发生变化;当m+n╪p+q时,恒容时混合气体的平均相对分子质量不发生变化。 ㈡化学平衡状态的特殊标志 在恒容条件下,混合气体的密度能否作为化学平衡状态的标志呢?这主要看可逆反应中有无非气态物质参加或生成。因为该条件下的气体密度只和气体的质量有关,若是全气态物质参加的可逆反应,在恒容条件下,不论是否达到平衡,混合气体的总质量都不发生变化,混合气体的密度不发生变化,此时不能作为化学平衡状态的判断标志。若有非气态物质参与的可逆反应,在恒容条件下,只有达到平衡 2011-2012学年高二化学选修4(人教版)同步练习第二章 第三节化学平衡 一. 教学内容: 化学平衡 二. 重点、难点: 1.建立化学平衡概念 2.影响化学平衡移动的条件 3.勒夏特列原理的归纳总结 三. 具体内容: (一)可逆反应 1.溶解平衡状态的建立 2.可逆反应 (1)正、逆反应的判断 (2)符号 (3)前提 (二)化学平衡状态 1.平衡状态 (1)溶解平衡状态 (2)化学平衡状态 (3)构成化学平衡体系的基本要求 (4)化学平衡状态的判断 (5)图示表示方法 (三)影响化学平衡状态的条件 1.浓度对化学平衡的影响 (1)实验 (2)结论 (3)规律 (4)图示 (5)应用 2.温度对化学平衡的影响 (1)实验 1 (2)结论 3.压强对化学平衡的影响 4.催化剂对化学平衡的影响 5.勒夏特列原理 6.等效平衡 (1)内容 (2)规律 (四)化学平衡常数 1.公式 2.应用 【典型例题】 [ 例 1] 某温度下在密闭容器中发生如下反应:2M ( g ) +N ( g)≒ 2E ( g),若开始时只充入2molE ( g ),达平衡时,混合气体的压强比起始时增大了20% ;若开始时只充入2molM和1molN的混合气体,达平衡 时 M 的转化率为() A. 20% B. 40% C. 60% D. 80% 答案: B 解析:考察等效平衡和转化率的计算。 [ 例 2] 能够说明N 2 + 3H 2≒ 2NH 3反应在密闭容器中已达到平衡状态的是() ①容器内N2、H2、NH3三者共存 ②容器内N2、H2、NH3三者浓度相等 ③容器内N2、H2、NH3的浓度比恰为1:3:2 ④t min 内生成 1molNH 3同时消耗 0.5molN 2 ⑤t min 内,生成 1molN 2同时消耗 3mol H 2 化学平衡状态判断方法及其习题 B(g) 【升华】“变”到“不变”。“变”就是到达平衡过程中量“变”,而到达平衡后“不变”,一定平衡? 【巩固练习】 1.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)2NO2(g);ΔΗ<0,不能 说明已达到平衡状态的是 A.正反应生成NO2的速率和逆反应生成O2的速率相等 B.反应器中压强不随时间变化而变化 C.混合气体颜色深浅保持不变 D.混合气体平均分子量保持不变 2.在一定温度下,反应A2(g)+ B2(g)2AB(g)达到平衡的标志是 A.单位时间生成的n mol的A2同时生成n mol的AB B.容器内的总压强不随时间变化 C.单位时间生成2n mol的AB同时生成n mol的B2 D.单位时间生成n mol的A2同时生成n mol的B2 3.下列叙述表示可逆反应N2 + 3H22NH3一定处于平衡状态的是 A.N2、H2、NH3的百分含量相等 B.单位时间,消耗a mol N2的同时消耗3a mol H2 C.单位时间,消耗a molN2的同时生成3a mol H2 D.反应若在定容的密器中进行,温度一定时,压强不随时间改变 4.对于固定体积的密闭容器中进行的气体反应可以说明 A(g) + B(g) C(g)+D(g)在恒温下已达到平衡的是 A.反应容器的压强不随时间而变化 B.A气体和B气体的生成速率相等 C.A、B、C三种气体的生成速率相等 D.反应混合气体的密度不随时间而变化 5.下列说法中,可以表明反应N2+3H22NH3已达到平衡状态的是 A.1molN≡N键断裂的同时,有3molH—H键形成 B.1molN≡N键断裂的同时,有3molH—H键断裂 C.1molN≡N键断裂的同时,有6molN—H键形成 D.1molN≡N键断裂的同时,有6molN—H键断裂 6.可逆反应N 2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表 示。下列各关系中能说明反应已达到平衡状态的是 A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3) C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2) 7.在2NO2(红棕色)N2O4(无色)的可逆反应中,下列状态说明达到平衡标志的是 A.c(N2O4)=c(NO2)的状态 B.N2O4处于不再分解的状态 C.NO2的分子数与N2O4分子数比为2∶1的状态 D.体系的颜色不再发生改变的状态 8、可逆反应 H2 (气)+I2 (气)=2HI (气)达到平衡时的标志是() A、混合气体的密度恒定不变 B. 混合气体的颜色不再改变 C. H2、I2 、HI的浓度相等 D. I2在混合气体中体积分数不再改变 9、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g) 2C(g)达到平衡的标志是 A、C的生成速率与C的分解速率相等 B.、单位时间生成n molA,同时生成3n molB C、A、B、C的物质的量浓度保持不变 D、A、B、C的分子数之比为1 :3 :2 E、容器中气体的密度保持不变 F、混合气体的平均摩尔质量保持不变 G、容器中气体的总压强保持不变 10.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的 A 、A(气)+B(气)C(气) B 、A(气)+2B(气)3C(气) C 、A(气)+B(气)C(气)+D(气) D 、以上都达到平衡 11.能够充分说明在恒温下的密闭容器中反应:2SO2+O22SO3,已经达到平衡的标志 化学专题化学平衡状态 考纲要求:化学平衡状态的判断及比较? 化学平衡状态 1.研究的对象: 2.化学平衡状态:在一定条件下可逆反应 中相等,反应混合物中各组分的质量分数的状态。 3.化学平衡的特征: 动——动态平衡; 等——正逆反应速率相等; 定——各物质含量保持不变; 变——条件改变,平衡移动。 4.平衡状态的标志: m A(g)+n B(g pC(g)+q D(g) 【升华】“变”到“不变”。“变”就是到达平衡过程中量“变”,而到达平衡后“不变”,一定平衡? 【巩固练习】 2.在一定温度下,反应A 2(g)+B2(g)2AB(g)达到平衡的标志是() A.单位时间生成的nmol的A2同时生成nmol的AB B.容器内的总压强不随时间变化 C.单位时间生成2nmol的AB同时生成nmol的B2 D.单位时间生成nmol的A2同时生成nmol的B2 3.下列叙述表示可逆反应N 2 + 3H22NH3一定处于平衡状态的是() A.N2、H2、NH3的百分含量相等 B.单位时间,消耗amolN2的同时消耗3amolH2 C.单位时间,消耗amolN2的同时生成3amolH2 D.反应若在定容的密器中进行,温度一定时,压强不随时间改变 6.可逆反应N 2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列 各关系中能说明反应已达到平衡状态的是() A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3) C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2) 7.在2NO 2(红棕色)N2O4(无色)的可逆反应中,下列状态说明达到平衡标志的是() A.c(N2O4)=c(NO2)的状态 B.N2O4处于不再分解的状态 C.NO2的分子数与N2O4分子数比为2∶1的状态 D.体系的颜色不再发生改变的状态 8、可逆反应H 2 (气)+I2 (气)2HI(气)达到平衡时的标志是() A、混合气体的密度恒定不变 B.混合气体的颜色不再改变 C. H2、I2 、HI的浓度相等 D. I2在混合气体中体积分数不再改变 9、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g) 2C(g)达到平衡的标志是() A、C的生成速率与C的分解速率相等 B、单位时间生成nmolA,同时生成3nmolB C、A、B、C的物质的量浓度保持不变 D、A、B、C的分子数之比为1 :3 :2 E、容器中气体的密度保持不变 F、混合气体的平均摩尔质量保持不变 G、容器中气体的总压强保持不变 10、可逆反应∶2NO 22NO+O2在密闭容器中反应,达到平衡状态的标志是() 化学平衡的标志和判断 长乐高级中学 黄炳生 化学平衡状态的判断:具体表现为“一等六定”: 一等:正逆反应速率相等; 六定:① 物质的量一定,② 平衡浓度一定,③ 百分含量保持一定,④ 反应的转化率一定,⑤ 产物的产率一定,⑥ 正反应和逆反应速率一定。 除了上述的“一等六定”外,还可考虑以下几点: ①同一物质单位时间内的消耗量与生成量相等。 ②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比。 ③在一定的条件下,反应物的转化率最大,或产物的产率最大。 ④对于有颜色变化的可逆反应,颜色不再改变时。 对于反应前后气体总体积变的可逆反应,还可考虑以下几点: ①反应混合物的平均相对分子量不再改变。 ②反应混合物的密度不再改变。 ③反应混合物的压强不再改变。 还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。 1、等速标志: 指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。 即 V (正)= V (逆) 2、各组分浓度不变标志: 因为V (正)= V (逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。 3.有气体参与的可逆反应: (1)从反应混合气体的平均相对分子质量(M )考虑:M=m(总)/n(总) ①若各物质均为气体: 当气体△n(g)≠0时,若M 一定时,则标志达平衡。如2SO 2(g)+O 2(g) 2SO 3(g) 当气体△n(g)=0时,若M 为恒值,无法判断是否平衡。如H 2(g)+I 2(g) 2HI(g) ②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M 一定时,则标志 达平衡。 如C(s)+O 2(g) CO 2(g)、CO 2(g)+ C(s) 2CO(g) 高二上学期化学培优测试(四) 1.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是() A.2NO+O22NO2B.Br2(g)+H22HBr C.N2O42NO2D.6NO+4NH35N2+3H2O 2.在一个固定容积的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时,C的浓度为wmol/L。若维持容器的容积和温度不变,按下列情况配比为开始浓度,达到平衡后C的浓度仍为wmol/L的是() A、4molA+2molB B、2molA+1molB+3molC+1molD C、3molC+1molD+1molB D、3molC+1molD E、1molA+++ 3.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是() ①生成物的百分含量一定增加②生成物的产量一定增加 ③反应物转化率一定增大④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂 A.①②B.②⑤C.③⑤D.④⑥ 4.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一 倍,当达到新平衡时,B的浓度是原来的60%,则()A.平衡向逆反应方向移动了B.物质B的质量分数增加了 C.物质A的转化率减小了D.a>b 5.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4 此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是()A.x>y B.x=y C.x<y D.不能确定 6.(双选)在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是() A.升温B.降温C.减小容器体积D.增大容器体积 7.在体积可变的密闭容器中,反应mA(g)+nB(s)pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是()A.(m+n)必定小于p B.(m+n)必定大于p 判断化学平衡状态的标志---小析 一、判断化学平衡状态的标志 1、什么是化学平衡状态 化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。 2、平衡状态的判断方法: 直接判定:V正=V逆 ①同一物质:该物质的生成速率等于它的消耗速率。 ②不同的物质:速率之比等于方程式中的系数比,但必须是不同方向的速率。即必须是一个V正一个是V逆之比等于系数比才能判断是平衡状态。 例1、可逆反应:2NO2(g)= 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( B ) A 单位时间内生成n mol O2的同时生成2n mol NO2 【 B 单位时间内生成n mol O2的同时生成2n mol NO C 用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态 例2、判断 在反应2HI(g) H2(g)+I2(g)中能判断达平衡状态的有2molH-I键断裂就有1molH-H生成(错误)间接判定: ①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。 ②各组成成分的质量分数、物质的量分数、气体的体积分数保持不变。 ③若反应前后的物质都是气体,且系数不等,总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。 ④反应物的转化率、产物的产率保持不变。 总之:能变的量保持不变说明已达平衡。 | 二、具体方法 注意事项:在研究化学平衡时注意各物质的状态,和左右两边气体系数和是否相等。 在做题时注意用公式推出结论,在进行讨论,在此要注意哪些是可变量,哪些是不变量。 一、密度 ρ密度=质量/体积 ①可逆反应:2NO2(g) =2NO(g) + O2(g),在体积固定的密闭容器中,密度保持不变能否判断是平衡状态(否) 原因:在反应中质量不变,体积不变,密度是个恒定量,不随时间的变化而变化。 ②可逆反应:2NO2(g) =2NO(g) + O2(g),在压强固定的密闭容器中,密度保持不变能否判断是平衡状态(能) 选修四化学速率章末测试题(内含答案) 一.选择题(共20小题) 1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g).达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为() A.9 B.16 C.20 D.25 2.在体积为V的密闭容器中发生可逆反应3A(?)+B(?)═2C (g),下列说法正确的是() A.若A 为气态,则气体的平均密度不再变化时反应达到平衡状态 B.升高温度,C的体积分数增大,则该正反应放热 C.达到平衡后,向容器中加入B,正反应速率一定加快 D.达到平衡后,若将容器的容积压缩为原来的一半,C的浓度变为原来的1.8倍,则A一定为非气态 3.在体积均为1.0L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1mol A和0.2molA,在不同温度下反应A(g)+B(s)?2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是() A.反应A(g)+B(s)?2C(g)△S>0、△H<0 B.A的转化率:a(状态Ⅱ)>a(状态Ⅲ) C.体系中c(C):c(C,状态Ⅱ)>(C,状态Ⅲ) D.化学平衡常数:K (状态Ⅰ)=K (状态Ⅲ)>K(状态Ⅱ) 4.在醋酸溶液中,CH3COOH电离达到平衡的标志是() A.溶液显电中性 B.溶液中检测不出CH3COOH分子存在 C.氢离子浓度恒定不变 D.c(H+)=c(CH3COO﹣) 5.对于可逆反应:2A(g)+B(g)?2C(g)△H<0,下列各图正确的是()A.B.C. D. 6.工业上用丁烷催化脱氢制备丁烯:C4H10(g)═C4H8(g)+H2(g)(正反应吸热) 将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是()化学平衡状态的判断标志
化学平衡状态标志的判断
化学平衡标志习题
化学平衡的标志和判断总结
化学平衡状态标志习题
化学平衡状态的判断标志
化学平衡练习题.doc
化学平衡状态标志的判断方法及习题
化学平衡状态的标志
化学平衡的标志和判断
化学平衡移动练习题含答案
判断化学平衡状态的标志
选修四化学平衡练习题含答案.doc
