碧云天 细胞凋亡试剂盒(C1062)

自己翻译的罗氏tunel检测细胞凋亡试剂盒说明书
罗氏tunel检测细胞凋亡试剂盒说明书 注意:Label溶液含有甲次砷酸盐和二氯化钴,严禁吸入和食入。 反应悬浮物收集于密闭、不易碎、有明确标识的容器中,按有毒废物处理。 需要自己配置的其他物品: 除上表所列试剂外,还需准备以下溶液。下表列出每步所需物品概览:
产品概述: 特异性:TUNEL 反应优先标记凋亡产生的DNA 链断裂,从而辨别凋亡与坏死、以及由抑 制细胞生长的药物或放射线产生的primary DNA 链断裂 实验干扰:假阴性:在某些型式的凋亡细胞中DNA 链断裂可能缺失或不完全。空间位阻, 如细胞外元件可能阻止TdT 到达DNA 断裂处。两种情况均能产生假阴性。 假阳性:在坏死晚期,可能产生大量的DNA 片段 DNA 链断裂也可能在具有高增殖和代谢活动的细胞中出现。两种情况均能产生 假阳性。为确认细胞死亡的凋亡型式,应认真进行每种细胞的形态学检查 凋亡过程中产生的形态学改变尤其特征形式,因此,对于可以结果进行解释时, 细胞形态评估是一项重要的参数 样本:细胞离心涂片和细胞涂片 在chamber slides 上培养的黏附细胞 冰冻或福尔马林固定、石蜡包埋样本 分析时间:2-3小时,除外培养、固定和渗透 检测次数:一个试剂盒50T
步骤和所需材料: 1 流程图: 2 样品准备 黏附细胞、细胞涂片和细胞离心涂片 需准备的其他试剂:Washing buffer:磷酸盐缓冲液(PBS) Blocking buffer封闭溶液:甲醇稀释的3% H2O2 Fixation solution固定溶液:PBS配制的4%多聚甲醛,ph ,新鲜配制 Permeabilisation solution 渗透液:%Triton1)X-100溶于%柠檬酸钠溶液 中,新鲜配制 步骤:下表描述了细胞固定、内源性过氧化物酶封闭和细胞渗透过程。 组织部分 福尔马林-包埋组织 福尔马林包埋组织的预处理:可按4种不同的方式预处理。如用蛋白酶K,不含核酸酶,浓 度、孵育时间和温度应按组织类型优化 注意:只用罗氏应用科学的蛋白酶K,因其经检测不含核酸酶, 核酸酶可导致假阳性。 另外3中替代方法在下表中描述(step 2) 需准备的其他试剂:二甲苯和乙醇(浓度:95%,90%,80%,70%,溶于双蒸水中)
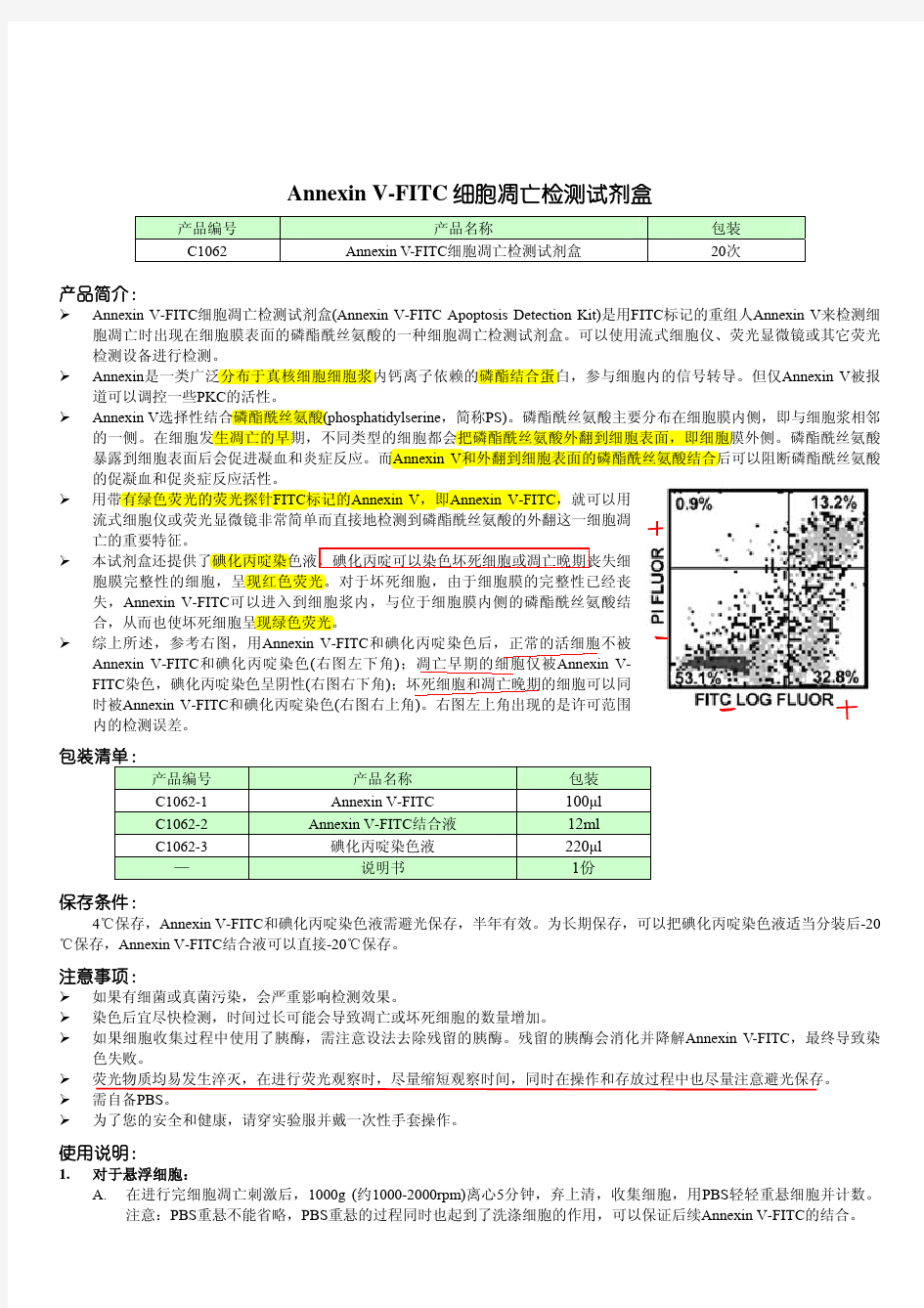
高中生物细胞的凋亡
高中生物细胞的凋亡2019年3月21日 (考试总分:108 分考试时长: 120 分钟) 一、填空题(本题共计 2 小题,共计 8 分) 1、(4分)(1)甲、乙两细胞中都存在且含有核酸的细胞器有(填标号)。 (2)为了研究抗体的合成,向甲细胞中注射3H标记的亮氨酸,放射性依次出现在甲细胞的 (用→和标号表示)细胞膜→分泌物中。甲细胞分泌抗体的方式是——————,若用呼吸抑制剂处理该细胞,抗体的分泌速率会——————(加快、减慢或不变)。若甲细胞发生癌变,则该细胞易扩散转移的主要原因是——————。 (3)如果将甲细胞放入0.3g/mL的蔗糖溶液中,将会出现细胞壁与——————分离的现象,其原因是——— ———。若将只含甲细胞的植物组织经解离→漂洗→染色→制片后,放在高倍显微镜下观察,不能观察到染色体的原因是——————。 (4)为了探究温度对膜的流动性的影响,有人做了以下实验:分别用红色和绿色荧光剂标记人和小鼠 细胞的细胞膜上的蛋白质。然后让两个细胞在37℃条件下融合并培养,40分钟后,融合的细胞膜上红 色和绿色均匀相间分布。该实验不够严密,请说明:——————,请写出改进思路——————。 2、(4分)Ⅰ.生产实践中总结出“根深叶茂”和“育秧先育根”的宝贵经验,即必须根生长得好,地上部分才能很好地生长。请回答: (1)根是植株细胞分裂素合成的中心,细胞分裂素合成后向上运输,能够抑制侧根向周围生长,促进 主根向更深的土层生长;蔬菜育苗移栽时,切除主根,可促进侧根生长。以上现象说明根具有——————— ———现象。 (2)在用IAA处理插条生根时,如果IAA的浓度较低,适合采用——————————法处理插条,此时的室内 环境最好遮荫且——————————,以保持IAA溶液的较低浓度。 (3)IAA除具有促进生根的功能,还具有防止脱落的功能。有些研究结果如右图所示。据图可知,IAA 对脱落的效应与——————————有关。 (4)脱落的生物化学过程主要是水解离层的细胞壁和中胶层,使细胞分离。与脱落有关的酶类较多,其中——————————是较为关键的。 Ⅱ.甘蔗发霉时滋生的节菱孢霉菌能产生三硝基丙酸(3-NP),引起神经细胞中毒或凋亡。图甲表示突触结构,③表示兴奋性神经递质。图乙表示注射生理盐水配制的1ml3-NP(300umol/L)后,小鼠纹状体细胞合成的与凋亡蛋白相关的mRNA(P53)的总含量。请回答。 (1)甲中结构①发生的代谢过程是——————————。 (2)胆碱酯酶能够分解兴奋性神经递质,而3-NP能抑制胆碱酯酶的合成,则食用发霉甘蔗会使图甲中物质③的含量——————————,将导致下一个神经元——————————。 (3)图乙同期对照组中应加入——————————。在神经细胞凋亡过程中直接起作用的细胞器是——————————。 (4)据图乙推测小鼠纹状体细胞凋亡数目可能在——————————时段内增加的最多,原因是——————————。 二、单选题(本题共计 20 小题,共计 100 分) 3、(5分)下列关于人体内细胞的凋亡、衰老和癌变的叙述,正确的是 A.癌细胞是人体内具有自养能力并快速增殖的细胞 B.衰老细胞的代谢水平降低,所有酶的活性降低 C.细胞凋亡,相关基因活动增强,有利于人体的生长发育 D.骨骼肌细胞分化过程中,控制肌动蛋白合成的基因将会表达,遗传物质在不断变化 4、(5分)研究发现,小鼠气管上皮细胞中的分泌细胞具有“去分化”的能力,这对高等脊椎动物在不同器官中和受伤情形下的再生能力可能具有更为普遍的贡献。下列相关叙述正确的是 A.干细胞内遗传物质的改变是分泌细胞形成的根本原因 B.受伤的细胞死亡与细胞的衰老死亡均属于细胞凋亡 C.“去分化”形成的干细胞在受伤情况下的再生体现了细胞的全能性 D.分泌细胞“去分化”时,细胞内有些蛋白质的合成将会中断
常用细胞凋亡检测方法(图)
常用细胞凋亡检测方法(图) 转载请注明来自丁香园 发布日期:2012-02-16 13:41 文章来源:丁香通 关键词:丁香园生物专题义翘神州细胞培养点击次数:951 一、细胞凋亡的形态学检测 1、光学显微镜和倒置显微镜 ①未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。 ②染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。 2、荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。常用的DNA 特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释,终浓度为10 ug/ml。DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为10 ug/ml。结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 3、透射电子显微镜观察 结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 二、磷脂酰丝氨酸外翻分析(Annexin V法) 磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。 碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细核红染。因此将Annexin-V 与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。 方法
Annexin V-FITC PI细胞凋亡检测试剂盒
Annexin V-FITC/PI 细胞凋亡检测试剂盒 Annexin V-FITC Apoptosis Detection Kit 一、试剂盒说明 在正常细胞中,磷脂酰丝氨酸(PS )只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS )由脂膜内侧翻向外侧。Annexin V 是一种分子量为35~36kD 的Ca 2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V 被作为检测细胞早期凋亡的灵敏指标之一。将Annexin V 进行荧光素FITC 标记,以标记了的Annexin V 作为荧光探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。 碘化丙啶(Propidium Iodide, PI )是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核染红。因此将Annexin V 与PI 匹配使用,就可以将处于不同凋亡时期的细胞区分开来。 本试剂盒可应用于培养细胞凋亡检测(不推荐用于检测组织样本)。 二、试剂盒组份 组份 (20 assays) (50 assays) (100 assays) 储存条件 AnnexinV-FITC 100 μL 250μL 500 μL Propidium Iodide 100 μL 250μL 500 μL Binding Buffer 10.0 mL 25 mL 50 mL 注:1、Annexin V-FITC 组份建议按需分装小份冻存于-20 ℃,避免反复冻融; 2、Propidium Iodide 和Binding Buffer 组份不用时可放置于4℃保存,Propidium Iodide 需要避光。 3、Store at -20℃ for 12 months 三、试剂盒以外自备仪器和试剂 流式细胞仪或荧光显微镜、低速离心机、微量移液器 1.5m L Microtube 、载玻片、盖玻片(荧光显微镜观察需用)、PBS 、不含EDTA 的胰酶消化液 四、使用注意事项 1. 微量试剂取用前请离心集液。 2. Annexin V-FITC ,Propidium Iodide (PI )避光保存及使用。对于Annexin V-FITC 这个组份,建议您在收到产品之后,分装为小份避光保存于-20℃,即用即取。 3. Propidium Iodide (PI )有毒,操作时要戴手套。 4. 本试剂盒适用于检测活细胞,流式细胞仪检测时,细胞数量不以应低于1×105,不推荐用于检测组织样本。 5. 推荐使用悬浮培养细胞。如果是贴壁细胞,需用不含EDTA 的胰酶消化,如消化不当,可能引起假阳性,而 用细胞刮子会造成细胞粘连成团,而影响检测。可将胰酶消化后细胞的保存在含2%BSA 的PBS 中,防止进一步的损伤。 6. 细胞固定后可能导致荧光的淬灭,请不要固定样品。 7. 因检测细胞的类型、凋亡诱导剂种类、使用的检测仪器不同,因而流式检测的荧光补偿也不同,因此建议每 次检测均需使用未经凋亡诱导处理的细胞作为对照,进行荧光补偿的调节。 五、 操作方法 1. 悬浮细胞离心(2000rpm 离心5min )收集;贴壁细胞用不含EDTA 的胰酶消化收集(注:胰酶消化时间不 易过长,否则容易引起假阳性); -20℃避光 4℃避光 4℃
骨骼肌细胞凋亡是COPD患者体重下降的重要原因
国外医学呼吸系统分册2003午第23卷第4期 骨骼肌细胞凋亡是COPD患者体重下降的重要原因【英]/AgustiAGN…//AmJRcspirCritCareMed.r2002。166(41.--485~489 COPD患者存疾病进程中常有矸;H月原因的体审r降,限制r其运动能力,危害r其生活质量。为此我们假设骨骼肌细胞凋亡是其中的霞要原因,作了如F研究。 方法15例患稳定性COPD的出院患者,十研究的3个月中尤一人住院或改变治疗方案。治疗包括|_乏效&激动剂、溴化异丙托品、茶碱和(或)吸人激素。无一人口服激素。其中7例体重指数(BMl)小于20kg/m2(17.5±0.5kg/m2,区刚16.4--18.6kg/mz),8侧BM【正常(24.8±o7kg/群.区间232~263kg/m4)。8例健康志原者为当地募集的普通居民(BMI.25.4士0.6kg/n12.1X阃z4.o~267kg/In。).6例行髋或膝外科术的矫形外科患哲(BMI,26.^+06kg/m。,区间24,8~27.9kg/m2)。后两组未接受激素治疗。所有受试者行肺孱测定,【’()PI)患者还行弥散功能(DzCO)厦动脉I【IL气测定。除矫形外利患者外,其余实验对象行运动懈受性实验,测定吸入():峰值(Vo。peak)。骨骼肌活检以针刺活检股凹头肌外侧部组织.矫形外科患者于手术中获取肌组织,80℃保存。骨骼肌细胞捅亡用柬端转移酶介导的u’II,缺Lj末端标记实验(TUNEI。法)及聚ADP棱糖聚合酶(PARP)蛋白水解片段免疫测定法。fIUNE!。法要求每倒|i舌检的髑张切片经两位检骑者独寺观察凋亡核,至少含两个阳性染色的核判为肌细胞凋亡。肌纤维边界结构由苏术精染色确认,仅位于政边界山的TUNEl,阳性才计为凋亡肌细胞核。计数至少200个肌细胞以计算捅亡阳降百分比,以两位检验者的平均值用f分析。PARP法即用Western杂交铡定PARP裂解的89ku片段与PARP天然的117ku蛋白质韵光密度比值定量t判定每一活检肌组织的凋亡水平。所有结果以平均值士标准差表示.两观察者的免疫组化测定值用组内相关系数分析,组间差异用步法变异分析,变异的相关性用Pearson检验,P<:0175台统汁学意义。 结果临脒和功能检查资料显示,健康对且{{组年龄低丁其他组,COPD+低BMI组年龄小丁COPD+正常BMI组,并低于行矫形外科术的患者:除COI’D斗低BMl组的{、MI(:20kg/m2,其他组BMI在正常范围。两组COPD组的吸烟史无差别,均有严重的气流阻塞,DL(1(J下降及低氧动脉血症,并肖运动耐受力严重受限,兄其是低BMI者(P<0.()5)。骨骼肌细胞凋亡榆测的TUNEI。技术,曲个操作者结果一致(r一0.96.P<001)。TUNEI。法与PARP法测定凋亡水平旱线性相关。TUNE[。测定的售骼肌活检组纵中细胞凋亡的百分率,健康组(38±1.8%)、矫正术组(60±2.3%)、COPD{正常BMI组(171±4,2%)、COPD+低BMI组(57.1±12.4%)依次增加(P-%0.0001)。PARP片段比值分别为健康组(0.5士0.2)、矫正术组(2.0土09)、COPD+正常BMI组(1.1土1j)、COl’D1低】}MI组(5.3一l、5)。COPD+低BMI组肌细胞PARP裂解显著增加。对BMI小同的两组COI’D患者间变异的研究显示.COPD患者f由BMl与骨骼肌细胞凋产呈负相关(IUNEL法,r 一0.65。P一0.009;PARP法r058,P一0.()●)。而BMl或骨骼肌细胞凋亡与COPI)患者的肺功能(FEV。,D。。(×),PaO。)无显著相关。BMI与运动能/J(Vo,peak)的相关性(,二074,P一0006),比BMI与气流m塞程度fFEV,)的相关性(r一0.66.,一002)要好。 结论体重下降的COPD患者骨骼肌细胞凋亡增加,且COI,D患者的骨骼肌细胞捌亡与其运动耐受性差有关,而与肺功能损害无干日关性。 (王祥摘王虹校) 不同标本容器和检验方法对胸水白细胞计数和分类结果的影响【英]/ConnerBD…//Chest.一2003,123(4).一1181~1183 就采用自动化纠胞计数器或手工计数,不同试管采集胸水标本对胸水向细胞(WBC)汁数和分类结果的影响进行了研究。 方法于超声定位下崩17号穿刺针从26例患者采集胸水标本28份,同一份标本分剐采用经依地酸(EDTA),拘橼酸或肝索化处理试管,玻璃试管或塑料试管等不同容器留置.4℃r冷藏。在4小时内对标本进行WBC计数和分类,Jf一在24小时后采用自动化计数器复查。 结果经EDTA处理试管采集的胸水,采用手T和自动化WBC计数结果基本一致(r一092;P<20001),而其它试管的检验结果觚为不一,中位封f|胞计数2种无抗凝剂试管的显著低于EDTA试管(P-C0.05).其中玻璃试管仅为后者的55%。而日,降低程度患者之间不一,部分达100蹦,或-Q25%。3种抗凝剂试管之间WBC计数比较也存在善异,枸橼酸和肝素处理试管显著低于E1)TA试管,但中位值仍显著大于玻璃试管。EDTA试管胸水手工和自动化细胞分类结果颇小一致,其巾.rI,件粒细胞百分比的相关系数仅为0.63(St)估计为12.8%);单棱绌胞/问应细胞的相关系数更低为o19(SD2.5“);而淋巴细胞百分比的相关系数较好为92蹦。5种小同试管标奉采用自动化计数器的胸水细胞分类¨数结果不.EDTA试管的中性粒细胞百分比和单核/间成细胞百分比较高,而淋巴细胞和嗜酸粒细胞百分比降低。标本贮存24小时后同类试管(EDTA或枸橼酸处理试管)的自动化wBC计数和细胞分类百分比结果无显著差异。 结果EDTA试管胸水标本的手工计数和自动化i1数结果非常接近。采用无抗凝剂管收集的标本WBC计数显著降低。胸水自动化WBC计数结果不准确.可能与难以区别中性粒细胞和单核细胞/间皮细胞有关不论采用何种试管标奉冷藏24小时对WBC计数和分类结果均无重要影响。 (任少华摘胡华成校) 万方数据
流式细胞仪检测细胞凋亡——Annexin VPI双染色法
流式细胞仪检测细胞凋亡——Annexin V/PI 双染色法 基本原理 细胞凋亡早期改变发生在细胞膜表面,目早期识别仍有困难些细胞膜表面的改变之是磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,使PS暴露在细胞膜外表面。PS是一带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使PS暴露在细胞膜外。Annexin V是一种Ca+依赖的磷脂结合蛋白,最初发现是一种具有很强的抗凝血特性的血管蛋白,Annexin V具有易于结合到磷脂类如PS的特性。对PS有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的PS。PS转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用Annexin V结合在细胞膜表面作凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法。 试剂与仪器 l孵育缓冲液:10mmol/L HEPES/NaOH,PH 7.4,140mmol/L NaCl,5mmol/L CaCl2 l标记液:将FITC- Annexin V(宝灵曼公司产品)和PI加入到孵育缓冲液中,终浓度均为1ug/ml l流式细胞仪 实验步骤 1. 细胞收集:悬浮细胞直接收集到10ml的离心管中,每样本细胞为(1~5)×106,/mL 500~1000r/min离心5min,弃去培养液。 2. 用孵育缓冲液洗涤1次,500~1000r/min离心5min。 3. 用100ul的标记溶液重悬细胞,室温下避光孵育10~15min。 4. 500~1000r/min离心5min沉淀细胞孵育缓冲液洗1次。 5. 加入荧光(SA-FLOUS)溶液4℃下孵育20min,避光并不时振动。 6. 流式细胞仪分析:流式细胞仪激发光波长用488nm,用一波长为515nm的通带滤器检测FITC荧光,另一波长于560nm的滤器检测PI。 7. 结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如PI有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的DNA可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期PI不会着染而没有红色荧光信号。正常活细胞与此相似。在
一步法TUNEL细胞凋亡检测试剂盒说明书
一步法TUNEL细胞凋亡检测试剂盒说明书 货号:T2190 规格:20次 保存:-20oC保存,荧光标记液需避光保存。 产品简介: 细胞在发生凋亡时,会激活一些DNA内切酶,这些内切酶会切断核小体间的基因组DNA。细胞凋亡时抽提DNA进行电泳检测,可以发现180-200bp的DNA ladder。基因组DNA断裂时,暴露的3’-OH可以在末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase,TdT)的催化下加上绿色荧光探针荧光素(FITC)标记的dUTP(fluorescein-dUTP),从而可以通过荧光显微镜或流式细胞仪进行检测,这就是TUNEL(TdT-mediated dUTP Nick-End Labeling)法检测细胞凋亡的原理。 一步法TUNEL细胞凋亡检测试剂盒(One Step TUNEL Apoptosis Assay Kit)为您提供了一种高灵敏度又快速简便的细胞凋亡检测方法。对于经过固定和洗涤的细胞或组织,只要经过一步染色反应,洗涤后就可以通过荧光显微镜或流式细胞仪检测到呈现绿色荧光的凋亡细胞。 TUNEL法特异性检测细胞凋亡时产生的DNA断裂,但不会检测出射线等诱导的DNA断裂(和细胞凋亡时的断裂方式不同)。这样一方面可以把凋亡和坏死区分开,另一方面也不会把射线等诱导发生DNA断裂的非凋亡细胞判断为凋亡细胞。极少数细胞凋亡时没有DNA断裂,此时不适用TUNEL法检测。在个别类型的坏死细胞中也发现TUNEL检测呈阳性。在需要严格判断细胞凋亡的情况下,最好同时检测多个凋亡指标。产品内容: 1.TdT酶100μl 2.荧光标记液900μl 3.TdT酶稀释液(选用)500μl
细胞凋亡检测方法
细胞凋亡检测方法 一、细胞凋亡的形态学检测 1 光学显微镜和倒置显微镜 (1)未染色细胞:凋亡细胞的体积变小、变形,全面皱缩,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体,凋亡小体为数个圆形小体围绕在细胞周围。贴壁细胞出现皱缩、变圆、脱落。 (2)染色细胞: 姬姆萨(Giemsa)染色、瑞氏染色等:正常细胞核色泽均一;凋亡细胞染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态;坏死细胞染色浅或没染上颜色。 苏木素-伊红(HE)染色:细胞核固缩碎裂、呈蓝黑色、胞浆呈淡红色(凋亡细胞),正常细胞核呈均匀淡蓝色或蓝色,坏死细胞核呈很淡的蓝色或蓝色消失。 2 荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。 常用的DNA特异性染料有:Hoechst 33342,Hoechst 33258,DAPI。三种染料与DNA 的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。 Hoechst是与DNA特异结合的活性染料,能进入正常细胞膜而对细胞没有太大细胞毒作用。Hoechst 33342在凋亡细胞中的荧光强度要比正常细胞中要高。 DAPI为半通透性,用于常规固定细胞的染色。 PI和Hoechst33342双标:PI、Hoechst33342均可与细胞核DNA(或RNA)结合。但PI不能通过正常细胞膜,Hoechst则为膜通透性荧光染料,故细胞在处于坏死或晚期调
亡时细胞膜被破坏,这时可为PI着红色。正常细胞和中早期调亡细胞均可被Hoechst着色,但是正常细胞核的Hoechst着色的形态呈圆形,淡兰色,内有较深的兰色颗粒;而调亡细胞的核由于浓集而呈亮兰色,或核呈分叶,碎片状,边集。故PI着色为坏死细胞;亮兰色,或核呈分叶状,边集的Hoechst着色的为调亡细胞。 凋亡细胞体积变小,细胞质浓缩。细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 3 透射电子显微镜观察 凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 二、磷脂酰丝氨酸外翻分析(Annexin V法) 磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜内侧,但在细胞凋亡早期,PS可从细胞膜内侧翻转到细胞膜表面,暴露在细胞外环境中。磷脂酰丝氨酸的转位发生在凋亡早期阶段,先于细胞核的改变、DNA断裂、细胞膜起泡。体内的吞噬细胞可通过识别
凯基TUNEL细胞凋亡原位检测试剂盒
凯基TUNEL细胞凋亡原位检测试剂盒(通用)(BIOTIN标记POD法,适用于细胞、组织样本) 使用说明书 一、TUNEL制品说明 凯基TUNEL细胞凋亡检测试剂盒是用来检测细胞在凋亡过程中细胞核DNA 的断裂情况,其原理是生物素(biotin)标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂的DNA的3‘-OH末端,并可与连接了的辣根过氧化酶的链霉亲和素(Streptavidin-HRP)特异结合,在辣根过氧化酶底物二氨基联苯胺(DAB)的存在下,产生很强的颜色反应(呈深棕色),特异准确地定位正在凋亡的细胞,因而在普通显微镜下即可观察和计数凋亡细胞;由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH 形成,很少能够被染色。 本试剂盒适用于组织样本(石蜡包埋、冰冻和超薄切片)和细胞样本(细胞涂片)的凋亡原位检测。 本试剂盒特点 ●操作简便:使用Ready-to-Use型试剂,并配有Proteinase K 和DAB。 ●高灵敏度:可以单一检出初期的凋亡细胞。 ●高特异性:能特异性染色凋亡细胞。 ●快速操作:整体操作约需3小时。 ●用途广泛:可应用于组织切片、细胞样本等。 ●方便观察:使用光学显微镜观察实验结果。 ●高正确性:有阳性对照片的制备方法,可以确认试剂盒的有效性
使用注意事项 1.使用前请认真阅读本说明书,提前准备好相关试剂。 2.因本试剂盒中组分均为微量,使用前请离心集液。 3.为避免试验误差、降低试剂的损耗,建议使用精密度高的进口微量移液枪及枪头。 4. TdT 酶反应液最好在使用前根椐样本数量集中配制,再分别滴加于各样本片上,避免每个样本单独配制而产生的试剂损耗。 5. 为防止样本脱落,请使用硅烷(Silane)处理的载玻片或采用多聚赖氨酸铺片。 6. 固定好的样本可以在-20℃的70%乙醇中放置30分钟或至过夜,以改善细胞的渗透性。 7. 使用PBS清洗细胞样本时,不要直接加在细胞样本上,以防止细胞样本的脱落。 8. 进行PBS清洗时,以5分钟清洗3次为标准。 9. DAB为固体粉末,使用前加入PBS配制成20×DAB(10 mg/ml)后,按说明书显色使用。 二、TUNEL试剂盒组分 试剂盒以外自备仪器和试剂
invitrogen AnnexinV PI双染试剂盒说明书中文
流式细胞仪 1,使用特定的方法诱导细胞凋亡,设置一个没有处理的control组 2,在一定孵育期后收获细胞,用冰冷的PBS清洗 3,准备1X的annexin结合液,例如,对于10个实验来说,加1ml 5X annexin 结合液(组分C)到4ml 去离子水中 4,准备一个100ug/ml的PI工作液,例如,通过稀释5ul 1mg/ml的PI储存液(组分B)到45ul 1X annexin 结合液中。没有使用的这部分工作液用于以后的实验。 5,再次离心2步骤中洗过的细胞,弃上清用1X annexin 结合液重悬。调整细胞密度,用1X的annexin 结合液稀释到大约1x106/ml,为每个实验准备100ul 足够的体积。 6,加5ul Alexa Fluor 488 annexin V(组分A)和1ul 100ug/ml PI工作液(4步骤中准备的)到每100ul的细胞悬液中。 7,室温孵育细胞15min. 显微镜观察 1,使用特定的方法诱导细胞凋亡,设置一个没有处理的control组 2,在一定孵育期后收获细胞,用冰冷的PBS清洗 3,准备1X的annexin结合液,例如,配置1ml,加200ul 5X annexin 结合液(组分C)到800ul去离子水中 4,准备一个100ug/ml的PI工作液,例如,通过稀释5ul 1mg/ml的PI储存液(组分B)到45ul 1X annexin 结合液中。没有使用的这部分工作液用于以后的实验。 5,再次离心2步骤中洗过的细胞,弃上清用1X annexin 结合液重悬。调整细胞密度,用1X的annexin 结合液稀释到大约1x106/ml,为每个实验准备足够的体积。 6,加5-25ul的annexin V缀合物(组分A)和1-2ul(100ug/ml)PI工作液到100ul 的细胞悬液中。高浓度的annexinV缀合物会产生较好的结果;最佳染色浓度需要凭借经验 7,室温孵育细胞15min 8,1X annexin 结合液清洗细胞 9,用一个合适方法使细胞固定在载玻片上,用一个适当的滤镜观察荧光效果。 细胞应该被分成3组:活细胞,凋亡细胞和死细胞。活细胞在细胞膜上有微弱的annexin V染色,而凋亡细胞在膜上有一个显著亮度,死亡细胞在膜上有annexin染色和核上的PI染色。
实验14-细胞凋亡的诱导和检测
实验14 细胞凋亡的诱导和检测 20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞容物溢出,细胞坏死常引起炎症反应。 细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。细胞凋亡时的生化变化特征是核酸切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。 1.细胞凋亡的检测方法 凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征: (1)DAPI时常用的一种与DNA结合的荧光染料。借助于DAPI染色,可以观察细胞核的形态变化。 (2)Giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。 (3)吖啶橙(AO)染色,荧光显微镜观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。凋亡细胞核染色质呈黄绿色浓聚在核膜侧,可见细胞膜呈泡状膨出及凋亡小体。 (4)吖啶橙(A())/溴化乙啶(EB)复染可以更可靠地确定凋亡细胞的变化,AO只进入活细胞,正常细胞及处于凋亡早期的细胞核呈现绿色;EB只进入死细胞,将死细胞及凋亡晚期的细胞的核染成橙红色。 (5)台盼蓝染色对反映细胞膜的完整性,区别坏死细胞有一定的帮助,如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。使用透射电镜观察,可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。 (6)木精-伊红(HE)染色是经典的显示细胞核、细胞质的染色方法,染色结果清晰。发生凋亡的细胞经HE染色后,其细胞大小的变化及特征性细胞核的变化:染色质凝集、呈新月形或块状靠近核膜边缘,晚期核裂解、细胞膜包裹着核碎片“出芽”凸出于细胞表面形成凋亡小体等均可明显显示出来。 DNA凝胶电泳:细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞小分子 质量DNA片段增加,高分子DNA减少,胞质出现DNA片段。但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180~200 bp DNA片段,而坏死细胞的DNA断裂点为无特征的杂乱片段,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
碧云天 细胞凋亡-一步法TUNEL检测试剂盒
一步法TUNEL细胞凋亡检测试剂盒 产品简介: 碧云天生产的一步法TUNEL细胞凋亡检测试剂盒(One Step TUNEL Apoptosis Assay Kit)为您提供了一种高灵敏度又快速简便的细胞凋亡检测方法。对于经过固定和洗涤的细胞或组织,只要经过一步染色反应,洗涤后就可以通过荧光显微镜或流式细胞仪检测到呈现绿色荧光的凋亡细胞。 细胞在发生凋亡时,会激活一些DNA内切酶,这些内切酶会切断核小体间的基因组DNA。细胞凋亡时抽提DNA进行电泳检测,可以发现180-200bp的DNA ladder。基因组DNA断裂时,暴露的3’-OH可以在末端脱氧核苷酸转移酶(Terminal Deoxynucleotidyl Transferase, TdT)的催化下加上绿色荧光探针荧光素(FITC)标记的dUTP(fluorescein-dUTP),从而可以通过荧光显微镜或流式细胞仪进行检测,这就是TUNEL(T dT-mediated d U TP N ick-E nd L abeling)法检测细胞凋亡的原理。 注:FITC是fluorescein isothiocyanate的缩写,实际上大多数情况下所谓的FITC即为fluorescein。 本试剂盒有如下优点。(1) 高灵敏度:可以在单细胞水平检测到细胞凋亡,同时由于凋亡早期就有DNA断裂,可以检测到早期的细胞凋亡。(2) 特异性:TUNEL检测时通常更容易标记凋亡细胞,而不容易标记坏死细胞。(3) 快速:仅需约1-2个小时即可完成。(4) 方便:只需一步染色反应,洗涤后即可观察,不必使用二抗等进行多步操作。(5) 应用范围广:可以用于检测冷冻或石蜡切片中的细胞凋亡情况,也可以检测培养的贴壁细胞或悬浮细胞的凋亡情况。 TUNEL法特异性检测细胞凋亡时产生的DNA断裂,但不会检测出射线等诱导的DNA断裂(和细胞凋亡时的断裂方式不同)。这样一方面可以把凋亡和坏死区分开,另一方面也不会把射线等诱导发生DNA断裂的非凋亡细胞判断为凋亡细胞。 极少数细胞凋亡时没有DNA断裂,此时不适用TUNEL法检测。在个别类型的坏死细胞中也发现TUNEL检测呈阳性。在需要严格判断细胞凋亡的情况下,最好同时检测多个凋亡指标。 本试剂盒足够检测20个样品。 保存条件: -20℃保存,荧光标记液需避光保存。 注意事项: 需自备用于洗涤细胞的PBS或HBSS,用于封片的抗荧光淬灭封片液(P0126),用于固定的4%多聚甲醛或向碧云天订购免疫染色固定液(P0098),同时需自备含0.1% Triton X-100的PBS或向碧云天订购免疫染色洗涤液(P0106)。 如果用于石蜡切片的检测,需自备蛋白酶K,二甲苯。蛋白酶K(ST533)可以向碧云天订购。 为了您的安全和健康,请穿实验服并戴一次性手套操作。 使用说明: 1.对于贴壁细胞或细胞涂片: a.PBS或HBSS洗涤一次。 b.如果细胞贴得不牢,可以干燥样品使细胞贴得更牢。 c.用4%多聚甲醛或碧云天生产的免疫染色固定液(P0098)固定细胞30-60分钟。 d.用PBS或HBSS洗涤一次。 e.加入含0.1% Triton X-100的PBS或碧云天生产的免疫染色洗涤液(P0106),冰浴孵育2分钟。 f.转步骤5。 2.对于悬浮细胞或细胞悬液: a.收集细胞(不超过200万细胞),PBS或HBSS洗涤一次。 b.用4%多聚甲醛或碧云天生产的免疫染色固定液(P0098)固定细胞30-60分钟。为防止细胞聚集成团,宜在侧摆摇床或 水平摇床上缓慢摇动的同时进行固定。 c.用PBS或HBSS洗涤一次。
细胞凋亡试剂盒(FITC)
凯基Annexin V-FITC细胞凋亡检测试剂盒 (Annexin V-FITC Apoptosis Detection Kit) Cat number:KGA For Research Use Only Store at4℃for one year Expire date: 一、试剂盒说明 在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V 被作为检测细胞早期凋亡的灵敏指标之一。将Annexin V进行荧光素(EGFP、FITC)标记,以标记了的Annexin V作为荧光探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。 碘化丙啶(Propidium Iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。因此将Annexin V与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。 本试剂盒可应用于培养细胞凋亡检测(不推荐用于检测组织样本)。 二、试剂盒组份 组份Cat: KGA105 (10 assays) Cat: KGA106 (20 assays) Cat: KGA107 (50 assays) Cat: KGA108 (100 assays) 储存条件 AnnexinV-FITC 50μL 100μL 250μL 500μL 4℃避光 Propidium Iodide 50μL 100μL 250μL 500μL 4℃避光 Binding Buffer 5 mL 10.0 mL 25 mL 50 mL 4℃ 三、试剂盒以外自备仪器和试剂 流式细胞仪或荧光显微镜、低速离心机、微量移液器 1.5m L Microtube、载玻片、盖玻片(荧光显微镜观察需用)、PBS、不含EDTA的胰酶消化液 四、使用注意事项 1.微量试剂取用前请离心集液。 2.Annexin V-FITC,Propidium Iodide (PI)避光保存及使用。 3.Propidium Iodide (PI)有毒,操作时要戴手套。 4.本试剂盒适用于检测活细胞,流式细胞仪检测时,细胞数量不以应低于1×105,,不推荐用于检测组织样本。 5.推荐使用悬浮培养细胞。如果是贴壁细胞,需用不含EDTA的胰酶消化,如消化不当,可能引起假阳性,而用细胞刮子会造成细胞粘连成团,而影响检测。可将胰酶消化后细胞的保存在含2%BSA 的PBS中,防止进一步的损伤。 6.细胞固定后可能导致荧光的淬灭,请不要固定样品。 7.因检测细胞的类型、凋亡诱导剂种类、使用的检测仪器不同,因而流式检测的荧光补偿也不同,因此建议每次检测均需使用未经凋亡诱导处理的细胞作为对照,进行荧光补偿的调节。 五、操作方法 1.悬浮细胞离心(2000rpm离心5min)收集;贴壁细胞用不含EDTA的胰酶消化收集(注:胰酶消化时间不易过长,否则容易引起假阳性); 2.用PBS洗涤细胞二次(2000rpm离心5min)收集1~5×105细胞;
运动与细胞凋亡
第27卷 第1期北京体育大学学报V ol.27 N o.1 2004年1月Journal of Beijing S port University Jan.2004 运动与细胞凋亡 汤长发,周 婕 (湖南师范大学体育学院,湖南长沙 410012) 摘 要:细胞凋亡的研究是运动科学中一个较新的领域。近年来,运动领域的科学工作者对运动与骨骼肌细 胞、心肌细胞、淋巴细胞、肝细胞凋亡关系进行了研究,并对运动引发细胞凋亡的机制进行了探讨,但研究结 果有一定的差异,关于运动与细胞凋亡的关系还需要更深层次的研究。 关键词:运动;细胞凋亡;骨骼肌细胞;淋巴细胞;心肌细胞;肝细胞 中图分类号:G804.23 文献标识码:B 文章编号:1007-3612(2004)01-0068-03 Exercise and Apoptosis T ANG Chang2fa,ZH OU Jie (Institute of Physical Education,Hunan N ormal University,Changsha410012,Hunan China) Abstract:The research on apoptosis is a new area in exercise science.In recent years,exercise scientists have studied the relationship between exercise and a poptosis occurred in the skeletal my ocyte,cardiac my ocyte,lym phocyte and hepato2 cyte,as well as the mechanism of the exercise-induced apoptosis.There are s ome divergences in those results,s o m ore w ork need to be done in this area. K ey w ords:exercise;apoptosis;skeletal my ocyte;cardiac my ocyte;lym phocyte;hepatocyte 细胞凋亡是细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程,最后细胞脱落离体或裂解为若干凋亡小体,被其他细胞吞噬。自1972年病理学家K err等提出细胞凋亡的概念以来,人们对这一生物学现象进行了大量的研究,从细胞凋亡的形态特征,细胞凋亡的发生机制,到细胞凋亡在发育、免疫、衰老、损伤修复等生理过程中的作用,以及细胞凋亡与各种临床疾病的关系,细胞凋亡成为了生命科学和医学中的研究热点。而细胞凋亡的研究在体育科学中起步较晚,目前有关运动状态下细胞凋亡的情况,以及运动对细胞凋亡的影响的报道在国内外都比较少,运动与细胞凋亡的关系还需要大量的研究来进行更深层次的探讨。 1 细胞凋亡的特征 细胞凋亡是一个主动的细胞死亡过程,它与细胞坏死这种被动过程在形态特征和生化特征方面都有本质的区别。 首先从形态特征而言,坏死细胞先是膜通透性增加,细胞外形发生不规则变化,内质网扩张,核染色质不规则位移,进而线粒体及核肿胀,溶酶体破坏,细胞膜破裂,细胞浆的内容物外溢,引起严重的炎症反应,坏死的细胞常常是成群的细胞一起丢失。而凋亡细胞的特征是细胞体积缩小,随即与邻近细胞的连接丧失,彼此脱离,失去微绒毛,胞浆浓缩,内质网扩张呈泡状并与细胞膜融合,线粒体无大变化,核染色质浓缩呈半月形,染色质凝聚靠近于核膜周边,核仁裂解,进而细胞膜内陷将细胞自行分割为多个具有完整膜性结构,内含各种细胞成分的凋亡小体。细胞凋亡的过程不导致溶酶体破裂,没有细胞内容物外泄,故不引起炎症反应。 细胞凋亡最具代表性的生化特征是,细胞核内DNA被核酸内切酶降解为180~220bp整数倍大小的片段,在琼脂糖凝胶电泳上呈现DNA梯形带。而细胞坏死时,DNA被随机降解为任意长度的片段。但有些细胞凋亡时,DNA并不降解,表明DNA降解并不是细胞凋亡必不可少的内容。而细胞凋亡的另一生化特征是,凋亡往往需要新的基因转录和蛋白质合成,是一个耗能的过程,因此某些蛋白质的合成和增加可以用来检测细胞凋亡的发生[1]。 2 运动引发细胞调亡的机制 凋亡产生的机制至今尚未完全清楚,它既受到细胞外信号的调控,同时受到细胞内酶活性的诱导,现已发现大约30多种分子参与细胞凋亡的调控,另外至少有20种左右的分子参与细胞凋亡的信号转导,DNA复制、转录与修复,也参与影响和调节细胞凋亡的发生和发展。 这其中基因的调控起着关键的作用,有些基因表达蛋白质启动细胞凋亡(如Bax,Fas,p53等),有些则表达蛋白质抑制凋亡(如Bcl-2,Bcl-X L),而细胞最终的结果是生存还是死亡,则取决于不同基因表达的比例。比如,如果Bcl-2表达的水平高于Bax,那么细胞可以存活,反之则死亡。现已有多项研究都发现Bcl-2和Bax与运动诱导的细胞凋亡相关。而Adam opoulos等(2002)[3]在对慢性心衰病人(CHF)的研究中发现,经过12周的运动训练,CHF病人的最大吸氧量提高了,而介导细胞凋亡的可溶性Fas和Fas L水平下降了,这种结果显示训练可以提高CHF病人的耐受力。而在正常人中则没有观测到Fas和Fas L水平下降。金其贯[2]的研究发现,大鼠力 投稿日期:2003-03-06 作者简介:汤长发(1962-),男,湖南邵东人,硕士,副教授,研究方向体育锻炼与青少儿体质。
