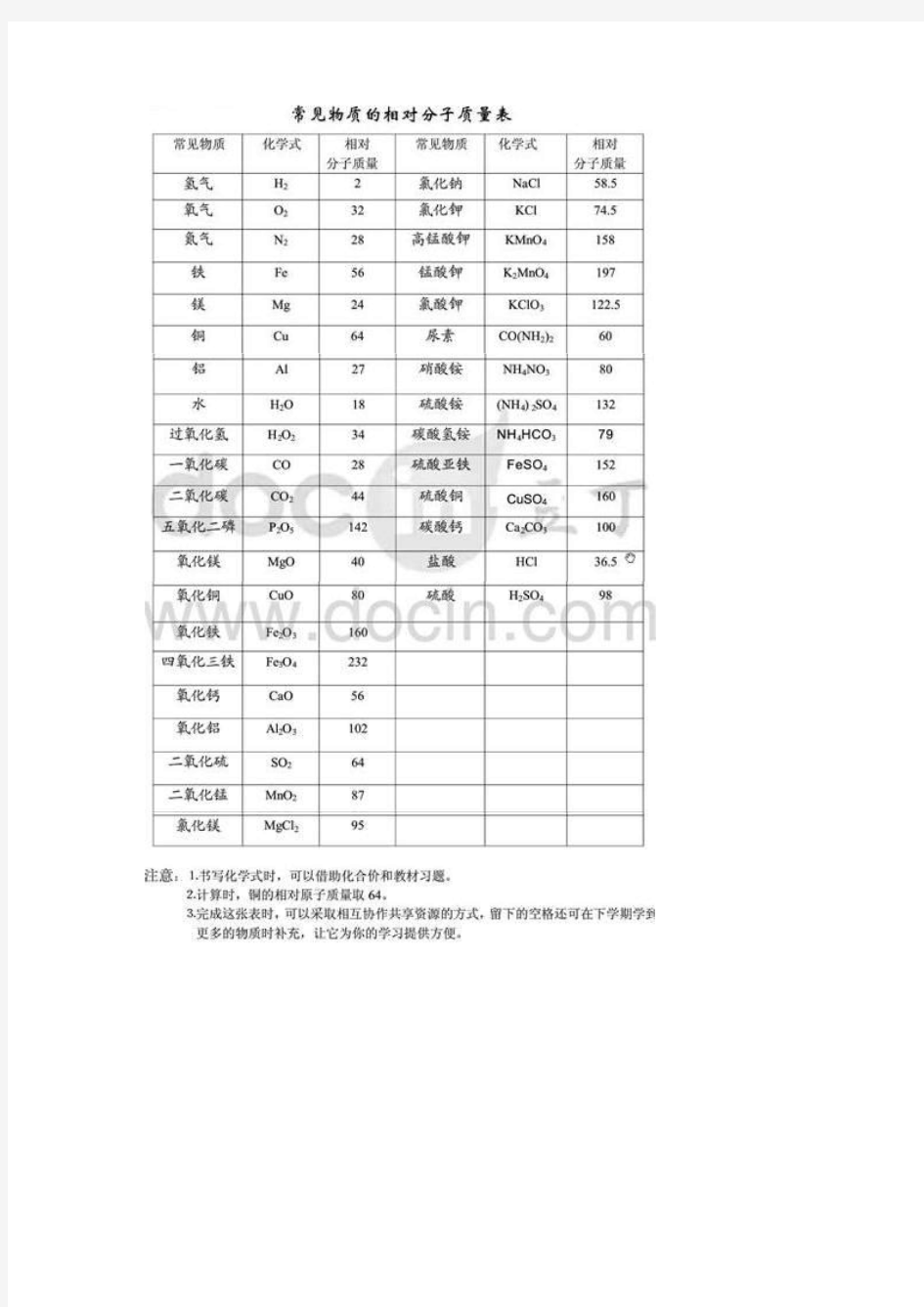
我的常见物质的相对分子质量表
高中化学中常见物质的相对分子质量
高中化学中常见物质的相对分子质量 注:下划线的建议记下来(计算题经常要用到)。 Na 2O 62 Na 2 O 2 78 NaOH 40 NaCl 58.5 Na 2 CO 3 106 NaHCO 3 84 Na 2 S 78 Na 2SO 4 142 NaNO 3 85 NaClO 74.5 KOH 56 KCl 74.5 K 2CO 3 138 KHCO 3 100 K 2 SO 4 174 KNO 3 101 MgO 40 Mg(OH) 2 58 MgCl 2 95 MgCO 3 84 MgSO 4 120 CaO 56 Ca(OH) 2 74 CaCl 2 111 CaCO 3 100 Ca(HCO 3 ) 2 162 CaSO 4 136 Ca(ClO) 2 143 Ba(OH) 2 171 BaCl 2 208 BaCO 3 197 BaSO 4 233 Ba(NO 3 ) 2 164 Al 2O 3 102 Al(OH) 3 78 AlCl 3 133.5 Al 2 (SO 4 ) 3 342 KAl(SO 4 ) 2 ·12H 2 O 474 NaAlO 2 82 SiO 2 60 H 2 SiO 3 78 Na 2 SiO 3 122 SiCl 4 170 NH 3 17 N 2 H 4 32 NO 30 NO 2 46 HNO 3 63 NH 4 Cl 53.5 (NH 4 ) 2 CO 3 94 NH 4 HCO 3 79 (NH 4) 2 SO 4 132 NH 4 NO 3 80 CO(NH 2 ) 2 (尿素)60 P 2O 5 142 H 3 PO 4 98 Na 3 PO 4 164 Ca 3 (PO 4 ) 2 310 H 2O 18 H 2 O 2 34 H 2S 34 SO 2 64 SO 3 80 H 2 SO 4 98 HF 20 CaF 2 78 HCl 36.5 HClO 52.5 HBr 81 HI 128 MnO 2 87 KMnO 4 158 K 2 Cr 2 O 7 294 FeO 72 Fe 2O 3 160 Fe 3 O 4 232 Fe(OH) 3 107 FeCl 2 127 FeCl 3 162.5 FeS 88 FeS 2 120 FeSO 4 152 Fe 2 (SO 4 ) 3 400 CuO 80 Cu 2O 144 Cu(OH) 2 98 CuCl 2 135 CuS 96 Cu 2 S 160 CuSO 4 160 CuSO 4·5H 2 O 250 Cu(NO 3 ) 2 188 AgCl 143.5 AgBr 188 AgI 235 Ag 2SO 4 312 Ag 2 CO 3 276
常用相对分子质量
相对分子质量: 氢H 1 氩 Ar 40 碳C 12 钙 Ca 40 氮N 14 锰 Mn 55 氧O 16 铁 Fe 56 氟F 19 铜 Cu 64 氖Ne 20 锌 Zn 65 钠Na 23 银 Ag 108 镁Mg 24 碘 I 127 铝Al 27 钡 Ba 137 硅Si 28 钨 W 184 磷P 31 铂 Pt 195 硫S 32 金 Au 197 氯Cl 35.5 汞 Hg 201 钾 K 39 铅 Pb 207 氢气H2 2 氨气NH3 17 氮气N228 氧气O232 一氧化碳 CO 28 二氧化碳 CO244 一氧化硫 SO 48 二氧化硫 SO264 三氧化硫 SO380 二氧化锰 MnO2 87 二氧化硅 SiO2 60 一氧化氮 NO 30 二氧化氮 NO 246 三氧化钨 WO3232 二硫化碳 CS2 76 二硫化亚铁FeS2 120 五氧化二磷P2O5142 氧化铁Fe2O3 160 氧化亚铁FeO 82 四氧化三铁Fe3O4 232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO 40 氧化钙CaO 56 氧化铝Al2O3102 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223 氧化锌ZnO 81 过氧化氢H2O234 氯气Cl271 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl295 氯化钙CaCl2111 氯化铜CuCl2135 氯化锌ZnCl2136 氯化钡BaCl2208 氯化铝AlCl3133.5 氯化铁FeCl3162.5 氯化亚铁FeCl2127 氯化银AgCl 143.5 氯化氢HCl 36.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5 硫酸H2SO498 硫酸锌ZnSO4161 硫酸铵(NH4)2SO4132 硫酸铜CuSO4160 硫酸钡BaSO4233 硫酸钙CaSO4136 硫酸钾KSO4135 硫酸钠Na2SO4142 硫酸镁MgSO4120 硫酸铁Fe2(SO4)3 400
相对原子质量表
相对原子质量表 ——(1-56H-Ba)—— 原子序数元素名称元素符号相对原子质量1氢H1 2氦He4 3锂Li7 4铍Be9 5硼B10.8 6碳C12 7氮N14 8氧O16 9氟F19 10氖Ne20 11钠Na23 12镁Mg24.3 13铝Al27 14硅Si28 15磷P31 16硫S32
17氯Cl35.4 18氩Ar40 19钾K39 20钙Ca40 21钪Sc50 22钛Ti47.8 23钒V51 24铬Cr52 25锰Mn55 26铁Fe55.8 27钴Co59 28镍Ni58.6 29铜Cu63.5 30锌Zn65.4 31镓Ga69.7 32锗Ge72.6 33砷As75 34硒Se79 35溴Br80 36氪Kr83.798(2) 37铷Rb85.4678(3) 38锶Sr87.62(1)
40锆Zr91.224(2) 41铌Nb92.90638(2) 42钼Mo95.94(2) 43锝Tc[97.9072] 44钌Ru101.07(2) 45铑Rh102.90550(2) 46钯Pd106.42(1) 47银Ag107.8 48镉Cd112.411(8) 49铟In114.818(3) 50锡Sn118.7 51锑Sb121.760(1) 52碲Te127.60(3) 53碘I127 54氙Xe131.293(6) 55铯Cs132.9054519(2) 56钡Ba137.3——(57-71La-Lu镧系)—— 原子序数元素名称元素符号相对原子质量57镧La138.90547(7) 58铈Ce140.116(1) 59镨Pr140.90765(2)
元素相对原子质量表
原子序数元素名称元素符号相对原子质量 1 氢 H 1.007 94(7) 2 氦 He 4.002 602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012 182(3) 5 硼 B 10.811(7) 6 碳 C 12.017(8) 7 氮 N 14.006 7(2) 8 氧 O 15.999 4(3) 9 氟 F 18.998 403 2(5) 10 氖 Ne 20.179 7(6) 11 钠 Na 22.989 769 28(2) 12 镁 Mg 24.305 0(6) 13 铝 Al 26.981 538 6(8) 14 硅 Si 28.085 5(3) 15 磷 P 30.973 762(2) 16 硫 S 32.065(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.098 3(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955 912(6) 22 钛 Ti 47.867(1) 23 钒 V 50.941 5(1) 24 铬 Cr 51.996 1(6) 25 锰 Mn 54.938 045(5) 26 铁 Fe 55.845(2) 27 钴 Co 58.933 195(5) 28 镍 Ni 58.693 4(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1) 32 锗 Ge 72.64(1) 33 砷 As 74.921 60(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.467 8(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.905 85(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.906 38(2) 42 钼 Mo 95.94(2) 43 锝 Tc [97.9072]
物体的质量
6.1物体的质量 一、教材分析 本节内容主要包括质量的初步概念、单位;常用托盘天平的正确使用方法。由于质量是学生认识各种物质的基本物理量之一,天平的正确使用又是最基本的实验技能,因此本节内容比较重要。 二、教学目标 (1) 初步认识质量的概念,知道质量的单位及换算。 (2) 会正确使用托盘天平称质量。 (3) 对常见物体的质量形成较为具体的数量级观念。 (4)通过对托盘天平的调节和使用,培养学生认真操作、自觉遵守操作规范的良好习惯。感受测量是认识物理世界的重要方法。 三、教学重难点 重点:(1)理解质量的含义。(2)会正确地使用托盘天平测物体的质量。 难点:(1)对质量单位的感性认识。(2)正确使用天平测物体的质量。 四、教法分析 质量对学生来讲是一个常接触的问题,理解起来比较容易,但是,由于学生的实践较少,对于质量单位缺乏感性认识,1kg到底有多少,缺乏经验。因此上课时要多举几个生活中常见1kg的例子,增加学生的感性认识。另外天平的操作动手能力要求较高,学生熟练使用比较困难,多练习几遍才能掌握。 五、教学过程设计 教学设计理念:创设物理情景,激发学生兴趣,调动学生的积极性,从而主动的参与到学习活动中来,相互交流、合作学习。 1.首先让学生区分“物体”和“物质”。通过创设问题情景:“铁钉和铁锤都是由铁组成的,为什么铁锤比铁钉重?” 让学生讨论明白物体是由物质组成的。其次引入质量的概念,铁锤比铁钉重,是它们含有铁的量不同,引导学生明白不同物体所含物质的多少有差别,为了比较物体所含物质的多少,引入质量的概念。
2.质量是物体的一种属性。再次创设问题情景,准备一块橡胶泥,让学生捏成各种形状。问这块橡胶泥所含物质的多少是否发生了变化,质量是否发生了变化?将一个冰块在容器里化成水后质量会如何变化?师生讨论得出结论:质量不变。进而说明物体的质量与物体的形状、状态、和所处的位置变化无关。所以物体的质量是物体本身的一种属性。 思考题:如果将这块橡胶泥带到月球,它的质量如何? 3.质量的单位及换算。通过类比的方法引出质量的单位。大家知道比较两个同学的身高,首先要确定长度的单位。那么,比较质量的大小,就要确定质量的单位。质量的国际单位是kg。其次使学生获得感性认识。1kg的物质有多少呢?20个普通鸡蛋的质量约为1kg,两瓶中等容积的矿泉水的质量约为1kg。再组织学生阅读“科学窗”关于千克原器的介绍,进一步理解1kg的含义。最后介绍常用的质量单位以及各单位之间的关系,让学生阅读表格“一些物体的质量的近似值”,使学生感知物体质量的数量级,培养学生的判断能力。并简要介绍我国古代劳动人民发明的测量根据——杆秤,激发学生的民族自豪感。 4.天平的正确使用方法。首先学习天平,天平是测量质量的工具,实验室的学生天平是托盘天平。将学生2人一组,配备一架天平,组织学生对照教材天平结构图,弄清天平结构。认识天平结构时,要注意观察方法:从下向上依次进行。托盘天平的正确使用是本节的重点和难点,为突破难点,老师要分步示范天平的调节和使用方法。先练习调节方法:放平、调零。再练习称量的方法:左物体右砝码,轻拨游码,物体质量砝码质量数标尺读数。
相对分子质量
相对分子质量目录
编辑本段计算题 一、求相对分子质量 格式为: 解: XXX的相对分子质量=各元素数量*各元素相对原子质量=结果 初三考生要注意这里一律以元素为单位分开计算,不能以原子团为单位整体计算,否则是没有分的。 例题 例1:计算H2O的相对分子质量。 解:H2O的相对分子质量=1×2+16×1=18 注意这里与摩尔质量不同,不可写为M(H2O) 例2:计算H2SO4的相对分子质量。 解:H2SO4的相对分子质量=1×2+32+16×4=98 二、计算组成物质的各元素的质量比 格式为: XXX中X元素与X元素质量比=(X原子个数*X相对原子质量):(X原子个数*X相对原子质量) 例1:求二氧化碳碳氧元素质量比 CO2中碳元素和氧元素的质量比=12:(16×2)=3:8 三、计算物质中某元素的质量分数 格式为:某元素的质量分数=(该元素分子的相对原子质量×原子个数)/(相对分子质量)×100% 这里要注意写上100%,否则公式错误,考试时公式分扣除。 例:有MgO与MgSO4两种物质的混合物,已知镁的质量分数为33%,求氧化镁质量分数 解:设MgO质量分数X ( X·Mg + ( 1 - X )·Mg ) / ( X·MgO + ( 1 - X )·MgSO4 )=33% 解出X即为氧化镁质量分数 编辑本段计量 原子的质量计量一样,分子的质量计量也先后存在3个量名称:相对分子质量、分子质量和分子量。众所周知,分子的质量为组成分子的各原子的质量之和。在日常专业工作中,不论是单质还是化合物,它们的分子
质量都是根据各元素原子的个数和各元素的“相对原子质量”(由元素周期表上查到)计算得到。既然元素的相对原子质量是一个单位为“1”的相对质量,那么由此计算得到的分子质量必然也是一个单位为“1”的相对质量。对于某些结构复杂的生物大分子,往往都是通过电泳、离心或色谱分析等方法测得其近似分子质量,因而更是一个相对概念的量值。所以,我们过去长期习惯使用着的“分子量”实际上都是相对的分子质量。因此,国标指出“以前称为分子量”的即是“相对分子质 量”(relativemolecularmass),并将后者定义为“物质的分子或特定单元的平均质量与核素12C原子质量的1/12之比”。相对分子质量是两个质量之比,也在计算表达形式上进一步明确了“相对”的含义。对于定义中的“特定单元”,主要是指空气等组成成分基本不变的特殊混合物,它们的相对质量可根据其组成成分(N2,O2,CO2,Ar等)的相对分子质量和其在空气中的体积分数计算其平均质量,然后与12C原子质量的1/12相比即可获得。相对分子质量的量符号为Mr.,单位为“1”。 常用的相对分子质量 参考元素周期表 元素周期表 编辑本段1 .酸类 盐酸HCl = 1+ 硝酸HNO3 63 = 1+14+16*3 碳酸H2CO3 62 硫酸H2SO4 98 磷酸H3PO4 98 编辑本段2
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5142 氧气O232 氢氧化钙(熟石灰)Ca(OH)274 氯气Cl271 氢氧化铜Cu(OH)298 氨气NH317 氢氧化钠NaOH 40 氮气N228 过氧化氢(双氧水)H2O234 一氧化碳CO 28 碱式碳酸铜(绿)Cu2(OH)2CO3222 二氧化碳CO244 盐酸(氯化氢)HCl 36.5 一氧化硫SO 48 氯化钙CaCl2111 二氧化硫SO264 氯化钾KCl 74.5 三氧化硫SO380 氯化铁(淡黄 FeCl3162.5 溶) 二氧化锰MnO287 氯酸钾KClO3122.5 碳酸H2CO362 高锰酸钾(灰锰氧)KMnO4158 碳酸钙CaCO3100 硫酸铜(白固蓝 CuSO4160 溶) 碳酸氢铵NH4HCO379 硫酸钠Na2SO4142 硝酸HNO363 硝酸铵NH4NO380 硫酸H2SO498 甲烷CH416 亚硫酸H2SO382 尿素CO(NH2)260 磷酸H3PO498 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H226 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO 72
硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
初中常用相对分子质量及计算公式
氢 气 H 2 2 五氧化二磷 P 2O 5 142 氧 气 O 2 32 氢氧化钙(熟石灰) Ca(OH)2 74 氯 气 Cl 2 71 氢氧化铜 Cu(OH)2 98 氨 气 NH 3 17 氢氧化钠 NaOH 40 氮 气 N 2 28 过氧化氢(双氧水) H 2O 2 34 一氧化碳 CO 28 碱式碳酸铜(绿) Cu 2(OH)2CO 3 222 二氧化碳 CO 2 44 盐酸(氯化氢) HCl 36.5 一氧化硫 SO 48 氯化钙 CaCl 2 111 二氧化硫 SO 2 64 氯化钾 KCl 74.5 三氧化硫 SO 3 80 氯化铁(淡黄溶) FeCl 3 162.5 二氧化锰 MnO 2 87 氯酸钾 KClO 3 122.5 碳 酸 H 2CO 3 62 高锰酸钾(灰锰氧) KMnO 4 158 碳酸钙 CaCO 3 100 硫酸铜(白固 蓝溶) CuSO 4 160 碳酸氢铵 NH 4HCO 3 79 硫酸钠 Na 2SO 4 142 硝 酸 HNO 3 63 硝酸铵 NH 4NO 3 80 硫 酸 H 2SO 4 98 甲 烷 CH 4 16 亚硫酸 H 2SO 3 82 尿 素 CO(NH 2)2 60 磷 酸 H 3PO 4 98 甲 醇 CH 3OH 32 水 H 2O 18 乙醇(酒精) C 2H 5OH 46
氧化铜(黑)CuO 80 乙炔C H226 2 氧化镁(白)MgO 40 乙酸(醋酸)CH COOH 60 3 氧化钙(白)CaO 56 四氧化三铁(黑)Fe O4232 3 氧化铁(红)Fe O3160 2 氧化亚铁(黑)FeO 72 硫酸亚铁(淡绿)FeSO 152 4 硫酸锌(白/无)ZnSO 161 4 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n
物体的质量
苏科版﹒物理( 八 )年级(下)册 第(六)单元课题:物体的质量 学案 【概念】 一、物体的质量自学课本101-102页相关内容,完成: 1.自然界中的一切物体都是由______组成的,物体所含物质的多少叫做______,质量通常用符号___表示。质量是物质的一种______,它与物体的______、______和____________无关. 2.质量的国际单位是______,符号是____。常用的单位还有_____ ( )、_____( )、______ ( ) 、______( )等,它们的关系是:1t=____Kg;1g=____Kg;1mg=____Kg。 3.一个成年人的质量大约有_______,一只鸡蛋的质量大约有_60_____. 二、物体质量的测量自学课本102-104相关内容,完成: 1.常用的测量质量的工具有______、______,实验室常用___________测物体的质量,使用它时首先要观察它的,也就是它。 2.对照课本图和托盘天平实物,说说托盘天平的构造 3.使用托盘天平称量铝块的质量 (1)放平:将天平放在_________________; (2)调零:将______拨在________________________; (3)调平:调节横梁____________使_______________________; (4)称量:____盘放物体,____盘放砝码,并调节______使横梁再次平衡; (5)记录:m=砝码质量数 + 游码读数=_______+_______=________ (6)整理器材. 4.使用天平时要注意: (1)每个天平都有自己的______,也就是它所能称的最大质量。被测物体的质量______(能,不能)超过称量。(2)向盘中加减砝码时,要用______,不能用手接触砝码,不能把砝码弄湿、弄脏。(3)潮湿的物体和化学药品______ (能,不能)直接放到天平的托盘中。 【当堂导练】 1.关于质量的说法中,正确的是 ( ) A.水结成冰后,质量变大了 B.把铁块加热后,再锻压成铁片,质量变小 C.物理课本在广州和在北京时,质量是一样的 D.1kg的铜块和106mg的铜线的质量并不相等 2.质量相同的木块和铁块相比较 ( ) A.木块的体积较大,所以所含物质较多 B.铁块较重,所以所含物质较多 C.木块和铁块质量相同,所含物质的多少是一样的 D.无法比较其物质含量的多少
常用分子式分子质量
相对分子质量: 氢H 1 氩Ar 40 碳C 12 钙Ca 40 氮N 14 锰Mn 55 氧O 16 铁Fe 56 氟F 19 铜Cu 64 氖Ne 20 锌Zn 65 钠Na 23 银Ag 108 镁Mg 24 碘I 127 铝Al 27 钡Ba 137 硅Si 28 钨W 184 磷P 31 铂Pt 195 硫S 32 金 Au 197 氯Cl 35.5 汞Hg 201 钾K 39 铅Pb 207 氢气H2 2 氨气NH3 17 氮气N2 28 氧气O2 32 一氧化碳CO 28 二氧化碳CO2 44 一氧化硫SO 48 二氧化硫SO2 64 三氧化硫SO3 80 二氧化锰MnO2 87 二氧化硅SiO2 60 一氧化氮NO 30 二氧化氮NO 246
三氧化钨WO3 232 二硫化碳CS2 76 二硫化亚铁FeS2 120 五氧化二磷P2O5 142 氧化铁Fe2O3 160 氧化亚铁FeO 82 四氧化三铁Fe3O4 232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO40 氧化钙CaO 56 氧化铝Al2O3 102 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223 氧化锌ZnO 81 过氧化氢H2O2 34 氯气Cl2 71 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl2 95 氯化钙CaCl2 111 氯化铜CuCl2 135 氯化锌ZnCl2 136 氯化钡BaCl2 208 氯化铝AlCl3 133.5 氯化铁FeCl3 162.5 氯化亚铁FeCl2 127 氯化银AgCl143.5 氯化氢HCl 36.5 氯酸钾KClO3 122.5 氯化铵NH4Cl 53.5 硫酸H2SO4 98 硫酸锌ZnSO4 161 硫酸铵(NH4)2SO4 132 硫酸铜CuSO4 160 硫酸钡BaSO4 233 硫酸钙CaSO4 136 硫酸钾KSO4 135 硫酸钠Na2SO4 142 硫酸镁MgSO4 120 硫酸铁Fe2(SO4)3 400
常用相对分子质量
相对分子质量: 氢 H 1 氩Ar 40 碳 C 12 钙Ca 40 氮 N 14 锰Mn 55 氧 O 16 铁Fe 56 氟 F 19 铜Cu 64 氖 Ne 20 锌Zn 65 钠 Na 23 银Ag 108 镁 Mg 24 碘I 127 铝 Al 27 钡Ba 137 硅 Si 28 钨W 184 磷 P 31 铂Pt 195 硫 S 32 金Au 197 氯 Cl 35.5 汞Hg 201 钾 K 39 铅Pb 207 氢气 H2 2 氨气 NH3 17 氮气 N2 28 氧气 O2 32 一氧化碳CO 28 二氧化碳CO2 44 一氧化硫SO 48 二氧化硫SO2 64 三氧化硫SO3 80 二氧化锰MnO2 87 二氧化硅SiO2 60 一氧化氮NO 30 二氧化氮NO 246 三氧化钨WO3 232 二硫化碳CS2 76 二硫化亚铁 FeS2 120 五氧化二磷 P2O5 142 氧化铁 Fe2O3 160 氧化亚铁 FeO 82 四氧化三铁 Fe3O4 232 氧化铜 CuO 80 氧化亚铜 Cu2O 144 氧化钠 Na2O 62 氧化镁 MgO 40 氧化钙 CaO 56 氧化铝 Al2O3 102 氧化汞 HgO 217 氧化银 Ag2O 232 氧化铅 PbO 223 氧化锌 ZnO 81 过氧化氢H2O2 34 氯气 Cl2 71 氯化钾 KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl2 95 氯化钙CaCl2 111 氯化铜CuCl2 135 氯化锌ZnCl2 136 氯化钡BaCl2 208 氯化铝AlCl3 133.5 氯化铁FeCl3 162.5 氯化亚铁FeCl2 127 氯化银AgCl 143.5 氯化氢HCl 36.5 氯酸钾KClO3 122.5 氯化铵NH4Cl 53.5 硫酸H2SO4 98 硫酸锌ZnSO4 161 硫酸铵 (NH4)2SO4132 硫酸铜CuSO4 160 硫酸钡BaSO4 233 硫酸钙CaSO4 136 硫酸钾KSO4 135 硫酸钠Na2SO4 142 硫酸镁MgSO4 120 硫酸铁Fe2(SO4)3 400 硫酸亚铁FeSO4 152
相对原子质量表模板
相对原子质量表
相对原子质量
物质与氧气的反应: (1)单质与氧气的反应(化合反应): 镁在空气中燃烧:2Mg+O2点燃 2MgO 铁在氧气中燃烧: 3Fe+2O2点燃 Fe3O4 铜在空气中加热: 2Cu+O2△ 2CuO 铝在空气中燃烧: 4Al+3O2点燃 2Al2O3 氢气在空气中燃烧: 2H2+O2点燃 2H2O 红磷在空气中燃烧: 4P+5O2点燃 2P2O5 硫粉在空气中燃烧: S+O2点燃 SO2 碳在空气中燃烧: C+O2点燃 CO2 碳在空气中不充分燃烧: 2C+O2点燃 2CO ( 2) 化合物与氧气的反应: 一氧化碳在氧气中燃烧: 2CO+O2点燃 2CO2(化合反应) 甲烷在空气中燃烧: CH4+2O2点燃 CO2+2H2O 酒精在空气中燃烧: C2H5OH+3O2点燃 2CO2+3H2O 二.几个分解反应: 水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑ 加热高锰酸钾:2KMnO4△ 2MnO4+MnO2+O2↑ 碳酸不稳定分解:H2CO3==H2O+CO2↑ 加热氧化汞: 2HgO △ 2Hg+O2↑ 分解过氧化氢制取氧气: 2H2O2 2H2O+O2↑
高温煅烧石灰石:CaCO3高温 CaO+CO2↑ 三.几个氧化还原反应: 氢气还原氧化铜:H2+CuO △ Cu+H2O 木炭还原氧化铜:C+2CuO 高温 2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3高温 4Fe+3CO2↑ 一氧化碳还原氧化铜:CO+CuO △ Cu+CuO 一氧化碳还原氧化铁:3CO+Fe2O3高温 2Fe+3CO2 四.单质氧化物酸碱盐的相互关系: (1)金属单质+酸==盐+氢气(置换反应) 锌和稀硫酸反应:Zn+H2SO4==ZnSO4+H2↑ 铁和稀硫酸反应:Fe+H2SO4==FeSO4+H2↑ 27镁和稀硫酸反应:Mg+H2SO4==MgSO4+H2↑ 28铝和稀硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑29锌和稀盐酸反应:Zn+2HCl==ZnCl2+H2↑ 30铁和稀盐酸反应:Fe+2HCl==FeCl2+H2↑ 31镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑ 32铝和稀盐酸反应:2Al+6HCl==2AlCl3+3H2↑ (2)金属单质+盐(溶液)==另一种金属+另一种盐 33铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu 34锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu 35铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg
5.1物体的质量教学设计
5.1物体的质量教学 设计 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
教学设计 课题: 5.1 物体的质量(沪粤版) 课题: 5.1 物体的质量 一、教材分析 《课标》要求:知道质量的含义。会测量固体和液体的质量。 质量是物理学的基本概念,是全章的基础。关于“质量”,要求学生对质量的概念有一个初步的认识,让学生懂得质量是反映物体所含物质多少的物理量,物体的质量不随物体的形状和所处空间位置的变化而变化,并让学生对质量单位的大小有感性的认识,培养学生估测常见物体质量的能力。
《课标》要求学生能用测量质量的常用工具去测量固体和液体的质量,是关于基本技能方面的要求,属于独立操作水平,即学生必须学会正确操作与读数。 二、教学目标 1、知识与技能 (1)知道质量的初步概念及单位。知道质量是物体的一种基本属性,它不随着物体的形状、空间位置等的改变而改变。 (2)能对质量单位形成感性认识,会粗略估计常见物体的质量。 (3)会正确使用托盘天平测量固体和液体的质量。 2、过程与方法 (4)经历通过比较物体所含物质的多少建立质量初步概念的过程。 3、情感态度与价值观 (5)在学习使用托盘天平的过程中,培养规范操作的良好习惯和实事求是的科学态度。 三、教学重难点 教学重点:建立质量的概念,对质量单位形成感性认识,学会用天平测量质量。 教学难点:质量的概念和质量是物体的属性比较抽象;托盘天平的使用方法和注意事项比较复杂,学生难以掌握,是本节的教学重点。 四、学情分析
“质量”一词在生活中比较常见,而且在不同的地方其含义也不同,学生可能易混淆。八年级学生好奇、好动、乐于探究,但在操作上容易出现偏差,比如,调节天平平衡时,游码未归零;有的同学可能会习惯性地用手去拨动游码和取放砝码;将物体放在右盘,砝码放在左盘等等。这需要加强规范指导,培养学生良好的探究意识和科学的探究方法。 五、教学方法 通过让学生阅读文本、密切联系生活实际,积极参与探究过程来亲身体验;借助多媒体、实物展示等手段为学生提供直观、感性的认识;采用观察、比较等方法,加强启发、引导,让学生充分讨论和交流,以此完成教学目标的教学。 六、教具准备 教师用:米尺、木板、铁钉、冰块、铁锤、水桶、烧杯、物品包装袋、演示天平等。 学生用:天平和砝码、一元硬币、乒乓球、笔、量筒、酒精等。 七、课型:新授课 八、课时:1课时 九、教学过程设计
初中常用相对分子质量及常用化学计算公式
初中常见分子量总结(根据颜色和可溶性,可以组合分离和除杂题自测) 氢气(无无)H2 2 硝酸HNO363 氧气(无无)O232 硝酸根离子团NO3-62 氨气(刺透)NH317 硝酸铵(白/无)NH4NO380 硝酸银Ag NO3170 水H2O 18 盐酸(氯化氢)HCl 36.5 二氧化碳(无无)CO244 两个氯化氢分子 2 HCl73 氧化钙(生石灰)白CaO 56 氯离子Cl1-35.5 一氧化碳(无无)CO 28 氯化钠(食盐)白NaCl 58.5 氧化镁(白)MgO 40 氯化铁(淡黄溶)FeCl3162.5 氧化铁(红)Fe2O3160 氯化钙(白/无)CaCl2111 氧化铜(黑)CuO 80 氯化钡(白/无)BaCl2208 四氧化三铁(黑)Fe3O4232 氯化银AgCl 143.5 氧化亚铁(黑)FeO 72 二氧化锰(黑)MnO287 二氧化硫(刺透)SO264 硫酸H2SO498 硫酸根离子团SO42-96 碳酸H2CO362 硫酸铜(白固蓝溶)CuSO4160 碳酸根CO32—60 硫酸钠(白/无)Na2SO4142 碳酸钙(白沉酸溶)CaCO3100 硫酸钡(白不溶沉)BaSO4233 碳酸钠(白/无)Na2CO3106 硫酸镁(白/无)MgSO4120 碳酸钡(白沉酸溶)BaCO3197 硫酸亚铁(淡绿)FeSO4152 碳酸氢铵(白/无)NH4HCO379 硫酸锌(白/无)ZnSO4161 碱式碳酸铜(绿)Cu2(OH)2CO3222 五水硫酸铜(蓝固蓝溶)Cu SO4 5H2O 250 ? 氯酸钾KClO3122.5 氢氧化钠NaOH 40 高锰酸钾(灰锰氧)KMnO4158 氢氧化钙(熟石灰微溶)Ca(OH)274 甲烷CH416 氢氧根 OH17 尿素CO(NH 2)260 氢氧化镁(白/无)Mg(OH)258 乙醇(酒精)C2H5OH 46 氢氧化铜(蓝沉酸溶)Cu(OH)298 乙酸(醋酸)CH3COOH 60 氨水NH3 H2O35 蔗糖C6H12O6180 ?
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5 142 氧气O2 32 氢氧化钙(熟石灰a(OH)2 74 氯气Cl2 71 氢氧化铜C U(OH)2 98 氨气NH3 17 氢氧化钠NaOH 40 氮气N2 28 过氧化氢(双氧水)2 34 一氧化碳CO 28 碱式碳酸铜绿)CU2(OH) CO 222 二氧化碳CO2 44 盐酸(氯化氢)HCI 36.5 一氧化硫SO 48 氯化钙CaCl2 111 二氧化硫SO2 64 氯化钾KCl 74.5 三氧化硫SO3 80 氯化铁(淡黄FeCl3 162.5 溶) 二氧化锰MnO2 87 氯酸钾KCIO3 122.5 碳酸H2CO3 62 高锰酸钾(灰锰氧MnO4 158 碳酸钙CaCQ 100 硫酸铜(白1 蓝CuSO4 160 溶 碳酸氢铵NH4HCO3 79 硫酸钠Na2SO4 142 硝酸HNO3 63 硝酸铵NH4NO3 80 硫酸H2SO4 98 甲烷CH4 16 亚硫酸H2SO3 82 尿素CO(NH2)2 60 磷酸H3PO4 98 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H2 26 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁黑)FmO4 232 氧化铁(红)Fe2O3 160 氧化亚铁(黑)FeO 72
硫酸亚(淡绿)eSO 152 硫酸锌(白无)ZnSO4 161 初中化学常用计算公式 一.常用计算公式: (1)相对原子质量=某元素一个原子的质量/ 一个碳原子质量的 1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量Xm+ B的相对原子质量X ②A元素与B元素的质量比=A的相对原子质量X m: B的相对原子质量X n ③A元素的质量分数3 =A的相对原子质量X m /AmBn 的相对分 子质量
(完整版)初中物理科学八年级上册《质量》导学案
质量 【学习目标】 1.知道质量的概念,对常见物体的质量有一定认识;了解常见的测量质量的工具,初步掌握托盘天平的使用方法。 2.通过积极合作,学会正确使用托盘天平测量物体的质量。 3.养成自觉遵守操作规范的良好习惯。 【重点】质量的概念;托盘天平的使用方法。 【难点】用天平测固体、液体的质量。 预习案 I.知识储备 l.日常生活中常用台秤、案秤、杆秤和磅秤来测量物体的“重量”(即本节要学习的质量)。 2.一名中学生的“体重”大约是100 斤(即50 公斤或者说50 千克),一只母鸡的“重 量”大约是2 公斤(即2 千克)。 3.日常生活中用的案秤、磅秤,使用前需要调节横梁平衡。 Ⅱ.教材助读 1.质量 (l)你知道什么叫做质量吗?质量的基本单位是什么?还有哪些常用单位? (2)从课本的“小资料”中,了解一些物体的质量大小。 2.质量的测量 实验室测质量的常用工具是。 3.天平的使用 (l)结合教材图6- 1 -2,了解托盘天平的结构,熟悉各部分的名称。 (2)使用天平进行测量之前应该注意哪些问题? (3)测量前怎样调节天平平衡?天平调平衡前游码应放在什么位置? (4)用天平测量物体质量时,物体和砝码分别放在哪边托盘内? (5)测量时,天平平衡后,所测物体的质量跟砝码质量和游码位置之间有什么关系? 4.物体的质量不随它的、、位置而 改变。 Ⅲ.预习自测 1.质量的单位:质量的国际单位是,符号:。常用的单位还有: .、,它们的换算关系是千进制:1 t=kg , 1 kg=g , 1 g=mg,大头针质量约是8.0×10-5kg= mg,鲸的质量是 1.5×105kg= t 2.一个物体的质量大小取决于( ) A.物体的形状 B.物体所含物质的多少
化学中常用相对原子质量和相对分子质量.
常用的相对原子质量 元素名称元素符号相对原子质量氢H 1 碳 C 12 氮N 14 氧O 16 钠Na 23 镁Mg 24 铝Al 27 硅Si 28 磷P 31 硫S 32 氯Cl 35.5 钾K 39 钙Ca 40 锰Mn 55 铁Fe 56 铜Cu 64 锌Zn 65 银Ag 108 碘I 127 钡Ba 137
常用的相对分子质量 物质名称化学式相对分子质量 氢气H2 2 氨气NH3 17 氮气N228 氧气O232 水H2O 18 过氧化氢H2O234 一氧化碳CO 28 二氧化碳CO244 一氧化硫SO 48 二氧化硫SO264 三氧化硫SO380 二氧化锰MnO287 二氧化硅SiO260 一氧化氮NO 30 二氧化氮NO246 五氧化二磷P2O5142 氧化铁Fe2O3160 氧化亚铁FeO 72 四氧化三铁Fe3O4232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO 40 氧化钙CaO 56 氧化铝Al2O3 102 氧化锌ZnO 81 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223
氯气Cl271 氯化氢HCl 36.5 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl295 氯化钙CaCl2111 氯化铜CuCl2135 氯化锌ZnCl2136 氯化钡BaCl2208 氯化铝AlCl3133.5 氯化铁FeCl3162.5 氯化银AgCl 143.5 氯酸钾KClO3122.5 氯化铵NH4Cl 53.5 氯化亚铁FeCl2 127 物质名称化学式相对分子质量硫酸H2SO498 硫酸锌ZnSO4161 硫酸铵(NH4)2SO4132 硫酸铜CuSO4160 硫酸钡BaSO4233 硫酸钙CaSO4136 硫酸钾K2SO4174 硫酸钠Na2SO4142 硫酸镁MgSO4120 硫酸铁Fe2(SO4)3400 硫酸亚铁FeSO4152 硫酸铝Al2(SO4)3342 硫酸氢钠NaHSO4120 硫酸氢钾KHSO4136 亚硫酸H2SO382 亚硫酸钠Na2SO3126
初中常用相对分子质量及计算公式
氢气H22五氧化二磷P2O5142 74氧气O232氢氧化钙(熟石灰)(Ca(OH) 2 氯气Cl271氢氧化铜Cu(OH)298氨气NH3,17氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234 《 一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)(HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO2|64氯化钾KCl 三氧化硫SO380氯化铁(淡黄溶)FeCl3 ~ 二氧化锰MnO287氯酸钾KClO3 158碳酸H2CO362高锰酸钾(灰锰氧)^KMnO 4 碳酸钙CaCO3100硫酸铜(白固蓝溶)CuSO4160碳酸氢铵NH4HCO3`79硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380 H2SO498甲烷CH416硫酸 亚硫酸H2SO382尿素、CO(NH )260 2 磷酸H3PO498甲醇CH3OH32水H2O}18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226 、 氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56" 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3 (160) 氧化亚铁(黑)FeO72 】 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161@
初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn [ ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn的相对分子质量 (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100% |
相对原子质量表
相对原子质量表 1~56号元素 原子序数元素名称元素符号相对原子质量 1 氢H 1.00794 2 氦He 4.002602 3 锂Li 6.941 4 铍Be9.012 182 5 硼B10.811 6 碳C12.0107 7 氮N14.006 7 8 氧O15.999 4 9 氟F18.998 403 2 10 氖Ne20.179 7(6) 11 钠Na22.989 769 28 12 镁Mg24.305 0 13 铝Al26.981 538 6 14 硅Si28.085 5 15 磷P30.973 762 16 硫S32.065 17 氯Cl35.453 18 氩Ar39.948 19 钾K39.098 3 20 钙Ca40.078 21 钪Sc44.955 912 22 钛Ti47.867 23 钒V50.941 5 24 铬Cr51.996 1 25 锰Mn54.938 045 26 铁Fe55.845 27 钴Co58.933 195 28 镍Ni58.693 4 29 铜Cu63.546 30 锌Zn65.39 31 镓Ga69.723 32 锗Ge72.64 33 砷As74.921 60 34 硒Se78.96 35 溴Br79.904 36 氪Kr83.798 37 铷Rb85.467 8 38 锶Sr87.62 39 钇Y88.905 85 40 锆Zr91.224 41 铌Nb92.906 38
42 钼Mo95.94 43 锝Tc(97.9072) 44 钌Ru101.07 45 铑Rh102.905 50 46 钯Pd106.42 47 银Ag107.868 2 48 镉Cd112.411 49 铟In114.818 50 锡Sn118.710 51 锑Sb121.760 52 碲Te127.60 53 碘I126.904 47 54 氙Xe131.293 55 铯Cs132.905 451 9 56 钡Ba137.327 57~71号元素(镧系) 原子序号元素名称元素符号相对原子质量 57 镧La138.905 47 58 铈Ce140.116 59 镨Pr140.907 65 60 钕Nd144.242 61 钷Pm(145) 62 钐Sm150.36 63 铕Eu151.964 64 钆Gd157.25 65 铽Tb158.925 35 66 镝Dy162.500 67 钬Ho164.930 32 68 铒Er167.259 69 铥Tm168.934 21 70 镱Yb173.04 71 镥Lu174.967 72~88号元素 原子序号元素名称元素符号相对原子质量 72 铪Hf178.49 73 钽Ta180.947 88 74 钨W183.84 75 铼Re186.207 76 锇Os190.23 77 铱Ir192.217 78 铂Pt195.084 79 金Au196.966 569 80 汞Hg200.59
