电厂用化学药品大全

电厂用化学药品简介
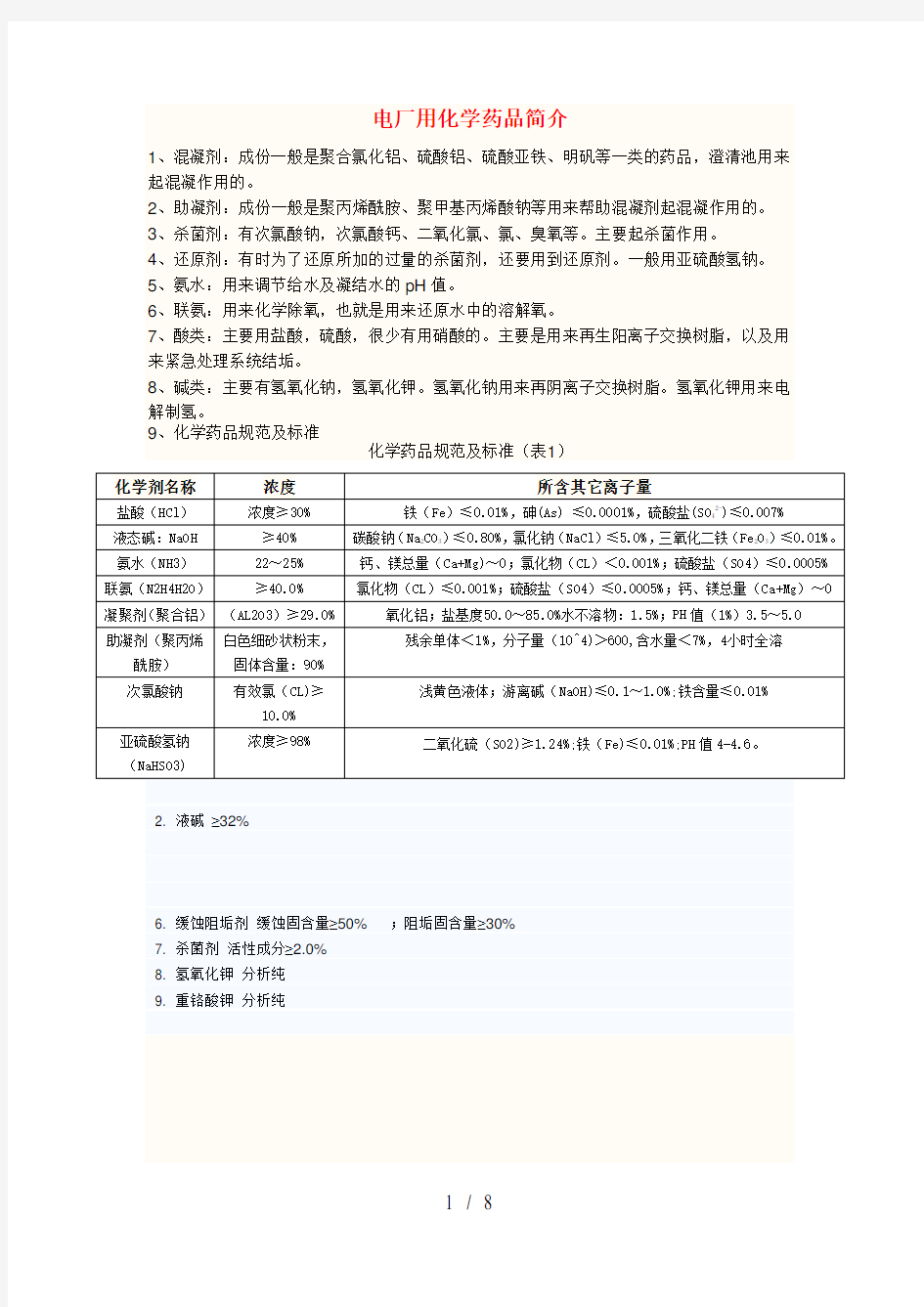
1、混凝剂:成份一般是聚合氯化铝、硫酸铝、硫酸亚铁、明矾等一类的药品,澄清池用来起混凝作用的。
2、助凝剂:成份一般是聚丙烯酰胺、聚甲基丙烯酸钠等用来帮助混凝剂起混凝作用的。
3、杀菌剂:有次氯酸钠,次氯酸钙、二氧化氯、氯、臭氧等。主要起杀菌作用。
4、还原剂:有时为了还原所加的过量的杀菌剂,还要用到还原剂。一般用亚硫酸氢钠。
5、氨水:用来调节给水及凝结水的pH值。
6、联氨:用来化学除氧,也就是用来还原水中的溶解氧。
7、酸类:主要用盐酸,硫酸,很少有用硝酸的。主要是用来再生阳离子交换树脂,以及用来紧急处理系统结垢。
8、碱类:主要有氢氧化钠,氢氧化钾。氢氧化钠用来再阴离子交换树脂。氢氧化钾用来电解制氢。
9、化学药品规范及标准
化学药品规范及标准(表1)
火电厂水处理反渗透装置运行中加哪些药,其目的是什么
先加杀菌剂,杀死水中的微生物;再加絮凝剂,使水中浊度降低;加还原剂是为了还原水中余氯等氧化性物质;加阻垢剂是为了防止反渗透膜浓水侧结垢。清洗剂是在运行过程中,反渗透膜受到污染才使用,分离线清洗和在线清洗。
几种药剂不一定同时使用,但一定要注意药剂的配伍性。
火电厂燃煤锅炉怎么脱硝?
1、M型炉内燃烧脱NOX法锅炉燃烧所产生的烟气,大约95%的NOX是NO。在炉膛内,NO有可能发生2种截然相反的化学反应:a在较低的反应温度和较高浓度O2的条件下,NO与O2发生氧化反应,生成NOX。b在较高的反应温度和较低浓度O2的条件下,NO与煤炭发生还原反应,生成无害的N2。在发生NO还原反应的同时,由于空气量不足,将造成烟气中的碳氢化合物和CO等可燃性物质增加。在这种情况下,应当在NO还原反应的下游区域,分级供给燃料完全燃烧所需要的空气量,使得燃烧完全燃烧。
2、技术特点(1)对燃料的适应性强,适用于煤、油、汽等燃料:(2)不增加机组运行费用,不用触媒,也不需要喷氨;(3)不增加新的环境污染物;(4)锅炉效率和烟气量不发生变化;(5)锅炉运行状况好,燃烧稳定,能保证锅炉的安全运行;(6)脱NOX效率高,最高可达50%;
3、市场前景(1)同时采用M型低NOX燃烧和M型炉内燃烧脱NOX相结合的方法,对NOX的控制效果显著,600MW燃煤锅炉NOX排放水平远低于《火电厂大气污染排放标准》(GB13223-1996)的规定值。(2)M型低NOX燃烧器和M型炉内燃烧脱NOX相结合的方法,技术成熟,易于操作,且可确保锅炉安全、经济、稳定地运行,锅炉效率等于或优于未采用M型低NOX燃烧器和M型炉内燃烧脱NOX相结合法的600MW超临界直流锅炉,且不增加机组运行费用,也不产生其他次生污染物。(3)M型低NOX燃烧器和M 型炉内燃烧脱NOX相结合的方法可作为我国燃煤电厂,特别是大中型燃煤电厂控制NOX 污染的手段之一。
电厂专用阻垢缓蚀剂
产品性能
1、由膦羟酸、聚合物、铜缓蚀剂等复合而成,操作简单。
2、对碳酸盐水垢有很强的络合增溶作用,能防止水垢在热交换器析出。
3、阻垢作用在PH值7.0~9.0均有效。
4、聚合物分散剂对有机及无机杂质有很好的分散作用。
5、低抗氧化能力强,可有效的防止铜设备受溶解氧腐蚀。
6、低磷、符合环保要求。
用途
本品专用于电厂循环冷却水系统。
电厂热电偶
关键是耐磨热电偶不知道是及在电厂的,还是水泥厂的,如果用在电厂的,耐磨用一年是没问题的;用在水泥厂的炉窑里只能用1-3个月。我们公司的水泥厂专用和循环硫化床专用耐磨热电偶质量好,价格也公道,是不错的选择。耐磨型涂层目前二种,一种材料硬度HRC58-62,测温范围0-600℃;耐腐型涂层具有良好的防腐性能,除了熔融金属锂、钾、钠、
氢氟酸、三氟化氯、三氟化氧高流速的液氮外,它几乎可抵抗其它所有的化学介质,在0-250℃范围内长期使用。若固定螺纹要做成耐腐结构,则该螺纹不能在压力环境下工作。钛合金管能耐海水、各种氯化物和次氯酸盐、湿氯和氧化性酸(包括发烟硝酸)碱等腐蚀、不耐较纯的还原性酸(硫酸、盐酸),钛合金管测温范围在500℃以下。
关于火电厂化学这一方面的问题
300
[ 标签:火电厂化学]
1.热力设备的化学监督有几种形式?
2.混床再生的操作步骤有哪些?
3.循环水浓缩倍率是如何控制的?常用的循环水处理方法有哪些?防止循环水结垢的原理有哪些?
4.简述化学车间在发电厂的作用。
问题补充2009-03-18 23:15
急用啊嫌打的慢加我QQ给我传资料也行
问题补充2009-03-18 23:26
知道其中的回答也可以啊
问题补充2009-03-19 01:45
5.汽水取样时应注意什么?
6.配置稀酸时应注意些什么?浓酸倾洒在室内应如何处理?
7.混床正洗合格的标准是什么?
8.写出下列中温中压(3.8~5.8MPA)汽水质量标准A锅炉水.水质标准
B 锅炉给水水质标准
C凝结水及疏水水质标准?
SOSO用户回答:4人气:26解决时间:2009-03-26 23:17
满意答案
好评率:0%
第三问的回答
浓缩倍率一般采用排污的方法进行控制。循环水常用的处理方法有:一软化,二加缓蚀剂防止对金属系统的腐蚀,三加絮凝剂,降低循环水中碱性离子含量。防止循环水结构:1、软化循环水,2、加酸控制总碱含量在1.0以下;3、可加缓蚀阻垢剂将碱性离子螯合,同时可以起到一定的防腐作用。
工业循环水系统有着各自的特点,实际情况需要结合你的原水以及工艺条件来进行确定。
好:0
不好:0
原创:0
非原创:0
涩郎2009-03-19 01:55
满意答案
好评率:0%
1.化学监督(ehemieal supervision)对电力建设、生产中的水、汽、油、气、燃料进行监测、控制、调整、数据处理、综合分析和管理;对热力设备和发、供电电气设备在安装、调试过程中的各种有关化学工作的检查和监测,对设计阶段有关化学工作的管理.化学监怪以标准、规程、导则、制度为依据,采用统一的方法进行监测和检查,及时发现和消除发、供电设备的隐患,防止设备损坏和事故的发生。化学监督工作按专业分为:①各类水、汽质量的监怪(见水汽质全监份):②电力用油、气质量的监任(见电力用油、油质监督);③燃料的质t监督(见嫩料质童监份);④废水处理与监督(见度水处理). 化学监督工作贯穿于设计、验收、安装、调试、运行、检修、停备用和启动等全过程。在设计过程中,主要是监督系统的设备、仪器、材料(包括离子交换树脂、油品、气体介质和徽料等)的选择和布局,是否满足安全生产、经济合理、技术先进和环境保护要求。在电力建设过程中,主要是检查和监测热力设备、充油、气电气设备出厂和进人安装现场的保管、安装、试压、化学清洗、启动前吹洗和启动投运过程中是否符合保证水、汽、煤、油、气质量的要求。在生产过程中进行的主要工作有:①在运行中按规定周期(定期或连续)进行采样与测定;②在检修中对设备内部的状况(如热力设备中的沉积物和腐蚀)进行检查,并取样分析;③对侧定数据进行整理、分析和判断(诊断);④发现问题,提出对策;⑤将一定时间(如半年、一年、一个大修期)的测定数据进行整理和综合分析,掌握运行规律,研究改进和提高措施. 技术管理主要是制定完整的试验方法和规程制度,建立、健全有关技术档案。化学监督工作与发、供电单位各部门、各设备的运行密切相关,应明确规定各部门职责范围和监督内容,制定相应
规程制度。随着发、供电设备容量、参数的提高,对水、汽、油、气、燃料质量的要求越来越高,要求化学监仔工作必须走向规范化和科学化,为此,要研究使用、不断发展痕量检测技术、状态监侧技术、在线监侧技术、自动控制技术、微机管理技术、专家诊断系统、神经网络系统等新技术。使化学监督工作能及时准确地从水、汽、油、气、燃料的质量反映出发、供电设备的状况和变化。
答案补充
2.混床再生的操作步骤
混床处理工艺的设备包括混合离子交换器和体外再生设备。其中体外再生设备主要包括树脂分离器、阴(阳)树脂再生器、树脂贮存塔、混杂树脂塔和酸碱再生设备。目前国内混床处理工艺主要特点体现在树脂分离再生工艺上。树脂的分离再生工艺有三种,如下文所述。
1.1树脂二次分离再生工艺
所谓树脂二次分离再生工艺,是将失效的混床树脂输送至树脂分离器(阳树脂再生器),完成水力分离后,将上层的阴离子交换树脂移送至阴树脂再生器。阴阳树脂分离面附近的混合树脂输送到混杂树脂塔,然后分别再生阴阳树脂。对于混杂树脂塔内的树脂,下一次再生时将被送回到树脂分离器(阳树脂再生器)内进行二次分离。在这里,树脂分离器同时作为阳树脂再生器。其再生步骤如下:
(1) 混床失效树脂送到树脂分离器(阳树脂再生器)。(2) 混杂树脂从杂树脂塔输送到树脂分离器。(3) 树脂分离器内反洗分层。(4) 树脂分离器内上部阴树脂输送到阴树脂再生器内。(5) 树脂分离器内中间层混杂树脂送回混杂树脂塔。(6) 分别对阴阳树脂进行再生。
(7) 将再生好的阴阳树脂送到树脂贮存塔。
答案补充
1.2锥体分离再生工艺
锥体分离再生工艺是将树脂分离器底部作成一锥体。该设备同时作为阴树脂再生器而不作为阳树脂再生器。失效树脂从混床输送到树脂分离器完成水力分层后,位于树脂分离器下部的阳树脂从锥体底部被输送到阳树脂再生器。由于树脂分离器底部为一锥形体,树脂分离界面的树脂很少,从而减少中间混合树脂的数量,提高分离效果。在输送阳树脂时,分离界面在自动控制时的自动检测常采用光电法或电导法。所谓光电法即采用光电计检测阴阳树脂颜色的深浅;而电导法则采用测量阴阳树脂输送水的电导变化,当充入W2气体的树脂输送
水由阳树脂变为阴树脂时,其电导将变小。利用两种方式产生的信号变化来控制阴阳树脂界限。其再生步骤如下:
(1) 失效树脂从混床输送到树脂分离器(阴树脂再生器)。
(2) 失效树脂在树脂分离器(阴树脂再生器)内反洗分层。
(3) 利用水力方法将分离器下部阳树脂从锥体底部输送到阳树脂再生器。
(4) 分别对阴阳树脂进行酸碱再生。
(5) 将再生好的阴树脂输送到阳树脂再生器备用。
答案补充
1.3阴阳树脂的单塔再生工艺
该工艺是将失效树脂从混床输送到树脂分离器内,失效树脂水力分层后,在分离器内同时对阴阳树脂进行再生。树脂分离器同时作为树脂再生器。该方式同补给水处理除盐混床完全相同。再生步序如下:
(1) 失效树脂水力输送到树脂分离器。
(2) 树脂分离器内失效树脂进行水力分层。
(3) 树脂分离器内阴阳树脂进行酸碱再生。
(4) 再生好的树脂输送到混床内混和备用。
答案补充
4.化学车间在发电厂的作用
热力发电过程其实就是一个工质的形态转化过程,在锅炉里面,水被加热成过热蒸汽,然后通入至汽轮机里面做功发电,做完功的乏汽最终在凝汽器里面被凝结成水,再进入锅炉里面循环使用,由此可见水在电厂里面的地位。
在电厂里面有很多种类的水:循环水,给水,各种旋转机械的冷却水……这些水的供给以及锅炉每天的煤质化验都是在化学车间完成的。
在化学车间里主要有预处理设备:斜管沉淀池、过滤器和无阀滤池等,这些设备主要是把循环水来水中的杂质、悬浮物去除,保证厂工业水系统、消防水系统用水,并供给化学除盐水水源。
除盐设备:阳床、阴床、混床等。顾名思义,通过这些阴阳离子床的吸附作用,除去水中的离子,保证进入主厂房补给水系统水质合格。
加药设备:如除盐水加氨处理、循环水加氯处理等。为了更好的满足生产中所需要水的水质,这些设备操作必不可少。
药品注册管理办法附件化学药品注册分类及申报要求
附件2: 化学药品注册分类及申报资料要求 一、注册分类 1.未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2.改变给药途径且尚未在国内外上市销售的制剂。 3.已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6.已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1.药品名称。 2.证明性文件。 3.立题目的与依据。 4.对主要研究结果的总结及评价。 5.药品说明书、起草说明及相关参考文献。 6.包装、标签设计样稿。 (二)药学研究资料 7.药学研究资料综述。 8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9.确证化学结构或者组份的试验资料及文献资料。 10.质量研究工作的试验资料及文献资料。 11.药品标准及起草说明,并提供标准品或者对照品。
电厂化学实验室药品管理制度
电厂化学实验室药品管理制度 一、化学药品保管室要阴凉、通风、干燥,有防火、防盗设施,禁止吸烟和使用明火。 二、化学药品要由可靠的、有化学专业知识的人专管。 三、化学药品应按性质分类存放,并采用科学的保管方法。如受光易变质的应装在避光容器内;易挥发、溶解的,要密封;长期不用的,应蜡封;装碱的玻璃瓶不能用玻璃塞等。 四、对危险药品要严加管理: 1(危险药品必须存入专用仓库或专柜,加锁防范。 2(互相发生化学作用的药品应隔开存放。 3(危险药品都要严加密封,并定期检查密封情况,高温、潮湿季节尤应注意。 4(对危险药品要严格执行领用制度,登记其去向和用途,并要定期清点,确保安全。 5(危险药品仓库的周围和内部严禁有火源。 6(用不上的危险药品,应及时调出;变质失效的要及时销毁,销毁时要注意安全,不得污染环境。 7(磷、钾、钠、碳化钙、二硫化碳、苯、乙醚、发烟硫酸、丙酮、乙酸、甲苯等非经常使用的危险药品,做完实验后,剩余部分应及时存入危险药品库。 8(下列经常使用的危险药品,化学药品室可保存一瓶,重量不能超过规定限额,多余的应存放在危险药品库中:无水乙醇1000 g,氯酸钾、高锰酸钾、硝酸、硝酸钠等各500 g,溴100 g、浓硝酸和浓硫酸各1000 g,工业乙醇10 ?。 9(镁粉、镁带、铝粉、三氯化铝、甲酸、盐酸、氢氧化钠、重铬酸钾、五氯化二磷、亚硝酸钠、硝酸汞、硝酸铝、硝酸铜、硝酸镉、酚、甲醛、丙三醇等危险药品可存放在化学药品室。
10(以上未列出的其它危险药品,根据危险程度,采取相应的管理措施。 11(凡已稀释和已配成溶液的危险药品(如浓硫酸、浓硝酸、红磷、乙醇),可不存入危险药品仓库。 煤泥矸石电厂 2011-11-26
化学药品新注册分类申报资料要求(试行)的通告(2016年 第80号)综述
附件 化学药品新注册分类申报资料要求(试行) 第一部分 注册分类1、2、3、5.1类申报资料要求(试行) 一、申报资料项目 (一)概要 1.药品名称。 2.证明性文件。 2.1注册分类1、2、3类证明性文件 2.2注册分类5.1类证明性文件 3.立题目的与依据。 4.自评估报告。 5.上市许可人信息。 6.原研药品信息。 7.药品说明书、起草说明及相关参考文献。 8. 包装、标签设计样稿。 (二)主要研究信息汇总表 9. 药学研究信息汇总表。
10. 非临床研究信息汇总表。 11. 临床研究信息汇总表。 (三)药学研究资料 12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。 12.1(3.2.S.1)基本信息 12.2(3.2.S.2 )生产信息 12.3(3.2.S.3 )特性鉴定 12.4(3.2.S.4)原料药的质量控制 12.5(3.2.S.5)对照品 12.6(3.2.S.6)包装材料和容器 12.7(3.2.S.7)稳定性 13. (3.2.P)制剂。 13.1(3.2.P.1)剂型及产品组成 13.2(3.2.P.2)产品开发 13.3(3.2.P.3)生产 13.4(3.2.P.4)原辅料的控制 13.5(3.2.P.5)制剂的质量控制 13.6(3.2.P.6)对照品 13.7(3.2.P.7)稳定性 (四)非临床研究资料 14.非临床研究资料综述。 15.主要药效学试验资料及文献资料。
16.安全药理学的试验资料及文献资料。 17.单次给药毒性试验资料及文献资料。 18.重复给药毒性试验资料及文献资料。 19.遗传毒性试验资料及文献资料。 20.生殖毒性试验资料及文献资料。 21.致癌试验资料及文献资料。 22.依赖性试验资料及文献资料。 23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。 24.其他安全性试验资料及文献资料。 25.非临床药代动力学试验资料及文献资料。 26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。 (五)临床试验资料 27.临床试验综述资料。 28.临床试验计划及研究方案。 29. 数据管理计划、统计分析计划。 30.临床研究者手册。 31.知情同意书样稿、伦理委员会批准件;科学委员会审查报告。 32.临床试验报告。 33.临床试验数据库电子文件(原始数据库、衍生的分析数据库及其变量说明文件)。
电厂化学水处理认识
电厂化学水处理综述 ——水寿 摘要:对用水进行较好的净化处理才能防止热力设备的结垢、腐蚀,避免爆管事故,有效防止过热器和汽机的积盐,以免汽轮机出力下降甚至造成事故,从而保证锅炉、汽机等重要设备的安全、有序运行。本文介绍了电厂化学水处理技术的发展特点,以及常规的方法与应用。 关键词:化学水处理;特点;方法 前言:电厂的化学水处理主要是指锅炉用水的给水处理,这个过程的好坏直接关系到相关设备是否可以安全经济运行,所以说化学水处理是电厂生产的重要过程。因此必须在建设前期从设计上严把关,深入研究化学处理的工艺,做好预控工作,建设过程中慎重对待化学水处理的施工和设备安装,为以后电厂顺利投产运营打下坚实的基础。基于该背景,本文对电厂化学水处理的发展特点、常见方法和工艺进行了综述,方便更好的理解该该部分技术内容为以后工作打下坚实的基础,同时也作为本人的学习总结。 1 化学水处理的技术特点 水在火力发电厂水汽循环系统中所经历的过程不同,水质常有较大的差别。因此根据实用的需要,人们常给予这些水以不同的名称,具体为原水、锅炉补给水、给水、锅炉水、锅炉排污水、凝结水、冷却水和疏水等,通常情况下为了方便又简单的分为炉内水和炉外水。电厂化学水处理主要包括补给水处理和汽、水监督工作,补给水处理
也叫炉外水处理,是净化原水、制备热力系统所需质量合格的补给水,是锅炉水质合格的重要保障。汽水监督工作是改善锅炉运行工况、防止汽水循环不良的安全保障。随着当前技术的不断发展进步,现代电厂化学水处理呈现出集中、多元化、环保等特点,下面分别阐述。1.1分布集中化 在以往的电厂化学水处理过程中,常常设有多种处理系统,一般按照功能分为净水预处理系统、锅炉补给水处理系统、汽水的取样监测分析、循环水处理系统、加药处理系统、废水处理系统等等。这种按照功能作用设立的多种处理系统占地面积大、需要的维护人员多、给生产管理造成了不便。现在为了提高化学水处理设备的利用率、节约场地及管理方便,化学水处理设备的布置呈现紧凑、集中、立体的结构。根据相关文献的研究,该种结构的布局满足了整体流程的需要,是一种效果较好的结构模式。 1.2处理工艺多元化 化学水处理的传统常用工艺为混凝过滤、离子交换、磷酸酸化处理,随着科学技术的不断发展,电厂化学水处理工艺向着多元化的方向发展。当前水处理工艺发展为利用微生物对水质进行处理,利用膜处理技术对化学水进行反渗透、细微过滤也已经广泛应用于水处理,超滤、流动电流技术也在化学水处理中发挥着积极的作用。 处理控制系统也越来越集中化,把各个子系统合为一整套系统,然后采用PLC加上位机的控制结构。其中,PLC负责对各个子系统进行控制和数据采集,通过通信接口与PLC连接起来的上位机负责对各
化学药品注册-化学药品注册分类
许可事项化学药品注册分类 一、化学药品注册分类 1、未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。 2、改变给药途径且尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的原料药及其制剂; (2)已在国外上市销售的复方制剂; (3)改变给药途径并已在国外上市销售的制剂。 4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6、已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1、药品名称。 2、证明性文件。 3、立题目的与依据。 4、对主要研究结果的总结及评价。 5、药品说明书样稿、起草说明及最新参考文献。 6、包装、标签设计样稿。
(二)药学研究资料 7、药学研究资料综述。 8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9、确证化学结构或者组份的试验资料及文献资料。 10、质量研究工作的试验资料及文献资料。 11、药品标准草案及起草说明,并提供标准品或者对照品。 12、样品的检验报告书。 13、辅料的来源及质量标准。 14、药物稳定性研究的试验资料及文献资料。 15、直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16、药理毒理研究资料综述。 17、主要药效学试验资料及文献资料。 18、一般药理研究的试验资料及文献资料。 19、急性毒性试验资料及文献资料。 20、长期毒性试验资料及文献资料。 21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等主要与局部、全身给药相关的特殊安全性试验研究和文献资料。 22、复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。 23、致突变试验资料及文献资料。 24、生殖毒性试验资料及文献资料。 25、致癌试验资料及文献资料。
化学试剂的纯度分类及标准
化学试剂的纯度分类及标准
————————————————————————————————作者:————————————————————————————————日期: ?
化学试剂的纯度分类及标准 国标试剂:该类试剂为我国国家标准所规定,适用于检验、鉴定、检测 基准试剂(JZ,绿标签):作为基准物质,标定标准溶液。 优级纯(GR,绿标签)(一级品):主成分含量很高、纯度很高,适用于精确分析和研究工作,有的可作为基准物质。 分析纯(AR,红标签)(二级品):主成分含量很高、纯度较高,干扰杂质很低,适用于工业分析及化学实验。 化学纯(CP,蓝标签)(三级品):主成分含量高、纯度较高,存在干扰杂质,适用于化学实验和合成制备。 实验纯(LR,黄标签):主成分含量高,纯度较差,杂质含量不做选择,只适用于一般化学实验和合成制备。 教学试剂():可以满足学生教学目的,不至于造成化学反应现象偏差的一类试剂。 指定级(ZD),该类试剂是按照用户要求的质量控制指标,为特定用户订做的化学试剂。 高纯试剂(EP):包括超纯、特纯、高纯、光谱纯,配制标准溶液。此类试剂质量注重的是:在特定方法分析过程中可 能引起分析结果偏差,对成分分析或含量分析干扰的杂质含量,但对主含量不做很高要求。 色谱纯(GC):气相色谱分析专用。质量指标注重干扰气相色谱峰的杂质。主成分含量高。 色谱纯(LC):液相色谱分析标准物质。质量指标注重干扰液相色谱峰的杂质。主成分含量高 指示剂(ID):配制指示溶液用。质量指标为变色范围和变色敏感程度。可替代CP,也适用于有机合成用。 生化试剂(BR):配制生物化学检验试液和生化合成。质量指标注重生物活性杂质。可替代指示剂,可用于有机合成 生物染色剂(BS):配制微生物标本染色液。质量指标注重生物活性杂质。可替代指示剂,可用于有机合成 光谱纯(SP):用于光谱分析。分别适用于分光光度计标准品、原子吸收光谱标准品、原子发射光谱标准品 电子纯(MOS):适用于电子产品生产中,电性杂质含量极低。 当量试剂(3N、4N、5N):主成分含量分别为99.9%、99.99%、99.999%以上。 电泳试剂:质量指标注重电性杂质含量控制。 此外,还有特种试剂,生产量极小,几乎是按需定产,此类试剂其数量和质量一般为用户所指定。 试剂 reagent 又称化学试剂或试药。主要是实现化学反应、分析化验、研究试验、教学实验、化学配方使用的纯净化学品。 一般按用途分为通用试剂、高纯试剂、分析试剂、仪器分析试剂、临床诊断试剂、生化试
电厂化学实验用药配置方法
配药方法: 20ug/L二氧化硅工作液: 准确吸取0.1ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。40ug/L二氧化硅工作液: 准确吸取0.2ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。60ug/L二氧化硅工作液: 准确吸取0.3ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。80ug/L二氧化硅工作液: 准确吸取0.4ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。100ug/L二氧化硅工作液: 准确吸取0.5ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。1mg/L二氧化硅工作液: 准确吸取5ml(1ml≈0.1mg)硅标准液,用除盐水稀释至500ml。 1.5mg/L二氧化硅工作液: 准确吸取3.75ml(1ml≈0.1mg)硅标准液,用除盐水稀释至 500ml。 10 mol/LH2SO4: 准确量取1400ml浓硫酸,缓缓注入到3600ml除盐水中,混匀。 5%钼酸铵: 准确称取50g钼酸铵溶于1000ml除盐水中,混匀。 1:1盐酸: 准确量取500ml盐酸溶于500ml除盐水中,混匀。 1.5%氯化亚锡: 准确称取3.75g氯化亚锡溶于50ml1:1盐酸中,用除盐水稀释至 250ml,液体石蜡封液面。 0.1mol/L EDTA: 准确称取20gEDTA溶于1000ml除盐水中混匀,并标定。(标定方法:20ml氧化锌+80ml除盐水+0.5ml10%氨水+5ml氨—氯化铵缓冲溶液+5滴0.5%络黑T,用新配好的EDTA滴定) 0.01mol/L EDTA: 准确称取8gEDTA溶于1000ml除盐水中,加35ml除盐水混匀。(直接用0.1mol/L EDTA稀释10倍也可以) 硼砂缓冲溶液: 准确称取40g硼砂和10g氢氧化钠溶于1000ml除盐水中,加入 4ml0.01mol/L EDTA,混匀。
(完整版)新旧化学药品注册分类对比2016.3.4
化学药品注册分类对比(仅供参考) 2016年3月4日,食品药品监管总局发布了《化学药品注册分类改革工作方案》。现将《化学药品注册分类改革工作方案》与《药品注册管理办法》(2007版)相比,有以下这些不同之处:
相较于2015年11月6日《化学药品注册分类改革工作方案(征求意见稿)》中提到的2.5含有已知活性成分的新用法用量和新规格的制剂,在此方案中并未体现,可能只能走补充申请了。 相关注册管理要求 (一)对新药的审评审批,在物质基础原创性和新颖性基础上,强调临床价值的要求,其中改良型新药要求比改良前具有明显的临床优势。对仿制药的审评审批,强调与原研药品质量和疗效的一致。
(二)新注册分类1、2类别药品,按照《药品注册管理办法》中新药的程序申报;新注册分类3、4类别药品,按照《药品注册管理办法》中仿制药的程序申报;新注册分类5类别药品,按照《药品注册管理办法》中进口药品的程序申报。 新注册分类2类别的药品,同时符合多个情形要求的,须在申请表中一并予以列明。 (三)监测期有变动; (四)可以继续按照原规定进行审评审批,也可以申请按照新注册分类进行审评审批。如申请按照新注册分类进行审评审批,补交相关费用后,不再补交技术资料,国家食品药品监督管理总局药品审评中心要设立绿色通道,加快审评审批。符合要求的,批准上市;不符合要求的,不再要求补充资料,直接不予批准。 (五)新注册分类的注册申请所核发的药品批准文号(进口药品注册证/医药产品注册证)效力与原注册分类的注册申请核发的药品批准文号(进口药品注册证/医药产品注册证)效力等同。 (六)国家食品药品监督管理总局组织相关部门细化工作要求,做好受理、核查检查、技术审评及制定、修订相关国家药品标准等工作。 (七)《药品注册管理办法》与本方案不一致的,按照本方案要求执行。
化学制剂行业
化学制剂行业
————————————————————————————————作者: ————————————————————————————————日期: ?
化学药品制剂制造 一行业定义及分类 (一) 定义 指直接用于人体疾病防治、诊断的化学药品制剂的制造。其中包括:片剂、针剂、胶囊、药水、软膏、粉剂、溶剂等各种剂型的药品及放射性药物;不包括: 中成药制造,动物用药制造和生物制品和生化药品的制造。 (二)分类 1、化学药品从是否获得药品专利保护的角度可以分为专利药和非专利药 专利药是指生产厂商申请专利保护,从而在专利期内享受市场独占性的药物,专利药的生产和销售被制药商垄断。价格也完全由制药商决定。专利保护期一般为17-20 年,从申请专利到研究开发投人市场需经历十年左右时间,故一个新药正的实际受保护期一般不会超过十年。一般药物的市场存在期要比其专利保护期长得多。 非专利药是指药物专利持有者之外的企业因专利过期,或者是合法取得专利持有者的专利授权而生产出的药品。非专利药都是没有商品名的,只标注药品通用名,医生对非专利药开处方也只写通用名,因此也被称为“通用名药物”。一般仿制药均为非专利药。2004年,FDA出台法规规定,首个获准的非专利药均享有Hatch-Waxman 法案规定的180d 的市场独占期,这期间不批准其它同样的非专利药上市。这一规定意味着授权式非专利药同样可以率先上市,占领市场先机。通用名药一般已经销售多年,疗效确切,加之投人少,研制周期短,风险小,受到很多厂商的青睐。如果率先上市,也能迅速夺取市场,获取高额利润。低价的通用名药上市,将对专利药带来极大的冲击。首个非专利药上市时,品牌药将流失15%~30%的市场分额。当更多的非专利药上市时,品牌药的市场销售甚至能削减90%。 近几年来,一些发达国家政府为减少庞大的医疗费用支出,减少社会保障压力和财政赤字,鼓励使用通用名药。使通用名药市场得到了快速发展。目前,通用名药市场已经占全球药品市场的40%以上。 2、化学药品制剂根据是否需要医师开处方,可以分为处方药和非处方药。 非处方药,又成为OTC,大都用于多发病常见病的自行诊治,如感冒、咳嗽、消化不良等。非处方药是不需要医师或其它医疗专业人员开写处方即可购买的药品,一般公众凭自我判断,按照药品标签及使用说明就可自行使用。 处方药则需要医师或其它医疗专业人员开写处方。处方药的消费模式是由医生代理病人进行消费。药品消费属于谨慎的消费行为,需求弹性较小,更进一步从处方药和非处方药的消费模式可以看出处方药的需求弹性较非处方药的弹性
在建电厂化学危险品管理制度
国电海南电厂2×350MW新建工程总承包项目管理文件 化学危险品管理制度 国电电厂2×350MW新建工程 总承包项目部
目录 1 范围 2 编制依据 3 术语和定义 4职责 5管理规定 6 危险品仓库的附属设施 7 化学危险品发放 8化学危险品搬运 9 化学危险物品使用 10 化学危险品安全检查 11化学危险品应急措施 12 化学危险品防火防爆 13 化学危险品相关文件
1 范围 本制度规定了对工程项目的化学危险物品采购、储存、搬运、使用和销毁等各个环节的安全管理职责、管理内容与方法、检查与考核等。 本制度适用于公司项目部对化学危险品的管理。 2 编制依据 《中华人民共和国安全生产法》 《危险化学品安全管理条例》 《危险货物分类与产品编号》GB6944-86 3 术语和定义 化学危险品:指中华人民共和国国家标准GB6944—86《危险货物分类与产品编号》规定的分类标准中的爆炸品、压缩气体和液化气体、易燃液体、易燃固体、自燃物品和遇湿易燃物品、氧化剂和有机过氧化物、有毒品、放射性物品和腐蚀品等八类。 4职责 4.1项目部物资部负责按规定对化学危险品进行管理。 4.2 项目部安全质量部负责组织相关人员的培训。 4.3项目部物资部和代保管负责对化学危险物品采购及仓储的管理。 4.3.1 需从取得危险化学品生产许可证或者危险化学品经营许可证的企业采购危险化学品。 4.3.2危险化学品的包装必须符合国家法律、法规的规定和国家标准的要求。购进的危险化学品应当在危险化学品的包装内附有与危险化学品完全一致的化学品安全技术说明书,并在包装(包括外包装件)上加贴或者栓挂与包装内危险化学品完全一致的化学品安全标签。 5 管理规定 5.1 物资代保管应对保管者进行必要的有关化学危险物品的知识教育,并保留教育记录。化学危险物品保管者必须在进行相应教育并考核合格后方可上岗作业。 5.2 化学危险品的验收 5.2.1 化学品入库前应进行验收,包装应完整,不得有破损和泄露情况,包装外应贴有完整的化学危险品标签,危险化学品的包装内应附有与危险化学品完全一致的化学品安全技术说明书,并在包装(包括外包装件)上加贴或者栓挂于包装内危险化学品完全一致的化学品安全标签。不符合验收要求可拒绝入库。新增加的危险化学品种类要先仔细阅读说明书。 5.3化学危险品的储存 5.3.1 验收员根据进仓凭证详细核对品名、危规编号、规格、数量,入库后根据其化学性质及存储条件妥善放置到相应的储存地点,及时填写记录。 5.3.2 储存管理要求。应做到分类储存,专职保管,定额管理。 5.3.3 危险品堆垛不得过高过密,并保持六距:(墙垛、垛距、顶距、梁距、灯距、柱距),堆垛密度:一级危险品最大堆垛不得超过40平方米,一般危险品的最大堆垛不得超过80平方米。 5.3.4 凡危险性质互有影响,相互抵触(如接触后回发生爆炸、燃烧或产生毒气)的危险品,必须分
化学试剂的分类
(一) 化学试剂 1. 化学试剂的分类 化学试剂数量繁多,种类复杂,通常根据用途分为一般试剂、基础试剂、高纯试剂、色谱试剂、生化试剂、光谱纯试剂和指示剂等。采用的标准为国家标准(标以“GB”字样)和行业标准(标以“HG”字样)。食品检验常用的试剂主要有一般试剂、基础试剂、高纯试剂和专用试剂等。 化学试剂的分级: 除此之外还有许多特殊规格试剂,如基准试剂、色谱纯试剂、光谱纯试剂、电子纯试剂、生化试剂和生物染色剂等。使用者要根据试剂中所含杂质对检测有无影响选用合适的试剂。 (1) 一般试剂 根据GB 15346-1994《化学试剂的包装及标志》规定,一般试剂分为三个等级,即优级纯、分析纯和化学纯。通常也将实验试剂列入一般试剂。 (2) 基础试剂 可用作基准物质的试剂叫做基准试剂,也可称为标准试剂。基础准试剂可用来直接配制标准溶液,用来校正或标定其他化学试剂。 如在配置标准溶液时用于标定标准溶液用的基准物 (3) 高纯试剂 高纯试剂不是指试剂的主体含量,而是指试剂的某些杂质的
含量而言。高纯试剂等级表达方式有数种,其中之一是以内处“9”表示,如用于9.99%,99.999%等表示。“9”的数目越多表示纯度越高,这种纯度的是由100%减去杂质的质量百分数计算出来的。 (4) 专用试剂 专用试剂是指具有专门用途的试剂。例如仪器分析专用试剂中色谱分析标准试剂、气相色谱载体及固定液、薄层分析试剂等。与高纯试剂相似之处是,专用试剂不仅主体含量较高,而且杂质含量很低。它与高纯试剂的区别是,在特定的用途中有干扰的杂质成分只须控制在不致产生明显干扰的限度 以下。 表1 .1 化学试剂等级对照表 其他级别化学试剂等级对照表
火力发电厂常用危险化学品的安全管理详细版
文件编号:GD/FS-3532 (管理制度范本系列) 火力发电厂常用危险化学品的安全管理详细版 The Daily Operation Mode, It Includes All Implementation Items, And Acts To Regulate Individual Actions, Regulate Or Limit All Their Behaviors, And Finally Simplify The Management Process. 编辑:_________________ 单位:_________________ 日期:_________________
火力发电厂常用危险化学品的安全 管理详细版 提示语:本管理制度文件适合使用于日常的规则或运作模式中,包含所有的执行事项,并作用于规范个体行动,规范或限制其所有行为,最终实现简化管理过程,提高管理效率。,文档所展示内容即为所得,可在下载完成后直接进行编辑。 1. 概述 危险化学品因其易燃、易爆、有毒、有害的性质,在生产、使用、贮存、运输、废弃过程中,可能发生事故,造成众多人员的伤亡或形成社会灾害性事故。在生产过程中不可避免地使用各种类型的危险化学品,为了加强对危险化学品事故进行有效的控制,必须预先对危险化学品的性质、可能发生事故的途径、危害程度及可能涉及的范围等因素进行分析,确保减少危险化学品事故的危害程度,根据发电企业的自身特点,真正将“安全第一,预防为主”方针落到实处,确保把危险化学品事故危害降到最低水平,实
现救灾减灾的目的,维护企业安全和稳定。 2. 火力发电厂常用危险化学品的种类及特性 危险化学品,按危险特性分为8类,包括爆炸品、压缩气体和液化气体、易燃液体、易燃固体、自燃物品和遇湿易燃物品、氧化剂和有机过氧化物、有毒品和腐蚀品等。 易燃、易爆危险化学品的大量泄漏,其气体(蒸气)可能与空气混合形成爆炸性气团,飘散到较远的地方遇到着火源引爆并迅速回火到泄漏处,引起火灾、爆炸事故的发生。可燃危险化学品的燃烧热值一般较高,发生火灾后火势迅速扩大,温度高,热辐射强,使消防人员难以靠近,增大了灭火的难度;同时,附近的设备、容器因受热而内压升高,可能造成容器破裂或爆炸,扩大事故的危害。爆炸产生的碎片和冲击波能使附近的人员伤亡,建筑物和设备受到损
生物制品、化学药品注册分类及申报资料要求2020
附件 生物制品注册分类及申报资料要求 生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。为规范生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂。 预防用生物制品是指为预防、控制疾病的发生、流行,用于人体免疫接种的疫苗类生物制品,包括免疫规划疫苗和非免疫规划疫苗。 治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;细胞治疗和基因治疗产品;变态反应原制品;微生态制品;人或者动物组织或者体液提取或者通过发酵制备的具有生物活性的制品等。生物制品类体内诊断试剂按照治疗用生物制品管理。 按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等。 药品注册分类在提出上市申请时确定,审评过程中不因其他药品在境内外上市而变更。 第一部分预防用生物制品 一、注册分类 ——1 ——
1 类:创新型疫苗:境内外均未上市的疫苗: 1.1 无有效预防手段疾病的疫苗。 1.2 在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、 新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。 1.3 含新佐剂或新佐剂系统的疫苗。 1.4 含新抗原或新抗原形式的多联/多价疫苗。 2 类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品的安全性、有效性、质量可控性有改进,且具有明显优势的疫苗,包括: 2.1 在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。 2.2 具有重大技术改进的疫苗,包括对疫苗菌毒种/ 细胞基质/生产工艺/ 剂型等的改进。(如更换为其他表达体系或细胞基质的疫苗;更换菌毒株或对已上市菌毒株进行改造;对已上市细胞基质或目的基因进行改造;非纯化疫苗改进为纯化疫苗;全细胞疫苗改进为组分疫苗等) 2.3 已有同类产品上市的疫苗组成的新的多联/多价疫苗。 2.4 改变给药途径,且具有明显临床优势的疫苗。 2.5 改变免疫剂量或免疫程序,且新免疫剂量或免疫程序具有明显临床优势的疫苗。 2.6 改变适用人群的疫苗。 3 类:境内或境外已上市的疫苗: 3.1 境外生产的境外已上市、境内未上市的疫苗申报上市。 ——2 —
2015版药典化学药物(原料药和制剂)稳定性试验研究指导原则
2015版药典化学药物(原料药和制剂)稳定性研究技术指导原则(修订) 一、概述 原料药或制剂的稳定性是指其保持物理、化学、生物学和微生物学特性的能力。稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。 稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。本指导原则为原料药和制剂稳定性研究的一般性原则,其主要适用于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application)。其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更申请(Variation Application)等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进行。 本指导原则是基于目前认知的考虑,其他方法如经证明合理也可采用。 二、稳定性研究的基本思路
(一)稳定性研究的内容及试验设计 稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计一系列的试验来揭示原料药和制剂的稳定性特征。稳定性试验通常包括影响因素试验、加速试验和长期试验等。影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进一步验证所用分析方法的专属性、确定加速试验的放臵条件及选择合适的包装材料提供参考。加速试验是考察原料药或制剂在高于长期贮藏温度和湿度条件下的稳定性,为处方工艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放臵条件。长期试验则是考察原料药或制剂在拟定贮藏条件下的稳定性,为确认包装、贮藏条件及有效期/复检期提供数据支持。 对临用现配的制剂,或是多剂量包装开启后有一定的使用期限的制剂,还应根据其具体的临床使用情况,进行配伍稳定性试验或开启后使用的稳定性试验。 稳定性试验设计应围绕相应的试验目的进行。例如,影响因素试验的光照试验是要考察原料药或制剂对光的敏感性,通常应采用去除包装的样品进行试验;如试验结果显示其过度降解,首先要排除是否因光源照射时引起的周围环境温度升高造成的降解,故可增加避光的平行样品作对照,以消除光线照射之外其他
化学试剂常用分类方法有哪些
化学试剂常用分类方法有哪些? 试剂分类的方法较多。如按状态可分为固体试剂、液体试剂。按用途可分为通用试剂、专用试剂。按类别可分为无机试剂、有机试剂。按性能可分为危险试剂、非危险试剂等。 化学试剂又叫化学药品,简称试剂。化学试剂是指具有一定纯度标准的各种单质和化合物(也可以是混合物)。要进行任何实验都离不了试剂,试剂不仅有各种状态,而且不同的试剂其性能差异很大。 有的常温非常安定、有的通常就很活泼,有的受高温也不变质、有的却易燃易爆:有的香气浓烈,有的则剧毒……。只有对化学试剂的有关知识深入了解,才能安全、顺利进行各项实验。既可保证达到预期实验目的,又可消除对环境的污染。因此,首先要知道试剂的分类情况。然后掌握各类试剂的存放和使用。 化学试剂的分类 从试剂的贮存和使用角度常按类别和性能2种方法对试剂进行分类。 无机试剂和有机试剂 这种分类方法与化学的物质分类一致,既便于识别、记忆,又便于贮存、取用。 无机试剂按单质、氧化物、碱、酸、盐分出大类后,再考虑性质进行分类。 有机试剂则按烃类、烃的衍生物、糖类蛋白质、高分子化合物、指示剂等进行分类。 危险试剂和非危险试剂 这种分类既注意到实用性,更考虑到试剂的特征性质。因此,既便于安全存放,也便于实验工作者在使用时遵守安全操作规则。 1.危险试剂的分类 根据危险试剂的性质和贮存要求又分为: (1)易燃试剂 这类试剂指在空气中能够自燃或遇其它物质容易引起燃烧的化学物质。由于存在状态或引起燃烧的原因不同常可分为: ①易自燃试剂:如黄磷等。 ②遇水燃烧试剂:如钾、钠、碳化钙等。 ③易燃液体试剂:如苯、汽油、乙醚等。 ④易燃固体试剂,如硫、红磷、铝粉等。 (2)易爆试剂 指受外力作用发生剧烈化学反应而引起燃烧爆炸同时能放出大量有害气体的化学物质。如氯
电厂化学实验室管理制度
目录 1.化学分场化验班班长岗位职责 (2) 2.化验室安全操作制度 (3) 3.化验室安全生产管理制度 (4) 4.化验室分析记录管理制度 (5) 5.化验室岗位定期工作 (6) 6.化验室化学试剂使用管理制度 (8) 7.化验室煤质检验管理制度 (9) 8.化验室燃油检验管理制度 (10) 9.化验室危险药品管理制度 (11) 10.化验室卫生管理制度 (12) 11.化验室消防管理制度 (13) 12.化验室仪器设备使用管理制度 (14)
化学分场化验班班长岗位职责 1、负责化验室化学监督和试验的组织领导工作,并进行有效地组织生产,合理安排分工和专业组之间的协调工作。 2、负责全班的安全文明生产工作。 3、负责化学监督工作。 4、负责全班的现代化管理工作。 5、负责全班的日常管理工作。 6、对各项实验报告、分析数据的准确性,可靠性负责。 7、对运行班组使用分析仪器仪表药品的配备,检验工作负责。 8、对本班组在生产过程中的人身安全和设备安全具体负责,把控制异常和未遂作为安全目标,组织全班成员,按设备系统进行安全技术分析预测,做到及时发现异常并进行安全控制。 9、教育、监督本班组人员认真贯彻执行安全规程制度,及时制止违章违纪行为,及时学习事故通报,吸取教训,制订有效的措施,防止同类事故重复发生。 10、经常检查本班组工作场所工作环境、安全设施、设备工器具的完好情况。
化验室安全操作制度 1、化验室需装备各种必备的安全设施(通风橱、防尘罩、试剂柜、防毒面具、消防灭火器材等)。 2、对消防灭火器材定期检查,不能任意挪用,保证随时可取用。经常对化验室人员进行安全防火教育,保证化验室人员都能正确使用所备的各种消防灭火器材。 3、化验室内各种仪器设备都应按要求放置在固定的处所,不得任意移动。各种标签要保证清晰完整,避免拿错用错造成事故。 4、化验室分析仪器设备必须严格遵守安全使用规则和操作规程,认真填写使用记录,发现问题及时汇报。 5、用电、用气、用火时,必须按有关规定操作以保证安全。 6、化验员工作时劳保必须穿戴齐全。化验用的样品要摆放整齐,不可乱堆乱放。 7、化验室工作完毕后,详细检查化验室的门、窗、水、电安全后方可锁门。 8、化验室内不准吸烟、吃食物、存放与化验无关的物品。
电厂用化学药品大全
电厂用化学药品简介 1、混凝剂:成份一般是聚合氯化铝、硫酸铝、硫酸亚铁、明矾等一类的药品,澄清池用来起混凝作用的。 2、助凝剂:成份一般是聚丙烯酰胺、聚甲基丙烯酸钠等用来帮助混凝剂起混凝作用的。 3、杀菌剂:有次氯酸钠,次氯酸钙、二氧化氯、氯、臭氧等。主要起杀菌作用。 4、还原剂:有时为了还原所加的过量的杀菌剂,还要用到还原剂。一般用亚硫酸氢钠。 5、氨水:用来调节给水及凝结水的pH值。 6、联氨:用来化学除氧,也就是用来还原水中的溶解氧。 7、酸类:主要用盐酸,硫酸,很少有用硝酸的。主要是用来再生阳离子交换树脂,以及用来紧急处理系统结垢。 8、碱类:主要有氢氧化钠,氢氧化钾。氢氧化钠用来再阴离子交换树脂。氢氧化钾用来电解制氢。 9、化学药品规X及标准 化学药品规X及标准(表1)
火电厂水处理反渗透装置运行中加哪些药,其目的是什么 先加杀菌剂,杀死水中的微生物;再加絮凝剂,使水中浊度降低;加还原剂是为了还原水中余氯等氧化性物质;加阻垢剂是为了防止反渗透膜浓水侧结垢。清洗剂是在运行过程中,反渗透膜受到污染才使用,分离线清洗和在线清洗。 几种药剂不一定同时使用,但一定要注意药剂的配伍性。 火电厂燃煤锅炉怎么脱硝? 1、M型炉内燃烧脱NOX法锅炉燃烧所产生的烟气,大约95%的NOX是NO。在炉膛内,NO有可能发生2种截然相反的化学反应:a在较低的反应温度和较高浓度O2的条件下,NO与O2发生氧化反应,生成NOX。b在较高的反应温度和较低浓度O2的条件下,NO与煤炭发生还原反应,生成无害的N2。在发生NO还原反应的同时,由于空气量不足,将造成烟气中的碳氢化合物和CO等可燃性物质增加。在这种情况下,应当在NO还原反应的下游区域,分级供给燃料完全燃烧所需要的空气量,使得燃烧完全燃烧。 2、技术特点(1)对
化学药品注册分类及申报 要求
《药品注册管理办法》(局令第17号)附件二:化学药品注册分类及申报资料要求-------------------------------------------------------------------------------- 一、注册分类 1、未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2、改变给药途径且尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6、已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1、药品名称。 2、证明性文件。 3、立题目的与依据。 4、对主要研究结果的总结及评价。 5、药品说明书、起草说明及相关参考文献。 6、包装、标签设计样稿。 (二)药学研究资料 7、药学研究资料综述。 8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9、确证化学结构或者组份的试验资料及文献资料。 10、质量研究工作的试验资料及文献资料。 11、药品标准及起草说明,并提供标准品或者对照品。 12、样品的检验报告书。 13、原料药、辅料的来源及质量标准、检验报告书。 14、药物稳定性研究的试验资料及文献资料。 15、直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16、药理毒理研究资料综述。
化学试剂的分类和分级
化学试剂的分类和分级 点击次数:567 发布时间:2011-6-1 化学试剂的种类很多,世界各国对化学试剂的分类和分级的标准不尽一致。 IUPAC(International Union of Pure and Applied Chemistry国际理论和应用化学联合会)对化学标准物质的分类为: A级:原子量标准。 B级:和A 级最接近的基准物质。 C级:含量为100+-0.02%的标准试剂 D级:含量为100+-0.05%的标准试剂 E级:以C级或D级为标准对比测定得到的纯度的试剂 化学试剂按用途可分为标准试剂,一般试剂,生化试剂等等。 我国习惯将相当于IUPAC 的C级、D级的试剂称为标准试剂。 优级纯,分析纯,化学纯是一般试剂的中文名称。 一级:即优级纯(GR,Guaranteed reagent);标签为深绿色,用于精密分析试验 二级:即分析纯(AR,Analytical reagent);标签为金光红,用于一般分析试验 三级:即化学纯(CP,Chemical pure)标签为中蓝,用于一般化学试验。 超高纯≥ 99.99% 优级纯≥ 99.8% 分析纯≥ 99.7% 化学纯≥ 99.5% 此外还有其他试剂中文名称,英文简称和英文全名: 化学纯试剂 CP Chemical pure 实验试剂 LR Laboratory reagent 纯 Pur Pure, Purum 特纯 EP Extra Pure
特纯 Puriss Purissimum 精制 Purif Puirfed 生化试剂 BC Biochemical 生物试剂 BR Biological reagent 生物染色剂 BS Biological stain 生物学用 FBP For biological purpose 组织培养用 (无简称) For tissue medium purpose 微生物用 FMB For microbiological 显微镜用 FMP For microscopic purpose 电子显微镜用 (无简称) For electron microscopy 涂镜用 FLB For lens blooming 工业用 Tech Technical grade 实习用 Pract Practical use 分析用 PA Pro analysis 精密分析用 SSG Super special grade 合成用 FS For synthesis 闪烁用 Scint For scintillation 电泳用 (无简称) For electrophoresis use 测折光率用 RI For refractive index 显色剂 (无简称) Developer 研究级 (无简称) Research grade 指示剂 Ind Indicator 络合指示剂 (无简称) Complexon indicator 荧光指示剂 (无简称) Fluorescene indicator 氧化还原指示剂 Redox Redox indicator 吸附指示剂 Adsorb Adsorption indicator 基准试剂 PT Primary reagent 光谱纯 SP Spectrum pure 光谱标准物质 SSS Spectrographic standard substance 分光纯 UV Ultra violet pure 原子吸收光谱 AAS Atomic absorption spectrum 红外吸收光谱 IR Infrared absorption spectrum 核磁共振光谱 NMR Nuclear magnetic resonance spectrum
