常见阳离子的检验方法

常见离子的检验方法
常见离子的检验方法 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。 8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色 二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。 5、 SO42-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色。②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO3)2试纸变黑。②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS 或CuS)。
常见离子检验
一、常见阳离子的检验 1、Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH 溶液。 2、Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。 4、Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。 8、NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。 9、H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。 二、常见阴离子的检验 1、OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水。 3、Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。 5、SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
高中化学常见离子的检验和物质的鉴别
(一)常见阳离子的检验方法 离子检验试剂实验步骤实验现象离子方程式 H+①酸度计 ②pH试纸 ③石蕊试 液 ①将酸度计的探头 浸泡在待测液中② 用玻璃棒蘸取少量 待测液滴到干燥的 pH试纸上③取样, 滴加石蕊试液 ①、②pH<7 ③石蕊变红 K+焰色反应①铂丝用盐酸洗涤 后在火焰上灼烧至 原火焰色②蘸取溶 液,放在火焰上灼 烧,观察火焰颜色。 浅紫色(通过蓝色 钴玻璃片观察钾 离子焰色) Na+焰色反应火焰分别呈黄色 NH4+NaOH溶液 (浓) 取少量待测溶液于 试管中,加入NaOH 浓溶液并加热,将 湿润红色石蕊试纸 置于试管口 加热,生成有刺激 性气味、使湿润红 色石蕊试纸变蓝 的气体 Ag+稀HNO3、稀 盐酸(或 NaCl) 取少量待测溶液于 试管中,加入稀HNO3 再加入稀盐酸(或 NaCl) 生成白色沉淀,不 溶于稀HNO3 Ag++Cl-=AgCl↓ Ba2+①稀H2SO4 或可溶性 硫酸盐溶 液②稀 HNO3 取少量待测溶液于 试管中,加入稀 H2SO4再加入稀HNO3 产生白色沉淀,且 沉淀不溶于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液 取少量待测溶液于 试管中,加入KSCN 溶液 变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚 取少量待测溶液于 试管中,加苯酚 溶液显紫色 淀粉KI溶 液 滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2加NaOH溶 液 加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测溶液 于试管中,加入 KSCN溶液,新制的 氯水 ①加入KSCN溶液 不显红色,加入少 量新制的氯水后, 立即显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3
离子检验总结归纳
精心整理常见离子的检验方法] (1) 阳离子检验试剂实验现象离子方程式 H+①紫色石蕊试液 ②橙色甲基橙试 液 ③锌片(或铁片) ①石蕊试液变红色 ②甲基橙试液变红色 ③有能燃烧的气体产生 Zn+2H+=Zn2++H2↑ K+焰色反应紫色(透过蓝色钴玻璃) Na+焰色反应黄色 NH4+NaOH溶液(浓) 加热,产生有刺激性气味、使 湿润红色石蕊试纸变蓝色的 气体 NH4++OH-=NH3↑+H2O Fe2+①NaOH溶液 ②新制的氯水 +KSCN溶液 ①生成白色沉淀,迅速变为灰 绿色,最后变成红褐色 ②滴加新制的氯水,溶液由浅 绿色变为黄色,再滴加KSCN 溶液,溶液呈红色 ①Fc2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ②2Fe2++C12=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe3+①NaOH溶液 ②KSCN溶液 ①生成红褐色沉淀 ②生成红色溶液 ①Fc3++3OH-=Fe(OH)3↓ ②Fe3++3SCN-=Fe(SCN)3 Cu2+①NaOH溶液 ②浓氨水 ①生成蓝色絮状沉淀,加热 后变成黑色 ②生成的蓝色沉淀,溶于过 量浓氨水中,呈深蓝色溶液 ①Cu2++2OH-=Cu(OH)2↓ Cu(OH)2CuO+H2O ②Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3·H2O= [Cu(NH3)4]2++2OH- +4H2O Ag+①盐酸或氯化物+ 稀HNO3 ②NaOH溶液 ③氨水 ①生成白色沉淀,白色沉淀不 溶于稀HNO3 ②生成白色沉淀,并迅速变为 棕黑色 ③生成白色沉淀,过量的氨 水使沉淀溶解 ①Ag++C1-=AgCl↓ ②Ag++OH-=AgOH↓ 2AgOH=Ag2O+H2O ③Ag++2NH3·H2O= AgOH↓+2NH4+ AgOH+2NH3·H2O= [Ag(NH3)2]++2H2O Al3+①氨水 ②NaOH溶液 ①产生白色沉淀 ②产生白色胶状沉淀,过量的 NaOH溶液使沉淀溶解 ①A13++3NH3·H2O= Al(OH)3↓+3NH4+ ②A13++3OH-=Al(OH)3↓ A1(OH)3+OH-=A1O2-+2H2O Mg2+NaOH溶液产生白色絮状沉淀,过量的 NaOH溶液不能使沉淀溶解 Mg2++2OH-=Mg(OH)2↓
中学常见离子检验方法与常见操作
一、常见离子的检验方法 1.常见阳离子的检验 2.常见阴离子的检验
1.检验溶液中含有F e3+的实验操作: 取少量溶液置于试管中,滴加几滴K S C N溶液,若溶液变红,则证明溶液中含有F e3+。2.检验溶液中含有F e2+的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液变红,则证明溶液中含有F e2+。 3.验证溶液中不含有铁元素的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液不变红,则证明溶液中不含+铁元素。 4.检验溶液中含有N H 4 +的实验操作是: 取少量溶液置于试管中,加入氢氧化钠后加热,将湿润的红色石蕊试纸放在试管口,若试纸 变蓝则证明溶液中含有N H 4+。
5.如何检验S O 4 2- 取少量溶液置于试管中,加入盐酸无现象,在加入B a C l 2 溶液产生白色沉淀则证明溶液 中有S O 4 2- 。 6.如何检验C l - 取少量溶液置于试管中,加入A g N O 3 溶液有白色沉淀产生,再加入H N O 3 后沉淀不 溶解则证明溶液中含有C l - 。 二、实验室常见操作 1. 气密性检验 (1)装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等) →描述现象→得出结论; (2)微热法检查的关键词是封闭、微热、气泡、水柱; (3)液差法的关键词是封闭、形成液差。 甲 ①实验开始前,某同学对甲实验装置进行了气密性检查,方法是: 关闭活塞,从长颈漏斗加水至浸没长颈漏斗的下端,继续加水形成一段水柱,一段时间水柱无变化则证明装置气密性良好。 ①实验开始前,某同学对乙实验装置进行了气密性检查,方法是: 关闭分液漏斗活塞,将导管插入水中用酒精灯微热烧瓶,导管口有气泡冒出,停止加热导管内出现一段水柱,证明气密性良好。 2.气体的收集 依据:根据气体的溶解性或密度 ① ② ③ ④ ⑤ ⑥
常见离子的检验方法
《生活中常见的化合物》初四化学专题复习 教学目标: 1、通过复习常见离子的检验方法,提高学生分析问题的能力。 2、进一步复习常见化肥的名称和作用、有机物相关知识。 3、培养科学的阅读、分析、解答问题的能力。 教学教程 一、常见离子的检验方法 是。 二、碳酸钙、氧化钙、氢氧化钙三种物质间的转化。 1、复习阅读P73页3 2.练习:1)《石灰吟》中的化学知识。古诗《石灰吟》“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间。”从化学视角看,它描述了“石灰”的生产使用过程。请你指出诗句中所涉及到的化学变化,并写出反应方程式。思考在系列变化中“石灰”的主要成份及俗称。 2)(2006?威海)某化工厂用石灰石制取碳酸钙,流程图为 (1)请写出上述方案中所依据反应的化学方程式 ①______ ___; ②_______ __; ③. (2)请你仍然用石灰石为原料,其他试剂任选,设计另外一种制备碳酸钙的实验方案,将你的实验方案用流程图的形式表示出来: 三、常见化肥的名称和作用。 1、阅读复习P73 2、练习
1)、(2015?兰州)下列属于复合肥的是() A.NH4Cl B.KCl C.CaHPO4 D.KNO3 2)、(2015?孝感)下列对某一主题的知识归纳,有错误的一组是() A、物质鉴别 硫酸钾和硫酸铵﹣﹣熟石灰混合研磨、闻气味 羊毛纤维与合成纤维﹣﹣灼烧、闻气味 B、物质除杂 盐酸中混有硫酸﹣﹣加适量氯化钡溶液过滤 木炭粉中混有铁粉﹣﹣磁铁吸引 C、安全知识电器着火﹣﹣切断电源,再用干粉灭火器灭火 居室装修﹣﹣常开窗通风,防止甲醛中毒 D、物质与微粒构成 水﹣﹣由氢原子和氧原子构成 氯化钠﹣﹣由钠离子和氯离子构成 A.A B.B C.C D.D 3)、(2015?x疆)古丽同学发观校园中的玫瑰花生长不茂盛,叶子发黄.需要施加下列肥料中的()A.K2CO3B.NH4Cl C.Ca(H2PO4) 4)、某化学兴趣小组进行了识别化肥的探究活动.他们对氯化铵、碳酸氢铵、硫酸钾、磷矿粉四种化肥的实验探究步骤如下: (1)步骤一:在装有四种化肥的试管中,分别加入少量稀盐酸,有气体产生的是_____. (2)步骤二:再分别取少量未区分出的另外三种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是_____.由此可知,在使用该类化肥时,要避免与_____(填“酸”或“碱”)性物质混合使用,以防降低肥效. 有同学提出,氯化铵、硫酸钾也可用下列某种物质进行区分,你认为可行的是_____. A.硝酸钡溶液;B.氯化钠溶液;C.酚酞溶液;D.稀盐酸. 四、生活中的有机物。 1、阅读复习P74 2、练习: 1)(2014.威海)8.人体就像一个复杂的“化学工厂”。在下列食物中,不能给这个“化学工厂”提供能量的是 A. 鸡蛋 B.花生油 C.矿泉水 D.馒头6.(2分)2)(2015?威海)在①糖类②油脂③蛋白质④维生素⑤纤维素⑥无机盐⑦水⑧二氧化碳中,属于人体必须 3)2008.威海8.人类从环境中摄取的物质,通过化学反应为生命活动提供物质和能量。下列物质是人的正常生命活动所必需的,且作为反应物参加了化学反应的是 ①蛋白质;②淀粉;③油脂;④维生素;⑤食盐;⑥水;⑦空气;⑧黄曲霉素;⑨二氧化铅;⑩纤维素。 A.①②③④⑤⑥⑦B.①②③④⑤⑥⑦⑧ C.①②③④⑤⑥⑦⑨D.①②③④⑤⑥⑦⑩ 4)2009.威海4.下列说法中,不正确的是 ( ) A.油脂和维生素是人体中重要的供能营养素 B.玻璃钢是日常生活中应用广泛的复合材料之一 C.氮肥、磷肥、钾肥及复合肥是农业生产中主要的化学肥料 D.浓硝酸、重金属盐等可使蛋白质发生化学变化,失去生理功能
氯离子的检验
氯离子的检验
————————————————————————————————作者: ————————————————————————————————日期: ?
赤峰学院本科生论文 题目:生活用水中氯离子的检验 姓名: 李久鹏 学号: 专业: 建筑环境与能源应用工程
摘要:生活用水常用氯化物做除污剂,生活用水出厂时必须对氯离子浓度做检验,过高的氯离子浓度的生活用水会影响水质引发疾病。 关键词:氯离子;水质影响;检测方法。 1概述 氯化物是水和废水中一种常见的无机阴离子。几乎所有天然水中都有氯离子存在,它的含量范围变化很大。在河流、湖泊、沼泽地区,氯离子含量一般较低,而在海水、盐湖及某些地下水中,含量可高达数十克/L。在人类的生存活动中,氯化物有很重要的生理作用及工业用途。正因为如此,在生活污水和工业废水中,均含有相当数量的氯离子。 若饮水中氯离子含量达到250mg/L,相应的阳离子为钠时,会感觉到咸味;水中氯化物含量高时,会损害金属管道和建筑物,并妨碍植物的生长。 附表1:氯离子水质标准 标准名称限值生活饮用水卫生标准(GB5749-2006) <25 0.0mg/L 地下水质量标准(G3838-200 <250.0mg/L 2) 2 方法选择 测定氯化物的方法较多,其中:离子色谱法是目前国内外最通用
的方法,简便快捷。硝酸银滴定法、硝酸汞滴定法所需仪器设备简单适合于清洁水测定,但硝酸汞滴定法适用的汞盐剧毒,因此这里不做推荐。电位滴定法和电极流动法适合于测定带色或污染水样,在污染源监测中使用较多。同时把电极法改为流通池测量,可保证电极的持久使用,并能提高测量精度。 (一)离子色谱法 (1)方法原理 本法利用离子交换的原理,连续对多种阴离子进行定性和定量分析。水样注入碳酸盐-碳酸氢盐溶液并流经系列的离子交换树脂,基于待测阴离子对低容量强碱性阴离子树脂(分离柱)的相对亲和力不同而彼此分开。被分开的阴离子,在流经强酸性阳离子树脂(抑制柱)室,被转换为高电导的酸型,碳酸盐-碳酸氢盐则转变成弱电导的碳酸(消除背景电导)。用电导检测器测量转变为相应酸型的阴离子,与标准进行比较,根据保留时间定性,峰高或峰面积定量。一次金阳可连续测定六种无机阴离子(-F 、-Cl 、-2NO 、-3NO 、-24HPO 和-24SO ) (2)干扰及消除 当水的负峰干扰F-或Cl -的测定时,可用于100ml 水样中加入1ml 淋洗贮备液来消除负峰的干扰。 保留时间相近的两种离子,因浓度相差太大而影响低浓度阴离子的测定时,可用加标的方法测定低浓度阴离子。 不被色谱柱保留或弱保留的阴离子干扰F -或C l-的测定。若这种共淋洗的现象显著,可改用弱淋洗液(0.005m ol /L 742O B Na )
高中化学常见离子检验方法一览表
高中化学常见离子检验 方法一览表 公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-
高中化学常见离子检验方法一览表(一)常见阳离子的检验方法
Fe3+KSCN溶 液 取少量待测溶 液于试管中, 加入KSCN溶液 变为血红色溶 液 Fe3++3SCN-=Fe(SCN) 3加苯酚 取少量待测溶 液于试管中, 加苯酚 溶液显紫色 淀粉KI 溶液 滴加淀粉KI溶 液 溶液显蓝色2Fe3++2I-=2Fe2++ I 2加NaOH 溶液 加NaOH溶 产生红褐色沉 淀 Fe3++3OH-=Fe(OH) 3 ↓ 离子检验试 剂 实验步骤实验现象离子方程式? Fe2+ ①KSCN 溶液, 新制的 氯水 ①取少量待测 溶液于试管 中,加入KSCN 溶液,新制的 氯水 ①加入KSCN 溶液不显红 色,加入少量 新制的氯水 后,立即显红 色。 2Fe2+ + Cl 2 2Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN) 3 ②加 NaOH溶 液 ②取少量待测 溶液于试管 中,加入NaOH 溶液并露置在 空气中 ②开始时生成 白色Fe(OH) 2 沉淀,迅速变 成灰绿色,最 后变成红褐色 Fe(OH) 3 沉 淀。 Fe2++2OH —=Fe(OH) 2 ↓ 4Fe(OH) 2 十 O 2 +2H 2 O=4Fe(OH) 3 ③(无 其它还 原性物 质如 SO 3 2-)酸 性高锰 酸钾 取少量待测溶 液于试管中, 加入酸性高锰 酸钾溶液 加入酸性高锰 酸钾溶液紫色 褪去 Al3+NaOH溶 液 取少量待测溶 液于试管中, 逐滴加入NaOH 溶液至过量 加入适量 NaOH溶液后 生成白色沉 淀,该沉淀溶 于过量NaOH 溶液中 Al3++3OH-=Al(OH) 3 ↓ Al(OH) 3 +OH-=AlO 2 -+ 2H 2 O
常见离子的检验方法
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH) 2 ],该沉淀不溶于过量 的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO 4 ),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH) 2 ],迅速变成灰 绿色,最终变成红褐色[Fe(OH) 3 ]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH) 2 ]。②插入铁片或锌片,有红色的铜析出。 8、 NH 4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH 3 ),该气体 能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na 2CO 3 溶液,产生无色气体;②能使紫色石蕊试液、pH 试纸变红。 10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色
二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO 3 溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO 3 溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO 3 溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。 ②加入氯水和淀粉试液,溶液变蓝。 5、 SO 4 2-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO 32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO 2 ),该 气体可使品红溶液褪色。②加入BaCl 2溶液,生成白色沉淀(BaSO 3 ),该沉淀可 溶于盐酸,产生无色、有刺激性气味的气体(SO 2 )。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO 3) 2 试纸变黑。②能与Pb(NO 3 ) 2 溶液或CuSO 4 溶液生成黑色的沉淀(PbS或 CuS)。 8、 CO 32-:①加入CaCl 2 或BaCl 2 溶液,生成白色沉淀(CaCO 3 或BaCO 3 ),将 沉淀溶于强酸,产生无色、无味的气体(CO 2 ),该气体能使澄清的石灰水变混 浊。②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向 原溶液中加入CaCl 2 溶液,产生白色沉淀。 9、 HCO 3 -:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变 浑浊;向原溶液中加入CaCl 2 溶液,无明显现象。 10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味 的气体(NO 2 )。 11、PO 43-:AgNO 3 溶液、稀硝酸生成黄色沉淀,加硝酸沉淀溶解
几种常见离子的检验
几种常见离子的检验 离 子 所用试剂方法现象化学方程式 Cl-AgNO3溶液和稀 HNO3 将AgNO3溶液滴入待测液中,再加稀 HNO3 生成白色沉淀.且不溶于稀HNO3 AgNO3+NaCl ==AgCl↓+N aNO3 SO4 2-BaCl2溶液和稀 盐酸 将稀盐酸滴入待测液中,再加BaCl2 溶液 滴加稀盐酸无现象,滴加 BaCl2 溶液生成白色沉淀,且沉淀不溶 于稀盐酸 BaCl2+Na2S O4==BaSO4 ↓+ +2NaCl CO3 2-盐酸(或HNO3) 和澄清石灰水 向待测液中加入盐酸(或HNO3).将产 生的气体通入澄清石灰水中 产生无色无味的气体,此气体能 使澄清的石灰水变浑浊 Na2CO3+2HC l==2NaCl+H 2O+ CO2↑ CO2+Ca(OH) 2==CaCO3↓ +H2O OH-酚酞试液、紫色 石蕊试液或红 色石蕊试纸 ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 ①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 —— H+紫色石蕊试液 或蓝色石蕊试 纸 ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 ①溶液变红 ②蓝色石蕊试纸变红 —— NH4 +浓NaOH溶液 将浓NaOH溶液加入待测液中,加热, 将湿润的红色石蕊试纸置于试管口 (或用玻璃棒蘸浓盐酸置于试管口) 放出有刺激性气味的气体,该气 体能使湿润的红色石蕊试纸变 蓝(或遇到浓盐酸产生大量白 烟) NH4Cl+NaOH NaCl+H2 O+NH3↑ Cu2NaOH溶液将NaOH溶液加入待测液中生成蓝色沉淀CuSO4+2NaO
离子检验 试剂
阳离子 铯离子Cs +: 四碘合铋酸钾(KBiI 4):与铯离子反应生成亮红色Cs 3[Bi 2I 9]沉淀,用于分析化学试剂,可鉴定铯离子。 铵根离子NH 4+: 碘化汞钾(K 2HgI 4): 与氨作用产生黄色或棕色(高浓度时)沉淀,是鉴定试样中氨的常用试剂。灵敏度大约为0.3μg NH 3/2μL 。检出限量:0.05μg 最低浓度:1μg·g -1(1ppm) NH 4++2[HgI 4]2-+4OH - →HgO·Hg(NH 2)I ↓+7I - +3H 2O 注:Fe 3+、Cr 3+、Co 2+、Ni 2+、Ag +、Hg 2+等离子能与奈斯勒试剂生成有色沉淀,大量S 2-的存在,使[HgI 4]2-分解析出HgS ↓。大量I -存在使反应向左进行,沉淀溶解。妨碍鉴定。 氢氧化钠(NaOH):在强碱性介质中 NH 4++NaOH →NH 3↑+H 2O NH 3使润湿的红色石蕊试纸变蓝或PH 试纸呈碱性反应 注:CN -+H 2O →OH-并加热 HCOO - +NH 3↑干扰鉴定 锂离子Li +: 高碘酸铁钾(K 2FeIO 6): 与锂离子反应生成黄色的KLi[FeIO 6]沉淀,用作分析化学中鉴定锂离子的试剂。可由铁离子与高碘酸根反应,调节pH 制得。 铁离子Fe 3+: 硫氰酸钾(KSCN): 遇Fe 3+ 生成血红色的硫氰酸铁络离子[Fe(SCN)n ]3-n (n=1—6),是检验 Fe 3+ 离子十分灵敏的方法,可以排除目前已知的一切其它金属离子的影响。 注: 1、在酸性溶液中进行,但不能用HNO 3。 2、F -、H 3PO 4、H 2C 2O 4、酒石酸、柠檬酸以及含有α - 或β -羟基的有机酸都能与Fe 3+形成稳定的配合物而干扰。溶液中若有大量汞盐,由于形成[Hg(SCN)4]2-而干扰,钴、镍、铬和铜盐因离子有色,或因与SCN -的反应产物的颜色而降低检出Fe 3+的灵敏度。 亚铁氰化钾(K 4[Fe(CN)6]): Fe 3+与亚铁氰化钾反应生成深蓝色沉淀。检出限量:0.05μg 最低浓度:1μg·g -1(1ppm) 4 Fe 3++3[Fe(CN)6]4-→Fe 4[Fe(CN)6]3↓ 注:1、 K 4[Fe(CN)6]不溶于强酸,但被强碱分解生成氢氧化物,故反应在酸性溶液中进行。 2、其他阳离子与试剂生成的有色化合物的颜色不及Fe 3+的鲜明,故可在其他离子存在时鉴定Fe 3+,如大量存在Cu 2+、Co 2+、Ni 2+等离子,也有干扰,分离后再作鉴定。 钾离子K +: 亚硝酸钴钠[Na 3Co(NO 2)6]: K +在中性或乙酸酸性条件下,与亚硝酸钴钠生成黄色结晶形沉
常见阳离子的检验方法
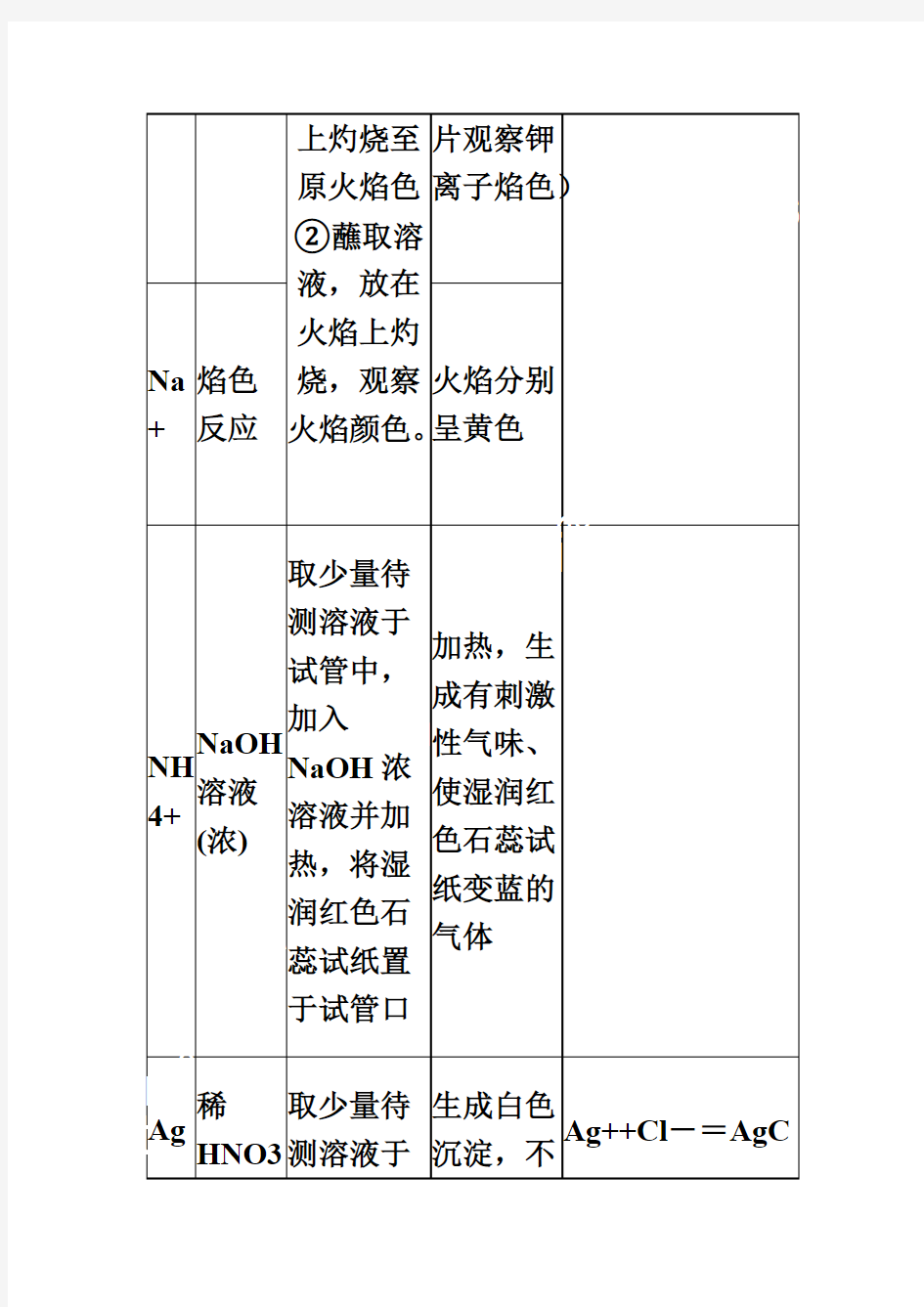
(一)常见阳离子的检验方法 离子 检验 试剂 实验步骤 实验现象 离子方程式 H+ ①酸度计 ②pH 试纸③石蕊试液 ①将酸度 计的探头 浸泡在待 测液中② 用玻璃棒蘸取少量待测液滴 到干燥的pH 试纸上③取样,滴 加石蕊试 液 、②pH<7 ③石蕊变红 K+ 焰色反应 ① 铂丝用盐酸洗涤后在火焰浅紫色(通过蓝色钴玻璃
上灼烧至原火焰色②蘸取溶液,放在火 焰上灼烧,观察火焰颜色。 片观察钾 离子焰 色) Na + 焰色反应 火焰分别呈黄色 NH 4+ NaOH 溶液(浓) 取少量待 测溶液于试管中,加入NaOH 浓溶液并加热,将湿润红色石蕊试纸置于试管口 加热,生 成有刺激 性气味、使湿润红色石蕊试 纸变蓝的 气体 Ag + 稀HNO3、稀盐酸(或取少量待 测溶液于试管中,加入稀生成白色沉淀,不溶于稀Ag++Cl -= AgCl↓
NaCl)H NO3再 加入稀盐 酸(或 NaCl) HNO3 Ba 2+ ①稀 H2SO 4或可 溶性 硫酸 盐溶 液②稀 HNO3 取少量待 测溶液于 试管中,加 入稀 H2SO4再 加入稀 HNO3 产生白色 沉淀,且 沉淀不溶 于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe 3+ KSCN 溶液 取少量待 测溶液于 试管中,加 入KSCN 溶液 变为血红 色溶液 Fe3++3SCN-= Fe(SCN)3 加苯 取少量待 测溶液于 溶液显紫
酚试管中,加 苯酚 色 淀粉KI溶液滴加淀粉 KI溶液 溶液显蓝 色 2Fe3++2I-= 2Fe2++ I2 加NaOH 溶液加NaOH 溶 产生红褐 色沉淀 Fe3++3OH-= Fe(OH)3↓ 离子检验 试剂 实验步骤实验现象离子方程式 Fe 2+ ①KSC N溶 液,新 制的 氯水 ①取少量 待测溶液 于试管中, 加入 KSCN溶 液,新制的 氯水 ①加入 KSCN溶 液不显红 色,加入 少量新制 的氯水 后,立即 2Fe2+ + Cl2#FormatImgI D_1# 2Fe3+ + 2Cl- Fe3++3SCN -=Fe(SCN)3
高中化学常见离子的检验和物质的鉴别之欧阳语创编
(一)常见阳离子的检验方法 时间:2021.03.01 创作:欧阳语 离子 检验试剂实验步骤实验现象离子方程式 H+①酸度计② pH试纸③石 蕊试液 ①将酸度 计的探头 浸泡在待 测液中② 用玻璃棒 蘸取少量 待测液滴 到干燥的 pH试纸 上③取 样,滴加 石蕊试液 ①、② pH<7 ③石蕊变 红 K+焰色反应①铂丝用 盐酸洗涤 后在火焰 上灼烧至 原火焰色 ②蘸取溶 液,放在 火焰上灼 烧,观察 火焰颜 色。 浅紫色 (通过蓝 色钴玻璃 片观察钾 离子焰 色) Na+焰色反应火焰分别呈黄色 NH4+NaOH溶液 (浓) 取少量待 测溶液于 试管中, 加入 NaOH浓 溶液并加 热,将湿 润红色石 蕊试纸置 于试管口 加热,生 成有刺激 性气味、 使湿润红 色石蕊试 纸变蓝的 气体 Ag+ 稀HNO3、 稀盐酸(或 NaCl) 取少量待 测溶液于 试管中, 生成白色 沉淀,不 溶于稀 Ag++Cl-=AgCl↓
加入稀 HNO3再 加入稀盐 酸(或NaCl) HNO3 Ba2+①稀H2SO4 或可溶性硫 酸盐溶液② 稀HNO3 取少量待 测溶液于 试管中, 加入稀 H2SO4再 加入稀 HNO3 产生白色 沉淀,且 沉淀不溶 于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液 取少量待 测溶液于 试管中, 加入 KSCN溶 液 变为血红 色溶液 Fe3++3SCN-=Fe(SCN)3加苯酚 取少量待 测溶液于 试管中, 加苯酚 溶液显紫 色 淀粉KI溶液 滴加淀粉 KI溶液 溶液显蓝 色 2Fe3++2I-=2Fe2++ I2 加NaOH溶 液 加NaOH 溶 产生红褐 色沉淀 Fe3++3OH-=Fe(OH)3↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量 待测溶液 于试管 中,加入 KSCN溶 液,新制 的氯水 ①加入 KSCN溶 液不显红 色,加入 少量新制 的氯水 后,立即 显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3 ②加NaOH 溶液 ②取少量 待测溶液 于试管 中,加入 NaOH溶 液并露置 在空气中 ②开始时 生成白色 Fe(OH)2 沉淀,迅 速变成灰 绿色,最 后变成红 褐色 Fe(OH)3 沉淀。 Fe2++2OH —=Fe(OH)2↓ 4Fe(OH)2十 O2+2H2O=4Fe(OH)3 ②加K3 [Fe(CN )6] 取少量待 测溶液于 试管中, 加入铁氰 化钾 特征性蓝 色沉淀
EDTA测定各种金属离子的方法 汇总
EDTA是目前最常用的测定各类金属离子的络合滴定剂,大部分金属离子可以直接滴定其含量,少部分由于动力学原因需要借助返滴定或置换滴定测定。下面我们将对于实验室常见的15种金属离子的EDTA滴定法进行整理。 金属离子如未特殊说明,默认配制成酸性的0.02 mol·L-1的标准溶液,每组测定取25.00 mL。准确加入意味着需要准确知道溶液的浓度和体积。 1. 镁、钙 稀释溶液体积至100 mL,加入10 mL氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入铬黑T(钙镁均可)或钙指示剂(仅限钙),滴定至终点溶液颜色由紫红色变为天蓝色。 注意事项:镁存在下测定钙时,用氢氧化钠调节pH使镁沉淀,此时应增加溶液体积,减少氢氧化镁沉淀对钙指示剂的吸附。 2. 铝(返滴定或置换滴定) 稀释溶液体积至100 mL,准确加入过量EDTA标准溶液,再加入15 mL醋酸缓冲溶液(60 g醋酸钠、2 mL冰乙酸定容至100 mL),加热煮沸3 min,加入PAN指示剂,用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。加入1~2 g氟化钠后煮沸,再用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。 注意事项:通常采用第二步置换滴定测得的结果。 3. 锰(II) 稀释溶液体积至100 mL,用氨水(1+1)调节pH到10,再加入25 mL 氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入K-B混合指示剂,滴定至终点溶液颜色由紫红色变为纯蓝色。 注意事项:高价锰可用盐酸羟胺还原后测定。 4. 铁(III) 用盐酸(1+1)调节pH到2,水浴加热至60℃,加入Ssal指示剂,滴定至终点溶液颜色由紫红色变为无色或淡黄色。 注意事项:二价铁可用过氧化氢氧化至三价后测定。pH需在1.3 ~ 2之间,太低络合不定量,太高铁离子水解沉淀。 5. 钴(II)(返滴定) 准确加入过量EDTA标准溶液,再加入10 mL醋酸缓冲溶液(20 g醋酸钠、2.6 mL冰乙酸定容至100 mL),稀释溶液体积至100 mL,加入PAN 或二甲酚橙,用Cu2+标准溶液或Zn2+标准溶液滴定至终点溶液颜色变为紫红色。 注意事项:钴(III)可用过氧化氢还原至钴(II)后测定。可尝试在80℃下直接滴定。
高中化学常见阴阳离子的检验方法
常见阳离子的检验方法 K+ 焰色反应①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。浅紫色(通过蓝色钴玻璃片观察钾离子焰色) Na+ 焰色反应火焰分别呈黄色 NH4+ NaOH溶液(浓) 向未知溶液中加入NaOH浓溶液并加热加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体离子 Ag+ ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。Ag++Cl-=AgCl↓ Ba2+ 稀H2SO4或可溶性硫酸盐溶液向未知溶液中加入稀H2SO4再加入稀HNO3 产生白色沉淀,且沉淀不溶于稀HNO3 Ba2++ SO42-=BaSO4↓ Fe3+ KSCN溶液向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚变为血红色溶液Fe3++3SCN-=Fe(SCN)3 加NaOH溶液产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓加苯酚溶液显紫色Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ Fe2+ ①加NaOH溶液①向未知溶液中加入NaOH溶液并露置在空气中①开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。Fe2++2OH —=Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3②KSCN溶液,新制的氯水②加入KSCN 溶液,新制的氯水②加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3 Al3+ 加NaOH溶液向未知溶液中加入NaOH溶液加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓ Cu2+ 浓氨水向未知溶液中加入浓氨水加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色Cu++2OH-=Cu(OH)2↓Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 常见阴离子的检验方法 CO32- ①BaCl2溶液、稀盐酸向未知溶液中加入BaCl2 溶液再向沉淀中加入稀盐酸。1.加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体Ba2++ CO32-=BaCO3↓BaCO3+2H+=Ba2++CO2↑+H2O ②稀盐酸、Ca(OH)2溶液加入稀盐酸后放出的气体通入使澄清的Ca(OH)2 溶液2.加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊CO32-+2H+=H2O+CO2↑Ca2++2OH-+CO2=CaCO3↓+H2O SO42- BaCl2溶液、稀硝酸或稀盐酸向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸。生成不溶于稀硝酸或稀盐酸的白色沉淀Ba2++ SO42-=BaSO4↓
常见阳离子的检验方法
常见阳离子的检验方法: 离 子 检验试剂实验步骤实验现象离子方程式 K+焰色反应①铂丝在火焰上灼烧至原火 焰色②蘸取溶液,放在火焰 上灼烧,观察火焰颜色。浅紫色(通过蓝色钴玻璃片 观察钾离子焰色) —— N a+ 焰色反应火焰分别呈黄色N H4 +NaOH溶液(浓) 向未知溶液中加入NaOH 浓溶液并加热 生成有刺激性气味、使湿润 红色石蕊试纸变蓝的气体 NH4++OH-=NH3↑+H 2 O Al 3+加NaOH溶液 向未知溶液中加入NaOH 溶液 加入适量NaOH溶液后生 成白色沉淀,该沉淀溶于过 量NaOH溶液中 Al3++3OH-=Al(OH)3↓ Cu 2+浓氨水向未知溶液中加入浓氨水 加入适量浓氨水后生成蓝色 沉淀,该沉淀溶于过量浓氨 水中,溶液呈深蓝色 Cu2++2OH-=Cu(OH) 2 ↓ Cu(OH)2+4NH 3 ·H2O=[Cu(NH3)4]2++ 2OH-+4H2O A g+①稀盐酸或可 溶性盐酸盐② 稀HNO3③氨 向未知溶液中加入稀盐酸再 加入稀HNO3向过滤出的沉 淀中加氨水 生成白色沉淀,不溶于稀H NO3,但溶于氨水,生成[A g(NH3)2]+ Ag++Cl-=AgCl↓
水 Ba 2+稀H2SO4或可 溶性酸盐溶液 向未知溶液中加入稀H2SO4 再加入稀HNO3 产生白色沉淀,且沉淀不溶 于稀HNO3 Ba2++SO42-=BaSO4↓ Fe 3+KSCN溶液 向未知溶液中加入KSCN溶 液或加NaOH溶液或加苯 酚 变为血红色溶液 Fe3++3SCN-=Fe(SC N)3 加NaOH溶液产生红褐色沉淀 Fe3++3OH-=Fe(OH)3 ↓ 加苯酚溶液显紫色 Fe3++6C6H6OH→[Fe (C6H5O)]3-+6H+ Fe 2+①加NaOH溶 液 向未知溶液中加入NaOH 溶液并露置在空气中 开始时生成白色Fe(OH)2沉 淀,迅速变成灰绿色,最后 变成红褐色Fe(OH)3沉淀。 Fe2++2OH-=Fe(OH)2 ↓4Fe(OH)2+O2+2 H2O=4Fe(OH)3 ②KMnO4 (H+) 溶液 向未知溶液中加入KMnO4 (H+)溶液 KMnO4(H+)紫色褪去 MnO4-+5Fe2++8H+= 5Fe3++Mn2++4H2O ③K3[Fe(CN)6] 向未知溶液中加入K3[Fe(C N)6]溶液 出现蓝色Fe3[Fe(CN)6]2沉 淀 3Fe2++2[Fe(CN)6]-=F e3[Fe(CN)6]2↓ ④KSCN溶液, 新制的氯水 加入KSCN溶液,新制的氯 水 加入KSCN溶液不显红色, 加入少量新制的氯水后,立 即显红色。 2Fe2++Cl2=2Fe3++2C l-Fe3++3SCN-=Fe(SC N)3
化学实验3——常见离子的检验方法
化学实验3——常见物质的检验方法 一.常见阳离子的检验方法 ⑴Na+、K+:用干净的铂丝蘸取待测物质少许,放在酒精灯上灼烧,火焰呈黄色,说明有钠存在;透过蓝色的钴玻璃,火焰呈紫色,说明有钾离子存在。 ⑵Al3+:加入氢氧化钠溶液,生成白色絮状沉淀,该沉淀能溶于盐酸与氢氧化钠溶液,但不溶于氨水。 ⑶Ag+:加入稀盐酸,生成白色沉淀,该白色沉淀不溶于稀硝酸 ⑷Fe2+:加入KSCN溶液,无现象,再加入氯水,溶液变血红色 ⑸Fe3+:加入KSCN溶液,溶液变血红色 ⑹NH4+:加入浓的氢氧化钠溶液,产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝。 二.常见阴离子的检验: ⑴Cl-:加入硝酸银溶液反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水。 ⑵I-:能与硝酸银反应,生成黄色沉淀,黄色沉淀不溶于稀硝酸 ⑶SO42-:加入BaCl2溶液反应,生成白色沉淀,白色沉淀不溶于稀盐酸 ⑷SO32-:溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色 ⑸CO32-:能与CaCl2溶液反应,生成白色的CaCO3沉淀,该沉淀溶于盐酸,生成无色无味、能使澄清石灰水变浑浊的CO2气体。 ⑹HCO3-:加盐酸,产生无色无味,能使澄清的石灰水变浑浊的气体;向原溶液加入氯化钙,无明显现象。 三.常见气体的检验方法 1.CO2:将气体分别通入澄清的石灰水和品红溶液中,如果澄清的石灰水变浑浊,且品红不褪色,则通入的气体是CO2。 2.NH3:用润湿的红色石蕊试纸靠近待检气体的瓶口,如果试纸由红色变为蓝色,则证明待检气体是NH3。 3.SO2:将待检气体通入品红溶液中,如果品红溶液褪色,且受热后又恢复原色,则证明待检气体是SO2。
高中化学之常见离子的检验知识点
高中化学之常见离子的检验知识点 Ⅰ常见阳离子的检验: (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。(2)Na+、K+用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。 (3)Ba2+能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 (4)Mg2+能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 (5)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 (6)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。(7)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。(8)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl- (9)Fe3+能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。(10)Cu2+蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH
溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 Ⅱ常见阴离子的检验: (1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 (2)Cl-能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。 (3)Br-能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。 (4)I-能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。 (5)SO42-能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。 (6)SO32-浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。 (7)S2-能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。(8)CO32-能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水
