第七章 流体地球化学

第七章流体地球化学
第一节地壳中的流体
一、流体的定义
我们采纳Fyfe(1978)[6]的建议,用流变学的术语,并从地质情况来进行考虑如果一个体系在应力或外力的作用下能发生流动或变形,并且与周围物质处于相对平衡,我们就把它叫作流体。换句话来说,当一个应力作用到一个物体上时,这个物体会改变它的大小、形状、组成和位置。
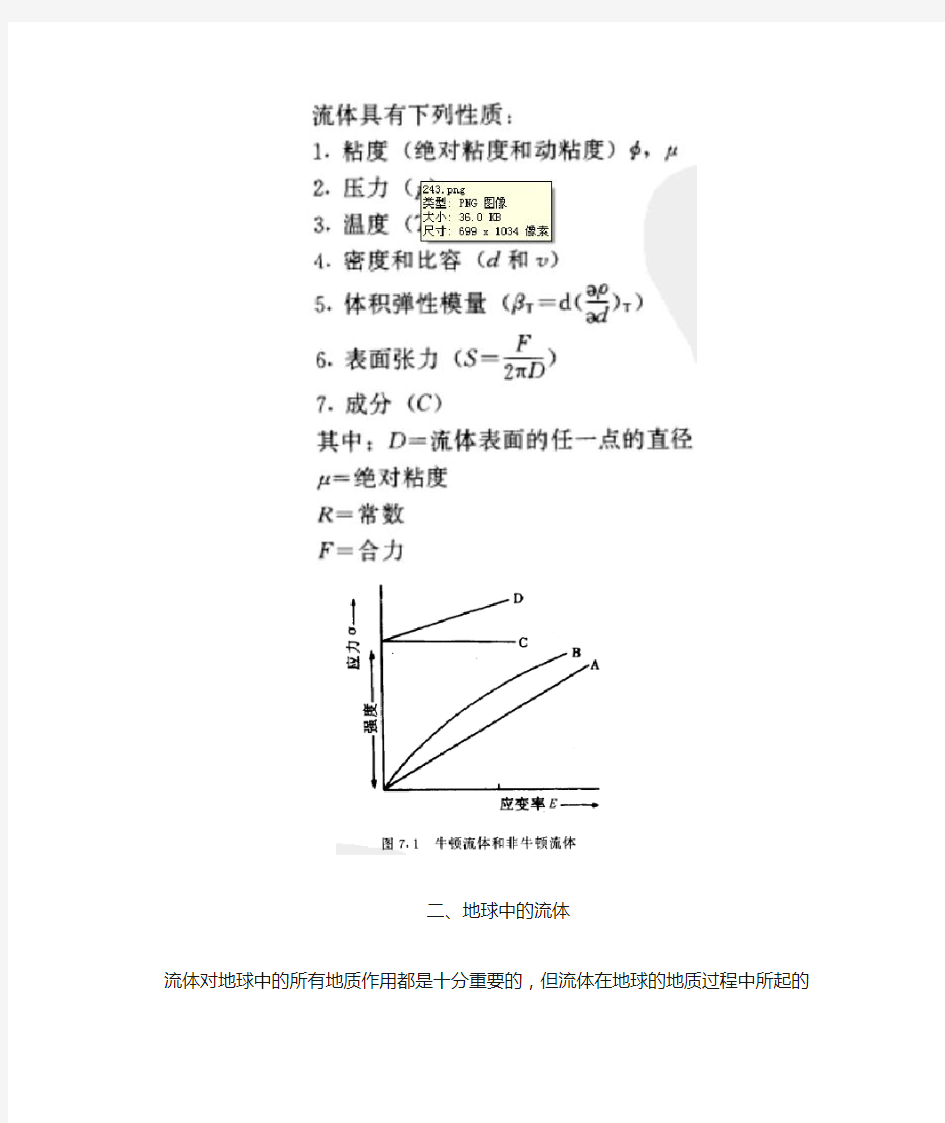
按照流变学的定义,流体是由应力和应望率所确定的。对于地球中的物体来说当一个压力作用到该物体时,根据其应变率的不同可以分为牛顿流体(图7.1曲线A)和非牛顿流体(图7.1曲线B)。为对比起见,也在图7.1中列出了固体的特征曲线(C和D)。
二、地球中的流体
流体对地球中的所有地质作用都是十分重要的,但流体在地球的地质过程中所起的全部作用至今并不完全清楚。地壳中的流体的总质量,我们可以从以下数据中估计出来。现在的海洋质量为1.4×1024g,地壳的平均质量是2.3×l025g。如果我们假定地壳中的含水量与海水的质量相似的话,那么地壳中的含水量也是1.4×1024g,约占地壳总质量(1.4×1024/2.3×l025)的6%左右。大多数人的估计是地壳中流体的量约占总质量的3%-6%,如果占3%,则为6.9×1023g。地幅中流体的含量,有人认为约占地慢的0.03%,即为1.2×1024g 与地壳中的含水量相当(地慢总质量为4×l027g)。海水、地壳中、地慢中流体的质量是十分相近的。现代板块的研究告诉我们,当板块俯冲时,把地表水带到了地下数公里,甚至数十公里的地方,这些水(至少是一部分)又通过循环回到了地表,其中另一部分可能在地下深处被固定在含水的矿物如滑石、金云母、角闪石以及其它相中。从上面的叙述我们可知海水(水圈)、地壳和地慢中的流体处于相对平衡状态,并且又是互相循环的。
地球中主要有以下几种流体:
1.岩浆:各种成分的岩浆,从酸性到超基性,以及碱性岩浆,主要是一种硅酸盐熔融体,含H2O一般<5%。
2.以H2O为主的流体,包括:
(1)岩浆水
(2)变质水
(3)同生水
(4)海水
(5)卤水、
(6)地表水
(7)地热水等
3.以碳氢化合物为主的流体:石油、天然气等。
4.存在于矿物和岩石中的挥发份,包括:
(1)H2O
(2)CO2
(3)卤素
(4)碳
(5)其它(如O2、H2、N2、H2S、惰性气体等)
5.受到应力作用而发生形变的矿物和岩石(从品格变形到大规模的岩石形变和位
以水为主的流体显然是最主要部分,尤其是岩浆水、变质水、同生水、卤水、地热水等是十分重要的,因为它们与成矿(或成矿流体)密切相关。
三、地壳的去流体作用——流体的形成
1.沉积物的“去流体”作用
沉积物逐渐被埋藏到一定厚度(或者说沉积到一定厚度)时,有一个上覆的压力存在。这个压力使得沉积物中最易移动的物质——流体,从沉积物中排出去,这样使得流体集中起来。比如页岩在压实作用之前大约由45%的水和55%的矿物碎屑组成,经压实作用之后,原来所含的水大约失去75%左右,剩下的25%则被封闭在页岩的孔隙中。
Magara(1978)[10]在总结沉积物脱水过程中水的移动情况时指出:
1.沉积岩的去水作用在沉积盆地的任何部分(浅处或深处,中心或四周)均可发生。
2.脱水过程中流体的移动方向,如果存在有一系列的沉积物的话(从砂岩至粘土),是从页岩或粘土向砂岩中移动,或者是向盆地的可渗透的地层方向移动。
3.从沉积盆地本身来考虑,脱水过程中流体的移动方向是从盆地的中心部分向边缘部分移动,或者是从较深的部位向相对浅的部位移动。
4.移出水的量与沉积物的量成一定比例,并且常与地质事件相关连。
5.去水作用与压力有关。具体来说是与上覆负荷的压力和流体静压力有关,只有当上覆负荷的压力大于流体静压力时,这种去水作用方能发生。
6.去水作用也与沉积盆地的构造作用有关。例如当沉积物中有裂隙产生时,水很快沿裂隙排出。
沉积物压实作用与地下的物理化学条件、深度和孔隙库有关,其中压力(即上覆厚度)起了很大的作用,这时存在的压力主要有两个:静岩压力(P s)和岩石中流体的压力(P f)。在大多数情况下P s>P f,这时压实作用进行得很好,如果P s=P f,则压实作用处于平衡状态下,如果P f稍大于P s,则压实作用就很难进行了。
除了压力这个因素外,孔隙度也是反映压实作用情况的最有用的因素,因为当时的压力已很难测到,在压实过程中,孔隙度与深度成反比,图7.2表明孔隙度与深度的关从上面的叙述中可知,在沉积物的压实成岩作用中要放出很多流体,这是地壳中流体的一个来源。
2.变质作用放出的流体
在变质作用中,原先固定在岩石中的挥发份因变质作用而得以释放出来形成变质流体。现举例如下:
这些变质反应,均可放出H20、C02等流体,而这些流体又与岩石、矿物起反应,从而形成新的变质矿物。关于这部分我们在后面详述。
3.岩浆作用所放出的热液
据研究,岩浆中最多大约含有5%-6%的H2O、CO2和其它挥发份。当岩浆上升,温度和压力也随之下降,这时它们所含的流体就会释放出来,这就是我们通常所说的岩浆热液。
在地壳中进行的三大地质作用:沉积作用、变质作用和岩浆作用,均可形成地壳中
的流体,根据目前我们所掌握的知识,显然从沉积作用所放出的流体最多,而且分布广
泛。
4.海水、天水和地下水
水圈中的水(包括海水、天水和地下水)也是地壳中流体的重要来源,地壳中的水还与大气圈和生物圈处于相对平衡的状态。
5.构造作用对流体的影响
地壳中的流体并不是处于静止的状态,而是处在一个构造作用的环境中。近年来地质学的很大进展在于在大洋深处发现不少热泉、热点、黑烟囱和硫化物矿床。这些都是流体作用的地点和结果,板块构造作用不但解释了地壳的结构构造,同时也为地壳中流体在受到构造作用时所产生的迁移、循环和相互作用提供了理论依据。除了板块构造外,许多断裂和裂隙也是流体迁移的通道。例如在古老变质岩地区的剪切裂隙带(shearzone)是许多变质流体的通道,在许多沉积岩中,其层间常常是很好的流体通道,岩石的渗透率或孔隙度常是决定其流动的重要因素,我们常说的透水层或夹水层(不透水层)就包含着流体流动这个因素。
Fyfe(1978)[5]认为由于流体的流动所产生的流体压力也可以使岩石发生变形,产生各种弯曲的断裂甚至光滑的曲面。当这些断裂形成之后,流体又可以沿这些裂隙发生移动。
四、地壳中流体的分类
地壳中的流体可按其化学成分、产状及成因分类。
1.化学成分分类
地壳中流体的化学成分分类包括:
(1)岩浆-硅酸盐流体
(2)H2O
(3)H2O-NaCl,这里以NaCl代表溶于水中的所有盐类
(4)H2O-NaCl-C02
(5)有机流体如石油、天然气等
2.产状和成因分类
(1)岩浆热液
(2)变质流体
(3)海水
(4)热卤水(包括地热水和同生水)
(5)地下水(大气降水)
(6)石油和天然气
(7)硅酸盐熔浆
下面我们把几种流体作一简述:
(1)大洋水:大洋水包括大洋及其邻近的且相连的大海中的水,其成分见表7.1。
(2)大气降水:由大气降水作用来的水(不管是哪个年代降的水)包括雨水、雪、冰、河水(其成分见表7.1)、湖水以及存在于地壳浅处的地下水。这种大气降水是由于水圈与大气圈
相互循环作用的产物。
(3)同生水:指当沉积作用时存在于空隙和孔隙中的水。同生水也称地层水,是在沉积作用的同时捕获的水。大多数情况下是一种古海水,当然这种古海水是与地层同一成固的,且与其处于平衡状态。但由于水岩相互作用,其成分与古海水大不相同。
(4)地层水:我们把在地层的孔隙或层间存在的水统称为地层水,不管其成因和年代如何,也就是说地层水包括了同生水和后来进入地层的水。
(5)变质水:与变质岩呈平衡的或者在变质岩脱水作用时放出的水,叫做变质水。
(6)初始水:在地球形成时存在的、或者来自地幅、地核的水,并且从未与现在地球的水圈相互作用过,这种水叫初始水。
(7)热液水:指任何成因或来源的热的水溶液,如果我们能把热液中的水的来源搞清楚,那么根据其主要来源又可把热液分为岩浆热液、海水热液、热卤水、地热水等。
油田水的成分见表7.2。美国加利福尼亚州Salton海的卤水的成分见表7.3。
(8)外来水:对现在所存在的体系或环境是外来的任何一种水称之为外来水。例如在蛇绿岩套中的热海水即为外来水,又如在冲断层发生时,一种成因未知的外来水可以通过冲断层的下盘迁移到冲断层的上盘,并且与其流过和容纳这种水的矿物和岩石发生相互作用,这种水我们把它叫做外来水。
第二节流体和岩石的相互作用
流体和岩石的相互作用是指在一定的温度、压力条件下流体与岩石中的矿物起反应,使原来的矿物组合转变为另一组新的、在新的条件下更加稳定的矿物。在这一过程中流体的成分也随之改变,并成为与这组新矿物相平衡的流体。换句话说,通过两者的相互作用,不仅使岩石的矿物组合发生了变化,而且也改变了原来流体的成分。流体与矿物—岩石的相互作用的研究是最近10到20年间发展起来的,并且召开过8次国际性的会议,发表了许多论文和著作,下面我们举几个例子来说明这个问题。
一、太古宙绿岩带成矿流体与岩石的相互作用简述
在加拿大的Abitibi太古宙绿岩带,产出许多金矿,形成金矿的成矿流体沿剪切带上升,与其两侧的岩石发生了反应,形成了典型的蚀变带,包括铁白云石化、钠长石化、绿云母(含Cr或V的云母)及黄铁矿化。剪切带的围岩为镁铁质火山岩和侵入岩,流体(H2O—CO2—NaCl)与其发生相互作用,使斜长石、辉石和钠长石发生分解,在蚀变作用开始时形成铁白云石、方解石和绿泥石,再继续反应会形成铁白云石—绿泥石和绢云母,最后生成绿云母。见表7.4。
二、海水—玄武岩的相互作用
海水的盐分主要是NaCl,水的主要供给源是大气降水(雨水、河水),显然这两者在盐度上有区别,在成分上和所含的离子种类上也有所不同(表7.1)。现代海水的成分相当稳定,至少其中一些元素(Na、Mg、Ca、K、Cl)的比例是恒定的。研究表明,不仅现代海水的成分是稳定的,而且在过去的500Ma年中也是十分稳定的,显然,在海水中发生下一些重要的缓冲反应,这些反应在长期的地质过程中一直持续着,并且使海水成分相对稳定。但是海水也与其中的岩石进行着相互作用。
图7.3所示为玄武岩与海水的相互作用,分为以下四种情况:
1高温(>100℃) 低的海水通量扩张中心的轴部
2中温中等海水通量扩张中心的两侧
3低温低的海水通量位于海底表面的玄武岩
4低温高海水通量基底玄武岩表面
在这种相互作用中,海水和玄武岩中的元素发生了交换。玄武岩从海水中汲取Mg,其数量级为l-10g/100ml。Ca则从玄武岩淋滤出来进入海水。K、Si、B和Li也从玄武岩中淋滤出来,部分进入海水,而绝大部分则就地沉淀变成新的矿物。其它元素如Na、Fe、Mn、Sr、Ba、Co、Cr、Ni则视不同的矿物共生组合而发生变化。实验表明,Na的得失还与水的流量有关,当水/岩石比小于10时,Na则进入岩石,而大于lO时则进入海水。
表7.5列出了玄武岩的变质相及有关矿物。蚀变形成的矿物组合还和海水/岩石比密切相关。根据海底观察、岩芯研究和实验,提出海水流量与矿物共生组合的关系:水/岩石矿物共生组合
0-2 绿泥石+钠长石+绿帘石+阳起石
2-35 绿泥石+钠长石+绿帘石+阳起石+石英
35-50 绿泥石+钠长石+石英
>50 绿泥石+石英
即海水的流量增加时,石英出现,绿帘石、阳起石和钠长石依次消失。
玄武岩与海水这种相互作用,不仅在海底的表面,而且在海底较深部的玄武岩也是如此。表7.6和7.7列出了大西洋中4l 7A和418A观察点处的岩芯中得出的结果。在4l ‘7A和418A处的岩石年龄为H oMa,样品取自600m处的钻孔。表中所给出的结果是从100m
到600m处的样品。从表中可知岩石失去5i、Mg、Ca,得到K、P、HzO和COz以及象Rb、Ba、B、L5这些元素。在海底打钻600m深处的玄武岩是属于低温和水流量较小的地方,即属于深部的基底玄武岩。表7.8列出了温度不同时海水与玄武岩相互交换的结果。在低温时岩石净增元素多,但在高温时岩石净增的只有Mg和HzO,而迁移到海水中去的元素猛增,表明温度高有利于元素从玄武岩中迁移到海水中去。如果考虑到玄武岩与海水作用的整个温度范围,则可以看出:岩石失去的是Si、Ca、Ba、Li、Fe、Mn、Cu、Ni和Zn,而得到的是MglK、B、Rb、H20、Cs和U、Na。
三、花岗岩与地下水的相互作用
很多学者对花岗岩与水的相互作用做过研究。W.M.刚munds等人(1985)研究了英国康瓦尔(Cornwall)的花岗岩与地下水的反应,该地区花岗岩中的地下水是一种矿化度高达19.3g/1的卤水,其温度为52℃左右。W.M.Edmunds经过地质观察和实验研究,认为这种卤水是由于热的“干”花岗岩与地下水起作用而形成的。他的实验是这样进行的:样品是从花岗岩中打钻的岩芯,取自地下深处2000m处的花岗岩,把这种岩石加热,用地下水与其进行循环(1500h,即二个月左右),然后对花岗岩和地下水分别进行鉴定和分析。结果发现地下水和花岗岩中的斜长石和黑云母进行了相互作用,其方程如下:K z(Mg,Fe)‘(Fe,Al,U)2(Sie02。)(OH)z(F,C1)z十H zO十12H’
一A1zSi zOs(OH)‘十4HdSio‘十2K’5(Nao.s,Cao.2)(A11.zSi z.:O:)十6H十十19H20
一3A12Si 20 s(OH)‘十4Na4十Ca”十8H‘Sio‘
“..t....●量夕rt r.H—.h.l r—ld 』“门11·—4蜂LU U』
在Carnmenellis及其邻区,分布着四个正在开采的锡矿,均产在Carnmenems花岗岩中。在这四个锡矿的不同深度取地下热水样,同时也对地表浅处的地下水进行取样,然后进行对比(表7.9)。从表中可知这四个开采矿区的地下热水与浅部的地下水相比,有以下特
点:
1.深部的地下水(240一690m深处)实际上已是一种热卤水,其总的矿化度比浅部地下水高出2—260倍。
2,相比之下,Na’无论从含量上,还是从所占百分比上均有明显的增加,另外Ca2J、K’、U’、Mg”、Srz’等阳离子也有明显的增加。
3.阴离子Cl—含量大大增加,其它阴离子如HCO:—、NO:—、SOZ—、F—也有所增加。
4,金属离子如Fe”(Fe:’)、Mn z’的含量有很大增加,其它金属离子如Cu2L、N 伊也有所增加。这种情况与我们上面讲的Edmunds等人的实验结果十分相似。但我们列出的反应毕竟是简单的化学式,而实际情况要复杂得多。
这种结果也可用实验来证明,一个干的热的花岗岩经过了1008到4032h的水循环(将近半年),其实验后水的分析结果表明,其总的矿化度比原来打进去的水增加了1.8—1.9倍,其pH值增加了2个单位(从7到9)。从组分上的增减来看,Na、认、C1、S01—、H凹:—、Si和B的含量增加,即这些成分进入溶液,Ca、K、Mg的含量减少,即这些元素结合到矿物中。
第三节1.气体的状态方程理想气体的状态方程为:流体的物理化学性质表征流体的状态方程尸V=M只T式中尸:压力;V:摩尔体积;只:气体常数;T:绝对温度;”:摩尔数(m01)当”=lg寸,尸V=只7
实际气体的状态方程(即范德瓦耳斯方程)则是考虑到实际气体分子占有一定体积
和分子之间存在着相互作用力这两个因素。对上述理想气体方程作适当修正得出实际气体的
状态方程:
(尸十“/V’)(V一6)=22RT当”=lg寸,尸=及7’/(V一仑)一“/V’式中“为气体分子间相互作用力的一种度量;6为气体分子所占体积的一种度量。
范德瓦耳斯方程虽然比理想气体方程更接近实际情况,但对于以水为主的流体来说仍有很大的差距,因而我们介绍一下适用于流体的方程。
2.流体的状态方程
许多学者提出了流体的状态方程,其中以修正的Redlich—Kwong方程应用最普遍(简称MRK方程):
,—上j:二———上5:2———
‘V一是/了[V(V十6)]式中“,6的含义与范德瓦耳斯方程中的含义相同。当我们知道了流体所属的体系之后,就可以根据MRK方程去求出这个体系的尸、1/、7参数,以及密度、盐度、各组分的摩尔数等。体系及相图
HzO普遍存在于地球上,特别是水圈、大气圈和岩石圈中,并且积极参与各种地质作用,特别是成矿作用中,HzO是最重要的溶剂和搬运者。
图7.4是水的尸—V—‘相图。图7.5是水的卜V相图。图7.6是水的尸—‘相图。从图中可以看出:H20有三相,即气相、液相和固相。H 20的三相点的温度为o.015℃(273.16K),压
力为o.o0603bar;临界点的温度为374.15℃,临界压力为221.2bar。从图7.5和图7.6我们
可以根据两个常数(尸,‘或‘,V)求出另外的参数4、V、尸和/uzo。一般来说我们是用体系的户—v—*来表示整个体系,但这三度空间的图看起来不方便,所以我们常常作出它的切面团,如尸人尸—1/、c—1/图,这样就比较容易表达。
(2)C02
与H20不同,C02分子具有四极矩和较大的体积,在化学上显弱酸性。通常各种离子化合物在C02流体中的溶解度很低,但一些碳氢化合物(如甲烷、乙烷)则可以以任何先例
与CO z相混合。图7.7和图7.8是C02的尸—‘相图。从图中可知COz的三相点温度为一56.6℃,压力小于10bar;t陆界点温度为十31.1℃,压力为73.6b脏。与HzO的相图一样,如果知道尸、‘、V中的任意两个参数,则可以从图中求出第三个参数,这为了解COz流体在地质过程中的行为提供了理论基础。2.二元体系(1)HzO—NaCl体系
H 20—NaCl体系是地质过程中最的常见的流体体系之一。虽然在各种地质条件下流体不止含有NaCl一种盐,但从流体包裹体的研究,对地下水、地下卤水、油田水和地热水的研究都表明:在大多数情况下NaCl是最主要的一种盐类。另外一方面,经过很多研究者的努力,H20—NaCl体系的大量尸—V—f—X实验资料已经获得,尤其是最近几年来,人工包裹体的研究给出了相当完整的系统相图,这就使得这个体系在流体研究中显得格外重
要。另外在成矿流体研究中相当重要的一个方面——流体包裹体的研究中,均以此体系来求得成矿流体的盐度。
A.一般性质
在室温时NaCl在水中的溶解度小于27wt%,但是随温度升高,NaCl在H20中的溶解度增加,直到高温时NaCl与HzO构成连续的混合物。许多人测定了温度高达500℃时,沿液—气平衡曲线NaCl在H20中的溶解度。Sour比jan和Kennedy(1962)报道了压力直到1240bar,温度从250一700℃范围内该二元系的液—气两相区和气—固区中NaCl的溶解度。ChoM在1986年则作出2.54kbar和温度为1000C时NaCl的溶解度。图7.9列出了H2()—NaCl体系的严—‘—X图。图7。10是该体系的低温部分的‘—X剖面。
H20—NaCl体系是有一个中间化合物的二元共结系。中间化合物是NaCl.2H,O,即石盐水化物。它在低于0.1℃时通过NaCl与H zo反应生成;当温度)o.1℃时分解(不均匀溶化),图中由B点表示,因此在B点,石盐、石盐水化物、液相和气相四相共存。BC是一条含饱和NaCl溶液十气相十石盐的单变曲线。在快速降温时,石盐水化物来不及在B点形成,于是这条单变曲线将与单变曲线OE(NaCl溶液十气相十冰)汇聚到一个亚稳共结点(冰十石盐十液相十气相)A;而在稳定平衡时,它被共结点E所取代,在E点冰十石盐水化物十液相十气相四相共存。
所有浓度为o一61.9%NaCl的水溶液在低于一20.8℃时形成冰和石盐水化物两种固相,它们与蒸气共存。升温到共结点时,两种固相开始溶化,产生具有共结点组成的液相,这时冰、石盐水化物、液相和气相共存,温度不变。对于H20—NaCl体系来说,这个初熔温度可作为鉴别特征c只有当两种固相之一熔化完毕、温度才继续上升,对于浓度小于23.3wt%NaCt的水溶液,首先熔完的是NaCl·2H 20,随后温度上升,冰也不断熔化,溶液的组成将沿EO线(冰十L十V单变曲线)演变。冰的最后熔化温度对应于ED线上的x点,即浓度为X的溶液的冰点。因此,如果知道了冰最后熔化的温度,即冰点,就可以从该图确定H20—NaCl体系中的NaCl的浓度,或者更精确地按照R.W.Potter等人(1978)提出的公式计算NaCl含量:
Ws=o.oo十1.769580——4.2384×10—“O’十5.2778×lo—‘O。土o.028式中trs是溶液中的Nacl重量百分比,o是冰点下降。
B.高温时体系的相关系
随着流体中NaCl含量增加,临界温度和压力从纯H zO的374℃和22lbar逐渐上升。例如,溶液中NaCl含量为5%、11.5%、l 9.6%、24,8%和26.4%时,临界温度分别上升至lJ425,C、500。C、600‘C、675。C和700℃,而I临界压力分另g为356bar、590bar、922bar、1163bar和1237bar。随着NaCl含量继续增加,临界温度还要升高,但临界压力在达到某最高点后便逐渐下降。
Walther(1984)综合实验资料作出了H zO—NaCl体系的‘—J图(图7.11)。因此我们知道了温度和压力,便可以从‘—d图中的等压线上确定共存气相和液相的盐度和比容(密度)。反过来,如果通过包裹体冷冻法或通过加热测定石盐子矿物的熔化温度而确定了流体的盐度,又测定了均一温度,便能从这些图中查到均一时流体的密度(比容)和压力。
流体在管内的流动阻力
2.2 流体在管内的流动阻力 本节重点:牛顿粘性定律、层流与湍流的比较。 难点: 边界层与层流内层。 2.2.1 牛顿粘性定律与流体的粘度 1. 流体的粘性 流体的典型特征是具有流动性,但不同流体的流动性能不同,这主要是因为流体内部质点间作相对运动时存在不同的内摩擦力。这种表明流体流动时产生内摩擦力的特性称为粘性。粘性是流动性的反面,流体的粘性越大,其流动性越小。流体的粘性是流体产生流动阻力的根源。 2. 牛顿粘性定律与流体的粘度 如图2-3所示,设有上、下两块面积很大且相距很近的平行平板,板间充满某种静止液体。若将下板固定,而对上板施加一个恒定的外力,上板就以恒定速度u 沿x 方向运动。若u 较小,则两板间的液体就会分成无数平行的薄层而运动,粘附在上板底面下的一薄层流体以速度u 随上板运动,其下各层液体的速度依次降低,紧贴在下板表面的一层液体,因粘附在静止的下板上, 其速度为零,两平板间流速呈线性变化。对任意相邻两层流体来说,上层速度较大,下层速度较小,前者对后者起带动作用,而后者对前者起拖曳作用,流体层之间的这种相互作用,产生内摩擦,而流体的粘性正是这种内摩擦的表现。 平行平板间的流体,流速分布为直线,而流体在圆管内流动时,速度分布呈抛物线形,如图2-4所示。 实验证明,对于一定的流体,内摩擦力F 与两流体层的速度差. u d 成正比,与两层之间的垂直距离dy 成反比,与两层间的接触面积A 成正比,即 图2-4 实际流体在管内的速度分布 图2-3 平板间液体速度变化
dy u d A F . μ= (2-16) 式中:F ——内摩擦力,N ; dy u d . ——法向速度梯度,即在与流体流动方向相垂直的y 方向流体速度的变化率,1/s ; μ——比例系数,称为流体的粘度或动力粘度,Pa ·s 。 一般,单位面积上的内摩擦力称为剪应力,以τ表示,单位为Pa ,则式(1-26)变为 dy u d . μ τ= (2-17) 式(2-16)、(2-17)称为牛顿粘性定律,表明流体层间的内摩擦力或剪应力与法向速度梯度成正比。 剪应力与速度梯度的关系符合牛顿粘性定律的流体,称为牛顿型流体,包括所有气体和大多数液体;不符合牛顿粘性定律的流体称为非牛顿型流体,如高分子溶液、胶体溶液及悬浮液等。本章讨论的均为牛顿型流体。 粘度的物理意义 流体流动时在与流动方向垂直的方向上产生单位速度梯度所需的剪应力。粘度是反映流体粘性大小的物理量。 粘度也是流体的物性之一,其值由实验测定。液体的粘度,随温度的升高而降低,压力对其影响可忽略不计。气体的粘度,随温度的升高而增大,一般情况下也可忽略压力的影响,但在极高或极低的压力条件下需考虑其影响。 粘度的单位 在国际单位制下,其单位为 [][] s Pa m s m Pa .?== ?? ? ???= dy u d τμ 在一些工程手册中,粘度的单位常常用物理单位制下的cP (厘泊)表示,它们的换算关系为 1cP =10-3 Pa ·s 2.2.2 流动型态 1. 流体的流动型态
t3
第三章水及水中元素的同位素成分 (一)名词解释 1、同位素效应 2、同位素分馏 3、温度效应 4、纬度效应 5、高程效应 6、大陆效应 7、季节效应 8、雨量效应 9、山体屏蔽效应 10、氧漂移 11、降水氢氧稳定同位素的高程效应 (二)填空题 1、氧同位素的国际标准英文缩写为(),而碳同位素的国际标准缩写为()。 2、氚的单位为T.U,1T.U相当于()个氢原子中有一个氚原子。 3、对于同位素交换反应C18O2+H218O=C16O18O+H218O,其分馏系数CO2-H2O 可表示为(),天然水的氢氧同位素组成的国际标准的英文缩写为SMOW ,意思为()某水样的氧同位素组成与SMOW相比更轻,则其()。 4、同位素组成的常用表示方法有(),(),()和()。 5、大气CO2的δ13C平均值是(),而土壤CO2的δ13C平均值是()。 6、对于同位素交换反应C18O2+H218O=C16O18O+H218O,其分馏系 数CO2-H2O 可表示为(),天然水的氢氧同位素组成的国际标准的英文缩写为SMOW ,意思为()。 7、天然水的氢氧稳定同位素组成一般以(),()表示,其国际标准的英文缩写为SMOW,意指()。 8、氢氧稳定同位素的高程效应,实际是()的一种表现,若已知某地气温的高程变化率为-0.5℃/100m ,δ18O随温度的变化为0.30‰/度,则δ
18O 的高程变化率为()。不同成因的盐水具有不同的同位素组成,试指出下列盐水的δD的范围,海水(),大气降水流经岩盐矿床而形成的盐水()。由于蒸发浓缩而富集盐分的盐湖水()。 (三)简答题 1、降水氢氧稳定同位素组成的温度效应、纬度效应的含义? 2、氧漂移及其影响因素? 3、何谓降水氢氧稳定同位素的大陆效应?试用蒸发与凝结的机理加以解释 4、何谓降水氢氧稳定同位素的大陆效应?试用蒸发与凝结的机理加以解释。 5、次生方解石中12C的来源是什么? 6、自然界碳同位素的分馏过程有哪些? 7、同位素温度计的基本原理是什么? 8、大气降水中氢氧稳定同位素的分布特征 9、大气降水中氚的分布特征。 10、简述氢氧同位素常用的表示方法及标准。 11、硫同位素用什么标准来表示?地下水中硫同位素组成情况如何? 12、自然界硫同位素的分硫过程有哪些? 13、沉积物的碳同位素成分由海岸向海洋方向有什么变化规律?它与什么有关? 14、次生方解石中碳的轻同位素是什么来源的?有几种? 15、氚的成因及天然水中氚的一般分布情况怎样? 16、天然14 C的产生及其循环。 17、怎样利用氢氧稳定同时确定含水层补给区或补给区高程? 18、13C 能解决水文地质中的哪些问题?
水文地球化学试卷
09031123 一、名词解释(每题3 分,共21 分) 1、BOD: 指用微生物降解水中有机物过程中所消耗的氧量,以mg/L 为单位。 2、脱硫酸作用: 在缺氧和有脱硫酸菌存在的情况下,SO4 2- 被还原成H2S 或S2-的过 程。 3、同离子效应: 一种矿物溶解于水溶液,如若水溶液中有与矿物溶解相同的离子,则这种矿物的溶解度就会降低,这种现象在化学上称为同离子效应 4、降水氢氧稳定同位素的高程效应: 大气降水中的18O 和D 含量随着海拔高程的增加而不断下降的现象。 5、酸性垒: 当中性或碱性条件转变为弱酸性和酸性条件或在pH 值急剧降低的地段所形成的地球化学垒。 6、水分子的缔合作用: 由单分子水结合成比较复杂的多分子水而不引起水的物理化学性质改变的现象。7、硅质水与硅酸水: SiO2 含量大于50mg/L 的水称为硅质水(1.5 分);在阴离子中,HSiO3 -占阴离子首位(按mol%计算)的水称为硅酸水(1.5 分)。 二、填空(每题1 分,共14 分) 1、水对离子化合物具有较强的溶解作用,是由于水分子具有较强的(介电)效应所致,水的沸点较高,是由于水分子间(氢键)的破坏需 要较大的能量。 2、在35℃下,pH=7 的地下水是(碱)性。在天然水化学成分的综 合指标中,体现水的质量指标的有(TDS,硬度,含盐量或含盐度, 电导率),而表征水体系氧化还原环境状态的指标有(COD,BOD,TOC,Eh )。 3、迪拜—休克尔公式的使用条件是离子强度小于(0.1 mol/L ),而 戴维斯方程的使用条件是离子强度小于(0.5 mol/L )。
4、空气迁移的标型元素主要决定环境的(氧化还原)条件,而水迁移的标型元素主要决定环境的(酸碱)条件 5、在氮的化合物中,(NO- 2,NH4 + )可作为地下水近期受到污染的 标志,而(NO- 3 )可作为地下水很早以前受到污染的标志。 6、Fe2+在(酸)性中迁移强,而在(碱)性中迁移弱。 7、地球化学垒按成因可分为(机械)垒、(物理化学)垒、(生 物)垒和(复合)垒。 8、碱度主要决定于水中的(HCO- 3,CO2- 3 )的含量。硬度是以 (Ca2+,Mg2+)的毫克当量总数乘以50,而暂时硬度是以(HCO- 3,CO2- 3 )的毫克当量总数乘以50。 9.大气CO2 的δ13C 平均值是(-7 ‰),而土壤CO2 的δ13C 平均值是(-25‰)。 10.标型元素的标型程度取决于(元素的克拉克值)和(它的迁移能力)。 11.弥散作用包括(分子扩散),(对流扩散迁移)和(渗透分 散)。 12、SiO2 和Na/K 地热温度计适用的温度范围分别为(0~250 ℃)和(150~350 ℃)。 13.近代火山型浅部地下热水的水化学类型为(SO2- 4 SO2- 4 Cl- ), 而深部地下热水的水化学类型为(Cl-HCO- 3 )。 14.海水的水化学类型为(Cl-Na ),而海成存封水的水化学类型为(Cl-Na -Ca)。 三.简答题(每题5 分,共30 分) 1、氧漂移及其影响因素?
成矿流体活动的地球化学示踪研究综述
第14卷第4期1999年8月 地球科学进展 ADVAN CE I N EA R TH SC IEN CES V o l.14 N o.4 A ug.,1999 成矿流体活动的地球化学示踪研究综述Ξ 倪师军,滕彦国,张成江,吴香尧 (成都理工学院,四川 成都 610059) 摘 要:成矿流体活动的地球化学示踪是近年来流体地球化学研究的一个新趋势。通过流体来源示踪、运移示踪和定位示踪可以追溯流体活动的全过程,对恢复流体活动历史、演化历程具有积极意义。对成矿流体活动的地球化学示踪方法进行了一定的总结,对人们常用的地球化学示踪方法——同位素地球化学示踪、元素地球化学示踪、包裹体地球化学示踪及气体地球化学示踪的研究现状进行了综述。 关 键 词:成矿流体;流体地球化学;地球化学示踪 中图分类号:P595 文献标识码:A 文章编号:100128166(1999)0420346207 地球化学示踪研究是查明元素、矿物等在地质地球化学作用过程中的来源、演化及其最终发展状态,是揭示地球化学作用机理和过程的重要途径和有效手段。成矿流体地球化学是当前国际地学界研究的前沿和热点之一,成矿流体活动的地球化学示踪研究已成为一个新的趋势,通过流体来源示踪、运移示踪和定位可以追溯流体活动的全过程,对恢复流体活动的历史、演化历程具有积极意义。 1 同位素地球化学示踪 由于同一元素不同同位素的原子质量不同,其热力学性质有微小的差异。正是这种差异导致同位素组成在物理、化学作用过程中发生变化,引起同位素分馏,包括热力学平衡分馏和动力学分馏2种类型〔1〕。 经过长期的分异、分馏、衰变演化,地球不同层圈、不同地质单元具有明显不同的同位素组成特征。因此可以根据同位素具有基本相同的化学性质示踪成岩、成矿物质的来源、推断源区的地球化学特征。另外还可以根据同位素分馏规律和矿物的同位素组成,示踪矿物形成时的物化条件和演化过程〔1〕。用稳定同位素数据来定量地说明成矿介质水和其他物质的来源,开始于60年代初期〔2〕,作为独特的示踪剂和形成条件的指标,稳定同位素组成已广泛地应用于陨石、月岩、地球火成岩、沉积岩、变质岩、大气、生物、海洋、河流、湖泊、地下水、地热水及各种矿床的研究,成为解决许多重大地质地球化学问题的强大武器〔3〕。在应用稳定同位素研究成矿流体的演化过程(源、运、储)的同时,人们也不断地应用放射性同位素来定量、半定量地研究地质地球化学作用过程,即应用放射性同位素研究地球化学示踪和地球化学作用发生的年代问题。同位素分析新方法新技术的不断发展,如R e2O s、L u2H f、L a2B a2Ce等方法的建立〔4〕,使同位素示踪技术也得到了丰富和发展。111 氢、氧同位素示踪 利用氢、氧同位素示踪成矿溶液的来源,是同位素示踪技术在地质研究中取得的最重要成果之一〔1〕。由于不同来源的流体具有不同特征的氢氧同位素组成,因此成矿流体的氢氧同位素组成成为判断成矿流体来源的重要依据,如卢武长①、魏菊英〔5〕 Ξ国家自然科学基金项目“成矿流体定位的地球化学界面及地学核技术追踪方法研究”(编号:49873020)、国家科技攻关项目“矿床(体)快速追踪的地球化学新方法、新技术”(编号:962914203202)和国土资源部百名跨世纪优秀人才培养计划基金资助。 第一作者简介:倪师军,男,1957年4月出生,教授,主要从事地球化学的教学与研究。 收稿日期:1998208210;修改稿:1999204213。 ①卢武长1稳定同位素地球化学1成都地质学院内部出版,19861116~1451
第四节 流体在管内的流动阻力
第四节流体在管内的流动阻力实际上理想流体是不存在的。流体在流动过程中需要消耗能量来克服流动阻力,本节讨论流体流动阻力的产生、影响因素及其计算。 §1.4.1牛顿粘性定律与流体的粘度 1、牛顿粘性定律 设有间距很小的两平行板,两平板间充满液体 (如图)。下板固定,上板施加一平行于平板的切向 力F,使上板作平行于下板的等速直线运动。紧贴 上板的液体层以与上板相同的速度流动,而紧贴固 定板的液体层则静止不动。两层平板之间液体的流 速分布则是从上到下为由大到小的渐变。 此两板间的液体可看成为许多平行于平板的流体层,这种流动称为层流,而层与层之间存在着速度差,即各液层之间存在着相对运动。运动较快的液层对与之相邻的运动较慢的液层作用着一个拖动其向运动方向前进的力;而与此同时,运动较慢的液层对其上运动较快的液层也作用着一个大小相等方向相反的力,从而阻碍较快的液层的运动。这种运动着的流体内部相邻两流体层间的相互作用力称为流体的内摩擦力(粘滞力)。流体流动时产生内摩擦力的这种特性称为粘性。 在上图中,若某层流体的速度为u,在其垂直距离为dy处的邻近流体层的速度为u+du,则du/dy表示速度沿法线方向上的变化率,称为速度梯度。 实验证明,内摩擦力F与两流体层间的接触面积S成正比,与速度梯度du/dy成正比。即: F∝S·du/dy 亦即: F=μS·du/dy 剪应力τ:单位面积上的内摩擦力,即F/S, 单位N/㎡ 于是: τ=F/S=μ·du/dy——牛顿粘性定律 μ为比例系数,称为粘性系数或动力粘度,简称粘度 说明:
①牛顿粘性定律可表达为剪应力与法向速度梯度成正比, 与法向压力无关,流体的这一规律与固体表面的摩擦力 的变化规律截然不同。 ②牛顿粘性定律的使用条件:层流时的牛顿型流体。 ③根据此定律,粘性流体在管内的速度分布可以预示为:如图 紧贴壁面的流体受壁面固体分子力的作用而处于静止状态, 随着离壁距离的增加,流体的速度连续地增大,至管中心 处速度达到最大。而当μ=0,无粘性时(理想流体),管内 呈恒速分布,即速度不随位置,时间变化,各点均相同。 ④剪应力的单位: 因此,剪应力的大小也代表动量传递的速率(即单位时间、单位面积上传递的动量)。 传递方向:动量传递的方向与速率梯度的方向相反,即由高速度向低速度传递,以动量传递表示的牛顿粘性定律为: τ’:动量传递速率;“负号”表示两者方向相反 2、流体的粘度 (1)、粘度的物理意义: 从τ=μ·du/dy 可得μ=τ/(du/dy) 其物理意义为促使流体流动产生单位速度梯度的剪应力,粘度总是与速度梯度相联系,它只有在运动时才显现出来。分析静止流体规律时不用考虑粘度。(2)、粘度随压强、温度的变化 粘度是流体的物理性质之一,其值由实验测定。 一般地, 流体的粘度μ=f(p,T)
水文地球化学教学大纲
《水文地球化学》教学大纲 一、课程名称:水文地球化学 Hydrogeochemistry 二、课程编号: 三、学分学时:2学分/32学时 四、使用教材:沈照理等编,《水文地球化学基础》,地质出版社,1993年5月第一版,1999年第二次印刷 五、课程属性:专业内选修课 选修 六、教学对象:地质工程专业本科生 七、开课单位:地球科学与工程学院地质科学与工程系 八、先修课程:普通化学、普通地质学、岩石矿物学、构造地质学、水文地质学基础等。 九、教学目标: 通过比较系统地介绍有关水文地球化学的基础理论,掌握水-岩相互作用在天然和人类活动条件下导致的地下水各溶解组分的迁移转化规律,熟悉应用水化学的分析理论与方法解决各种环境和工程问题。 十、课程要求: 通过本课程的学习,使学生掌握水文地球化学的平衡理论,学会水文地球化学的分析方法,基本要求是: 1.掌握水化学平衡原理; 2.掌握地下水溶解组分的迁移和转化规律; 3.学会应用水文地球化学的基本原理和分析方法解决自然和人类活动条件下的各种地下水环境问题; 十一、教学内容: 本课程主要由以下内容组成: 第一章水化学基础(12学时) ?知识要点:溶解平衡、碳酸平衡、洛河计算、氧化还原作用、吸附平衡 ?重点难点:各种平衡的计算方法 ?教学方法:课堂教学 第二章地下水化学成分的组成(4学时)
?知识要点:天然水的化学特性、元素的水文地球化学特性、天然水化学成分的综合指标、 地下水化学成分的数据处理 ?重点难点:各天然水体的常量和微量及痕量化学成分特性 ?教学方法:课堂教学 第三章地下水化学成分的形成与特征(4学时) ?知识要点:渗入成因地下水、沉积成因地下水和火山成因地下水的化学成分的形成与特征 ?重点难点:各种成因水的化学成分的形成机理与演化 ?教学方法:课堂教学 第四章水的地球化学循环(4学时) ?知识要点:地下水圈、地壳中水的地球化学循环、成矿过程中的地球化学循环 ?重点难点:地下水循环过程中元素的迁移转化 ?教学方法:课堂教学 第五章水文地球化学的应用(8学时) ?知识要点:地下水污染、地球化学环境与人体健康、矿泉水 ?重点难点:如何应用水文地球化学的基本原理分析和评价各种水环境问题 ?教学方法:课堂教学 十二、实践环节: 主要是习题: ?络合计算 ?饱和指数计算 ?Eh-pH计算 ?吸附平衡计算 ?水化学成分的图示 ?应用分析 十三、教学参考: 1.参考教材 ?沈照理等编,《水文地球化学基础》,地质出版社,1993年5月第一版,1999年第二次印刷 2.参考文献 ?杨忠耀,环境水文地质,原子能出版社,1990年 十四、考核方式:
流体力学习题及答案-第七章
第七章 粘性流体动力学 7-1 油在水平圆管内做定常层流运动,已知75=d (mm ),7=Q (litres/s ),800=ρ (kg/m 3),壁面上480=τ(N/m 2),求油的粘性系数ν。 答:根据圆管内定常层流流动的速度分布可得出2 08 1m u λρτ=; 其中:λ是阻力系数,并且Re 64= λ; m u 是平均速度,585.1075.014.325.01074 123 2=???==-d Q u m π(m/s )。 由于阻力系数2 8m u ρτλ=,因此02 02886464Re τρτρλm m u u ===; 即: 2 8τρν m m u d u = ; 所以油的粘性系数为401055.3585 .18008075 .0488-?=???== m u d ρτν(m 2/s )。 7-2 Prandtl 混合长度理论的基本思路是什么? 答:把湍流中流体微团的脉动与气体分子的运动相比拟。 7-3无限大倾斜平板上有厚度为h 的一层粘性流体,在重力g 的作用下做定常层流运动,自由液面上的压力为大气压Pa ,且剪切应力为0,流体密度为ρ,运动粘性系数为ν,平板倾斜角为θ。试求垂直于x 轴的截面上的速度分布和压力分布。 答:首先建立如图所示坐标系。 二维定常N-S 方程为: ???? ????+??+??-=??+??22221y u x u x p f y u v x u u x νρ ??? ? ????+??+??-=??+??22221y v x v y p f y v v x v u y νρ 对于如图所示的流动,易知()y u u =,()y p p =,0=v ,θsin g f x =,θcos g f y -=;
地球化学调查
地球化学调查 3.1地热资源勘查各阶段宜进行地球化学调查,采用多种地球化 学调查方法,包括地热流体特有组分(F、SiO2、B、H2S 等)调查分析、氡气测量等,确定地热异常分布范围。3.2 具代表性的地热流体,宜采集地球化学样品,并适当采用 部分常温地下水、地表水及大气降水样品作为对照,分析 彼此的差异和关系。样品采集方法、要求遵照本规范附录 B。 3.3 测定代表性地热流体,常温地下水、地表水、大气降水中 稳定同位素和放射性同位素,推断地热流体的成因与年龄。 3.4 计算地热流体中Na/K、CI/B、CI/F、CI/SiO2等组分的重量 克分于比率,并进行水岩平衡计算,分析地热流体中矿物 资源的来源及其形成的条件。 3.5 对地表岩石和地热钻井岩芯中的水热蚀变矿物进行取样鉴 定,分析推断地热活动特征及其演化历史。 3.6 地球化学调查图件比例尺与地质调查比例尺一致。 7.7.1地热流体与岩土试验分析 7.7.1 在地热勘查中,应系统采取水、气、岩土等样品进行分析 鉴定,获取热储及地热流体的有关参数,各类样品按下述 要求采取:
a) 地热流体全分析:各勘查阶段的全部地热井和代表性泉点 均应采取; b) 气体分析:凡有气体逸出的地热井(泉)均应采取;中高 温地热井应采用井下压力采样器取样; C) 微量元素、放射性元素(U、Ra、Rn)、毒性成分的分析:按 每个储层采样,预可行性勘查阶段各取(1-2)个,可行性勘查阶段各取(3-5)个,开采阶段各取(5-7)个; d) 稳定同位素:可行性勘查阶段可取(1-2)个,开采阶段可 取(2-3)个; e) 放射性同位素:可行性勘查阶段每层热储各取(3-5)个, 开采阶段每层热储各取(5-7)个; f) 岩土分析样:采集典型热储和盖层岩样及包含水热蚀变的岩 土样品。 7.7.2 地热流体化学成分全分析项目包括:主要阴离子(HCO3-1、 CI-1、SO4-2、CO3-2)、阳离子(K+1、Na+1、Ca+2、Mg+2)、微量元素和特殊组分(F、Br、I、SiO2、B、H2S、AI、Pb、Cs、Fe、Mn、Li、Sr、Cu、Zu等)、放射性元素(U、Ra、Rn)及总a、总β放射性、PH值、溶解性总固体、硬度、耗氧量等。对高温热田应增加Hg、As、Sb、Bi、的测试,对温泉和浅埋热储应视情况增加污染指标如酶、氰等的分析,并根据不同的用途增加相关分析项目。 7.73 同位素分析:一般测定稳定同位素D(H2、18O、34S)和放射
工程流体力学答案(陈卓如)第七章
[陈书7-6] 烟囱直径m d 1=,烟量h k 69.17g q m =,烟气密度3 k 7.0m g =ρ,周围大 气密度3 2.1m Kg a =ρ,烟囱内压强损失g V d h P w 2035.02 =?,V 为烟囱内烟气流动的速 度,h 为烟囱高度。为保证烟囱底部断面1处的负压不小于mm 10水柱,烟囱的高度h 应大于(或小于)多少? [解] 此题用Bernoulli 方程求解。 对1、2断面列出总流的伯努利方程: w h g V g p z g V g p z +++=++222 212221111αραρ (1) 由质量守恒可知:21V V = 再假定动能修正系数:121==αα 式(1)可简化为: w h g p z g p z ++=+ ρρ2211 (2) ()w h z z g p p --=-2112ρ (3) 断面1处的负压:111p p p a V -=,移项可得:V a p p p 111-= 而断面2处的压强为当地的大气压,即: a p p 22= 其中a p 1和a p 2分别为断面1、2处的大气压 将以上各式代入(3)式得: () ()w V a a h z z g p p p --=+-21112 ρ (4) d H
而:gh p p a a a ρ=-12,h z z =-21 代入(4)式得:()gh h h g p a w V ρρ--=1 (5) 依题意,能量损失:g V d h P h w w 2035.02 =?= 代入(5)式:?? ????-???? ??-=-??? ? ??-=a a V dg V gh gh dg V gh p ρρρρ2035.012035.012 21 移项得:?? ????-???? ??-= a V dg V g p h ρρ2035.012 1 (6) 令w ρ为水的密度,负压可用h ?高的水柱表示为:h g p w V ?=ρ1 代入(6)得:a w dg V h h ρρρ-??? ? ?? -?= 2035 .012 将流速:2 4d q V m ρ= 代入上式,得: a m w g d q h h ρρρρ-??? ? ?? -?= 3 22 216035 .01 (7) 将:mm h 10=?、2 10s m g =、3 k 2.1m g a =ρ、3k 7.0m g =ρ、3 k 1000m g w =ρ、 h k 69.17g q m =和m d 1=代入(7)式得: ()m h 20-= 因为:h z z =-21,所以:m h z z 2012=-=- 【陈书7-10】 将一平板伸入水的自由射流内,垂直于射流的轴线。该平板截去射流流量的一部分1V q ,引起射流剩余部分偏转角度α。已知射流流速30m s V =,全部流量
流体地球化学 报告
《流体地球化学》 题目:地幔流体及其成矿作用 读书报告 教师:张成江教授 指导老师:何明有教授 姓名: 张建军 学号: 2011050169 学院:核自学院 专业:核能与核技术工程 2011年12月15日
地幔流体及其成矿作用 1 地幔流体组成和特点 地幔流体是指赋存于地球内部由原始气体元素(He3、A r36等)、挥发分(幔 源CO 2、S、H2O等) 所组成的气体、稀溶液及具挥发分的富碱的硅酸盐熔体。 现代火山喷气、玄武岩圈闭气体、地幔镁铁质和超镁铁质包体成分分析及金刚石 包裹体分析表明, 地幔流体是以C2H2O 为主的体系, 并且含有一定的金属氧化 物〔6〕, 其流体种类受地幔氧逸度f O 2 及深度的制约〔7〕, 当f O 2 在Q FW —MW (氧缓冲反应限定的范围) 时, 流体种类以CO 22H2O 为主; 接近IW 时以CH42H2O为主。W yllie〔8〕用微量CO 2、H2O 和橄榄岩(假定地幔中CO 2?(CO 2+ H2O ) = 018) 进行的成岩试验表明, H2O、CO 2 含量在深度上是分层的, 以地 盾区地热曲线、固相线位置、矿物稳定组合区间三者之间关系, 推测120 km 深 度以下时金云母、白云石、橄榄石与富H2O 气相共存; 较浅处(约90 km ) 时, 随 着角闪石等含水矿物形成, 大量的H2O 被消耗, 气相中CO 2 与H2O 含量比值 随之增大, 形成上地幔中相对富CO 2 的区域; 在260~120 km 之间则为碳酸盐、金云母、C2H2O 挥发分溶解于熔体中, 无独立的H2O 和CO 2 相存在。Sh iano 等〔9〕在研究Kerguelen 地区超镁铁质捕虏体时发现了富硅质熔体、富碳酸盐 的熔体和富CO 2 流体包裹体共生, 显示是地幔深部均一的熔融相在到达上地幔 温压条件时形成不混溶的三相, 并充填于橄榄岩形成的裂隙中。这同样证明了 C2H2O 随深度变化的推断。包裹体一直被作为了解深部流体的重要窗口, 然而 已有的资料表明地幔流体包裹体在随寄主岩上升过程中已发生了次生变化, 并 且显示出几乎所有的捕虏体中多为纯CO 2 包裹体,缺少甚至没有H2O 的成分。 对此认为主要由4 种原因引起: ①在硅酸盐熔体中H2O 的溶解度比CO 2 更大, 熔融时H2O 比CO 2 优先进入熔体中, 形成相对富集的CO 2 相; ②氢的扩散作 用引起在低f O 2 时流体主要成分是CH4, 在达到一定温度和压力时H 发生迁移, 留下相对较富的CO 2; ③与围岩发生水岩反应再平衡的结果,H2O 比CO 2 更易 与含氧的硅酸盐发生反应, 剩下相对较富的CO 2; ④变形过程中H2O 比CO 2 更 易进入位错而被泄漏掉。因此, 多数地幔包体中的流体包裹体在被寄主岩从深 部带到地表过程中已发生了次生变化, 其成分已有所改变。由于我们对地幔流 体还缺乏详细研究和了解, 大多数地幔流体性质仍是有待研究的前沿课题。 2 地幔流体的来源及成矿作用 按照目前的了解, 地幔流体主要以两种方式形成: 一种由地核及下地幔脱 气作用; 另一种为洋壳俯冲作用带入大量富含挥发分物质的再循环〔1, 3, 4〕。 稀有气体的He2A r 同位素体系研究表明地幔流体主要有3 种源区〔10〕: ①地 幔柱型源区; ②洋中脊玄武岩型源区; ③岛弧型源区。其中最值得一提的是地 幔柱源区, 推测地幔柱构造起源于地幔深部热边界层, 具有800~ 1 200km 直 径的头部和100~200 km 的尾部〔11, 12〕, 由地幔深部穿越不同的上覆圈层 直抵地表, 且因直接来自富集地幔, 含有大量挥发分和不相容元素, 其成矿意 义值得重视。流体在上地幔的富集是地幔流体成矿的基础, 前已述及流体是由 深部地幔或地核脱气作用和再循环物质脱水作用形成, 形成的流体可能在上地 幔顶部附近富集, 特别是在软流圈上隆引起减压变薄时, 溶解于地幔橄榄岩高 压围岩矿物相中的挥发分出溶, 形成细小的早期流体包裹体, 并在地幔蠕变过 程中往有利的部位运移〔13〕, 从而促进流体的更进一步富集。聚集的挥发分
水文地球化学
水文地球化学研究现状、基本模型与进展 摘要:1938 年, “水文地球化学”术语提出, 至今水文地球化学作为一门 独立的学科得到长足的发展, 其服务领域不断扩大。当今水文地球化学研究的理论已经广泛地应用在油田水、海洋水、地热水、地下水质与地方病以及地下水微生物等诸多领域的研究。其研究方法也日臻完善。随着化学热力学和化学动力学方法及同位素方法的深入研究, 以及人类开发资源和保护生态的需要, 水文地球化学必将在多学科的交叉和渗透中拓展研究领域, 并在基础理论及定量化研究方面取得新的进展。 早期的水文地球化学工作主要围绕查明区域水文地质条件而展开, 在地下水的勘探开发利用方面取得了可喜的成果( 沈照理, 1985) 。水文地球化学在利用地下水化学成分资料, 特别是在查明地下水 的补给、迳流与排泄条件及阐明地下水成因与资源的性质上卓有成效。20 世纪60 年代后, 水文地球化学向更深更广的领域延伸, 更多地是注重地下水在地壳层中所起的地球化学作用( 任福弘, 1993) 。 1981 年, Stumm W 等出版了5水化学) ) ) 天然水化学平衡导论6 专著, 较系统地提供了定量处理天然水环境中各种化学过程的方法。1992 年, C P 克拉依诺夫等著5水文地球化学6分为理论水文地球化学及应用水文地球化学两部分, 全面论述了地下水地球化学成分的形成、迁移及化学热力学引入水文地球化学研究的理论问题, 以及水文地球化学在饮用水、矿水、地下热水、工业原料水、找矿、地震预报、防止地下水污染、水文地球化学预测及模拟中的应用等, 概括了20 世纪80 年代末期水文地球化学的研究水平。特别是近二十年来计算机科学的飞速发展使得水文地球化学研究中的一些非线性问题得到解答( 谭凯旋, 1998) , 逐渐构架起更为严密的科学体系。 1 应用水文地球化学学科的研究现状 1. 1 油田水研究 水文地球化学的研究在对油气资源的勘查和预测以及提高勘探成效和采收率等方面作出了重要的贡献。早期油田水地球化学的研究只是对单个盆地或单个坳陷, 甚至单个凹陷进行研究, 并且对于找油标志存在不同见解。此时油田水化学成分分类主要沿用B A 苏林于1946 年形成的分类。1965 年, E C加费里连科在其所著5根据地下水化学组分和同位素成分确定含油气性的水文地球化学指标6中系统论述了油气田水文地球化学特征及寻找油气田的水文地球化学方法。1975 年, A G Collins 在其5油田水地球化学6中论述了油田水中有机及无机组分形成的地球化学作用( 汪蕴璞, 1987) 。1994 年, 汪蕴璞等对中国典型盆地油田水进行了系统和完整的研究, 总结了中国油田水化学成分的形成分布和成藏规律性, 特别是总结了陆相油田水地球化学理论, 对油田水中宏量组分、微量组分、同位素等开展了研究, 并对油田水成分进行种类计算, 从水化学的整体上研究其聚散、共生规律和综合评价找油标志和形成机理。同时还开展了模拟实验、化学动力学和热力学计算, 从定量上探索油田水化学组分的地球化学行为和形成机理。 1. 2 洋底矿藏研究
第4章 水文地球化学参数
第四章水文地球化学参数 水文地球化学参数有三类:物性水文地球化学参数,条件水文地球化学参数,综合性水文地球化学参数。 第一节物性和条件水文地球化学参数 一、物性水文地球化学参数 物性水文地球化学参数是反映事物的性质(物质的性质和物质间相互作用时的质量和能量关系)的参数。如平衡常数,反应速度常数,分配系数,吸附容量,自由能,焓,熵,标准电子活度或标准电极电位,离子电位,离子半径和价态,以及原子结构和其外层的价电子层结构都是反映事和物内在本性的参数。这些参数反映的是事物的本性,或反映的仅仅是事物在理想状态时的特征。事物在理想条件下的状态与实际条件下是有一定的差距的。在研究客观具体事物时还需根据具体条件作具体分析。但尽管如此,收集和掌握这些参数对水文地球化学研究无疑是非常必要和有益的,因为这些参数是对事物进行分析判断的基础,是对事物进行理论计算和实践设计必不可少的参数。 二、条件水文地球化学参数 条件水文地球化学参数是反应体系及其环境所处的条件的参数,是用来描述事物或体系与环境的外观状态的参数,当然也是进行水文地球化学计算时所需要的基本数据。它们主要有水化学组分,含量,pH,pE或Eh,温度,压力等。无疑这些参数是水文地球化学研究和计算中必不可少的重要参数,因而也是我们野外和实验室工作中必须取得的主要资料。 第二节参比和综合性水文地球化学参数 上面已提及,仅有物性水文地球化学参数是不能对水岩体系的客观状态和变化作出确定性的定量回答,也是无法对水岩体系进行具体的水文地球化学计算。但是仅仅依靠条件水文地球化学参数也是不够的,因为同一个客观具体条件对不同的事物的影响显然是不尽相同的。对一个事物要作出既科学又符合客观实际的回答,必须将理论与实践相结合,也就是说,将事物的条件状态与该条件下事物发生变化的边界状态相比较,才能对事物的状态、发展结果和将可能发生的事件作出正确的论断。反映实际条件与该具体条件下的边界条件相比较的结果的参数
水文地球化学试卷B卷
一、名词解释(每题3分,共21分) 1、盐效应:矿物在纯水中的溶解度低于矿物在高含盐量水中的溶解度,这种含盐量升高而使矿物溶解度增大的现象。 2、阳离子交替吸附作用:在一定条件下,岩石颗粒吸附地下水中的某些阳离子,而将其原来吸附的某些阳离子转入水中,从而改变了地下水的化学成分,这一作用即为阳离子交替吸附作用。 3、氧化垒:在还原条件被氧化条件激烈交替的地段上所形成的地球化学垒。 4、侵蚀性CO2:当水中游离CO2大于平衡CO2时,水中剩余部分的CO2对碳酸盐和金属构件等具有侵蚀性,这部分即为侵蚀性CO2。 5、TDS:指水中溶解组分的总量,它包括溶于水中的离子、分子及络合物,但不包括悬浮物和溶解的气体。 6、硅质水与硅酸水: SiO2含量大于50mg/L的水称为硅质水(1.5分);在阴离子中,HSiO3-占阴离子首位(按mol%计算)的水称为硅酸水(1.5分)。 7、硬度:是以水中Ca2+和Mg2+来量度,其计算方法是以 Ca2+和Mg2+的毫克当量总数乘以50,以CaCO3表示,其单位为mg/L。二、填空(每题1分,共14分)1、Fe2+在(酸)性中迁移强,而在(碱)性中迁移弱。 2、地球化学垒按成因可分为(机械)垒、(物理化学)垒、(生物)垒和(复合)垒。 3、碱度主要决定于水中的(HCO-3,CO2-3 )的含量。硬度是以( Ca2+,Mg2+)的毫克当量总数乘以50,而暂时硬度是以( HCO-3,CO2-3 )的毫克当量总数乘以 50。 4.大气CO2的δ13C平均值是(-7 ‰),而土壤CO2的δ13C平均值是( -25‰)。 5.标型元素的标型程度取决于(元素的克拉克值)和(它的迁移能力)。 6.弥散作用包括(分子扩散),(对流扩散迁移)和(渗透分散)。7、SiO2 和Na/K地热温度计适用的温度范围分别为( 0~250 ℃)和( 150~350 ℃)。 8.近代火山型浅部地下热水的水化学类型为(SO2-4 SO2-4 -Cl ),而深部地下热水的水化学类型为(Cl-HCO-3 )。 9.海水的水化学类型为( Cl-Na ),而海成存封水的水化学类型为(Cl-Na -Ca )。 10、水对离子化合物具有较强的溶解作用,是由于水分子具有较强的(介电)效应所致,水的沸点较高,是由于水分子间(氢键)的破坏需要较大的能量。11、在35℃下,pH=7的地下水是(碱)性。在天然水化学成分的综合指标中,体现水的质量指标的有( TDS,硬度,含盐量或含盐度 , 电导率),而表征水体系氧化还原环境状态的指标有( COD,BOD,TOC,Eh )。 12、迪拜—休克尔公式的使用条件是离子强度小于( 0.1 mol/L ),而戴维斯方程的使用条件是离子强度小于( 0.5 mol/L )。 13、空气迁移的标型元素主要决定环境的(氧化还原)条件,而水迁移的标型元素主要决定环境的(酸碱)条件14、在氮的化合物中,( NO-2,NH4+ )可作为地下水近期受到污染的标志,而( NO-3 )可作为地下水很早以前受到污染的标志。 三.简答(每题5分,共30分) 1、水的酸度与pH值的区别? 答:酸度是表征水中和强碱能力的指标(1分)。它与水中的氢离子浓度并不是一回事,pH值仅表示呈离子状态的H+数量(1分),而酸度则表示中和过程中可以与强碱进行反应的全部H+数量,其中包括原已电离的和将会电离的部分(2分),已电离的H+数量称为离子酸度,它与pH值是一致的(1分)。 2、水分析结果是简分析,请问从那几方面检查分析数据可靠性。?答:(1)阴阳离子平衡的检查(1.5分)(2)碳酸平衡关系的检查(1.5分)(3)分析结果中一些计
《水文地球化学》教学大纲
《水文地球化学》教学大纲 Hydrogeochemistry-Course Outline 第一部分大纲说明 一、课程的性质、目的与任务 《水文地球化学》是水文与水资源工程专业本科生必修的一门主要专业基础课。通过本课程的学习,使学生掌握水文地球化学的基本原理和学会初步运用化学原理解决天然水的地球化学问题和人类对天然水的影响问题的方法与手段,为学习后续课程和专业技术工作打下基础。 二、与其它课程的联系 学习本课程应具备普通地质学、综合地质学、工程化学和水文地质学的基础。后续课程为水质分析实验、铀水文地球化学、环境水文地质学和水文地质勘察。 三、课程的特点 1.对基本概念、基本规律与常见的应用方法的理解并重。 2.对基本理论与常见水文地球化学问题的定量计算方法的掌握并重。 3. 采用英文教材,中、英语混合授课。 四、教学总体要求 1.掌握水文地球化学的基本概念、基本规律与研究方法。 2.掌握控制地下水与地表水化学成分的主要作用:酸碱反应与碳酸盐系统;矿物风化与矿物表面过程;氧化-还原反应;有机水文地球化学作用等。 3.通过理论讲述、研究实例分析与习题课,使学生理解天然水中常见的化学组份与同位素组成,掌握最基本的地球化学模拟方法与整理水化学数据的能力。 五、本课程的学时分配表 编 号教学内容课堂讲 课学时 习题课 学时 实验课 学时 自学 学时 1 引言及化学背景 (Introduction and Chemical Background) 6 2 酸碱反应与碳酸盐系统 (Acid-Base Reactions and the Carbonate System) 4 2 3 矿物风化与矿物表面过程 Mineral weathering and mineral surface processes 6
环境水文地球化学 第一篇 第一次作业
1.地下水的主要组成成分是什么? 答:地下水是组成成分复杂的溶液,近八十种天然元素以离子、原子、分子、络合物和化合物等形式存在于地下水中,有些已溶解和活动于地下水中的有机质、气体、微生物和元素同位素的形式存在。这些可溶物质主要是岩石风化过程中,经过水文地球化学和生物地球化学的迁移、搬运到水中的地壳矿物质。 地下水中溶解的无机物主要组分(即浓度>5mg/L)为:HCO3-、Cl-、SO42-、Na+、K+、Ca+、Mg2+、SiO2。占地下水中无机物成分含量的90-95%,决定着地下水的化学类型。 地下水中有机组分种类繁多,主要有:氨基酸、蛋白质、糖(碳水化合物)、葡萄糖、有机酸、烃类、醇类、醚类、羧酸、苯酚衍生物、胺等。各种不同形式的有机物主要由C、H、O组成,这三种元素占全部有机物的98.5%,另外还存在有少量的N、P、K、Ca等元素。 地下水中常见溶解气体有:O2、CO2、CH4、N2、H2以及惰性气体Ar、Kr、He、Ne、Xe等。 微生物成分主要有三种类型:细菌、真菌和藻类。微生物在地下水化学成分的形成和演变过程中起着重要的作用。地下水中存在各种不同的细菌。有在氧化环境中的硝化菌、硫细菌、铁细菌等喜氧细菌;有在还原环境的脱氮菌、脱硫菌、甲烷生成菌、氨生成菌等。这些微生物活动可以发生脱硝酸作用、脱硫酸作用、甲烷生成作用和氨生成作用等还原作用,也可以发生硫酸根生成、硝酸根生成和铁的氧化等作用等,从而导致地下水化学成分的相应变化。 2.举例论述络合作用有何环境意义? 答:地下水中大多数金属能与配体形成各种各样的络合物,这些络合物可能是电中性的,也可能是带正电或者带负电。金属络合作用对环境的意义在于:络合物的溶解度是影响金属形态迁移的重要因素;重金属离子与不同配体的配位作用,改变其化学形态和生化毒性,如铝离子(毒性很强)、有机铝络合物(毒性很弱)的生物毒性相差很大;络合作用影响络合剂的性质,如配位体的氧化还原性、脱羧及水解等;有些络合物可以通过化学絮凝、活性炭吸附或离子交换等方法容易地从水中去除。但有些重金属形成螯合物后很难用常规办法去除,影响水处理中对重金属的排除效率;络合作用会加速金属的腐蚀,比如氯离子和氨的作用。 3.胶体的稳定性和ζ电位有什么关系?研究胶体的ζ电位有何环境意义? 答:ζ电位是胶体稳定性的一个重要指标,因为胶体稳定是与离子键的经典排斥力密切相关的。ζ电势的降低会使静电排斥力减小,致使粒子之间范德华力占优势,从而引起胶体的聚沉难和破坏。故研究ζ电势的变化规律是十分重要的。 4.地球化学垒和水文地球化学分带形成的原因是什么? 答:地球化学垒是正在表生带内,因为短间隔内化学元素迁徙环境显然变迁,迁徙强度突然削弱而招致某些化学元素浓集的地段;水文地球化学分带是地下水化学成分和水中总溶解固体沿着水平或者垂直方向呈现有规律的带状分布和变化的现象。故它们共同形成成因都是地下
水文地球化学题库—孙占学(217寝室成员整理)剖析
第一章地下水的无机化学成分 一、名词解释 1、侵蚀性CO 2 : 当水中“游离CO2 ”,大于“平衡CO2 ”时,多余部分的CO2对碳酸和金属构件等具有侵蚀性,这部分CO2 ,即为“侵蚀性CO2 ”。 2、游离CO 2 溶解于水中的CO2统称为游离CO2. 3、平衡CO 2 与HCO3-相平衡的CO2 ,称为平衡CO2 。 4、Ph 5、去硝化作用 在缺氧条件下,异养型去氮菌把NO3-、NO2- (还原)分解为气态氮(N2O和N2 )的过程。 6、硝化作用 在自养型亚硝化菌和硝化菌的作用下,NH4+被氧化为亚硝酸盐和硝酸盐的作用。 7、微量组分 不决定水化学类型 8、大量组分 决定水化学类型,一般含量大于100mg/L 9、组分 二、填空题 1、地下水中的化学组分可以分为四组:(大量组分),(微量组分),(放射性组分),和(气体组分);水的中性点的pH 值随温度的升高而()。 2 、Cl - 具有很强的迁移性能,其原因在于:(不形成难溶化合物),(不被胶体所吸附),(不被生物所吸附))。碳酸衍生物的存在形式与水的pH 值有关,当pH>8 时,以()占优势:当pH<5 时,则以()占优势。 3、细菌按呼吸方式分有和两大类。 三、简答题 1、地下水中氟的来源简况。 2、地下水中的主要气体成分及来源。 3、何谓地下水中的微量元素?研究它有何意义?
4、什么是硝化作用或去硝化作用,它们各在什么环境中进行? 四、论述题 试论地下水中二氧化碳的起源及其水文地球化学意义。 第三章水及水中元素的同位素成分 (一)名词解释 1、同位素效应 由于某种元素的一种同位素被另一同位素所替换,从而引起物质在在物理、化学性质上出现差异的现象,称之为同位素效应。 同位素效应是造成同位素分馏的根本原因。 2、同位素分馏 3、温度效应 大气降水中的δ18O和δD 随地面或云层的温度升高而增大,反之,则降低。 4、纬度效应 大气降水中的δ18o和δD值随纬度增加而减少。 5、高程效应 大气降水中δ18O和δD随海拔高度增加而下降的现象 6、大陆效应 大气降水中的δ18O和δD由沿海到大陆部逐渐降低得现象 7、季节效应 降水的δ18D和δD值随气温,湿度,蒸发和降水的季节变化而发生周期变化。
