抗菌药物最小抑菌浓度的测定

抗菌药物最小抑菌浓度的测定
一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24 小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法,检测几种抗菌药物对■一菌株的最小抑菌浓度(MIC), 对临床诊断用药有指导作用。
试剂: MH液体培养基无菌试管
分光光度计0.5麦氏标准比浊管
MH琼脂微量加样器
蒸儒水吸头
接种环
0.1 mol磷酸缓冲液
(PH6.0)
无菌生理盐水无菌平板
无菌滤膜0.22无菌针简
抗菌药物
金黄色葡萄球菌、大肠
埃希菌、铜绿假单胞菌
四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:
抗菌药物原液
配置OOOOOOOOOOOOO
MH液体试管中抗菌药物梯度稀释
观察结果
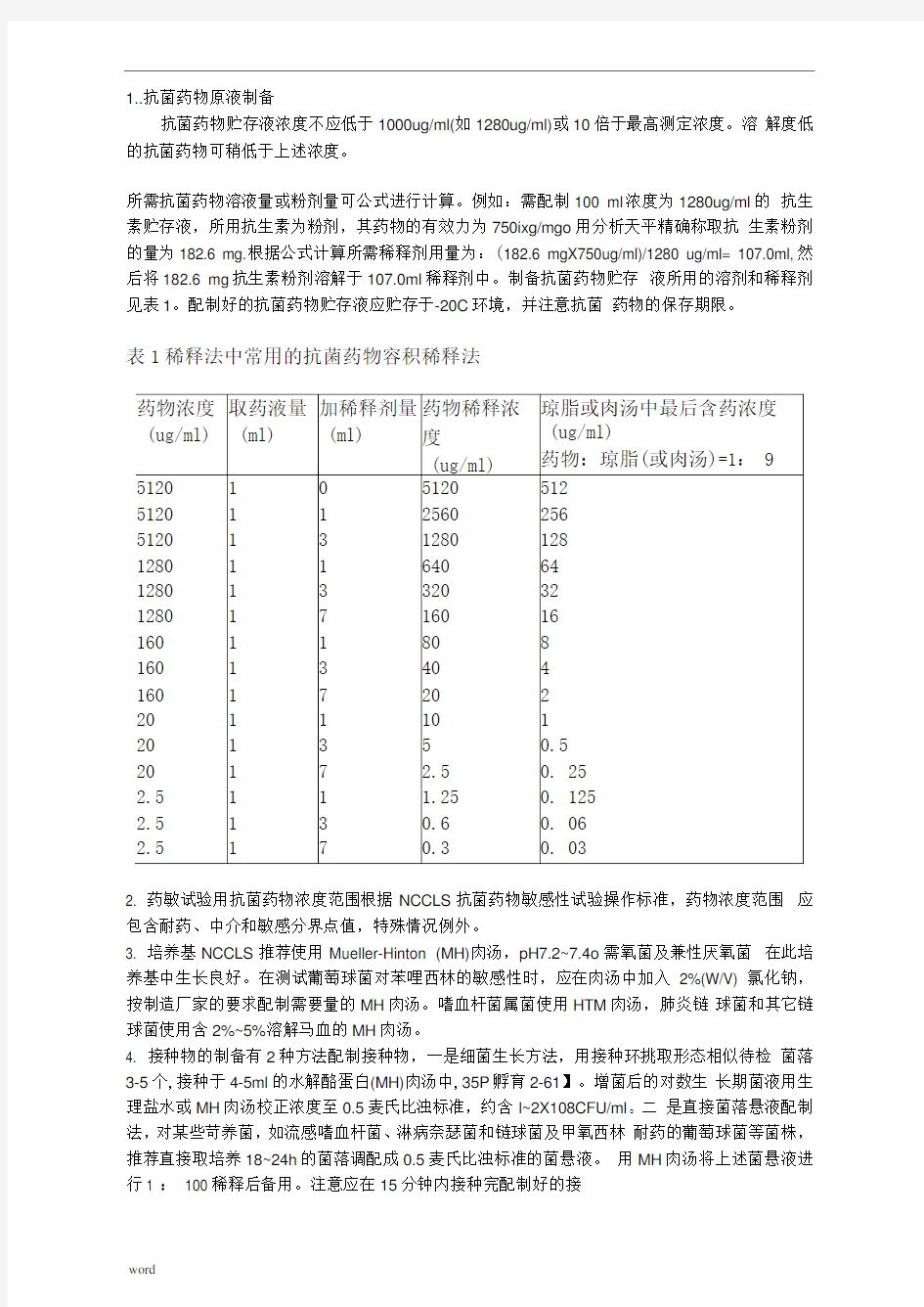
1..抗菌药物原液制备
抗菌药物贮存液浓度不应低于1000ug/ml(如1280ug/ml)或10倍于最高测定浓度。溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。例如:需配制100 ml浓度为1280ug/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750ixg/mgo用分析天平精确称取抗生素粉剂的量为182.6 mg.根据公式计算所需稀释剂用量为:(182.6 mgX750ug/ml)/1280 ug/ml= 107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。制备抗菌药物贮存液所用的溶剂和稀释剂见表1。配制好的抗菌药物贮存液应贮存于-20C环境,并注意抗菌药物的保存期限。
表1稀释法中常用的抗菌药物容积稀释法
2. 药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3. 培养基NCCLS推荐使用Mueller-Hinton (MH)肉汤,pH7.2~7.4o需氧菌及兼性厌氧菌在此培养基中生长良好。在测试葡萄球菌对苯哩西林的敏感性时,应在肉汤中加入2%(W/V) 氯化钠,按制造厂家的要求配制需要量的MH肉汤。嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4. 接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35P孵育2-61】。增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含l~2X108CFU/ml。二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。用MH肉汤将上述菌悬液进行1 : 100稀释后备用。注意应在15分钟内接种完配制好的接
种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
5. 稀释抗菌药物的制备及菌液接种取无菌试管(13X 100mm) 13支,排成一排,除第1管加入肉汤外,其余每管加入MH肉汤1ml,在第1管加入抗菌药物原液(如1280 ug/ml) 0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25pg/mL然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5X105CFu}ml°第1管至第11管药物浓度分别为128、64、32、16、8、4、2、1、05、0.25、0.125 ug/mL 另外设对照 3 支, 别为肉汤对照、质控菌对照和待测菌生长对照。
6. 孵育将接种好的稀释管塞好塞子,置35°C普通空气孵箱中孵育16~20h:嗜血杆菌和链球菌在普通空气孵箱中孵育20~24h;对可能的耐甲氧西林葡葡球菌和耐万古霉素肠球菌应持续孵育满24h°
7. 结果判断与解释在读取和报告所测试菌株的MIC前,应检查生长对照管的细菌生长情况是否良好,同时还应检查接种物的传代培养情况以确定其是否污染,质控菌株的MIC值是否处于质控范围。以肉眼观察,药物最低浓度管无细菌生长者,即为受试菌的MIC.甲氧茉胺嚅陇或磺胺药物的肉汤稀释法终点判断,与阳性生长对照管比较抑制80%细菌生长管药物浓度为受试菌MIC.
[MIC参考范围】
表2稀释法质控标准菌株MIC预期值范围(ug/ml)
最小抑菌浓度的测定
几种测定抗菌药物最低抑菌浓度(MIC)方法 1.1.常量肉汤稀释法 1.1. 1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如 1280μg/ml)或10倍于最高测定浓度。溶解度低的抗菌药物可稍低于上述浓度。 抗菌药物直接购自厂商或相关机构。所需抗菌药物溶液量或粉剂量可公式进行计算。例如: 需配制100ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。用分析天平精确称取抗生素粉剂的量为 182.6mg。根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml) /1280μg/ml= 107.0ml,然后将 182.6 mg抗生素粉剂溶解于 107.0ml稀释剂中。 制备抗菌药物贮存液所用的溶剂和稀释剂见表5。配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。 1.1. 2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。 1.1. 3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH 7.2~
7.4。需氧菌及兼性厌氧菌在此培养基中生长良好。在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。 嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。 1.1. 4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至 0.5麦氏比浊标准,约含1~2×108CFU/ml。二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成 0.5麦氏比浊标准的菌悬液。用MH肉汤将上述菌悬液进行1∶100稀释后备用。注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。 1.1. 5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入 1.6mlMH肉汤外,其余每管加入MH肉汤1ml,在第1管加入抗菌药物原液(如1280μg/ml) 0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。此时各管药物浓度依次为 256、128、 64、32、
大气飘尘浓度测定方法
水质六种特定多环芳烃的测定高效液相色谱法 GB 13198—91 1 适用范围 本标准规定了测定水中多环芳烃(PAH)的高效液相色谱(HPLC)法。本标准参照采用国际标准ISO/DIS 7981/2高效液相色谱法分析的六种特定多环芳烃。 本标准适用于饮用水、地下水、湖库水、河水及焦化厂和油毡厂的工业污水中荧蒽、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、苯并(ghi)苝、茚并(1,2,3-cd)芘六种多环芳烃的测定。 本法用环己烷提取水中多环芳烃,提取液通过弗罗里硅土柱,PAH吸附在柱上,用丙酮加二氯甲烷混合溶液脱附PAH后,用配备荧光和(或)紫外检测器的高效液相色谱仪测定。本方法对六种PAH通常可检测到ng/L水平。 水样中若存在可被共萃取的能产生荧光信号或熄灭荧光的物质对本法也有干扰。本法用弗罗里硅土柱层析净化分离,可降低荧光背景。 2 试剂和材料 2.1 高效液相色谱流动相为水和甲醇的混合溶液。 2.1.1 甲醇:分析纯,用全玻璃仪器重蒸馏,要求有足够低的空白。 2.1.2 水:电渗析水或蒸馏水,加高锰酸钾在碱性条件下重蒸。在测定的化合物检测限内未观察到干扰。 2.2 配制标准样品和水样预处理使用的试剂和材科。 2.2.1 二氯甲烷(CH 2Cl 2 ):用全玻璃蒸馏器重蒸馏,在测定化合物检测限内不出现色谱干扰为 合格。 2.2.2 丙酮(C3H6O):同2.2.1。 2.2.3 环已烷:分析纯,同2.2.1。 注:若环已烷的纯度不够,可采用附录中两种办法中的任一种进行净化。 2.2.4 无水硫酸钠(Na 2SO 4 ):分析纯,在400℃加热2h。 2.2.5 硫代硫酸钠(Na 2S 2 O 3 ·5H 2 O):分析纯。 2.2.6 弗罗里硅土(Florisil):60~100目,色层分析用。在400℃加热2h。冷却后,用水(2.1.2)调至含水量为11%(m/m)。 2.2.7 碱性氧化铝;层析用,50~200μm,活度为BrockmannⅠ级。达到Ⅰ级的制法如下: 将氧化铝加热至550±20℃至少2h,冷却至200~250℃,移入放有高氯酸镁的干燥器内,继续冷却,即得活度为BrockmannⅠ级的氧化铝。在干燥器内可存放五天。 2.2.8 柱层析用硅胶:100目,在300℃活化4h。 2.2.9 浓硫酸(H2SO4):分析纯。 2.2.10 标准溶液:
流式细胞仪常用的几种检测方法
流式细胞仪常用的几种检测方法(转载) 一、测定用乙醇固定的DNA的含量 1、培养细胞的DNA含量的测定 制备单细胞悬液于200μl的PBS缓冲液中; 加入2ml预冷的70%乙醇,4℃保存; 附:细胞固定的一般步骤 1) 取单细胞悬液1~2×106个细胞于PBS(PH=7.2)缓冲液中; 2) 300g离心5分钟,弃上清,反复两次; 3) 重悬细胞于0.5ml PBS缓冲液中; 4) 将细胞悬液放置于2~3ml冷70%乙醇中,混匀,保存于4℃,至少30分 钟。在4℃条件下可保存2~3周。 注意: 2根据实验的要求,固定剂也可选用1~3%多聚甲醛; 2将乙醇作为固定剂时,乙醇应预冷至0~4℃; 2细胞在固定时,固定剂应缓慢滴入细胞悬液中,使固定剂的浓度缓慢增加,并不断震摇,以免细胞成团(特别是用乙醇固定时)。 2 300g离心5分钟,去上清,再重悬于400μl PBS中; 2显微镜下观察,若有明显的黏附,须再用筛网过滤; 2加入PI(含Rnase),避光孵育30分钟; 2上机检测。 2、新鲜组织的DNA含量的测定 1) 用200mg湿重组织用机械法制成单细胞悬液; 2) 500g离心5分钟; 3) 弃上清,重悬于10ml染色-去污剂中; 4) 再过滤,用200目的筛网或70~80μm的筛网过滤; 5) 上机检测。 3、石蜡包埋组织切片的DNA含量的测定 1) 从石蜡包埋切取切片50 μm厚,2~3片,制成单细胞悬液; 2) 用PBS缓冲液洗涤,500g离心5分钟,弃上清; 3) 加入PI液1ml室温避光30分钟; 4) 调整细胞浓度为1×106/ml; 5) 上机检测。 二、细胞凋亡检测及相关分子检测 1、细胞DNA含量分布(由细胞DNA降解方式检测细胞凋亡)
最小抑菌量
抑菌圈法测量抑菌活性 1.无菌条件下取保存于-80℃的大肠杆菌、金黄色葡萄球菌、沙门氏菌、链球菌、李氏杆菌、猪丹毒、植物乳酸菌、戊糖乳酸杆菌菌种划线于固体琼脂平板上,37℃培养,挑取单个菌落,连续传代2次,保存备用。 2.取活化后的不同菌种接种于相应的培养基中,其中大肠杆菌、金黄色葡萄球菌、沙门氏菌接种于LB培养基中,37℃摇床培养至对数生长期。链球菌、李氏杆菌、猪丹毒、巴斯杆菌接种于LB培养基中(加入5%的血清),37℃摇床培养至对数生长期。植物乳酸菌和戊糖乳杆菌接种于MRS培养基中,37℃静置培养至对数生长期。 3.取对数生长期的各种细菌10 μL加入到1mL相应的培养基中混匀,涂于琼脂平板,待菌液稍干后,在每个平板中放入2个牛津杯,其中一个牛津杯中加入200 μL复性超滤浓缩的1 mg/mL重组蛋白,另一个牛津杯中加入最后一次透析液作为对照,每种菌做三个重复。 4.将琼脂平板放入37℃温箱中培养,细菌长满平板后用镊子小心的取出牛津杯,测量清晰地抑菌圈直径。 2.2.9.2 最小抑菌浓度测定(MIC) 1.菌悬液制备:取2.2.8.1中活化的大肠杆菌、金黄色葡萄球菌、沙门氏菌、链球菌、李氏杆菌10uL接种于相应的5mL培养基中,37℃摇床培养至对数生长期。 2.平板活菌计数:用生理盐水将培养至对数生长期的各种细菌做10倍比稀释,混匀后选择10-5、10-6、10-7、10-8、10-9、10-10六个稀释度接种平板,每个稀释度做三个重复,每板接种100uL,并将之在平板上涂布均匀,37℃培养16 h,选择菌落数在30至300的稀释度,计算其菌落数的平均值,并按其稀释倍数计算出培养液中的活菌数量。 3.乳铁蛋白溶液的制备:将2.2.7.2方法中复性的蛋白进行超滤浓缩,并用2.2.7.3方法进行蛋白浓度的测定,使其终浓度达到4mg/mL。 4.乳铁蛋白对各种细菌的MIC值:取灭菌的干净离心管25支,分成五组,每组5个,编号1~5,将五种细菌培养至对数生长期,再将其稀释至105/mL,每个离心管中加入0.5 mL。再向每组的第一个离心管中加入0.5 mL浓度为4mg/mL的猪乳铁蛋白制备液,混匀后取0.5 mL加入到第二个离心管中,同样的方法一直稀释到第五个离心管中,1~5管中重组蛋白的浓度分别2.0、1.0、0.5、0.25、0.125 mg/mL,37℃作用18 h,观察结果,以无细菌生长的最低浓度为MIC值。
细胞生长状况有关指标的检测方法
细胞生长状况有关指标的检测方法 一、细胞计数 这是细胞培养中常用的基本技术之一。所用材料为细胞计数板。巴氏吸管和显微镜。步骤如下。 l 取清洁计数板和专用盖玻片,用丝绸布轻轻擦干。 l 取细胞悬液0.3ml,加入0.9结晶紫染液,混匀后滴半滴于细胞计数板内,以充满不外溢为宜。也可直接将细胞悬液在一侧滴加到盖玻片中,不要溢出,也不要过少或出现气泡。 l 在显微镜下用10X物镜观察计数四角大方格中的细胞数。代入下式得出细胞密度。 细胞数(ml)=(4大格细胞数之和/4)×104×稀释倍数 台盼蓝染色法可计算出活细胞和死细胞数以测定细胞存活百分率。一般0.5%-1.0%的台盼蓝染液可使死细胞染成蓝色,活细胞不着色。此外还可用0.02%的藻红b染液将死细胞或受损细胞染成红色,或用0.05%的苯胺黑染液将死细胞染成黑丝。 细胞存活率=[4大格活细胞数/(4大格活细胞数+4大格死细胞数)]×100% 在进行细胞计数操作时,必须把细胞悬液准备好,细胞应分散良好,并充分混匀,若出现较多细胞团或细胞数少于200个/10mm2或多于500个/100mm2时,需重制细胞悬液,重新计数。 二、细胞生长曲线和生长倍数 细胞生长曲线是细胞培养实验中最基本的指标,是测定细胞绝对增值数值和生长繁殖基本规律常用的简便方法。常用的方法为:在同一规格的培养瓶中,接种等量的同一代细胞,经培养后每隔24h取出几瓶细胞进行计数,以培养时间为横坐标,不同时刻的细胞数的对数为纵坐标,标出各点并连成线,即为该细胞的生长曲线,可反映出细胞生长的动态。 测定生长曲线的另一种方法是用96孔/24孔细胞培养板,分7组,每组3孔,培养1周(7天),期间逐日检测一组,计数,最后把7天中的细胞数值绘成图,即为细胞生长曲线。 也可采用MTT法来进行生长曲线测定。 标准的细胞生长曲线近似“S”形,一般在传代后第一天细胞数有所减少,经过一段时间的潜伏期,再进入对数生长期,达到平台期后生长稳定,最后衰老。
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)资料解读
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释法 琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。 1.培养基制备 使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。 2.含药琼脂平板制备 根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。 3.接种物制备与接种 制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。 4.结果判断 将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。 如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
大气环境监测方法标准
标准编号标准名称实施日期 HJ 77.2-2008 环境空气和废气二噁英类的测定同位素稀释高分辨气相色谱-高分辨质谱 法 2009-4-1 国家环保总局公告 2007年第4号 环境空气质量监测规范(试行)2007-1-19 HJ/T 75—2007 固定污染源烟气排放连续监测技术规范(试行)2007-8-1 HJ/T 76—2007 固定污染源烟气排放连续监测系统技术要求及检测方法(试行)2007-8-1 HJ/T 373-2007 固定污染源监测质量保证与质量控制技术规范(试行)2008-1-1 HJ/T 397-2007 固定源废气监测技术规范2008-3-1 HJ/T 398-2007 固定污染源排放烟气黑度的测定林格曼烟气黑度图法2008-3-1 HJ/T 400-2007 车内挥发性有机物和醛酮类物质采样测定方法2008-3-1 HJ/T 174-2005 降雨自动采样器技术要求及检测方法2005-5-8 HJ/T 175-2005 降雨自动监测仪技术要求及检测方法2005-5-8 HJ/T 193-2005 环境空气质量自动监测技术规范2006-1-1 HJ/T 194-2005 环境空气质量手工监测技术规范2006-1-1 HJ/T 165-2004 酸沉降监测技术规范2004-12-9 HJ/T 167-2004 室内环境空气质量监测技术规范2004-12-9 HJ/T 93-2003 PM10采样器技术要求及检测方法2003-7-1 HJ/T 62-2001 饮食业油烟净化设备技术方法及检测技术规范(试行)2001-8-1 HJ/T 63.1-2001 大气固定污染源镍的测定火焰原子吸收分光光度法2001-11-1 HJ/T 63.2-2001 大气固定污染源镍的测定石墨炉原子吸收分光光度法2001-11-1 HJ/T 63.3-2001 大气固定污染源镍的测定丁二酮肟-正丁醇萃取分光光度法2001-11-1 HJ/T 64.1-2001 大气固定污染源镉的测定火焰原子吸收分光光度法2001-11-1 HJ/T 64.2-2001 大气固定污染源镉的测定石墨炉原子吸收分光光度法2001-11-1 HJ/T 64.3-2001 大气固定污染源镉的测定对-偶氮苯重氮氨基偶氮苯磺酸分光光度法2001-11-1 HJ/T 65-2001 大气固定污染源锡的测定石墨炉原子吸收分光光度法2001-11-1 HJ/T 66-2001 大气固定污染源氯苯类化合物的测定气相色谱法2001-11-1 HJ/T 67-2001 大气固定污染源氟化物的测定离子选择电极法2001-11-1 HJ/T 68-2001 大气固定污染源苯胺类的测定气相色谱法2001-11-1 HJ/T 69-2001 燃煤锅炉烟尘和二氧化硫排放总量核定技术方法—物料衡算法(试行)2001-11-1 HJ/T 77-2001 多氯代二苯并二恶英和多氯代二苯并呋喃的测定同位素稀释高分辨率毛细 管气相色谱/高分辨质谱法 2002-1-1 HJ/T 54-2000 车用压燃式发动机排气污染物测量方法2000-9-1 HJ/T 55-2000 大气污染物无组织排放监测技术导则2001-3-1 HJ/T 56-2000 固定污染源排气中二氧化硫的测定碘量法2001-3-1 HJ/T 57-2000 固定污染源排气中二氧化硫的测定定电位电解法2001-3-1 GB/T 12301-1999 船舱内非危险货物产生有害气体的检测方法2000-8-1 HJ/T 27-1999 固定污染源排气中氯化氢的测定硫氰酸汞分光光度法2000-1-1 HJ/T 28-1999 固定污染源排气中氰化氢的测定异烟酸-吡唑啉酮分光光度法2000-1-1 HJ/T 29-1999 固定污染源排气中铬酸雾的测定二苯基碳酰二肼分光光度法2000-1-1 HJ/T 30-1999 固定污染源排气中氯气的测定甲基橙分光光度法2000-1-1 HJ/T 31-1999 固定污染源排气中光气的测定苯胺紫外分光光度法2000-1-1 HJ/T 32-1999 固定污染源排气中酚类化合物的测定 4-氨基安替比林分光光度法2000-1-1
琼脂稀释法测定抗菌药物最低抑菌浓度MIC
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)
————————————————————————————————作者:————————————————————————————————日期: ?
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释 法 琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。 1.培养基制备 使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。 2.含药琼脂平板制备 根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。 3.接种物制备与接种 制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。 4.结果判断 将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。 如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
中华人民共和国国家标准环境空气质量标准
中华人民共和国国家标准环境空气质量标准 添加时间:[2004-05-27]创建人:管理员 GB 3095-1996 (代替GB 3095-82) 国家环境保护局1996-01-18批准1996-10-01实施 前言 根据《中华人民共和国环境保护法》和《中华人民共和国大气污染防治法》,为改善环境空气质量,防止生态破坏,创造清洁适宜的环境,保护人体健康,特制订本标准。 本标准从1996年10月1日起实施,同时代替GB3095-82。 本标准在下列内容和章节有改变: -标准名称; -3.1-3.14(增加了14种术语的定义); -4.1-4.2(调整了分区和分级的有关内容); -5.(补充和调整了污染物项目、取值时间和浓度限值); -7.(增加了数据统计的有效性规定)。 本标准由国家环境保护局科技标准司提出。 本标准由国家环境保护局负责解释。 1 主题内容与适用范围 本标准规定了环境空气质量功能区划分、标准分级、污染物项目、取值时间及浓度限值,采样与分析方法及数据统计的有效性规定。 本标准适用于全国范围的环境空气质量评价。 2 引用标准 GB/T 15262空气质量二氧化硫的测定──甲醛吸收副玫瑰苯胺分光光度法 GB 8970空气质量二氧化硫的测定──四氯汞盐副玫瑰苯胺分光光度法
GB/T 15432环境空气总悬浮颗粒物测定──重量法 GB 6921空气质量大气飘尘浓度测定方法 GB/T 15436环境空气氮氧化物的测定──Saltzman法 GB/T 15435环境空气二氧化氮的测定──Saltzman法 GB/T 15437环境空气臭氧的测定──靛蓝二磺酸钠分光光度法 GB/T 15438环境空气臭氧的测定──紫外光度法 GB 9801空气质量一氧化碳的测定──非分散红外法 GB 8971空气质量苯并[a]芘的测定──乙酰化滤纸层析荧光分光光度法 GB/T 15439环境空气苯并[a]芘的测定──高效液相色谱法 GB/T 15264空气质量铅的测定──火焰原子吸收分光光度法 GB/T 15434环境空气氟化物的测定──滤膜氟离子选择电极法 GB/T 15433环境空气氰化物的测定──石灰滤纸氟离子选择电极法 3、定义 1.总悬浮颗粒物(Total Suspended Particicular,TSP):指能悬浮在空气中,空气动力学当量直径≤100微米的颗粒物。 2.可吸入颗粒物(Particular matter less than 10 μm,PM10):指悬浮在空气中,空气动力学当量直径≤10微米的颗粒物。 3.氮氧化物(以NO2计):指空气中主要以一氧化氮和二氧化氮形式存在的氮的氧化物。
白细胞的检测方法
第四章白细胞检验的基本方法 第一节白细胞功能的检验 一、墨汁吞噬试验 【目的】掌握墨汁吞噬试验的原理、方法、注意事项和临床意义。 【实验原理】墨汁吞噬试验(ink phagocytosis test)是依据血液中的中性粒细胞及单核细胞对细菌、异物等具有吞噬作用,在一定量的肝素抗凝血中,加入一定量的墨汁,经37℃温育4h,涂片染色后,在显微镜下观察吞噬细胞对墨汁的吞噬情况,并计算吞噬率及吞噬指数,从而协助急性白血病的诊断与鉴别。 【材料】 1.器材试管、移液管、微量移液器、载玻片、37℃水浴箱、显微镜等。 2.试剂 (1)肝素:配成6U/ml水溶液。 (2)制备墨汁:于普通砚台上加生理盐水5ml,以优质中国块墨或印度墨,以100r/min 研磨3min。所得墨汁经普通滤纸过滤3次备用。 (3)瑞氏染液等。 【方法步骤】 1.取小试管1支,加肝素20μl,加外周血100μl,混匀。 2.加入过滤墨汁10μl,混匀,加塞。 3.置37℃温育4h。 4.取温育后样本,推制成血涂片,干燥后,瑞氏染色。 5.油镜下观察计数幼稚细胞或中性成熟粒细胞100个;计数单核细胞20个。 6.判断结果根据细胞吞噬墨粒多少及大小,可定为下列程度: 阴性:细胞内未见吞噬墨粒。 阳性:(+) 细胞内吞噬有小墨粒1~5个。 (++) 细胞内吞噬有大小不等墨粒10个左右。 (+++) 细胞内吞噬有大墨粒10个左右,小墨粒较多。 (++++) 细胞内吞噬有多数大颗墨粒,并有块状、球状,小墨粒很多,但细胞核清楚。 7.计算吞噬率及吞噬指数 吞噬率(%)= ×100% 吞噬指数= 【注意事项】肝素剂量对白细胞的吞噬功能有影响,肝素用量过大,细胞形态异常,吞噬率和吞噬指数降低;肝素用量过小,影响抗凝。以每100μl血用0.3U肝素为最适宜。【参考范围】 成熟中性粒细胞吞噬率59~89%,吞噬指数66~186; 成熟单核细胞吞噬率90~100%,吞噬指数227~399。 【临床意义】临床上可利用该试验了解吞噬细胞的吞噬功能,对白血病的诊断和分型有一定参考价值。粒细胞仅成熟阶段才具有吞噬功能,单核细胞幼稚阶段和成熟阶段均具有吞噬能力。AML-M5a为弱阳性,M5b吞噬指数明显增高。AML-M2、ALL和AML-M3吞噬试验均为阴性,AML-M4呈阳性反应。CML的成熟粒细胞吞噬能力明显降低。 二、白细胞吞噬功能试验 【目的】掌握白细胞吞噬功能试验的原理、方法、注意事项和临床意义。 【实验原理】白细胞吞噬功能试验(leukophagocytic function test),是将待测的白细胞与葡萄球菌混合,37℃温育一定时间后,细菌可被中性粒细胞吞噬,涂片染色后,在显微镜下观
环境空气自动监测系统检测作业指导书
环境空气自动监测系统检测作业指导书1 概述 环境空气质量自动监测系统由监测子站、中心计算机室、质量保证实验室和系统支持实验室等组成,一般分析单元能自动监测环境空气中的氮氧化物、二氧化硫、臭氧、一氧化碳和PM10等参数。其监测仪器一般分为点式监测仪器和开放光程监测仪器。 本作业指导书用于对氮氧化物、二氧化硫、臭氧、一氧化碳和可吸入颗粒物PM10等参数监测仪器、采样装置等监测子站进行测试。 2 编制依据 GB 3095-1996 环境空气质量标准 HJ/T 193-2005 环境空气质量自动监测技术规范 HJ/T 194-2005 环境空气质量手工监测技术规范 HJ 479-2009 环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法 HJ 483-2009 环境空气二氧化硫的测定四氯汞盐吸收-副玫瑰苯胺分光光度法 HJ 482-2009 环境空气二氧化硫的测定甲醛吸收-副玫瑰苯胺分光光度法 GB/T 15437-1995 环境空气臭氧的测定靛蓝二磺酸钠分光光度法 GB/T 15438-1995 环境空气臭氧的测定紫外光度法 GB 9801-88 空气质量一氧化碳的测定非分散红外法
GB 6921-86 大气飘尘浓度测定方法 GB/T 15432-1995 环境空气总悬浮颗粒物的测定重量法 GB/T 15263-94 环境空气总烃的测定气相色谱法 《空气和废气监测分析方法》(第四版) 3 技术要求和性能指标 环境空气自动监测系统应满足以下表3-1、表3-2和表3-3中各项技术性能指标的要求。 3.1 外观要求 3.1.1 应有制造计量器具CMC标志(进口产品应取得我国质量监督检验检疫部门出具的计量器具型式批准证书)和产品铭牌,铭牌上应标有仪器名称、型号、生产单位、出厂编号、制造日期等。 3.1.2 仪器表面无明显碰、划伤,外观整齐、清洁,零部件表面不得锈蚀。 3.1.3 仪器各紧固件应连接牢固、可靠;各调节器件应功能正常,操作灵活方便。 3.1.4 仪器主机面板显示部分数字清晰,字符、标识易于识别。 3.2 工作环境条件要求 系统在以下工作环境中应能正常工作。 a 环境温度为0℃~40℃; b 相对湿度为不大于85%; c 工作电源为交流220V±20V、频率50Hz±1Hz;
渗透压摩尔浓度测定方法
渗透压摩尔浓度测定方法 生物膜,例如人体的细胞膜或毛细血管壁,一般具有半透膜的性质,溶剂通过半透膜由低浓度溶液向高浓度溶液扩散的现象称为渗透,阻止渗透所需施加的压力,即为渗透压。在涉及溶质的扩散或通过生物膜的液体转运各种生物过程中,渗透压都起着极其重要的作用。因此,在制备注射剂、眼用液体制剂等药物制剂时,必须关注其渗透压。处方中添加了渗透压调节剂的制剂,均应控制其渗透压摩尔浓度。 静脉输液、营养液、电解质或渗透利尿药(如甘露醇注射液)等制剂,应在药品说明书上标明其渗透压摩尔浓度,以便临床医生根据实际需要对所用制剂进行适当的处置(如稀释)。正常人体血液的渗透压摩尔浓度范围为285~310mOsmol/kg ,0.9%氯化钠溶液或5%葡萄糖溶液的渗透压摩尔浓度与人体血液相当。 溶液的渗透压,依赖于溶液中溶质粒子的数量,是溶液的依数性之一,通常以渗透压摩尔浓度(Osmolality )来表示,它反映的是溶液中各种溶质对溶液渗透压贡献的总和。 渗透压摩尔浓度的单位,通常以每千克溶剂中溶质的毫渗透压摩尔来表示,可按下列公式计算毫渗透压摩尔浓度(mOsmol/kg ): 1000n m Osm ol/kg ??=分子量的克数每千克溶剂中溶解溶质)毫渗透压摩尔浓度( 式中,n 为一个溶质分子溶解或解离时形成的粒子数。在理想溶液中,例如葡萄糖n=1,氯化钠或硫酸镁n=2,氯化钙n=3,枸橼酸钠n=4。 在生理范围及稀溶液中,其渗透压摩尔浓度与理想状态下的计算值偏差较小;随着溶液浓度的增加,与计算值比较,实际渗透压摩尔浓度下降。例如0.9%氯化钠注射液,按上式计算,毫渗透压摩尔浓度是2×1000×9/58.4=308mOsmol/kg ,而实际上在此浓度时氯化钠溶液的n 稍小于2,其实际测得值是286mOsmol/kg ;复杂混合物,如水解蛋白注射液的理论渗透压摩尔浓度不容易计算,因此通常采用实际测定值表示。 1.渗透压靡尔浓度的测定
抗菌药物最小抑菌浓度的测定
抗菌药物最小抑菌浓度的测定 一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。 二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。 三、仪器和试剂: 四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:
1..抗菌药物原液制备 抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。溶解度低的抗菌药物可稍低于上述浓度。 所需抗菌药物溶液量或粉剂量可公式进行计算。例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。用分析天平精确称取抗生素粉剂的量为182.6 mg。根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。制备抗菌药物贮存液所用的溶剂和稀释剂见表1。配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。 表1 稀释法中常用的抗菌药物容积稀释法 2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。 3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。需氧菌及兼性厌氧菌在此培养基中生长良好。在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。 4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。用MH肉汤将上述菌悬液进行1∶100稀释后备用。注意应在15分钟内接种完配制好的接
hj618-2011PM2.5和PM10的测定
H J 中华人民共和国国家环境保护标准 HJ618-2001 代替GB6921-86 环境空气PM10和PM2.5的测定重量法 2011-09-08发布 2011-11-01实施环境保护部发布
目次
2前言 为贯彻《中华人民共和国环境保护法》和《中华人民共和国大气污染防治法》,保护环境,保障人体健康,规范环境空气中PM10和PM2.5 的测定方法,制定本标准。 本标准规定了测定环境空气中PM2.5和PM10 的重量法。 本标准是对《大气飘尘浓度测定方法》(GB 6921-86)的修订。 本标准首次发布于 1986 年,本次为第一次修订。修订的主要内容如下:——将飘尘改为可吸入颗粒物(PM10); ——增加了规范性引用文件、术语和定义、质量控制与质量保证三章内容;——增加了PM10和PM2.5 的术语和定义; ——对PM10 采样器性能指标进行了修改,将切割粒径Da50=(10±1)μm改为Da50=(10±0.5)μm;捕集效率的几何标准差σg≤1.5 改为σg =(1.5±0.1)μm。全部性能指标要求符合《PM 10 采样器技术要求及检测方法》(HJ/T 93-2003 )中的规定; ——增加了PM2.5 采样器性能指标,切割粒径Da50=(2.5±0.2 )μm;捕集效率的几何标准差为σg=(1.2±0.1)μm;其他性能指标要求符合《PM10采样器技术要求及检测方法》(HJ/T 93 -2003 )中的规定。 自本标准实施之日起,原国家环境保护局1986 年 10 月 10 日批准、发布的国家环境保护 标准《大气飘尘浓度测定方法》(GB 6921-86)废止。 本标准的附录A 为资料性附录。 本标准由环境保护部科技标准司组织修订。 本标准主要起草单位:中日友好环境保护中心、国家环境分析测试中心。 本标准环境保护部2011 年9 月8 日批准。 本标准自2011 年 11 月 1 日起实施。 本标准由环境保护部解释。
活细胞内钙离子浓度的检测
活细胞内钙离子浓度 的检测
钙离子—第二信使 钙离子在信号传导通路中发挥第二信使作用。 在细胞收缩、运动、分泌和分裂等重要活动中,均需要钙离子的参与及调节。 钙离子的信使作用是通过其浓度的升高或降低来实现的。 细胞内游离钙离子的浓度是10-8---10-7M,比细胞外钙离子浓度低104---105倍,当细胞受到特异性信号刺激后,细胞内钙库(内质网、肌浆网)的钙通道或质膜上的钙通道开放,使细胞内钙离子浓度快速升高,产生钙信号,进而使细胞内某些酶的活性和蛋白质功能发生改变,产生细胞效应。
荧光钙离子测定技术发展简史 荧光钙离子浓度测定中常用的指示剂 荧光钙离子测定常用仪器 荧光钙离子测定的原理及具体方法
荧光钙离子测定技术发展简史 In 1920s 许多学者开始着手进行钙离子浓度的测定许多学者开始着手进行钙离子浓度的测定。。 1962年,Shimomura 等首次分离出水母蛋白作为钙激活蛋白检测Ca 2+浓度浓度,,但其发光高峰较相应生理过程出现慢但其发光高峰较相应生理过程出现慢,,且分子量大且分子量大,,通过细胞膜及在胞浆内扩散的能力较差浆内扩散的能力较差,,难于反映细胞内Ca 2+浓度的动态变化浓度的动态变化。。 1967年Ross 使用离子选择性微电极直接测定细胞内Ca 2+水平水平,,该方法简便该方法简便,,但反应时间长但反应时间长,,只能测定静息状态下的Ca 2+水平水平。。 70年代用砷偶氮年代用砷偶氮ⅢⅢ(aresenazo Ⅲ)染色染色,,可定量分析钙离子变化可定量分析钙离子变化,,但用微注射技术将染料注入细胞内注射技术将染料注入细胞内,,故只能测大细胞的Ca 2+变化变化。。
环境空气质量标准(GB3095-1996)二级
标准规定了环境空气质量功能区划分、标准分级、污染物项目、取值时间及浓度限值,采样与分析方法及数据统计的有效性规定。本标准适用于全国范围的环境空气质量评价。环境空气质量功能区分为三类:一类区为自然保护区、风景名胜区和其它需要特殊保护的地区;二类区为城镇规划中确定的居民区、商业交通居民混合区、文化区、一般工业区和农村地区;三类区为特定工业区。空气环境质量分为三级:一类区执行一级标准,二类区执行二级标准,三类区执行三级标准。共限定了六种污染物的浓度值:SO2、TSP、PM10、NOx、NO2、CO、O3、Pb、B[a]P、F。标准同时配有各项污染物分析方法。 1 主题内容与适用范围 本标准规定了环境空气质量功能区划分、标准分级、污染物项目、取值时间及浓度限值,采样与分析方法 及数据统计的有效性规定。 本标准适用于全国范围的环境空气质量评价。 2 引用标准 GB/T 15262 空气质量二氧化硫的测定甲醛吸收副玫瑰苯胺分光光度法 GB 8970 空气质量二氧化硫的测定四氯汞盐副玫瑰苯胺分光光度法 GB/T 15432 环境空气总悬浮颗粒物测定重量法 GB 6921 空气质量大气飘尘浓度测定方法 GB/T 15436 环境空气氮氧化物的测定 Saltzman法 GB/T 15435 环境空气二氧化氮的测定 Saltzman法 GB/T 15437 环境空气臭氧的测定靛蓝二磺酸钠分光光度法 GB/T 15438 环境空气臭氧的测定紫外光度法 GB 9801 空气质量一氧化碳的测定非分散红外法 GB 8971 空气质量苯并[a]芘的测定乙酰化滤纸层析荧光分光光度法 GB/T 15439 环境空气苯并[a]芘的测定高效液相色谱法 GB/T 15264 空气质量铅的测定火焰原子吸收分光光度法 GB/T 15434 环境空气氟化物的测定滤膜氟离子选择电极法 GB/T 15433 环境空气氟化物的测定石灰滤纸氟离子选择电极法 3 定义
流式细胞方法测定
流式细胞仪实验方法 一、实验准备 1.标本制备: 2.最小化非特异性结合: 二、凋亡 1.凋亡的检测方法:网站和其它 2.PI染色法 3.Annexin V 法 4.TUNNEL法 三、细胞因子 1.激活的细胞因子 2.CBA 四、血小板 1.活化 2.活化检测 3.网织血小板 五、红细胞 1.网织红细胞 2.PNH 3.胎儿红细胞 六、肿瘤学 1.DNA 细胞周期 2.蛋白 3.多药耐药 4.微小残留白血病
第一部分标本处理 一、流式细胞术常规检测时的样品制备 (一)直接免疫荧光标记法 取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。 (二)间接免疫荧光标记法 取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。本方法费用较低,二抗应用广泛,多用于科研标本的检测。但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。所以标本制备时应加入阴性或阳性对照。另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。 二、最小化非特异性结合的方法 1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。 2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。这个步骤通过阻断第一抗体和细胞表面或胞内结构的非特异性的交互作用来降低背景。 3.在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞内结构之间的交互作用。 通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。 4.使用F(ab’)2片段会使背景决定于第一或第二抗体与FC受体的全分子结合。大多数的第二抗体的F(ab’)2片段容易利用。而第一抗体的F(ab’)2片段一般是不能利用或很难制作。因此,在NaN3存在的条件下,将新鲜组织或细胞与正常血清一起培育应选择优先加入第一抗体。在此情况下,即使在随后的步骤中用完所有的抗体分子,FC受体决定的背景影响已不再重要。 5.其它:已标记的抗体和其他一些内在的免疫球蛋白或加入实验系统中的其它物质的交叉反应也可能会有背景影响。为了降低背景,在多重标记过程中,所有的已标记的抗体应被吸附,避免其他种类蛋白的交叉反应。
室内空气中可吸入颗粒物的测定方法
附录J (规范性附录)室内空气中可吸入颗粒物的测定方法 可吸入颗粒物的测定方法有重量法(GB 6921)、光散射法(WS/T206)、压电晶体振荡法以及β射线法等。原则上这些方法均可用于室内空气中可吸入颗粒物的测定,但这些方法必须符合GB 6921或WS/T206,或经重量法(GB 6921)比对合格方可。下面仅列出重量法测定室内空气中可吸入颗粒物的分析方法供参考。 J.1 相关标准及依据 本方法主要依据GB 6921《大气飘尘浓度测定方法》。 J.2 原理 使一定体积的空气进入切割器,将10μm以上粒径的微粒分离。小于这一粒径的微粒随着空气流经分离器的出口被阻留在已恒重的滤膜上。根据采样前后滤膜的重量差及采样体积,计算出可吸入颗粒物浓度,以mg/m3表示。 J.3 切割器性能指标 J.3.1 要求所用切割器在收集效率为50%时的粒子空气动力学直径D50=10±1μm。 J.3.2 要求切割曲线的几何标准差σg小于等于1.5。 J.3.3 在有风条件下(风速小于8m/s)切割器入口应具有各向同性效应。 J.3.4 所用切割器必须经国家环境保护总局主管部门(或委托的单位)校验标定。 J.4 采样系统性能指标 J.4.1 在同样条件下三个采样系统浓度测定结果变异系数应小于15%。 J.4.2 在采样开始至终了的时间内,采样系统流量值的变化应在额定流量的±10%以内。 J.4.3 采样设备噪声应符合国家有关标准。 J.5 采样要求 J.5.1 采用合格的超细玻璃纤维滤膜。采样前在干燥器内放置24h,用感量优于0.1mg的分析天平称重,放回干燥器1h后再称重,两次重量之差不大于0.4mg即为恒重。 J.5.2 将已恒重好的滤膜,用镊子放入洁净采样夹内的滤网上,牢固压紧至不漏气。采样结束后,用镊子取出。将有尘面两次对折,放入纸袋,并做好采样记录。 J.5.3 如果测定任何一次浓度,采样时间不得少于1h。测定日平均浓度间断采样时不得少于4次。https://www.360docs.net/doc/a86201278.html, J.5.6 采样后滤膜处理按J.5.1的方法进行。 J.6 计算 可吸入颗粒物浓度按下式计算: c=dn12V1000)G(G×. 式中: c——可吸入颗粒物浓度,mg/m3; G2——采样后滤膜的重量,g; G1——采样前滤膜的重量,g; Vnd——换算成标准状态下的采样体积,m3。67 附录K (规范性附录)室内空气中总挥发性有机物的测定方法 GB/T18883《室内空气质量标准》与GB50325《民用建筑工程室内环境污染控制规范》对总挥发性有机化合物(total volatile organic compounds,TVOC)的定义有所不同,对应的分析方法也不同(分别对应K.1、K.2)。目前国内应用较多的除了上述两个标准所列的分析方法,还有光离子化法(K.3、K.4 )。光离子化总量测定法(K.4)虽没有被上述两个标准列入标准分析方法,其检测结果也与标准分析方法没有可比性,但光离子化法的测定结果也可反映室内总挥发性有机化合物污染程度,又以其较低的市场价格,易于操作而得到广泛应用。鉴于此,本规范将光离子化总量测定法列为非仲裁性分析方法,以供选择使用,评价依据可参照
