基因敲除三大技术对比

基因敲除三大技术对比
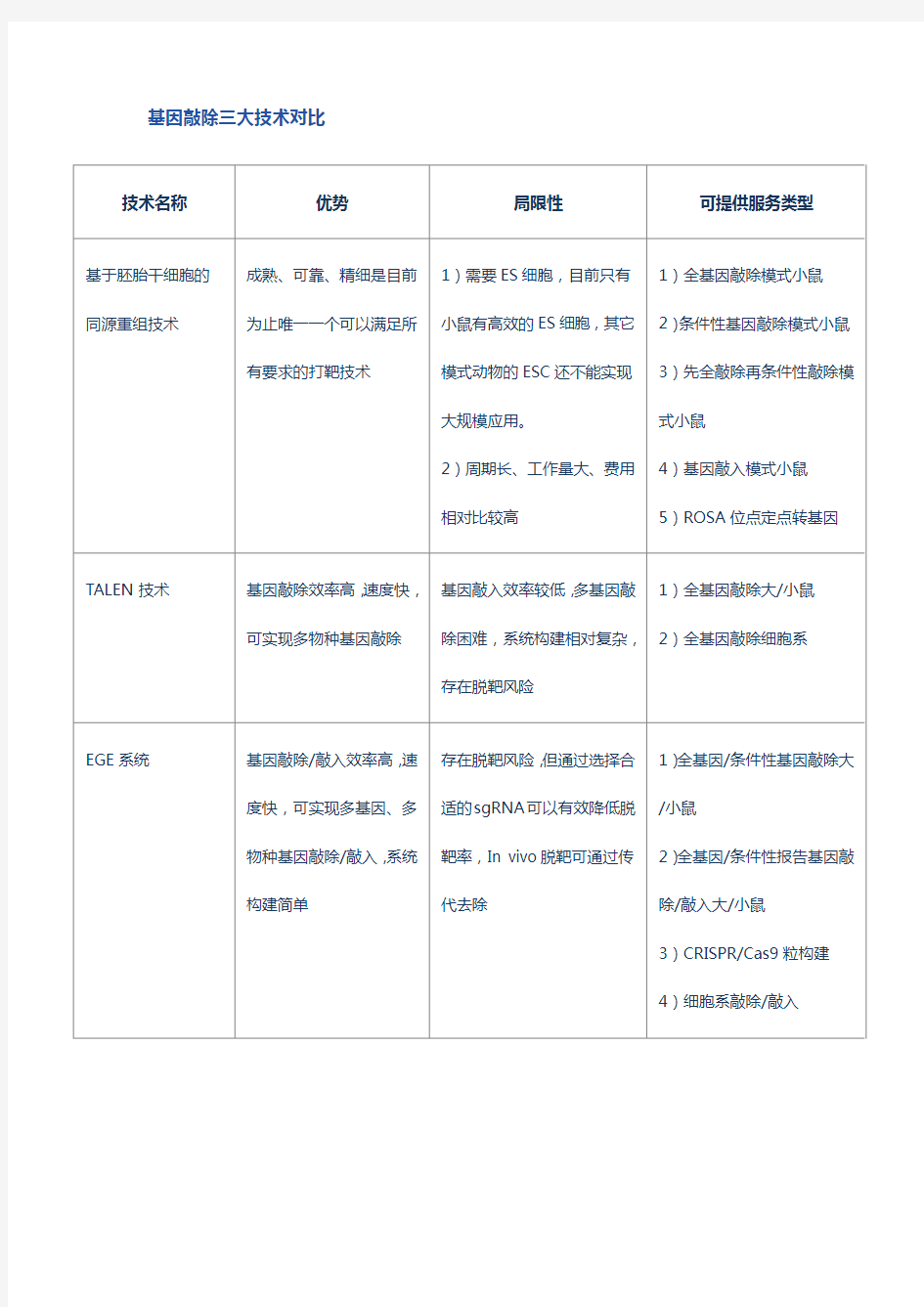
技术名称优势局限性可提供服务类型
基于胚胎干细胞的同源重组技术成熟、可靠、精细是目前
为止唯一一个可以满足所
有要求的打靶技术
1)需要ES细胞,目前只有
小鼠有高效的ES细胞,其它
模式动物的ESC还不能实现
大规模应用。
2)周期长、工作量大、费用
相对比较高
1)全基因敲除模式小鼠
2)条件性基因敲除模式小鼠
3)先全敲除再条件性敲除模
式小鼠
4)基因敲入模式小鼠
5)ROSA位点定点转基因
TALEN技术基因敲除效率高,速度快,
可实现多物种基因敲除基因敲入效率较低,多基因敲
除困难,系统构建相对复杂,
存在脱靶风险
1)全基因敲除大/小鼠
2)全基因敲除细胞系
EGE系统基因敲除/敲入效率高,速
度快,可实现多基因、多
物种基因敲除/敲入,系统
构建简单存在脱靶风险,但通过选择合
适的sgRNA可以有效降低脱
靶率,In vivo脱靶可通过传
代去除
1)全基因/条件性基因敲除大
/小鼠
2)全基因/条件性报告基因敲
除/敲入大/小鼠
3)CRISPR/Cas9粒构建
4)细胞系敲除/敲入
免疫类
B-NSG小鼠:Biocytogen-NOD-SCID-IL2rg
B-NSG小鼠是NOD遗传背景,Prkdc和IL2rg双基因敲除的小鼠,是目前国际公认的免疫缺陷程度最高、最适合人源细胞或组织移植的工具小鼠。
基本特征
?NOD(non-obese diabetes)遗传背景:自发I型糖尿病;其巨噬细胞对人源细胞吞噬作用弱;先天免疫系统,如补体系统和树突状细胞功能降低。
?Prkdcscid :Prkdc(protein kinase DNA-activated catalytic)基因突变,小鼠的功能性T 和B细胞缺失,淋巴细胞减少,表现为细胞免疫和体液免疫的重度联合免疫缺陷(severe combined immune deficiency, scid)。
?Il2rgnull:Interleukin-2受体的gamma链(IL-2R γc,又称CD132)位于小鼠X染色体上,是具有重要免疫功能的细胞因子Il2、Il-4、Il-7、Il-9、Il-15和I-21的共同受体亚基,该基因敲除后的小鼠机体免疫功能严重降低,尤其是NK细胞的活性几乎丧失。
B-NSG小鼠:综合了NOD-SCID-IL2rg背景特征,具有重度免疫缺陷表型,无成熟T细胞、B 细胞和功能性NK细胞,细胞因子信号传递能力缺失等。非常适合人造血干细胞及外周血单核细胞的移植和生长。
优点
?迄今世界上免疫缺陷程度最高的工具小鼠;
?与NOD-scid小鼠相比寿命更长,平均长达1.5年;
?对人源细胞和组织几乎没有排斥反应;
?少量细胞即可成瘤,依赖于细胞系或细胞类型;
?无B淋巴细胞泄漏。
成功案例
小鼠脾脏流式分析图:
主要应用领域
?人源细胞或组织移植?肿瘤和肿瘤干细胞研究
?ES和iPS细胞研究
?造血和免疫学研究
?人类疾病感染模型研究
IL17-EGFP knockin mice
Catalog number:BCG‐IM-0001
Name:C57BL/6-Il17atm1Bcgen
Mouse strain:IL17‐EGFP knockin mice
Gene common name :Interleukin 17A, IL‐17A,IL17A
Chromosome :Chromosome 1
Allele Type :Targeted (Knockin)
Strain of Origin:C57BL/6J
ES Cell Line Strain:C57BL/6
Expressed Gene:EGFP, Enhanced Fluorescent Protein
Note:DNA fragment containing IRES‐EGFP‐SV40polyA signal sequence was inserted downstream of the stop codon of theinterleukin 17A (IL17A) gene.
疾病模型类
基因敲除技术研究进展
兰州交通大学化学与生物工程学院综合能力训练Ⅰ——文献综述 题目:基因敲除技术研究进展 作者:王振宇 学号:201207744 指导教师:谢放 完成日期:2014-7-16
基因敲除技术研究进展 摘要基因敲除是自20世纪80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。在总结已有研究成果的基础上,本文对基因敲除技术的概况、原理方法应用以及近年来基因敲除技术的研究进展作一个简单的综述。 关键词基因敲除 RNA i生物模型基因置换基因打靶同源重组1. 基因敲除技术简介 基因敲除(Gene knockout)是指一种遗传工程技术,针对某个序列已知但功能未知的序列,改变生物的遗传基因,令特定的基因功能丧失作用,从而使部分功能被屏障,并可进一步对生物体造成影响,进而推测出该基因的生物学功能。 它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。基因敲除借助分子生物学、细胞生物学和动物胚胎学的方法,通过胚胎干细胞这一特殊的中间环节将小鼠的正常功能基因的编码区破坏,使特定基因失活,以研究该基因的功能;或者通过外源基因来替换宿主基因组中相应部分,以便测定它们是否具有相同的功能,或将正常基因引入宿主基因组中置换突变基因以达到靶向基因治疗的目的。基因敲除是揭示基因功能最直接的手段之一。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段(即基因打靶),从而达到基因敲除的目的。随着基因敲除技术的发展,除了基因打靶技术外,近年来新的原理和技术也逐渐被应用,比较成功的有RNA干扰技术,同样也可以达到基因敲除的目的。简单的说基因敲除是指将目标基因从基因组中删除。基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、
基因敲除技术研究新进展2011
基因敲除技术研究新进展 黄薇,严放北京大学医学部心血管研究所 gene knockout)技术是20世纪80年代发展起来的一门新技术。应用DNA同源重组技术将灭活的基因导入小鼠胚em cells,ES cells)以取代目的基因,再筛选出已靶向灭活的细胞,微注射入小鼠囊胚。该细胞参与胚胎发育形成可得到纯合基因敲除小鼠。基因敲除小鼠模型的建立使许多与人类疾病相关的新基因的功能得到阐明,使现代生物学进展。基于基因敲除技术对医学生物学研究做出的重大贡献,在该领域取得重大进展的三位科学家,70岁的美国人chi)、82岁的美国人奥利弗?史密西斯(Oliver Smithies)和66岁的英国人马丁?埃文斯(Martin Evans)分享了2 80年代末期的基因敲除技术为第一代技术,属完全性基因敲除,不具备时间和区域特异性。关于第二代区域和组织于1993年。Tsien等[1]于1996年在《Cell》首先报道了第一个脑区特异性的基因敲除动物,被誉为条件性基因敲除oxP系统为基础,Cre在哪种组织细胞中表达,基因敲除就发生在哪种组织细胞中。 imizu等[2]于《Science》报道了以时间可调性和区域特异性为标志的第三代基因敲除技术,其同样以Cre/LoxP系统re的表达。该技术使目的基因的敲除在时间上可人为控制,避免了死胎或动物出生后不久即死亡等现象的出现。 实验室Cui[3]等又报道了第四代基因工程技术,即可诱导的区域性蛋白质敲除技术,用这一技术构建的模式动物可在定蛋白质的功能,从根本上改变了前三代基因敲除技术对蛋白质代谢速度的内在依赖性,达到空前的时间精度,成组研究最先进的工具之一。 以来上述基因敲除技术只能在小鼠上完成,因为只有小鼠的ES细胞能在体外培养中无限增殖并同时保持多分化潜能以及猴等大动物模型在疾病研究中更接近于人类,大动物更有益于某些繁琐的手术操作,同时血浆及组织样本量较大家介绍近两年来基因敲除技术在大动物模型上的突破及进展。 一、大鼠ES细胞基因打靶技术 ,大鼠的生理和药理特性与人类更相近,是研究人类疾病的一种重要动物模型,在心血管疾病和糖尿病等领域的作S细胞在体外难以长期维持自我更新,用传统培养方法无法获得具有生殖传代能力的大鼠ES细胞[5]。因此在过去二物模型远不及小鼠发展迅速。2010年Tong等[6]于《Nature》报道了p53基因敲除大鼠,这在基因敲除技术上又是
基因敲除技术
第23卷武 夷 科 学V o.l23 2007年12月WUY I SCIENCE J OURNA L D ec.2007 文章编号:1001 4276 (2007)01 0187 04 几种常用的基因敲除技术 李今煜,陈健铭,彭振坤 (福建农林大学生命科学学院,福建福州350002) 摘要: 摘要:随着功能基因组学研究的深入发展,基因敲除技术逐渐成为基因功能研究的重要手段,本文就常用的三种基因敲除技术,即同源重组、插入突变、RNA干扰各自的原理、适用的范围和优缺点作简要介绍。关键词: 基因敲除;同源重组;插入突变;RNA干扰 中图分类号: Q343.1 文献标识码: A 随着越来越多生物的全基因组被测序,功能基因组学成为时下研究的热点。研究基因功能的方法主要有两种思路,一是通过增强其表达,取得表达产物进行研究,二是减弱或者终止其表达,观察整体功能的变化,进而推测相应的基因功能。前者因为不能反映基因产物的真实表达情况,而逐渐被抛弃。后者将基因与生物的整体功能联系起来考察,并能为基因的功能提供直接证据,因而其技术不断得到发展和完善,其中最常用的就是基因敲除(gene knockou t)技术。 基因敲除技术除最早的同源重组技术外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和RNA,i它们同样可以达到基因敲除的目的。下面就这几种基因敲除技术简要进行介绍。 1 利用同源重组进行基因敲除 基因敲除是在同源重组技术及胚胎干细胞(e mbryon i c ste m cel,l ES细胞)技术的基础上逐步完善发展起来,主要是利用DNA转化技术,将含有目的基因和靶基因同源片段的重组载体导入靶细胞,通过载体与靶细胞染色体上同源序列间的重组,将外源基因整合入内源基因组内,使外源基因得以表达。通过研究靶细胞或者个体在目的基因插入前后遗传特性的改变,达到研究基因功能的目的[1]。 基因敲除技术已从最初简单的完全敲除发展到条件敲除阶段,现正朝着特定组织基因敲除、特定时间基因敲除的可调控敲除方向发展。完全基因敲除是通过同源重组直接将靶基因在细胞或者动物个体中的活性完全消除;而条件基因敲除则是将某个基因的修饰限制于特定类型的细胞或个体发育特定的阶段,即通过位点特异的重组系统实现特定基因敲除[2],现阶段以噬菌体的C re/Loxp系统和酿酒质粒的FLP/FRT系统应用得最为广泛[3]。 虽然基因敲除技术的广泛使用使其成为研究基因功能重要的技术手段,但目前仍然存在 收稿日期:2007-09-26 基金项目:福建省自然科学基金计划资助项目(项目编号:2006J0052)。 作者简介:李金煜(1976-),女,硕士,研究方向:主要从事生物化学与分子生物学领域的研究。
转基因技术的基本概念
转基因技术的基本概念:(来源:生命经纬) (一)转基因技术的定义 将人工分离和修饰过的基因导入到生物体基因组中,由于导入基因的表达,引起生物体的性状的可遗传的修饰,这一技术称之为转基因技术。人们常说的“遗传工程”、“基因工程”、“遗传转化”均为转基因的同义词。经转基因技术修饰的生物体在媒体上常被称为“遗传修饰过的生物体”(Genetically modified organism,简称GMO)。 (二)几种常用的植物转基因方法 遗传转化的方法按其是否需要通过组织培养、再生植株可分成两大类,第一类需要通过组织培养再生植株,常用的方法有农杆菌介导转化法、基因枪法;另一类方法不需要通过组织培养,目前比较成熟的主要有花粉管通道法。 1.农杆菌介导转化法 农杆菌是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位,并诱导产生冠瘿瘤或发状根。根癌农杆菌和发根农杆菌中细胞中分别含有Ti质粒和Ri质粒,其上有一段T-DNA,农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中。因此,农杆菌是一种天然的植物遗传转化体系。人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株。 农杆菌介导法起初只被用于双子叶植物中,近年来,农杆菌介导转化在一些单子叶植物(尤其是水稻)中也得到了广泛应用。 2.基因枪介导转化法 利用火药爆炸或高压气体加速(这一加速设备被称为基因枪),将包裹了带目的基因的DNA溶液的高速微弹直接送入完整的植物组织和细胞中,然后通过细胞和组织培养技术,再生出植株,选出其中转基因阳性植株即为转基因植株。与农杆菌转化相比,基因枪法转化的一个主要优点是不受受体植物范围的限制。而且其载体质粒的构建也相对简单,因此也是目前转基因研究中应用较为广泛的一种方法。 3.花粉管通道法 在授粉后向子房注射合目的基因的DNA溶液,利用植物在开花、受精过程中形成的花粉管通道,将外源DNA导入受精卵细胞,并进一步地被整合到受体细胞的基因组中,随着受精卵的发育而成为带转基因的新个体。该方法于80年代初期由我国学者周光宇提出,我国目前推广面积最大的转基因抗虫棉就是用花粉管通道法培育出来的。该法的最大优点是不依赖组织培养人工再生植株,技术简单,不需要装备精良的实验室,常规育种工作者易于掌握。(三)常用的动物转基因技术 1.显微注射法 在显微镜下,用一根极细的玻璃针(直径1-2微米)直接将DNA注射到胚胎的细胞核内,再把注射过DNA的胚胎移植到动物体内,使之发育成正常的幼仔。用这种方法生产的动物约有十分之一是整合外源基因的转基因动物。 2.体细胞核移植方法 先在体外培养的体细胞中进行基因导入,筛选获得带转基因的细胞。然后,将带转基因体细胞移植到去掉细胞核的卵细胞中,生产重构胚胎。重构胚胎经移植到母体中,产生的仔畜百分之百是转基因动物。 (四)转基因技术与传统技术的关系 自从人类耕种作物以来,我们的祖先就从未停止过作物的遗传改良。过去的几千年里农作物改良的方式主要是对自然突变产生的优良基因和重组体的选择和利用,通过随机和自然的方式来积累优良基因。遗传学创立后近百年的动植物育种则是采用人工杂交的方法,进行
CRISPR cas9基因敲除原理及其应用
CRISPR/Cas9基因敲除原理及其应用 CRISPR(clustered,regularly interspaced,short palindromic repeats)是一种来自细菌降解入侵的病毒DNA或其他外源DNA的免疫机制。在细菌及古细菌中,CRISPR系统共分成3类,其中Ⅰ类和Ⅲ类需要多种CRISPR相关蛋白(Cas蛋白)共同发挥作用,而Ⅱ类系统只需要一种Cas蛋白即可,这为其能够广泛应用提供了便利条件[1]。 目前,来自Streptococcus pyogenes的CRISPR-Cas9系统应用最为广泛。Cas9蛋白(含有两个核酸酶结构域,可以分别切割DNA两条单链。Cas9首先与crRNA及tracrRNA结合成复合物,然后通过PAM序列结合并侵入DNA,形成RNA-DNA复合结构,进而对目的DNA双链进行切割,使DNA双链断裂。 由于PAM序列结构简单(5’-NGG-3’),几乎可以在所有的基因中找到大量靶点,因此得到广泛的应用。CRISPR-Cas9系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞,是目前最高效的基因组编辑系统[1]。 通过基因工程手段对crRNA和tracrRNA进行改造,将其连接在一起得到sgRNA(single guide RNA)。融合的RNA具有与野生型RNA类似的活力,但因为结构得到了简化更方便研究者使用。通过将表达sgRNA的原件与表达Cas9的原件相连接,得到可以同时表达两者的质粒,将其转染细胞,便能够对目的基因进行操作[2,3]。
目前常用的CAS9研究方法是通过普通质粒,质粒构建流程如下:Cas9质粒构建 设计2条单链oligo序列; 退火形成双链DNA pGK1.1 将双链DNA连接到载体 中 转化G10competent cell 筛选阳性克隆;测序验证 序列;质粒大提;电转染 靶细胞 在细胞内crRNA识别靶 位点,Cas9对靶位点进行 随机剪切 Cruiser TM酶切细胞池,计 算突变率;Cruiser TM酶切 初筛阳性克隆;将阳性克 隆测序验证;做敲除序列 比对分析。
(三)转基因技术 - 国家科技重大专项
附件1 转基因重大专项2018年度课题支持范围 根据转基因重大专项总体实施方案和“十三五”实施计划,针对我国动植物转基因研发和产业化发展中急需解决的关键问题,协调推进技术研发与产品熟化,拓展转基因研究领域,进一步遴选新型重大产品、重要基因和关键技术,2018年拟启动实施11个重大课题和一批重点课题,提升我国转基因动植物研发水平和能力。 一、重大课题 (一)早熟抗病转基因棉花新品种培育 1. 研究目标:根据我国棉区结构调整,通过聚合早熟、抗黄萎病、抗虫、抗除草剂和株型等主要性状,培育适宜油后、麦后直播, 以及西北内陆无膜种植的早熟多抗转基因棉花新品系(种),改良棉花品种早熟、抗病和抗除草剂等特性,并示范推广。 2. 研究内容:利用转vgb等基因的早熟材料、转iap和p35等基因的抗黄萎病材料以及抗草甘膦等除草剂的转基因棉花
材料,围绕早熟、抗病虫、抗除草剂等重要性状,采用分子聚合育种等技术,创制早熟、抗病虫、抗除草剂等综合性状优良的转基因棉花新材料和新品系,培育早熟抗黄萎病转基因棉花新品种。 3. 考核指标:创制早熟、抗黄萎病、抗虫、抗除草剂等转基因棉花新材料30份,筛选转基因棉花新品系30个,转基因抗黄萎病新品系的黄萎病相对病情指数20以下;培育早熟转基因棉花新品种10—12个,累计推广面积1500万亩;申报发明专利10—15项,获得发明专利8—10项,申报品种权10—12项,获得品种权5—6项。 4. 实施期限:2018—2020年。 5. 组织实施方式:采取“择优委托、专家论证”的方式确定课题承担单位。 (二)高品质转基因奶牛新品种培育 1.研究目标:以功能型乳铁蛋白转基因奶牛为重点,完成食用安全评价和功能性产品开发研究,完成安全证书和产品生产许可证书申报,制定转基因奶牛的品种、饲养管理、繁殖
基因敲除小鼠的制作方法
.. 一、常规基因敲除鼠(Conventional Knockout) 常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用Neo Cassette 替换掉。这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。 二、条件性基因敲除小鼠(Conditional Knockout) 条件性基因敲除小鼠是通过基因打靶,把两个loxP 位点放到目的基因一个或几个重要的外显子的两边。该小鼠和表达Cre酶小鼠杂交之前,其目的基因表达完全正常。当和组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。 条件性基因敲除鼠适用范围为:(1)该基因有胚胎致死性;(2)用于研究该基因在特定的组织或细胞中的生理病理功能。 三、基因敲入小鼠(Knockin) 基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。 此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。 获得嵌合体及之后品系纯化详细流程: 基因敲除其他方法: 一、ZFN技术制作基因敲除鼠 ZFN能够识别并结合指定的基因序列位点,并高效精确地切断。随后细胞利用天然的DNA 修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而ZFN的基因敲除效率能达到10%。利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。 这项技术中设计特异性的ZFN是最关键的环节,目前研究者采用计算生物学方法设计高特异性的ZFN,但ZFN的脱靶(off target),也就是把不该切的地方切了的问题仍是一个挑战。也正因为这个原因,利用ZFN技术进行小鼠的基因修饰还无法完全取代传统技术。 二、TALEN技术制作基因敲除鼠 TALEN 技术是一种崭新的分子生物学工具。科学家发现,来自一种植物细菌的TAL蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。利用TAL的序列模块,可组装成特异结合任意DNA序列的模块化蛋白,从而达到靶向操作内源性基因的目的,它克服了ZFN方法不能识别任意目标基因序列,以及识别序列经常受上下游序列影响等问题,而具有ZFN相等或更好的灵活性,使基因操作变得更加简单方便。然而同样因为脱靶的问题,利用TALEN技术进行小鼠的基因修饰仍然无法取代传统技术。 ;.
简述转基因技术原理
转基因技术的理论基础来源于进化论衍生来的分子生物学。基因片段的来源可以是提取特定生物体基因组中所需要的目的基因,也可以是人工合成指定序列的DNA片段。DNA片段被转入特定生物中,与其本身的基因组进行重组,再从重组体中进行数代的人工选育,从而获得具有稳定表现特定的遗传性状的个体。该技术可以使重组生物增加人们所期望的新性状,培育出新品种。 1992年荷兰培育出植入了人促红细胞生成素基因的转基因牛,人促红细胞生成素能刺激红细胞生成,是治疗贫血的良药。转基因技术标志着不同种类生物的基因都能通过基因工程技术进行重组,人类可以根据自己的意愿定向地改造生物的遗传特性,创造新的生命类型。同时转基因技术在药物生产中有着重要的利用价值。转基因技术,包括外源基因的克隆、表达载体、受体细胞,以及转基因途径等,外源基因的人工合成技术、基因调控网络的人工设计发展,导致了21世纪的转基因技术将走向转基因系统生物技术2000年国际上重新提出合成生物学概念,并定义为基于系统生物学原理的基因工程与转基因技术。 1.转基因的细胞学原理: (1)细胞周期及MPF:细胞周期可人工分成4个时期,分别为G1期、S期、G2期和M期。细胞在正常情况下,沿着G1-S-G2-M路线运转。S期为DNA合成期,M期为有丝分裂期,M期结束到S期开始之前为G1期,S期末到有丝分裂期(M期)为G2期。有丝分裂的启动由成熟促进因子也叫M期促进因子(maturation/mitosism/meiosis promoting factor,MPF)调控,MPF 在细胞分裂中呈周期性变化即分裂后逐渐积累,到G2晚期达到高峰,由中期向后期转换时骤然消失。因此推测MPF是真核细胞M期的一个基本调节物质,能引导细胞由间期向M期转变。MPF由蛋白激酶激活,存在于所有的真核细胞中(包括减数分裂的性细胞)。但并非所有的细胞都是周期中细胞,某些细胞在一定的条件下可以脱离细胞周期进入G0期或分化为不分裂的细胞,而且G0期细胞可通过诱导重新进入周期。 (2)通过MⅡ期的卵母细胞转基因:MⅡ期的卵母细胞的MPF含量很高,可以诱导细胞核发生一系列变化包括核膜破裂(NEBD)和早熟染色体凝集(premature chromosome condensation,PCC),处于减数分裂MⅡ期的卵母细胞无核膜的时间远远长于有丝分裂M期的细胞。所以此时期的卵母细胞可作为基因导入的受体。据此1998年Anthonv等对逆转录病毒载体感染发育早期的动物胚胎方法加以改进,用逆转录病毒载体注射MⅡ期的卵母细胞,注射完毕的卵母细胞同获能后的精子共同孵育后,体外发育至囊胚,再移植到母牛体内得到了转基因小牛。1999年Anthonv等又将精子与外源基因共孵育,然后将精子头部显微注射入MⅡ期的卵母细胞,这两种方法共同之处都是利用MⅡ期的卵母细胞无核膜,外源基因易导入的 特点。 2.转基因的胚胎学原理: (1)哺乳动物转基因的胚胎学原理:精子和卵子只有发育成熟后,精卵相遇时才能完成受精过程。精子进入卵子后头尾分离,胞核出现核仁,形成核膜,头部膨大形成雄原核;同时卵子排出第二极体形成雌原核。一般来说雄原核比雌原核大。接着雌雄原核的核膜消失,雌雄原核融合。随后细胞周期性卵裂,分裂球增加到32个时形成桑葚胚,进入子宫再发育至囊胚,此前的胚胎细胞具有很强的分化能力。从哺乳动物受精卵分裂发育的规律来看,转基因操作时较合适的部位是受精卵的雄原核,精子进入卵细胞后的1小时,雄原核和雌原核还未融合,在显微镜下容易看到雄原核。多数研究者在此时期把外源基因显微注射到雄原核,通
基因敲除技术的最新进展doc - 丁香园
基因敲除技术的最新进展 yunfenglin 干细胞与组织工程讨论版 【摘要】 自从上世纪80年代初的胚胎干细胞技术的成熟,在短短的20年里,关于基因敲除动物模型的报道呈几何数增长。现在的技术已经可以产生在时间和空间上都可以人为控制的,从点突变到染色体组大片段的删除和重排的各种基因突变小鼠,这样就可以让研究每个基因的具体功能成为可能。本文将首先简介基因敲除技术的技术背景、基本原理、基本步骤;然后将重点介绍现在基因敲除的常用策略及其利弊;接着将探讨基因打靶结果不理想的常见因素,包括基因背景、基因重复、基因补偿、和基因补充;最后介绍基因打靶技术的技术热点,包括组织特异性打靶、诱导性打靶。并探讨基因打靶技术在颌面外科的应用前景。 【关键词】基因敲除、条件性基因打靶、组织特异性基因打靶、诱导性基因打靶 技术背景 基因打靶技术是20世纪80年代发展起来的[1],是建立在基因同源重组技术基础以及胚胎干细胞技术基础上的一种新分子生物学技术。所谓胚胎干细胞(Embryonic Stem cell,ES)是从着床前胚胎(孕3—5天)分离出的内细胞团(Inner cell mass,ICM)细胞[2],它具有向各种组织细胞分化的多分化潜能,能在体外培养并保留发育的全能性。在体外进行遗传操作后,将它重新植回小鼠胚胎,它能发育成胚胎的各种组织。而基因同源重组是指当外源DNA片段大且与宿主基因片段同源性强者并互补结合时,结合区的任何部分都有与宿主的相应片段发生交换(即重组)的可能,这种重组称为同源重组。[3] 基因打靶就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术[4]。它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、可靠,它的发展将为发育生物学、分子遗传学、免疫学及医学等学科提供了一个全新的、强有力的研究、治疗手段,具有广泛的应用前景和商业价值。现在基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。2000年初的敲除了决定表面抗原的猪的模型的成功建立更是为异种器官移植排除了一道重要的障碍,展示了基因敲除技术的美好前景。 基本步骤 利用基因打靶技术产生转基因动物的程序一般为: a.ES细胞的获得:现在基因敲除一般应用于鼠,而最常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系逐渐被发展应用,最近来自于C57BL/6×CBN/JNCrj F1小鼠的胚胎干细胞系成功地用于基因敲除。c57BL/6小鼠种系等已经广泛的应用于免疫学领域,并以此为背景建立了许多成功的转基因模型。[5,9,11] b.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因(如neo基因,TK基因等)的载体上,此重组载体即为打靶载体。因基因打靶的目的不同,此载体有不同的设计方法,可分为替换性载体和插入型载体[6,7]。如为了把某一外源基因引入染色体DNA的某一位点上,这种情况下应设计的插入型载体要包括外源
基因敲除技术的原理、方法和应用
基因敲除技术的原理、方法和应用 2010-01-24 17:03:43 来源:易生物实验浏览次数:6302 网友评论 0 条 1.基因敲除概述 2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 2.2利用随机插入突变进行基因敲 除。 2.3.RNAi引起的基因敲除。 3.基因敲除技术的应用及前景 4.基因敲除技术的缺陷 关键词:基因敲除 1.基因敲除概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA,它们同样可以达到基因敲除的目的。 2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。1985 年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型 [1]。直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1): a.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
转基因技术介绍
转基因技术 编辑 转基因即转基因技术。 转基因技术(Genetically Modified,简称GM),是指运用科学手段,从某种生物体基因组中提取所需要的目的基因,或者人工合成指定序列的基因片段,将其转入另一种生物中,使与另一种生物的基因组进行重组,再从重组体中进行数代的人工选育,从而获得具有特定的遗传性状个体的技术。该技术可以使重组生物增加人们所期望的新性状,培育出新品种。转基因技术的理论基础来源于分子生物学。人们常说的"遗传工程"、"基因工程"、"遗传转化"均为转基因的同义词(但如今人们对改变原有动植物性状的技术称为转基因技术(狭义),将对微生物的操作称为遗传工程技术(狭义)。经转基因技术修饰的生物体在媒体上常被称为"遗传修饰过的生物体"(Genetically modified organism,简称GMO)。 目录 1发展历史 2基本技术过程 3分类 人工转基因 植物转基因 动物转基因 微生物基因重组 自然转基因 4转基因技术产物 转基因生物 转基因食品 5技术特点 组合原理 植物 动物 6与杂交的区别 种基根杂交技术 植物杂交 杂交畜牧 7转基因技术现状 转基因食品 技术应用 商业化 8媒体报道 9转基因植物转化方法 农杆菌介导转化 花粉管通道法 核显微注射法 基因枪法 精子介导法 核移植转基因法 体细胞核移植法
10影响 减少温室气体排量 疑问 对环境系统 对生态物种 动物试验 11社会 学者批评 转基因标识法案 12相关事件 动物异常事件 转基因水稻争议 巴西坚果事件 普斯泰事件 转基因玉米事件 俄转基因食品事件 广西迪卡玉米事件 转基因大米试验 实验鼠致癌事件 猕猴喂养实验 律师申请公开遭拒 13批准作物一览 1发展历史 1974年,波兰遗传学家斯吉巴尔斯基(Waclaw Szybalski)称基因重组技术为合成生物学概念,1978年,诺贝尔医生奖颁给发现DNA限制酶的纳森斯(Daniel Nathans)、亚伯(Werner Arber)与史密斯(Hamilton Smith)时,斯吉巴尔斯基在《基因》期刊中写道:限制酶将带领我们进入合成生物学的新时代。转基因技术,包括外源基因的克隆、表达载体、受体细胞,以及转基因途径等,外源基因的人工合成技术、基因调控网络的人工设计发展,导致了21世纪的转基因技术将走向转基因系统生物技术2000年国际上重新提出合成生物学概念,并定义为基于系统生物学原理的基因工程与转基因技术。 2基本技术过程 (1)从生物有机体复杂的基因组中,分离出带有目的基因的DNA片段;或者人工合成目的基因。 (2)在体外, 将带有目的基因的DNA 片段连接到能够自我复制并具有选择标记的载体分子上, 形成重组DNA分子。 (3)将重组DNA分子引入到受体细胞(亦称宿主细胞或寄主细胞) 。 (4)带有重组体的细胞扩增,获得大量的细胞繁殖体。 (5) 从大量的细胞繁殖群体中,筛选出具有重组DNA分子的细胞克隆。 (6)将选出的细胞克隆的目的基因进一步研究分析,并设法使之实现功能蛋白的表达。 3分类 转基因过程按照途径可分为人工转基因和自然转基因,按照对象可分为植物转基因技术,动物转基因技术和微生物基因重组技术。 人工转基因 将人工分离和修饰过的基因导入到生物体基因组中,由于导入基因的表达,引起生物体的性状的可遗传的修饰,这一技术称之为转基因技术(Transgene technology)。人们常说的“遗传工
基因敲除技术
基因敲除技术 顾欣徐夕陈文舒贾琳莹 基因敲除技术是一种定向改变细胞或生物个体遗传信息的实验手段。通过对生物体遗传信息的定向修饰----外源基因定位引入,并使修饰后的遗传信息在生物体内遗传,表达突变的性状,从而研究基因功能等生命科学的重大问题,以及提供相关的疾病治疗,新药筛选评价模型等。基因敲除技术的发展已使得对特定细胞,组织或动物个体的遗传物质进行修饰成为可能。它的产生和发展建立在胚胎干细胞(embryonic stem cell,ES细胞)技术和同源重组技术成就的基础之上,并促进了相关技术的进一步发展。 方法 走进21世纪,生命科学已经进入了后基因组时代。大规模的基因功能研究正式成为生命科学研究的热点。宏伟的人类基因组计划的顺利实施,完成了人类基因组及多种模式生物基因组的序列测定。基因敲除技术综合应用现代生物医学各个研究领域的高新技术及最新研究成果,提供一个研究系统使得研究者可以在生物整体水平,组织水平,细胞水平,分子水平各个层次上全面系统地研究基因的功能。在基因功能研究方面,它具有地方所难以比拟的直接性和有效性,是后基因组时代进行功能基因组学研究的重要平台技术。从第一例成功的基因敲除报道至今,在包括美国,日本和欧洲各国在内的发达国家中,基因敲除技术已成为常规性的重要生物医学研究手段。利用基因敲除技术得到特定靶基因功能获得或者缺失的小鼠突变体并进行相关表型的研究将最终有利于绘制人类基因在各种生理和病理过程中功能的立体图卷。对基因功能的深入研究和了解将有助于发现新的具有应用价值的基因和蛋白,因此,通过基因敲除进行的基因功能研究将成为今后医药产业的基础。 基因敲除技术的发展使得它可以满足大规模基因功能研究的需要。基因敲除研究结合随机化学物质(如ENU)诱变的研究也正在世界上多个小鼠基因组中心进行。除了基因完全失活的小鼠模型,携带基因功能获得或者部分基因功能丧失突变的小鼠模型将会有助于对基因功能更全面和更深入的了解。 由于人类作为研究对象的局限性,发展相应的人类疾病动物模型,对于研究人类疾病的分子机制以及研制相应的诊断,治疗药物均具有非常重要的意义。通过基因敲除研制的人类疾病小鼠已有数百种,这些模型的建立极大地丰富了人类对这些疾病相关基因功能的了解。
基因敲除技术样本
基因敲除技术 点击次数: 2605 发布日期: -5-25 来源: 本站仅供参考, 谢 绝转载, 否则责任自负 1.概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术, 是经过一定的途径使机体特定的基因失活或缺失的技术。一般意义上的基因敲除主要是应用DNA同源重组原理, 用设计的同源片段替代靶基因片段, 从而达到基因敲除的 目的。随着基因敲除技术的发展, 除了同源重组外, 新的原理和技术也逐渐被应用, 比较成功的有基因的插入突变和iRNA, 它们同样能够达到基因敲除的目的。2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初, 胚胎干细胞( ES细胞) 分离和体外培养的成功奠定了基因敲除的技术基础。1985年, 首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到 1987年, Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在, 运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的 使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1):
图1.基因同源重组法敲除靶基因的基本步骤 a.基因载体的构建: 把目的基因和与细胞内靶基因特异片段同源的DNA 分子 都重组到带有标记基因(如neo 基因, TK 基因等)的载体上, 成为重组载体。基因敲除是为了使某一基因失去其生理功能, 因此一般设计为替换型载体。 b.ES 细胞的获得: 现在基因敲除一般采用是胚胎干细胞, 最常见的是鼠, 而兔, 猪, 鸡等的胚胎干细胞也有使用。常见的鼠的种系是129及其杂合体, 因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向, 是基因敲除的理想实验动物。而其它遗传背景的胚胎干细胞系也逐渐被发展应用。[2, 3] c.同源重组: 将重组载体经过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中, 使外源DNA与胚胎干细胞基因组中相应部分发生同源重组, 将重组载体中的DNA序列整合到内源基因组中, 从而得以表示。一般地, 显微注射命中率较高, 但技术难度较大, 电穿孔命中率比显微注射低, 但便于使用。[4,5] d.选择筛选已击中的细胞: 由于基因转移的同源重组自然发生率极低, 动物的重组概率为10-2~10-5, 植物的概率为10-4~10-5。因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。当前常见的方法是正负筛选法( PNS法) , 标记基因的特异位点表示法以及PCR法。其中应用最多的是PNS法。[6]
转基因技术
转基因技术 转基因产品(GMOs)是通过基因重组技术获得的基因改良生物及其加工产品。对转基因产品,用转基因产品定性检测方法(qualitative detection)对样品中转基因成分进行检测,以判定该样品是否为转基因产品。 实时荧光PCR法 是目前最有发展前途的定量检测方法,也是目前最适合出入境检验检疫的检测技术之一。所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光集团,利用荧光信号积累,实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。该方法可以有效提高检测的准确性和灵敏度。它既能做定性检测,加入标准品也能做定量检测。 酶联检测方法, 应称作酶联免疫吸附测定,是把抗原及抗体的免疫反应和酶的高效催化反应有机地结合而发展起来的,用酶作为标记物或指示剂进行抗原或抗体定性和定量测定的综合技术。试纸条检测方法也是转基因产品抗血清检测方法。这两种方法是中国与美国谷物化学家协会(AACC)联合研究的。中方主要承担转基因玉米和大豆两个品种的抗血清特异性、灵敏度以及定量检测的研究内容。目前,这两种方法已上升为ISO标准,即将发布。其技术创新点为: 研究制定了《基因检验实验室技术要求》,建立了我国口岸系统转基因产品检测实验室体系。建立了转基因产品的亲和诱捕技术,较好解决了DNA提取的技术难点,该方法特别适用于食品和饲料等多组分样品。 建立了精炼植物油和深加工食品中核酸的提取方法。针对食用油脂中DNA含量极低、破坏严重的特点,建立了食用油脂中DNA提取方法。 建立了边界序列的测定方法和转基因作物品系鉴定方法,首次测定出番茄棉花边界序列。对转基因的检测不仅能检测种类,而且还能检测品系,如对基因玉米、马铃薯、大豆等都能进行鉴定。 行设计了实时荧光PCR定量(性)检测引物32对和相对应的探针,建立了转基因产品实时荧光PCR定量(性)检测方法,该方法能检测目前国内外已报道的主要商品化转基因品种。建立了转基因产品的基因芯片检测方法。自行研究设计了基因芯片检测的引物和探针,优化基因芯片杂交条件和多重PCR反应条件,首次建立了高通量的转基因产品基因芯片检测方法。 研究制定了12项行业标准,7项国家标准。
浅谈对转基因的看法
浅谈对转基因看法 转基因技术是现代生物技术的核心,运用转基因技术培育高产、优质、多抗、高效的新品种,能够降低农药、肥料投入,对缓解资源约束、保护生态环境、改善产品品质、拓展农业功能等具有重要作用.目前,世界许多国家把转基因生物技术作为支撑发展、引领未来的战略选择,转基因技术已成为各国抢占科技制高点和增强农业国际竞争力的战略重点. 我国是一个人口大国,解决十三亿人口的吃饭问题始终是头等大事.在工业化、城镇化快速发展的过程中,突破耕地、水等资源约束,保障国家粮食安全和农产品长期有效供给,归根结底要靠科技创新和应用.推进转基因技术研究与应用,是着眼于未来国际竞争和产业分工的重大发展战略,是确保国家粮食安全的必然要求和重要途径.经过多年努力,我国在重要基因发掘、转基因新品种培育及产业化应用等方面都取得了重大成果.当前我们必须认真实施好国家转基因生物新品种培育重大专项,努力抢占未来经济科技竞争制高点,加速转基因生物技术研究与应用健康发展,为我国农业可持续发展提供强有力的科技支撑. 同样是为了防治病虫害,同样是为了满足人类对食物的需求,化学农药和转基因作物却遇到了公众截然相反的态度.化学农药问世后,人们欢呼人类在同病虫害的斗争中取得胜利.转基因作物问世后,争议声却一直不绝于耳,公众始终充满疑虑. 公众最关心的是转基因食品的安全性,焦点集中在两个方面:转基因食品是否对人和哺乳动物有毒性?是否会引起过敏?事实是,在有关国际机构以及各国政府高度重视和严格监管下,转基因作物在全球大面积商业化种植13年来,从未发生安全性事故. 转基因食品尽管是个新鲜词,但“基因”一词已有100年历史,它由丹麦遗传学家约翰逊于1909年提出.基因能控制生物的性状,转基因就是把一种生物的基因转入到另外一种生物中,使被转入基因的生物产生人类需要的新性状.人类在文明进程中所做的作物品种选育,实质也属于“转基因”,目的是获得产量更高、品质更好的农作物,使其更符合人类的需求. 有人担心转基因食品的外源基因会跑进人体,进而改变人的基因.科学常识告诉我们,所有生物的所有基因都是由核酸组成的,进入胃肠后都要被消化、降解成小分子,不再是完整的基因,不会以基因的形态进入人体组织.我们每天食用的米饭、馒头、蔬菜、肉类等含有亿万个基因,有谁担心过这些基因对自己有害而不去吃饭? 转基因在争论中前行.转基因农作物自1996年在全球开始大规模种植以来,带来了巨大的经济效益和显着的社会与生态效益,其推广速度之快为近代农业科技史上所罕见.目前,美国市场上70%的食品中都含有转基因成分.据估计,全球有半数以上人口食用过转基因食品. 诚然,同任何新生事物一样,转基因不可能十全十美,10多年时间虽然没有出什么问题,但也不能说今后百分之百的没风险,这就注定转基因还要在争论中前行.公众对转基因食品的了解认识还需要一个过程,争论在时刻提醒科学家和政府,把转基因的安全性始终放在重要位置,趋利避害,防范风险,确保转基因技术造福人类
基因敲除小鼠技术
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基 础研究实验室转向商业模式,成为一项高度标准化的新兴产业 一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生 以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等 常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管 如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基 因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi 和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的
转基因技术
转基因技术 摘要:转基因技术就是将人工分离和修饰过的基因导入到目的生物体的基因组中,从而达到改造生物的目的。转基因技术就是把一个生物体的基因转移到另一个生物体DNA中的生物技术。 1.转基因技术的进步历程 1945年首次使用分子生物学这一术语,主要指针对生物大分子的化学和物理结构的研究。1871年,Miescher从死的白细胞核中分离出DNA。1928年,Griffith发现肺炎链球菌的无毒菌株与其被杀死的有毒菌株混合,即变成致病菌株。1944年Avery等发现从强致病力的S 型肺炎链球菌中提取的DNA能使致病力弱的R型转化成S型。如果加入少量DNA酶,这种转化立即消失,但加入各种蛋白水解酶则不能改变这种变化。这一著名的实验证明了引起细菌遗传改变的物质为DNA 1949年发现了了Chargaff规律:G=C,A=T;以及DNA具有典型的螺旋结构 1953年,Watson和Crick提出了DNA双螺旋模型 于1970年从大肠杆菌中分离出第一个能切割DNA的酶,它可以在DNA核苷酸序列的专一性位点上切割DNA分子,这种酶被称为限制性内切酶,以后很多种限制性酶陆续被分离出来,目前已有数百种。 在此以前,科学家已经发现了细菌中存在的DNA连接酶。1972年Berg首次将不同的DNA片段连接起来,并且将这个重组的DNA分子有效地插入到细菌细胞之中,重组的DNA进行繁殖,产生了重组DNA的克隆。Berg是重组DNA或基因工程技术的创始人,并于1980年获得了诺贝尔奖。 重组DNA技术的出现奠定了现代转基因技术的基础。转基因技术的基本原理就是在生物体中插入新的遗传物质。1973年,科学家在大肠杆菌中表达了一个来自沙门氏菌的基因,从而首次在科学界引发了关于转基因安全性的深入思考 1978年重组DNA技术公司-Genetech利用重组DNA技术创建了一个新的大肠杆菌菌系,用于生产人胰岛素。 相关研究进行监管。 1978年重组DNA技术公司-Genetech利用重组DNA技术创建了一个新的大肠杆菌菌系,用于生产人胰岛素。 之后不久,Herbert Boyer创建全球第一个重组DNA技术公司-Genetech,并于1978年宣布利用重组DNA技术创建了一个新的大肠杆菌菌系,用于生产人胰岛素。1986年,美国加利福尼亚州奥克兰市一个叫做领先遗传科学(Advanced Genetic Sciences)的小型生物技术公司准备对一种保护植物免受冻害的基因工程防霜负型细菌进行田间试验,但该试验由于反生物技术人士的阻扰而一再延期。同年,孟山都公司取消了一项表达杀虫蛋白的基因工程微生物的田间试验。 20世纪80年代后期到90年代初期,包括粮农组织(FAO)、世界卫生组织(WHO)在内的一些国际组织开始制定关于转基因植物及其产品的安全评价规范。 80年代后期,在加拿大、美国开始出现小规模的转基因植物田间试验。90年代中期,美国首次批准转基因植物大面积种植,从而揭开了转基因植物商业化应用飞速发展的序幕。 2.转基因植物及其技术 转基因植物是指利用重组DNA技术将克隆的优良目的基因整合到植物的基因组中,并使其得以表达,从而获得的具有新的遗传性状的植物。自1983年世界第一例转基因植物——烟草
