课题_基因敲除小鼠的pcr鉴定

一、技术介绍与研究进展
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN 等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理
基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),
利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。
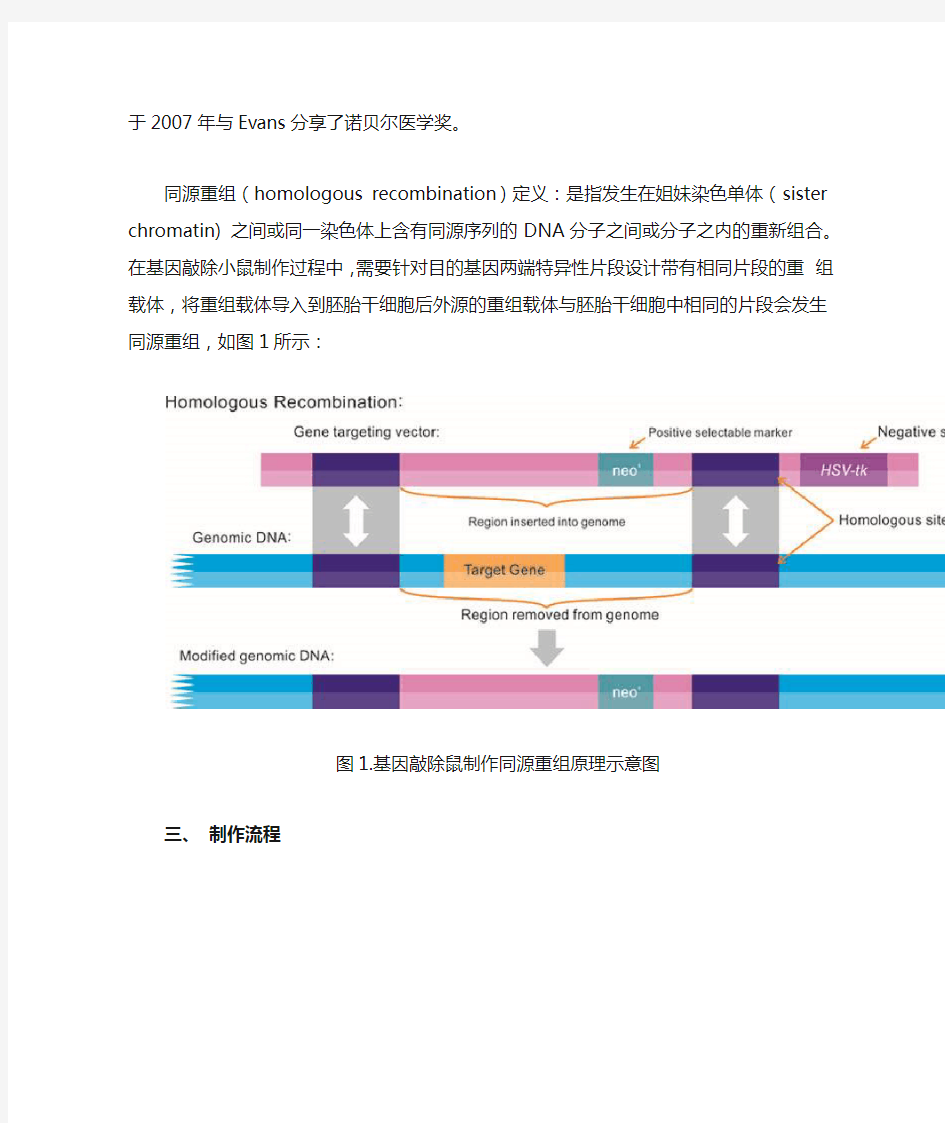
同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示:
图1.基因敲除鼠制作同源重组原理示意图
三、制作流程
图2.基因敲除鼠制作过程示意图
1. Knockout载体设计与构建
根据研究项目具体情况和要求把目的基因和与细胞内靶基因特异片段同源的DNA 片段都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组的Knockout载体。
2. Knockout ES细胞筛选
Knockout载体测序验证正确后,将载体线性化,然后电转入ES细胞,通过载体上的正负筛选基因获得阳性的Knockout ES克隆。选取PCR鉴定打靶载体正确插入的ES基因组DNA用于Southern Blot鉴定,将Southern Blot鉴定的Knockout ES扩大培养并液氮保存。
3. Knockout ES细胞囊胚注射得到嵌合体小鼠
扩增经鉴定插入或置换片段位置正确的Knockout ES细胞,以囊胚显微注射的方式将一定数量的Knockout ES细胞注入特定品系小鼠囊胚中,然后将囊胚移植到假孕的小鼠子宫中。待后代小鼠出生后,通过小鼠的毛色中来源于ES细胞毛色的比例判断嵌合程度的高低,以及该小鼠的后代中可能获得生殖系传递能力。
4. 由嵌合体小鼠繁殖出生殖遗传系Knockout 小鼠
将嵌合体小鼠与适当品系的小鼠交配,后代小鼠出生后,通过PCR方式检测小鼠是否含有打靶序列。如有,则该小鼠为具备生殖遗传能力的Knockout小鼠(F1代鼠)。
5. Knockout小鼠生殖系传递鉴定
将嵌合体小鼠和适当品系野生型小鼠交配,通过后代小鼠毛色或PCR基因型鉴定的方法验证嵌合体小鼠生殖系传递能力。
四、基因敲除常见方法
一、常规基因敲除鼠(Conventional Knockout)
常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用Neo Cassette 替换掉。这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。
二、条件性基因敲除小鼠(Conditional Knockout)
条件性基因敲除小鼠是通过基因打靶,把两个loxP位点放到目的基因一个或几个重要的外显子的两边。该小鼠和表达Cre酶小鼠杂交之前,其目的基因表达完全正常。当和组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。
条件性基因敲除鼠适用范围为:(1)该基因有胚胎致死性;(2)用于研究该基因在特定的组织或细胞中的生理病理功能。
三、基因敲入小鼠(Knockin)
基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。
此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。
获得嵌合体及之后品系纯化详细流程:
五、基因敲除其他方法
一、ZFN技术制作基因敲除鼠
ZFN能够识别并结合指定的基因序列位点,并高效精确地切断。随后细胞利用天然的DNA修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而ZFN的基因敲除效率能达到10%。利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。
这项技术中设计特异性的ZFN是最关键的环节,目前研究者采用计算生物学方法设计高特异性的ZFN,但ZFN的脱靶(off target),也就是把不该切的地方切了的问题仍是一个挑战。也正因为这个原因,利用ZFN技术进行小鼠的基因修饰还无法完全取代传统技术。
二、TALEN技术制作基因敲除鼠
TALEN 技术是一种崭新的分子生物学工具。科学家发现,来自一种植物细菌的TAL蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。利用TAL 的序列模块,可组装成特异结合任意DNA序列的模块化蛋白,从而达到靶向操作内源性基因的目的,它克服了ZFN方法不能识别任意目标基因序列,以及识别序列经常受上下游序列影响等问题,而具有ZFN相等或更好的灵
活性,使基因操作变得更加简单方便。然而同样因为脱靶的问题,利用TALEN 技术进行小鼠的基因修饰仍然无法取代传统技术。
六、常见问题与解答
1. 什么是ES细胞显微注射?
答:胚胎干细胞显微注射是制作基因敲除小鼠的一个最常用的方法。主要过程是将携带目的基因的胚胎干细胞注射到小鼠的囊胚腔中获得嵌合体小鼠。所得嵌合体小鼠的组织,将同时含有来源于囊胚的细胞和胚胎干细胞。嵌合体小鼠必须和野生型小鼠配种以决定遗传改变的生殖系能否传递,这样可能获得转基因或打靶基因(来源于胚胎干细胞)稳定的生殖系传递的小鼠。一般情况下,大约能获得50%继承了目的基因的后代。
2. 嵌合体
遗传学上用以指不同遗传性状嵌合或混杂表现的个体。免疫学上的涵义则指一个机体身上有两种或两种以上染色体组成不同的细胞系同时存在,彼此能够耐受,不产生排斥反应,相互间处在嵌合状态。在基因敲除鼠中指通过向囊胚注射被外源基因转化了的胚胎干细胞,使得发育成为的个体中含有不同基因型的细胞,产生的个体也叫嵌合体,即该生物体中嵌合了两种不同遗传结构的细胞(一种是基因型被改变了的细胞,另一种是原来的基因型的细胞)。
3. 条件性敲除的原理?
答:Cre-LoxP系统是源于P1噬菌体的一个DNA重组体系,由Cre酶和相应的LoxP位点组成,它能导致重组发生在特定的DNA序列处(LoxP位点),该系统可以将外源基因定点整合到染色体上或将特定DNA片段删除。基于Cre-LoxP的基因打靶要分两步来进行。首先要在胚胎干细胞的基因组中引入LoxP序列,这一步可以通过打靶载体的设计和对同源重组子的筛选来实现。下一步通过Cre 介导的重组来实现靶基因的遗传修饰或改变。Cre-LoxP系统既可以在细胞水平
上用Cre重组酶表达质粒转染中靶细胞,通过识别LoxP位点将抗性标记基因切除,又可以在个体水平上将重组杂合子小鼠与Cre转基因小鼠杂交,筛选子代小鼠就可得到删除外源标记基因的条件性敲除小鼠。
4. 如何鉴定和挑选嵌合体?
答:动物只有部分组织细胞整合有外源基因,则称为嵌合体动物。它的鉴定主要根据毛色去鉴定。注射的ES和囊胚来源不同的小鼠品系。它们的毛色不同。因此可以根据毛色的嵌合率来鉴定和挑选嵌合体。
5. ROSA26与定点插入?
答:利用同源重组技术,把外面的cDNA片段或者其他DNA片段,定点插入到ROSA26位置。ROSA26是一个安全区域,外源性的基因定点插入这个位点不会影响其他基因的表达。
七、行业领先企业
Taconic Farms,Inc.成立于1952年,是位于纽约哈得孙河谷地区的一家家族企业。自成立以来,公司一直是世界上最大的实验室啮齿动物供应商之一,在持续生产高品质、定义明确的大鼠和小鼠方面拥有良好的口碑。Taconic在转基因小鼠的定制设计和生产、小
鼠和大鼠育种、屏障系统、基因和动物健康方面的专业经验为利用活体模型开展药物开发的研究人员提供支持。Taconic在美国和欧洲设有六个育种工厂和三个服务实验室,员工人数超过1000名,致力于从事技术创新。
赛业生物科技是目前国内探生网https://www.360docs.net/doc/ad5041166.html,提醒:最大的转基因/基因敲除鼠技术服务供应商,旗下的赛业转基因动物中心是国际顶尖的转基因/基因敲除模式动物中心,中心拥有数千平方米实验场地,动物种群规模超过10万只,每年可构建转基因鼠模型3000例及基因敲除鼠模型300例,累计构建转基因/基因敲除鼠模型数千例。中心主要提供转基因小鼠、基因敲除小鼠、基因敲入小鼠等技术服务。
基因敲除小鼠的制作方法
.. 一、常规基因敲除鼠(Conventional Knockout) 常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用Neo Cassette 替换掉。这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。 二、条件性基因敲除小鼠(Conditional Knockout) 条件性基因敲除小鼠是通过基因打靶,把两个loxP 位点放到目的基因一个或几个重要的外显子的两边。该小鼠和表达Cre酶小鼠杂交之前,其目的基因表达完全正常。当和组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。 条件性基因敲除鼠适用范围为:(1)该基因有胚胎致死性;(2)用于研究该基因在特定的组织或细胞中的生理病理功能。 三、基因敲入小鼠(Knockin) 基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。 此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。 获得嵌合体及之后品系纯化详细流程: 基因敲除其他方法: 一、ZFN技术制作基因敲除鼠 ZFN能够识别并结合指定的基因序列位点,并高效精确地切断。随后细胞利用天然的DNA 修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而ZFN的基因敲除效率能达到10%。利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。 这项技术中设计特异性的ZFN是最关键的环节,目前研究者采用计算生物学方法设计高特异性的ZFN,但ZFN的脱靶(off target),也就是把不该切的地方切了的问题仍是一个挑战。也正因为这个原因,利用ZFN技术进行小鼠的基因修饰还无法完全取代传统技术。 二、TALEN技术制作基因敲除鼠 TALEN 技术是一种崭新的分子生物学工具。科学家发现,来自一种植物细菌的TAL蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。利用TAL的序列模块,可组装成特异结合任意DNA序列的模块化蛋白,从而达到靶向操作内源性基因的目的,它克服了ZFN方法不能识别任意目标基因序列,以及识别序列经常受上下游序列影响等问题,而具有ZFN相等或更好的灵活性,使基因操作变得更加简单方便。然而同样因为脱靶的问题,利用TALEN技术进行小鼠的基因修饰仍然无法取代传统技术。 ;.
基因敲除小鼠技术共9页word资料
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基础研究实验室转向商业模式,成为一项 高度标准化的新兴产业 一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies 于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 图1.基因敲除鼠制作同源重组原理示意图 三、制作流程 图2.基因敲除鼠制作过程示意图 1. Knockout载体设计与构建
基因敲除技术样本
基因敲除技术 点击次数: 2605 发布日期: -5-25 来源: 本站仅供参考, 谢 绝转载, 否则责任自负 1.概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术, 是经过一定的途径使机体特定的基因失活或缺失的技术。一般意义上的基因敲除主要是应用DNA同源重组原理, 用设计的同源片段替代靶基因片段, 从而达到基因敲除的 目的。随着基因敲除技术的发展, 除了同源重组外, 新的原理和技术也逐渐被应用, 比较成功的有基因的插入突变和iRNA, 它们同样能够达到基因敲除的目的。2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初, 胚胎干细胞( ES细胞) 分离和体外培养的成功奠定了基因敲除的技术基础。1985年, 首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到 1987年, Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在, 运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的 使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1):
图1.基因同源重组法敲除靶基因的基本步骤 a.基因载体的构建: 把目的基因和与细胞内靶基因特异片段同源的DNA 分子 都重组到带有标记基因(如neo 基因, TK 基因等)的载体上, 成为重组载体。基因敲除是为了使某一基因失去其生理功能, 因此一般设计为替换型载体。 b.ES 细胞的获得: 现在基因敲除一般采用是胚胎干细胞, 最常见的是鼠, 而兔, 猪, 鸡等的胚胎干细胞也有使用。常见的鼠的种系是129及其杂合体, 因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向, 是基因敲除的理想实验动物。而其它遗传背景的胚胎干细胞系也逐渐被发展应用。[2, 3] c.同源重组: 将重组载体经过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中, 使外源DNA与胚胎干细胞基因组中相应部分发生同源重组, 将重组载体中的DNA序列整合到内源基因组中, 从而得以表示。一般地, 显微注射命中率较高, 但技术难度较大, 电穿孔命中率比显微注射低, 但便于使用。[4,5] d.选择筛选已击中的细胞: 由于基因转移的同源重组自然发生率极低, 动物的重组概率为10-2~10-5, 植物的概率为10-4~10-5。因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。当前常见的方法是正负筛选法( PNS法) , 标记基因的特异位点表示法以及PCR法。其中应用最多的是PNS法。[6]
课题 基因敲除小鼠的pcr鉴定
基因敲除小鼠pc鉴 一、技术介绍与研究进展 敲除动物技术已经/ 基因、基因敲入转该技术从上世成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,原核显史,经典技术如DNA纪七八十年代诞生以来,至今已有近四十年的历 在小鼠模型构建方面日趋微注射、胚胎干细胞显微注射技术一直以来经久不衰,制备技术一样,逐渐从完善,并且如同剪切酶和抗体等常规分子生物学试剂的 催生了数以百基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,然存在一些难以计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍TALEN和费用高昂等,而ZFN克服的缺陷,如步骤繁琐、周期漫长、成功率低、等新技术的出现,或有可能将这一局面彻底改变。二、同源重组技术原理同源重组的原理发展起来的,年代中后期基于DNA基因敲除鼠技术是上世纪80)homologous recombination1987年根据同源重组(在Capecchi和Smithies),这的外源基因的定点整合(EStargeted integration的原理,首次实现了),gene knockout(基因敲除)或gene targeting(基因打靶一技术称为 利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝
尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 1.基因敲除鼠制作同源重组原理示意图图制作流程 三、. 基因敲除鼠制作过程示意图图2. 载体设计与构建1. Knockout根据研究项目具体情况和要求把目的基因和与细胞内靶基因特异片段同源的的载体上,成为重
课题-基因敲除小鼠的pcr鉴定
课题-基因敲除小鼠的pcr鉴定
一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN 等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"
(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 图1.基因敲除鼠制作同源重组原理示意图 三、制作流程
敲基因小鼠鼠尾基因鉴定实验报告
碱法提取小鼠总DNA及基因鉴定: 一、实验器材:加样枪(1ml、200ul、20ul、10ul)、枪头(大中小一套)、EP管(20ul、1.5ml、 10ml)、试管架、浮标、温度计、胶布、手套、记号笔、锥形瓶、称量匙、冰盒 二、实验试剂:A液、B液、引物、mix、双蒸水、三蒸水、琼脂糖、TBE(5x、1x、回收液)、 核苷酸染料、Marker 三、母液配置: 1.10M NaOH:NaOH 40g加双蒸水至90ml,待NaOH完全溶解冷却后定容至100ml 2.0.5M EDTA:EDTA.Na2盐18.61g, NaOH 1.5g, 加双蒸水至80ml,逐滴加入10M NaOH 至EDTA完全溶解后加双蒸水定容至100ml 3.1M TrisHCl(pH8.0):Tris碱12.1g,加水至70ml,边搅拌边加入浓盐酸4ml,然后 边逐滴加入1M HCl边测PH值,直至PH升至8.0(+\-0.05),定容至100ml(pH=8.8 的TrisHCl中边加入浓盐酸边测PH值至PH=8.0(+\-0.05)为止) 四、实验步骤: 1.剪取鼠尾(约芝麻大小)储存于-20度冰箱(-20度冰箱,主要是防止DNA降解,4度不 行) 2.提取DNA: 1)配置工作液——20ml体系液:50ul 10M NaOH 加双蒸水至20ml 8ul 0.5M EDTA B液:800ul 1M TrisHCl(pH8.0)加双蒸水至20ml 2)加150ulA液(液体应完全浸没标本),95度水浴锅煮1.5h(将EP管插入浮标 中后用胶布缠好防止EP管在加热过程中爆开) 3)加150ulB液,混匀(上下颠倒3-5下) 4)12000r/min 4度离心5分钟(可储存于-20度冰箱) 3.PCR(冰上操作):P1 0.5ul(P为AC3I,G为AAA) 1)配置PCR体系——15ul体系P2 0.5ul Mix 7.5ul 三蒸水4.5ul DNA 2ul 2)加2ul上述离心后的上清液至PCR体系,瞬离 3)PCR仪扩增,参数设定:预变性:94度——3min 变性:94度——30s 退火:55度——30s 30个循环 延伸:72度——24s 72度——5min 4度——∞ 4.琼脂糖凝胶电泳: 1)制胶——2%琼脂糖凝胶配方: 总体积(ml)20 30 40 50 60 120 琼脂糖(g)0.4 0.6 0.8 1 1.2 2.4 TBE 1x(ml)20 30 40 50 60 120 Tris-base 13.6g TBE 5x配方:硼酸 6.56g EDTA 0.73g
敲除鼠的构建
如何设计条件性基因敲除小鼠模型 摘要: 小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。 小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。 条件性基因敲除小鼠的设计利用了Cre/LoxP或Flipe/Frt原理。它们都是位点特异性重组酶系统。这里以Cre/LoxP系统为例。比如在待敲除的一段目标DNA序列的两端各放置一个loxP序列,得到flox(flanked by loxP)小鼠。将flox小鼠与带有细胞特异性表达Cre 的小鼠交配繁殖,以获得在特定细胞里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠。此外,若与控制Cre表达的其他诱导系统(比如CreERT2)相结合,还可以对某一基因同时实现时空两方面的调控。 Cre/loxP系统来源于噬菌体,可以介导位点特异的DNA重组。该系统含有两个组成成分:一个是一段长34bp的DNA序列(LoxP序列),含有两个13 bp的反向重复序列和一个8 bp的核心序列。LoxP的方向由中间这8个碱基决定。这段LoxP序列是Cre重组酶识别的位点。令一个组成部分是Cre重组酶。它是由噬菌体编码的一种由343个氨基酸组成的蛋白。Cre可以介导两个LoxP位点的重组,从而引起两个LoxP之间DNA序列的缺失。如果将Cre重组酶cDNA通过基因工程的手段置于组织或细胞特异性启动子之下,可以得到Cre组织/细胞特异性表达的Cre小鼠,也叫Cre工具小鼠。跟Flox小鼠交配之后,可以得到条件性基因敲除小鼠。 所谓Flox小鼠是指在某个基因的某个外显子两侧各放一个LoxP序列。这段序列就是Flanked by LoxP,也就叫做Flox小鼠。这种Flox小鼠一般要通过设计构建打靶载体、胚胎干细胞重组、囊胚显微注射、和嵌合体小鼠传代来获得。这种小鼠跟Cre工具小鼠交配,由于Cre的表达,介导两个LoxP位点序列的重组,从而敲除两个LoxP之间的序列。由于不同Cre工具小鼠的Cre表达有组织/细胞特异性,就可以达到在不同组织、细胞里特异性敲除目的基因的目标。比如上皮细胞、胸腺细胞、T细胞、B细胞、心肌细胞、肠道、肺脏等。 那如何设计条件性基因敲除小鼠呢?这里所说的设计主要是Flox小鼠的设计。所谓条件性敲除,是说除了特定细胞外,其它细胞里面没有任何的基因表达异常。一般情况下,不要在第一个外显子前面放置LoxP序列。因为第一个外显子前面一般是启动子。放置LoxP 序列有可能会破坏或改变启动子活性。条件性敲除一般是敲掉最早引起移码突变的外显子。这样的话,最好不要敲除有起始密码子ATG的外显子。否则的话,基因可能会利用ORF 内的ATG编码一个缺少部分N端序列的蛋白,这个蛋白很可能有全部或部分野生蛋白的功能。在选择要敲除的外显子的时候(各放一个LoxP在一个外显子的两侧),该外显子的碱基数目不能是3N,否则新基因pre-RNA拼接得到的mRNA不能产生移码突变。会产生一个
基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法-2018-2-28
基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法 一、CRISPR/Cas9靶向基因敲除小鼠制作的基本技术原理: 通过CRISPR/Cas9基因敲除技术,crRNA通过碱基配对与tracrRNA(trans-activating RNA)结合,形成双链RNA。这一tracrRNA:crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶标的特定位点剪切双链DNA。在与crRNA引导序列互补的位点,Cas9蛋白的HNH核酸酶结构域剪切互补链而Cas9 RuvC-like 结构域剪切非互补链,实现敲除目的基因的功能,制备基因敲除小鼠模型。 二、具体步骤如下: 一)模型制作策略制作:利用生物信息学手段(NCBI&IMPC&MGI),分别仔细分析目的基因敲除后小鼠的生存能力及繁育能力,并结合邻近基因的影响,最终选择合适的敲除区域进行敲除方案的设计,出具相应的制作策略。 二)载体的设计和构建:使用麻省理工学院的CRISPR Design工具 (https://www.360docs.net/doc/ad5041166.html,/),依据中靶Score的高低及脱靶Score的高低设计一对长度为20bp的针对靶标DNA的寡聚核苷酸链序列用于制备sgRNA,并在该靶区域设计引物用于后续阳性小鼠的基因鉴定。 1、制备sgRNA的实验方法步骤: 1)线性化pUC57-GDNA-T7载体 中提pUC57-GDNA-T7载体,用BsaI线性化过夜。胶回收保存备用。 2)引物退火及加磷酸 将上下游引物(干粉)稀释,再进行引物退火及加磷酸。 3)连接&阳性菌落筛选
取步骤二中的加磷酸产物与线性化载体pUC57-GDNA-T7进行连接,该连接反应在干式恒温器中进行。对连接产物进行转化,涂板,37°C培养箱过夜培养。再用PCR&测序的方法筛选阳性克隆,再将测序正确的克隆进行甘油菌保种,-80°C保存备用 4)制备转录模板 以构建好的sgRNA载体为模板进行PCR扩增,将PCR产物切胶回收,回收产物离心后倒掉上清留DNA沉淀,再溶解DNA。再吸1 μl测DNA浓度,浓度应介于300-500ng/μl,OD260/280介于1.8-2.0范围内。 5)最后进行sgRNA转录,将得到的sgRNA测浓度,跑电泳,分装保存。 三)Cas9/sgRNA的显微注射:将转录好的Cas9 mRNA,sgRNA混合使用显微操作仪将混合物显微注射到小鼠受精卵的胞浆中,再将受精卵移植到假孕的母鼠子宫中,等待F0代小鼠出生。 四)F0 小鼠的鉴定:在F0代小鼠出生后5-7天时,采用剪脚趾法标记小鼠,并将剪取鼠尾组织用在靶区域设计的引物进行鉴定,选取PCR阳性的样品进行测序。 五)F0代小鼠的可遗传性检测:将PCR以及测序正确的F0代小鼠与野生型C57BL/6小鼠进行交配,产生F1代小鼠,依据F0代小鼠的鉴定方法对F1代小鼠进行鉴定,获得的阳性F1代杂合子小鼠即可稳定遗传。
基因敲除小鼠的PCR鉴定
基因敲除小鼠的PCR鉴定 一、实验目的: 通过PCR扩增程序及琼脂糖凝胶电泳方法鉴定凝血因子IX基因敲除小鼠的基因型。 二、实验原理: 真核生物的一切有核细胞(包括培养细胞)都能用来制备基因DNA。真核生物的DNA是以染色体的形式存在于细胞核内,因此,制备DNA的原则是既要将DNA与蛋白质、脂类和糖类等分离,又要保持DNA分子的完整。提取DNA的一般过程是将分散好的组织细胞在含SDS(十二烷基硫酸钠)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。 1.PCR原理: PCR技术的基本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性-退火-延伸三个基本反应步骤构成: 1) 模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备; 2) 模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合; 3) 引物的延伸:DNA模板-引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链重复循环变性-退火-延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍 2.琼脂糖凝胶电泳原理: 在pH8.0~8.3的缓冲液中,核酸分子带负电荷,向正极移动。由于不同大小和构象的核酸分子电荷密度大致相同,因此在自由泳动时,各种核酸分子的迁移率相似,无法分开。然而,在浓度适当的凝胶中,由于分子筛效应,使大小和构象不同的核酸迁移率出现差异,从而把它们分开。核酸在凝胶中的迁移率取决于其分子大小、高级结构、胶浓度和电场强度,与分子的碱基组成及电泳温度(4~30℃之间)无明显关系。一般说,同样构象的分子迁移率与分子量对数及胶浓度成反比,与电场强度(小于5V/cm)成正比。 三、实验操作 1.获取鼠尾组织 剪鼠尾0.5cm置于试管中,加入500ul裂解液和10ul蛋白酶K(20mg/ml),55℃水浴过夜,至鼠尾溶解 2.提取基因组DNA 1) 试管中加入300ul饱和NaCl,充分混匀,12500rpm 离心20min
课题_基因敲除小鼠的pcr鉴定
一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN 等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),
利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 图1.基因敲除鼠制作同源重组原理示意图 三、制作流程
PCR方法在ApoE基因敲除小鼠基因型鉴定中的应用
PCR方法在ApoE基因敲除小鼠基因型鉴定中的应用 摘要目的为ApoE基因敲除鼠探索快速、简单的基因型PCR检测方法。方法设计两对引物扩增野生型ApoE基因和ApoE缺陷突变基因的DNA片段,用PCR仪梯度方案测试最佳退火温度,然后用PCR鉴定方案检测小鼠基因型并将所得基因型结果与已经过经典的Southern blot方法检测得到的基因型结果比较。结果野生型仅在155 bp处有一条条带,突变纯舍子仅在245 bp处有一条条带,杂合子则在155和245bp处出现两条条带。用PCR方法获得的ApoE基因分析结果与经典的Southern blot方法获得的结果完全一致。结论用PCR方法分析ApoE基因敲除鼠的基因型具有快速、简单、廉价和适用的特点。 关键词聚合酶链反应基因型基因打靶载脂蛋白E Genotype identification of ApoE Gene Knockout Mice with Polymerase Chain Reaction Objective This study was to explore a simple and quick polymerase chain reaction(PCR)method for genotyping of ApoE knockout mice.Method Two pairs of primers were designed to amplify genomic DNA fragment of wild-type ApoE gene and the same region on ApoE targeting veceor respectively.A gradient PCR strategy was used to test the best annealing temperature. Results A 155bp band was found in wild-type ApoE mice,a 245 bp band in homozygous mutated ApoE mice and both bands in hetemzygous mice.The genotyping results were completely coincided with those from typical Southern blot. Conclusion PCR is a simple,fast and practical method for the genotyping of ApoE gene knockout mice. Key words Poiymerase Chain Reaction genotype gene targeting ApoE 载脂蛋白(apolipoprotein,ApoE)是清除乳糜微粒和极低密度脂蛋白的受体的配体,因此,缺乏ApoE则会导致血液循环中富含胆同醇的物质积累而更加容易引起动脉粥样硬化
基因敲除技术
基因敲除技术 1.概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA,它们同样可以达到基因敲除的目的。 2.实现基因敲除的多种原理和方法: 2.1. 利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。1985年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1): a. 基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。 b.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,最常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系也逐渐被发展应用。[2,3] c.同源重组:将重组载体通过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重
TSC1转基因敲除小鼠动物模型的构建及敲除效果的初步研究
基金项目:国家自然科学基金资助(31271271 )*通讯作者文章编号:1 007-4287(2019)07-1239-06T SC1转基因敲除小鼠动物模型的构建及敲除效果的初步研究 王 红1, 2,3,蒋 莉4,王 岩5,许振凯6,王威平6,方 航1,2,3,孙 鹏7,8,9*,白晓春1,2,3,6*(1. 南方医科大学附属第三医院,广东广州510630;2.广东省骨科研究院,广东广州510630;3.广东省骨科医院,广东广州510630;4.吉林大学第一医院急诊科,吉林长春130021; 5. 吉林大学中日联谊医院科学研究中心,吉林长春130033;6.南方医科大学,广东广州510515;7.中山大学肿瘤防治中心麻醉科,广东广州510060;8.华南肿瘤学国家重点实验室广东广州510060; 9. 肿瘤医学省部共建协同创新中心,广东广州510060)摘要:目的 为探讨mTOR信号通路在骨骼发育过程中的机制作用,建立骨骼发育相关的TSC1转基因小鼠, 提供稳定的动物模型。方法 取8周龄健康清洁级TSC1flox/flox小鼠分别与肢芽干细胞特异性重组酶(Prx-1-C re)小鼠、软骨细胞特异性重组酶(Col2al-Cre)小鼠及成骨细胞特异性重组酶(Osx-C re)小鼠进行杂交。将繁殖出的小鼠继续与TSC1flox/flox小鼠回交,并对其子代小鼠的基因型进行鉴定及mTOR活性检测。结果 杂交后分别获得肢芽 干细胞特异性TSC1敲除小鼠、软骨细胞特异性TSC1敲除小鼠和成骨细胞特异性TSC1敲除小鼠各8只。与正常组 比较,上述3种转基因小鼠p- S6均比正常组升高(P<0.05)。结论 本实验成功应用Cre/loxP系统构建肢芽干细胞特异性TSC1敲除小鼠、软骨细胞特异性TSC1敲除小鼠、成骨细胞特异性TSC1敲除小鼠,均提示mTOR活性增高, 有明显TSC1敲除效果,为mTOR信号通路研究骨与软骨发育的机制作用提供实验基础。 关键词:基因敲除小鼠;骨发育;T SC1;mTOR信号通路中图分类号:Q786文献标识码:A Construction of TSC1transg enic knockout mouse model and their knockout effect WANG Hong1,2,3,JIANG Li4,WANG Yan5,et al.(1.The Third Aff iliated Hospital,Southern Medical University,Guangzhou 510630,China;2.Academy of Orthopedics Guangdong Province,Guangzhou510630,China;3.Orthpaedic Hospital of Guang dongProvince Guangzhou 510630,China;4.The First Hospital of Ji Lin University Emergency Department,Changchun130021,China;5.China-Japan Union Hospital of Jilin University Science Research Center,Changchun130033,China)Abstract:Obj ective The research is aimed to establish TSC1transgenic mice about bone development,and to pro-vide a stable animal model for investigating the mechanism of mTOR signaling pathway in bone development.Methods 8-week-old healthy TSC1flox/flox mice hybridize with limb bud stem cell specific recombinase(Prx-1-Cre)chondro-cy te specific recombinant mice,chondrocyte(Col2al-Cre)mice and osteoblast specific recombinase(Osx-Cre)mice.Thebreeding mice are continued to hybridize with TSC1flox/flox mice,and the genotype and mTOR activity of their off-spring mice is identified by PCR.Results After hybridization,we obtain 8limb bud stem cell specific TSC1knockoutmice,chondrocyte specific TSC1knockout mice and osteoblast specific TSC1knockout mice.And p -S6of those 3trans-genic mice is higher than the normal group(P<0.05).Conclusion Limb bud stem cell sp ecific TSC1knockout mice,chondrocyte specific TSC1knockout mice and osteoblast specific TSC1knockout mice are obtained successfully by Cre/loxP system.They show significantly high mTOR activity,and have a significan TSC1knockdown effect,providing anexperimental basis for study about the mechanism bone and cartilage development by mTOR signaling pathway.Key words:Gene knockout mice;bone and cartilage development;TSC1;mTOR signaling pathway(Chin J Lab Diag n,2019,23:1239) 结节性硬化复合物1(Tuberous sclerosis com-p lex1,TSC1),是人类的一种抑癌基因,与哺乳动物雷帕霉素靶蛋白(The mammalian target of rap am-ycin,mTOR)有着密切的联系。目前研究发现,mTOR能整合细胞内外各种信号,是机体与细胞感受营养的信号通路[1]。TSC1位于mTOR信号通路的上游,对mTOR有一定抑制作用。既往研究主要集中mTOR信号通路对心脑疾病及肿瘤发病机制的探讨,而近期实验发现mTOR信号通路在骨骼— 9321—中国实验诊断学 2019年7月 第23卷 第7期
小鼠基因组提取与基因型鉴定
小鼠基因组提取与基因型鉴定 一.小鼠基因组提取 1.试剂与纯化柱 2.方法 2.1 剪0.4- 0.6 CM鼠尾,切成小块,装进1.5mlEP管中,加300ul 裂解 液.(自配的裂解液,配方见下表) 2.2 加入10ul蛋白酶K,充分混匀,56℃过夜(约16个小时),或加入30ul蛋白 酶K,充分混匀,56℃2h。 2.3 尾巴完全裂解后,取出,充分混匀,直至混液成均匀且无结块,向管内 加入50ul Buffer AL,充分混匀。然后加入200ul无水乙醇,充分混匀 (用手上下颠倒混匀,动作不宜过猛,防止DNA断裂)。 2.4 将上述混合液加入到装有2ml收集管的柱子中,12000rpm离心1min,倒 掉废液,将柱子放回收集管。 2.5 向柱子中加入250ul Buffer AW1,静置2-3min,12000rpm离心1min,倒 掉废液,将柱子放回收集管。 2.6 向柱子中加入250ul Buffer AW2,静置2-3min,12000rpm离心1min,倒 掉废液,空离2min。注意:此步拿柱子时不要碰到收集管中的液体。2.7 将柱子放到一个干净的1.5ml离心管中,开口放15min左右,(残留的液
体蒸发干,残留的乙醇对PCR有影响))(有条件的可放在安全柜中通风吹干10-15min) 2.8 向柱子中心慢慢滴加200ul无菌去离子水。室温静置3min,12000rpm离 心2min,为增加基因组DNA的回收率,可将离心得到的溶液再加入吸 附柱中,室温放置2min,12000prm离心2min。 小鼠基因组裂解液的配制(1000ml为例) 二.小鼠基因型鉴定 1. 基因型鉴定方法:采用PCR检测方法,以确定小鼠为纯合子/杂合子/野生型1.1引物 引物对及扩增片段大小
基因敲除小鼠制备的流程
基因敲除小鼠的制备流程 基因敲除小鼠已经成为现代生命科学基础研究和药物研发领域不可或缺的实验动物模型,在生命科学、人类医药和健康研究领域中发挥着重要的作用。基于胚胎干细胞的基因打靶技术、EGE技术(基于Crispr cas9技术)是当下比较火热的基因敲除小鼠制备技术。利用这两种技术制备基因敲除小鼠的流程是什么样的? 一、基于胚胎干细胞的基因打靶技术制备基因敲除小鼠的流程: 1.课题设计,订购课题BAC菌; 2.按照课题设计,完成打靶载体设计和构建; 3.将重组载体电转到胚胎干细胞中,用G418筛选转染后的胚胎干细胞, 得到阳性克隆; 4.进一步通过PCR和southern blot杂交技术(基因敲除小鼠检测金标 准)对上一步得到的阳性克隆进行筛选,得到稳定整合外源基因的胚 胎干细胞阳性克隆; 5.将胚胎干细胞阳性克隆注射到小鼠囊胚中,并植入到假孕小鼠的子宫 内; 6.得到嵌合鼠,并获得F1阳性杂合子小鼠。 基于胚胎干细胞的基因打靶技术制备基因敲除小鼠是目前为止唯一一个 可以满足几乎所有基因组修饰要求的打靶技术,但目前只应用在小鼠的基因敲除上,而且其周期长工作量大。 二、利用EGE技术(基于Crispr cas9技术)制备基因敲除小鼠的流程 1.设计构建识别靶序列的sgRNA;
2.设计构建致靶基因切割的EGE系统载体质粒; 3.利用百奥赛图自主开发的UCA试剂盒对sgRNA/Cas9进行活性检测; 4.设计构建打靶载体; 5.体外转录sgRNA/Cas9 mRNA; 6.小鼠受精卵原核注射sgRNA/Cas9 mRNA和打靶载体; 7.获得Fo代小鼠,利用PCR对Fo代小鼠进行基因型鉴定; 8.获得F1代小鼠,利用PCR和southern blot杂交技术(基因敲除小 鼠检测金标准)对F1代小鼠进行基因型鉴定。 虽然EGE技术(基于Crispr cas9技术)制备基因敲除小鼠看似比基于胚胎干细胞的基因打靶技术制备基因敲除小鼠流程繁琐,其实不然,EGE技术(基于Crispr cas9技术)系统构建简单,基因敲除/敲入效率高,速度快,可实现多基因、多物种基因敲除/敲入,最快2个月即可得到F0代阳性鼠,5个月得到F1F1代杂合子小鼠。
小鼠脚趾DNA提取以及基因型鉴定
小鼠脚趾DNA提取以及Macf1fl/flC57BL/6-Prrx1-Cre小鼠 基因型鉴定 张茹 2016年3月15日 一.小鼠脚趾DNA提取 【原理】 1.提取过程 真核生物的DNA是以染色体的形式存在于细胞核内,因此,制备DNA的原则是即要将DNA与蛋白质、脂类和糖类等分离,又要保持DNA分子的完整。提取DNA的过程是将动物组织在含SDS(十二烷基硫酸钠)和蛋白酶K的消化液中消化分解蛋白质,再用酚抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA析出来。 2.裂解液各成分作用 在匀浆后提取DNA的反应体系中,SDS可使蛋白变性并溶解细胞膜中的脂质,从而使细胞裂解,并使组织蛋白与DNA分离。EDTA可以整合镁离子,这样将会抑制细胞中Dnase的活性;因为该酶必须在有镁离子存在下才会起作用。蛋白酶K的重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在下保持很高的活性。并且可将蛋白质降解成小肽或氨基酸,使DNA分子完整地分离出来。 3.Tris苯酚作用 酚是非极性分子,水是极性分子,当蛋白水溶液与酚混合时,蛋白质分子之间的水分子就被酚挤去,使蛋白失去水合状态而变性。经过离心,变性蛋白质的密度比水的密度为大,因而与水相分离,沉淀在水相下面,从而与溶解在水相中的DNA分开。而酚作为有机溶剂比重更大,保留在最下层。 【实验材料】 1.耗材 1.5ml离心管,水浴锅,高速冷冻离心机,1ml移液枪,200ul移液枪,通风橱,1ml移液枪枪头,200ul移液枪枪头。 2.试剂 Tris-HCl,EDTA,NaCl,SDS,灭菌水,Tris苯酚,无水乙醇,75%乙醇,1倍
TE缓冲液 【实验步骤】 1.SNET裂解液(50ml):100mM Tris-HCl(10ml,PH8.0), 200mM EDTA(1.25ml PH8.0), 1M NaCl(20ml), 10% SDS(5ml), 水(13.75ml)。 (裂解液在常温下结晶,使用之前在55℃水浴锅中预热) 蛋白酶K(PK):储存浓度:10mg/ml;终浓度:100ug/ml 2、操作步骤: 1)小鼠标记编号,并收集小鼠脚趾样品于1.5mlEP管中(提前高压灭菌)。 2)提前准备55℃水浴锅,并把4℃离心机打开(300rmp离心降温至4℃)。 3)往装有小鼠脚趾组织的EP管里加入400ul Snet裂解液,4ul 蛋白酶K(实验 经验,充分消化可加6-7ul),其浓度是10mg/ml,即终浓度为100ug/ml; 4)置于55℃水浴锅中裂解1h(实验经验,充分裂解需2.5-3.5h); 5)待组织裂解完后,在通风厨中加入400ul Tris饱和酚(除去蛋白质杂质),剧 烈震荡20s(实验经验,剧烈震荡100多次),至呈乳浊液; 6)12,000g,4℃,离心10min(所有管子方向一致); 7)吸取上清330-390ul于新的EP管中(缓慢吸取,勿吸到蛋白层),加二倍体 积的无水乙醇(即660-780ul),轻摇出现白色絮状沉淀(轻摇100多次,充分混匀); 8)同第五步离心后,用1ml枪头一次吸取上清,留剩余刚好淹没沉淀; 9)加1ml 75%乙醇,12,000g ,4℃离心5min; 10)用1ml枪头一次吸取上清,留剩余刚好淹没沉淀; 11)12,000g ,4℃离心3min; 12)用200ul枪吸干上清(在沉淀对面吸取),通风橱中晾干; 13)根据沉淀量多少加20~50ul无菌水溶解DNA沉淀,吸吹10~15次,混匀。
