二元及三元硼酸盐及硅酸盐系统玻璃生成规律
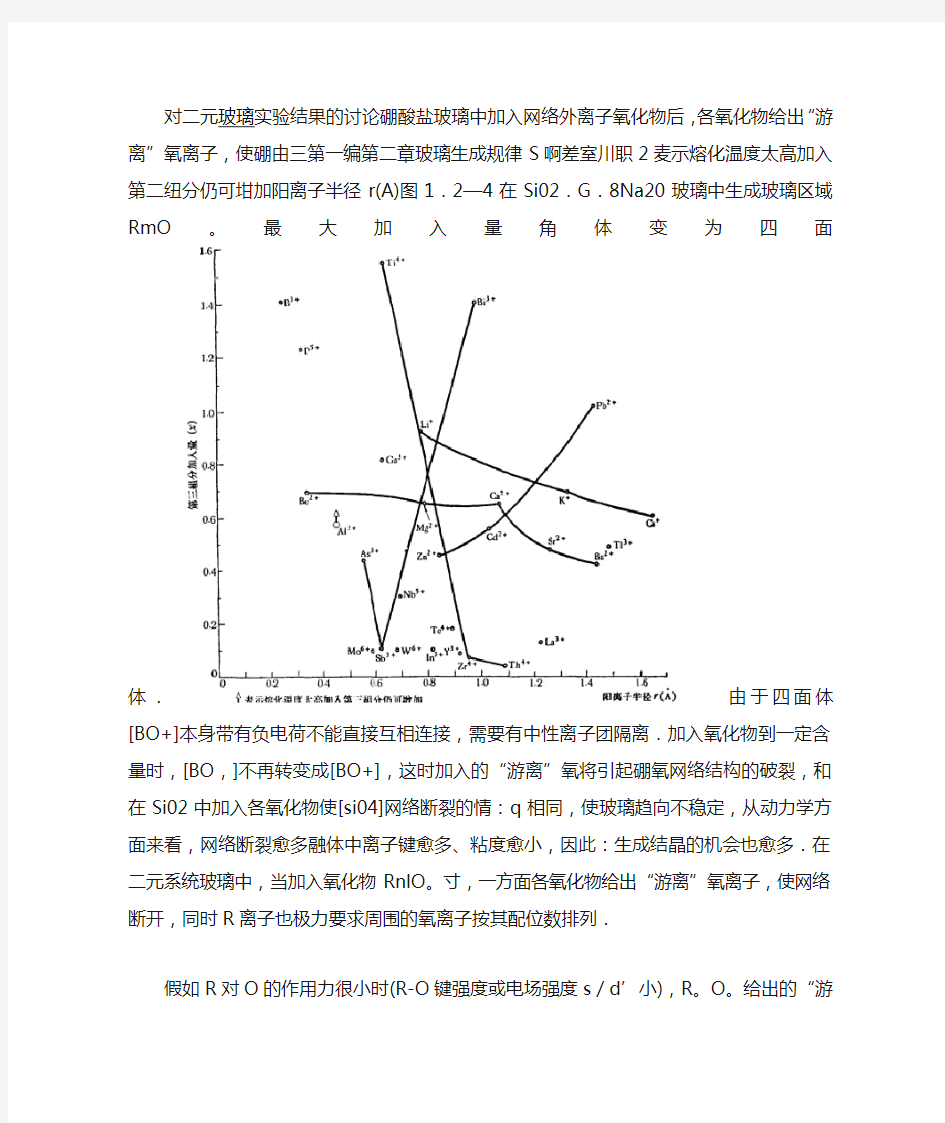

对二元玻璃实验结果的讨论硼酸盐玻璃中加入网络外离子氧化物后,各氧化物给出“游离”氧离子,使硼由三第一编第二章玻璃生成规律S啊差室川职2麦示熔化温度太高加入第二纽分仍可坩加阳离子半径r(A)图1.2—4在Si02.G.8Na20玻璃中生成玻璃区域RmO。最大加入量角体变为四面体.
由于四面体[BO+]本身带有负电荷不能直接互相连接,需要有中性离子团隔离.加入氧化物到一定含量时,[BO,]不再转变成[BO+],这时加入的“游离”氧将引起硼氧网络结构的破裂,和在Si02中加入各氧化物使[si04]网络断裂的情:q相同,使玻璃趋向不稳定,从动力学方面来看,网络断裂愈多融体中离子键愈多、粘度愈小,因此:生成结晶的机会也愈多.在二元系统玻璃中,当加入氧化物RnlO。寸,一方面各氧化物给出“游离”氧离子,使网络断开,同时R离子也极力要求周围的氧离子按其配位数排列.
假如R对O的作用力很小时(R-O键强度或电场强度s/d’小),R。O。给出的“游离”氧促使Si-O-Si断裂,网络结构受R的积聚作用较小,这寸玻璃结晶主要是断网作用所引起.但在阳离子R对O的作用力很大寸(郎窟/。’很大)则阳离子R有可能将周围的氧按其§I.2—4二元及三元硼酸盐及硅酸盐系统玻璃生成规律配位数来排列(图1.2-5)。这样会产生两种结果:i)如R能取得氧而自成带电的四面体[R04]时,则玻璃容易产生分相,如加入B20a,Gs203,A103后易生成[BO,),[Ga04],[A104]等;㈠如阳离子R不能成四面体,则玻璃容易结晶及分相.
因此阳离子R的极化率口小或场强度-/(1’大时,玻璃生成范围远小于斯梯弗斯(Ste~els)1171、慕尔和今冈稔等人所推得的极限.加入三价以上的非玻璃生成休氧化
物.Jx~lL-Xp-\,户o,.户/Nr-八(a)图1.2-5硅氧四面体围绕离子R情况(a)配位数为4;
(b)配位数为6时,则同时存在断网和积聚两种作用.一方面加入每一分子氧化物带入两个以上的氧,如R-O键强度或电场强度较小时,氧将参加到网络中,使两个键断裂.
如R-O键强度及s/d’较大时,则要求按本身需要的配位数排列,产生积聚作用,使玻璃分相和结晶.因此这类氧化物的成玻璃范围极小。氧化铅在硼酸盐或硅酸盐玻璃中,分子百分比超过50寸,仍能成稳定的玻璃.对这种现象,目前还有很多不同的解释,有人孰为由于铅及氧离子的相互极化生成了不对称的六面体[PbOs]‘”’,有人孰为PbO生成两个低矮的四面体‘19),合并成[PbOs],也有人孰为PbO中的pb2+可作为连接的桥,另外有入从吸收光谱改变得出生成四面体(Pb04]的结论[10I.根据玻璃生成范围的试验数据,在硼铅,硅铅玻璃中,氧化铅的分子合量可以超过75g6.在1)203-PbO—耻03玻璃系统中,PbO可达60一?59S;(分子gG),而作为玻璃生成体的B203低于8g6(分子g6)时,仍能成透明的玻璃.由此可见,除了PbO能起玻璃生成体的作用外,用其他观点是较难解释的.
玻璃物理化学性能计算
玻璃物理化学性能计算 一、玻璃的粘度计算 ...1.粘度和温度的关系 ...2.玻璃组成对温度的作用 ...3.粘度参考算点及在生产中的应用 ...4.粘度的计 二、玻璃的机械性能和表面性质 ...1.玻璃表面张力的物理与工艺意义 ...2.玻璃表面张力与组成及温度的关系 ...3.玻璃的表面性质 ...4.玻璃的密度计算 三、玻璃的热学性质和化学稳定性 ...(一)玻璃的热学性能 ...(二)玻璃的化学稳定性 ...(三)玻璃的光学性质 一、玻璃粘度和温度的关系 粘度是玻璃的重要性质之一。它贯穿着玻璃生产整个阶段,从熔制、澄清、均化、成型、加工、直到退火都与粘度密切相关。在成型和退火方面年度起着控制性的作用。在高速成型机的生产中,粘度必须控制在一定的范围内,而成型机的速度决定与粘度随温度的递增速度。此外玻璃的析晶和一些机械性能也与粘度有关。 所有实用硅酸盐玻璃,其粘度随温度的变化规律都属于同一类型,只是粘度随温度变化的速度以及对应某给定温度的有所不同。在10怕.秒(或者更低)至约1011怕.秒的粘度范围内,玻璃的粘度由玻璃化学成分所决定的,而在从约1011怕.秒(1015泊,或者更高)的范围内,粘度又是时间的函数。
这些现象可由图来说明: Na 2O---CaO---SiO 2 玻璃的弹性、粘度与温度的关系 上图的三个区。在A区温度较高。玻璃表现为典型的粘度液体,他的弹性性质近于消失。在这一温度去中粘度仅决定于玻璃的组成和温度。当温度近于B 区时,粘度随温度下降而迅速增大,弹性模量也迅速增大。在这一温度区的粘度去决定于组成和温度外,还与时间有关。当温度进入C区,温度继续下降,弹性模量继续增大,粘滞留东变得非常小。在这一温度区,玻璃的粘度和其它性质又决定于组成和温度而与时间无关。图中所市的粘度和弹性随温度的变化现象,可以从玻璃的热历史说明。
玻璃发霉及处理方法
如何防止玻璃发霉及处理玻璃发霉的方法 一、概述 用传统的熔融法制备玻璃产品工艺过程中,为了降低成本,选用了纯碱为助熔剂,随之而带来的是玻璃制品在一定条件下易风化(俗称发霉)。玻璃发霉(也称反碱)是由于玻璃存放时间过长或者天气潮湿引起的化学反应;在阳光的照射下其表面出现有彩虹、霉点、水印、油印、纸纹等现象。 玻璃发霉是储运过程中出现的问题,发霉后的玻璃制品表面会失去光泽,失去透明,呈现彩虹、白斑或贴片现象(不易分离)等。 玻璃发霉通常发生在浮法玻璃的空气面(上面),这是因为浮法玻璃下表面与锡液接触,表面渗入一层薄锡,对玻璃起了保护作用。 二、玻璃发霉可分为下列几个阶段: 1.最初,水或潮气吸附在玻璃表面。 2.随后,水或潮气向玻璃内扩散。 3.表面层中的可溶性硅酸盐被水解和破坏。首先是硅酸钠和硅酸钾等被水解和破坏。形成的苛性钠(NaOH)并分离出SiO2。 4.分离出来的SiO2生成硅氧凝胶,在玻璃表面形成保护性薄膜,它阻止了进一步的侵蚀作用。 5.水解形成的苛性钠,与空气中的二氧化碳作用生成碳酸钠,聚集在玻璃表面,构成表面膜中的可溶性盐。由于它的强吸湿性,吸收水分而潮解,最后形成碱液小滴。当周围的温度、湿度改变时,这些小滴的浓度也随之变化。如果浓缩的碱液小滴和玻璃长期接触时,凝胶状硅氧薄膜可在其中部分地被溶解,而使玻璃表面发生严重的局部侵蚀,形成斑点。这是钠离子从玻璃本体中迁移出去,与空气反应生成的白色富碱离子群。扫描电镜可观察到白色粒子群。
三、发霉的识别和检查方法 目测外观形貌法是最简洁可行的方法。既在集中的强光下,将试样放置在反射光和透射光中观察玻璃表面有无斑点和雾状物。这些斑点和雾状物用布或水擦不掉。出现上述现象的玻璃,表示试样已经发霉。如果在集中的强光下,肉眼观察到少数斑点和薄雾状物属轻微发霉。如果在集中的强光下,肉眼观察到很多斑点和轻雾状物属中等发霉。如果在没有集中的光束照射下,肉眼观察到一些斑点和雾状物属严重发霉。 发霉也可在自然光下,通过喷雾湿润法观察到。 四、发霉的防止 一方面与玻璃本身的表面特性有关,同时也与浮法玻璃包装前采取的防霉处理措施、包装密封程度、储运条件有密切关系。当浮法玻璃成型、退火后,一般均采取在线包装,此时玻璃的温度约为50~100℃。包装好的玻璃须经库存、运输后才到用户,时间有时很长。如果遇到高温、高湿季节,储运又不当,成箱玻璃会出现发霉。 发霉出现在浮法玻璃的空气面,因为玻璃的锡面(下表面)是因为①②③④⑤⑥⑦⑧的机理玻璃自身缺陷、原片包装 发霉的过程P45 在室温或稍高于室温的条件下,新鲜的玻璃表面将从周围环境中吸附水分及油脂,吸附水的OH-基的形式与Si4+相结合,影响玻璃表面的结构。 由于OH- 离子能形成氢链,并吸附其它物质,因此清洁的玻璃表面能被水、乙醇或硫酸表面本来是亲水性的,只是由于附着了其它物质,才变成了疏水性的。 玻璃表面有以下特征:①在退火过程中,碱离子向玻璃表面移动;②表面容易与O2、SO2、H2O及HCL等反应;③表面强度低,容易产生Griffith裂纹;④在玻璃表面上容易进行离子交换;⑤表面上的玻璃态的Sio2可以被水解,使Si-O键断裂;⑥表面组分容易蒸发及分解;⑦表面容易析晶;⑧表面具有润温性等。
玻璃工艺学重点内容
玻璃的定义:结构上完全表现为长程无序的、性能上具有玻璃转变特性的非晶态固体。 玻璃的通性:各向同性、介稳性、无固定熔点、性质变化的连续性、性质变化的可逆性 晶子学说:玻璃是由无数“晶子”所组成的,晶子是具有晶格变形的有序排列区域,分散在无定形介质中,从“晶子” 部分到无定形部分是逐步过渡的,二者之间并无明显界线。 无规则网络学说:玻璃的近程有序与晶体相似,即形成阴离子多面体,多面体顶角相连形成三维空间连续的网络,但其排列似拓扑无序的。 玻璃结构和熔体结构的关系: ⑴玻璃结构除了与成分有关以外,在很大程度上与熔体形成条件、玻璃的熔融态向玻璃态转变的过程有关。(玻 璃的结构不是一成不变的) ⑵玻璃似过冷的液体,玻璃的结构是熔体结构的继续。(继承性) ⑶玻璃冷却至室温时,它保持着与该温度范围内某一温度相应的平衡结构状态和性能。(对应性) 单元系统玻璃的结构主要有:石英玻璃结构、氧化硼玻璃结构、五氧化二磷玻璃结构。 硼氧反常现象:当氧化硼与玻璃修饰体氧化物之比达到一定值时,在某些性质变化曲线上出现极值或折点的现象。根据无规则网络学说的观点,一般按元素与氧的单键能的大小和能否生成玻璃,将氧化物分为:网络生成体氧化物、网络外体氧化物和中间体氧化物。 混合碱效应:二元碱硅玻璃中,碱金属氧化物总含量不变,用另一种逐渐取代一种时,玻璃的性质出现极值。 T f:玻璃膨胀软化温度 T g:玻璃转变温度 玻璃的形成方法:熔体冷却法和非熔融法 三元玻璃形成区: ①由于新的共熔区的形成,三元系统形成区中部出现突出部分。 ②含有两种网络形成体(F)的三元系统,突出位置受到共熔点位置的影响,即突向低熔点的一侧。 ③三元系统只有一种网络形成体(F)时,突出部分偏向低熔点氧化物的一侧。 ④网络中间体(I)可使网络修饰体(M)较多的区域重新形成玻璃,在有I的三元系统中,形成区突向偏M的一侧,呈半圆形。 ⑤F-M、F-I等不能形成玻璃的二元系统加入新的氧化物,由于新的共熔物形成,可以在其中间部位形成较小的不稳定的玻璃形成区。 玻璃的分相:玻璃在高温下为均匀得熔体,在冷却过程中或在一定温度下热处理时,由于内部质点迁移,某些组分发生偏聚,从而形成化学组成不同得两个相,此过程称为分相 玻璃分相的原因:一般认为氧化物熔体的液相分离是由于阳离子对氧离子的争夺所引起的。当网络外体的离子势较大、含量较多时,由于系统自由能较大而不能形成稳定均匀的玻璃,它们就会自发的从硅氧网络中分离出来,自成一个体系,产生液相分离。 分相对玻璃析晶的影响: ①为成核提供界面:玻璃的分相增加了相间的界面,成核总是优先产生于相的界面上。 ②分散相具有高的原子迁移率:分相导致两液相中的一相具有较母相明显大的原子迁移率,这种高的迁移率能够 促进均匀形核。 ③使成核剂组分富集于一相:分相使加入的成核剂组分富集于两相中的一相,因而起晶核作用。 微晶玻璃:是用适当组成的玻璃控制析晶或者诱导析晶而成,它含有大量(95%~98%)细小的(在1μm以下)晶体和少量残余玻璃相。 影响玻璃黏度的因素 ⑴玻璃的黏度随温度的升高连续变化,温度越高粘度越低。 ⑵玻璃的结构对黏度影响分两个方面:玻璃网络结构越稳定,玻璃的黏度越大; 玻璃中碱金属离子或者碱土金属离子使玻璃网络聚合,玻璃的黏度越大。 ⑶玻璃组成对黏度的影响主要为: ①玻璃中氧化物的性质与数量:倾向于形成更大的阴离子基团的氧化物,使玻璃黏度增大;碱性氧化物使玻璃形成的网络解离,玻璃的黏度降低; ②氧-硅比:氧硅比越大,硅氧四面体群解离,玻璃黏度降低
1-10-1-国内外玻璃冷加工的具体内容
细分课题总结报告 ——国内外玻璃冷加工的具体内容 冷加工即在不加热的情况下,通过机械的方法来改变玻璃制品的外形和表面状态的过程。通常包括切割、研磨、抛光、车刻、钻孔、磨砂等。 一、切割 切割是玻璃生产和加工过程中必不可少的基本工序。其质量要求为:尺寸准确、断面平整垂直,无崩边掉角。这对于玻璃后续的加工至关重要。 伴随着玻璃工业的发展,传统切割技术延用至今,基本满足了大多数玻璃产品的切割要求。近10多年来,随着科学技术的迅猛发展,以及某些切割难度较大的玻璃制品的大量应用。如何高质量、高精度、高效率、低成本、低损伤的对玻璃制品进行切割,并尽量减少后续加工的工作量,成为人们迫切需要解决的问题。 通过对传统切割技术的不断改进提升,对新技术的不断探索,一些针对性较强的切割技术发展较快:如坚硬刀轮切割、水刀切割、激光切割等。这些切割技术针对性强,应用效果好,在一些新型玻璃产品制造中发挥了重要的作用。 1)传统切割技术 所谓切割并不是通常意义上的直接切裁,而是制造划痕,造成应力集中然后裂片。玻璃是一种典型的脆性材料,根据脆性材料断裂的微裂纹理论,脆性材料的断裂可以分为两个过程,一是微裂纹的产生,二是微裂纹的扩展。当外力施加于脆性材料时,微裂纹尖端应力将成倍数增加并且随着外力的增大微裂纹的长度也在增长,即微裂纹扩展。另外脆性材料断裂的微裂纹理论还表明,存在一个临界长度当微裂纹的长度大于临界长度后,它就会自动迅速扩展从而使材料断裂。 基于以上理论:传统切割技术使用坚硬、锐利硬质材料刀头刻划玻璃表面,形成的划痕线可等效认为是由很多的微裂纹组成,每个微裂纹的长度沿着刀头刻划的方向,在划痕线的下方会形成一定深度的破坏区域,这一深度可认为是微裂纹的端面半径。由于微裂纹的端部是应力集中的地方。切割压力使微裂纹端部的应力增大,使得微裂纹很快向玻璃厚度方向扩展,形成纵向微裂纹。在良好的切割状况下。连续的纵向微裂纹的末端几乎都在同一条水平线上。 在划痕完成后,就需要进行裂片即对玻璃施加外力,增大纵向微裂纹端部的应力,使纵向微裂纹迅速扩展,贯穿到玻璃的底部。达到使玻璃分离的目的。 由于在整个切割过程中直接与玻璃表面接触的是切割刀头,所以刀头的材料和参数对于切割质最有着重要的影响。随着切割经验的积累和现代工业的发展切割刀头不断得到了改进,切割的质量、精度、效率也不断提升。 2)水刀切割技术 外形由复杂曲线构成的工艺美术玻璃的切割,以及超厚玻璃、夹层玻璃,都对玻璃切割技术提出了更专业化的要求。1979 年,Mohamed Hashish 博士在福禄研究室工作,开始研究增加水刀切割能量的方法,以便切割金属和其它硬质材料。Hashish 博士被公认为加砂水刀之父,他发明了在普通水刀中添加砂料的方法。他使用石榴石作为砂料。凭借这种方法,水刀(含有砂料)能够切割几乎任何材料。1980 年,加砂水刀第一次被用于切割金属、玻璃和混凝土。1983 年,世界上第一套商业化的加砂水刀切割系统问世,被用于切割汽车玻璃。该技术的第一批用户是航空航天工业,他们发现水刀是切割军用飞机所用的不锈钢、钛和高强度轻型合成材料以及碳纤维复合材料的理想工具(已用于民用飞机)。从那以后,加砂水刀被许多其它工业采纳,例如加工厂、石料、瓷砖、玻璃、喷气发动机、建筑、核工业、
各种玻璃的成分
各种玻璃的成分: (1)普通玻璃(Na2SiO3、CaSiO3、SiO2或Na2O·CaO·6SiO2) (2)石英玻璃(以纯净的石英为主要原料制成的玻璃,成分仅为SiO2) (3)钢化玻璃(与普通玻璃成分相同) (4)钾玻璃(K2O、CaO、SiO2) (5)硼酸盐玻璃(SiO2、B2O3) (6)有色玻璃在(普通玻璃制造过程中加入一些金属氧化物。Cu2O——红色;CuO——蓝绿色;CdO——浅黄色;CO2O3——蓝色;Ni2O3——墨绿色;MnO2——紫色;胶体Au ——红色;胶体Ag——黄色) (7)变色玻璃(用稀土元素的氧化物作为着色剂的高级有色玻璃) (8)光学玻璃(在普通的硼硅酸盐玻璃原料中加入少量对光敏感的物质,如AgCl、AgBr 等,再加入极少量的敏化剂,如CuO等,使玻璃对光线变得更加敏感) (9)彩虹玻璃(在普通玻璃原料中加入大量氟化物、少量的敏化剂和溴化物制成) (10)防护玻璃(在普通玻璃制造过程加入适当辅助料,使其具有防止强光、强热或辐射线透过而保护人身安全的功能。如灰色——重铬酸盐,氧化铁吸收紫外线和部分可见光;蓝绿色——氧化镍、氧化亚铁吸收红外线和部分可见光;铅玻璃——氧化铅吸收X射线和r射线;暗蓝色——重铬酸盐、氧化亚铁、氧化铁吸收紫外线、红外线和大部分可见光;加入氧化镉和氧化硼吸收中子流。 (11)微晶玻璃(又叫结晶玻璃或玻璃陶瓷,是在普通玻璃中加入金、银、铜等晶核制成,代替不锈钢和宝石,作雷达罩和导弹头等)。 (12)玻璃纤维(由熔融玻璃拉成或吹成的直径为几微米至几千微米的纤维,成分与玻璃相同) (13)玻璃丝(即长玻璃纤维) (14)玻璃钢(由环氧树脂与玻璃纤维复合而得到的强度类似钢材的增强塑料。) (15)玻璃纸(用粘胶溶液制成的透明的纤维素薄膜) (16)水玻璃(Na2SiO3)的水溶液,因与普通玻璃中部分成分相同而得名) (17)金属玻璃(玻璃态金属,一般由熔融的金属迅速冷却而制得) (18)萤石(氟石)(无色透明的CaF2,用作光学仪器中的棱镜和透光镜) (19)有机玻璃(聚甲基丙烯酸甲酯)
耐高温硼硅酸盐玻璃
耐高温硼硅酸盐玻璃 硼硅酸盐玻璃隶属低膨胀硼硅酸盐系列,膨胀系数3.3,玻璃质量完全符合ISO3583国际标准,经切割、磨边,高温钢化处理等多项工艺制作而成,具有良好的物理及化学性能。 彭硅酸盐玻璃的含硅量在80%以上,玻璃的内部结构稳定性极为良好,因而具有较好的机械性能和化学性能;由于它的低热膨胀系数,能更好地耐受较高的温差变化,并具有良好的灯焰加工性能,是制造实验室用各种加热器皿、结构复杂的玻璃仪器、化工设备和压力水表玻璃等的良好玻璃材料。广泛应用于化工搪瓷压力容器设备、轻工冷冻、印染、造船、防爆器材等机械视镜配套部件。 一、产品执行标准:执行国家HG/T2144-91化学工业部设计的HGJ501-86-0技术条件及联邦德国标准:DIN 52313-78《玻璃制品的耐温度交变性能的确定》。 二、产品型号及大小:按客户要求生产。 三、产品质量技术指标: 1、化学成份: SiO2:81% B2O3:13% Na2O/K2O:4% Al2O3:2% 2、机械特性: 密度ρ(25℃) 2.2g/cm3 杨氏模数64kN/mm3DIN 13316 努氏硬度480 ISO9385 泊松比0.2 DIN 13316 抗弯强度25Mpa DIN 52292 T1
3、热学特性: 线性膨胀系数 3.25*10-6K-120-300℃热容0.83KJ*(kg*K)-120-100℃ 导热系数 1.2W*(m*k)-190℃ 4、最高工作温度: 热稳定性△T300℃(厚度5T测试)冷热冲击强度值短期使用500℃(厚度5T测试)<10h 长期使用450℃(厚度5T测试)≥10h 5、玻璃的粘度: 粘度 工作点104 dpas 1270℃ 软化点107.6 dpas 820℃ 退火点1013 dpas 560℃ 应变点1014.5 dpas 520℃ 转变温度525℃ 6、玻璃的化学性能: ISO 719/DIN 12 111 HGB1 耐水性 ISO 720 HGA1 耐酸性ISO 1776/DIN 12 116 1 耐碱性ISO 695/DIN 52 322 A2 7、玻璃的耐化学腐蚀性: 试剂重量损失目视检查结果/外观 24 h at 95℃ 5VO1.% HCI <0.01 无变化 0.02n h2SO4<0.01 无变化 H2O <0.01 无变化 6 h at 95℃ 5%NaOH 1.1 白斑 0.02 n NaOH 0.16 白色浑浊 0.02 n Na2CO30.16 无变化 20 min at 23℃
硅酸盐玻璃物理性
近年来苏联乔姆金娜Il,l与阿本l,+1也分嚼0提出了计算狡璃性貭的体系.乔姆金娜按以下加和公式计算玻璃的性貭(1.4—3)∑—S01式中/,(与Po为玻璃与其氧化物的性貭;do为氧化物重量百分比;Jo为氧化物结构系数.系数JD及/,o由微分法求得. 所谓微分法是将原始玻璃的性貭与添加微量(1—2gG)的氧化物后的性貭加以比较,并假定在微量的氧化物加入后不改变玻璃的基本结构状态.Jo在大多数情;B下相当于氧化物分子量,而有时等于一定的硅酸盐分子量.氧化硼和氧化铅的Jo与Po根据它们在玻璃中的 结构状态不同给出了几组数值. 乔姆金娜孰为氧化硼的户。与Jo决定于硼的配位数,而氧化铅的Po与Jo决定于在玻璃中形成的硅酸铅所处的状忒在乔姆金娜的计算系统中提供了几种常用氧化物的计算系数,可用以计算玻璃密度、光学常数及热膨胀系数等常用性貭,·阿本按下式计算玻璃的性貭§1.4—1现有硅酸盐玻璃物理性貭各种计算方法的评价g—∑百jr;(土.4-4);式中豆为某氧化物;的部分性貭; 为此氧化物的分子分数.阿本用下面方法获得氧化物部分性貭豆;首先在总结大量文献数据的基础上按加和原则计算几种在玻璃中性貭表现较稳定的氧化物部分性貭,同时系统地在不同组成玻璃中添加某氧化物并测定玻璃的性貭变化,然后用微差方法计算这氧化物部分性貭.通过试验数据的积累,阿本进一步建立了氧化物部分性貭与其在玻璃中含量的关系,并且发现有一系列氧化物(Si02,Ti02,Bz03,MgO,CdO,PbO)其部分性貭不是常数,而决定于玻璃成份. 例如阿本孰为氧化硼部分性貭决定于它的配位数,而硼是否由三角沐变成四面体由下面三种因素决定:(i)碱金属与碱土金属氧化物和氧化硼含量之比值;(㈠玻璃中氧化铝的合量;(iii)二氧化硅合量.阿本提供了比较多的氧化物(18种)的部分性貭数据,且可以根据它们计算折射率、色散、密度等了种玻璃性貭.除了上述玻璃光学常数、密度和热膨胀系数外,适合进行计算的性貭还有弹性系数. 在威因凯尔曼与萧特Il’以后,克拉尔克(Clarke)与脱纳尔(Turner)山’也对个别硅酸盐玻璃系统中某些氧化物的弹性模数提出一些计算系数.不久前阿本、柯茨劳夫撕卡姬与干福熹‘l‘’在研究硅酸盐玻璃弹性变化的试验基础上也提出了玻璃弹性模数及扭变模数新的计
平板玻璃的特点
平板玻璃的特点 平板玻璃也称白片玻璃或净片玻璃。其化学成分一般属于钠钙硅酸盐玻璃。它具有透光、透明、保温、隔声,耐磨、耐气候变化等性能。接下来装修界小编就给大家介绍一下平板玻璃的特点以及平板玻璃的价格。平板玻璃的特点平板的玻璃由于生产的厚度是 5mm左右,是一种比较薄的玻璃,其平整度以及厚度相差比较多的,这种平板的玻璃主要
应用于普通居民家的玻璃门窗的使用,是一种居用建筑玻璃,经过一定的喷砂、雕磨,再加上一定的腐蚀处理以后,就可以把这种玻璃制作成为屏风、黑板、隔断堵等使用,对于质量比较好的玻璃也可以做为某种深加工的产品来进行使用,比如原片玻璃。平板玻璃的特征平板玻璃具有良好的透视,透光性能好(3mm和5mm厚的无色透明平板玻璃的可见光透射比分别为88%和86%),对太阳中近红热射线的透过率较高,但对可见光设置室内墙顶地面和家具、织物而反射产生的远红外长波热射线却有效阻挡,故可产生明显的“暖房效应”。无色透明平板玻璃对太阳光中紫外线的透过率较低。平板玻璃具有隔声和一定的保温性能,其抗拉强度远小于抗压强度,是典型的脆性材料。平板玻璃具有较高的化学稳定性,通常情况下,对酸、碱、盐及化学试剂及气体有较强的抵抗能力,但长期遭受侵蚀介质的作用也能导致质变和破坏,如玻璃的风化和发霉都会导致外观的破坏和透光能力的降低。平板玻璃热稳性较差,急冷急热,易发生爆裂。平板玻璃分类按厚度可分为薄玻璃、厚玻璃、特厚玻璃;按表面状态可分为普通平板玻璃、压花玻璃、磨光玻璃、浮法玻璃等。平板玻璃还可以通过着色、表面处理、复合等工艺制成具有不同色彩和各种平板玻璃特殊性能的制品,如吸热玻璃、热反射玻璃、选择吸收玻璃、中空玻璃、钢化玻璃、夹层玻璃、
玻璃工艺学考试重点
1、玻璃态物质具有以下五个特性: 1. 各向同性 2. 无固定熔点 3. 亚稳性 4. 变化的可逆性 5. 可变性 2、论述硼酸盐和硅酸盐玻璃结构的桥氧对其结构和性能的影响。 从一系列硼酸盐和硅酸盐玻璃结构,可以看出,桥氧在结构中起着重要的作用。一般桥氧愈多,结构愈强固,许多物理性能向好的方面转变。反之,桥氧愈少,结构和性能就愈不好。 3、逆性玻璃。 如果玻璃中同时存在两种以上金属离子,而且它们的大小和所带的电荷也不相同时,也能制成玻璃。用y代表每个多面体的桥氧平均数,当y<2也能制成玻璃,而且某些性能随金属离子数的增大而变好。一般把这种玻璃称为逆性玻璃。逆性玻璃的结构与无规则网络学说的结构模型是完全相反的。逆性玻璃在性质上也发生逆转性。 4、论述玻璃的逆性 第一,在结构上它与通常玻璃是逆性的。一般玻璃的结构以玻璃形成物为主体,金属离子处于网络的空穴中,它仅起补助性作用。逆性玻璃恰恰相反,多面体的短链反而为大量的金属离子所包围。如果金属离子比作“海洋”,那末,多面体就是“海洋”中的岛屿。因此,决定玻璃聚结程度的不是多面体之间的连结,而是金属离子与多面体短链中的氧离子之间的结合。逆性玻璃的结构与无规则网络学说的结构模型是完全相反的。 第二,逆性玻璃在性质上也发生逆转性。一般玻璃的性质是随着Si02的减少(即Y值减少)而降低。而逆性玻璃则相反,碱金属和碱土金属含量愈多(即Y值愈小),结构愈强固,而某5、晶子学说 认为玻璃是由无数“晶子”所组成。晶子是具有晶格变形的有序排列区域,分散在无定形介质中,从“晶子”部分到无定形部分是逐步过渡的,两者之间并无明显界线。 6、无规则网络学说 认为像石英晶体一样,熔融石英玻璃的基本结构单元也是硅氧四面体,玻璃被看作是由硅氧四面体为结构单元的三度空间网络所组成,但其排列是无序的,缺乏对称性和周期性的重复,故不同于晶态石英结构。当熔融石英玻璃中加入碱金属或碱土金属氧化物时,硅氧网络断裂,碱金属或碱土金属离子均匀而无序地分布于某些硅氧四面体之间的空隙中,以维持网络中局部的电中性。 从目前有关玻璃性质及其玻璃结构的研究资料来看,可以认为短程有序和长程无序是玻璃态物质结构的特点.在宏观上玻璃主要表现出无序均匀和连续性,而在微观上它又是有序,微不均匀和不连续性的。无规则网络学说宏观上强调了玻璃中多面体相互间排列的连续性,均匀性和无序性方面。这可以说明玻璃的各向同性,以及玻璃性质随成分变化的连续性等基本特性。晶于学说强调玻璃的有序性,不均性和不连续性方面,它反映了玻璃结构的另一重要特性。 7、硼反常现象 在钠硅酸盐玻璃中加入氧化硼时,往往在性质变化曲线中产生极大值和极小值,这现象也称为硼反常性。这种在钠硼玻璃中的硼反常性,是由于硼加入量超过一定限度时,它不是以硼氧四面体而是以硼氧三角体出现于玻璃结构中,因此,结构和性质发生逆转现象。 8、“硼—铝反常”现象 在钠硼铝硅玻璃中,当中不存在B203时,A1203代替Si02能使折射率、密度等上升。当玻璃中存在B203时,同样地用A1203代替Si02,随B203含量不同出现不同形状的曲线。当Na20/B2O3=4时出现极大值,而当NagO/B2O3≥>1时,nD(折射率)与d (密度)显著下降。
各种玻璃配方知识
各种玻璃配方知识 字体大小:大| 中| 小2007-08-02 14:02 - 阅读:734 - 评论:0 第一节概述 1.物质的玻璃态 自然界中,物质存在着三种聚集状态,即气态,液态和固态。固态物质又有两种不同的形式存在,即晶体和非晶体(无定形态)。 玻璃态属于无定形态,其机械性质类似于固体,是具有一定透明度的脆性材料,破碎时往往有贝壳状断面。但从微观结构看,玻璃态物质中的质点呈近程有序,远程无序,因而又有些象液体。从状态的角度理解,玻璃是一种介于固体和液体之间的聚集状态。 对于“玻璃”的定义,二十世纪四十年代以来曾有过几种不同的表述。1945年,美国材料试验学会将玻璃定义为“熔化后,冷却到固化状态而没有析晶的无机产物”。也有将玻璃定义扩展为“物质(包括有机物,无机物)经过熔融,在降温冷却过程中因粘度增加而形成的具有固体机械性质的无定形物体”。我国的技术词典中把“玻璃态”定义为;从熔体冷却,在室温下还保持熔体结构的固体物质状态。其实,在上世纪八十年代,有人提出上述定义…是多余的限制?。因为,无机物可以形成玻璃,有机物也可以形成玻璃,显然早期的表述并不合适。另外,经过熔融可以形成玻璃,不经过熔融也可以形成玻璃,例如,经过气相沉积,溅射可得到非晶态材料,采用溶胶-凝胶法也可以得到非晶态材料,可见后期的表述也并不妥当。现代科学技术的发展已使玻璃的含义有了很大的扩展。因此,有人把具有下述四个通性的物质不论其化学性质如何,均称为玻璃。这四个通性是; (1)各相同性。玻璃的物理性质,如热膨胀系数,导热系数,导电性,折射率等在各个方向都是一致的。表明物质内部质点的随机分布和宏观的均匀状态。
硅酸盐物理化学模拟试题及答案
《物化与硅物化》(下)模拟试题 2008级硅工专业 一、填空题(共70分) 1.系统中的相必须在物理性质和化学性质上都是 ____________ 的,但不一 定只含一种物质。相与物质的量的多少____________,与物质是否连续也____________。例如:空气是 ________ 相,固溶体是 ___________相,水泥生料是 ____________ 相。(6分) 2.相律是相平衡系统的普遍规律。相律确定了多相系统中系统的 _________ ________ ,__________ ,__________和 __________ 之间的关系。(4分) 3.多晶转变根据其进行的方向是否可逆,分为可逆的转变和不可逆的转变两种类型。可逆转变又称为 ______________ ,其特点是_______________ 。不可逆转变又称为 ______________ ,其特点是 _______________ 。(5分) 4.离子半径是 ____________________________________________ 。(2分) 5. _____________________________________________ 的现象称为离子极化现象。极化结果,不仅使离子间距离_______________ ,从而降低了__________________,而且使晶体结构的类型发生变化,晶体中质点间_________________ 的性质发生改变。 (5分) 6. 硅酸盐晶体结构可以根据结构中硅氧四面体的连接方式分成五种,其中岛状结构的特点是_______________________ ;组群状结构的特点是____________________________ ;链状结构的特点是____________________ ;层状结构的特点是 ___________________________ ;架状结构的特点是____________________ 。(10分)
玻璃基础理论课程1
玻璃基础理论课程 主要内容: 1、玻璃是什么及玻璃结构. 2、玻璃三个主要特性. 3、玻璃种类. 4、玻璃粘度. 5、玻璃主要成分. 6、热导率. 7、热膨胀和应力. 8、玻璃机械强度. 9、玻璃表面张力. 10、有关玻璃其它方面的一些理论知识. 一、.玻璃是什么及玻璃结构 1、玻璃是什么? 玻璃在几千年前就在自然界中被发现物质,有着广泛的应用.在一些情况下,如果液体的冷却速度非常快,液体或变的很粘,不同的粒子流动性很低,这样就失去规则结构,象 这样的材料称之为玻璃.(si02) 玻璃是不规则的结构、非晶体并且是不均匀的.玻璃在加热后化学键在不同的时间内断开. 不同的材料有不同的结构,如食盐或金属其基础结构是立方体,是规则的结构、结晶体并且是均匀的.金属在加热后化学键在相同的时间内断开. 2、什么是理想的晶体结构?(也称规则结构). 当结晶速度大于冷却速度时就可以形成理想的晶体结构,也称规则结构,反之就形成不理想的非晶体结构,也称不规则结构.
2、玻 璃 三个主要特性 1. 玻璃有哪三个主要特性 ? 玻璃没有固定的熔点,只有一个熔解范围. 玻璃在低温下是热的不良导体.玻璃在高温下是热的良导体. 玻璃有很高的表面张力. 3、玻璃种类 1.玻璃的种类有哪些 ? 玻璃的种类有三大类: 软料玻璃、硬料玻璃和石英玻璃或二氧化硅玻璃. 软料玻璃包括:石灰料玻璃和铅玻璃.,软料玻璃膨胀系数:à=90- 100X10-7/度 硬料玻璃包括:硼硅酸盐玻璃、铝硅酸盐玻璃.硬料玻璃膨胀系数:à=35-40 X10-7/度 石英玻璃或二氧化硅玻璃膨胀系数:à=6.5X10-7/度 1--1、石灰料玻璃
玻璃工艺学-130425
《玻璃工艺学》课程教学大纲 课程编号:4102105 英文名称:Glass Technology 编写人:赵彦钊编写日期:2013年7月 审核人:杨海波 一、课程说明 1.课程类别/课程性质:专业课/必修课 2.开课学期:第六学期 3.学时与学分:64/4 4.适用专业:无机非金属材料工程(玻璃方向) 5.先修课程:无机材料物理化学、硅酸盐热工设备 6.推荐教材或参考书目: 推荐教材赵彦钊、殷海荣主编. 玻璃工艺学. 化学工业出版社.2006 参考书目 [1]西北轻工业学院主编.玻璃工艺学.轻工业出版社.1982 [2]华东化工学院等主编.玻璃工艺原理.中国建筑工业出版社.1981 [3]作花济夫等编(蒋国栋等译).玻璃手册.中国建筑工业出版社.1985 [4]上海玻璃与搪瓷研究所主办.玻璃与搪瓷(杂志) 7. 考核方式:闭卷考试,平时成绩25%-35% 8.课外自学要求:按教学进程布置作业。 9. 主要实践教学环节:工艺综合实验40学时(实验单独设置) 二、课程的目的和任务 玻璃工艺学是材料科学与工程学院材料专业(玻璃方向)的专业必修课。本课程是研究玻璃的结构、性能、制备工艺以及玻璃组成、结构、性能三者关系等综合性应用技术科学。本课程要求学生系统地深入理解并掌握玻璃组成、结构、性能以及三者之间联系的玻璃物理化学;玻璃工艺原理、工艺流程、工艺因素;了解各种制品的生产流程、生产技术。 本课程的先修课程为无机材料物理化学、硅酸盐热工设备。 三、能力培养要求 通过学习本课程,培养学生在实践中运用课程所学的理论知识,分析和解决生产实践中的工艺技术问题,增长实践操作技能,巩固理论知识。 四、教学基本要求 通过本课程的各个教学环节,达到以下基本要求: 第一章玻璃的结构与组成
煤中的矿物质(硅酸盐矿物和硫酸盐矿物)
煤中的矿物质(硅酸盐矿物和硫酸盐矿物) 一、硫酸盐矿物 1.重晶石 重晶石是含氧盐大类硫酸盐类 矿物。 化学组成: BaSO4。常含Sr、Ca、 Pb等,Ba与Sr可以形成完全类质 同象。 结构特点:斜方(正交)晶系。 晶体结构中Ba2+处于七个SO42-之间 而为它们当中的十二个O2-所包围, 故其配位数为12。而O2-则与一个 S6+和三个Ba2+接触。故其配位数为 4。 晶体形态:常以良好的单晶体 出现。一般为平行于{001}的板状 或厚板状。本样品为板条状晶 簇。 物理性质:常为无色或白色, 有时呈黄、褐、淡红等色,本样品 为米黄色,透明,条痕白色,玻璃 光泽,解理面显珍珠光泽。硬度小 于小刀(3~3.5);性脆;解理平 行{001}和{210}完全,平行{010} 中等。比重4.5左右。 鉴定特征:以晶体形态、解理、 大比重为特征。鉴别特征相对密度大、具有三组解理、低的干涉色、光轴角中等偏小是重晶石的鉴别特征。重晶石与天青石十分相似,但重晶石的干涉色稍高、光轴角较小。根据重晶石的干涉色低,不难与干涉色高达三级的硬石膏区别。 2.石膏
白色,自形长柱状结构,纤 维状构造,主要矿物是石膏。属 风化成因,由硫化物氧化的硫酸 盐溶液与钙质围岩反应生成。形 成于氧化带中,呈脉状产出。 光性特征:无色、白色,含有 氧化铁则呈黄、红、褐等色,薄片 中无色。负低突起,具不明显的糙 面。最高干涉色为一级白--黄白 (照片148),在⊥(010)切面上, 对完好的{010}解理缝为平行消 光,在(010)切面上则为斜消 光,cΛNp=38°。延性以负为主。 折射率、双折射率、光性方位 及光轴角等随温度而变更。双 晶有时可呈聚片式,也常见平 行(100)的燕尾式双晶。二轴晶 正光性。垂直光轴的干涉图能 见到强倾斜色散r>1。随温度的 升高,光轴角则减小,加热到 90C时,2V=0°。 鉴别特征:与硬石膏的区 别是石膏为负低突起,硬石膏 为正中突起;石膏的双折射率 远远低于硬石膏;硬石膏的假 立方形解理(三组解理相互直交)也是二者区别特征之一。 二、硅酸盐矿物 1.锆石 化学组成:ZrO267.01(含Zr 49.5),SiO2 32.99。由于Zr和Hf 的化学性质很接近,所以锆石中 经常含有一定数量的Hf。正常情 况下Hf/Zr比接近于0.007,但 在个别情况下可高达0.6。锆石中 还经常含有少量的Fe、TR、Th、 U以及Sn、Nb、Na、Ca、Mn等
第七章 玻璃的结构与性能
第七章玻璃的结构与性能 一、填空题: 1、玻璃的结构特征为﹍短程有序﹍﹍和﹍长程无序﹍﹍。P178 2、玻璃包装材料主要是﹍钠钙玻璃﹍﹍,它具有很好的化学惰性和稳定性,有很高的抗 压强度。 3、固态物质的两种不同的结构状态是﹍晶体﹍﹍和﹍玻璃﹍﹍。 4、在石英玻璃和普通玻璃中,﹍﹍二氧化硅﹍又叫作网络形成体氧化物。 5、在玻璃加工工艺中,料性﹍长﹍(长、短)的玻璃粘度随温度变化慢,适合形 状复杂的玻璃器皿成型;料性﹍短﹍(长、短)的玻璃粘度随温度变化快,适 合制瓶机成型 6、玻璃与水和酸作用的实质是﹍玻璃中硅酸盐水解﹍。 7、玻璃化学稳定性常用的测试方法有﹍粉末法﹍﹍和﹍表面法﹍﹍。 8、当今玻璃包装材料的一个主要发展趋向是﹍开发生产高强度轻量玻璃容器﹍﹍。 二、选择题: 1、可以单独形成玻璃的形成体氧化物是( B ) A CaO B SiO2 C Na2O D AL2O3 2、氧化物玻璃的组成(形成,改变,中间)p178 A 形成体氧化物、改变体氧化物、网络外体氧化物 B 形成体氧化物、网络外体氧化物、中间体氧化物 C 改变体氧化物、网络外体氧化物、中间体氧化物 D 改变体氧化物、碱土金属氧化物、中间体氧化物 3、本身不能单独形成玻璃,但能改变玻璃的性质的氧化物不包括( C ) A Na2O B K2O C Li D ZnO
4、由SiO2、B2O3和AL2O3三种氧化物形成的玻璃,若SiO2>B2O3>AL2O3,则此玻璃称为( A ) A 铝硼硅酸盐玻璃 B 硼铝硅酸盐玻璃 C 硅硼铝酸盐玻璃 D 硅铝硼酸盐玻璃 三、名词解释题: 1、玻璃形成体氧化物—— 氧化物玻璃组成成分中可以单独形成玻璃的氧化物。 2、玻璃改变体氧化物—— 氧化物玻璃组成成分中不可以单独形成玻璃,但可以改变玻璃的性质的氧化物。3、玻璃中间体氧化物—— 介于玻璃形成体氧化物和玻璃改变体氧化物之间的氧化物,在一定条件下可以成为玻璃形成体的氧化物。 4、理论强度—— 理论强度是指玻璃不存在任何缺陷的理想情况下,能承受的最大负荷。由玻璃各组分之间的键强决定。 5、粘度—— 粘度是表征流体内摩擦力或者表示阻碍液体流动性质的物理量。 6、玻璃的料性—— 在玻璃加工工艺中,经常把粘度在10~105P a·s(102~106泊)范围内随温度变化的快慢叫做玻璃的料性。 四、问答题: 1、玻璃和晶态物质在结构和性质上的主要区别有哪些?(结构上的区别、比容随温 度变化的规律、粘度随温度变化的规律) 结构:晶体结构中的原子、离子或分子的空间排列是规则有序的,不论从几个原子间距的微观尺度,还是从长距离的宏观尺度来观察,晶体可以由构成它的最小结构单元(晶胞)重复周期性排列得到。玻璃的结构与晶体不同,虽然从几个原子间距的微观尺度来看,原子的排列也有规则,但从较长的距离观察时,原子排列没有可重复的周期性。 比容:晶体比容随温度的变化在熔点Tm处突然下降即出现了不连续性。在熔点以上,晶体以液态形式存在,在熔点一下为晶态。而玻璃没有确定的熔点,比容随温度连
各种玻璃的物理和化学性能
Ⅰ.GG17耐高温玻璃 GG17耐高温玻璃性能完全符合ISO3583国际标准,是一种高硼硅玻璃,具有优良的物理化学性能,它的含硅量在80%以上,玻璃的内部结构稳定性极为良好,因而具有较好的机械性能和化学性能;由于它的低热膨胀系数,能更好的耐受较高的温差,并具有良好的灯焰加工性能,是制造实验室用各种加热器皿、结构复杂的玻璃仪器、化工设备和压力水表玻璃等的良好玻璃材料。 具体的物理化学性能如下: 含硅量80%以上 应变温度520℃ 退火温度560℃ 软化温度820℃ 折射率 1.47 透光率(2mm) 92% 弹性模量67KNmm-2 抗张强度40-120Nmm-2 玻璃应力光学常数 3.8×10-6mm2 /N 加工温度(104dpas) 1220℃ 线膨胀系数(20-300℃) 3.3×10-6K-1 密度(20℃) 2.23gcm-1 比热0.9Jg-1K-1 导热率 1.2Wm-1K-1 耐水性能(ISO 719) 1级 耐酸性能(ISO 195) 1级 耐碱性能(ISO 695) 2级 耐热急变玻棒法玻棒Φ6×30mm 300℃ 关于GG17玻璃的几点说明 a.GG17玻璃制造的仪器如需长期加热和加压,它的最高安全操作温度不应超过应变温度(520℃)。它在加热到退火温度时,不易变形,如放在适当支架上,且内部不受压力情况下,可以在短时间内加热到600℃,在此情况下,应使仪器缓慢冷却,藉以减少产生永久应力的程度。 b.GG17玻璃管(在25℃时)的安全工作压力可根据下式计算: P=140T/D P为安全工作压力单位为kg/cm2 T为玻璃管壁厚D为玻璃管内径单位为mm 上式公式不适用于具有平底的玻璃管 c.GG17玻璃化学组成:(%) SiO2 B2O3 Al2O3 Na2O K2O 80.5 12.8 2 4 0.4 Ⅱ.“九五”耐高温玻璃 九五料玻璃是一种低碱高硼硅玻璃,不含钙镁锌及铂元素,具有较好的物理和化学性能,用于制造各种玻璃仪器。 具体的物理化学性能如下: 含硅量79%
玻璃工艺学复习练习题样本
玻璃工艺学复习练习题 一、解释以下概念 1.硼反常: 碱金属氧化物加入到B2O3玻璃中, 使玻璃的结构得到加强, 物理 化学性能得到改进。这与碱金属氧化物加入到石英玻璃中的情形恰好相反。 这是一种硼反常。在钠硅玻璃中加入B2O3, 玻璃的结构随B2O3增加而逐渐加强, 玻璃的性质得到改进。但B2O3的含量超过某数值时, 将出现逆转: 随着B2O3的增加, 玻璃结构逐渐弱化, 玻璃的性质逐渐劣化, 在玻璃的性质变化曲线上出现极值。这是另一种硼反常。 2.逆性玻璃: 结构和性质的变化趋势( 变化方向) 与一般玻璃相反的玻璃。 3.玻璃的转变温度区间: 玻璃从流动性的熔体转变为具有刚性的固体, 要经 过一个过渡温度区。这个过渡温度区称为玻璃的转变温度区。 4.玻璃的热历史: 玻璃在转变温度区和退火温度区的经历。 5.双减效应: 在简单的硅酸盐玻璃系统( R2O-SiO2) 中, 一种碱金属氧化物被 另一种碱金属氧化物替代时, 随着替换量的增加, 在性质-成分曲线上, 第一类性质会出现极大值或极小值。这种现象称为混合碱效应( 或中和效应) 。 6.临界冷却温度: 能生成玻璃的最小冷却速度。 7.结晶容积分率: 晶体体积与熔体体积之比 8.稳定分相: 在液相线以上就存在的分相。 9.亚稳分相: 在液相线以下才开始发生的分相。 10.不混溶区: 玻璃发生分相的组成-温度范围。 11.均匀成核: 在宏观均匀的熔体或玻璃中, 没有外来物参与, 与相界、缺陷 无关的成核过程。又称本征成核、自发成核。 12.非均匀成核: 依靠相界或基质的缺陷而发生的成核过程。 13.晶核: 具有一定大小能够稳定生长的结晶区域称为晶核。 14.微晶玻璃: 微晶玻璃是经过往玻璃中加入成核剂, 再经过热处理、光照射 或化学处理等手段使玻璃均匀析出大量微小晶体所形成的致密的微晶相与
各种玻璃配方知识
字体大小:大| 中| 小2007-08-02 14:02 - 阅读:734 - 评论:0 第一节概述 1.物质的玻璃态 自然界中,物质存在着三种聚集状态,即气态,液态和固态。固态物质又有两种不同的形式存在,即晶体和非晶体(无定形态)。 玻璃态属于无定形态,其机械性质类似于固体,是具有一定透明度的脆性材料,破碎时往往有贝壳状断面。但从微观结构看,玻璃态物质中的质点呈近程有序,远程无序,因而又有些象液体。从状态的角度理解,玻璃是一种介于固体和液体之间的聚集状态。 对于“玻璃”的定义,二十世纪四十年代以来曾有过几种不同的表述。1945年,美国材料试验学会将玻璃定义为“熔化后,冷却到固化状态而没有析晶的无机产物”。也有将玻璃定义扩展为“物质(包括有机物,无机物)经过熔融,在降温冷却过程中因粘度增加而形成的具有固体机械性质的无定形物体”。我国的技术词典中把“玻璃态”定义为;从熔体冷却,在室温下还保持熔体结构的固体物质状态。其实,在上世纪八十年代,有人提出上述定义‘是多余的限制’。因为,无机物可以形成玻璃,有机物也可以形成玻璃,显然早期的表述并不合适。另外,经过熔融可以形成玻璃,不经过熔融也可以形成玻璃,例如,经过气相沉积,溅射可得到非晶态材料,采用溶胶-凝胶法也可以得到非晶态材料,可见后期的表述也并不妥当。现代科学技术的发展已使玻璃的含义有了很大的扩展。因此,有人把具有下述四个通性的物质不论其化学性质如何,均称为玻璃。这四个通性是; (1)各相同性。玻璃的物理性质,如热膨胀系数,导热系数,导电性,折射率等在各个方向都是一致的。表明物质部质点的随机分布和宏观的均匀状态。
(2)介稳性。熔体冷却成玻璃体时并没有处于能量最低的状态,仍然有自发转变为晶体的倾向,因而,从热力学的观点看,处于介稳状态。但常温下玻璃的粘度非常大,自发转变为晶体的速度非常慢,所以,从动力学的观点看,它又是非常稳定的。 (3)固态和熔融态间转化的渐变性和可逆性。玻璃态物质由熔体转变为固体是在一定温度区间(转化温度围)进行的,性质变化过程是连续的和可逆的,它与结晶态物质不同,没有固定的熔点。 (4)性质随成分变化的连续性和渐变性。在玻璃形成围,玻璃的性质随成分发生连续的逐渐的变化。例如,在R2O-SiO2系统中,玻璃的弹性模量随Na2O或K2O 含量的上升而下降,随Li2O含量的上升而上升。 2.玻璃的分类 玻璃的分类方式很多,常见的有按组成分,按应用分及按性能分等。 2.1按组成分类 这是一种较严密的分类方法,其特点是从名称上直接反映了玻璃的主要和大概的结构,性质围。按组成可将玻璃分为元素玻璃,氧化物玻璃和非氧化物玻璃三大类; 元素玻璃指由单一元素构成的玻璃,如硫玻璃,硒玻璃等。 氧化物玻璃指借助氧桥形成聚合结构的玻璃,如硅酸盐玻璃,硼酸盐玻璃,磷酸盐玻璃等。它包含了当前已了解的大部分玻璃品种,这类玻璃在实际应用和理论研究上最为重要。 非氧化物玻璃当前这类玻璃主要有两类。一类是卤化物玻璃,玻璃结构中连接桥是卤族元素。研究较多的是氟化物玻璃(如BeF2玻璃,NaF-BeF2玻璃)和氯化物玻璃(如ZnCl2玻璃,ThCl4-NaCl-KCl玻璃);另一类是硫族化合物玻璃,玻璃结构中的连接桥是第六族元素中除氧以外的其它各元素。例如,硫化物玻璃,硒化物玻璃等。
