高中化学专题训练电化学

电化学
1.一种太阳能电池的工作原理如图Z7- 1 所示,电解质为铁氰化钾
铁氰化钾 K4[Fe(CN) 6] 的混合溶液,下列说法不正确的是 ( )
图 Z7- 1 A. K+移向催化剂 b B.催化剂 a 表面发生的化学反应: [Fe(CN) 6] 4--e-===[Fe(CN)6] 3-
C.[Fe(CN) 6]3-在催化剂 b 表面被氧化
D.电解池溶液中的 [Fe(CN) 6]4-和[Fe(CN) 6] 3-浓度基本保持不变 2.工业上常用电解硫酸钠溶液联合生产硫酸和烧
碱,生产装置如图
阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为
法中正确的是 ( )
图 Z7- 2
A.a 极与电源的负极相连
B.产物丙为硫酸溶液
C.离子交换膜 d 为阴离子交换膜
D. b电极反应式: 4OH-- 4e-===O2↑+ 2H2O 3.如图
Z7- 3,下列说法不正确的是 ( )
图 Z7- 3
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 B.若 a为纯铜, b为粗铜,该装置可用于粗铜的电解精炼 C.燃料电池中正极反应为 O2+ 4e-+2H2O===4O-H
D.电子经导线流入 b 电极K3[Fe(CN) 6] 和亚
Z7- 2 所示,其
中1∶2,以下说
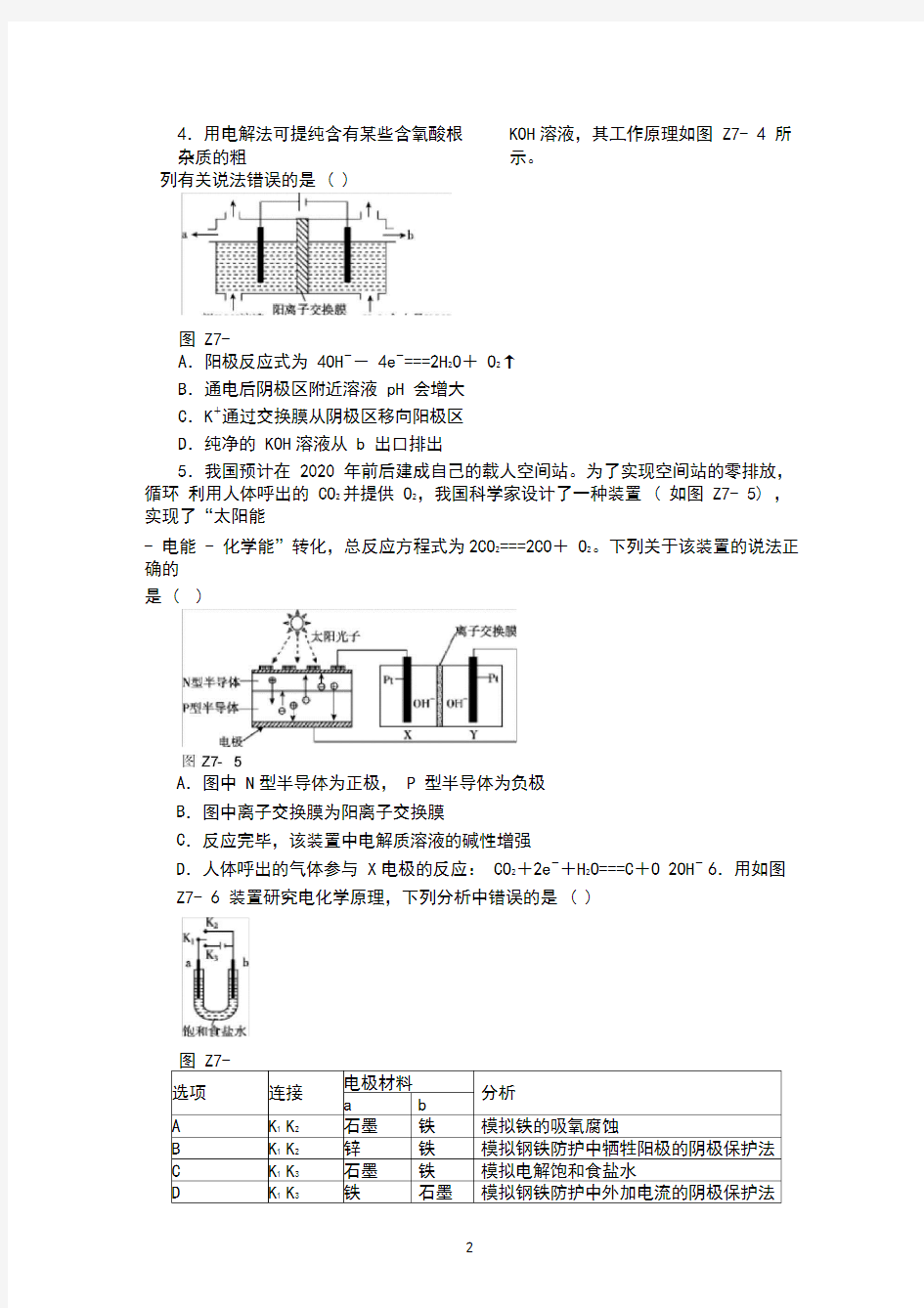
4.用电解法可提纯含有某些含氧酸根杂质的粗
KOH 溶液,其工作原理如图 Z7- 4 所示。
列有关说法错误的是 ( )
A .阳极反应式为 4OH -- 4e -
===2H 2O + O 2↑ B .通电后阴极区附近溶液 pH 会增大 C .K +通过交换膜从阴极区移向阳极区 D .纯净的 KOH 溶液从 b 出口排出
5.我国预计在 2020 年前后建成自己的载人空间站。为了实现空间站的零排放,循环 利用人体呼出的 CO 2并提供 O 2,我国科学家设计了一种装置 ( 如图 Z7- 5) ,实现了“太阳能
- 电能 - 化学能”转化,总反应方程式为 2CO 2===2CO + O 2。下列关于该装置的说法正确的 是 ( )
A .图中 N 型半导体为正极, P 型半导体为负极
B .图中离子交换膜为阳离子交换膜
C .反应完毕,该装置中电解质溶液的碱性增强
D .人体呼出的气体参与 X 电极的反应: CO 2+2e -
+H 2O===C +O 2OH -
6.用如图 Z7- 6 装置研究电化学原理,下列分析中错误的是 ( )
选项
连接 电极材料 分析
a b A K 1 K 2 石墨 铁 模拟铁的吸氧腐蚀
B K 1 K 2 锌 铁 模拟钢铁防护中牺牲阳极的阴极保护法
C K 1 K 3 石墨 铁 模拟电解饱和食盐水
D
K 1 K 3
铁 石墨
模拟钢铁防护中外加电流的阴极保护法
图 Z7-
7.(1) 利用如图 Z7- 7 实验装置可以合成氨,钯电极 B 的电极反应式为
图 Z7- 7
(2)用惰性电极电解葡萄糖和硫酸钠混合溶液,可以制得葡萄糖酸
[CH2OH(CHOH4)COOH]
和己六醇 [CH
2OH(CHOH4)CH2OH]。葡萄糖酸在 _ 极生成,对应的电极反应式为
(3)如图 Z7- 8 所示,以 N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物 ) ,
写出生成这种硝化剂的阳极电极反应式:___________________________ 。
图 Z7- 8
(4)用粗硅作原料,熔融盐电解法制取甲硅烷原理如图 Z7- 9,判断 B 为电源的
______ 极,电解时阳极的电极反应式为 ____________________________ 。
图 Z7- 9
(5)一种氨燃料电池,使用的电解质溶液是 2 mol/L 的 KOH溶液。电池反应为 4NH3+
3O2===2N2+6H2O。
图 Z7- 10
通入 a 气体一极的电极反应式为
NH3 转移电子的物质的量为___
8.(1) 图 Z7- 11 是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,甲醇
在催化剂作用下提供质子 (H+) 和电子,电池总反应为 2CH3OH+ 3O2===2CO2+4H2O。
一个甲醇分子经过电化学氧化,可以产生个电子的电量,其负极的电极反应式为
;消耗 3.4 g
图 Z7- 11
(2) 用间接电化学法除去 NO 的过程如图 Z7- 12 所示。
图 Z7- 12
②电解一段时间,当阴极产生的气体体积为 112 mL(标准状况 )时,停止电解,通过阳
离子交换膜的阳离子的物质的量为 ___ mol ;用平衡移动原理解释阴极区 pH 增大的原
因: _____________________________ 。 (4) 我国的科技人员为了消除 SO 2 的污染,利用原电池原理,变废为宝,设计由
SO 2 和
O 2来制备硫酸,设计装置如图 Z7- 14 所示,电极 A 、 B 为多孔的材料。
已知电解池的阴极室中溶液的 pH 在 4~ 7 之间,写出阴极的电极反应式:
。用离子方程式表示吸收池中除去 NO
的原理: (3) 目前已发明了电解法制取 ClO 2 的新工艺。
①用石墨作电极,在一定条件下电解饱和食盐水制取 极产生 ClO 2 的电极反应式: ClO
2(如图 Z7- 13 所示) ,写出阳 。
图 Z7-
图 Z7- 14
A极为______ ( 填“正极”或“负极” ) 。B极的电极反应式是
___________________________ 。
答案:
1.C [解析] 由图可知,电子从负极流向正极,则 a为负极, b为正极。 b为正极,则 K+移向催化剂 b, A项正确; a 为负极,发生氧化反应,则催化剂a表面
发生反应
[Fe(CN)6]4--e-===[Fe(CN)6]3-,B项正确; b上发生还原反应 [Fe(CN) 6] 3-+e-
===[Fe(CN)6] 4-,[Fe(CN) 6] 3-在催化剂 b表面被还原, C项错误;由 B、C中的电极反应可知,二者以 1∶1相互转化,电解质溶液中 [Fe(CN) 6] 3-和[Fe(CN) 6] 4-浓度基本保持不变, D 项正确。
2.B [ 解析 ] 分析装置图可知是电解装置,电解硫酸钠溶液的实质是电解水,
气体甲与气体乙的体积比约为 1∶ 2,气体甲为氧气,气体乙为氢气,阳极生成氧气,电极反应 2H2O-4e-===4H++ O2↑,阴极生成氢气, 2H2O+2e-===2OH-+H2↑,
所以判断 a 电极是阳极, b 电极是阴极,在阳极室得到硫酸,在阴极室得到氢氧化
钠溶液,则 c 为阴离子交换膜, d 为阳离子交换膜。分析可知 a 电极为阳极,与电源正极相连, A 项错误;阳极室生
成氢离子,生成产物丙为硫酸, c 为阴离子交换膜, B项正确; d 为阳离子交换膜, C项错误; b 电极是阴极,该电极发生还原反应 2H2O+2e-===2OH-+H2↑, D
项错误。
3.B [ 解析 ] 燃料电池中,通入氢气的电极为负极、通入氧气的电极为正极,
则b是
阴极、 a 是阳极。此装置用于电镀铜时,阳极溶解的金属铜等于阴极析出的金属
Cu,所以
电解质溶液中铜离子相当于不参加反应,则其浓度不变, A 项正确;电解精炼铜时,粗铜作阳极、纯铜作阴极,所以若 a为粗铜, b 为纯铜,该装置可用于粗铜的精炼, B项错误;燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应为O2+ 4e-+
2H2O===4O-H,C项正确;电子从负极沿导线流向 b 电极, D项正确。
4.C [ 解析] 阳极发生氧化反应,反应方程式为4OH--4e-===2H2O+O2↑, A
正确;
阴极发生还原反应,消耗氢离子产生氢气,使溶液中氢离子浓度减小,所以溶液pH 增大,
B 正确;钾离子通过交换膜从阳极区移向阴极区,这样才可以达到提纯氢氧化钾的作用, C
错误;纯净的 KOH在阴极制得,从 b 口排出, D 正确。
5.D [ 解析 ] 根据图中左边电源内负电荷移向负极,N型半导体为负极, P 型半导体
为正极, A错误; N型半导体为负极, X 极为电解池的阴极,电极反应为CO2+2e-+
H2O===C+O 2OH-,生成的氢氧根离子通过离子交换膜在Y 极参加反应,所以图中离子交换
膜为阴离子交换膜, B 错误, D正确;总反应方程式为 2CO2===2CO+O2,根据总反应可知,反应前后溶液的碱性不变, C 错误。
6.D [ 解析 ] 在中性条件下,铁作负极失电子,石墨作正极,正极上氧气得电子生成氢氧根离子,则 Fe发生吸氧腐蚀, A正确; Zn、Fe形成原电池, Zn作负极被腐蚀, Fe作正极被保护,属于牺牲阳极的阴极保护法,B正确; Fe作阴极,阴极上氢离子得电子,石
墨作阳极,阳极上氯离子失电子,电解氯化钠溶液生成氢气、氯气和氢氧化钠, C 正确;
Fe与正极相连, Fe作阳极, Fe失电子,被腐蚀, Fe 不能被保护, D错误。
7. (1)N 2+ 6H++ 6e-===2NH3
(2)阳 CH2OH(CHOH4)CHO+ H2O-2e-===
CH2OH(CHOH4)COO+H 2H+
(3)N2O4+ 2HNO3- 2e-===2N2O5+ 2H+
(4)正 Si+4H--4e-=== SiH4↑
(5)2NH3+6OH--6e-===N2+6H2O 0.6 mol
[ 解析 ] (1) 根据图示可知在钯电极 B 上 N2获得电子,与 H+结合形成 NH3,电极反应式为 N2+6e-+ 6H+===2NH3。(2) 葡萄糖生成葡萄糖酸 [CH2OH(CHOH4)COOH 是] 氧化反应,在阳极发生,对应的电极反应式为 CH2OH(CHOH4)CHO+ H2O- 2e-
===CH2OH(CHOH4)COO+H 2H+。 (3)Pt 是惰性电极, N2O4发生失去电子的反应,产物是
N2O5,电极反应式为 N2O4+ 2HNO3-2e-
===2N2O5+2H+。 (4) 从图示知, H-移向阳极生成 SiH4,B 是电源的正极,阳极上电极反应式为 Si+4H--4e-===SiH4↑。 (5) 电池反应为 4NH3+ 3O2===2N2+ 6H2 O。该电池负极是氨气失电子生成氮气,根据示意图可知 a 电极是负极,发生氧化反应,发生的电极反应式为2NH3+
6OH-- 6e -===N2+ 6H2O,反应中 2 mol 氨气反应转移 6 mol 电子, 3.4 g NH 3的物质的量= 3.4 g ÷ 17 g/mol = 0.2 mol ,所以转移电子的物质的量为 0.6
mol 。
8. (1)6 CH3OH+H2O- 6e-===CO2+ 6H+
(2)2HSO3-+ 2e-+2H+===S2O42-+ 2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
(3)①Cl --5e-+2H2O===ClO2↑+ 4H+
②0.01 在阴极发生 2H++2e-===H2↑, H+浓度减小,使得 H2O OH-+H+的平衡向
右移动, OH-浓度增大, pH增大
(4)正极 SO2+ 2H2 O- 2e-===SO42-+4H+
[解析] (1) 根据 2CH3OH+ 3O2===2CO2+ 4H2O可知道, 3 mol 氧气得到的 12 mol 电子来自于 2 mol 的甲醇,一个甲醇分子失去 6 个电子,该电池的负极反应为
CH3OH+H2O- 6e ===CO2+ 6H+。(2) 阴极发生还原反应,亚硫酸氢根离子得电子生成连二亚硫酸根离子,电极反应式为 2HSO3-+ 2e-+2H+===S2O42-+ 2H2O;连二亚硫酸根离子与一氧化氮发生氧化还原反应生成氮气,离子反应方程式为2NO+2S2O42-+2H2O===N2+ 4HSO3-。 (3) ①由题意可知,氯
离子放电生成 ClO2 ,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为Cl --5e-+2H2O===ClO2↑+ 4H+。②在阴极发生 2H++2e-===H2↑,氢气的物质的量为
0.112 L = 0.005 mol ,通过阳离子交换膜的阳离子为+
1 价离子,通过交换膜的阳离子
的物质的量为 0.005 mol × 2= 0.01 mol ,电解中阴极 H+浓度减小,使得 H2O OH-+
H+的平衡向右移动,溶液的 pH增大。 (4)B 极生成硫酸,则通入的气体应为 SO2,由+ 4价升高到+ 6 价,发生氧化反应, B极为负极, A极为正极。 B极的电极反应式为 SO2+2H2O-2e-===SO42-+4H+。
