物理化学实验讲义(外学院)

实验94 步冷曲线法绘制Sn-Bi二元合金相图
实验概述
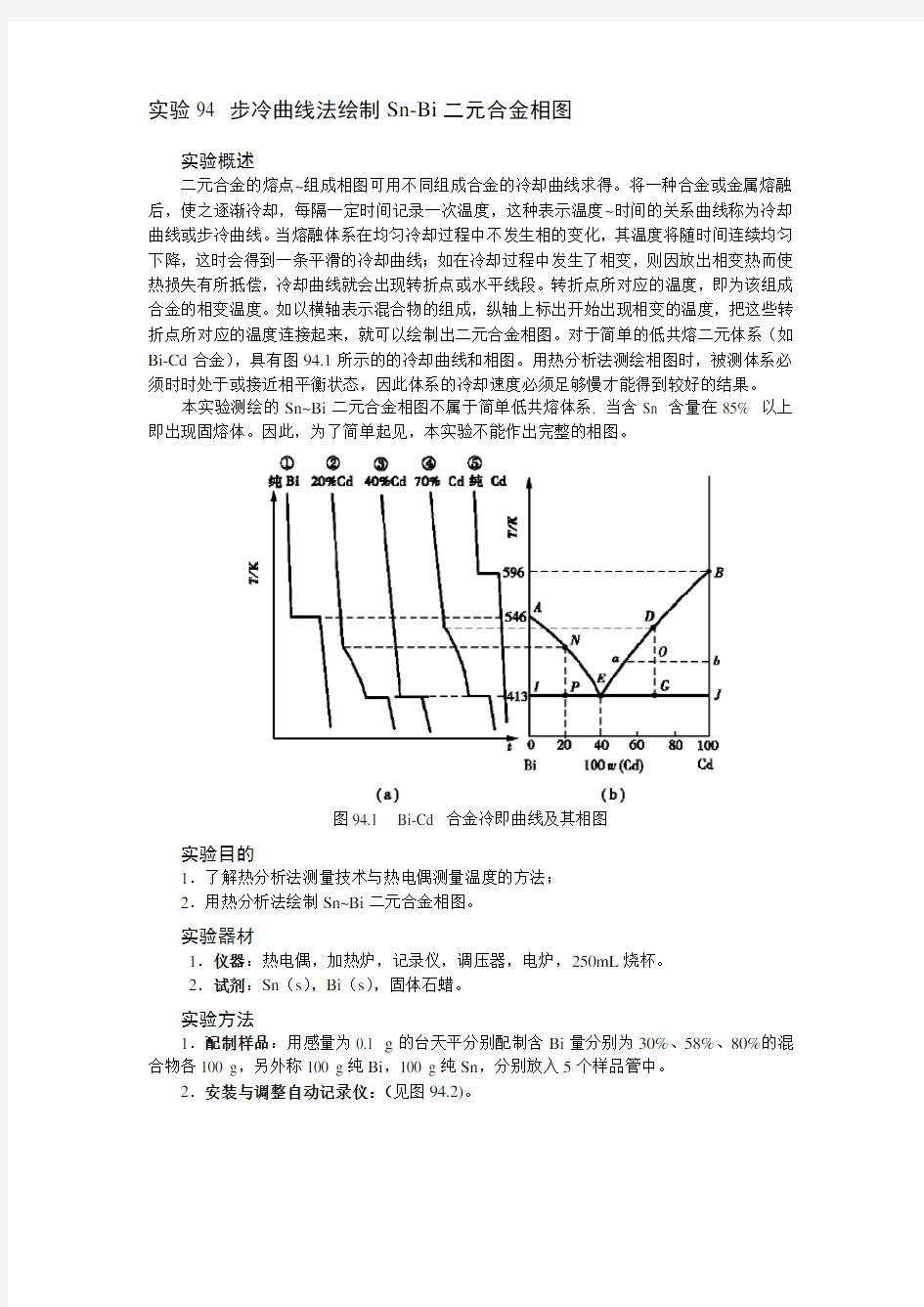
二元合金的熔点~组成相图可用不同组成合金的冷却曲线求得。将一种合金或金属熔融后,使之逐渐冷却,每隔一定时间记录一次温度,这种表示温度~时间的关系曲线称为冷却曲线或步冷曲线。当熔融体系在均匀冷却过程中不发生相的变化,其温度将随时间连续均匀下降,这时会得到一条平滑的冷却曲线;如在冷却过程中发生了相变,则因放出相变热而使热损失有所抵偿,冷却曲线就会出现转折点或水平线段。转折点所对应的温度,即为该组成合金的相变温度。如以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些转折点所对应的温度连接起来,就可以绘制出二元合金相图。对于简单的低共熔二元体系(如Bi-Cd合金),具有图94.1所示的的冷却曲线和相图。用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此体系的冷却速度必须足够慢才能得到较好的结果。
本实验测绘的Sn~Bi二元合金相图不属于简单低共熔体系, 当含Sn 含量在85% 以上即出现固熔体。因此,为了简单起见,本实验不能作出完整的相图。
图94.1 Bi-Cd 合金冷即曲线及其相图
实验目的
1.了解热分析法测量技术与热电偶测量温度的方法;
2.用热分析法绘制Sn~Bi二元合金相图。
实验器材
1.仪器:热电偶,加热炉,记录仪,调压器,电炉,250mL烧杯。
2.试剂:Sn(s),Bi(s),固体石蜡。
实验方法
1.配制样品:用感量为0.1 g的台天平分别配制含Bi量分别为30%、58%、80%的混合物各100 g,另外称100 g纯Bi,100 g纯Sn,分别放入5个样品管中。
2.安装与调整自动记录仪:(见图94.2)。
图94.2 冷却曲线测定装置
3.测定被研究体系的步冷曲线:依次测纯Bi、含Bi 30%、58%、80%的混合物及纯Sn 的冷却曲线。方法如下:将样品管放在加热电炉中,让样品熔化(在样品上方覆盖一层石蜡,以防止样品氧化)。同时将热电偶的热端(连玻璃套管,见图94.2)插入样品管中。待样品熔化后,用热电偶玻璃套搅拌样品,使它各处组成均匀一致。样品的温度不宜升得太高,一般在样品全部熔化后,再升高30℃左右即可(如升得太高样品容易氧化变质,而且将增加冷却时间;如太低,则不能明显地测得转折点)。然后将样品管移到冷却保温杯中,让其缓缓冷却,维持样品冷却速度在6~8℃?min-1之间。或让样品在加热炉内缓慢冷却,同时开动记录仪,保持冷却速度在6~8℃?min-1。将已测样品及另一待测样品同时加热熔化。从已测样品中取出热电偶插入待测的已熔化的样品中,同样方法绘制冷却曲线,依次将全部样品测定。
4.用小烧杯装一定量的水,在电炉上加热,将热电偶插入水中绘制出当水沸腾时的水平线。
数据记录和处理
1. 用已知纯Bi、纯Sn的熔点和水的沸点作标准温度。以冷却曲线上转折点读数作横坐标,标准温度作纵坐标,作出热电偶的校正曲线。
2. 找出各步冷曲线中拐点和平台对应的温度值。
3. 从校正曲线上查出0%、30%、58%、80%、100% Bi合金的熔点温度,然后以横坐标表示组成,纵坐标表示温度作出Sn-Bi二元合金相图。
思考题
1.金属熔融体冷却时,冷却曲线上为什么会出现转折点?纯金属、低共熔金属及合金属的转折点各有几个?曲线形状为何不同?
2.试用相律分析低共熔点、熔点曲线及各区域内的相应自由度。
实验95 硫酸铜的差热分析
实验概述
差热分析(简称DTA )是一种热分析方法,可用于鉴别物质并考察其组成结构以及转
化温度、热效应等物理化学性质,它广泛地应用于许多科研及生产部门。
许多物质在加热或冷却过程中,当达到某一温度时,往往会发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理化学变化,并伴随有焓的改变,因而产生热效应,其表现为该物质与该外界环境之间有温度差。差热分析是在程序控制温度下,测量物质与参比物之间的温度差与温度关系的一种技术。差热分析曲线描述了样品与参比物之间的温差(ΔT )随温度或时间的变化关系。在测定之前,首先要选择一种对热稳定的物质作为参比物(亦称基准物)。在温度变化的整个过程中,该参比物不会发生任何物理或化学的变化,没有任何热效应出现。通常选用的参比物为经过灼烧或烘过的Al 2O 3、MgO 、SiO 2等物质。
将样品与参比物一起置入一个程序可控的升温或降温的电炉中,然后分别记录参比物的
温度以及样品与参比物之间的温差,随着测定时间的延续就可以得到差热分析曲线图(见图98.1)。如果试样和参比物的热容大致相同,当试样没有发生热效应时,参比物和试样试样的温度基本相同,此时得到的是一条平滑的直线,称为基线,如图98.1的OA 和CD 线段。如果试样发生变化引起热效应,那么参比物和试样就会产生温度差,在差热分析曲线上就会有峰出现,如图ABC 和DEF 线段。同时,差热分析中一般规定放热峰为正峰,此时样品的焓变小于零,温度高于参比物;吸热峰为负峰,出现在基线的另一侧。
0温
差
Δ
图95.1 差热分析曲线图 1.谱图分析
从差热图上可以看到差热峰的数目、位置、方向、高度、宽度、对称性以及峰的面积等。峰的数目就是在测定温度范围内,待测样品发生变化的次数;峰的位置标志样品发生变化的温度;峰的方向表明热效应的正负性;峰面积则是热效应大小的反映。在完全相同的测定条件下,许多物质的差热谱图就具有特征性,因此可以通过对比已知物的差热图来鉴别物质的种类。而对峰面积进行定量处理,则可确定某一变化过程的热效应大小。峰的高度以及峰的对称性除与测定条件有关,往往还与样品变化过程的各种动力学因素有关,由此可以计算某些类型反应的活化能和级数。
差热峰的位置可参照图95.2所示方法来确定。正常情况下(图95.2,a ),其起始温度T e 和终点温度可由两曲线的外延交点确定,峰面积就是基线上的阴影面积,峰顶温度T p 可以从曲线最高点作横坐标的垂线即可得到。由于T e 大体代表了开始变化的温度,因此常用T e 表征峰的位置,对于很尖锐的峰,其位置也可以用峰顶温度T p 表示。
图95.3 简单差热分析装置原理示意图 在实际测定中,由于样品与参比物间往往存在比热,导热系数、粒度、装填疏密程度等
方面的差异,再加上样品在测定过程中可能发生收缩或膨胀,差热线就会发生漂移,其基线
不再平行于时间轴,峰的前后基线也不在一条直线上,差热峰也可能因此而不尖锐,这时可
以通过作切线的方法来确定转折点及峰面积(参见图95,b ),图中阴影部分就为校正后的
峰面积。
(a) 正常曲线 (b) 基线漂移的校正
图95.2 差热峰位置和面积的确定
2.实验装置
最简单的差热分析装置如图95.3所示,样品和参比物分别装填在玻璃坩埚内并置于保
持器的两个孔中。将两对同样材料制成的热电偶的热端分别插入样品和参比物中,热电偶上
两个相同的线头接在一起,见图中1点(或置于空气中)另两端连在记录仪上,由于这两对
热电偶所产生的热电势方向正好相反,在样品没有发生变化时,它与参比物处在同一温度,
这两对热电偶的热电势大小一样而互相抵消,记录仪图纸上出现与时间轴平行的直线。一旦
样品发生变化,产生热效应,则两热电偶这时所处的温度不同,两热电偶的热电势大小不一
样,在记录仪图上出现峰值。
测定时,将保持器放在电炉内,通过调整变压
器,而改变加热功率,使体系按所规定的速率匀速
升温,并每隔一定的时间记录一次参比物的温度,
这样就可以绘制出如图95.1那样的差热图,ΔT 为
温差电势,T 为参比物温度。
现代成套的差热分析仪可以自动控制升温或
降温速率,并自动记录差热信号和参考点温度,这
种差热分析仪将温度及温差换成了电信号,故还可
以将信号输送到自动积分仪或计算机,对测定数据
进行处理。
3.测定条件的选择
(1)升温速率的选择
升温速率对测定结果有明显的影响,一般来说
速率低时,基线漂移小,所得峰形显得矮而宽,可以分辨出靠近很近的峰,但每次测定时间较长;升
温速率高时,峰形比较尖锐,测定时间较短,而
基线漂移明显,与平衡条件相距较远,出峰温度误差较大,分辨能力下降。
为便于比较,在测定一系列样品时,应采用相同的升温效率。
升温速率一般采用2~20 °C?min-1。在特殊情况下,最慢可为0.1 °C?min-1,最快可达200 °C?min-1,而最常用的是8~12 °C?min-1。
(2)参比物的选择
测定时应尽可能选用与样品的比热,导热系数相近的材料作为参比物。
(3)气氛及压力的选择
许多试样的测定受气氛及压力的影响很大,例如,碳酸钙、氧化银的分解温度分别受气氛中二氧化碳、氧气的分压的影响;液体、溶液的沸点以及冰水与外压的关系则是十分明显的;许多金属在空气中测定会被氧化等等。因此,应根据待测样品的性质,选择适当的气氛和压力。现代差热分析仪的电炉备有密封罩,并装有若干气体阀门,便于抽空及通入指定的气体。为方便起见,本实验在大气中进行。
(4)样品的预处理及用量
一般的非金属固体样品均应经过研磨,使成为100—200目左右的微细颗粒,这样可以减少死空间,改善导热条件,但不应过度的研磨,因为可能会破坏晶体的晶格。对于那些会分解而释放出气体的样品,颗粒则应大些。
参比物的颗粒度以及装填松紧度都应与样品尽可能一致。
样品用量应尽可能少,这样可以得到比较尖锐的峰并能分辨靠得很近的相邻峰。样品过多峰形往往形成大包,并使相邻的峰互相重叠而无法分辨。当然样品也不能过少,因为它受仪器灵敏度稳定性的制约。一般用量为0.5~1.5 g。
如样品体积太小,不能完全覆盖热电偶,或样品容易因烧结,熔融而结块,可渗入一定量的参比物或其它热稳定材料。
实验目的
1.掌握差热分析实验原理,了解试样热处理的基础方法。
2.掌握差热分析仪法的操作技术。
3.用差热分析法对CuSO4?5H2O进行差热分析,并能定性解释所得的差热现象。
实验器材
1.仪器:双笔自动记录仪, 加热电炉, 程序升温控制仪, 热电偶。
2.试剂:α-Al2O3(AR),CuSO4?5H2O(AR)。
实验方法
1.将自动记录仪、电炉、热电偶等按图98.3连接好。
2.调整好记录仪笔的位置。为了判断热效应的正负与记录笔移动方向的关系,可用手握住准备插入参比物的热电偶的端部用体温将其加热,,观察笔运动的方向,习惯上是使笔向右偏转为样品吸热,向左偏转为样品放热。
3.称取0.1~0.3 g的CuSO4?5H2O与0.4 ~ 0.2 g的α-Al2O3均匀混合后,装入玻璃坩锅并置于保持器的左侧孔中,右孔装入0.5 g α-Al2O3,并各用玻璃棒压实
4.将保持器放入电炉中,将热电偶的两热端分别插到样品和参比物的中央,并注意两热电偶插入的深度必须尽可能一致。
5.加热升温。调节调压变压器,使电炉升温,升温度控制在2~3 °C?min左右。
数据记录和处理
1. 记录时应写明测定条件:参比物名称、规格、用量、稀释比、仪器型号、气氛、大气压、室温、升温速率。
2.从原始记录选取若干数据点,作出差热曲线及升温曲线。
3.指明硫酸铜变化的次数。
4.找出各峰的开始温度和峰温度。
5.根据硫酸铜的化学性质,讨论各峰所代表的可能反应,写出反应方程式。
思考题
1.差热分析与简单热分析有何异同?
2.影响差热分析结果的主要因素有哪些?
3.在什么情况下,升温过程与降温过程所做的差热分析结果相同?在什么情况下只能采用升温过程?在什么情况下采用降温过程为好?
实验98 电导率法测定醋酸的电离常数
实验概述
电解质溶液属第二类导体,它是靠正负离子的定向迁移传递电流。溶液的导电本领,可用电导率来表示。
研究溶液电导率时常到摩尔电导率,它与电导率和浓度的关系为:
c m /κ=Λ (98.1)
式中:m Λ-摩尔电导率(12-??mol S m ),κ-电导率(1-?m S );c -溶液浓度(-3m ?mol )。 m Λ随浓度变化的规律,对强弱电解质各不相同,对强电解质稀溶液可用下列经验式
m m ∞Λ=Λ- (98.2) 式中:m ∞Λ-无限稀摩尔电导率;A -常数。将m ∞Λ对c 作图,外推可求得m ∞
Λ。 弱电解质电离产生的离子浓度很低,因此摩尔电导率m λ和无限稀释摩尔电导率m ∞Λ相差
较大,因此,浓度为c 时弱电解质的电离度a 为:
m m a ∞Λ=Λ (98.3)
对于AB 型弱电解质,在溶液中达到电离平衡时,电离平衡常数K c 、溶液浓度c 、电离度α之间有如下关系: a
ca K c -=12
(98.4) 合并(98.3)、(98.4)式即得:
2
()m c m m m c K ∞∞Λ=ΛΛ-Λ (98.5)
结合(98.1)并线性化处理得
2m
1()m c m c K K κ∞∞=Λ-ΛΛ (98.6) 以k 对Λ-1m 作图为一直线,直线斜率
(98.7)
其中m ∞Λ的值可根据离子独立运动规律求出:
(98.8)
其中:γ+和γ-分别表示1 mol 电解质在溶液中产生γ+ mol 阳离子和γ- mol 阴离子,m λ∞+,、m λ∞-,
分别为阳离子和阴离子的无限稀释的摩尔电导(其值可查表)。例如,查出25℃下H +的m λ∞+
,值为0.03498 S ?m 2? mol -1, CH 3COO – 的m λ∞-,值为0.00409 S ?m 2? mol -1,则在25℃下醋酸水溶液
无限稀释摩尔电导率o m ∞Λ(HOAc,25C )
=0.03498+0.00409=0.03907 S ?m 2?mol -1同理可得,o m ∞Λ(HOAc,30C )=0.0414 S ?m 2? mol -1。代入(98.7)式即可算得K c 。 实验目的
1.了解溶液电导、电导率、摩尔电导率的基本概念;
2.用电导率法测定弱电解质溶液的电离平衡常数的方法。
2()m c K β∞
=Λm m m γλγλ∞∞∞++--Λ=+,,
实验器材
1.仪器:DDS-11A型电导率仪,超级恒温器;
2.试剂:0.100 mol?L-1 HAc标准溶液,0.01 mol?L-1 KC1标准溶液。
实验方法
1. 调节恒温槽温度在25℃±0.1℃。如果室温较高,则温度可调节在30℃±0.1℃。
2. 电导率的测量方法请参阅《实验化学导论》6.7.1。
3. 测定电导电极常数。先用蒸馏水洗涤电导池和电导电极,再用少量0.01 mol?L-1KC1溶液淋洗三次,加入少量0.01 mol?L-1KC1,使液面超过电极10~20 mm即可,再将电导池置于恒温水槽中,恒温5-10 min后进行测量。重复测定三次,然后取平均值。
4. 测定醋酸溶液的电导率。将电导池和电导电极用蒸馏水洗涤,再用少量的被测醋酸淋洗三次,然后注入被测醋酸溶液,使溶液超过电极10~20 mm,再将电导池置于恒温水槽中,恒温5-10 min后进行测量。本实验需测定0.010、0.025、0.050、0.100 mol?L-1四种不同浓度醋酸的电导率。重复测定三次,然后取平均值。
注意事项
1.恒温水的温度应恒定,误差不超过±0.1℃。溶液恒温时间不得少于15 min。
2.用待测液淋洗电极时,应注意不要损坏铂黑,以免电极常数改变,引起误差。电极用后应清洗干净,并将铂黑浸没在蒸馏水中。以防电极干燥、老化。
3.测量时,量程开关应由大到小调节。
数据记录和处理
1. 将实验数据统一为国际单位制。
2.根据(98.1)式计算各个浓度醋酸的摩尔电导率Λm及Λ-1m。
3.以κ对Λ-1m作图,并求出所得直线的斜率,然后根据(98.7)式求出K c的值。
4.计算实验结果的相对误差。K c(HAc, 25o C)=1.75?10-2,K c(HAc,3 0o C)=1.80?10-2。
思考题
1.为什么要测电导电极常数?如何测定?
2.本实验为什么要在恒温条件下进行?
实验99 电动势法测定化学反应的热力学函数
实验概述
本实验是测定反应
)()()(44s Pb ZnSO s PbSO S Zn +→+
的热力学函数,该反应设计成一个可逆电池:
)()()(44Hg Pb S PbSO aq ZnSO Hg Zn )
( 根据电化学原理,在恒温恒压的可逆操作条件下,电池所做的电功是最大有用功。通过
测定电池的电动势E (略去锌汞齐和铅汞齐的生成热)根据不同温度下电动势数据,即可得到电池反应的Δr G m 。
zFU W G f m r -=-=?max , (99.1)
式中z 为反应式中电子的计量系数,F 为法拉第常数,U 为电池的电动势。
因为 m r P r m r m r S T T
G T H G ?-=???=?-?)( (99.2) 故 P m r T
U nFT nFU H )(??+-=? (99.3)
P m r T
U nF S )(
??=? (99.4) RT G Q K m r a a /ln ln ?-= (99.5)
式中:K a 为反应的平衡常数,Q a 为活度商。
按照化学反应设计成一个电池,测量一系列不同温度下电池的电动势,以电动势对温度
作成曲线。从曲线的斜率可以求得任一温度T 的dE/dT 值。利用上述公式(99.1)、(99.3)、(99.4)、(99.5)即可求得该反应的势力学函数?r G m 、?r H m 、?r S m 及平衡常数K a 。
根据热力学原理,只有在恒温、恒压、可逆条件下,(99.1)式才成立,这就不仅要求电池反应本身是可逆的,而且电池也必须在可逆条件下工作,即充电和放电过程都必须在非常接近平衡状态下进行,只允许有无限小的电流通过。因此,不能直接用伏特计来量度电池的电动势,因为当把伏特计与电池接通后,由于电池中发生的化学变化,有电流流出,电池中溶液浓度不断改变,电动势也会有变化。另一方面,电池本身也有内阻,所以用伏特计量出的只是外电路的电位降,而不是可逆电池的电动势。因此,测量可逆电池的电动势应该在电路中几乎没有电流通过。根据欧姆定律:
I R R U i )(0+= (99.5)
式中:R i 是内阻,R 0是外阻外电路电位降。
对于外电路: U o = R 0 I (99.6)
因为(99.5)、(99.6)式中I 相等,所以
i o o R R R U Uo +=
(99.7)
当R o >>R i 时, U ≈U 0
(99.8) 直流电位差计就
是根据波根多夫
对消法实验原理设计的,其简单工作原理如图99.1,AB 为均匀的电阻线,工作电池E w 相通,被测电池的负极与工作电池的负极并联,正极则经过检流计(G )接到滑动接置来决定。移动滑动点的位置便会找到某一点如C 点,当电钥K 闭合时,检流计中几乎没有电流通过,此时电池的电动势恰好和AC 线段所代表的电位差在数值上相等而方向相反。
图99.1 对消去测定电动势原理示意图
为了求得AC 线段的电位差,可以将D 向上与标准电池E N 接通。由于标准电池的电动势是已知的,而且能保持恒定,因此同样方法可以找出另一点H ,使检流计中几乎没有电流通过。则AH 段的电位差就等于E N 。因为电位差与电阻线的长度成正比,故待测电池的电
动势为:
(99.9)
在一定温度下标准电池电势一定,293.15K 时,为1.01855伏, 所以
AH
AC E x ?=01855.1 (99.10) AH 段上的电位差等于E N ,故E x 等于AC 段的电位差。
实验目的
1.掌握对消法测定可逆电池电动势的原理和方法以及电位差计、检流计和标准电池的使用方法;
2.测定不同温度下待测可逆电池的电动势,并由此计算其化学反应的热力学函数Δr G m 、 Δr H m 、Δr S m 及K a ;
3.掌握用图解微分进行数据处理的方法。
实验器材
1.仪器:U J 25电位差计,检流计,工作电池,待测电池,超级恒温槽。
2.试剂:Pt ,Zn ,Pb ,Hg (l ),PbSO 4(s ),ZnSO 4溶液。
实验方法
1. 装制电池
这一电池的构造如图99.2所示。由H 形管构成。管底焊接两根铂丝,作为电极的导线。管的两边分别装入锌汞齐和铅汞齐。在铅汞齐上部是悬浮固体PbSO 4。整个电池管中充满ZnSO 4溶液。在H 形管的横臂上塞有洁净的玻璃毛,以防止悬浮的PbSO 4固体污染锌半电池管。在管口塞上橡皮塞并用蜡密封,以便浸入恒温不槽中不致发生渗漏。将塞子钻个孔,接根玻璃管,使在热膨胀时有伸缩余地。
AH AC
E E N X =
图99.2 Zn-Pb 电池示意图
汞齐的制备方法:按质量来取金属和汞(在粗天平进行称重),在通风橱里将汞热一下,向其中加入金属,冷却后,先用蒸馏水洗汞齐,再用ZnSO 4溶液洗三、四次,用角匙将汞齐移入电池管中,要使铂丝的全部浸没。 配制0.02 mol ?L -1 ZnSO 4溶液,加入锌汞齐上。而铅汞齐上则加入带有悬浮PbSO 4溶液。此液是,取100 mL 0.02 mol ZnSO 4溶液,加入约2 g PbSO 4研磨,摇动后,将此悬浮液加入铅汞齐上。加时要小心,不要让PbSO 4跑入锌极上。
2.测定不同温度下电池的电动势
(1)根据实验实验原理连接好实验仪器装置。电位差计的使用方法请参阅《实验化学导论》6.7.2.1.
(2)校正标准电池的电动势:20℃时标准电池的电动势为1.01855 V ,当实验时环境温度不是20℃时,应根据下列近似公式校正:
)20(40/--=?t V U t μ (99.11)
式中t 为环境温度。
(3)标定工作电流:具体方法参阅附录中电位差计一节。
(4)将上述电池置于恒温水槽内,达到热平衡后(一般水温达到所设温度后需10~15min )测量其电动势,并记录温度。再升温,测电动势。温度范围在15°~50°之间,每隔4~5℃左右测一次,至少测五种温度下的电动势。 注意事项
1.检查工作电池、标准电池、待测电池极性是否接错。各接点接触是否可靠。
2.恒温水温度是否稳定,波动小于±0.1℃。恒温水达到指定温度后,需再等10~15分钟,电池才能达到热平衡。
3.切忌按键时间大于1秒或频繁按键。
4.每次测定后,应重新检查是否保持标准化。
5.要防止电池振动,如电池摇动后,要稳定30分钟后再测量。
数据记录和处理
1. 将测得的电动势E 对T 作图,并由图上的曲线求取20℃, 25℃, 30℃, 35℃, 40℃五个温度下的E 和dT dU 值。dT
dU 值是通过作曲线的切线(可用镜像法),由切线的斜率求得。 2.利用方程式(99.1)、(99.2)、(99.3)、(99.4)计算25℃, 30℃, 35℃时该电池反应的m r m r m r S H G ??? , ,的数值。
3.根据所得Δr G m ,计算该反应的平衡数数K a 值,利用平衡移动实验原理解释实验结果。
思考题
1.本实验采用的方法适用于测定哪一类化学反应的热力学函数?2.为什么不用伏特计直接测量电池的电动势?
3.为什么要标定电位差计的工作电流?
4.标准电池在实验中起什么作用?
大学物理近代物理学基础公式大全
一. 狭 义相对论 1. 爱因斯坦的两个基本原理 2. 时空坐标变换 3. 45(1(2)0 m m γ= v = (3)0 E E γ= v =(4) 2222 C C C C v Pv Pv Pv P E E E E ==== 二. 量子光学基础 1. 热辐射 ① 绝对黑体:在任何温度下对任何波长的辐射都能完全吸收的物体。 吸收比:(T)1B αλ、= 反射比:(T)0B γλ、= ② 基尔霍夫定律(记牢) ③ 斯特藩-玻尔兹曼定律 -vt x C v = β
B B e e :单色辐射出射度 B E :辐出度,单位时间单位面积辐射的能量 ④ 唯恩位移定律 m T b λ?= ⑤ 普朗克假设 h εν= 2. 光电效应 (1) 光电效应的实验定律: a 、n I ∝光 b 、 0 00a a a a e U ek eU e U ek eU e U ek eU e U ek eU νννν----==== (23、 4 三. 1 ② 三条基本假设 定态,,n m n m h E E h E E νν=-=- ③ 两条基本公式 2210.529o n r n r n A == 12213.6n E E eV n n -== 2. 德布罗意波 20,0.51E mc h E MeV ν=== 22 mc mc h h νν== 电子波波长:
h mv λ= 微观粒子的波长: h h mv mv λλ= === 3. 测不准关系 x x P ???≥h 为什么有?会应用解题。 4.波函数 ① 波函数的统计意义: 例1① ② 例2.① ② 例3.π 例4 例5,,设 S 系中粒子例6 例7. 例8. 例9. 例10. 从钠中移去一个电子所需的能量是2.3eV ,①用680nm λ=的橙光照射,能否产生光电效应?②用400nm λ=的紫光照射,情况如何?若能产生光电效应,光电子的动能为多大?③对于紫光遏止电压为多大?④Na 的截止波长为多大? 例11. 戴维森革末实验中,已知电子束的动能310k E MeV =,求①电子波的波长;②若电子束通过0.5a mm =的小孔,电子的束状特性是否会被衍射破坏?为什么? 例12. 试计算处于第三激发态的氢原子的电离能及运动电子的德布罗意波长。 例13. 处于基态的氢原子,吸收12.5eV 的能量后,①所能达到的最高能态;②在该能态上氢原子的电离能?电子的轨道半径?③与该能态对应的极限波长以及从该能态向低能态跃迁时,可能辐射的光波波长?
大学物理化学实验全集
实验六.二组分固-液体系相图的绘制 一、实验目的 (1)热分析法测绘Sn-Bi二元合金相图 (2)掌握热分析法的测量技术 (3)掌握热电偶测量温度的基本原理以及数字控温仪和升降温电炉的使用方法 二、实验原理 用几何图形来表示多相平衡体系中有哪些相,各相的成分如何,不同相的相对量是多少,以及它们随浓度、温度、压力等变量变化的关系图叫相图。以体系所含物质的组成为自变量,温度为应变量所得到的T-x图就是常见的一种相图。 绘制相图的方法很多,热分析法就是常用的一种实验方法。即按一定比例配成一两组分体系,将体系加热到熔点以上成为液态,然后使其逐渐冷却,每隔一定时间记录一次温度,以体系的温度对时间的关系曲线称为步冷曲线。熔融体系在均匀冷却过程中无相变时,其温度将连续均匀下降,得到一条平滑的冷却曲线,当冷却过程中发生相变时,放出相变热,使热损失有所抵偿,冷却曲线就会出现转折。当两组分同时析出时,冷却速度甚至变为零,冷却曲线出现水平段。转折点或平台所对应的温度,即为该组成合金的相变温度。 取一系列组成不同的二元合金,测得冷却曲线,再将相应的转折点连接起来即得到二元合金相图(如下图所示) 三、实验所用仪器、试剂 1.KWL-09可控升降温电炉,SWKY-1数字控温仪 2.编号为1-6的六个金属硬质试管依次分装:纯铋、含锡20%,42%,60%,80%的合金、纯锡。8号试管为空管。 四、实验步骤 1.安装并调整SWKY-1数字控温仪与KWL-09可控升降温电炉,将控温仪与电炉用电缆连接。2号炉膛(右侧)放8号空管,将与控温仪相连的温度传感器(传感器2)插入其中 2.1.将装有试剂的试管1放入1号炉膛(注意安全,始终用铁夹小心夹住试管),并将与电炉连接的温度传感器(传感器1)插入炉膛旁边的另一小孔中(注:不要将传感器1插入试管中)。将2号传感器插入放有8号空管的炉膛2 2.2.调节控温仪(工作/量数按钮),将电炉温度设定为350℃,再调为工作状态,此时1号炉膛开始加热。调节定时按钮,是时间显示为30s。将电炉“冷风量调节”电压调到零,“加热量调节”调到180V(电压过低加热太慢,电压过高有损仪器使用寿命),给2号炉膛预热到200度左右(避免温度下降过快,减小试管冷却时发生过冷现象的可能) 2.3.当温度显示1号炉膛温度达到350℃时,再等10min左右。待温度稳定后将预热后的8号空管用铁夹移出去,并将1号试管夹入2号炉膛。换入2号试管加热,熔融。关闭“加热量调节”,此时控温仪显示温度上升,当温度上升到310℃以上时,打开“冷风量调节”,电压调为1.5V。此时温度开始下降,当温度降到接近300℃时,开始记录温度。每隔30s,控温仪会响一声,依次记下此时的仪表读数即可。
物理化学实验思考题答案
实验一燃烧热的测定预习思考题答案 1、开机的顺序是什么? 答案:打开电源---热量计数据处理仪—计算机。(关机则相反) 2、搅拌太慢或太快对实验结果有何影响? .答案:搅拌的太慢,会使体系的温度不均匀,体系测出的温度不准,实验结果不准,搅拌的太快,会使体系与环境的热交换增多,也使实验结果不准。 3、萘的燃烧热测定是如何操作的?燃烧样品萘时,内筒水是否要更换和重新调温? 答案:用台秤粗称萘0.7克,压模后用分析天平准确称量其重量。 在实验界面上,分别输入实验编号、实验内容(发热值)、测试公式(国标)、试样重量、 点火丝热值(80J),按开始实验键。其他同热容量的测定。内筒水当然要更换和重新调温。 4、燃烧皿和氧弹每次使用后,应如何操作? 答案:应清洗干净并檫干。 5、氧弹准备部分,引火丝和电极需注意什么? 答案:引火丝与药片这间的距离要小于5mm或接触,但引火丝和电极不能碰到燃烧皿,以免引起短路,致使点火失败。 6、测定量热计热容量与测定萘的条件可以不一致吗?为什么? 答案:不能,必须一致,否则测的量热计的热容量就不适用了,例两次取水的量都必须是2.6升,包括氧弹也必须用同一个,不能换。 7、量热计热容量的测定中,“氧弹充氧” 这步如何操作? 答案:①卸下氧弹盖上的进出气螺栓及垫片,旋上导气管接头,并用板手拧紧; ②关闭(逆时针)氧气钢瓶的减压阀; ③打开(逆时针)氧气钢瓶总阀门,至指针指向10 Mpa左右; ④打开(顺时针)氧气钢瓶的减压阀;使指针指向2.5Mpa→充氧1min; ⑤关闭(逆时针)氧气钢瓶的减压阀; ⑥用板手旋松导气管接头,取出。垫上垫片,拧紧螺栓。 8、实验过程中有无热损耗,如何降低热损耗? 答案:有热损耗,搅拌适中,让反应前内筒水的温度比外筒水低,且低的温度与反应后内筒水的温度比外筒高的温度差不多相等。 9、药片是否需要干燥?药片压药片的太松和太紧行不行?
大学物理公式大全
大学物理公式大全 TPMK standardization office【 TPMK5AB- TPMK08- TPMK2C- TPMK18】
第一章 质点运动学和牛顿运动定律 1.1平均速度 v = t △△r 1.2 瞬时速度 v=lim △t →△t △r =dt dr 1. 3速度v=dt ds = =→→lim lim △t 0 △t △t △r 1.6 平均加速度a =△t △v 1.7瞬时加速度(加速度)a=lim △t →△t △v =dt dv 1.8瞬时加速度a=dt dv =22dt r d 1.11匀速直线运动质点坐标x=x 0+vt 1.12变速运动速度 v=v 0+at 1.13变速运动质点坐标x=x 0+v 0t+ 2 1at 2 1.14速度随坐标变化公式:v 2-v 02=2a(x-x 0) 1.15自由落体运动 1.16竖直上抛运动 ?????===gy v at y gt v 22122 ???? ???-=-=-=gy v v gt t v y gt v v 2212 0220 0 1.17 抛体运动速度分量???-==gt a v v a v v y x sin cos 00 1.18 抛体运动距离分量?? ? ??-?=?=20021sin cos gt t a v y t a v x 1.19射程 X=g a v 2sin 2 1.20射高Y= g a v 22sin 20 1.21飞行时间y=xtga —g gx 2 1.22轨迹方程y=xtga —a v gx 2 202 cos 2 1.23向心加速度 a=R v 2 1.24圆周运动加速度等于切向加速度与法向加速度矢量和a=a t +a n 1.25 加速度数值 a=2 2n t a a + 1.26 法向加速度和匀速圆周运动的向心加速度相 同a n =R v 2 1.27切向加速度只改变速度的大小a t = dt dv 1.28 ωΦ R dt d R dt ds v === 1.29角速度 dt φ ωd = 1.30角加速度 22dt dt d d φ ωα== 1.31角加速度a 与线加速度a n 、a t 间的关系 a n =22 2)(ωωR R R R v == a t =αωR dt d R dt dv == 牛顿第一定律:任何物体都保持静止或匀速 直线运动状态,除非它受到作用力而被迫改变这种状态。 牛顿第二定律:物体受到外力作用时,所获得的加速度a 的大小与外力F 的大小成正比,与
物理化学实验总结与心得
物化实验总结与心得 闽江学院化学与化学工程系120101202242 朱家林 时间过的很快,一个学期的物化实验已经结束了。经过一个学期的物化实验的学习,学到了很多专业知识和实验基本操作,以及很多做人做事的技巧和态度。物化实验是有用的,也是有趣的,物理化学实验涉及到了化学热力学、化学动力学、电化学、表面化学。一下,简单的回顾一下本学期的十四个物化实验。 实验一、燃烧热的测定 用氧弹卡计测定萘的燃烧热;了解恒压燃烧热与恒容燃烧热的区别;了解卡计中主要部分的作用。掌握卡计的实验技术;学会用雷诺图解法校正温度变化。热是一个很难测定的物理量,热量的传递往往表现为温度的改变。而温度却很容易测量。如果有一种仪器,已知它每升高一度所需的热量,那么,我们就可在这种仪器中进行燃烧反应,只要观察到所升高的温度就可知燃烧放出的热量。根据这一热量我们便可求出物质的燃烧热。试验中要注意:压片时应将Cu-Ni合金丝压入片内;氧弹充完氧后一定要检查确信其不漏气,并用万用表检查两极间是否通路;将氧弹放入量热仪前,一定要先检查点火控制键是否位于“关”的位置。点火结束后,应立即将其关上。氧弹充氧的操作过程中,人应站在侧面,以免意外情况下弹盖或阀门向上冲出,发生危险。 实验二、液体饱和蒸汽压的测定 明确纯液体饱和蒸气压的定义和气液两相平衡的概念,深入了解纯液体饱和蒸气压和温度的关系棗克劳修斯-克拉贝龙方程式;用等压计测定不同温度下苯的饱和蒸气压。初步掌握真空实验技术;学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。测定前必须将平衡管a,b段的空气驱赶净。冷却速度不应太快,否则测得的温度将偏离平衡温度。如果实验过程中,空气倒灌,则实验必须重做。在停止实验时,应该缓慢地先将三通活塞打开,使系统通大气,再使抽气泵通大气(防止泵中油倒灌),然后切断电源,最后关闭冷却水,使装置复原
大学物理化学实验报告---液体饱和蒸汽压的测定
纯液体饱和蒸汽压的测量 目的要求 一、 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱 和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。 二、 用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验 技术。 三、 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸 点。 实验原理 通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol 液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm (101.325kPa )时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示: 2 m vap d ln d RT H T p ?= (1) 式中,R 为摩尔气体常数;T 为热力学温度;Δvap H m 为在温度T 时纯液体的摩尔 气化热。 假定Δvap H m 与温度无关,或因温度范围较小,Δvap H m 可以近似作为常数,积分上式,得: C T R H p +??-=1 ln m vap (2) 其中C 为积分常数。由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为 R H m vap ?- ,由斜率可求算液体的Δvap H m 。 静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此 法一般适用于蒸气压比较大的液体。静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置,如图1所示: 平衡管由A 球和U 型管B 、C 组成。平衡管上接一冷凝管,以橡皮管与压
高分子材料物理化学实验复习资料
一、热塑性高聚物熔融指数的测定 熔融指数 (Melt Index 缩写为MI) 是在规定的温度、压力下,10min 高聚物熔体通过规定尺寸毛细管的重量值,其单位为g 。 min)10/(600 g t W MI ?= 影响高聚物熔体流动性的因素有因和外因两个方面。因主要指分子链的结构、分子量及其分布等;外因则主要指温度、压力、毛细管的径与长度等因素。 为了使MI 值能相对地反映高聚物的分子量及分子结构等物理性质,必须将外界条件相对固定。在本实验中,按照标准试验条件,对于不同的高聚物须选取不同的测试温度与压力。因为各种高聚物的粘度对温度与剪切力的依赖关系不同,MI 值只能在同种高聚物间相对比较。一般说来,熔融指数小,即在10min 从毛细管中压出的熔体克数少,样品的分子量大,如果平均分子量相同,粘度小,则表示物料流动性好,分子量分布较宽。 1、 测烯烃类。 2、聚酯(比如涤纶)不能测。 3、只能区别同种物质。 聚丙烯的熔点为165℃,聚酯的熔点为265℃。熔融加工温度在熔点上30~50 考:简述实验步骤: ① 选择适当的温度、压强和合适的毛细管。(聚丙烯230℃) ② 装上毛细管,预热2~3min 。 ③ 加原料,“少加压实”。平衡5min ,使其充分熔融。 ④ 加砝码,剪掉一段料头。1min 后,剪下一段。 ⑤ 称量 ⑥ 重复10次,取平均值。 ⑦ 关闭,清洁仪器。 思考题: 1、影响熔融指数的外部因素是什么?(4个) 2、 熔融指数单位:g/10min 3、测定热塑性高聚物熔融指数有何意义? 参考答案:热塑性高聚物制品大多在熔融状态加工成形,其熔体流动性对加工过程及成品性能有较大影响,为此必须了解热塑性高聚物熔体的流变性能,以确定最佳工艺条件。熔融指数是用来表征熔体在低剪切速率下流变性能的一种相对指标。 4、聚合物的熔融指数与其分子量有什么关系?为什么熔融指数值不能在结构不同的聚合物之间进行比较? 答:见前文。 二、声速法测定纤维的取向度和模量 测定取向度的方法有X 射线衍射法、双折射法、二色性法和声速法等。其中,声速法是通过对声波在纤维中传播速度的测定,来计算纤维的取向度。其原理是基于在纤维材料中因大分子链的取向而导致声波传播的各向异性。 几个重要公式: ①传播速度C=)/(10 )(106 3 s km t T L L ??-?- 单位:C-km/s ;L-m ;T L -μs ;△t-μs ②模量关系式 2 C E ρ= ③声速取向因子 22 1C C f u a -= ④?t(ms)=2t 20-t 40(解释原因) Cu 值(km/s ):PET= 1.35,PP=1.45,PAN=2.1,CEL=2.0 (可能出选择题) 测定纤维的C u 值一般有两种方法:一种是将聚合物制成基本无取向的薄膜,然后测定其声速值;另一种是反推法,即先通过拉伸试验,绘出某种纤维在不同拉伸倍率下的声速曲线,然后将曲线反推到拉伸倍率为
物理化学实验报告.
《大学化学基础实验2》实验报告 课程:物理化学实验 专业:环境科学 班级: 学号: 学生姓名:邓丁 指导教师:谭蕾 实验日期:5月24日
实验一、溶解焓的测定 一、实验名称:溶解焓的测定。 二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。 (2)掌握作图外推法求真实温差的方法。 三、基本原理: 盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。热平衡式: △sol H m=-[(m1C1+m2C2)+C]△TM/m2 式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值. 四、实验主要仪器名称: NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子 ;蒸馏水 天平1台;KCl;KNO 3 五、实验步骤: (1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 . n KCl : n水 = 1: 200 (2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温. (3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止. (4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计. KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作.
物理化学试验-华南理工大学
物理化学实验Ⅰ 课程名称:物理化学实验Ⅰ 英文名称:Experiments in Physical Chemistry 课程代码:147012 学分:0.5 课程总学时:16 实验学时:16 (其中,上机学时:0) 课程性质:?必修□选修 是否独立设课:?是□否 课程类别:?基础实验□专业基础实验□专业领域实验 含有综合性、设计性实验:?是□否 面向专业:高分子材料科学与工程、材料科学与工程(无机非金属材料科学与工程、材料化学) 先修课程:物理、物理化学、无机化学实验、有机化学实验、分析化学实验等课程。 大纲编制人:课程负责人张震实验室负责人刘仕文 一、教学信息 教学的目标与任务: 该课程是本专业的一门重要的基础课程,物理化学实验的特点是利用物理方法来研究化学系统变化规律,是从事本专业相关工作必须掌握的基本技术课程。其任务是通过本课程的学习,使学生达到以下三方面的训练: (1)通过实验加深学生对物理化学原理的认识,培养学生理论联系实际的能力; (2)使学生学会常用的物理化学实验方法和测试技术,提高学生的实验操作能力和独立工作能力; (3)培养学生查阅手册、处理实验数据和撰写实验报告的能力,使学生受到初步的物理性质研究方法的训练。 教学基本要求: 物理化学实验的特点是利用物理方法来研究化学系统变化规律,实验中常用多种物理测量仪器。因此在物理化学实验教学中,应注意基本测量技术的训练及初步培养学生选择和配套仪器进行实验研究工作的能力。 物理化学实验包括下列内容: (1)热力学部分量热、相平衡和化学平衡实验是这部分的基本内容。还可以选择稀溶液的依数性、溶液组分的活度系数或热分析等方面的实验。
物理化学实验讲义
1.恒温槽构造及恒温原理 2.乌氏粘度计的构造及测量原理 分子量是表征化合物特性的基本参数之一。但高聚物的分子量大小不一,参差不齐,一般在103~107之间,所以通常所测高聚物的分子量,是平均分子量。高聚物分子量测定方法很多,对线型高聚物,歌方法适用的范围如下: 端基分析<3×104 沸点升高、凝固点降低、等温蒸馏<3×104 渗透压104~106 光散射104~107 超离心沉降及扩散104~107 高聚物在稀溶液中的粘度,主要反映了液体在流动是存在着内摩擦,其中有溶剂分子与溶剂分子之间的内摩擦,表现出来的粘度叫纯溶剂粘度,记做η0,还有高分子与高分子之
间的内摩擦,以及高分子与溶剂分子之间的内摩擦,三者的总和表现为溶液的粘度,记做η,而在同一温度下,高聚物溶液的粘度一般都比纯溶剂的粘度要大,即η>η0,这些粘度增加的分数称作增比粘度,记做ηsp ,即: 110 00-=-=-=r sp ηηηηηηη 上式中ηr 称为相对粘度,它指明溶液粘度对溶剂粘度的相对值,仍是整个溶液的粘度行为;则意味着它已扣除了溶剂分子之间的内摩擦效应,仅留下纯溶剂与高分子之间,以及高聚物分子之间的内摩擦效应。但溶液的浓度又可大可小。显然,浓度越大,粘度也就越大,为了便于比较,取在单位浓度下所显示的粘度,即引入ηsp /C ,称为比浓粘度,其中C 是浓度。又为了进一步消除高分子与高分子之间的内摩擦效应,必须将溶液浓度无限喜试网,使得每个高聚物分子彼此相隔极远,其相互干扰可以忽略不计,这时溶液所呈现出的粘度行为主要就反映了高分子与溶剂分子之间的内摩擦。 这一粘度的极限值记为 []ηη=→C sp C 0lim [η]被称为特性粘度。如果高聚物分子的分子量越大,则它与溶剂间的接触表面也越大,因此摩擦就大,表现出的特性粘度也大。 人们在大分子的[η]与其分子量M 呈正比的关系基础上,推广出高聚物[η]与其平均分子量M 之间的半经验关系。 []αηM K = K 是比例常数,α是与分子形状有关的经验参数。K 和α值与温度、聚合物、溶剂性质有关,也和分子量大小有关。K 值受温度的影响较明显,而α值主要取决于高分子线团在某温度下,某溶剂中舒展的程度。线团舒展,摩擦增大,α值就大,接近于1,线团紧缩,发生摩擦的机会减小,α值就小,在极限的情况下,接近0.5,所以α介于0.5~1之间。K 和α的数值只能通过其他绝对方法确定(例如渗透压法、光散射法等等)。而从粘度法只能测得[η]。 测得液体粘度的方法,主要可分为三类: (1) 液体在毛细管里的流出时间; (2) 圆球在液体里的下落速度; (3) 液体在同心轴圆柱体间相对转动的影响。 在测定高分子的[η]时,以毛细管流出法的粘度计最为方便。 当液体在毛细管粘度计内因重力作用而流出时,遵守泊谡叶公式: lt V m lV t hgr ππρη884-= η——液体的粘度,ρ——液体的密度,l ——毛细管的长度,r ——毛细管半径,t ——是流出时间,h ——流过毛细管液体的平均液柱高度,V ——流经毛细管的液体体积,m ——毛细管末端校正的参数(一般在r/l<<1时,可以取m=1)。 对于某一支指定的粘度计而言,上式可以写成下式
大学物理之热学公式篇
热 学 公 式 1.理想气体温标定义:0 273.16lim TP p TP p T K p →=?(定体) 2.摄氏温度t 与热力学温度T 之间的关系:0 //273.15t C T K =- 华氏温度F t 与摄氏温度t 之间的关系:9325 F t t =+ 3.理想气体状态方程:pV RT ν= 1mol 范德瓦耳斯气体状态方程:2 ()()m m a p V b RT V + -= 其中摩尔气体常量8.31/R J mol K =?或2 8.2110/R atm L mol K -=??? 4.微观量与宏观量的关系:p nkT =,23kt p n ε= ,32 kt kT ε= 5.标准状况下气体分子的数密度(洛施密特数)253 0 2.6910/n m =? 6.分子力的伦纳德-琼斯势:12 6 ()4[()()]p E r r r σ σ ε=-,其中ε为势阱深度, σ= ,特别适用于惰性气体,该分子力大致对应于昂内斯气体; 分子力的弱引力刚性球模型(苏则朗模型):06 000, ()(), p r r E r r r r r φ+∞
物理化学实验数据处理
物理化学实验数据处理 实验一 电极的制备及电池电动势的测定与应用 一、实验数据记录 二、数据处理 1饱和甘汞电极电动势的温度校正 )298/(1061.72415.0/4-?-=-K T V SCE ? 15.273+=t T t 组成饱和甘汞电极的KCl 溶液的温度,℃。 2测定温度下锌、铜电极电动势的计算 1) 测定温度下锌电极电势的计算 Zn Zn SCE Hg Zn E /2)(+-=-??平均值 )(/2平均值Hg Zn SCE Zn Zn E --=∴+?? 2) 测定温度下铜电极电势的计算 SCE Cu Cu Hg Cu E ??-=+-/2)(平均值 S C E Hg Cu Cu Cu E ??+=∴-+)(/2平均值 3) 测定温度下标准锌电极电极电势的计算 ++ + +±++=+=2222ln 2)(ln 2/2//Zn Zn Zn Zn Zn Zn Zn m F RT Zn F RT γ?α??θ θ +++ ±-=∴222ln 2//Zn Zn Zn Zn Zn m F RT γ??θ(±γ参见附录五表V-5-30,11.02-?=+l mol m Zn ) 4) 测定温度下标准铜电极电极电势的计算 ++ + +±++=+=2222ln 2)(ln 2/2//Cu Cu Cu Cu Cu Cu Cu m F RT Cu F RT γ?α??θ θ +++ ±-=∴222ln 2//Cu Cu Cu Cu Cu m F RT γ??θ(±γ参见附录五表V-5-30,11.02-?=+l mol m Cu ) 2 298K 时锌、铜电极标准电极电势的计算 1)锌电极标准电极电势的计算 )298/(000016.0)298(/)(//22-?-=+ +K T K V T Zn Zn Zn Zn θθ?? )298/(000016.0/)()298(//22-?+=∴++ K T V T K Zn Zn Zn Zn θ θ?? 1)铜电极标准电极电势的计算 2 6//)298/(1031.0)298/(0001.0)298(/)(22-?+-?+=-+ +K T K T K V T Cu Cu Cu Cu θθ?? 2 6//)298/(1031.0)298/(0001.0)()298(22-?+-?-=∴-+ +K T K T T K Cu Cu Cu Cu θθ?? 15.273+=t T t 组成相应电极的电解质溶液的温度,℃。
大学物理化学实验汇总
实验一 电导的测定及其应用 一、实验目的 1、 测量氯化钾水溶液的电导率,求算它的无限稀释摩尔电导率。 2、 用电导率测量醋酸在水溶液中的解平衡常数。 3、 掌握恒温水槽及电导率仪的使用方法。 二、实验原理 1、根据电导公式:G=kA/l 式中k 为该电解质溶液目的电导率,其中 l/A 称为电导池常数,由于l 与A 不易精确测量,因此,试验中就是用一种已知电导率的溶液求出电导池常数k cell ,然后把欲测的溶液放入该电导池测出其电导值,再根据公式G=kA/l 求出摩尔电导率 , k 与 的关系为: 2、 总就是随着溶液的浓度的降低而增大的, 对于强电解质系 对于特定的电解质与溶剂来说,在一定温度下,A 就是一个常数,所以将 作图得到一 条直线,将所得的直线推至c=0可求得A m ∞。 3、对于弱电解质,其 无法用 ,由离子独立运动定律: 求得,其中 A m ∞+ 与A m ∞-分别表示正、负离子的无限稀摩尔电导率,它与温度及离子的本性有关。在无限稀的弱电解质中: 以cAm 对 作图,根据其斜率求出K 、、 三、实验仪器及试剂 仪器:梅特勒326电导仪1台,量杯50ml 2只 ,移液管125ml 9只,洗瓶1只 ,洗耳球1只。 试剂:10、00mol/m3 KCl 溶液, 100、0 mol/m3HAC 溶液 , 电导水。 四、实验步骤 1、 打开电导率仪器开关,预热5分钟。 2、 KCl 溶液电导率的测定: (1) 用移液管准确移取25ml 10、00mol/m3的KCl 溶液,置于洁净、干燥的量杯中,测定器电 导率3次,取其平均值。 (2) 再用移液管准确量取25、00ml 电导水,置于上述量杯中,搅拌均匀后,测定器电导率3 次,取其平均值。 m c κ = Λ m m,+ m, νν+--∞ ∞ ∞ =+ΛΛΛ m Λ m Λ m Λ m m ∞ =-ΛΛ m Λ m m ∞ =-ΛΛ m m = α∞ΛΛ() 2 m m m m 2 m m m m 1c c c K c c ∞∞ ∞∞?? ??-?=-=ΛΛΛΛΛΛΛΛΛ
《物理化学实验》讲义#(精选.)
备课教案撰写要求 一、认真钻研本学科的教学大纲和教材,了解本学科的教学任务、教材体系结构和国际国内最新研究进展,结合学生实际状况明确重难点,精心安排教学步骤,订好学期授课计划和每节课的课时计划。 二、教师备课应以二学时为单位编写教案;一律使用教学事务部发放的教案本撰写,不得使用其他纸张。在个人认真备课、写好教案的基础上,提倡集中备课、互相启发、集思广益,精益求精。 三、教案必须具备如下内容(每次课应在首页应写清楚):1、题目(包括章、节名称、序号);2、教学目的与要求;3、教学重点和难点分析;4、教学方法;5、教学内容与教学组织设计(主要部分,讲课具体内容);6、作业处理;7、教学小结。 四、教案必须每学期更新,开学初的备课量一定要达到或超过该课程课时总量的三分之一。教案要妥善携带及保存,以备教学检查。
教学进度计划表填表说明 1.本表是教师授课的依据和学生课程学习的概要,也是学院进行教学检查,评价课堂教学质量和考试命题的重要依据,任课教师应根据教学大纲和教学内容的要求认真填写,表中的基本信息和内容应填写完整,不得遗漏。 2.基本信息中的“课程考核说明及要求”的内容主要包括课程考核的方式、成绩评定的方法、平时成绩与考试成绩的比例、考试的题型、考试时间以及其他相关问题的说明与要求等。 3.进度表中“教学内容”只填写章或节的内容,具体讲授内容不必写;每次课只能以2学时为单位安排内容。 4.进度表中的“教学形式及其手段”是指教学过程中教师所采用的各种教学形式及相关手段的说明,一般包括讲授、多媒体教学、课件演示、练习、实验、讨论、案例等。 5.作业安排必须具体(做几题,是哪些题)。 6.进度表中的“执行情况”主要填写计划落实和变更情况。 7.教学进度计划表经责任教授、系(部)领导审签后,不得随意变动,如需调整,应经责任教授、系(部)领导同意,并在执行情况栏中注明。
大学物理公式全集.doc
大学物理公式集 基本概念(定义和相关公式) 位置矢量:r ,其在直角坐标系中:k z j y i x r ++=;2 22z y x r ++= 角位置:θ 速度:dt r d V = 平均速度:t r V ??= 速率:dt ds V = (τ V V =)角速度: dt d θω= 角速度与速度的关系:V=rω 加速度:dt V d a =或22dt r d a = 平均加速度:t V a ??= 角加速度:dt d ωβ= 在自然坐标系中n a a a n +=ττ其中dt dV a =τ(=rβ),r V n a 2 = (=r2 ω) 1.力:F =ma (或F = dt p d ) 力矩:F r M ?=(大小:M=rFcos θ方向:右手螺旋 法则) 2.动量:V m p =,角动量:V m r L ?=(大小:L=rmvcos θ方向:右手螺旋法则) 3.冲量:? = dt F I (=F Δt);功:? ?= r d F A (气体对外做功:A=∫ PdV ) 4.动能:mV 2/2 5.势能:A 保= – ΔE p 不同相互作用力势能形式不同且零点选择不同其形式 不同,在默认势能零点的情况下: 机械能:E=E K +E P 6.热量:CRT M Q μ =其中:摩尔热容 量C 与过程有关,等容热容量C v 与等压热容量C p 之间的关系为:C p = C v +R 7.压强:ω n tS I S F P 3 2 = ?= = 8.分子平均平动能:kT 2 3= ω ;理想气体内能:RT s r t M E )2(2 ++= μ 9.麦克斯韦速率分布函数:NdV dN V f = )((意义:在V 附近单位速度间隔内的分子数所 占比率) 10. 平均速率:πμ RT N dN dV V Vf V V 80 )(= = ? ?∞ 方均根速率:μ RT V 22 = ;最可几速率:μ RT p V 3= 11. 熵:S=Kln Ω(Ω为热力学几率,即:一种宏观态包含的微观态数) mg(重力) → mgh -kx (弹性力) → kx 2 /2 F= r r Mm G ?2 - (万有引力) →r Mm G - =E p r r Qq ?42 πε (静电力) → r Qq 0 4πε
大学物理化学实验思考题答案总结
蔗糖水解速率常数的测定 1.蔗糖水解反应速率常数和哪些因素有关? 答:主要和温度、反应物浓度和作为催化剂的H+浓度有关。 2.在测量蔗糖转化速率常数时,选用长的旋光管好?还是短的旋光管好? 答:选用长的旋光管好。旋光度和旋光管长度呈正比。对于旋光能力较弱或者较稀的溶液,为了提高准确度,降低读数的相对误差,应选用较长的旋光管。根据公式(a)=a*1000/LC,在其他条件不变的情况下,L越长,a越大,则a的相对测量误差越小。 3.如何根据蔗糖、葡萄糖、果糖的比旋光度数据计算? 答:α0=〔α蔗糖〕Dt℃L[蔗糖]0/100 α∞=〔α葡萄糖〕Dt℃L[葡萄糖]∞/100+〔α果糖〕Dt℃L[果糖]∞/100 式中:[α蔗糖]Dt℃,[α葡萄糖]Dt℃,[α果糖]Dt℃分别表示用钠黄光作光源在t℃时蔗糖、葡萄糖和果糖的比旋光度,L(用dm表示)为旋光管的长度,[蔗糖]0为反应液中蔗糖的初始浓度,[葡萄糖]∞和[果糖]∞表示葡萄糖和果糖在反应完成时的浓度。 设t=20℃L=2 dm [蔗糖]0=10g/100mL 则: α0=66.6×2×10/100=13.32° α∞=×2×10/100×(52.2-91.9)=-3.94° 4.试估计本实验的误差,怎样减少误差? 答:本实验的误差主要是蔗糖反应在整个实验过程中不恒温。在混合蔗糖溶液和盐酸时,尤其在测定旋光度时,温度已不再是测量温度,可以改用带有恒温实施的旋光仪,保证实验在恒温下进行,在本实验条件下,测定时要力求动作迅速熟练。其他误差主要是用旋光仪测定时的读数误差,调节明暗度判断终点的误差,移取反应物时的体积误差,计时误差等等,这些都由主观因素决定,可通过认真预习实验,实验过程中严格进行操作来避免。 乙酸乙酯皂化反应速率常数测定 电导的测定及其应用 1、本实验为何要测水的电导率? 答:因为普通蒸馏水中常溶有CO2和氨等杂质而存在一定电导,故实验所测的电导值是欲测电解质和水的电导的总和。作电导实验时需纯度较高的水,称为电导水。水的电导率相对弱电解质的电导率来说是不能够忽略的。所以要测水的电导率。 2、实验中为何通常用镀铂黑电极?铂黑电极使用时应注意什么?为什么?
大学物理公式大全下册
电磁学 1.定义: ①E 和B : F =q(E +V ×B )洛仑兹公式 ②电势:? ∞ ?= r r d E U 电势差:?-+ ?=l d E U 电动势:? + - ?= l d K ε(q F K 非静电 =) ③电通量:???=S d E e φ磁通量:???=S d B B φ磁通链: ΦB =N φB 单位:韦伯(Wb ) 磁矩:m =I S =IS n ? ④电偶极矩:p =q l ⑤电容:C=q/U 单位:法拉(F ) *自感:L=Ψ/I 单位:亨利(H ) *互感:M=Ψ21/I 1=Ψ12/I 2 单位:亨利(H ) ⑥电流:I = dt dq ; *位移电流:I D =ε 0dt d e φ 单位:安培(A ) ⑦*能流密度: B E S ?= μ 1 2.实验定律 ①库仑定律:0 204r r Qq F πε= ②毕奥—沙伐尔定律:204?r r l Id B d πμ?= ③安培定律:d F =I l d ×B ④电磁感应定律:ε感= –dt d B φ 动生电动势:?+ -??= l d B V )(ε 感生电动势:? - + ?=l d E i ε(E i 为感生电场) *⑤欧姆定律:U=IR (E =ρj )其中ρ为电导率 3.*定理(麦克斯韦方程组) 电场的高斯定理:?? =?0 εq S d E ??=?0 εq S d E 静 (E 静是有源场) ??=?0S d E 感 (E 感是无源场) 磁场的高斯定理:??=?0S d B ??=?0S d B (B 稳是无源场) E =F /q 0 单位:N/C =V/m B=F max /qv ;方向,小磁针指向(S →N );单位:特斯拉(T )=104高斯(G ) Θ ⊕ -q l
物化实验数据处理
2. 不稳定常数的测定 在络合物明显解离的情形下,用等摩尔系列法得到图2中的曲线,并作切线交于N 点。 设在N 点的光密度为D 0,曲线2极大的光密度为D ,则络合物的解离度α为: 对于MA 型络合物的 ,故将该络合物浓度c 及上面求出的α代入此式即可算出不稳定常数。 数据处理 2. 络合物不稳定常数的计算 在△D- 图上通过 为0和1.0处分别作曲线的切线,两切线交于一点,从 图上找到该点相应的光密度D 0以及曲线上极大点的光密度D ,由D 0和D 计算解离度α。 最后计算该络合物的不稳定常数 K 不稳文献值为2*10-3。 解: 从△D- 图上可以得到: D 0=0.382, D max = 0.264 则可求得解离度α: =0.50 得 =解离部分总浓度=总浓度络合物浓度总浓度D D 0=D 0ααK 不稳=c α21c M c M c A =D D 0=D 0 α=0.3820.3090.3820.264c M c M c A c M c M c A D D 0=D 0αc M c M c A αK 不稳=c α21
c A = c M 又知: c A + c M = 0.038 (mol ?L -1 ) 得 c A = c M = 0.019 (mol ?L -1 ) ∴ c MA = 0.019 (mol ?L -1 ),即c= 0.019 (mol ?L -1 ) 3. 络合反应标准自由能变化的计算 利用△G ? = - RT ln1/K 不稳计算该络合反应的标准自由能变化。 △G ? = - RT ln1/K 不稳 = -8.314*(273.15+22.5)*ln1/(2.63*10-3) = -1.46*104 (J ?mol -1) 原电池电动势数据处理 Ⅴ、数据记录(实验测试数据) E 1 = 1.11810 V (Zn-Cu 电池) E 2 = 1.07110 V (Zn-Hg 电池) E 3 = 0.04470 V (Cu-Hg 电池) Ⅵ、数据处理 1、 饱和甘汞电极的电极电势温度校正公式,计算实验温度时饱和甘汞电极的电极电势: )298/(1061.72415.0/4-?-=-K T V ? = 0.2415 - 7.61×10 –4(292 – 298) = 0.24607 V 2、 据测定的各电池的电动势,分别计算铜、锌电极的T ?、T θ?、298θ ?。 (1) 求 T ?: V E K Hg Cl Hg Cu Cu 29077.024607.004470.0)292(/3/222=+=+=+?? V E K Hg Cl Hg Zn Zn 82503.007110.124607.0)292(2//222-=-=-=+?? (2) 求T θ ?: αK 不稳=c α21= 0.019*0.309210.309= 0.019*0.0955 0.691=2.63*10 -3
大学物理化学实验报告-化学电池温度系数的测定课件.doc
物理化学实验报告 院系化学化工学院 班级化学061 学号13 姓名沈建明
实验名称 化学电池温度系数的测定 日期 2009.4.20 同组者姓名 史黄亮 室温 19.60 ℃ 气压 102.0 kPa 成绩 一、目的和要求 1、掌握可逆电池电动势的测量原理和电位差计的操作技术; 2、学会几种电极和盐桥的制备方法; 3、通过原电池电动势的测定求算有关 热力学函数。 二、基本原理 (一)、凡是能使化学能转变为电能的装置都称之为电池对定温定压下的可 逆电池而言 : r m (1) nFE T , p G E S nF (2) r m T p E H nE F nF T (3) r m T p 式中,F 为法拉弟(Farady)常数;n 为电极反应式中电子的计量系数 ;E 为电池 的电动势。
另, 可逆电池应满足如下条件: 1.电池反应可逆,亦即电池电极反应可逆。 2.电池中不允许存在任何不可逆的液接界。 即充放电过程必须在平衡态下进行,3.电池必须在可逆的情况下 工作,
因此在制备可逆电池、 测定可逆电池的电动势时应符合上述条件, 不高的测量中,常用正负离子迁移数比较接近的盐类构成 “盐桥 ”来消除液接电 位。用电位差计测量电动势也可满足通过电池电流为无限小的条件。 (二)、求电池反应的 Δ r G m 、Δr S m 、Δr H m 设计电池如下 : Ag(s) | AgCl(s) |饱和 KCl | Hg 2Cl 2(s) | Hg(l) 分别 测定电池在各个温度下的电动势,作 E — T 图,从曲线斜率可求得任一温度 下的 E T p 利用公式 (1),(2),(3) 即可求得该电池反应的 Δ r G m 、Δr S m 、Δr H m 三、仪器、试剂 SDC — Ⅱ数字电位差综合测试仪 1 台 精密稳压电源(或蓄电池) SC — 15A 超级恒温槽 铜电极 2 只 铂电极 1 只 饱和甘汞电极 1 只 恒温夹套烧杯 2 只 HCl ( 0.1000mol k ·g-1) AgNO3 ( 0.1000mol k ·g-1) 镀银溶液 镀铜溶液 四、实验步骤 一、电极的制备 1.银电极的制备 将欲用的两只 Pt 电极(一个电极 Pt 较短,作为阳极, 另一个电极作为阴极, 用于镀银) 浸入稀硝酸溶液片刻, 取出用蒸馏水洗净。 将洗净的电极分别插入盛 有镀银液( AgNO 3 3g ,浓氨水, KI 60g )中,控制电流为 0.3mA ,电镀 1h ,得 白色紧密的镀银电极一只。 2. Ag-AgCl 电极制备 在精确度 KCl 饱和溶液
