2019-2020学年辽宁省凌源市实验中学、凌源二中新高考化学模拟试卷含解析

2019-2020学年辽宁省凌源市实验中学、凌源二中新高考化学模拟试卷
一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)
1.下列说法不正确的是
A.淀粉能水解为葡萄糖B.油脂属于天然有机高分子
C.鸡蛋煮熟过程中蛋白质变性D.食用新鲜蔬菜和水果可补充维生素C
【答案】B
【解析】
【详解】
A.淀粉是多糖,水解最终产物是葡萄糖,A正确;
B.油脂是高级脂肪酸的甘油酯,属于天然有机物,但不是高分子化合物,B错误;
C.鸡蛋煮熟过程中,蛋白质分子结构发生了变化,不具有原来蛋白质的生理功能,物质的化学性质也发生了改变。因此鸡蛋煮熟过程是蛋白质变性,C正确;
D.新鲜蔬菜和水果含有丰富的维生素C,因此食用新鲜蔬菜和水果可补充维生素C,D正确;
故合理选项是B。
2.设N A为阿伏加德罗常数的值,下列说法不正确
...的是()
A.50mL 1mol/L硝酸与Fe完全反应,转移电子的数目为0.05N A
B.密闭容器中2molNO与1molO2充分反应,所得物质中的氧原子数为4N A
C.30g乙酸和甲醛(HCHO)的混合物完全燃烧,消耗O2的分子数目为N A
D.1L0.1mol/L的CH3COONH4溶液中,CH3COOH和CH3COO-的微粒数之和为0.1N A
【答案】A
【解析】
【分析】
【详解】
A项、50mL 1mol/L硝酸与Fe完全反应生成硝酸铁或硝酸亚铁,若硝酸的还原产物只有一氧化氮,50mL 1mol/L硝酸的物质的量为0.05mol,则生成一氧化氮转移的电子数目为0.0375mol,故A错误;
B项、2molNO与1molO2所含O原子的物质的量为4 mol,由质量守恒定律可知,反应前后原子个数不变,则所得物质中的氧原子数为4N A,故B正确;
C项、乙酸和甲醛(HCHO)的最简式相同,均为CH2O,30g CH2O的物质的量为1mol,1mol CH2O完全燃烧消耗O2的物质的量为1mol,故C正确;
D项、1L0.1mol/L的CH3COONH4的物质的量为0.1mol,由物料守恒可知溶液中CH3COOH和CH3COO-的物质的量为0.1mol,故D正确。
故选A。
【点睛】
本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键。
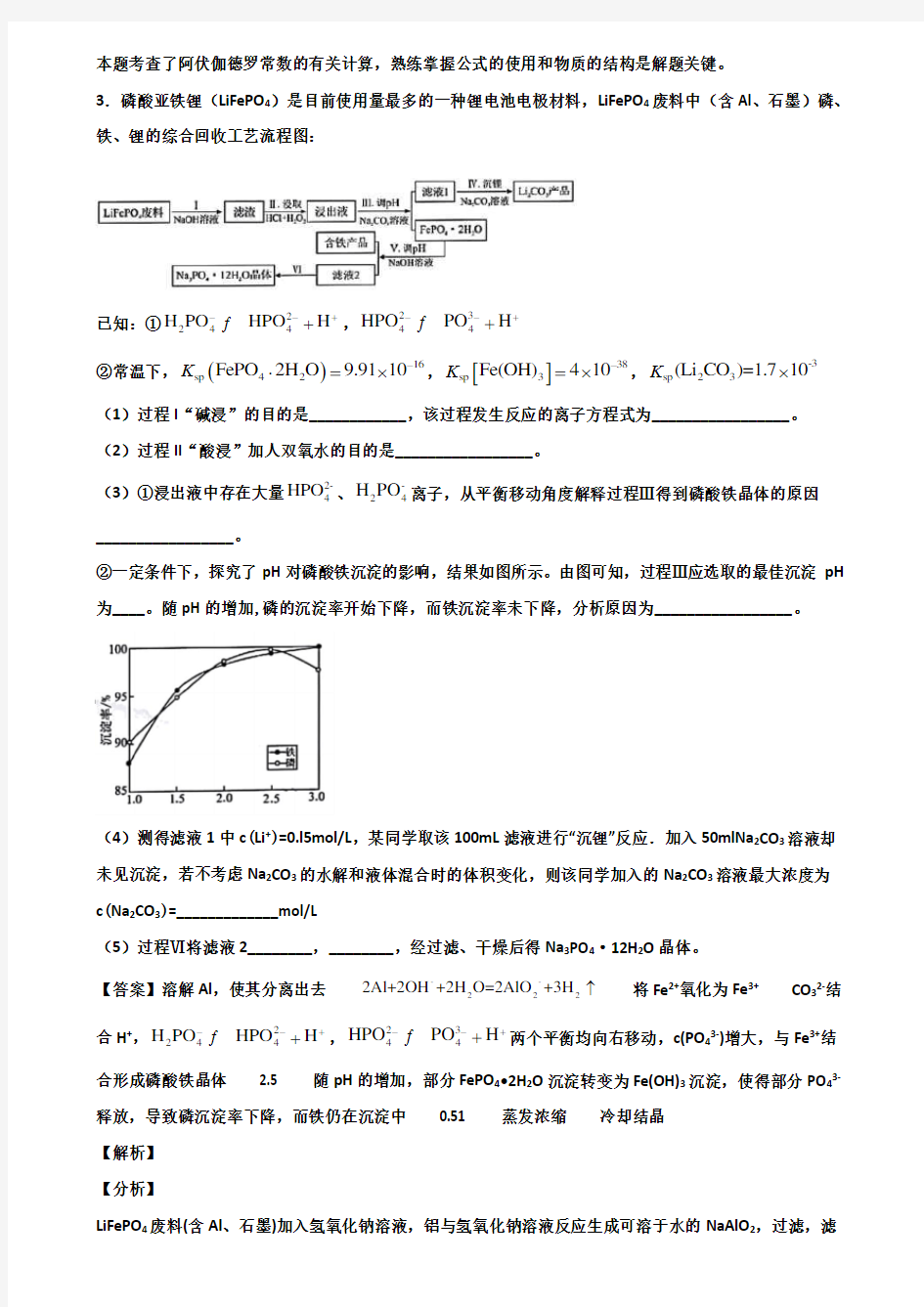
3.磷酸亚铁锂(LiFePO 4)是目前使用量最多的一种锂电池电极材料,LiFePO 4废料中(含Al 、石墨)磷、铁、锂的综合回收工艺流程图:
已知:①2244H PO HPO H -
-+
+?,2344HPO PO H --++?
②常温下,()16
sp 42FePO 2H O 9.9110
K -?=?,[]38
3sp Fe(OH)410
K -=?,-3
sp 23(Li CO )=1.710K ?
(1)过程I “碱浸”的目的是____________,该过程发生反应的离子方程式为_________________。 (2)过程II “酸浸”加人双氧水的目的是_________________。
(3)①浸出液中存在大量2-
4HPO 、-
24H PO 离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
②一定条件下,探究了pH 对磷酸铁沉淀的影响,结果如图所示。由图可知,过程Ⅲ应选取的最佳沉淀pH 为____。随pH 的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为_________________。
(4)测得滤液1中c (Li +)=0.l5mol/L ,某同学取该100mL 滤液进行“沉锂”反应.加入50mlNa 2CO 3溶液却未见沉淀,若不考虑Na 2CO 3的水解和液体混合时的体积变化,则该同学加入的Na 2CO 3溶液最大浓度为c (Na 2CO 3)=_____________mol/L
(5)过程Ⅵ将滤液2________,________,经过滤、干燥后得Na 3PO 4·12H 2O 晶体。
【答案】溶解Al ,使其分离出去 --
2222Al+2OH +2H O=2AlO +3H ↑ 将Fe 2+氧化为Fe 3+ CO 32-结
合H +,2244H PO HPO H -
-++?
,2344HPO PO H --++?两个平衡均向右移动,c(PO 43-)增大,与Fe 3+结
合形成磷酸铁晶体 2.5 随pH 的增加,部分FePO 4?2H 2O 沉淀转变为Fe(OH)3沉淀,使得部分PO 43-释放,导致磷沉淀率下降,而铁仍在沉淀中 0.51 蒸发浓缩 冷却结晶 【解析】 【分析】
LiFePO 4废料(含Al 、石墨)加入氢氧化钠溶液,铝与氢氧化钠溶液反应生成可溶于水的NaAlO 2,过滤,滤
渣中含有LiFePO 4和石墨,在滤渣中加入盐酸和过氧化氢浸取,可氧化亚铁离子生成铁离子,浸出液中含有铁离子、锂离子、2-4HPO 、-
24H PO 离子等,加入碳酸钠溶液调节pH ,可生成FePO 4?2H 2O ,滤液1中含有锂离子,滤液1中加入碳酸钠沉锂得到Li 2CO 3产品,FePO 4?2H 2O 中加入氢氧化钠溶液调节pH ,得到含铁产品和滤液2,滤液2为Na 3PO 4溶液,Na 3PO 4溶液再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得Na 3PO 4·12H 2O 晶体。 以此解答该题。 【详解】
(1)铝与氢氧化钠溶液反应生成可溶于水的NaAlO 2,则过程I“碱浸”的目的是溶解Al ,使其分离出去,该过程发生反应的离子方程式为--
2222Al+2OH +2H O=2AlO +3H ↑,故答案为:溶解Al ,使其分离出去;
--2222Al+2OH +2H O=2AlO +3H ↑;
(2)过程II“酸浸”加人双氧水的目的是将Fe 2+氧化为Fe 3+,故答案为:将Fe 2+氧化为Fe 3+;
(3)①浸出液中存在大量2-4HPO 、-24H PO 离子,加入碳酸钠溶液后,CO 32-结合H +,2244H PO HPO H --+
+?
,
2344HPO PO H --++?两个平衡均向右移动,c(PO 43-)增大,与Fe 3+结合形成磷酸铁晶体;
②过程Ⅲ得到FePO 4?2H 2O ,由图可知在pH 等于2.5时,磷的沉淀率最高,则应选取的最佳沉淀pH 为2.5,根据图像可知,随pH 的增加,磷的沉淀率开始下降,而铁沉淀率未下降,是因为随pH 的增加,部分FePO 4?2H 2O 沉淀转变为Fe(OH)3沉淀,使得部分PO 43-释放,导致磷沉淀率下降,而铁仍在沉淀中; 故答案为:2.5;随pH 的增加,部分FePO 4?2H 2O 沉淀转变为Fe(OH)3沉淀,使得部分PO 43-释放,导致磷沉淀率下降,而铁仍在沉淀中;
(4)混合溶液中+
0.15mol/L 100
Li =
=0.1mol/L 150
()c ?,设该同学加入的Na 2CO 3溶液的浓度为x mol/L ,则
混合溶液中2-3xmol/L 50x CO =
=mol/L 1503()c ?,二者混合未见沉淀,则2+2-2-3c 3()()x
=Li CO =0.1 1.7103
Q c c ?≤?,解得x 0.51≤,则该同学加入的Na 2CO 3溶液最大浓度为
c(Na 2CO 3)=0.51mol/L ,故答案为:051;
(5)滤液2为Na 3PO 4溶液,Na 3PO 4溶液再经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得Na 3PO 4·12H 2O 晶体,故答案为:蒸发浓缩;冷却结晶。
4.下列实验对应的现象及结论均正确且两者具有因果关系的是
B
向足量含有淀粉的FeI2溶液中滴
加2滴氯水
溶液变蓝还原性:I- > Fe2+
C 向FeCl2溶液中加入Na2O2粉末出现红褐色沉淀和无色液体FeCl2溶液部分变质
D 将浓硫酸滴入蔗糖中并搅拌
得黑色蓬松的固体并有刺激
性气味
该过程中浓硫酸仅体
现了吸水性和脱水性
A.A B.B C.C D.D
【答案】B
【解析】
【详解】
A.二氧化硫与氯化钡不反应,但溶解的二氧化硫能够被硝酸氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡白色沉淀,结论不正确,故A错误;
D.氯水先氧化碘离子生成碘单质,则溶液变蓝,可知还原性:I->Fe2+,故B正确;
C.过氧化钠具有强氧化性,与水反应生成碱,过氧化钠可氧化亚铁离子,因此出现红褐色沉淀和无色液体,该现象不能说明FeCl2溶液是否变质,故C错误;
D.浓硫酸滴入蔗糖中,使蔗糖脱水,反应放热,然后C与浓硫酸发生氧化还原反应生成二氧化硫等,主要体现了浓硫酸的脱水性和氧化性,结论不正确,故D错误;
故选B。
5.25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是()
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)【答案】D
【解析】
【详解】
A.由图可知,0.1 mol·L-1 HX溶液的pH=3,说明HX为弱酸,故A正确;
B.若V1=20,则溶液中的溶质只有NaX,由于HX为弱酸,则NaX溶液呈碱性,pH>7,所以V1应小于20,故B正确;
C.M点溶液中的溶质是等物质的量的HX和NaX,溶液呈酸性,说明HX的电离程度大于X-的水解程度,则溶液中离子浓度大小顺序为c(X-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.两种溶液等体积混合时,根据电荷守恒有c(Na+)+c(H+)=c(X-)+c(OH-),故D错误;
故选D。
6.(改编)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a、c两点对应的氢气生成速率相等
C.b点对应的反应速率为v(H2SO4)= 1.0×10-3 mol·L-1·s-1
D.d点没有构成原电池,反应速率减慢
【答案】D
【解析】
【分析】
【详解】
A.根据图像可知,随着饱和硫酸铜溶液的用量增加,化学反应速率先加快后减慢,则饱和硫酸铜溶液用量过多不利于更快收集氢气,A项正确;
B.根据图像可知,a、c两点对应的氢气生成速率相等,B项正确;
C.根据图像可知,b点收集336ml氢气用时150s,336ml氢气的物质的量为0.015mol,消耗硫酸0.015mol,则b点对应的反应速率为v(H2SO4)= 0.015mol÷150s=1.0×10-3 mol·L-1·s-1,C项正确;
D.d点锌置换出铜,锌、铜和硫酸构成原电池,化学反应速率加快,但硫酸铜用量增多,锌置换出来的铜附着在锌表面,导致锌与硫酸溶液接触面积减小,反应速率减慢,D项错误;答案选D。
7.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列说法不正
..确.的是
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
【答案】C
【解析】
【分析】
实验原理分析:二氧化碳通过U型管与过氧化钠反应生成氧气,氧气和没有反应的二氧化碳通入碱液洗气瓶除二氧化碳,可增加盛有澄清石灰水的洗气瓶验证二氧化碳是否除尽,在通过盛有浓硫酸的洗气瓶干燥氧气,最后收集;
【详解】
A.装置②中试剂可以是NaOH溶液,用来除掉二氧化碳气体,故不选A;
B. 装置③中盛有浓硫酸,作用是干燥O2,故不选B;
C. 由于氧气密度大于空气,选择装置b,故选C;
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶,验证二氧化碳是否除尽,故不选D;
答案:C
8.下列说法中不正确的是()
A.D和T互为同位素
B.“碳纳米泡沫”被称为第五形态的单质碳,它与石墨互为同素异形体
C.CH3CH2COOH和HCOOCH3互为同系物
D.丙醛与环氧丙烷()互为同分异构体
【答案】C
【解析】
【分析】
【详解】
A.D和T均为氢元素,但中子数不同,互为同位素,故A正确;
B.“碳纳米泡沫”和石墨均为碳元素形成的单质,互为同素异形体,故B正确;
C.CH3CH2COOH属于羧酸类,HCOOCH3属于酯类,官能团不同,不是同系物,故C错误;
D.丙醛与环氧丙烷()分子式相同,结构不同,互为同分异构体,故D正确;
综上所述,答案为C。
9.下列说法错误的是()
A.光照下,1 mol CH4最多能与4 mol Cl2发生取代反应,产物中物质的量最多的是HCl
B.将苯滴入溴水中,振荡、静置,上层接近无色
C.邻二氯苯仅有一种结构可证明苯环结构中不存在单双键交替结构
D.乙醇、乙酸都能与金属钠反应,且在相同条件下乙酸比乙醇与金属钠的反应更剧烈
【答案】B
【解析】
【分析】
A.甲烷和氯气发生取代反应生成多种氯代烃,取代1个氢原子消耗1mol氯气,同时生成氯化氢;B.苯与溴水不反应,发生萃取;
C.如果苯环是单双键交替,则邻二氯苯有两种;
D.醇羟基氢活泼性弱于羧羟基氢。
【详解】
A.甲烷和氯气发生取代反应生成多种氯代烃,取代1个氢原子消耗1mol氯气,同时生成氯化氢,1 mol CH4最多能与4 mol Cl2发生取代反应,产物中物质的量最多的是HCl,故A正确;
B.苯与溴水不反应,发生萃取,溴易溶于苯,苯密度小于水,所以将苯滴入溴水中,振荡、静置,下层接近无色,故B错误;
C.如果苯环是单双键交替,则邻二氯苯有两种,邻二氯苯仅有一种结构可证明苯环结构中不存在单双键交替结构,故C正确;
D.醇羟基氢活泼性弱于羧羟基氢,所以乙醇、乙酸都能与金属钠反应,且在相同条件下乙酸比乙醇与金属钠的反应更剧烈,故D正确;
故选:B。
10.下列有关反应的离子方程式书写正确的是()
A.氧化亚铁溶于稀硝酸:FeO+2H+===Fe2++H2O
B.过量SO2通入澄清石灰水中:SO2+OH-===HSO3-
C.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
D.NH4Al(SO4)2溶液与足量Ba(OH)2溶液混合:2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
【答案】B
【解析】
【详解】
A.氧化亚铁溶于稀硝酸,发生氧化还原反应,正确的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,
B、澄清石灰水中通入过量的二氧化硫生成亚硫酸氢钙,反应为Ca(OH)2+SO2=CaSO3↓+H2O,
CaSO3+SO2+H2O=Ca(HSO3)2,故总的离子方程式为OH-+SO2═HSO3-,故B正确;
C.NH4HCO3溶液与足量Ba(OH)2溶液混合反应生成碳酸钡沉淀和氨水,反应的离子方程式为
NH4++HCO3-+Ba2++2OH-═BaCO3↓+H2O+NH3·H2O,故C错误;
D.NH4Al(SO4)2溶液与足量的Ba(OH)2溶液混合,Al3+应转化为AlO2-,NH4+也会与OH-反应,故D错误;答案选B。
11.铁杉脂素是重要的木脂素类化合物,其结构简式如右图所示。下列有关铁杉脂素的说法错误的是()
A.分子中两个苯环处于同一平面
B.分子中有3个手性碳原子
C.能与浓溴水发生取代反应
D.1 mol铁杉脂素与NaOH溶液反应最多消耗3 mol NaOH
【答案】A
【解析】
【详解】
A. 分子中两个苯环连在四面体结构的碳原子上,不可能处于同一平面,故A错误;
B. 图中*标注的三个碳原子是手性碳原子,故B正确;
C. 酚羟基的邻对位可能与浓溴水发生取代反应,故C正确;
D. 1 mol铁杉脂素与NaOH溶液反应最多消耗3 mol NaOH,分别是酯基消耗1mol,2个酚羟基各消耗1mol,故D正确;
故选A。
12.在给定条件下,下列选项所示的物质间转化均能实现的是()
A.Ca(ClO)2(aq)HClO(aq)O2(g)
B.H2SO4(稀)SO2(g)BaSO3(s)
C.Fe2O3(s)FeCl3(aq)Fe (s)
D.SiO2(s)H2SiO3(胶体)Na2SiO3(aq)
【答案】A
【详解】
A. Ca(ClO)2与二氧化碳和水反应生成次氯酸,次氯酸再受热分解会产生氧气,A 项正确;
B. 根据金属活动性顺序已知,铜与稀硫酸不反应,B 项错误;
C. 铜与氯化铁反应时生成氯化亚铁与氯化铜,不能得到铁单质,C 项错误;
D. 二氧化硅不与水反应,D 项错误; 答案选A 。
13.常温下,分别向体积相同、浓度均为1 mol /L 的HA 、HB 两种酸溶液中不断加水稀释,酸溶液的pH 与酸溶液浓度的对数(lgc)间的关系如图。下列对该过程相关分析正确的是
A .H
B 的电离常数(Ka)数量级为10-3
B .其钠盐的水解常数(K h )大小关系是:NaB>NaA
C .a 、b 两点溶液中,水的电离程度b D .当lgc= -7时,两种酸溶液均有pH=7 【答案】B 【解析】 【分析】 【详解】 A.由图可知,b 点时HB 溶液中c=10-3mol·L -1,溶液中c (H +)=10-6mol·L -1,c (B -)=10-6mol·L -1,则 HB 的电离常数(Ka)= -6-6 -3 101010?=10-9,故A 错误; B.与A 同理,HA 的电离常数Ka=-4 -4 -3 1010 10?=10-5>HB 的电离常数,则HB 酸性弱于HA ,由酸越弱对应的盐水解能力越强,水解程度越大,钠盐的水解常数越大,故B 正确; C.a 、b 两点溶液中,b 水解程度大,水电离程度大,水的电离程度b>a ,故C 错误; D.当lg C= -7时,HB 中c (H + )91 7101010---=mol·L -1 ,HA 中c (H +)57 1010 10--=mol·L -1,pH 均不为7,故D 错误; 故选B 。 【点睛】 难点A 选项,从图中读出两点氢离子的浓度,酸的浓度,根据电离常数的定义写出电离常数,本题易错点 为D选项,当lg c= -7时,是酸的浓度是10-7mol·L-1,不是氢离子的浓度。 14.跟水反应有电子转移,但电子转移不发生在水分子上的是 A.CaO B.Na C.CaC2D.Na2O2 【答案】D 【解析】 【详解】 A.水与氧化钙反应生成氢氧化钙,元素化合价没有发生变化,故A错误; B.钠与水反应生成氢氧化钠和氢气,水中氢元素的化合价降低,得到电子,故B错误; C.碳化钙与水反应生成氢氧化钙和乙炔,化合价没有发生变化,故C错误; D.过氧化钠与水反应生成氢氧化钠和氧气,过氧化钠中的氧元素化合价既升高又降低,水中的元素化合价没有发生变化,故D正确; 故选:D。 15.用下列装置进行实验能达到相应实验目的的是 A.装置探究浓度对化学反应速率的影响 B.装置探究催化剂对H2O2分解速率的影响 C.装置制取SO2气体并验证其还原性(可加热) D.装置防止铁钉生锈 【答案】C 【解析】 【详解】 A. 该实验中高锰酸钾溶液过量,不能褪色,因此无法记录褪色的时间,因此该装置不能探究浓度对化学 反应速率的影响,A项错误; B. 欲探究催化剂对H2O2分解速率的影响,应保证过氧化氢的浓度是一致的,B项错误; C. 加热条件下,浓硫酸和铜发生氧化还原反应生成二氧化硫气体,二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,使酸性高锰酸钾溶液褪色,故C正确; D. 该装置为电解池,Fe作阳极,加速被腐蚀,不能防止铁钉生锈,故D错误; 答案选C。 【点睛】 本题C项涉及二氧化硫的还原性,二氧化硫的化学性质较多,可总结如下: 1、酸性氧化物:二氧化硫是酸性氧化物,和二氧化碳相似,溶于水显酸性,也可与碱反应; 2、还原性:二氧化硫可与酸性高锰酸钾、过氧化氢等强氧化性的物质反应; 3、弱氧化性:二氧化硫可与硫化氢反应生成硫单质等, 4、漂白性:二氧化硫的漂白性体现在可漂白品红等物质, 性质决定用途,学生切莫混淆,尤其是漂白性与还原性的区别,应加以重视。 二、实验题(本题包括1个小题,共10分) 16.某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹): (1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后______,则证明A装置的气密性良好。 (2)利用E装置能吸收的气体有______(任写两种即可)。 (3)用锌粒和稀硫酸制备H2时应选用装置___作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是__。 (4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。 ①A中玻璃仪器甲的名称为____,A装置中发生反应的离子方程式为____。 ②C中说明Cl-和S2-的还原性强弱的实验现象_____。 【答案】打开分液漏斗开关,水不能持续滴下或分液漏斗中液面长时间保持不变CO2、H2S、Cl2等气体中任选两种 B Zn和置换出的铜与电解质溶液形成原电池分液漏斗MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 产生淡黄色沉淀 【解析】 【详解】 (1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后打开分液漏斗开关,水不能持续滴下或分液漏斗中液面长时间保持不变,则气密性良好; (2)E中NaOH溶液能吸收酸性气体,例如CO2、SO2、H2S、Cl2等; (3)用锌粒和稀硫酸制备氢气应选择固体与液体反应装置,且不需要加热,则选择装置B;滴加硫酸铜后,Zn置换出Cu,形成Zn-Cu原电池,加快Zn与稀硫酸反应的速率; (4)①A中仪器甲的名称为分液漏斗;装置A制备氯气,利用浓盐酸和二氧化锰混合加热制氯气时发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O; ②A中制得的氯气通入Na2S溶液中有淡黄色S沉淀生成,因此C中说明Cl-和S2-的还原性强弱的实验现象产生淡黄色沉淀。 三、推断题(本题包括1个小题,共10分) 17.盐酸氨溴索(又称溴环己胺醇),可用于急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病的治疗。某研究小组拟用以下流程合成盐酸氨溴索和糖精的中间体X(部分反应条件及产物已略)。 已知信息: (Ⅰ)R1CHO+R2NH2一定条件 ??????→R1CH=N﹣R2 (Ⅱ) Fe HCl ??→(易被氧化) 请回答: (1)流程中A名称为_____;D中含氧官能团的名称是_____。 (2)G的分子式为_____;化合物E的结构简式是_____。 (3)A→B、F→G的反应类型分别为:_____、_____。 (4)写出B+C一定条件 ??????→D 的化学方程式_____。 (5)化合物X同时符合下列条件的同分异构体H有_____种;其中核磁共振氢谱有5组吸收峰的结构简式为_____。 ①苯环上有两个取代基,其中之一是氨基;②官能团与X相同,苯环上的一氯代物有两种。 (6)以甲苯和甲醇为有机原料,参照盐酸氨溴索的合成路线图,设计X的合成路线______(无机试剂任选, 标明试剂、条件及对应物质结构简式)。 【答案】邻硝基甲苯或1﹣硝基甲苯硝基、羟基C13H18N1OBr1 氧化反应取代反应 3 【解析】 【分析】 由B与C的分子式、D的结构简式,结合信息①,可知B为、C为,对比甲苯与B的结构,可知甲苯发生硝化反应生成A,A发生氧化反应生成B,故A为,D发生信息②中还原反应生成E为,由盐酸氨溴索的结构简式可知E→F发生还原反应生成F,F与溴发生苯环上取代反应生成G,G与HCl反应生成盐酸氨溴索,故F为、G为 。 (6)、甲基用酸性高锰酸钾溶液氧化引入羧基,硝基用Fe/HCl还原引入氨基,羧基与甲醇发生酯化反应引入酯基,氨基易被氧化且能与羧基反应,结合生成A的转化,应先发生硝化反应反应生成,再发生氧化反应生成,然后发生酯化反应生成,最后发生还原反应生成目标产物。【详解】 (1)A的结构简式为,其名称为:邻硝基甲苯或1﹣硝基甲苯。D中含氧官能团的名称是:硝基、羟基, 故答案为:邻硝基甲苯或1﹣硝基甲苯;硝基、羟基; (1)G的结构简式为,其分子式为:C13H18N1OBr1.由分析可知,化合物E的结构简式是:, 故答案为:C13H18N1OBr1;; (3)A→B是转化为,甲基转化为醛基,属于氧化反应。F→G是 转化为,F中苯环上氢原子被溴原子替代,属于取代反应,故答案为:氧化反应;取代反应; (4)B+C一定条件 ??????→D的化学方程式为, 故答案为:; (5)化合物X同时符合下列条件的同分异构体:①苯环上有两个取代基,其中之一是氨基;②官能团与X相同,另外一个取代基含有酯基,可能为﹣COOCH3、﹣OOCCH3、﹣CH1OOCH,苯环上的一氯代物有两种,1个不同的取代基处于对位,符合条件的H共有3种,其中核磁共振氢谱有5组吸收峰的结构简式为:, 故答案为:3;; (6)甲基用酸性高锰酸钾溶液氧化引入羧基,硝基用Fe/HCl还原引入氨基,羧基与甲醇发生酯化反应引 入酯基,氨基易被氧化且能与羧基反应,结合生成A的转化,应先发生硝化反应反应生成,再发生氧化反应生成,然后发生酯化反应生成,最后发生还原反应生成目标物,合成路线流程图为: , 故答案为:。 四、综合题(本题包括2个小题,共20分) 18.化合物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: 完成下列填空: (1)物质A中官能团的名称为__________。 (2)写出反应类型:反应①_____,反应④_________。 (3)反应③会生成与D互为同分异构体的副产物,写出生成该副产物的化学方程式_________。 (4)若未设计反应⑥,则化合物I中可能混有杂质,该杂质同样含有一个六元环和两个五元环,其结构简式为_____________。 (5)写出同时满足下列条件的物质I的一种同分异构体的结构简式______________。 ①属于芳香族化合物②能发生银镜反应③能发生水解反应④分子中有5种氢原子 (6)已知:CH2=CHCH2OH CH2=CHCOOH写出以CH2=CHCH=CH2、为原料制备的合成路线流程图(无机试剂任选).(合成路线常用的表示方法为:A…目标产 物)______________。 【答案】羟基、溴原子取代反应加成反应 或 【解析】 【分析】 (1)根据A的结构简式分析含有的官能团; (2)A中酚羟基中H原子被取代生成B;D中碳碳双键与氢气发生加成反应生成E; (3)反应③是取代反应,取代的位置可以是碳碳双键两端任意1个碳原子上的H原子; (4)羧基中的羟基可以取代苯环上Br原子的位置的H; (5)属于芳香族化合物,含有苯环;能发生银镜反应,能发生水解反应,说明含有甲酸形成的酯基,④分子中有5种氢原子,结合I的结构可知,还含有2个﹣CH=CH2,且为对称结构; (6)利用“逆推法”,的合成原料、HOOCCH=CHCOOH,先把CH2=CHCH=CH2变为HOOCCH=CHCOOH,则CH2=CHCH=CH2与溴发生1,4﹣加成生成BrCH2CH=CHCH2Br,再发生水解反应生成HOCH2CH=CHCH2OH,结合信息可知,在PDC/DMF条件下得到HOOCCH=CHCOOH。 【详解】 (1)根据A的结构简式,可知含有的含氧官能团为:羟基、溴原子; (2)对比A、B的结构可知,A中酚羟基中H原子被取代生成B,属于取代反应;对比D、E的结构可知,D中碳碳双键与氢气发生加成反应; (3)反应③是取代反应,取代的位置可以是碳碳双键两端任意1个碳原子上的H原子,故生成的副产物为,同时生成HBr,反应方程式为:;(4)反应④是取代反应,是羧基中的羟基取代苯环上的氢原子,该条件下会取代G中两个Br原子的位置,形成五元环或六元环,其结构简式为:; (5)I的同分异构体满足:①属于芳香族化合物;②能发生银镜反应;③能发生水解反应,含有甲酸形成的酯基,④分子中有5种氢原子,结合I的结构可知,还含有2个﹣CH=CH2,且为对称结构,符合条件的同分异构体为:或; (6)根据流程③把原料连接起来,可知的合成原料、HOOCCH=CHCOOH,先把 CH2=CHCH=CH2变为HOOCCH=CHCOOH,则CH2=CHCH=CH2与溴发生1,4﹣加成生成BrCH2CH=CHCH2Br,再发生水解反应生成HOCH2CH=CHCH2OH,结合信息可知,在PDC/DMF条件下得到HOOCCH=CHCOOH,合 成路线流程图为:。 【点睛】 本题考查有机物的合成与推断、有机反应类型、同分异构体书写等,(6)中注意根据转化图中隐含的信息将碳原子连接起来,较好地考查学生分析推理与知识迁移运用。 19.近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。 (1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________。 (2)在恒温恒容的容器中充入3molCO,3molH 2发生反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。 A.CO和CH3OCH3(g)的生成速率相等 B.混合物中CO的体积分数保持不变 C.反应容器中的压强不再变化 D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存 E.反应容器中混合气体的平均摩尔质量保持不变 (3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。 ①b极的电极反应式为______________________。 ②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____mL(气体处于标准状况;假设电解过程中溶液体积不变)。 (4)化学上采用NH3处理N x O y不仅可以消除污染,还可作为工业生产的能量来源。 已知:①2NO(g)=N2(g)+O2(g) ?H1= -177kJ.mol-1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ?H2= -1253.4kJ.mol-1 则用NH 3处理NO 生成氮气和气态水的热化学方程式为___________________。 (5)氨氧化物可用碱溶液吸收。若NO 和NO 2混合气体被NaOH 溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________。已知常温下.K a (HNO 2)=5×10-4,则反应HNO 2(aq)+NaOH(aq)NaNO 2(aq)+H 2O(1) 的平衡常数为________。 【答案】2OH -+SO 2=SO 32-+H 2O BCE 2NO 2+8e -+4H 2O =N 2+8OH - 448 4NH 3(g )+6NO (g )=5N 2(g )+6H 2O (g ) ?H =-1784.4kJ ·mol -1 NO +NO 2+2NaOH =2NaNO 2+H 2O 5×1010 【解析】 【分析】 【详解】 (1)利用钠碱循环法可脱除烟气中的SO 2。在钠碱循环法中,Na 2SO 3溶液作为吸收液,可由NaOH 溶液吸收SO 2制得,发生反应的离子方程式是2OH -+SO 2=SO 32-+H 2O 。 (2)A .CO 和CH 3OCH 3(g )的生成速率相等不满足正逆反应速率相等,没有达到平衡状态,A 错误; B .混合物中CO 的体积分数保持不变说明正逆反应速率相等,达到了平衡状态,B 正确; C .正反应体积减小,反应容器中的压强不再变化说明正逆反应速率相等,达到了平衡状态,C 正确; D .反应容器内CO 、H 2、CH 3OCH 3(g )、H 2O (g )四者共存不能说明正逆反应速率相等,不一定达到平衡状态,D 错误; E .气体质量不变,物质的量减小,则反应容器中混合气体的平均摩尔质量保持不变说明正逆反应速率相等,达到了平衡状态,E 正确; 答案选BCE 。 (3)①b 极电子流入,是正极,NO 2得到电子,电极反应式为2NO 2+8e -+4H 2O =N 2+8OH -。 ②常温下,若用该电池电解0.6L 饱和KCl 溶液,一段时间后,测得饱和KCl 溶液pH 变为13,生成氢氧化钾是0.6L ×0.1mol /L =0.06mol ,转移0.06mol 电子,a 电极氨气放电,1mol 氨气转移3mol 电子,则理论上a 极上消耗A 气体的物质的量是0.02mol ,体积为448mL 。 (4)已知:①2NO (g )=N 2(g )+O 2(g )? H 1= -177kJ ·mol -1 ②4NH 3(g )+3O 2(g )=2N 2(g )+6H 2O (g )? H 2= -1253.4kJ ·mol -1 则根据盖斯定律可知①×3+②即得到NH 3处理NO 生成氮气和气态水的热化学方程式为4NH 3(g )+6NO (g )=5N 2(g )+6H 2O (g ) ?H =-1784.4kJ ·mol -1。 (5)氨氧化物可用碱溶液吸收。若NO 和NO 2混合气体被NaOH 溶液完全吸收,只生成一种盐,该盐是亚硝酸钠,则该反应的化学方程式为NO +NO 2+2NaOH =2NaNO 2+H 2O 。已知常温下K a (HNO 2)=5×10-4,则反应HNO 2(aq )+NaOH (aq ) NaNO 2(aq )+H 2O (1)的平衡常数为 22 22c(NO )c(NO )c(H )K=c(OH )c(HNO )c(OH )c(HNO )c(H )a W K K --+ --+ ===5×1010。 辽宁省实验中学分校2017-2018学年高一12月月考 语文试题 第I卷阅读题 一、现代文阅读 (一)论述类文本阅读 阅读下面文章,完成下列小题。 汉字蕴含的美学 骆冬青 传说,仓颉造字,“天雨粟,鬼夜哭”,古人对文字的创生充满惊怖和景仰之情,后世“敬惜字纸”的意识中凝聚着华人对“文字”的共通感。汉字的诞生无从考据,可是,从古人刻画的留痕中,我们依然能够感受到那种鲜活灵动的精神。这种精神凝聚在汉字中,凝聚在书法中,凝聚在甲骨、青铜器、竹帛中。中华民族一项最伟大的创造,无疑是汉字这一文化符号。 身在中国文化浸润之中,却最容易忘记这一点。这是因为,汉字与西方拼音文字比起来,似乎在文化形态的比较中,已经落了下风。黑格尔曾断言:“拼音文字自在自为地最具智慧。”这表达了赤裸裸的西方中心主义,表现了一种傲慢与偏见。可是,这种观念,却被一些现代中国文人所接受。这无疑是受一种进化论式的想法所支配,认为文字的发展要经历四个主要阶段,即图画文字、象形文字、表意文字、表音文字。在这样的序列中,似乎清晰地显示了一种文字所处的文化地位,最晚形成的表音文字自然属于最高级的文字。那么,汉字处于什么位置? 从文字的起源来看,即使是拼音文字,亦需以一定形体作为“符号”来展示“声音”。也就是说,在根本意义上,形、音的合一,是所有文字必然的归宿。只不过,西方的拼音文字是以“字母”为基本元素的,“字母”作为表音的基础,生成为“单词”,方才成为西方语言书面表达的意义元素。汉字则不然。许慎的《说文解字序》曰:“仓颉之初作书也,盖依类象形,故谓之文。其后形声相益,即谓之字。文者,物象之本;字者,言孳乳①而浸多也。”这里,着重指出了“象形”的重要性。“文字”获得了一种哲学意义,作为“物象之本”的“文”和“形声相益”的“字”构成的“汉字”,与“字母”的不同在于,它是以“形声相益”的复合形态出现的,从而具有了一种生态学意义上的“生生不息”的创发性。 所以,从图画文字到象形文字,汉字似乎完成了一种飞跃。但在两者之间存在着复杂的关联,并非是一种单线的进化,“图”进一步形式化,“画”进一步抽象化,从而使“字”逐渐“象形化”“文字化”。也就是说,汉字,正如公认的,是合形、音、义为一体的文字。于是人们把汉字说成是表意文字。 【关键字】试题 辽宁省实验中学北校2016-2017上12月测试 命题人:李慧校正人:谷志伟 一、选择题(本大题包括12小题,每小题5分,共60分,每小题给出的四个选项中,只有一项是符合题目要求的,请将正确选项填涂在答题卡上). 1..下列结论中,不正确的是( ) A.平面上一定存在直线B.平面上一定存在曲线 C.曲面上一定不存在直线D.曲面上一定存在曲线 2.有下列三种说法 ①侧棱垂直于底面的棱柱是直棱柱②底面是正多边形的棱柱是正棱柱③棱柱的正面都是平行四边形.其中正确说法的个数是( ) A.0 B..2 D.3 3.已知水平放置的正的边长为,则△ABC的平面直观图△的面积为( ) A. B.C. D. 4.某几何体的三视图如下图所示,则该几何体的体积为() A. B. C. D. (第4题) (第5题) 5.如图,在空间四边形中,一个平面与边分别交于(不含端点),则下列结论错误的是() A.若,则平面 B.若分别为各边中点,则四边形为平行四边形 C.若分别为各边中点且,则四边形为矩形 D.若分别为各边中点且,则四边形为矩形 6.下列命题,正确的是( ) A.不共面的四点中,其中任意三点不共线 B.若点A、B、C、D共面,点A、B、C、E共面,则A、B、C、D、E共面 C.若直线共面,直线共面,则直线共面 D.依次首尾相接的四条线段必共面 7.已知直线和平面,给出以下命题,其中真命题为( ) A.若,则 B.若则 C.若,则 D.若,则 8.下面给出四个命题: ①若平面∥平面,是夹在,间的线段,若则;②若异面直线,是异面直线,则一定是异面直线;③过空间任一点,可以做无数条直线和已知平面平行;④平面∥平面,则 阅读理解 第一节,阅读下列短文,从每题所给胡四个选项中选出最佳选项 A One of the most important things in the world is friendship. In order to have friends, you have to be a friend. But how can you be a good friend at school? Listen—Listen when they are talking. Don’t say anything unless t hey ask you a question. Sometimes it’s not necessary for you to have anything to say; they just need someone to talk to about their feelings. Help them—If your friends are ever in need of something, be there to help them. You should try to put them first, but make sure you don’t do everything they want you to do. Try to take an extra(额外的)pencil or pen with you to classes in case (以防)they forget one. Have a little extra money in your pocket in case they forget something they need. Be there for them—Try to make something for your friends to help make them feel better in hard times. Making cards and encouraging them are among the nicest things you can do for a friend. Marilyn Monroe, a famous U(S. actor, once said,“I often make mistakes. Sometimes I am out of control. But if you can’t stay with me at my worst, you are sure not to deserve(值得)to be with me at my best.” Always remember this! If you don’t want to stay with your friends when they’re in hard times, then you don’t deserve to be with them when they’re h aving a good time! Make plans—Try to make plans with your friends. Go shopping, go for ice creams, have a party, go to a movie and so on. Take time to know each other even better by doing something you both enjoy. By planning things together, you both can have a good time. And you’ll remember 2019-2020学年东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)高三(上)第二次模拟历史试卷 一、解答题(共12小题,满分48分) 1. 晋人著古本《竹书纪年》说携王是虢公翰立之于携。清华楚简《系年》说“邦君诸正乃立幽王之弟余臣于虢,是携惠王”。对此解读正确的是() A.虢公翰立携王更为可信 B.周王传承存在兄终弟及现象 C.晋楚为争夺王室而斗争 D.两份文献所述不是同一事件 【答案】 B 【考点】 宗法制 【解析】 本题关键信息是“邦君诸正乃立幽王之弟余臣于虢,是携惠王”,结合西周的宗法制进 行分析即可。 【解答】 B项中两则材料的区别在于拥立携王者不同,但在幽王之后有携王之立是可以确认的,携王是由王之弟,因此B项正确; 就材料信息无法判断哪个更为可信,排除A项; 材料是对立携王之事的不同记载,但是材料并未有晋楚两国参与的信息,排除C项; D项所述明显错误,排除; 2. “编户齐民”是中国古代君主专制社会中,被国家统一编入户籍进行管理,并按照规 定同样担负赋役的居民。这一制度的实施() A.增强了国家治理能力 B.加重了普通民众的负担 C.旨在掌握人口真实情况 D.增强了封建国家的财力 【答案】 A 【考点】 古代赋税制度 【解析】 本题考查中国古代赋税制度。关键信息有:被国家统一编入户籍进行管理,并按照规 定同样担负赋役的居民。 【解答】 A根据材料并结合所学知识可知,编户齐民能够是国家掌握人口的真实情况,为征发 赋役等提供基础,这反映出国家治理能力的加强,A项正确。 编户齐民本身不会加重民众负担或增强国家财力,排除BD两项。 C项中“最终”之说错误,排除。 3. 如表是当今对汉代丝织业情况了解的部分情况。据此可以得出() 2019-2020学年辽宁省实验中学高一(上)期中历史试卷 一、选择题(共35小题,每小题2分,满分70分) 1. 考古学家在北京人遗址发现四层面积较大且较厚的灰烬层。这一发现,说明当时北京人的生产生活状况是() A.种植水稻 B.会使用火 C.烧制彩陶 D.铸造青铜器 【答案】 B 【考点】 中华文明的形成与发展 【解析】 本题考查中华文明的起源。题干中的关键信息是“四层面积较大且较厚的灰烬层”。【解答】 从材料中的“四层面积较大且较厚的灰烬层”可以得出,北京人已经会使用火,故B正确。 A、C、D在材料中没有体现,均不符合,故排除。 2. 我国水稻栽培历史悠久,水稻作为重要的粮食作物被列为五谷之首。袁隆平先生成功培育出优质杂交水稻,为人类解决“温饱”问题作出重大贡献。目前已知水稻种植最早出现于下列哪一地区?() A.黄河中游 B.长江下游 C.珠江三角洲 D.辽河流域 【答案】 B 【考点】 历史文化常识 【解析】 本题考查中华文明的起源。题干中的关键信息是“水稻种植”“最早出现”。 【解答】 依据所学知识可知,生活在距今约7 000年的河姆渡原始居民种植水稻,而河姆渡文化位于长江下游,我国由此成为世界上最早栽培水稻的国家。 3. 《三字经》中说:“始春秋,终战国,五霸强,七雄出。”其中“五霸”中最早出现的霸主和“七雄”中最后胜出的诸侯国分别是() A.齐桓公秦朝 B.晋文公齐国 C.齐桓公秦国 D.楚庄王秦国 【答案】 C 【考点】 春秋战国时期各国的改革 秦朝统一 【解析】 本题考查春秋战国时期形势。 【解答】 “战国七雄”中最后胜出的诸侯国是秦国,故A错误; 春秋时期,最先称霸的是齐桓公,故BD错误。 故选C。 小学升初中综合素质测评(二) 试卷满分:120分 考试时间:90分钟 一、对号入座(每题3分,共24分) 1.两根同样长的彩带,第一根用去一半,第二根用去 1 2 米,剩下的彩带( ) A .一样长 B .第一根长些 C .第二根长些 D .无法比较 2.下面的数一个零都不读出来的是( ) A .7800321 B .5203000 C .30204000 D .10200 3. 4 9 的分子加上4,要使分数的大小不变,分母应( ) A .加上4 B .扩大4倍 C .扩大2倍 D .扩大3倍 4.下列分数3415172538152425486 、、、、、中能化成有限小数的有( )个. A .4 B .3 C .2 D .1 5.下面各题,大小比较错误的是( ) A .8吨400千克>8.04吨 B .2个锐角的和<1个平角 C .4升<3000立方厘米 D .7.09<7.10 6.通过“整数和小数”的复习,你认为下列说法不正确的是( ) A .在0.1和0.2之间有无数个数 B .4.895保留两位小数是4.90 C .两个合数,一定不是互质数 D .☆÷△=9…6,△最小是7 7.图中的正方体、圆柱体和圆锥体的底面积相等,高也相等,下面说法正确的是( ) A .圆锥的体积是圆柱体积的3倍 B .圆柱的体积比正方体的体积小一些 C .圆锥的体积是正方体体积的 13 D .以上说法都不对 8.观察表一,寻找规律.表二、表三、表四分别是从表一中截取的一部分,其中a 、b 、c 的值分别为( ) A .20、29、30 B .18、30、26 C .18、20、26 D .18、30、28 语文学科高二年级 本试卷共8页,22题。全卷满分150分。考试用时150分钟 注意事项: 1.本试卷分第Ⅰ卷(阅读题)和第Ⅱ卷(表达题)两部分。答题前,务必先将自己的姓名、准考证号填写在答题卡上,并将准考证号条形码贴在答题卡的指定位置上。 2.作答时,将答案写在答题卡对应的答题区域内,写在试卷和答题卡非答题区域上均无效。 3.考试结束后,将答题卡上交。 第Ⅰ卷(阅读题共70分) 一、现代文阅读(35分) (一)论述类文本阅读(本题共3小题,9分) 读下面的文字,完成1-3题。 符瑞,或称之为?祥瑞??瑞应??祯祥??符应??嘉瑞??嘉祥?等,是古代帝王承天受命、施政有德的征验与吉兆。殷周之际新天道观念的形成是其产生的关键因素,图腾崇拜、征兆信仰、史官文化等因素是其产生的重要原因。符瑞文化的产生,对中国古代的政治、宗教、礼制、文学等众多领域产生了深远的影响。。 符瑞文化是一种政治文化,政治功能是其基本功能。首先,符瑞文化具有政治建构功能。符瑞文化为王权政治的合法性提供了强有力的天命依据。在中国古代社会中,较为普遍的思想信仰与观念是:王权嬗替乃天道必然,一切政权的更迭皆由乎天命,取乎天道。然而,?神道阐幽,天命微显?,天命又需要借助符瑞现象来显示。因此,符瑞实际上起着昭示天命、彰显德行的重要作用。正如沈约所说:?夫龙飞九五,配天光宅,有受命之符,天人之应。?其次,符瑞文化具有政治评价功能。符瑞不仅是王者承天受命的天意灵征,更是王者圣德充溢的天意嘉奖。符瑞文化构建了统治阶级自我肯定、自我宣扬和自我美化的评价机制,为统治阶级歌功颂德、粉饰太平提供了有力的思想资源。最后,符瑞文化具有政治调节功能。符瑞显现促使统治阶层调整统治策略:或改元以应天瑞,或立祠设祭,以合符应,或赏赐功臣、大赦天下以收揽人心。这些举措缓和了阶级矛盾,加强了统治阶级的凝聚力,形成了统治阶级内部别具特色的自我调节、自我修复和自我完善的运行机制。 符瑞文化是中国古代宗教文化或宗教意识的一部分,强化君权天授的政治观念,具有巨大的道德作用,同时也具有劝善惩恶的宗教功能。尤其是随着谶纬神学的盛行,符瑞文化 辽宁省实验中学分校2017-2018学年作文题分析与例文 辽宁省实验中学分校2017-2018学年作文题分析与例文 写作 22. 阅读下面的材料,根据要求写一篇不少于800字的文章。 这一代年轻人有着极强的民族自信心和国家荣誉感,这样的年轻人对自己的文化有一种自信,对这个世界有一种关怀,用一种真正的大国心态看待过去几百年的历史,包括辛酸史。然后再回过头来思考中国现在的发展、未来的崛起,以及未来世界的发展方向。年轻人应该如何看待中国和世界?你有怎样的思考? 请结合自己的体会与感悟,选好角度,确定立意,自拟题目,自选文体(诗歌除外),写一篇不少于800字的文章,要求不得脱离材料的内容和含意作文,不要套作,不得抄袭。 【答案】把孤岛连成大陆 始终有两种力量,在我们一生中激荡。一种推着我们向外走,一种拉着我们向内收。一种力量去远方,一种力量回原乡。 这一年,我们依然在工地上挥汗如雨,依然进出写字楼风风火火,或者像候鸟一样满世界飞翔……无论我们有多忙,走得有多远,却始终被一种力量牵绊,被一种惦记温暖,被一种责任召唤。于是,我们看到阿拉善沙漠的沙生植物在公益人脚下不断绵延,看到山间角落里的尘肺病人被一个个找到送医,看到凉山格斗孤儿们被遣送后重新回来学习与训练。高速运的时代陀螺,将社会切割成一个个网格,将人们隔离成一个个原子。但生命意志顽强地向外向上生长,激励我们从一个个原点走出,又将一个个原子彼此相连,让吾国斯民,遥相守望。 曾经,我们以为只要努力工作、播洒汗水,就可以自然获得更多的收入,站上更高的平台,让孩子得到更优的教育,使家人过上更好的生活。但总有一些意外,可能先于明天到达;总有一些事情,超出个人能力之外。交了昂贵学费,幼儿园不一定就能安全放心;住了高档小区,空气不一定就比别处清新;攒了一辈子钱,银行卡收得再紧也不一定躲得过诈骗的厄运。 在万物互联的时代,独善其身越来越不可能。我们为自己奔忙,也给他人幸福。我们捡起一片废纸,也是在为自己清洁环境。你我都是社会生态链的一环,是休戚相依的命运共同体。美好生活需要你我发自内心的善意,也需要更温暖的公共产品和制度供给。政府放开生育政策,让信奉家庭价值的中国人更好地亲其亲、子其子,不仅滋养着个体的终极幸福,也涵育着中华民族的繁荣之源。 曾经,我们以为人类进入新世纪第二个十年,历史早已教会人们珍惜和平与发展,但大变革大调整的时代版图,一直波谲云诡。有的国家将国门打开,有的却关门退;有的经济体高歌猛进,有的增长缺乏后劲;有的可能遍地黄金,有的满目战乱贫病…… 世界不稳定性不确定性的警报一直在为你我鸣响。气候变化利剑高悬,核爆危机阴魂不散,霸权与恐怖主义的双头怪胎竞相疯长,基因技术与人工智能将给人类带来怎样的伦理与法律挑战?没有一个国家能退回孤岛,自理人类的这些困难。只有深悟命运共同体的真义,穿过看似冰冷的商业与国家竞争,将一个个漂流的孤岛连成共享繁荣的大陆,我们才可能在天下为公中牵手大同,这个日夜旋的星球,才不会在浩渺宇宙中显得寒冷寂寥。 时空坐标中,个体局限性总是影响对历史大折的感知,即使亲历者,也往往在事后才突然醒悟。40年前,改革开放春雷炸响,父辈们筚路蓝缕,用一代人的时间,改变了自身的命运,也让百年中国告别积弱积贫,重拾伟大复兴的民族自信。今天,八十年代的新一辈已 2020┄2021学年辽宁省实验中学分校高一(下)期中化学试 卷 一、选择题(每小题均只有1个选项符合题意.共20小题,每小题3分,共60分)1.230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是() A.Th元素的质量数是232 B.Th元素的相对原子质量是231 C.232Th转化成233U是化学变化 D.230Th和232Th的化学性质相同 2.某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成H m X分子.在a 克H m X中所含质子的物质的量是() A.(A﹣N+m) mol B.(A一N) mol C.(A﹣N) mol D.(A一N+m) mol 3.有X和X+两种粒子,下列叙述正确的是() A.一定都是由质子、中子、电子构成的 B.化学性质几乎完全相同 C.质子数一定相等,质量数和中子数一定不相等 D.核电荷数和核外电子数一定相等 4.国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是()A.不仅有第2列元素的原子最外层有2个电子 B.第3~12列元素全为金属 C.第3列元素种类最多 D.第16、17列元素都是非金属元素 5.下列关于卤族元素由上到下性质递变的叙述,正确的是() ①单质的氧化性增强②单质的颜色加深③气态氢化物的稳定性增强 ④单质的沸点升高⑤阴离子的还原性增强. A.①②③B.②③④C.②④⑤D.④⑤ 6.砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是()A.与H2化合的能力:At2>I2 B.砹在常温下为白色固体 C.砹原子的最外层有7个电子 D.砹易溶于水,难溶于四氯化碳 7.在元素周期表中,铂的表示如图所示,下列对图示解读正确的是() A.铂是非金属元素,在常温下呈固态 B.“78”是铂的原子序数 C.“195.1”是铂的质量数 D.铂的名称为Pt 8.有一个未完成的离子方程式:[]+XO3﹣+6H+=3X2+3H2O,据此判断下列说法正确的是() A.X 2的电子式为 B.X元素在周期表中处于ⅤA族 C.X元素的原子最外电子层上有7个电子 东北三省三校哈师大附中、东北师大附中、辽宁省实验中学2020年高考考前模 拟化学试题 一、选择题(共包括22个小题。每小题均只有一个符合题意的选项) 1、下列解释工业生产或应用的化学用语中,不正确 ...的是 A.FeCl3溶液刻蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+ B.Na2O2用作供氧剂:Na2O2+H2O=2NaOH +O2↑ C.氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O D.Na 2CO3溶液处理水垢:CaSO4(s)+CO32?CaCO3(s)+SO42? 2、某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是 A.装置①中的试剂可能是二氧化锰 B.装置②、③中的试剂分别为浓硫酸、饱和食盐水 C.点燃④处酒精灯之前需排尽装置中的空气 D.球形干燥管中碱石灰的作用只有处理尾气 3、短周期元素W、X、.Y、Z位于不相邻主族,它们的原子序数及最外层电子数均依次增大且其中只有一种金属元素, W处在第一周期。下列说法错误的是 A.X为金属元素B.原子半径:X>Y> Z> W C.Y与Z可形成2种化合物D.Y的最高价氧化物对应的水化物是强酸 4、下列有关海水综合利用的说法正确的是( ) A.电解饱和食盐水可制得金属钠B.海水提溴涉及到氧化还原反应 C.海带提碘只涉及物理变化D.海水提镁不涉及复分解反应 5、水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)32Na2FePO4F+ NaTi2(PO4)3 下列说法错误的是 A.充电时,a接电源正极 辽宁省实验中学2019——2020学年度上学期期中阶段测试 高二数学试卷 考试时间:120分钟 试题满分:150分 一、单项选择题(每题只有一个正确选项,将正确选项涂在答题卡相应位置,每题正确得5分,错误不得分,共10题,满分50分) 1.数列1,3,7,15,……的通项可以是( ) A 、 12-n B 、12-n C 、12-n D 、12+-n n 2、点()3,2A -,()3,2B ,直线10ax y --=与线段AB 相交,则实数a 的取值范围是( ) A .41 32 a - ≤≤ B .1a ≥或1a ≤- C .11a -≤≤ D .43a ≥ 或1 2 a ≤ 3.若直线1:260l ax y ++=与直线2 2:(1)10l x a y a +-+-=平行,则a =( ) A .2或-1 B .-1 C .2 D . 23 4.以双曲线2 2 13 y x -=右焦点为圆心,且与双曲线的渐近线相切的圆的方程为() A .22 (2)3x y ++= B .22 (2)9x y ++= C .2 2 (2)3x y -+= D .2 2 (2)9x y -+= 5.若圆2 2240+-++=x y x y m 截直线30x y --=所得弦长为6,则实数m 的值为 A .1- B .2- C .4- D .31- 6.若直线l 1:x +3y +m =0(m >0)与直线l 2:2x +6y -3=0,则m =( ) A .7 B . 172 C .14 D .17 7.已知椭圆22 134 x y C +=:的上焦点为F ,直线10x y +-=和10x y ++=与椭圆分别相交 于点A 、B 、C 、D ,则AF BF CF DF +++=() A .23 B .8 C .4 D .43 8.数列{}n a ,{}n b 满足1 1111,2,n n n n b a b a a n N b +++==-==∈,则数列{} n a b 的前n 项和为 ( ) A .1 4(41)3 n -- B . 4(41)3 n - C .1 1(4 1)3 n -- D .1(41)3 n - 9.美学四大构件是:史诗、音乐、造型(绘画、建筑等)和数学,素描是学习绘画的必要一步,它包括了明暗素描和结构素描而学习几何体结构素描是学习素描最重要的一步,某同学在画“切面圆柱体”(用与圆柱底面不平行的平面去截圆柱,底面与截面之间的部分叫做切面圆柱体,切面圆柱体中原圆柱的母线被截面所截剩余的部分称为切面圆柱体的母线)的过程中,发现“切面”是一个椭圆,若切面圆柱体的最长母线与最短母线所确定的平面截切面圆柱得到的截面图形是有一个底角为60度的直角梯形,则该椭圆的离心率为( ) A . 12 B .2 C . 3 D .13 10.已知点P ,Q 分别在直线1:20l x y ++=与直线2:10l x y +-=上,且1PQ l ⊥,点 ()3,3A --,31,22 B ?? ??? ,则AP PQ QB ++的最小值为(). A .1302 B .32 132 + C .13 D .32 二、多项选择题(每题至少有两个正确选项,将所有正确选项涂在答题卡相应位置,每题5分,全部正确得5分,选项不全得2分,若有错误选项得0分,共2题,满分10分) 11.已知数列}{n a 为等差数列,11=a ,且842,,a a a 是一个等比数列中的相邻三项,记 辽宁省实验中学分校(北校)高中违纪学生管理条例(试行) 高中部学生处发布 第一章总则 第一条为维护学校正常的教育教学秩序,创造一个良好的教育教学环境,全面提高教育教学质量,增强学生法制观念,预防和减少学生违纪行为,实现立德树人的总目标。根据《中华人民共和国教育法》、《未成年人保护法》、《预防未成年人犯罪法》、《中学生守则》和《中学生日常行为规范》,结合学校实际,制定此条例。 第二条处分不是教育的目的,而是教育管理的手段,对违纪学生的处分,遵循依法治校原则,慎重且严格执行手续。学校对违纪学生坚持教育为主和实事求是的原则,对受处分的学生,学校教师和班主任要经常找他们谈心,要热情帮助,不歧视。利用好《辽宁省实验中学分校(北校)待优生转化教育记录》,帮助他们改正缺点,错误,及时撤消处分。 第三条对扰乱社会秩序、妨害公共安全、侵犯公民人身权利、破坏公私财产者,依照《中华人民共和国刑法》的规定构成犯罪者或违反《中华人民共和国治安管理处罚法》者依法移送司法或公安机关处理。 第二章处分的种类 第四条根据学生所犯错误的性质、情节、造成的后果,偶犯还是屡犯,本人对错误的认识和态度,给予下列七种处分:通报批评;警告;严重警告;记过;记大过;开除前警告;开除(或劝退)。 第五条凡学生所犯错误给集体和他人带来经济、物质损失的,除给予纪律处分外,必须依法依规承担赔偿责任。 第六条违反学校纪律有下列情形之一者,可从轻或免于处分: (一) 主动认错,态度真诚,有悔改表现; (二)情节轻微,不是主谋;(三)积极主动赔偿损失,并取得当事人原谅。 第七条违反学校纪律有下列情形之一者,从重处罚: (一)有较严重后果者;(二)认错态度不好者;(三)对检举人,证人打击报复者;(四)屡教不改(包括受处分后,又犯其它方面错误)者;(五)手段恶劣,情节严重者;(六)胁迫,诱骗和教唆他人违反处分条例行为者;(七)嫁祸于他人或制造假象掩盖违纪事实者;(八)勾结校外人员违法违纪,败坏学校声誉者;(九)威胁、侮辱学生管理工作人员者;(十)一人有两种以上违犯处分条例行为者。 第三章处分程序 第八条处分材料包括: (一)学生违纪事实的记载材料(即事情经过); (二)违纪者本人的检讨﹑保证书; (三)班级对违纪学生的评价; (四)其它与违纪有关的材料。 第九条处理程序: 通报批评可由班主任根据学生的违纪情况或日常表现情况,向年级提出处分申请,年级主任审批,班主任通知家长和学生本人,班主任做好学生的思想工作,处分决定班级或年级内公布; 警告、严重警告由年级主任根据学生的违纪情况和(或)日常表现情况,与班主任共同研究决定,年级主任通知家长和学生。年级主任和班主任做好学生的思想工作,并将处分决定 辽宁省实验中学2017-2018学年度下学期期中阶段测试 高一理科物理试卷 考试时间:90分钟 试题满分:100分 一、单项选择题(每小题4分,共48分。每小题有四个选项,1-8题只有一项是正确的,9-12题有两项或两项以上正确,错选不得分,漏选得2分) 1.下列说法正确的是( ) A. 伽利略提出了行星运动的三大定律 B. 牛顿最先在实验室里比较准确地测出了引力常量的数值 C. 海王星被称为“笔尖下发现的行星”,它的发现确立了万有引力定律的地位 D. 开普勒从实验中得出了行星运动定律 2.鸟神星是太阳系内已知的第三大矮行星,已知其质量为m ,绕太阳做匀速圆周运动(近似认为)的周期为T 1,鸟神星的自转周期为T 2,表面的重力加速度为g ,引力常量为G ,根据这些已知量可得( ) A. 鸟神星的半径为 Gm g B. 鸟神星到太阳的距离为1 3 4GmT π C. 鸟神星的同步卫星的轨道半径为2 2 32 4GmT π D. 鸟神星的第一宇宙速度为mgG 3.如图所示,轻质弹簧一端固定,另一端与一质量为m 、套在光滑竖直固定杆A 处的圆环相连,弹簧水平且处于原长.圆环从A 处由静止开始下滑,经过B 处的速度最大,到达C 处的速度为零,重力加速度为g ,则下列说法不正确的是( ) A. 由A 到C 的过程中,圆环的加速度先减小后增大 B. 由A 到C 的过程中,圆环的动能与重力势能之和先增大后减少 C. 由A 到B 的过程中,圆环动能的增加量小于重力势能的减少量 D. 在C 处时,弹簧的弹性势能为mgh 4.假定太阳系一颗质量均匀、可看做球体的小行星自转原来可以忽略。现若该星球自转加快,角速度为ω时,该星球表面的“赤道”上物体对星球的压力减为原来的2/3.已知引力常量G ,则该星球密度ρ为( ) A. 298G ωπ B. 2 3G ωπ C. 232G ωπ D. 294G ωπ 2020年东北三省三校高三第一次联合模拟考试 (哈师大附中、东北师大附中、辽宁省实验中学) 语文试题 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息; 2.请将答案正确填写在答题卡上。 第I卷(选择题) 一、选择题 1.请从下列句子中选出逻辑正确、表意清楚的两句( ) ( ) A.在从前,四方台向来没有人上去过,上去的人就从来没有回来过。 B.1942年,母亲在战争硝烟弥漫的华北大地上度过了她沉默、清贫的一生。 C.衡量科学技术进步的尺度,从过去的万年、千年、百年,已经变成现在的十年、一年,甚至日新月异。 D.某报刊载一篇关于哲学理论的文章,主要内容是黑格尔批判形而上学的局限性。E.在主持人问及澳大利亚山火危机能否推动政府调整今后减排目标时,澳总理暗示今后气候政策可能会发生改变。 第II卷(非选择题) 二、现代文阅读 阅读下面的文字,完成下面小题。 《韩非子》如何取法老子 周苇风 法家代表人物韩非是荀子的学生,因为口吃,不喜言谈。曾数次上书进谏韩王,却不被采纳。但他的文章传入秦国后大受欢迎,秦王甚至感叹“嗟乎,寡人得见此人与之游,死不恨矣”。 《史记》中,韩非与老子合传,同传中还有庄子和申不害。庄子和老子是道家人物, 韩非和申不害为法家人物。司马迁说,韩非“喜刑名法术之学,而其归本于黄老”。 黄老学派形成于战国时期,最初流行于齐国稷下学宫。它既讲道德又主刑名,既尚无为又崇法治,既以为“法令滋彰,盗贼多有”又强调“道生法”,要求统治者“虚静谨听,以法为符”。作为儒家学派的一员,荀子曾在稷下学宫三为祭酒,思想难免受到黄老思想的影响。他清醒地认识到,礼的施行无法完全依靠“克己”来实现。于是,便提出了礼法并举的思想。理解了这个学术背景,司马迁说韩非“其归本于黄老”也就不奇怪了。 《韩非子》有《解老》《喻老》两篇,顾名思义是解读《老子》的专著。从这个角度来看,韩非可以说是早期研究《老子》的专家。老子思想的核心是道,道是客观自然规律。韩非接受了老子对道的阐述,承认道决定宇宙万物的演变。同时,老子认为道具有“独立而不改,周行而不殆”的永恒意义。对此,韩非则进一步发挥,强调道是变化的,天地也是变化的,人也在不断变化中,整个社会都在变化。由此,治理社会的方式和方法自然也应该变化。但是,韩非也非常重视道的稳定性。道的稳定性在现实中表现为法。法是依道建立起来的,人人必须遵守,不能随意更改。 《老子》曰:“柔弱胜刚强。鱼不可脱于渊,国之利器不可以示人”;“以正治国,以奇用兵,以无事取天下”。这一思想到了申不害和韩非手里,则发展为以权术驾驭群臣,也就是术。韩非对以进为退、暗藏杀机及权谋的运用,可以说是津津乐道。《韩非子》就明确提出:“术者,藏之于胸中,以偶众端,而潜御群臣者也。故法莫如显,而术不欲见。” 春秋战国时期,残酷的现实使法家意识到,人君的威胁主要不是来自民众和敌国,而是来自臣下。所以,申不害和韩非都主张术应该隐藏在君主心中,不能为臣下窥破。术有权术的含义,但法家的术不仅仅局限于权术的运用。《韩非子》认为,所谓的术就是根据才能授予官职,明确职责并严加考核。这样,君主就可以操生杀之柄,督促群臣尽力工作。 人们在谈论法家时常常商、韩并举,认为韩非的思想是商鞅的继承和发展。确实,韩非认同商鞅富国强兵的种种举措,也主张建构一元化社会控制体系。然而,在继承商鞅法治思想的同时,韩非更加关注稳固社会秩序的永续。韩非和商鞅都认为,社会秩序的稳固在于加强君主专制集权。但是,商鞅对加强君主专制集权的具体措施缺少详细论述。韩非批评商鞅知法而无术,认为商鞅的种种富国强兵之举因“无术以知奸”,最终只能“资人臣而已”。由此,韩非尽力鼓吹权术,以弥补商鞅的不足。 不过,既然有驭臣之术,就会有欺君之方。尔虞我诈,你争我斗,反而加剧了政权的不稳定性。秦始皇后期迷信权术,为了让人觉得自己威严、神圣和神秘,长期疏远大臣,这就给了赵高弄权的机会。二世胡亥即位后,继续沿用秦始皇的做法,最终连刘邦 2019-2020学年辽宁省实验中学高一(上)期中化学试卷 一、单选题(本大题共19小题,共47.0分) 1. 下列说法正确的是( ) A. 钠与CuSO 4溶液反应:2Na +Cu 2+=Cu ↓+2Na + B. Na 2O 2与水反应时,生成0.1 mol O 2,转移的电子数为0.2N A C. 足量Na 2O 2加到紫色石蕊溶液中,石蕊溶液最终变成蓝色 D. 在酒精灯加热条件下,Na 2CO 3和NaHCO 3固体都能发生分解 2. “84”消毒液(有效成分为NaClO)可用于消毒和漂白,下列实验现象的分析错误的是( ) 实验 现象 混合后溶液的pH =9.9,短时间内未褪色,一段时间后蓝色褪去 混合后溶液pH =5.0,蓝色迅速褪去,无气体产生 混合后溶液pH =3.2, 蓝色迅速褪去,并产生大量气体,使湿润的淀粉?碘化钾试纸变蓝 ①②②B. 实验③中产生的气体是Cl 2,由HClO 分解得到:2HClO =Cl 2↑+H 2O C. 对比实验②和③,溶液的pH 可能会影响ClO ?的氧化性或Cl ?的还原性 D. 加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH 才能安全使用 3. 常温下,下列各组离子在指定溶液中能大量共存的是( ) A. 无色透明溶液中:K +,SO 42?,Na + ,MnO 4? B. c (H +)c (OH ?) =1×10?12的溶液中:NO 2?,Na +,[Al (OH )4]?,K + C. c (NO 3?)=1mol ?L ?1的溶液中:H +,NH 4+,Fe 2+,Cl ? D. 水电离的c (H +)=1×10?12mol ?L ?1的溶液中:HCO 3?,SO 42?,K +,Cl ? 4. 用N A 表示阿伏加德罗常数的值,下列叙述正确的是( ) A. 含有1mol 原子的氢气在标准状况下的体积约为22.4 L B. 25 ℃,1.01×105Pa ,64 g SO 2中含有的原子数为3N A C. 1 mol/L 的Na 2SO 4溶液含Na +数为2N A D. 标准状况下,11.2 L H 2O 含有的分子数为9g 5. 将5mol ·L ?1的Mg(NO 3)2溶液a mL 稀释至b mL ,稀释后溶液中NO 3?的物质的量浓度为( ) 东北三省三校(哈师大附中、东北师大附中、辽宁省实验中 学)2018届 一、选择题:本题目有35个题目,每个题目有4分,总分为I40分。在每个项目中给出的四个选项中,只有一个符合主题的要求。 10月,XXXX重厌氧交通大学根据土壤的性质,发明了一种将沙子和水混合成土壤的粘合剂,并在内蒙古乌兰布和沙漠进行了试验,成功地将4000多亩沙漠变成了绿洲,成为世界治沙史上的一个奇迹。相应地完成问题1-2。 1.大规模使用这种防砂技术的限制因素是:人工砂技术、土壤、运输、水源。这项技术可以给当地带来的直接影响包括 A.改变大气环流,增加夏季降水;保护水源,防止渗漏,增强土壤抗风蚀能力;促进产业结构调整,加快第二产业和第三产业发展;协调区域联系,促进矿产资源开发;当低温气流在埃加勒新浅滩向北流动时,南非的伪撒丁岛将随之向北迁移产卵。图1是南非沙丁鱼迁徙路线示意图,据此完成3 ~ 4个问题。 3当南非沙丁鱼向北迁移到它们的产卵场时,可能的现象是:1 .德班附近植被茂盛;开普敦附近平静的海水;鹦哥海盐场适宜的盐干燥;华北到处都是红叶 4.海洋中浮游生物的生存依赖于营养盐。该海域营养盐的来源是:a .由低温流携带到海面的营养盐;b .由盛行风吹来的营养盐;c .由暖流携带到海面的营养盐;d .当低温流遇到南方暖流时,营养盐泛滥 在一段时间内,中国东部的某个地区受到天气系统的影响,该系统有 好几天的好天气。在该系统中,心脏位于图3中的位置b。图2是摄影爱好者在该地区公园拍摄的风景照片。据此,完成5~6个问题。 5.如果系统继续影响该地区,可能是a。空气质量越来越差b。风力明显增加c。白天和晚上的温差在减小d。雨是连续的。 6.如果空调和空调也在废天气系统的控制之下,则空调中的天气与空调中的天气相反 A.湿冷b .干冷c .暖干d .暖湿 区位熵是一个用来衡量某一地区元素空间分布的指标。值越高,位置和功能越高。图4是XXXX圣彼得堡城市土地利用区位熵值的空间分布图。相应地完成7~8个问题。 7.圣彼得堡使用的最明显的土地类型是工业用地、商业用地、住宅用地、交通用地。关于圣彼得堡的城市发展,以下陈述是正确的:a .环形交通线缓解了市中心和郊区的交通压力;b .商业区的发展带动了城市住宅的快速发展;c .带状城市形态的形成与工业用地密切相关;d .城市的城市化水平已完全进入反城市化阶段 在两条相邻河流的开发过程中,如果低洼河流具有很强的侵蚀力,河谷的上游源头将会继续加长,使其与地势较高的河流相遇,从而捕获其河水称为河流捕获。图5是攻击前后河流的示意图。根据 这就完成了9 -11个问题。 9.关于甲和乙河流,正确的说法是 A.河流b的流动。河流a的高地形。河流b的侵蚀。河流b的侵蚀。河流d的直线河道。河流a的强沉积物堆积在10。河流b的m是由 xx扫描网上阅卷系统部分经典案例 : 大型考试阅卷服务 大型考试阅卷服务 xxxx教育局 xx教科所xx模拟 考试 xxxx市教育局 联考 xxxxxx xxxxxx中 小学联考上海市卢湾区教育局上海市长宁区教育局河北省邢台市教育局高中河北省沧州市教育局教科联考所联考 河北省廊坊市教育局高中河北省承德市教育局高中联考联考 云南省西双版纳州中考云南省楚雄州中考湖北省襄阳8校联考全国医护英语等级考试云南省保山市中考山东省德州中考 甘肃省金昌市中考贵州省遵义市高中联考广西省河池市高中联考河南省新乡市高中联考 xxxx市xx xxxx中、xx联 xxxxxx 考 xxxx高中联考xx天水xx xxxx教育局xx xx教育局联考xxxx市xx xx xxxx实验 中学 xx中医药大 学 xx知春里中 学 xx交通大学 初中部 xxxx中 学xxxxxx xxxxxx xxxx教育局xx xx教师资 xx教育局 格考试 xxxxxx 北京市理工大学附北京市附中香山学北京市人大附中第二分中校校 xx十一学校 北京市清华附中北京市十九中学北京市丰台二中北京市中关村中学北京市育英中学北京市师范大学北京市八一中学北京市万寿寺中学北京市人大附中 北京市太平路中学北京市科技大学附北京市北大附中香山分属中学校 xx交通大学高xxxx楼中 xx206中学中部学 北京师范大学xx xx八中xx分校附属中学 xxxx教研室 xx林业大学xxxx中学 xxxx中学xx五十七中 xxxx一中xxxx一中 xxxx第 十中学 河北省邯郸磁县河北省魏县四中河北省磁县一中河北省武安一中邯郸第二十七中学河北省钢苑中学河北省魏县一中河北省邯郸三中河北省邯郸四中河北省曲周一中 xxxxxx二 中学xx春光中学 中 1.辽宁省实验中学 2.东北育才学校 3.沈阳市第二中学 4.沈阳市第二十中学 5.沈阳市一二零中学 二、大连市: 1.大连市二十四中学 2.大连市育明高中 3.大连市第八中学 4.大连市第一中学 5.大连市第二十三中学 三、营口市: 1.营口高级中学 2.大石桥市第一高级中学 3.营口市开发区高中 4.盖州市第一高级中学 5.营口市第三高级中学 四、盘锦市: 1.盘锦市高级中学 2.辽河油田第一高级中学 3.盘锦第二完全中学 1.鞍山市第一中学 2.鞍山市新元高中 3.鞍山市第八中学 4.鞍山市鞍钢高中 5.鞍山市第三中学 六、丹东市: 1.丹东市第二高级中学 2.丹东市第一高级中学 3.丹东市第四高级中学 4.凤城市第一高级中学 5.东港市第二高级中学 七、本溪市: 1.本溪市高级中学 2.本溪市第一高级中学 3.本溪市满族自治县高级中学 4.本溪市第二高级中学 5.本溪市第二高级中学分校 八、锦州市: 1.锦州中学 2.渤海大学附属高级中学 3.锦州市铁路高级中学 4.凌海市第一高级中学 九、葫芦岛市: 1.葫芦岛市第一高级中学 2.葫芦岛市第二高级中学 3.兴城市第一高级中学 4.建昌县第一高级中学 5.绥中一高中 十、辽阳市: 1.辽阳市第一高级中学 2.辽化高中 3.灯塔一高 4.辽阳县一高 5.辽阳市第二高级中学十一、抚顺市: 1.抚顺二中 2.抚顺一中 3.抚顺十中 4.抚顺四方高中 5.抚顺六中 十二、阜新市: 1.阜新市实验高中 2.阜新市高级中学 3.阜新市海州高中 4.阜新市第二高级中学 5.阜新市蒙古族中学十三、铁岭市: 1.铁岭市第一高级中学十四、朝阳市: 1.朝阳二高 2.喀左蒙中 3.北票一中 4.凌源实验中学 5.建平一中辽宁省沈阳市实验中学分校(北校区)2017-2018学年高一12月月考语文试题(原卷版)
【试题】辽宁省实验中学分校2020学年高一12月月考数学试题
辽宁省凌源市实验中学2020┄2021学年高一10月月考试题英语
2019-2020学年东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)高三(上)第二次模拟历史试卷
2019-2020学年辽宁省实验中学高一(上)期中历史试卷
辽宁省实验中学北校区小升初数学真题
辽宁省实验中学分校2017-2018学年高二上学期期末考试语文试卷
辽宁省实验中学分校2017-2018学年作文题分析与例文
辽宁省实验中学分校2020┄2021学年高一下学期期中化学试卷 Word版含解析
【含高考模拟卷15套】东北三省三校哈师大附中、东北师大附中、辽宁省实验中学2020年高考考前模拟化学试题含
辽宁省实验中学2019--2020学年度上学期期中阶段测试
辽宁省实验中学分校(北校)高中学生违纪管理条例
辽宁省实验中学2019-2020学年高一物理下学期期中试题
2020年东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)高三第一次联合模拟语文试题及答案解析
2019-2020学年辽宁省实验中学高一(上)期中化学试卷 (含答案解析)
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2018届
南昊扫描网上阅卷系统部分经典案例
辽宁省各市高中排名
