常用干燥剂的性能和用途

常用干燥剂的性能和用途
1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H
2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。党用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH3、O2、N2等。
6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2。O2。CO2。CO 、N2。Cl2、HCl 、H2S、NH3、CH4等。
由上述可知、对一些气体的干燥剂可作如下选择。
气体名称常用干燥剂气体名称常用干燥剂
CO 浓H2SO4、CaCl2、P2O5H2S CaCl2
CO2CaCl2、浓H2SO4、P2O5N2浓H2SO4、CaCl2、P2O5
Cl2CaCl2、浓H2SO4NH3CaO、KOH或碱石灰
H2CaCl2、P2O5NO Ca(NO3)2
HBr CaBr2、ZnBr2O3CaCl2
HCl CaCl2、浓H2SO4SO2浓H2SO4、CaCl2、P2O5
HI CaI2
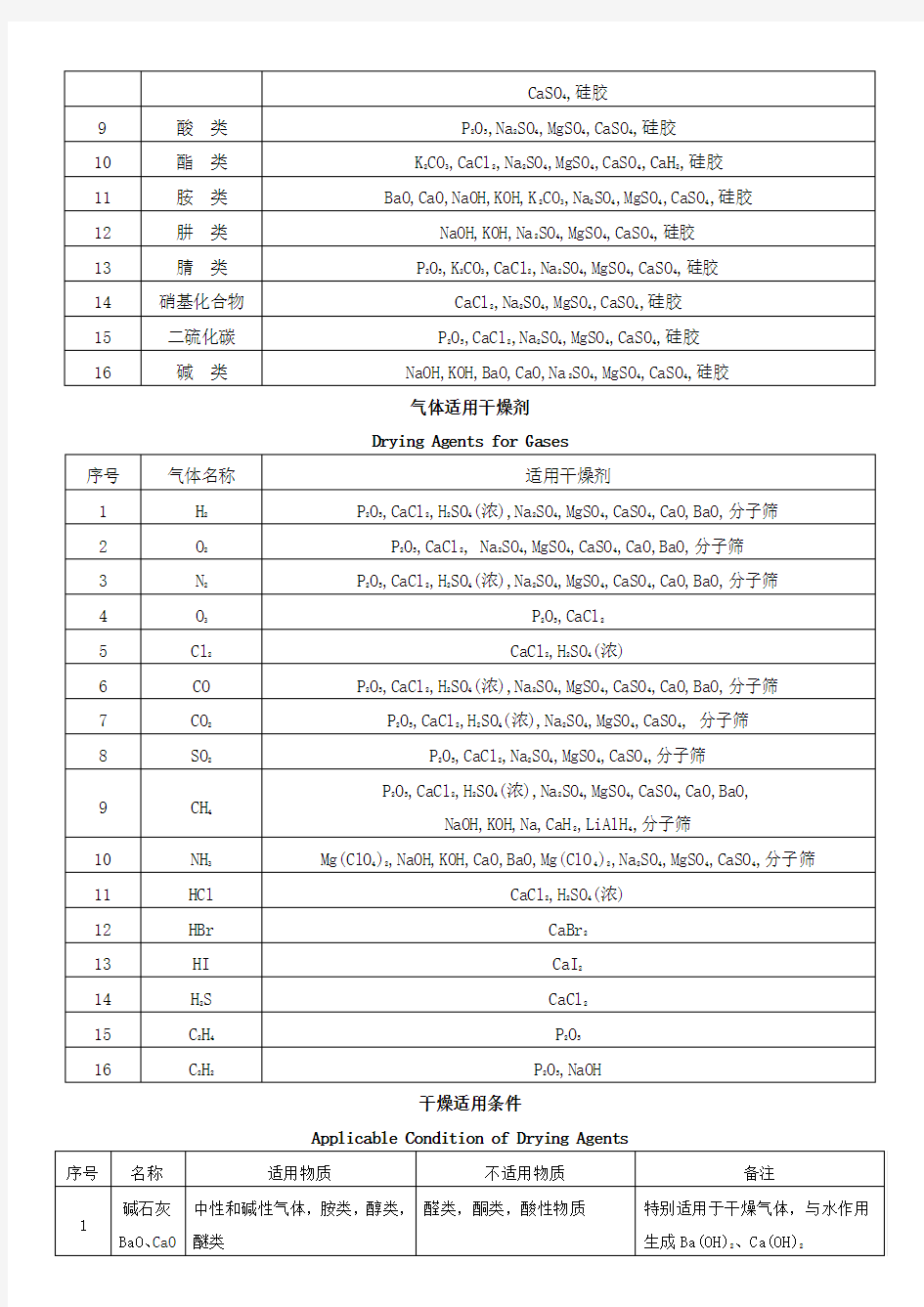
液体适用干燥剂
Drying Agents for Liquids
气体适用干燥剂
Drying Agents for Gases
干燥适用条件
Applicable Condition of Drying Agents
常用干燥剂
注:使用高氯酸盐时务必小心,碳、硫、磷及一切有机物都不能与之接触,否则会发生猛烈爆炸,造成危险。
高中化学干燥剂总结
高中化学干燥剂小结 1、酸性干燥剂:浓硫酸、P2O5、硅胶 1)浓硫酸(强氧化性酸) 2)P2O5(酸性白色粉末)、 3)硅胶(它是半透明,内表面积很大的多孔性固体,有良好的吸附性,对水有强烈的吸附作用。含有钴盐的硅胶叫变色硅胶,没有吸水时呈蓝色,被水饱和后呈粉红色。) 2、碱性干燥剂:碱石灰、CaO、固体NaOH 1)碱石灰(它是白色固体,主要成分CaO和NaOH)、 2)CaO(它是白色固体, 碱性氧化物)、 3)固体NaOH(强碱) 3、中性干燥剂:无水CaCl2、CuSO4 1)无水CaCl2(白色多孔固体)、 2)CuSO4(白色粉末,吸水程度较小,一般用来检验水的存在,吸水后变成蓝色CuSO4·5H20) 二、常见气体的分类 中学阶段常见的气体,按酸碱性也可分为三种: ①酸性气体:CO2、SO2、NO2、Cl2、HCl、H2S、HBr、HI等 ②碱性气体:NH3 ③中性气体:N2、O2、H2、CH4等 三、干燥剂的选择 1、总的原则:(酸碱性要一致且不能发生反应) a、酸性干燥剂不能干燥碱性气体,可以干燥酸性气体及中性气体; b、碱性干燥剂不能干燥酸性气体,可以干燥碱性气体及中性气体; c、中性干燥剂可以干燥各种气体。但这只是从酸碱反应这一角度来考虑, 2、同时还应考虑到规律之外的一些特殊性.如气体与干燥剂之间若发生了氧化还原反应,或生成络合物,加合物等,就不能用这种干燥剂来干燥该气体了。 特殊性: ①不能用浓硫酸干燥H2S, HBr,HI等还原性 ...气体,因为二者会发生氧化还原反应。如 H2S+H2SO4=2H2O+SO2+S↓,H2SO4+HBr= Br2+SO2+2H2O, H2SO4+HI= I2+SO2+2H2O ②不能用无水硫酸铜干燥H2S气体,二者会发生反应:CuSO4+H2S=H2SO4+CuS↓ ③不能用无水硫酸铜干燥NH3,二者可发生反应生成络合物:CuSO4+NH3={Cu(NH3)4}SO4 ④不能用无水CaCl2干燥NH3,二者会发生反应生成一些加合物:CaCl2+8NH3=CaCl2·8NH3
干燥剂的合理使用
干燥剂的合理使用 有机化合物在进行波普分析或定性、定量化学分析之前以及固体有机物在测定熔点前,都必须使它完全干燥,否则将会影响结果的准确性。液体有机物在蒸馏前也常要先进行干燥以除去水分,这样可以使液体沸点以前的馏分大大减少;有时也是为了破坏某些液体有机物与水生成的共沸化合物。另外很多有机化学反应需要在“绝对”无水条件下进行,不但所有的原料及溶剂要干燥,而且尚要防止空气中潮气浸入反应容器。因此在有机化学实验中,试剂和产品的干燥具有十分重要的意义。 一,基本原理 干燥方法大致可以分为物理法和化学法两种。物理法有吸附、分馏、利用共沸蒸馏将水分带走等方法。近年来还常用离子交换树脂和分子筛等来进行脱水干燥。化学法是以干燥剂来进行去水,其去水作用又可分为两类:(1)能与水可逆地结合生成水合物,如氯化钙、硫酸镁等;(2)与水发生不可逆的化学反应而生成一个新的化合物,如金属钠、五氧化二磷。目前应用最广泛的是第一类干燥剂。下面以无水硫酸镁为例讨论这类干燥剂的作用。 用无水硫酸镁来干燥含水的有机液体时,无论加入多少量的无水硫酸镁,在25℃时所能达到的最低水蒸气压力为1毫米汞柱,也就是说全部除去水分是不可能的。如加入的量过多,将会使有机液体的吸附损失更多;如加入的量不足,不能达到一水合物,则其蒸汽压力就要比1毫米汞柱高。这说明了在萃取时为什么一定要将水层尽可能分离干净,在蒸馏时为什么会有沸点前的馏分。通常这类干燥剂成为水合物需要一定的平衡时间,这就是液体有机物进行干燥时为什么要放置较久的道理。因为它吸收水分是可逆的,温度升高时蒸汽压也升高,因此液体有机物在进行蒸馏以前,必须将这类干燥剂滤除。 二,液体有机化合物的干燥 1.干燥剂的选择 液体有机化合物的干燥,通常是将干燥剂直接与之接触,因而使用的干燥剂必须不与该物质发生化学反应或催化作用,不溶解于该液体中。例如酸性物质不能用碱性干燥剂,碱性物质也不能用酸性干燥剂。有的干燥剂能与某些被干燥的物质生成络合物。如氯化钙易与醇类。胺类形成络合物,因而不能用来干燥这些液体。强碱性干燥剂如氧化钙、氢氧化钠能催化某些醛类或酮类发生缩合、自动氧化等反应,也能使脂类或酰胺类发生水解反应。氢氧化钾(钠)还能显著地溶解于低级醇中。在使用干燥剂时,还要考虑干燥剂的吸水容量和干燥性能。吸水容量是指单位重量干燥剂所吸得水量;干燥效能是指达到平衡是液体干燥的程度,对于形成水合物的无机盐干燥剂采用吸水后结晶水的蒸汽压来表示。例如,硫酸钠形成10个结晶水的水合物,其吸水容量达1.25.氯化钙再多能形成6个结晶水的水合物,其吸水容量为0.97。两者在25℃时水蒸气压分别为1.92及0.30毫米汞柱。因此,硫酸钠的吸水量较大,但干燥效能弱;而氯化钙的吸水量较小,但干燥效能强。所以在干燥含水量较多而又不易干燥的(含有亲水性基团)化合物时,常先用吸水量较大的干燥剂除去大部分水分,然后再用干燥效能强的干燥剂干燥。通常第二类干燥剂的干燥效能较第一类为高,但吸水容量较小,所以都是用第一类干燥剂干燥后,再用第二类干燥剂除去残留的微量水分,而且只是在需要彻底干燥的情况下才使用第二类干燥剂。此外选择干燥剂还要考虑干燥速度和价格。常用过自己的性能见表1: 表1各类有机物常用的干燥剂 化合物类型 干燥剂 烃 CaC12 、Na 、P2O5 卤代烃 CaC12、MgSO4 、、P2O5、Na2SO4 醇 K2CO3、MgSO4、CaO、Na2SO4 醚
常用干燥剂性能的说明
常用干燥剂性能的说明 化学干燥剂可分二类,一类是与水可以生成水合物的,如硫酸、氯化钙、硫酸铜、硫酸钠、硫酸镁和氯化镁等。另一类与水反应后生成其他化合物的,如五氧化二磷、氧化钙、金属钠、金属镁、金属钙和碳酸钙等,必须注意的是有些化学干燥剂是一种酸或与水作用后变为酸的物质,也有一些化学干燥剂是碱或与水作用后变为碱的物质,在用这些干燥剂时就应考虑到被干燥物的酸碱性质。应用中性盐类作干燥剂时,如氯化钙,它能与多种有机物形成分子复合物,也要加以考虑。因此在选择干燥剂时首先应了解干燥剂和被干燥物的化学性质是否相容,下面介绍一些实验室常用的干燥剂的性能。 一、氯化钙 对固体、液体和气体的干燥均可使用。有干燥能力的是含二分子结晶水的氯化钙CaCl22H2O,潮解吸水后成为含六分子结晶水的氯化钙CaCl26H2O加热至30℃时成CaCl24H2O,至200℃恢复为CaCl22H2O,如加热至800℃则水分完全失去,成为熔融的氯化钙,可以用氯化钙脱水的化合物有烃类、卤代烃类、醚类,对沸点较高的溶剂,干燥后重蒸溶剂时,应将干燥剂滤出,不可一起加热蒸馏,以免被吸去的水分在加热时再度放出,它的缺点是脱水能力不强,并且能和多种有机物生成复合物,如醇、酚、胺、氨基酸、脂肪酸等,因此不可用作为醇等溶剂的脱水于燥剂。 对结构不明的化合物溶液,就不宜使用氯化钙来干燥。 二、硫酸钠 无水硫酸钠可用于中性,酸性和碱性物质的脱水干燥剂,对有机物没有反应,可以广泛应用,吸水后成为带有十分子结晶水的硫酸钠Na2SO4?10H2O,但脱水能力弱而且作用慢,不能用加热来促使脱水,因为含水的硫酸钠在33℃以上又失结晶水,对于含水量较多的醇类不宜用作脱水干燥剂,适用于醚、苯、氯仿等溶剂,新买来的应加热焙干后使用。 三、硫酸镁 性质同硫酸钠,吸水效力强一些,与水生成水合物含七分子结晶水。 四、硫酸铜 制备无水醇时常加以应用,是相当弱的干燥剂。无水硫酸铜浅绿色,生成水合物质变兰CuSO45H2O,根据变兰的反应说明吸水过程在进行,故可用来检验溶剂的无水程度,CuSO45H2O加热至100℃失去四分子结晶水可以由此再生。加热温度不宜增至220——230℃否则就生成碱性盐类失去水合的效力。 五、硫酸钙 无水硫酸钙由石膏加热至160一180℃而得,如在500—700℃灼烧所得的无 水硫酸钙,几乎不能与水结合。它是强烈干燥剂之一,但吸水量不大,只能达到其全重量的6.6%,吸水后形成相当稳定的水合物2CaSO4?H2O,它和其它形成水合物的盐类不同,被干燥的有机液体不需要把它事先分开,可以放在一起蒸馏,甲醇、乙醇、乙醚、丙酮、甲酸和醋酸用硫酸钙脱水可得良好的效果。 六、苛性碱 苛性钠(NaOH)和苛性钾(KOH)是碱性干燥剂,适用于干燥有机碱类,如氨气、胺类、吡啶、重氮甲烷,生物碱等,作为干燥器内的干燥剂,用来排除被干燥物质挥发出来的酸性杂质时,应用更多,苛性钾的效力较苛性钠大60倍,对于酸性物或酮,醛等均不适用。 七、碳酸钾 无水碳酸钾的碱性比苛性碱弱,应用范围较广一些,除适用于碱性物质外,对醇类也适用。 八、氯化钙 俗称生石灰,也是一种碱性干燥剂,实验室常用来制造无水乙醇,因为来源方便,生成氢氧化钙不溶于乙醇,要得到绝对无水的乙醇,需要用过量很多的氧化钙,对1克水要5克块状氧化钙(理论量是3.11克)干燥有机碱液体也可用之,氧化钙不适用于甲醇,因CaO、H2O、CH3OH三者间与形成的复合物成一平衡,不完全脱水,而且要吸收20%的甲醇。 九、金属钠 金属钠有很强的脱水作用,广泛被应用于各种惰性有机溶剂的最后干燥,如用于乙醚、苯、甲苯、石油醚等,由于金属钠有可工塑性,脱水时可将钠块周围的杂质切去,用压钠机压成条状故入置有溶剂的容器内,这样使金属钠与液体接触的表面大大增加,不致由于金属钠含有的杂质在钠块表面形成一层薄膜,妨碍进一步与水作用,必须注意对CHCl3,CCl4及其他含有-OH,>C=O等反应性强的官能团的溶剂都不能用金属钠脱水,含水量多的溶剂也不能用,因为钠遇
有机化学试题(省竟)
有机化学试题 一、填空: 1. 在普通蒸馏中,测定沸点的温度计安装的正确高度是(温度计水银球的上沿对准蒸馏支管的下沿)。 2.常压蒸馏时需要加沸石以防止(过热暴沸),如果沸腾后中途停止,再加热前应(重新加入沸石);如果沸腾后忘记加沸石,应(在稍冷后再加入沸石)。; 3. 液体化合物的干燥方法有(物理方法和化学方法二种)两种,其干燥剂用量约为产物重量的(5~10%),视(含水量)的多少而定。 4. 使用水蒸气蒸馏装置蒸馏产物,可使产物在低于(100 )度的情况下被蒸出。 5. 在减压蒸馏时,加料量应不多于蒸馏瓶容积的(1/2),在进行水蒸汽蒸馏时,加料量应不超过其蒸馏瓶容积的(1/3)。 6、从茶叶中提取咖啡因时,乙醇提取液浓缩后加入生石灰是为了(中和咖啡因中的丹宁酸)。 7. 在芳香族重氮化合物的偶合反应中,重氮盐有(吸电子)取代基,反应容易进行;芳烃有(给电子)取代基,易发生反应。 8. 在化学实验中,会使人药品中毒的途径有哪几条(口服,皮夫接触,呼吸)。 9、在回流操作中,液体蒸气上升的高度应不超过( 冷凝管有效长度的1/3 )。 10. 薄层板点样时,其样点的直径应不超过(2mm),每个样点间的距离应不小(1cm)。 11. 在制备格氏反应所使用的乙醚时,使用浓硫酸的目的是为除去醚中的( 水和乙醇),使用金属钠可除去醚中的(微量水、醇中的活泼氢和过氧化物)。 12.在由高锰酸钾氧化伯醇的反应中,在不同的介质中得到的氧化、还原产物是:在酸 ),在中性介质中(可控制得到醛和中(有机酸和Mn++)、在碱中(有机酸和MnO 2 )。 MnO 2 13 .制得的叔氯丁烷洗涤时,加入5%碳酸氢钠的作用是(中和酸)。 14、在乙酰苯胺中加入稀硫酸回流发生的反应是(水解消除乙酰基),得到的产物是(苯胺的硫酸盐)。 15、把制备三苯甲醇的溶液蒸出乙醚后进行水蒸气蒸馏,在冷凝管中结出的白色固体粉末是(联苯)。 16、在金属钠与乙酸乙酯作用制备乙酰乙酸乙酯中,使用高纯度的乙酸乙酯与金属钠不发生缩合反应,而使用市售的乙酸乙酯则能发生反应,反应中真正起催化作用的是(醇钠)。 17、测定熔点用的毛细管直径约为(0.9~1.2mm),其装载样品的高度约为(2~3mm)。 18、用有机溶剂重结晶制备热溶液时要采用(回流)装置。 19、用同样多的溶剂萃取,多次萃取比一次萃取的效果(要好)。 20、液体物质以一定比例在一固定温度下沸腾,含有这中比例的混合物称做(恒沸物)。 21、能在两相间转移负(正)离子,并能提高化学反应速度的试剂被称为(相转移催化剂)。 22、在蒸馏操作中,在达到液体的沸点之前常常已经有一些液体被蒸馏出来,接得的这一部分液体称为(前馏分)。 23、没有α-H的醛(甲醛、苯甲醛、呋喃甲醛),在强碱作用下发生自身的氧化还原反应,一半分子被氧化,一半分子被还原,这种反应称为(Cannizzaro反应)。 24、在重结晶时往往需要加入脱色剂煮沸以除去其中的(有色杂质)和(树脂状)杂 5%)。 质。脱色作用的原理是(物理吸附),脱色剂的用量一般为粗产物重量的(1 ~ 25、准确测定有机物熔点的关键是(控制好加热速度)。
高中化学常见干燥剂归纳
高中化学常见干燥剂归纳整理 1.高中化学常见的干燥剂有哪些 浓硫酸、五氧化二磷 固体烧碱、石灰和碱石灰(氢氧化钠和氧化钙的混合物)无水氯化钙、无水硫酸镁 无水硫酸铜 2.分类及使用 常用的干燥剂有三类 第一类为酸性干燥剂。有浓硫酸、五氧化二磷、硅胶等; 第二类为碱性干燥剂,有固体烧碱、石灰和碱石灰(氢氧化钠和氧化钙的混合物)等; 第三类是中性干燥剂,如无水氯化钙、无水硫酸镁等。 常用干燥剂的性能和用途如下: 1.浓H 2SO 4:具有强烈的吸水性,常用来除去不与H 2SO 4反应的气体中的水分。例如常作为H 2、O 2、CO 、SO 2、N 2、HCl 、CH 4、CO 2、Cl 2等气体的干燥剂。 2.无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K 。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3.无水硫酸镁:有很强的干燥能力,吸水后生成MgSO 4·7H 2O 。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。 4.固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。常用来干燥氢气、氧气和甲烷等气体。 5.变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH 3、 O 2、 N 2等。 6.活性氧化铝(Al 2O 3):吸水量大、干燥速度快,能再生(400 -500K 烘烤)。 7.无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。 8.硫酸钙:可以干燥H 2 、O 2 、CO 2 、CO 、N 2 、Cl 2、HCl 、H 2S 、 NH 3、 CH4等。 注:无水硫酸铜(CuSO 4)(无水硫酸铜成白色)也具有一定的干燥性,并且吸水后变成蓝色的五水硫酸铜(CuSO 4·5H 2O ),但一般不用来做干燥剂。 3.干燥剂的选择 由上述可知、对一些气体的干燥剂可作如下选择。
干燥剂标准介绍
干燥剂标准介绍 1、药品食品干燥剂相关标准 药品食品用干燥剂的标准主要是由国家食品药品监督管理局制定的药品包装容器(材料)标准:《药用固体纸袋装干燥剂标准》YBB00122005。 该标准规定了对“固体制剂滤纸袋包装的细孔球型硅胶干燥剂”的要求,其中除了对干燥剂袋外观、强度,吸附剂的含水率、吸湿率等干燥剂基本性能要求外,着重就干燥剂在有害物质含量(如:砷含量等),微生物限度,脱色性能等方面进行了规定。 威胜针对药用食品用干燥剂,专门制定了两种产品标准,分别为《小圆柱干燥剂产品标准》WS-QWS-824-55和《透明条连续式干燥剂产品标准》WS-QWS-824-56,这两种产品在满足YBB00122005的基础上,增加了吸湿速度要求、粉尘要求、交货方式等要求,另外有使产品更适合进行自动化分装的要求。具体差异见下表: WS-QWS-824-55 WS-QWS-824-56 备注 硅胶原料 含水率 ≤% ≤% ≤% WS 的产品要求含水 率更低,更注重干燥剂低湿下的吸湿能力;小圆柱 产品规定原料粒度是为 了更好的控制产品粉尘。 粒度 — ~4mm — 吸湿率 20%RH ,≥%; 50%RH ,≥%; 90%RH ,≥%; 20%RH ,≥%; 50%RH ,≥%; 20%RH ,≥%; 50%RH ,≥%; 包材 荧光测 试 不得含有 不得含有 — 由于透明条连续式干燥剂的包材以及小圆柱干燥剂的外壳均为塑料,其理化性能指标还参照了YBB00122002以及YBB00172004中的相关规定。 坤含量 ≤% — ≤% 铅含量 ≤% ≤% ≤% 脱色试 验 无色 无色 无色 溶剂残留量 ≤10mg/m2 ≤10mg/m2 ≤10mg/m2 干燥剂袋 外观 干净整洁无破损 干净整洁无破损 干净整洁无破损 吸湿速度要求的制定,能使干燥剂在快速恒定吸收水分、控制湿度方 面有更好的表现。 牢度(抗跌性) 1.2m 高跌 落无破损 1m 高5次跌落无破损 1m 高5次跌落 无破损 粉尘 — 无粉尘 无粉尘 吸湿速 度 — 25度40%RH 25度60%RH 下
硅胶干燥剂的用途
胶干燥剂是透湿性小袋包装的不同品种的硅胶,主要原料硅胶是一种高微孔结构的含水二氧化硅,无毒、无味、无嗅,化学性质稳定,具强烈的吸湿性能,是一种高活性吸附材料。通常是用硅酸钠和硫酸反应,并经老化、酸泡等一系列后处理过程而制得。硅胶属非晶态物质,其形状透明不规则球体,其化学分子式为mSiO2·nH2O。因而广泛用于仪器、仪表、设备器械、皮革、箱包、鞋类、纺织品、食品、药品等的贮存和运输中控制环境的相对湿度,降低和减缓物品受潮,霉变和锈蚀。 硅胶有很强的吸附能力,对人的皮肤能产生干燥作用,因此,操作时应穿戴好工作服。若硅胶进入眼中,需用大量的水冲洗,并尽快找医生治疗。 硅胶本身是一种中性物质,除与强碱、强酸在一定条件下发生反应外,不会与其他任何物质发生反应。同时,硅胶也是唯一通过美国FDA认证,可与药品、食品直接接触使用的干燥剂。 如果硅胶干燥剂发生误食后,应及时就医。通常它不会对人体造成伤害,也不会被人体吸收,但并不是每种硅胶干燥剂都是安全的,需要通过医生诊断制定治疗方式。 质量指标符合HG/T2765-2005 单位吸附能力:吸附量RH=20%时≥10% RH=40%时≥20%RH=90%时≥30% 注:按GB10455-89标准:在RH=90%时合格品≥28% 一等品≥29% 优等品≥30%常用规格:0.5g、1g、2g、3g、5g、10g、20g、30g等 包装材料:复合纸、无纺纸、复合无纺纸、杜邦纸、OPP膜 硅胶干燥剂具有较强的吸湿能力,因此应贮存在干燥地方。包装与地面之间要有搁架。包装物有钢桶、纸桶、纸箱、塑料瓶、聚乙烯塑料复合袋、柔性集装袋等。具体包装规格见分类产品说明。运输过程中应避免雨淋、受潮和爆晒。 用途 药品、机械、光学电子、精密仪器、仪表、种子、加工食品、茶叶、各种化纤纺织、皮鞋、皮革、运动鞋以及文物档案、照相机、工艺美术品等一切需要防潮防霉的物品,应用十分广泛。具体说明如下 1、硅胶干燥剂可用于瓶装药品、食品的防潮。保证内容物品的干燥,防止各种杂霉菌的生长。
干燥剂的保质期是多久
干燥剂的保质期是多久 干燥剂在使用上都是有时间限制的,都是存在保质期的,不是说干燥剂就可以无限的使用,所以说对其保质期需要多加了解,那么干燥剂的保质期是多久? 一般的经常使用的一年以后就该换了吧!及时颜色仍然能烘回来,可能效果已经没有了。 干燥剂使用分类说明 医药保健品、生物试剂、食品行业专用干燥剂。专用干燥剂特点:卫生要求高,包装材料通过美国FDA论证,产品小巧高效、精致环保,有较好的相容性和化学稳定性。 按应用环境区分,干燥剂一般为三种情况: (1)在小环境中使用:干燥剂直接放在瓶、罐或其他密闭的小
袋中,使小环境中的物品保持干燥。 (2)在中环境中使用:干燥剂直接放在包装的纸箱(或包装桶、袋)中使用,以避免包装中的物品受潮。 (3)在大环境中使用:干燥剂直接放在类似仓库、集装箱中使用,以达到控制大环境湿度的目的。 目前,市面上的食品干燥剂大致有4种: 一种是透明的硅胶,没有毒性,误食后不需做任何处理;另一种是三氧化二铁,咖啡色的,具有轻微的刺激性;还有两种白色的粉末,一种是氯化钙,只有轻微的刺激性;另一种是氧化钙,也就是人们常说的生石灰,是白色或灰白色的块状物,有很强的吸收空气中水分的功能,因氧化钙遇水变成氢氧化钙的过程中释放热量,所以会灼伤人的眼睛、口腔或食道。同时,氢氧化钙呈碱性,对口咽、食道有腐蚀作用;如溅入眼中还会引起结膜和角膜的损伤。但由于石灰干燥剂成本相对较低,而吸湿率却可达30%左右,且可始终具有良好的吸
湿性能,因此被海苔、米饼、糖果、鱼干等干燥度要求较高的儿童食品类包装广泛应用。 前面两种是不溶于水的,后面两种溶于水.目前市面上用的最多的都是生石灰,其实这些都算不上有毒,基本都是腐蚀性物质。 干燥剂的保质期上面进行了介绍,不同干燥剂的保质期时间都是有差别的,要多了解易爆物品知识,通过就可以对这些知识有所了解,比如生活中常见的干燥剂有哪些等都可以有所熟悉。
常用干燥剂个作用及原理
常用干燥剂个作用及原理 干燥剂是指能除去潮湿物质(固态、液态或气态)中水分子的物质。干燥剂根据其干燥原理可分为化学干燥剂和物理干燥剂两类。 一. 化学干燥剂 化学干燥剂是一些能吸收水分并常伴有化学反应的物质。常见的有:、浓、 等。 化学干燥剂的蒸气压比水蒸气的蒸气压要小,结果空气中或潮湿物质中的水蒸气不断凝聚进入干燥剂,并生成结晶水合物或相应的酸或碱。上述物质与水发生反应的方程式为: 碱石灰是另一例化学干燥剂,易吸收水份和,生成, ,既可以用作干燥剂又可以用作的吸收剂。 化学干燥剂的使用原则是,用于干燥气体的干燥剂不能与被干燥的气体发生反应。一般来说,酸性气体如等可以用酸性或中性干燥剂干燥,但不能用碱性干燥剂干燥;碱性气体如等可以用碱性或中性干燥剂干燥,但不能用酸性干燥剂干燥;中性气体如等用酸性、碱性或中性干燥剂干燥都可以;具有还原性的气体如等不能用浓硫酸等氧化性干燥剂干燥。同时,因能与发生氨合反应生成氨合物而不能用无水氯化钙干燥。常见干燥剂与应用如下表所示。 二. 物理干燥剂 能吸收水分但不伴有化学反应的干燥剂称为物理干燥剂。这类干燥剂常见的是硅胶。 硅胶又叫氧化硅胶和硅酸凝胶,化学式可用来表示。它是一种无色透明
或乳白色颗粒,一般约含水3%~7%,吸湿量可达40%。市售商品中常含有,称为变色硅胶。利用它在吸水和脱水中发生的颜色变化来指示硅胶吸湿程度。其过程可用下式表示: 硅胶作为干燥剂,其干燥原理是依靠吸附作用来除去潮湿物质中的水分子,即通过固体表面的质点与各种气体、液体等中的水分子发生相互吸引力而将其吸附在固体物质表面上。这类物质大多有很多的孔隙,有着巨大的表面积。 硅胶可用可溶性硅酸盐与盐酸反应而制得,反应的实际过程很复杂,反应方程式一般可 写为: 硅酸在水里的溶解度不大,但生成后并不立即沉淀,而是硅酸分子之间发生缩合形成硅酸凝胶。将硅酸凝胶充分洗涤除去可溶性盐类后,干燥脱水即成为多孔性固体物质,称为硅胶。 具有吸附作用能作为干燥剂的物理干燥剂,除了硅胶外,还有活性炭、活性氧化铝等。
有机常用干燥剂介绍.jsp
各类有机物常用干燥剂介绍 1,CaCL2,中性,与水作用产物:CaCL2.nH2O,n=1,2,4,6。适用范围:烃类,卤代烃,烯酮,醚,硝基化合物,中性气体,氯化氢。非适用范围:醇,胺,氨,酚,酯,酸,酰胺和某些醛酮。特点:吸水量大,作用快,效力不高,是良好的初步干燥剂。廉价,含有碱性杂质氢氧化钙。2,硫酸钠中性,与水作用产物:七水和十水硫酸钠。适用范围:醇,酯,醛,酮,酸,酰胺,卤代烃,硝基化合物等不能用氯化钙干燥的物质。吸水特点:吸水量大,作用慢,效力低,是良好的初步干燥剂。 3,硫酸镁中性,与水作用产物:一水和七水硫酸镁。适用范围:醇,酯,醛,酮,酸,酰胺,卤代烃,硝基化合物等不能用氯化钙干燥的物质。特点:较硫酸钠作用快,效力高。 4,硫酸钙中性,与水作用产物:CaSO4.1/2H2O,适用范围:烷,芳香烃,醚,醇,醛,酮。特点:吸水量小,作用快,效力高,可先用吸水量大的干燥剂初步干燥后再用。 5,碳酸钾碱性,与水作用产物:1.5水和2水合物。适用范围:醇,酮,脂,胺和杂环等碱性化合物,非适用范围:酸,酚及其他酸性化合物。 6,硫酸强酸性。与水作用产物:H3OSO4。适用范围:脂肪烃,烷基卤代物。非适用范围:烯,醚,醇及弱碱性化合物。特点:脱水效力高。 7,氢氧化钾,氢氧化钠强碱性。适用于胺,杂环等碱性化合物干燥。非适用于醇,酯,醛酮,酸,酚和酸性化合物干燥。其特点是干燥快速有效。 8,金属钠强碱性。适用于醚,三级胺,烃中的痕量水干燥。对碱土金属或对碱敏感物,醇等不适用。其特点是效力高,作用慢,需经初步干燥后才可再用,干燥后需蒸馏。 9,P2O5,酸性,适用于醚,烃,卤代烃,腈中痕量水分,酸溶液,二硫化碳。不适用于醇,酸,酮,胺,,碱性化合物,氯化氢,氟化氢等的干燥。其特点是吸水效力高,干燥后需蒸馏。10,CaH2,碱性,适用于碱性,中性,弱酸性化合物干燥,不适用于对碱敏感的化合物干燥。其特点是效力高,作用慢,先经初步干燥再用,干燥后需蒸馏。 11,CaO,Bao,碱性,适用于低级醇类,胺。其特点是效力高,作用慢,干燥后需蒸馏。 12,3A,4A分子筛,中性,是物理吸附,适用于各类有机物,不饱和烃气体。其特点是干燥快速高效,经初步干燥后可再用。 13,硅胶,常用于干燥器,不适用于氟化氢干燥。
干燥剂的干燥效率
几种常用干燥剂的干燥效率 磷的燃烧产物是五氧化二磷,根据蒸气密度的测定,五氧化二磷的化学式是P4O10,它对水有很强的亲和力,吸湿性强,在空气中吸收水分迅速潮解,因此常用它作气体和液体的干燥剂。 比较干燥剂的干燥效率,可把已被水蒸气饱和的空气,在298K时通过相应的干燥剂,然后测定在1m3被干燥的空气中,尚有剩余的水蒸气含量(g)。水蒸气含量愈少说明该干燥剂的干燥效率愈高。 几种常用干燥剂的干燥效率 干燥剂的干燥效率 干燥剂每立方米水蒸气含量 P205 2*10的-5次方 Mg(ClO4)2 (无水) 5*10的-4次方 KOH(熔凝) 0.002 Al2O3 0.003 H2SO4(100%) 0.003 CaSO4 0.004 MgO 0.008 CaBr2 0.14 NaOH(熔凝) 0.16 CaO 0.2 CaCl2(粒状) 0.14~0.25 H2SO4(95.1%) 0.3 CaCl2(熔凝) 0.36 ZnCl2 0.8 ZnBr2 1.1 CuSO4 1.4 适用于气体干燥的常用干燥剂的性能和用途 1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H 2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。 3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。 4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。党用来干燥氢气、氧气、氨和甲烷等气体。 5、变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH3、O2、N2等 6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。 7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。 8、硫酸钙:可以干燥H2 。O2 。CO2 。CO 、N2 。Cl2、HCl 、H2S、NH3、CH4等 由上述可知、对一些气体的干燥剂可作如下选择。 气体名称常用干燥剂气体名称常用干燥剂 CO 浓H2SO4、CaCl2、P2O5H2S CaCl2 CO2 CaCl2、浓H2SO4、P2O5N2 浓H2SO4、CaCl2、P2O5 Cl2 CaCl2、浓H2SO4NH3 CaO、KOH或碱石灰 H2CaCl2、P2O5NO Ca(NO3)2 HBr CaBr2、ZnBr2 、O3 CaCl2 HCl CaCl2、浓H2SO4SO2 浓H2SO4、CaCl2、P2O5 HI CaI2
干燥剂在我们生活中有什么用
干燥剂在我们生活中有什么用? 食品干燥剂舍不得扔?原因是这四种! 吃零食的时候,经常会发现食品包装袋中有小袋干燥剂,通常情况下我们会把它扔掉,好奇的人会将它撕开,里面有时候是粉末,有时候是颗粒状,这到底能有什么用呢? 其实干燥剂的作用很简单,就是为了降低食品包装袋内的湿度,如果能降低食品包装内的湿度,是不是生活中其他地方也能用呢?bingo,说的对下面这几个方面,干燥剂就派上用场啦! 1、内衣裤干燥 洗完晾晒好的内衣裤,我们一定不要随意存放,毕竟是贴身衣服,为了保持干净卫生,避免和其他衣服交叉感染,还是用专门的内衣收纳盒存放比较好! 雨季马上到来,雨水增多,会增加潮气,为了防止内衣返潮,家中攒下来的干燥剂可就有大用处了。放到内衣收纳盒中,两三包,防潮效果很好哦! 2、粮食的干燥 家中除了大米、白面,还会储存一些谷类豆类食物,为了他们不变质防潮,尽量不要用塑料袋存放,还是要用专用的收纳盒存放。 这时就可以把食品中的干燥剂放到粮食收纳盒里,有人会觉得这样不太安全卫生,但其实只要干燥剂没有破损,放到它们中间是没有问题的,而且干燥剂是无味无毒的,不会影响日后食用,但是记得要经常更换干燥剂哦! 3、手机进水干燥 数码产品是很容易受潮的,拿手机来说,长时间不使用,放置位置不好,很容易受潮,尤其 是电池,所以手机不仅要找到干燥的地方存放,还要注意一下防潮措施。
找两三包干燥剂,放到手机存放的地方,能防止手机受潮,不影响使用。如果手机已经受潮或者进水,先用毛巾做一些擦干处理,但手法一定要轻柔哦,处理完以后再放点干燥剂巩固一下! 4、剪刀干燥 剪刀受潮很容易生锈啊,而且不容易去掉,影响锋利程度,使用很不方便,所以日常保养很重要。 平常留下来的食品干燥剂,就用上了,将剪刀收纳存放,用收纳盒或者收纳布袋都可以,再放置两三包高干燥剂就行,不只是剪刀,这样做其他工具也能得到保护,生锈事情就不会发生啦!
常用固体液体干燥剂
实验室中常用的干燥剂及其特性 1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H 2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。 2、无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快,能再生,脱水温度473K。吸水后形成含不同结晶水的水合物CaCl2·nH2O(n=1,2,4,6)。最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的干燥剂。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。 3、无水硫酸钠(Na2SO4):白色粉末状,吸水后形成带10个结晶水的硫酸钠 (Na2SO4·10H2O)。因其吸水容量大,且为中性盐,对酸性或碱性有机物都可适用,价格便宜,因此应用范围较广。但它与水作用较慢,干燥程度不高。当有机物中夹杂有大量水分时,常先用它来作初步干燥,除去大量水分,然后再用干燥效率高的干燥剂干燥。使用前最好先放在蒸发皿中小心烘炒,除去水分,然后再用。 4、无水硫酸镁(MgSO4):白色粉末状,吸水容量大,吸水后形成带不同数目结晶水的硫酸镁MgSO4·nH2O (n=1,2,4,5,6,7)。最终吸水产物为MgSO4·7H2O(48℃以下)。由于其吸水较快,且为中性化合物,对各种有机物均不起化学反应,故为常用干燥剂。特别是那些不能用无水氯化钙干燥的有机物常用它来干燥。 5、无水硫酸钙(CaSO4):白色粉末,吸水容量小,吸水后形成2CaSO4·H2O(100℃以下)。虽然硫酸钙为中性盐,不与有机化合物起反应,但因其吸水容量小,没有前述几种干燥剂应用广泛。由于硫酸钙吸水速度快,而且形成的结晶水合物在100℃以下较稳定,所以凡沸点在100℃以下的液体有机物,经无水硫酸钙干燥后,不必过滤就可以直接蒸馏。如甲醇、乙醇、乙醚、丙酮、乙醛、苯等,用无水硫酸钙脱水处理效果良好。 6、无水碳酸钾(K2CO3):白色粉末,是一种碱性干燥剂。其吸水能力中等,能形成带两个结晶水的碳酸钾(K2CO3·2H2O),但是与水作用较慢。适用于干燥醇、酯等中性有机物以及一般的碱性有机物如胺、生物碱等。但不能作为酸类、酚类或其他酸性物质的干燥剂。 7、固体氢氧化钠(NaOH)和氢氧化钾(KOH):白色颗粒状,是强碱性化合物。只适用于干燥碱性有机物如胺类等。因其碱性强,对某些有机物起催化反应,而且易潮解,故应用范围受到限制。不能用于干燥酸类、酚类、酯、酰胺类以及醛酮。 8、五氧化二磷(P2O5):是所有干燥剂中干燥效力最高的干燥剂。 P2O5与水作用非常快,但吸水后表面呈粘浆状,操作不便。且价格较贵。一般是先用其他干燥剂如无水硫酸镁或无水硫酸钠除去大部分水,残留的微量水分再用P2O5干燥。它可
常用干燥剂的性能和用途
常用干燥剂的性能和用途 1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H 2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。 2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。 3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。 4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。党用来干燥氢气、氧气、氨和甲烷等气体。 5、变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH3、O2、N2等。 6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。 7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。 8、硫酸钙:可以干燥H2。O2。CO2。CO 、N2。Cl2、HCl 、H2S、NH3、CH4等。 由上述可知、对一些气体的干燥剂可作如下选择。 气体名称常用干燥剂气体名称常用干燥剂 CO 浓H2SO4、CaCl2、P2O5H2S CaCl2 CO2CaCl2、浓H2SO4、P2O5N2浓H2SO4、CaCl2、P2O5 Cl2CaCl2、浓H2SO4NH3CaO、KOH或碱石灰 H2CaCl2、P2O5NO Ca(NO3)2 HBr CaBr2、ZnBr2O3CaCl2 HCl CaCl2、浓H2SO4SO2浓H2SO4、CaCl2、P2O5 HI CaI2 液体适用干燥剂 Drying Agents for Liquids
高中化学常用干燥剂
高中化学常用干燥剂有哪些? 1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H 2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。 2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。 3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。 4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。常用来干燥氢气、氧气和甲烷等气体。 5、变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH3、O2、N2等 6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。 7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。 8、硫酸钙:可以干燥H2 。O2 。CO2 。CO 、N2 。Cl2、HCl 、H2S、NH3、CH4等 1 实验室中常用的干燥剂及其特性 实验室中常用的干燥剂及其特性 ①无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快。吸水后形成含不同结晶水的水合物CaCl2·nH2O(n=1,2,4,6)。最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的干燥剂。 ②无水硫酸钠(Na2SO4):白色粉末状,吸水后形成带10个结晶水的硫酸钠(Na2SO4·10H2O)。因其吸水容量大,且为中性盐,对酸性或碱性有机物都可适用,价格便宜,因此应用范围较广。但它与水作用较慢,干燥程度不高。当有机物中夹杂有大量水分时,常先用它来作初步干燥,除去大量水分,然后再用干燥效率高的干燥剂干燥。使用前最好先放在蒸发皿中小心烘炒,除去水分,然后再用。
干燥剂的除水原理
干燥剂的除水原理 干燥剂是我们在日常生活中十分熟悉的东西,食品为了减少包装中的水分含量防止腐化也会使用干燥剂,衣服等各个方面也需要使用干燥剂。 干燥剂有两种除水方式,一种是化学吸附,一种是物理吸附。 物理吸附比如硅胶就是通过物理方式直接吸收空气中的水含量。 化学吸附则是让空气中的水和干燥剂发生化学反应,生成水合物。 一、化学吸附 1、生石灰干燥剂:主要成分为氧化钙,其吸水能力是通过化学反应来实现的,因此吸水具有不可逆性。不管外界环境湿度高低,它能保持大于自重35%的吸湿能力,更适合于低温度保存,具有极好的干燥吸湿效果,而且价格较低。可广泛用于食品、服装、茶叶、皮革、制鞋、电器等行业。目前最常见“雪饼”中使用该类型干燥剂。 但是生石灰干燥剂由于具有强碱腐蚀性,经常发生伤害小孩或老人眼睛的事情,目前已逐渐被淘汰。 2、氯化钙干燥剂:主要原料是氯化钙,是采用优质碳酸钙和盐酸为原料,经反应合成、过滤、蒸发浓缩、干燥等工艺过程精制而成。白色多孔块状、粒状或蜂窝状固体。味微苦,无臭。水溶液为无色。 主要用作无机化工生产其它各种钙盐的原料;也用作气体的干燥剂,生产醇、酯、醚和丙烯酸树脂时的脱水剂。在食品工业中用作钙质强化剂、固化剂、螯合剂、干燥剂等。 二、物理吸附 1、硅胶干燥剂:是透湿性小袋包装的不同品种的硅胶,主要原料硅胶是一种高微孔结构的含水二氧化硅,无毒、无味、无嗅,化学性质稳定,具强烈的吸湿性能,是一种高活性吸附材料。通常是用硅酸钠和硫酸反应,并经老化、酸泡等一系列后处理过程而制得。 硅胶属非晶态物质,其形状透明不规则球体,其化学分子式为mSiO2?nH2O。因而广泛用于仪器、仪表、设备器械、皮革、箱包、鞋类、纺织品、食品、药品等的贮存和运输中控制环境的相对湿度,防止物品受潮,霉变和锈蚀。 2、蒙脱石干燥剂:外观形状为灰色小球,最适宜在50℃以下的环境中吸湿。当温度高于50℃,蒙脱石的”放水”程度便大于”吸水”程度。但蒙脱石的优势在于价格便宜。 蒙脱石干燥剂也称膨润土干燥剂、陶土干燥剂。蒙脱石干燥剂颜色有:紫色、灰色、紫红。 蒙脱石干燥剂的特点:
生石灰做干燥剂
生石灰做干燥剂 干燥剂我们并不陌生,比如月饼中、饼干盒甚至于衣服、鞋子中都有干燥剂。干燥剂主要用于防湿保鲜,一般的干燥剂有氯化镁、氯化钙等。 生石灰可以与水反应生成氢氧化钙,故可以做干燥剂。干燥剂使用后生成的氢氧化钙具有腐蚀性。所以一般生石灰做干燥剂时外包装袋都会写有“请勿食用”的字样,这也是由于氢氧化钙的腐蚀性会对人身体有伤害。 生石灰做为干燥剂的应用: 在农村,它常用于畜禽栏舍的消毒,畜禽出栏后,将生石灰用水调成20%的石灰乳,涂刷墙面和地面。某农户误将生石灰直接撒在猪圈中消毒,一段时间后发现猪的蹄部干燥开裂,有的甚至出现灼伤、溃疡,原因是生石灰与水反应会放出大量热。还有就是食品包装袋中的干燥剂等等。 在日常生活中,应用的最多的还是活性氧化铝与硅胶,它们是通过物理法进行吸水处理的。而生石灰或者熟石灰作为干燥剂通过化学方式吸收水分子并改变其化学结构,变成另一种物质,从而达到保持干燥的效果。 那么,生石灰做干燥剂的具体原理是什么呢?且听苏州博盛工贸细细道来:生石灰做干燥剂的原理: 生石灰做干燥剂的原理是由于生石灰吸水后能变成熟石灰,化学反应式就是CaO+H2O=Ca(OH)2,生成的氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,用过一段时间后,干燥剂中的物质最多有氧化钙、氢氧化钙、碳酸钙三种。 有些食品包装袋内的干燥剂是铁粉,铁粉与水、氧气充分接触时容易生锈,生成的铁锈的主要成分是氧化铁,氧化铁呈红色。铁和水、氧气共同作用时生成铁锈,所以与生石灰干燥剂比较,铁粉除了做干燥剂外,还可做吸氧剂,比生石灰更能延长食品保质期。 结语:生石灰做为干燥剂时有一个放热的过程,有一定的危险性,所以物流干燥剂一般会定义生石灰干燥剂做为危险品处理,目前,生石灰用做干燥剂也越来越少了,不过由于价格便宜成本低所以还有一定的使用空间。
常见的气体干燥剂有哪些
常见的气体干燥剂有哪些 1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。例如常作为H 2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。 2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。干燥速度快,能再生,脱水温度473K。一般用以填充干燥器和干燥塔,干燥药品和多种气体。不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。 3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。吸水作用迅速,效率高,价廉,为一良好干燥剂。常用来干燥有机试剂。 4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。常用来干燥氢气、氧气和甲烷等气体。 5、变色硅胶:常用来保持仪器、天平的干燥。吸水后变红。失效的硅胶可以经烘干再生后继续使用。可干燥胺、NH3、 O2、 N2等 6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K 烘烤)。 7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。 8、硫酸钙:可以干燥H2、O2、CO2、CO 、N2、Cl2、HCl 、H2S、 NH3、CH4等。 实验室中常用的干燥剂及其特性 ①无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快。吸水后形成含不同结晶水的水合物CaCl2·nH2O(n
= 1,2,4,6)。最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。但是氯化钙能水解成Ca(OH)2或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。如与乙醇生成CaCl2·4C2H5OH、与甲胺生成 Ca Cl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的干燥剂。上海坪尧贸易有限公司为美国CPI合成润滑油在中国市场的总代理。除专业供应BASF干燥剂外,主要市场有碳氢气体压缩机油,冷冻压缩机油,空气压缩机油,冰箱及冰柜压缩机油,合成设备用油,食品级润滑油,食品级低温导热油,风力发电齿轮箱专用油等。 ②无水硫酸钠(Na2SO4):白色粉末状,吸水后形成带10个结晶水的硫酸钠(Na2SO4·10H2O)。因其吸水容量大,且为中性盐,对酸性或碱性有机物都可适用,价格便宜,因此应用范围较广。但它与水作用较慢,干燥程度不高。当有机物中夹杂有大量水分时,常先用它来作初步干燥,除去大量水分,然后再用干燥效率高的干燥剂干燥。使用前最好先放在蒸发皿中小心烘炒,除去水分,然后再用。上海坪尧贸易有限公司在合成冷冻油的市场主要提供以下的OEM指定用油:如:顿汉布什(Dunham-Bush)、开利Carrier(Carlyle)、格拉索GEA(Grasso)、世纪(Century)、谷轮(Copeland)、恩布拉科(Embraco)、博克(BOCK)、美优乐(Maneurop)、丹佛斯(Danfoss)、麦克维尔(Mcquay)、西亚特(CIAT)、J&E Hall(APV Baker)、特灵(Trane)、莱富康(Refcomp)、富士豪(Frascold)、GRAM、Vilter、布里斯托(Bristol)、克莱门特、Contour。普莱克斯(Praxair)、林德(Linde )、梅塞尔(MESSER)、法液空(Air Liquide) 、 Mycom, Toromont 。
