中级无机化学教案

中级无机化学教案
一教学重点
重点讲解第一章、第二章、第七章、及第九章,其中第九章因与普通无机化区别较大,在考题中所占比例小,稍微了解即可。
二教学难点
难点主要在于第一章中的分子轨道理论及VSEPR,第七章的晶体场理论,过渡金属化合物的电子光谱,最后
一章的EAN规则及其应用。
三教学内容
(一)引言
1 介绍本次考试试题结构:
填空题(共20个空,每空1分,共20分),选择题(共10小题,每题2分,共20分)回答问题(共8小题,1-4题每题6分,5-8题每题9分,共60分)
2 本次考试重要考察范围为
第一章原子、分子及元素周期性,第二章酸碱和溶剂化学第七章d区过渡元素(I)—配位化合物第九章
有机金属化合物簇合物
其中第九章为补充内容,考察量较少
(二)知识串讲
第一章原子、分子及元素周期性
要求掌握:
1 Slater规则计算电子的屏蔽常数
2 了解电负性的几种标度,理解环境对电负性的影响和基团电负性的概念
3 键参数价层电子对互斥理论分子对称性知识
4 单质及其化合物的一些性质的周期性变化规律
还要特别注意
5 掌握周期反常现象的几种表现形式及合理解释
一原子的性质
1 Slater屏蔽常数规则
将原子中的电子分组
(1s);(2s,2p);(3s,3p);(3d);(4s,4p);(4d);(4f);(5s,5p);(5d);(5f)等
位于某小组电子后面的各组,对该组的屏蔽常数σ=0,近似地可以理解为外层电子对内存电子没有
屏蔽作用;
同组电子间的σ=0.35 (1s例外,1s的σ=0.30);
对于ns或np上的电子,(n-1)电子层中的电子的屏蔽常数σ=0.85,小于(n-1)的各层中的电子
的屏蔽常数σ=1.00;
对于nd或nf上的电子,位于它左边的各组电子对它们的屏蔽常数σ=1.00。
2 电负性
电负性χ表示原子形成正负离子的倾向或化合物中原子对成键电子吸引能力的相对大小(并非单独原子的性质, 受分子中所处环境的影响)。有多种不同定义方法,定量标度也各不相同
①原子的杂化状态
原子的杂化状态对电负性的影响是因为s电子的钻穿效应比较强,s轨道的能量比较低,有较大的吸
引电子的能力。所以杂化轨道中含s成分越多,原子的电负性也就越大。
②键联原子的诱导作用
一个原子的电负性可因受周围原子诱导作用的影响而发生变化。例如,在CH3I中的碳的电负性就小
于CF3I中碳的电负性。其原因在于,F(3.98)的电负性远大于H(2.2),在F的诱导作用下,CF3I中C的电负性
增加,甚至超过了I(2.66)。结果使得在两种化合物中C-I键的极性有着完全相反的方向
二共价键分子的成键理论
2.1 几种典型分子轨道
σ轨道:原子轨道头对头方式重叠构成σ分子轨道。
σ重叠的电子云呈园柱型对称分布于键轴,s-s、s-p、px-px都可构成σ重叠。
π轨道:原子轨道以肩并肩方式重叠构成π分子轨道。
π分子轨道电子云对称分布于通过分子键轴的平面, py-py和pz-pz都可构成π重叠。
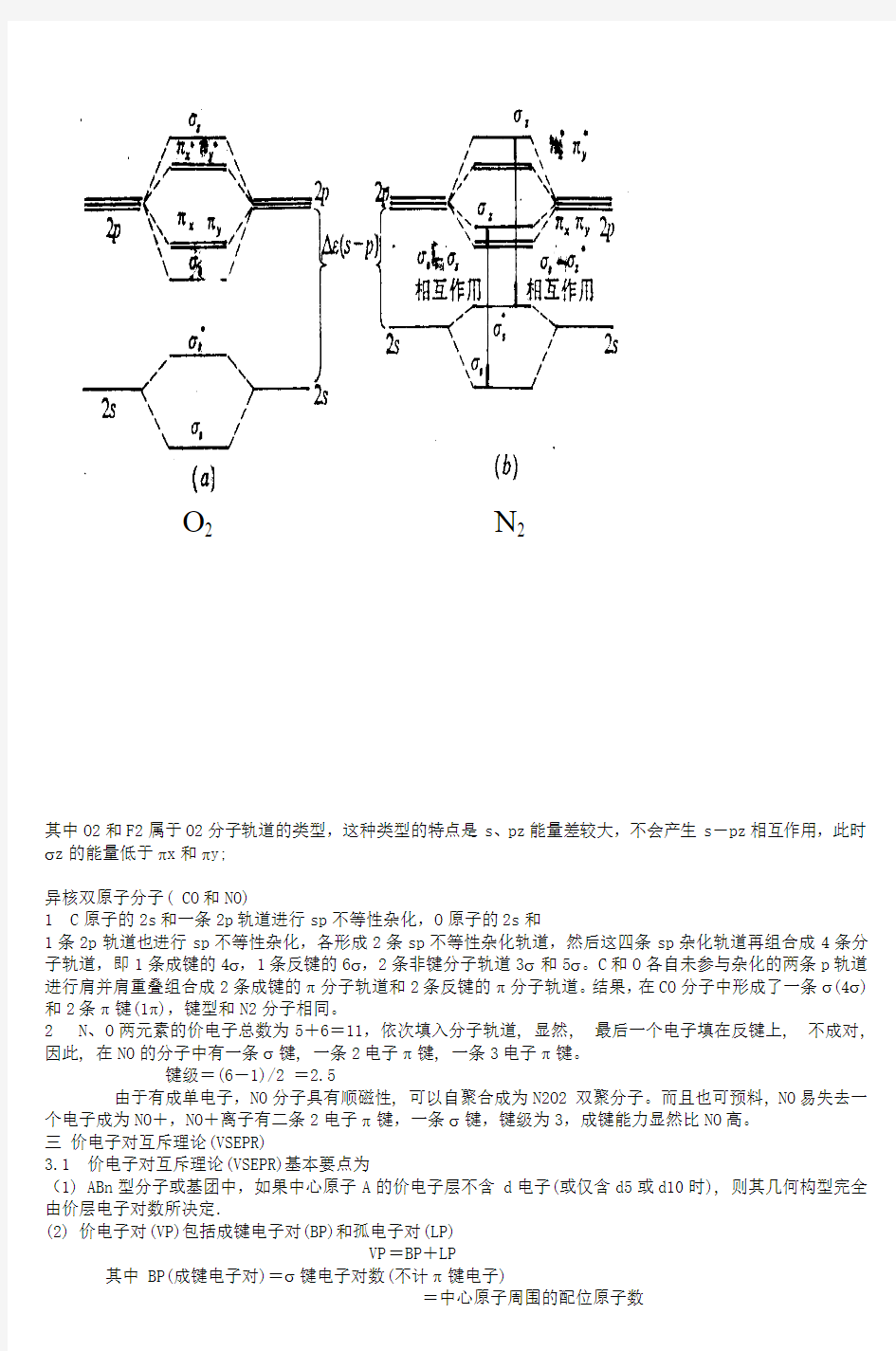
2.2 几种简单分子的分子轨道能级图
O2和N2代表了第二周期同核双原子分子的两种类型。
其中O2和F2属于O2分子轨道的类型,这种类型的特点是s 、pz 能量差较大,不会产生s -pz 相互作用,此时σz 的能量低于πx 和πy;
异核双原子分子( CO 和NO)
1 C 原子的2s 和一条2p 轨道进行sp 不等性杂化,O 原子的2s 和
1条2p 轨道也进行sp 不等性杂化,各形成2条sp 不等性杂化轨道,然后这四条sp 杂化轨道再组合成4条分子轨道,即1条成键的4σ,1条反键的6σ,2条非键分子轨道3σ和5σ。C 和O 各自未参与杂化的两条p 轨道进行肩并肩重叠组合成2条成键的π分子轨道和2条反键的π分子轨道。结果,在CO 分子中形成了一条σ(4σ)和2条π键(1π),键型和N2分子相同。
2 N 、O 两元素的价电子总数为5+6=11,依次填入分子轨道, 显然, 最后一个电子填在反键上, 不成对, 因此, 在NO 的分子中有一条σ键, 一条2电子π键, 一条3电子π键。 键级=(6-1)/2 =2.5
由于有成单电子,NO 分子具有顺磁性, 可以自聚合成为N2O2 双聚分子。而且也可预料, NO 易失去一个电子成为NO +,NO +离子有二条2电子π键,一条σ键,键级为3,成键能力显然比NO 高。 三 价电子对互斥理论(VSEPR)
3.1 价电子对互斥理论(VSEPR)基本要点为
(1) ABn 型分子或基团中,如果中心原子A 的价电子层不含 d 电子(或仅含d5或d10时), 则其几何构型完全由价层电子对数所决定.
(2) 价电子对(VP)包括成键电子对(BP)和孤电子对(LP) VP =BP +LP
其中 BP(成键电子对)=σ键电子对数(不计π键电子)
=中心原子周围的配位原子数
N 2
O
2
LP* =[中心原子的价电子-配位原子的单电子
的总和±离子的电荷(负电荷取+,正
电荷取-)]/2
* 若算得的结果为小数,则进为整数。
(3) 由于价电子对之间的库仑斥力和保利斥力,使价电子对之间的距离应保持最远。
因此, 中心原子价电子对数与价电子对的排布有以下关系:
2 3 4 5
直线三角形正四面体三角双锥
6 7 8
正八面体单冠八面体四方反棱柱
(4) 根据价电子对的排布确定分子的空间构型(分子的构型是指成键原子的空间几何排布,亦即成键电子对的空间排布)。
(5) 如果一个分子有几种可能的结构,则须确定谁是最稳定的结构。
确定稳定结构的原则是:
①对仅含BP、LP的分子,其斥力顺序是:
LP-LP > LP-BP > BP-BP
②对含有多重键的分子,则
叁-叁>叁-双>双-双>双-单>单-单
③在ABn型分子中,成键电子对间的斥力随配位原子B的电负性的增大而减小。随中心原子A的电负性的增大而增大。
④中心原子周围在最小角度的位置上斥力大的电子对数目越少其结构越稳定
例① XeF4,Xe:价电子数为8,四个 F 各有1个单电子,
BP=4,LP=(8-431)/2=2,VP=4+2=6,价电子对在空间按八面体排布,分子有两种可能的排布方式:
3.2 影响分子键角大小的因素
1 中心原子的杂化类型与键角的关系
轨道最大重叠原理要求,有利的成键方向是杂化轨道的空间取向。
如果用 b 表示成键的杂化轨道,L表示由孤对电子所占的杂化轨道,则夹角大小顺序为∠L ,L > ∠L ,b > ∠b ,b
2 中心原子孤对电子对的数目
对中心原子上的孤对电子对键角的影响的解释:
(1) 孤对电子含s电子成分多,其电子云比成键电子对更肥胖;
(2) 孤对电子只受中心原子一个核的吸引,它集中在中心原子核的周围。
孤对电子对对邻近电子对将产生较大的斥力, 迫使键角变小。
受孤对电子排斥使键角减小的其它例子
a sp3d杂化的SF4电子对呈三角双锥排布,有一对孤对电子排在赤道平面, 它排斥其它键, 使平面上的另两个键角不是120°, 而是小于120°, 而上下两键已不再与平面垂直, 夹角小于180°;
b 还有BrF3 , T形分子构型, 由于在电子排布的锥底平面上有两对孤对电子,使上下两键已不再与平面垂直,变成86.5°;
c IF5,四方锥,键角也减小。
d 再比较一下NO2+、NO2、NO2-的键角也可以看出,NO2+没有未成键电子,在NO2上有一个未成键电子,NO2-有两个未成键电子,单个未成键电子所产生的斥力比孤对要小,所以它们的键角分别为180°、132°、115°。
3 多重键
多重键所包含的电子较多, 斥力较单键大,结果是使分子内包含多重键的夹角增大,单键间的夹角变小,如OC(NH2)2,sp2杂化,正常为120°,由于双键C=O斥力大,使∠NCO扩大至126°, ∠NCN=108°。
4 电负性的影响
在ABn型分子中, 当原子B电负性减小时, A-B间的成键电子将愈来愈偏向A, 从而增加成键电子对间的斥力, 键角将增大。
5 p-d 键
第二周期元素的氟化物键角小于相应氢化物,其它周期元素则有相反的规律
四单质及其主族元素化合物的性质及其周期性递变规律
重点在于主族元素化合物的周期性性质
1 氯化物的水解作用
主族金属元素的氯化物, TlCl难溶于水, PbCl2的溶解度较小,其余的二元氯化物都易溶于水。其中碱金属和碱土金属的氯化物 (除LiCl、BeCl2及MgCl2外)溶于水, 在水中完全电离而不发生水解; 其他金属及Li、Be、Mg的氯化物会不同程度地发生水解。一般水解是分步进行的,有些金属在水解时生成的碱式盐在水中溶解度很小,可沉淀出来:
SnCl2+H2O=Sn(OH)Cl↓+HCl
SbCl3+H2O=SbOCl↓+2HCl
BiCl3+H2O=BiOCl↓+2HCl
非金属氯化物,除CCl4和NCl3外均强烈水解生成二种酸:
SiCl4+4H2O=H4SiO4+4HCl
PCl3+3H2O=H3PO3+3HCl
NCl3的水解产物是一种酸和一种碱:
NCl3+3H2O=NH3+3HOCl
CCl4难水解。
2 关于主族元素氯化物的水解大致可归纳出以下几条规律:
①正离子具有高的电荷和较小的半径,它们对水分子有较强的极化作用,因而易发生水解;反之,低电荷和较大离子半径的离子在水中不易水解。
②由8(2)、18到18+2电子构型的正离子,离子极化作用依次增强,水解变得容易。
③共价型化合物水解的必要条件是中心原子必须要有空轨道或具有孤电子对。
④温度对水解反应的影响较大,是主要的外因,温度升高时水解加剧。
⑤不完全亲核水解的产物为碱式盐[如Sn(OH)Cl、BiOCl],完全亲核水解的产物为氢氧化物[如Al(OH)3]或含水氧化物、含氧酸(如H2SiO3、H3PO4)等,这个产物顺序与正离子的极化作用增强顺序一致。低价金属离子水解其产物一般为碱式盐,高价金属离子水解产物一般为氢氧化物(或含水氧化物),正氧化态的非金属元素的水解产物一般为含氧酸。
⑥水解反应也常伴有其他反应,如配合:
3SnCl4+3H2O SnO2?H2O+2H2SnCl6
除碱金属及碱土金属(Be除外)外的大多数主族金属的氯化物皆能与Cl-形成配合物离子。如SnCl62-,PbCl42-,BeCl42-,AlCl4-,AlCl63-,InCl52-,TlCl63-,SnCl3-,PbCl62-,SbCl6-及BiCl52-等。
根据水解机理可以判断水解产物
上述SiCl4是中心原子具有空轨道的例子,发生的是亲核水解反应。水分子中的氧原子上的孤对电子首先进攻中心原子Si的空d轨道,SiCl4作为电子对的接受体接受来自水分子的电子并生成一个配位中间体SiCl4(OH2),其中心原子Si的杂化态由sp3变为sp3d,而后脱去一个HCl分子,变回sp3杂化态;然后再发生类似的亲核水解,逐步脱去氯原子生成Si(OH)4水解产物:亲电水解产物的特征是产物的中心原子直接与氢原子成键NCl3+3H2O=NH3+3HOCl
PCl3是中心原子既有空轨道(d轨道, 可以接受孤对电子进攻)又有孤电子对(可以接受质子的亲电进攻),加上PCl3中配位数仅为3,远远未达到第三周期最大的配位数6这一数值,所以PCl3可以同时发生亲核水解和亲电水解反应:PCl3的在第一步发生亲电水解后,不再具有孤对电子,其后只能发生水分子的亲核进攻,其间也发生了构型转变及键的断裂与消去的能量变化过程。PCl3水解的产物是H3PO3。PCl3+3H2O=H3PO3+3HCl CCl4难水解,是因C的价轨道已用于成键且又没有孤电子对之故
NF3的分子结构与NCl3同,其中N原子也是采用sp3杂化轨道成键,其上有一对孤对电子。然而,
1 由于F原子的电负性较大,使得NF3的碱性(给电子性)比NCl3小,因而亲电水解很难发生;
2 由于N是第二周期元素,只有4条价轨道(没有d轨道),不可能有空轨道接受水的亲核进攻;
3 N-F键的键能比N-Cl键的键能大,不容易断裂。
这些原因决定了NF3不会发生水解作用。
综上可见,在涉及卤化物的水解时,除了要考虑热力学因素外,通常还要注意卤化物中心离子的结构和特征。如
属于第几周期?
最大配位数为几?
有无孤对电子?
有无空轨道?
发生什么机理的水解?
水解过程能量的变化即键能大小?
有无动力学控制因素?等。
五元素电势图及其应用
一种元素的不同氧化态物种按照其氧化态由低到高从左到右的顺序排成图式,并在两种氧化态物种之间标出相应的标准电极电势值。这种表示一种元素各种氧化态之间标准电极电势的图式称为元素电势图,又称拉蒂默图。
(1) 判断元素各种氧化态的相对稳定性(判断是否能发生岐化)
对某一元素,其不同氧化态的稳定性主要取决于相邻电对的标准电极电位值。若相邻电对的φθ值符合φ右θ>φ左θ,则处于中间的个体必定是不稳定态,可发生歧化反应,其产物是两相邻的物质。
(2) 求未知电对的电极电势
利用Gibbs函数变化的加合性,可以从几个相邻电对的已知电极电势求算任一未知的电对的电极电势。
(3) 判断元素处于不同氧化态时的氧化还原能力
根据某一电对的电极电势越大,则氧化态物质的氧化能力越强,相应的还原态物质的还原性越弱的原理。
(4) 计算歧化反应进行的限度
歧化反应进行的限度可以由反应的平衡常数得到判断。
如,根据碱性介质中氯元素的电势图
可知Cl2可发生歧化反应。歧化产物既可能是ClO-和Cl-,也可能是ClO3-和Cl-。对于反应
Cl2+2OH-=ClO-+Cl-+H2O
Eθ=φθ(Cl2/Cl-)-φθ(ClO-/Cl2)=1.358-0.40=0.958(V)
根据 lgKθ=nEθ/0.0591
可算出反应的平衡常数 Kθ=1.631016
而对于Cl2的另一歧化反应
Cl2+6OH-=ClO3-+5Cl-+3H2O
Eθ=φθ(Cl2/Cl-)-φθ(ClO3-/Cl2)=1.358-0.48=0.878(V)
Kθ=1.931074
说明后一个歧化反应的趋势更大。
(5) 对氧化还原的产物作分析判断
六周期反常现象 (Periodic Anomalies
6.1 氢的不规则性问题
1 氢的原子序数为1,电子结构1s1,碱金属电子结构ns1,均可作为还原剂。说明氢与碱金属的类似性。
然而,氢与碱金属的差别十分大,这用不着多说。
2 但从获得1个电子就能达到稳定的稀有气体结构看,氢应与卤素类似。确实氢与卤素一样,都可作为氧化剂。
3 若将 H 的电子结构视为价层半满结构,
6.2第二周期元素的特殊性
总之, 第二周期元素与同族其他元素在性质上出现变化不连续的现象,却与第三周期斜对角元素相似。这被称为对角线关系或对角线相似
例如:为什么第二周期与第三周期同族元素性质明显差异?探讨其原因,有:
(1) 第二周期元素在成键时只限于使用s和p轨道(以s-p的杂化轨道成键);第三周期元素还可使用3d轨道(如sp3d、sp3d2、sp3d3……杂化轨道)成键, 共价数前者最大为4,后者出现5、6、7 ……等
(2) 第二周期元素作中心原子时,只以σ键同其他原子键合,而第三周期元素和更重元素除生成σ键外,还能生成p-d π键。如 SO42-中,S、O之间除生成S→O外,还因O原子上有2p孤对电子,而中心 S 原子有空 d 轨道,在对称性匹配条件下(如2pz-3dxz)可重叠生成p-d π键,这样,σ-π键的生成使S-O键的键长比正常的单键
6.3第四周期非金属元素(As、Se、 Br) 最高价态的不稳定性
1 PCl5、SbCl5稳定,AsCl5难制取
2 SO3、TeO3较稳定,SeO3易分解
3 Br(Ⅶ)的化合物虽已制得,但其氧化性大
3 Br(Ⅶ)的化合物虽已制得,但其氧化性大于Cl(Ⅶ)和I(Ⅶ)的氧化性
As、Se、Br高价不稳定是由于其电子层中出现了3d电子亚层,3d电子的屏蔽常数为0.93,不能完全屏蔽一个核电荷,从而使这些元素的有效核电荷较大,为达最高氧化态所需激发能不能被总键能的增加所抵销
6.4 惰性电子对效应
p 区过渡后金属元素,Ga、In、Tl;Ge、Sn、Pb;As、Sb、Bi等中的ns2电子逐渐难以成键,而6s2又更甚。这被称为惰性电子对效应。
第二章酸碱和溶剂化学
(一)要点掌握
酸碱概念
路易斯电子酸碱理论及HSAB规则质子酸碱和质子溶剂
溶剂化学
水合焓非水质子溶剂体系(酸性质子溶剂碱性质子溶剂、
亲核质子溶剂类水两性溶剂)
非质子溶剂体系(van der Waals溶剂 Lewis碱溶剂
离子传递溶剂熔盐体系)
酸碱强度的量度
水溶液中质子酸碱的强度(影响质子酸碱强度的因素
水溶液中质子酸碱的强度含氧酸的酸性)
非水溶剂中的质子酸碱的强度
电子酸碱的强度
超酸
(二)重点:质子理论,路易斯酸碱理论,溶剂体系理论,正负离子理论
《一》
一酸碱概念
酸和碱不能简单地分别定义为在电离时会产生H+离子和OH-离子的物质。
即使是酸,在水溶液中也不能产生游离的H+离子。
由于H+是一个裸露的原子核,其半径极小,为Li+离子半径的五万分之一,其电荷密度(e/r2)很大(为Li+离子的2.53109倍),易与水分子的氧生成氢键。换句话说,裸露的原子核在水中是不可能稳定存在的,易被水合。
1.1 Lewis(路易斯)电子酸碱理论
Lewis电子酸碱理论是一个广泛的理论,它完全不考虑溶剂,实际上许多Lewis酸碱反应是在气相中进行的。在Liwis酸碱反应中,一种粒子的电子对用来与另一种粒子形成共价键。“供给”电子对的粒子是碱,而“接受”电子对的粒子是酸。反应可以写成:
A(酸)+:B(碱) A←B
显然,路易斯酸应该有空的价轨道,这种轨道可以是σ轨道,也可以是π轨道。而路易斯碱应该有多余的电子对,这些电子可以是σ电子,也可以是π电子:
1.2HSAS规则:Pearson提出了软硬酸碱的概念。
把Lewis酸碱分成硬的、交界的和软的酸碱。
软酸、软碱之所以称为软,是形象地表明它们较易变形;
硬酸、硬碱之所以称为硬,是形象地表明它们不易变形。
换句话说,软酸或软碱是其价电子容易被极化或容易失去的酸或碱,而硬酸或硬碱则是其价电子与原子核结合紧密且不容易被极化或不容易失去的酸或碱硬碱中的价电子结合紧密,软碱中的价电子容易被极化。硬亲硬,软亲软,软硬交界就不管。
这被称作软-硬酸碱原理。
二质子理论
2.1质子酸;任何能释放质子的物种都叫作酸,任何能结合质子的物种都叫作碱。因此,酸是质子给予体,碱是质子接受体,酸失去一个质子后形成的物种叫做该酸的共轭碱,碱结合一个质子后形成的物种叫该碱的共轭酸。A(酸) B(碱) + H+
质子给予体质子接受体
式中A是B的共轭酸,B是A的共轭碱。
2.2质子溶剂
某些溶剂同水一样,也能自身电离放出质子生成去质子后的溶剂阴离子。
H2O+H2O H3O++OH- EtOH+EtOH EtOH2++EtO-
HF+2HF H2F++HF2- H2SO4+H2SO4 H3SO4++HSO4-
显然Brosted-Lowry的定义也适合这些溶剂。因此可将这种溶剂称为质子溶剂。
质子溶剂有一个显著的特点, 就是它们的分子中都含有H, 在一定的条件下可以作为质子给予体。
三溶剂化学
一种物种(如B)能使溶剂失去质子成为特征溶剂阴离子, 这样的物种无容置疑一定是碱。
水、乙醇、胺都能使H2SO4失去质子生成其特征阴离子HSO4-, 所以水、乙醇、胺在H2SO4中均为碱。
H2O + H2SO4 → H3O++ HSO4-
EtOH + 2 H2SO4 → EtHSO4 + H3O++HSO4-
CO(NH2)2 + H2SO4 → H2NCONH3++ HSO4-
在水中,HOAc是弱酸,HNO3是强酸,而在H2SO4中,二者均显示碱性。
HOAc + H2SO4 CH3CO2H2++ HSO4-
HNO3+ 2 H2SO4 → NO2++H3O++ 2HSO4-
根据 HA+HB’(质子溶剂) → A-+H2B’+
3.1 (溶剂特征阳离子)
一种物种(如HA)能使溶剂结合质子成为特征溶剂加质子阳离子,则该物种无疑一定是酸。
在水中为强酸的物质,如HClO4、HBr、H2SO4、HCl、HNO3在HOAc中表现出差异:
HClO4>HBr>H2SO4>HCl>HNO3
导电比值 400 : 160 : 30 : 9 : 1
这些酸在水中是完全电离的,它们表现出相同的酸强度,即它的强度被水“拉平”到水合质子H3O+的强度,即水对强酸具有“拉平效应”(levelling effect)。
而在水中为强酸的物质,却在HOAc中显示出差异,即HOAc将它们的酸性“拉开”,这种效应叫“拉开效应”。
3.2 碱性(非水)质子溶剂(亲核质子溶剂)
典型的碱性(非水)质子溶剂是液NH3。
2 NH
3 NH4++ NH2- K=5310-27
液NH3在很多方面类似于水,在液NH3中的许多反应都类似于水中的反应:
自电离 2H2O H3O++ OH- 2NH3 NH4++ NH2-
中和反应 KOH+HI → KI+H2O KNH2+NH4I → KI+2NH3
两性反应 Zn2++2OH-→Zn(OH)2↓→Zn(OH)42- (OH-过量)
Zn2++2NH2-→Zn(NH2)2↓→Zn(NH2)42- (NH2-过量)
3.3●类水两性溶剂
甲醇、乙醇等初级醇,尽管本身既不是酸也不是碱,但这些溶剂却都同水一样,可以因诱导而使溶质呈现出酸碱性,而溶剂本身既能作为质子接受体起碱的作用,又能作为质子的给予体起酸的作用。如
NH4++ EtOH(碱) NH3 + EtOH2+
RNH2 + EtOH(酸) RNH3++ EtO
《二》酸碱强度
1水溶液中质子弱碱的强度
①热力学讨论
②诱导效应和负离子的电荷分配性对酸的影响
所谓诱导力是分子间作用力中的一种。诱导效应是指一个分子的固有偶极使另一个分子的正负电荷重心发生相对位移,或是在一个分子内一个部分对另一个部分的诱导现象。
对于后者,以HARn (Hn+1A被n个取代基R取代后的产物)分子为例。如果取代基R的电负性比A大,R对电子的吸引作用比A强,则这种取代基称为吸电子基团。相反,如果R的电负性比A小,R对电子的吸引作用力比A弱,这种取代基团被称为斥电子基团。
由于取代基R的吸电子或斥电子作用,使得邻近化学键的电子密度发生改变。显然这就是一个分子中存在的诱导效应。
2 水溶液中质子酸碱的强度
3超酸
超酸是指酸度大于纯H2SO4酸的酸,即超酸的H0<-11.93。如 HSO3F H0=-15.07 H2S2O7 H0=-14.14
SbF5(900/0mol)与HSO3F(100/0mol)的混合酸,
SbF5+2HSO3F [SbF5(SO3F)]-+H2SO3F+
其H0=-27,该体系特称为魔酸。
H2SO3F+非常容易给出质子甚至可以使链烃先结合质子,然后脱掉1mol H2,生成正碳离子:
R3CH+H2SO3F+ R3CH2+HSO3F R3C++H2+HSO3F
超酸有非常重要的用途:由于超酸具有高强度的酸性,酸度函数在-11.93~-27之间,并且有很高的介电常数,因此它们能使某些非电解质成为电解质,能使一些弱的碱质子化(得到质子),上述烷烃正碳离子的生成就是一个具体的实例。
超酸可以作为良好的催化剂,使一些本来难以进行的反应在较温和的条件下进行,如在饱和烃的裂解、重聚、异构化、烷基化反应中被广泛应用。
第七章配位化合物
一配位化合物的基本概念
1 单齿,双齿,多齿配合物配位数不等于配体说
2 常见的配体
3配合物的命名
二几何构型
配合物是通过给予体和接受体的反应而生成的,给予体原子具有孤对电子,它给出孤对电子进入作为配合物中心原子或离子的空轨道,为了接受这些电子对,中心原子的原子轨道首先要进行杂化形成一组新的具有一定方向性和对称性的等价杂化轨道,再与配体的给予体轨道重叠形成σ配键。如果中心原子还有合适的孤对电子,而配体又有合适的空轨道,这时中心原子上的孤对电子将进入配体空轨道从而形成反馈的π配键。配合物的配位数就是中心原子在成键时动用的空轨道数。
根据配合物的磁矩可以计算配合物中成单的电子数并由此确定杂化轨道的类型
配位数与构型可互相判断,牢记课本上的表格
三异构现象
几何异构,旋光异构及其他异构
四键价理论(VB理论)
配合物的价键理论的基本思想是:
配合物是通过给予体和接受体的反应而生成的,给予体原子具有孤对电子,它给出孤对电子进入作为配合物中心原子或离子的空轨道,为了接受这些电子对,中心原子的原子轨道首先要进行杂化形成一组新的具有一定方向性和对称性的等价杂化轨道,再与配体的给予体轨道重叠形成σ配键。如果中心原子还有合适的孤对电子,而配体又有合适的空轨道,这时中心原子上的孤对电子将进入配体空轨道从而形成反馈的 π 配键。配合物的配位数就是中心原子在成键时动用的空轨道数所谓电价或外轨型配合物是中心离子的电子结构不受配体影响, 保持其自由离子的结构, 给予体电子排布在外层轨道, 中心离子和配体借静电引力结合在一起。而共价或内轨配合物是中心离子的内层d 电子重新排布空出部分轨道参与成键, 中心离子和配体借较强的共价键结合在一起。 现在,在过渡元素配位化学中VB 理论已逐步为配位场理论和分子轨道理论所代替。 五 晶体场理论
晶体场理论是一种静电理论, 它把配合物中中心原子与配体之间的相互作用, 看作类似于离子晶体中正负离子间的相互作用。但配体的加入, 使得中心原子原来五重简并的 d 轨道(见图)失去了简并性。在一定对称性的配体静电场作用下, 五重简并的 d 轨道分裂为两组或更多的能级组。 这种分裂将对配合物的性质产生重要影响。 一 晶体场中d 轨道能级的分裂 1 正八面体场
2 正四面体场
在正四面体场中,过渡金属离子的五条d 轨道同样分裂为两组,一组包括dxy 、dxz 、dyz 三条轨道,用t2表示,这三条轨道的极大值分别指向立方体棱边的中点。距配体较近,受到的排斥作用较强,能级升高,另一组包括dz2和dx2-y2,以e 表示,这两条轨道的极大值分别指向立方体的面心,距配体较远,受到的排斥作用较弱,能级下降。
二 分裂能和光谱化学序列
分裂能:中心离子的d 轨道的简并能级因配位场的影响而分裂成不同组能级之间的能量差。 分裂能的大小与下列因素有关: 1 配位场
亦即几何构型类型 如△t =(4/9)△o 2 金属离子 3 配体的本性
对同一金属离子,造成△值最大的是CN -离子,最小的是I -离子,通常把CN -、NO2-等离子称作强场配位体, I -、Br -、F -离子称为弱场配位体。 三 电子成对能和配合物高低自旋的预言
所谓成对能是电子在配对时为了克服静电场的排斥作用所需的能量, 通俗地讲就是使自旋成对的两个电子占据同一轨道所必须付出的能量, 以P 表示。
,C ≈4B 。电子成对能的大小可用描述电子相互作用的Racah 电子排斥参数B 和C 来表示。
对于一个处于某特定配位场中的金属离子, 其电子排布究竟采用高自旋, 还是低自旋的状态, 可以根据成对能和分裂能的相对大小来进行判断:
●当P >△时, 因电子成对需要的能量高, 电子将尽量以单电子排布分占不同的轨道, 取高自旋状态; ●当P <△时, 电子成对耗能较少, 此时将取低自旋状态。 四 晶体场稳定化能和配合物的热力学性质
由于电子的总能量,亦即各轨道总能量保持不变,e g 能量的升高总值必然等于t 2g 轨道能量下降的总值,这就是所谓的重心守恒原理(
原来
d 轨道能级在Oh 场中的分裂
在配体静电场的作用下, 中心金属离子的d轨道能级发生分裂, 其上的电子一部分进入分裂后的低能级轨道, 一部分进入高能级轨道。进入低能级轨道使体系能量下降, 进入高能级轨道使体系能量上升。根据能量最低原理, 体系中的电子优先进入低能级轨道。此时,如果下降的能量多于上升的能量, 则体系的总能量下降。这样获得的能量称为晶体场稳定化能。
这种因d轨道分裂和电子填入低能级轨道给配合物带来的额外稳定化作用将产生一种附加的成键作用效应。
1晶体场稳定化能的大小与下列因素有关:
★配合物的几何构型;
★中心原子的d电子的数目;
★配体场的强弱;
★电子成对能。
2 CFSE对配合物性质的影响
晶体场理论的核心是配位体的静电场与中心离子的作用所引起的d轨道的分裂和d电子进入低能级轨道带来的稳定化能使体系能量下降,从而产生一种附加成键作用效应。
五过渡金属配合物的电子光谱
过渡金属配合物的电子光谱属于分子光谱,它是分子中电子在不同能级的分子轨道间跃迁而产生的光谱。
根据电子跃迁的机理,可将过渡金属配合物的电子光谱分为三种:
λ d轨道能级之间的跃迁光谱, 即配位场光谱;
λ配位体至金属离子或金属离子至配位体之间的电荷迁移光谱
λ配体内部的电子转移光谱
电子光谱有两个显著的特点:
①为带状光谱
这是因为电子跃迁时伴随有不同振动精细结构能级间的跃迁之故。
②在可见光区有吸收,但强度不大,但在紫外区,常有强度很大的配位体内部吸收带。
过渡金属配合物电子运动所吸收的辐射能量一般处于可见区或紫外区,所以这种电子光谱通常也称为可见及紫外光谱。当吸收的辐射落在可见区时
,物质就显示出颜色。物质所显示的颜色是它吸收最少的那一部分可见光的颜色,或是它的吸收色的补色。
配体分子,可以具有上述一种,也可同时具有两种、三种跃迁方式,但同配位场光谱相比,只要记住它们的特点:
一大都出现在紫外区;
二吸收强度大。
第九章有机金属化合物簇合物
有效原子序数(EAN)规则和金属羰基化合物
类似羰基的有机过渡金属化合物
过渡金属不饱和链烃配合物
过渡金属环多烯化合物
过渡金属的羰基簇化物
过渡金属的卤素簇化物
应用有机过渡金属化合物
和金属原子簇化物的一些催化反应
一金属羰基配合物
金属羰基配位物有三个特点
①金属与CO之间的化学键很强。如在Ni(CO)4中,Ni-C键能为147 kJ2mol-1,这个键能值差不多与I-I 键能(150 kJ2mol-1)和C-O单键键能(142 kJ2mol-1)值相差不多。
②在这类配合物中,中心原子总是呈现较低的氧化态(通常为0,有时也呈较低的正氧化态或负氧化态)。氧化态低使得有可能电子占满dπ-MO,从而使M→L的π电子转移成为可能。
③大多数配合物都服从有效原子序数规则。
二有效原子序数规则(EAN规则)
1 EAN规则
EAN规则是说金属的d电子数加上配体所提供的σ电子数之和等于18或等于最邻近的下一个稀有气体原子的价电子数, 或中心金属的总电子数等于下一个稀有气体原子的有效原子序数。
EAN亦称为18电子规则,这个规则实际上是金属原子与配体成键时倾向于尽可能完全使用它的九条价轨道(五条d轨道、一条s、三条p轨道)的表现。
举例说明18e规则和如何确定电子的方法:
①把配合物看成是给体-受体的加合物,配体给予电子,金属接受电子;
②对于经典单齿配体, 如胺、膦、卤离子、CO、H-、烷基R-和芳基Ar-,都看作是二电子给予体。
如 Fe(CO)4H2 Ni(CO)4
Fe2+ 6 Ni 10
4CO 432=8 +)4CO 432=8
+)2H- 232=4 10+8=18
6+8+4=18
③在配合阴离子或配合阳离子的情况下,规定把离子的电荷算在金属上。如:
Mn(CO)6+: Mn+ 7-1=6, 6CO 632=12, 6+12=18
Co(CO)4-: Co- 9+1=10, 4CO 432=8, 10+8=18
2 EAN规则的应用
①估计羰基化合物的稳定性
稳定的结构是18或16电子结构,奇数电子的羰基化合物可通过下列三种方式而得到稳定:
a 从还原剂夺得一个电子成为阴离子[M(CO)n]-;
b 与其他含有一个未成对电子的原子或基团以共价键结合成 HM(CO)n或M(CO)nX;
c 彼此结合生成为二聚体。
②估计反应的方向或产物
如: Cr(CO)6+C6H6 →?
由于一个苯分子是一个6电子给予体,可取代出三个CO分子,因此预期其产物为:
[Cr(C6H6)(CO)3]+3CO
又如:Mn2(CO)10+Na →?
由于Mn2(CO)10 732+1032=34,平均为17,为奇电子体系,可从Na夺得一个电子成为负离子,即产物为:
[Mn(CO)5]-+ Na+
③估算多原子分子中存在的M-M键数,并推
测其结构
三金属羰基化合物中的化学键
1可以利用分子轨道理论来说明金属羰基化合物中的成键过程。
在CO的分子中,C和O都是以2s和2p原子轨道参与成键的。
由于C和O原子对称性相同的2s和2px轨道可以混合形成二条spx杂化轨道。在C和O组成分子时,这四条spx杂化轨道中有两条组成了两条σ孤对电子轨道,其中一条是氧的spx,另一条是C的spx,剩下两条spx杂化轨道进行组合,一条是CO的σ成键轨道,一条是反键轨道。
除此之外,还有两条充满的π键轨道和两条空的反键轨道, 它们是由py和pz轨道重叠而成, 分别位于xz和xy平面内。
2 类羰基配体的有机过渡金属配合物
N2、NO+、CN-等双原分子或基团是CO分子的等电子体。因此它们与过渡金属配位时与CO的情形十分相似,同样是既可作为σ给予体,又可作为π接受体。
分子N2与过渡金属生成配合物时的成键情况也与CO相似,氮原子上的孤对电子3σg进入过渡金属的空轨道,形成σ配键;同时过渡金属的非键d 电子进入N2分子的反键1πg空轨道,形成反馈π键,从而构成σ-π协同配位的结构。
然而同CO相比,N2最高占有轨道的能量比CO低,所以N2是一个较差的σ电子给予体,它给出电子形成σ配键的能力远比CO弱; 另一方面, N2分子的最低未占据空轨道的能量又比CO的高, 所以N2接受金属d电子形
成反馈π键的能力也不如CO强。因此,N2分子配合物的稳定性比金属羰基化合物差,生成的N2分子配合物的数量也远比羰基化合物少。
四亚硝酰基配合物
NO比CO多一个电子, 且这个电子处在反键π*轨道上(参考CO能级图), 键级为2+1/2=2.5。它容易失去一个电子形成亚硝酰阳离子NO+,NO→NO++e, 电离能为916.6 kJ2mol-1。NO+与CO是等电子体, 键级为3(NO 的键级为2.5)。NO的键长为115.1 pm, NO+的键长106.2 pm (正常N-O单键键长为140 pm,N=O键键长为121 pm,N≡O键键长为106 pm) 。
CO、N2、NO等配体,均为σ电子对给予体,所以是路易斯碱。但同时又都有不同程度的接受反馈π电子的能力,因而又都是路易斯酸。类似的配体还有很多,如CN-、AR3-、醇、酰胺等。它们中有许多是以接受π电子、形成反馈π键为主,据此,人们将这类配位体称为π酸配体。由这类配体形成的配合物称为π酸配合物。
五环多烯配合物
烯和炔是过渡元素的另一类重要配体,它们以π键的电子云来和金属配位,所以通常将生成的配合物叫π配合物。该配体,亦即以π键电子云去配位的配体称为π配体。
此处重点掌握:为什么二茂铁能稳定存在,以及对其他二茂铁类化合物稳定性差异进行分析。
六金属有机化合物和簇合物的形成条件
原子簇(Cluster)是金属原子簇化合物的简称,也可称之为簇合物。它是指3个或3个以上的金属原子直接键合而成的化合物(按照这个定义,很显然,硼烷和碳硼烷都不能算在原子簇之内)
1过渡金属羰基簇合物
配体为CO的过渡金属簇合物称为过渡金属羰基簇合物。
由于CO是一个较强的σ电子给予体和π电子接受体,所以羰基簇合物比较稳定,数量也较多。
CO在羰基簇合物中可以发挥不同的功能:
羰基簇合物功能
单核羰基簇合物端基配位
双核羰基簇合物端基+边桥基+半桥基
多核羰基簇合物端基+边桥基+半桥基+面桥基
在双核和多核羰基簇合物,CO的配位方式或可以同时出现,或出现其中的几种。如
Rh6(CO)12(μ3-CO)4 Re4(η5-C5H5)4(μ3-CO)4
一般地, 原子越小,越容易形成桥式结构。因此,同一族元素,从上而下非桥式配合物稳定性增加。2卤素簇
卤素簇在数量上远不如羰基族多,由卤素簇的特点可以理解这一点:
①卤素的电负性较大, 不是一个好的σ电子给予体,且配体相互间排斥力大, 导致骨架不稳定;
②卤素的反键π*轨道能级太高, 不易同金属生成 d→π反馈键,即分散中心金属离子的负电荷累积能力不强;
③在羰基簇中,金属的 d 轨道大多参与形成 d→π反馈键,因而羰基簇的金属与金属间大都为单键,很少有多重键。而在卤素簇中,金属的 d 轨道多用来参与形成金属之间的多重键,只有少数用来参与同配体形成σ键。如Re2C182-;
④中心原子的氧化态一般比羰基化合物高, d 轨道紧缩(如果氧化数低, 卤素负离子的σ配位将使负电荷累积, 相反,如果氧化数高, 则可中和这些负电荷), 不易参与生成d →π反馈键;
⑤由于卤素不能易用π*轨道从金属移走负电荷,所以中心金属的负电荷累积造成大多数卤素簇合物不遵守18电子规则。
例题:以Re2C182-为例:
2 Re3+=23(7-3)=8,8 C1-=16,4 M-M=8,
总电子数=32,平均每个Re为16e。
然而,对于Mo6C184+,
Mo612+=636-12=24,8C1-=16,
总数=40, 每个Mo为40/6, 这很难用18或16电子规则描述。
四答疑
朱文祥版中级无机化学答案前七章
第一章 3排除下列各酸在醋酸中的酸强度次序,并指出其中那些是超酸? 4指出下列物质在液氨中的酸碱行为? 5指出在100%硫酸中的酸碱行为? 8方程式 10、什么是硬软酸原理?试从化学键角度解释这种现象。
12粗略估计下述各酸的pKa值: 第三章
28、说明无水CuSO4、Cu(H2O)62+和Cu(NH3)42+的颜色差异,并指出产生这些差异的原因 29、指出Mn(H2O)62+和Fe(H2O)63+的颜色有何特征?说明原因 30、MnO4-中Mn为d0组态,为什么他能有很深的颜色?说明颜色来源 34、CrO42-离子是d0配合物,但它能呈现颜色,1解释显色原因,2预言他的跃迁能量比 Mn4-高还是低? 第四章 6试解释二茂铁鎓离子是一种强氧化剂;二茂钴在合适的溶剂中是一中强还原剂;二茂镍易跟NO气体反应生成
O? 8举例说明什么叫做协同成键作用? 16如果钒的羰基化合物符合EAN规则,那么它的最简单化合物的分子式应该是什么?为什么它实际上又是不稳定的? 17已知Mn2(CO)10只观测到2044~1980cm-1范围内的伸缩振动带,而Co2(CO)8观察到2071~2022cm-1的振动带以及另外两个1860cm-1和1858cm-1的振动带,试画出Mn2(CO)10和Co2(CO)8的合理的结构式? 22试分析对比蔡斯盐中,乙烯与Pt2+的成键方式与金属羰基化合物中CO与金属原子的成键方式的相同与区别点。 23在乙烯中用金属锂处理Co2(CO)8时得到一个化学式为的同的红色晶体,并放出CO,该晶体的红外光谱出现3个不同的羰基伸缩振动吸收峰2080~2000,1850和1600cm-1请据此推出他的最合理的结构式。
中级无机化学答案
简答題: 1. 第一过渡系元素氧化态分布有什么特点?为什么ⅦB族后的Fe元素不易达到族号氧化态? 答:氧化态分布的特征是两端少且氧化态低,中间氧化态多且高,元素呈现的氧化态与化合反应的能量及配位原子的性质有关:(1)Fe 原子虽然有8个价电子,但其要失去第七、第八个价电子时需要消耗很大的能量,虽然其形成化学键可获得一些能量,但其不能满足电离能的需要;(2)Fe的高氧化态,有很强的氧化能力,配体必须能与Fe共处。综上,Fe元素不易达到族号氧化态。 2. 钛被称作“第三金属”,请写出工业从TiO2矿抽取Ti的原理(用方程式表示)。 答:TiO2 + 2C + 2Cl2 →TiCl4 + 2CO TiCl4 + 2Mg → Ti + 2MgCl2 3. 为何氮气是反磁性物质而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ2s)2(σ2s*)2(π2p)4(σ2p)2], 而O2[KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)2],N2分子中无成单电子而O2分子中两个三电子π键中各有一个成单电子,因而N2是抗磁性的,而O2是顺磁性的。 4. PF3和BF3的分子组成相似,而它们的偶极矩却明显不同,PF3(1.03D)而BF3(0.00D),为什么? 答:这是因为P与B价电子数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 5. PF3和BF3的分子组成 相似,而它们的偶极矩却明 显不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 6. 热量和功是否为体系的 性质?是否为状态函数? 答:热和功都不是体系的状 态函数,而是过程函数。也 不是体系的性质,体系的性 质是描述体系的状态的物理 量,如T,V等。不能谈体系 在某种状态下具有多少功或 多少热量,它们只有在能量 变换时才会有具体的数值, 与途径有关,不同的途径, 数值不同。 7. 为何氮气是反磁性物质 而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ 2s)2(σ2s*)2(π2p)4(σ 2p)2],而O2[KK(σ2s)2(σ 2s*)2(σ2p)2(π2p)4(π 2p*)2],N2分子中无成单电 子而O2分子中两个三电子 π键中各有一个成单电子, 因而N2是抗磁性的,而O2 是顺磁性的。 8. 什么叫杂化?原子轨道 为什么要杂化? 答:杂化是指形成分子时, 由于原子的相互影响,若干 不同类型、能量相近的原子 轨道混合起来重新组合成一 组新轨道的过程.原子轨道 之所以杂化,是因为:(1) 通 过价电子激发和原子轨道的 杂化有可能可以形成更多的 共价键; (2)杂化轨道比未 杂化的轨道具有更强的方向 性,更利于轨道的重叠;(3) 杂化轨道的空间布局使得化 学键间排斥力更小,从而分 子构型更稳定。 9. PF3和BF3的分子组成相 似,而它们的偶极矩却明显 不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 选择题: 1.汞中毒的症状是 ( A )(A) 贫血 (B) 骨头畸形、压迫骨头会 引起剧痛 (C) 会诱发癌症 (D) 颤抖、呆滞、运动失调, 严重时死亡 2.在人体血液中负责输送氧 气的金属蛋白是( D ) (A) 肌红蛋白 (B) 铁贮存 蛋白 (C) 血蓝蛋白 (D) 血红蛋白 3.稀有气体中,最难被液化 的是 ( A )(A) He (B)Ne(C)Xe (D) Kr 4.下列物质中,强烈氧化性 与惰性电子对效应无关的是 ( C )(A) PbO2 (B) NaBiO3 (C) K2Cr2O7 (D) TlCl3 5. A → B + C是吸热的 可逆基元反应,正反应的活 化能为E正,逆反应的活化 能为E逆(B )(A) E正 < E逆(B) E正 > E逆 (C)E 正 = E逆 (D) 三种都可能 6.下列锕系元素是人工合成 的是 ( B )(A)Ac (B)Am (C)Th (D) U 7.维生素B12含有的金属元 素是 ( A )(A)Co (B) Fe (C) Ca (D) Mg 8.废弃的CN-溶液不能倒入 ( C )(A) 含Fe3+的 废液中 (B) 含Fe2+的废液 中 (C) 含Cu2+的酸性废液 中 (D) 含Cu2+的碱性废 液中 9. 速率常数k是一个 参数( D )(A) 无量纲 参(B) 量纲为 mol·L-1·s-1(C) 量纲为 mol2·L-1·s-1 的参数 (D) 量纲不定的参数 10.下列各元素中,电子亲 和能最高的是 ( C )(A) Cs (B) Li (C) Cl (D) F 11.最早被发现的稀有气体 元素是 ( A )(A) He (B)Ne (C)Ar (D) Kr 12.下列各元素中,第一电 离能最高的是 ( D )(A) Cs (B) Li (C) O (D) F 13. 已知某一反应 A + B →C 的E正=50kJ/mol,则该 反应的E逆为 ( D ) (A) -50KJ/mol (B) < 50KJ/mol (C) > 50KJ/mol (D) 无法确定 14.在酸性溶液中,不能稳 定存在的是 ( A ) (A) VO43- (B) CuSO4 (C) FeCl3 (D) Cr2O72- 16.Ln3+离子不易形成羰基 化合物是因为它们 ( B ) (A) 无d电子 (B) 是硬酸(C)无空d轨道 (D) 轨道对称性不匹配 17. H2O2的分解反应为: H2O2(aq) →H2O(l) + 1/2O2(g),下列表示的瞬时 速度中,正确的是 ( D ) (A) dc(H2O2)/dt (B)-dc(H2O)/dt(C)-dc(O2) /(2dt) (D) dc(O2)/(2dt) 18. 反应 X + Y → Z,其 速度方程式为:υ =k[X]2[Y]1/2,若X与Y的 浓度都增加4倍,则反应速 度将增加多少倍 ( D ) (A) 4 (B) 8 (C) 16 (D) 32 22下列元素中,电子亲和能 最高的是 ( B )(A) F (B) Cl (C) Li (D) Cs 23.在酸性溶液中,不能存 在的物种是 (A)(A)FeO42-(B)CuI
《故都的秋》教案
《故都的秋》教案 教材简析: 《故都的秋》是一篇优美的写景抒情散文,作者通过对北平秋色的描绘,赞美了故都的自然风物,抒发了向往、眷恋故都之秋的真情,并流露出忧郁、孤独的心境。该文作为人教 版新教材编入高中第二册第一单元。这个单元的教学重点是在整体把握散文思想内容和艺术 形式的基础上,品味散文的语言,赏析散文的表现手法。作为经典篇目的《故都的秋》更具 有领起、示范的作用,教学本文的关键是朗读、欣赏、领悟,即把握作品形象(所绘之景),感受作家倾注于其中的情。新大纲指出:“初步鉴赏文学作品,能感受形象,品味语言,领 悟作品的丰富内涵,体会其表现力。”结合高一学生实际,我把本课的教学指导思想定为以 学生为主体,教师为主导,美文美读,重情感熏陶,培养学生的创新思维能力。教学目标是(展示) 〖教学目标〗 〖知识目标〗 1、了解郁达夫的思想和创作风格。 2、领悟作者流露在文中的主观情感,学习本文以情驭景、借景抒情的写法。 3、品味文章明白、流畅、简洁清朗的语言。 〖能力目标〗 1、培养学生有感情地诵读散文的能力和学会如何鉴赏散文。 2、品味本文语言,提高语言鉴赏能力及掌握运用语言的一些表达技巧。 〖德育目标〗 体会作者在山河破碎、内外交困的现实下,赞美自然风物的真情以及内心的忧思及落寞。 体会作者深沉的爱国之情。 依据本单元的教学要求和课文内容,根据学生实际,我把本课的重难点定为: 〖教学重点〗引导学生对故都秋思特点进行分析,掌握文中以情驭景,以景显情、情 景 交融的写法。 〖教学难点〗体会作者对故都的赞美之情以及文中流露出的悲凉、伤感之情的由来,从而深层次理解本文的丰富内涵。 〖教学方法〗 1、美读法。朱自清说:“课文内容的理解,其意义获得一半在声音里头。”通过美读以激活学生的审美情感,点燃其心灵的火花,感受作品的意境美。 2、比较赏析法。鉴赏离不开比较。刘勰在《文心雕龙知音》中说:“凡操千曲而后晓声,观千剑而后识器”。听得多了,见得广了,就有了鉴别能力,欣赏水平才会提高。 3、讨论法。这是阅读教学普遍采用的一种行之有效的方法,它有助于培养学生探索、 发现、判断、推理的能力。 4、情境教学法。通过画面、音乐渲染一种气氛,把学生带入一种意境。音美以悦耳, 形美以染目,情美以动人,意美以感心,学生既能领略情境的意蕴,又能受到多方面的感染 和教育。 〖教学设想〗 为培养学生初步欣赏散文的能力,我将按照审美的心理过程;借助多媒体进行点拔式赏 析阅读,品味郁达夫语言的独特魅力。以诗解文,培养学生的人文素质。为此我将整个教学 过程分为“导语引入——整体感知——品味鉴赏——探究情缘——比较赏析——迁移训练” 六个部分。时间为一课时。 〖教学过程〗
《故都的秋》重点难点创新教学方法
《故都的秋》重点难点创新教学方法 教学重点: 掌握文章以情驭景、以景显情、情景交融的写法。 教学难点: 引导学生推敲文中悲凉、伤感的情调的由来,从深层次理解此文的丰富内涵。 学法指导: 散文教学既要教学生鉴赏课文,又要指导学生学会鉴赏的方法。在教学中应以教师为主导,以学生为主体,充分发挥学生的主观能动性,培养学生的阅读和鉴赏的能力。 (1)移情法。列举描写秋天的古典诗句,营造浓浓的秋意、秋的文化,将学生引入一个欣赏秋景,感受秋文化的情境中去。 (2)诵读法。“书读千遍,其意自见”。在散文的教学中则尤为突出。本文是现代散文史上的名篇,反复诵读可使学生感受到文章感情之浓厚,意味之隽永,文辞之优美。 (3)设疑讨论法。抒情散文重在抒写作者的情志与意趣,但这种抒写往往不是直接的,而是通过精巧的构思,富有情感与哲理的语言,在写景、状物、叙事中实现的。因此,在教学过程中需要设疑引导学生积极讨论,合作探究。 教学步骤: 一、导入新课:自古以来,文人墨客们都钟情于秋,秋在他们的笔下显得意蕴丰富,风情万种。 丹桂飘香,秋菊傲霜,秋有味;
秋风萧瑟,残荷听雨,秋有声; 霜叶黄花,秋草碧水,秋有色; 天高云淡,北雁南飞,秋有形…… 历代名家描写秋的名篇和佳句是举不胜举: “万山红遍,层林尽染。”(壮丽的湘江秋景图) “风急天高猿啸哀,渚清沙白鸟飞回。无边落木萧萧下,不尽长江滚滚来。”(秋风中,杜甫读到的是苍凉) “寒蝉凄切,对长亭晚,骤雨初歇”(柳永读到的是冷清、凄凉)“自古逢秋悲寂寥,我言秋日胜春朝。”(刘禹锡否定古来的悲秋观念,认为秋日胜过生气盎然的春天,表现了一种激越向上的思想感情。)…… 这些名篇和佳句,有的描写秋天的萧杀和凄凉,抒发作者深深的悲秋之感;有的刻画了秋天的绚丽多彩,寄寓了作者浓浓的赞秋之情。而郁达夫却以自己个性鲜明的思想,选择了独特的角度,运用与众不同的手法,写出《故都的秋》这篇散文精品。究竟郁达夫笔下的秋是怎样一种景象?“秋”景如何?“秋”意怎样?下面就让我们一起来学习郁达夫的《故都的秋》。(板书课题、作者) 二、释题 “故都”北平,即现在的北京,作者为什么不称“北平的秋”而叫“故都的秋”呢? 明确:北平曾作过元、明、清三个朝代的都城,可谓历史悠久,文化深厚,突出北平历史悠久。“故”有“从前的”、“过去的”的意思。人
《中级无机化学》试题及答案
西北大学化学系2003~2004学年度第二学期 《中级无机化学》试题及答案 一 按要求回答下列各题(6×5) 1 (1) 确定化合物B 10CPH 11的构型并予以命名; (2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。 解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子, n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1, 属闭式结构 命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11) (2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解 n -2=s +t m -2=2-2=0=s +x n -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2; 2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。 解: △Lat H m θ(LiH, s) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则, (1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构; (2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。 解:(1) 根据pK a 值判断,应有相同非羟基氧原子。 H 3PO 4: H 3PO 3: H 3PO 2: (2) H 3PO 4:一个非羟基氧原子,pK a 值约为2;H 2PO 4-:pK a 值增加5,约为7;HPO 42 -pK a 约为12。 4 用VSEPR 理论预言下列分子或离子的结构,并写出它们所属的点群: f m θ P H HO HO P OH HO HO P H HO H
故都的秋优秀教案
故都的秋优秀教案Last revision on 21 December 2020
教学目标 1、了解文章“景”和“情”和谐统一的写作特点。 2、体会作者在秋景中所寄托的感情。 3、联系文中所写的五幅秋景图,进一步掌握散文稿“形”与“神”的关系。 4、根据自己的主观色彩,有意识地选择几处景物,写几个片段。 教学重点 1、本文写故都的秋天,为何不详写故都秋天的着名风景 2、本文题为“故都的秋”,文中却多次提到南国之秋,为什么 教学过程 一、题解 “故”字,饱藏着眷念热爱故都之情。“秋”揭示了本文的描写角度。全题点出地点和节令,洗练含情。很值得品味。“故都”表明描写的地点,含有深切的眷念之意,“秋”字确定描写的内容,题目明确而又深沉。 文章将自然的“客观色彩”——故都的秋色,与作家内心的“主观色彩”——个人心情,自然地融化在一起,秋中有情的眷念,情中有秋的落寞。“北国的秋,却特别地来得清、来得静,来得悲凉”,全文紧扣“清”“静”“悲凉”落笔,以情取景,以景显情,信手写来情景浑然一体。 二、作者及时代背景 郁达夫(1896—1945),现代作家。浙江省富阳县人。1913年留学日本,曾广泛涉猎外国文学,深受近代欧洲、日本各种社会思潮和文艺作品的熏陶。1922年回国,从事文学创作活动,与郭沫若、成仿吾等组织了“创造社”,并曾在北京大学、武昌师范大学、中山大学任教。1930年参加中国左翼作家联盟。抗日战争爆发后,赴武汉投入抗日救亡运动,并到新加坡积极宣传抗日。后流亡到苏门答腊。1945年9月被日本宪兵秘密杀害。主要作品有短篇小说《沉沦》《春风沉醉的晚上》《薄奠》《出奔》《她是一个弱女子》《茫茫夜》等,在不同程度上揭露了旧社会的罪
中级无机化学习题和答案
中级无机化学习题 第二章 对称性与群论基础 1、利用Td 点群特征标表(右表)回答下列问题 (1)、群阶,对称操作类数,不可约表示数 (2)、SO 42-离子中S 原子3p x 轨道及3d xy 轨道所属的不可约表示 (3)、可约表示Г(10,-2,2,0,0)中包括了 哪些不可约表示?SO 42-离子是否表现为红外活性?SO 42-离子是否表现为拉曼活性的? 解:(1)点群的阶h=8;对称操作类=5;不可约表示数=5 (2)S 原子的P X 轨道所属不可约表示为T 2表示。 (3)()01231)2(811018 1 11=??+?-?+??=?Γ?=∑i A g h a χ;同理 02 =A a ;11=T a ;12=T a ;2=E a ;故可约表示E T T 221)0,0,2,2,10(⊕⊕=Γ- 因T 2表示中包含(x,y,z )和 (xy,xz,yz),故既表现为红外活性又表现为拉曼活性。 2 (1)、点群的阶,对称操作类数,不可约表示数 (2)、NH 3分子中偶极矩所属的不可约表示 (3)可约表示Г(6,0,2)中包括了哪些不可约表示? 解:(1)点群的阶h=6; 对称操作类=3;不可约表示数=3 (2)NH 3分子中偶极矩所属不可约表示为A 1表示 (3)()21231021616 1 11=??+??+??=?Γ?= ∑i A g h a χ;同理 02=A a , 2=E a ; 故可约表示E A 221)2,0,6(⊕=Γ 3 (1)、点群的阶,对称操作类数,不可约表示数 (2)、SF 5Cl 分子中S 原子Px 轨道所属的不可约表示 (3)、可约表示Г(4,0,0,-2,0)中包括了哪些不可约表示?
《故都的秋》教案(优秀教案)
《故都的秋》教学设计 【教材分析、学情分析】 本文是现代散文中的名篇,感情浓厚,意味隽永,文辞优美。由于本文的写作离今天已经久远,学生要充分把握文中的意蕴和情味可能有些困难,所以应当先作些作者情况和背景介绍,并提示学生诵读,宜慢不宜快,认真体会景物描写所蕴含的思想感情。围绕文眼“清、静、悲凉”,体会理解本文“以情驭景,以景显情,情景一体”的艺术手法,学会分析借景抒情散文的阅读方法。理清文章结构,深入体会作者的情感。抓住关键句和词语进行品评和鉴赏语言特色、艺术手法。 【教学目标】 1、理解本文“以情驭景,以景显情,情景一体”的艺术手法,学会分析借景抒情散文的阅读方法。 2、理清文章结构,深入体会作者的情感。 3、抓住关键句和词语进行品评和鉴赏语言特色、艺术手法。 【重点】 1、品味语言。 2、学习以情驭景、以景显情的艺术手法。 3、理解本文“主观情”与“客观景”的自然融合。 【难点】 准确把握作者丰富的情感内涵。 【教学方法】 1、朗读法 2、提问法 3、对比法 4、合作探究 【教具准备】 多媒体 【课时安排】 3课时 【教学步骤】
一、导入: 自古以来中国就有“女伤春,士悲秋”的传统,这“士悲秋”说的是中国的文人大多有一种悲秋情结。翻开文学史册,有多少人行走在秋风秋雨之中。有人独立寒秋,他看到的是“万山红遍,层林尽染,漫江碧透,百舸争流,鹰击长空,鱼翔浅底,万类霜天竞自由”,他感到的是无限的壮美!此人是谁?(毛泽东)有人在风中登高,他看到的是“无边落木萧萧下,不尽长江滚滚来”,他感到的是时光飞逝、壮志难酬的悲凉!此人是谁?(杜甫)有人在夕阳下悲叹,他看到的是“枯藤老树昏鸦,小桥流水人家,古道西风瘦马,夕阳西下,断肠人在天涯”,他感到的是漂泊的孤独与苍凉!此人是谁?(马致远)我们不难发现:不同的人,他们眼里的秋景不同,因为他们的情感有别。是啊,“一片自然风景就是一个心灵的世界”。下面,我们就一同走进散文大家郁达夫的《故都的秋》<板书>,走进郁达夫的心灵世界吧! 二、走近作者: 三、初步感知,朗读课文。 1、生自愿读,每人几段。(其他同学认真听,注意字音、节奏、情感),老师补充PPT8 2、听音频,作对比。 四、解题。 “故都”指什么地方?作者为什么不称“北平的秋”而叫“故都的秋”呢? 明确:北平、北平曾作过元、明、清三个朝代的都城,可谓历史悠久,文化深厚,突出北平历史悠久。现在的都城是南京,“故”有“从前的”、“过去的”的意思。人们对“从前的”、“过去的”的事物往往会产生怀念、眷恋等感情。譬如:漂泊在外者称自己魂牵梦萦的家乡为“故乡”,对与自己友情深厚的朋友称“故人”。从“秋”字可以看出,文章描写的是秋景。因此从标题看,这是一篇饱含着眷恋深情的情景交融的文章。 五、探究思考。 (一)、探讨2、13自然段。
西南大学《中级无机化学》网上作业题及答案
[0049]《中级无机化学》网上作业题答案 第一批次 [单选题]Fe3+与F-、Cl-、Br-、I-形成配合物,其稳定性最大的是()。 A:Fe3+与F-形成配合物 B:Fe3+与Cl-形成配合物 C: Fe3+与Br-形成配合物 D:Fe3+与I-形成配合物 参考答案:A [多选题]实验室配制SnCl2溶液时,必须在少量盐酸中配制(而后稀释至所需浓度),才能得到澄清溶液,这是由于() A:形成缓冲溶液 B:盐效应促使SnCl2溶解 C:同离子效应 D:阻止SnCl2水解 参考答案:CD [单选题]硼酸H3BO3是一种()。 A:一元中强酸 B:一元弱酸 C:三元弱酸 D:三元中强酸 参考答案:B [单选题]HF、HCl、HBr、HI的酸性最强的为()。 A:HF B:HCl C:HBr D:HI
参考答案:D [单选题]以HF为溶剂,醋酸为()。 A:酸 B:碱 C:盐 参考答案:B [单选题]在水中TlBr的溶解度比TlBr3的溶解度()。 A:大 B:小 C:相等 参考答案:B [单选题]LiF、LiCl、LiBr、LiI在水中溶解度最大的为()。A:LiF B:LiCl C:LiBr D:Lii 参考答案:D [单选题]HCO3-的共轭碱为()。 A:CO32- B:H2CO3 C:没有共轭碱 参考答案:A [单选题]H2PO4-的共轭酸为()。 A:HPO42- B:H3PO4 C:PO43-
参考答案:B [论述题]解释CF3COOH的酸性比CH3COOH的酸性强. 参考答案:是因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。当H原子解离后,生成的阴离子CF3COO?中形成离域∏34,大大增加了该阴离子的稳定性。因此CF3COOH具有很强的酸性。 [填空题] 判断相对Lewis碱性(1) (H3Si)2O和(H3C)2O;其中较强的是。 参考答案:(H3C)2O 第二批次 [单选题][Co(NH3)4Cl2]+有( ) 种几何异构体。 A:2 B:3 C:4 D:5 E:6 参考答案:A [填空题]配合物[Co(NH3)5Br]SO4中中心原子Co的配位数是()。 参考答案:6 [多选题]采用下列杂化能形成外轨型配合物的有()。 A:sp3d2 B:sp3 C:d2sp3 D:d4sp3 参考答案:AB [单选题][ZnCl4]2-为()构型,[PtCl4]2-为()构型。 A:平面正方形, 平面正方形 B:正四面体, 正四面体 C:正四面体, 平面正方形 D:平面正方形,正四面体
北京大学中级无机化学答案
无机化学习题参考答案(II) 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32 3v C (3)N 2O (N N O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4 d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4) 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3C CH 3 N P F F H 3C CH 3 N B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。 第二章
中级无机化学复习试题(精品文档)_共3页
中级无机化学复习题 1.为什么第二周期与第三周期同族元素性质存在明显差异? 2.为什么在矿物中Mg、Ca、Sr、Ba等金属离子以氧化物、氟化物、碳酸盐和硫酸盐等形式存在?Cu、Ag、Pb、Zn、Hg则以硫化物形式存在? 3.通过计算说明钾原子最后一个电子填充在4s 轨道上。 4.比较Lewis碱强度:NH3NF3NCl3NBr3 比较Lewis酸强度:BBr3BCl3BF3 5.完成下列化学反应: CO(NH2)2+H2SO4→ HNO3 +HF → H-+NH3 → 6.由于形成水合物必须放热,试分析M c X a(s)在298K时形成四水合物至少放热多少?(假定正、负离子在无水盐和含水盐中对摩尔熵的加和贡献相等。 已知每mol晶格水对水合物的摩尔熵的独立加和贡献约为39 J·K-1·mol-1,S mθ(H2O,l)=69.91 J·K-1·mol-1) 7.试通过估算Xe[PtF6]的反应焓变来说明由Xe(g)和PtF6(g)可以制备Xe[PtF6]。 (已知:PtF6-的半径为310 pm,Xe+半径为180 pm;Xe(g) 的第一电离能I1=1170 kJ mol-1,PtF6(g)的电子亲合能-771 kJ mol-1) 8.利用HSAB理论判断下列反应进行的方向,并说明理由。 HgF2 + BeI2= BeF2 + HgI2 Ag+ + HI = AgI + H+ 9.下图为自由能-温度图,回答下面问题: (1)为什么CO2线几乎与温度坐标轴平行,而CO线是一条向下的斜线? (2)已知CO2线有△Gθ=-393.5-3.3×10-3T,CO线有△
G θ=-221-0.18T ,求二线交点温度。 (3) 分别写出当温度低于和高于交点温度时,用碳还原金属氧化物MO 时的反应方程式? (4)为什么可以采用加热的方法制备Ag? 10.通过设计热力学循环计算CrCl 的生成焓,并讨论其能否稳定存在?(已知Cr +的半径估计约为100 pm, r (Cl -)=181 pm ,Cr 的升华焓和电离能 分别为397和653 kJ mol -1,Cl 2的离解能为243.4 kJ mol -1, Cl 的电子亲合能为 368.5 kJ mol -1) 。11. 已知酸性介质中下面两个元素的元素电势图: 请回答下列问题: 1) 计算:φo (IO 3-/I -)=? φo (IO 3-/HIO)=? 2) 指出电势图中哪些物质能发生歧化反应; 3) 在酸性介质中H 2O 2与HIO 3能否反应; 4) 在酸性介质中I 2与H 2O 2能否反应;5) 综合3)、4)两个反应,HIO 3与H 2O 2反应最终结果是什么?用反应式说明. 12. 利用价层电子对互斥理论完成下列问题 1)判断ClF 3、IF 5分子结构,画出分子构型图,说出构型名称。 IO 3- HIO I 2 I - 1.1951.450.535O 2 H 2O 2 H 2O 1.770.68
故都的秋优质课教案
故都的秋优质课教案 故都的“秋”,其实是郁达夫的“秋”,是表现了他主观感情、审美取向、文学气质和人生态度的“秋”。本文的悲凉美感,跟传统的悲秋情结有关,跟作者的身世性格有关,跟作品的创作背景也有关。下面是故都的秋优质课教案,欢迎阅读。 故都的秋优质课教案教材分析 《故都的秋》是人教版必修2第一单元的第二篇课文。这个单元主要学习写景状物散文。本单元的教学要求是通过鉴赏品味语言,向深层次赏析作者的情感,领悟文中的哲理。引导学生能通过文章精巧、绵密的构思,深入品味文中富有情感与哲理的语言。在欣赏语言的过程中,使学生从文章的“景语”里,品读出作家笔下“景”的独特之美,进而品读出作家的独特心境,品读出作家蕴含于文中的独特的情与理,体会作者的情态与志趣。 《故都的秋》是郁达夫在对故都北平的秋景细腻描摹中流露出自己内心的眷恋和落寞之情的作品,体现出这位文人当时的处境和浓重的“主观色彩”。作者通过独特的表现手法,表现出了“秋”独特的风姿,独特的色彩,独特的音响,独特的韵味,独特的意境。
学情分析 我的教学对象是高中一年级的学生,学生对散文并不陌生,能对散文的语言美、意境美,进行过初步的鉴赏。 通过早读的自读与齐读课文后,学生大多反映喜欢郁达夫细腻的文字,喜欢他笔下的秋的独特的韵味。但同时,由于对于作者以及作者所处的时代的陌生,他们普遍反映不大能理解作者当时的心境,也难以领悟主观色彩笼罩之下的景物描写的妙处,难以在情感上产生共鸣。 学生大多喜欢散文,同时思维能力和审美能力也正在形成之中。所以,课堂充分利用他们的兴趣引导他们进入特定的审美意境,既让学生鉴赏课文,又指导学生学会鉴赏的方法,并对作者与背景予以详细介绍,可让学生逐步学会品味课文并逐步走入作者内心。 教学目标 1.知识与能力:了解郁达夫的思想和创作风格。领悟作者在文中流露的主观情感。品味文章简洁清丽的语言。 2.过程与方法:由景入情,品味文章以情驭景、情景交融的艺术特色。 3.情感态度与价值观:体会作者在山河破碎、内外交困的现实下,热爱、眷恋故都的美好情感以及内心的忧思及落
中级无机化学1-5章年习题答案
无机化学习题参考答案 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4- d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4)- 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3CH 3 P F F H 3CH B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
故都的秋优秀教案
故都的秋优秀教案 秋天,无论在什么地方的秋天,总是好的;可是啊,北国的秋,却特别地来得清,来得静,来得悲凉。下文是的故都的秋优秀教案,欢迎阅读参考! 一、教学设计理念: 随着课程改革的深入发展,教师纷纷开始生成性课堂的教学探求。生成性的语文课堂就好像是塞林格笔下的“麦田”:有一群孩子在课堂“麦田”里自由自在地游戏、狂奔、乱跑,新的活动不断生成。教师就是站在那“麦田”悬崖边的守望者,守望着这片麦田,哪个孩子往悬崖边奔来,就把他捉住,不让一个孩子掉下“悬崖”,不让学生迷失于“课堂生成”。 在这堂课的设计上,以激发学生自主学习的兴致和开发性学习 的欲望为起点,课堂上适度发挥主导作用,给予学生有效的价值引导和点拨,对于学生生成的单一的信息资源,通过追问补充的方式将他们带到思维的边缘,让思考“向青草更青处漫溯”。 二、教材分析: 《故都的秋》是新课标人教版高中一年级的教学内容,具体编 排在必修2第一单元的第二篇。本单元所选的三篇课文都是抒情散文,单元的教学要求是通过鉴赏品味语言,向深层次赏析作者的情感。在欣赏语言的过程中,使学生从文章的“景语”里,品读出作家的独特心境,体会作者的情态与志趣。
《故都的秋》是郁达夫将自然界的“客观色彩”——故都的秋色,与作家内心的“主观色彩”——个人的心情,自然融化在一起,表现出故都之秋的特色和作者的独特感受的作品。以提高学生的语文实用阅读能力和增强学生的主动性为教学设计的出发点,我将本文分为两课时来学习。第一课时从内容和背景方面研读文章,感悟探究作者情感;第二课时从语言和艺术手法方面,体察作者情感。这是第一课时的设计方案。 三、学情分析: 学生是学习的主体,我的教学对象是高中一年级的学生,学生对散文是不陌生的,学过朱自清的《荷塘月色》等散文,感受过散文的语言美、意境美,进行过初步的鉴赏。要充分利用他们的兴趣引导他们进入特定的审美意境,既要让学生鉴赏课文,又要指导学生学会鉴赏的方法。 四、教学目标: 根据新课程标准的要求,结合该课的特点以及所教学生的实际情况,制定如下教学目标: 知识与能力目标: (1)了解文章“景”和“情”和谐统一的写作特色,进一步掌握散文“形”与“神”的关系; (2)掌握散文的阅读方法,陶冶学生性情,提高审美能力。 情感与态度目标:体会作者在秋景中所寄托的感情。 五、本课时教学重点、难点及依据:
《故都的秋》优质课一等奖教案
《故都的秋》教案 一、教学目标 1.知识与能力 品味文本精致细腻的悲凉美 学习文本抓景物特征写景的手法 2.过程与方法 培养朗读感悟、品味揣摩语言的能力。 3.情感态度与价值观 感受作者的审美情趣,提高审美能力 二、教学重点、难点 感受文本精致细腻的悲凉美,提高学生的审美能力 三、教学方法 整体感知——朗读品味——鉴赏评价——实践创新 四、学习方式 自主、合作、探究 五、设计思路 作者眼中,“悲凉”是美好的,哪怕是秋天带来的死亡都是美好的,作者感受到的秋的衰败、秋的死亡,其实就是一种人生的感悟,一种对生命的认识,因此在作者看来,这是一种人生享受。反映出作者的高雅的人生境界。本课设计紧扣“清、静、悲凉”,结合自己的感受品味写景文字的特点。 六、教学过程 (一)、导语设计 毛泽东独立于橘子洲头,看到“万山红遍,层林尽染……万类霜天竞自由”,感受到的是壮丽;杜甫登高,远望“风急天高猿啸哀,渚清沙白鸟飞回。无边落木萧萧下,不尽长江滚滚来。”的景象,感受到的是悲凉。柳永在“寒蝉凄切,对长亭晚,骤雨初歇”秋雨里,感受到的是凄苦。由此可见,一切景语皆情语。那么,达夫对于“故都”的秋又寄予了怎样的情怀呢?我们一起来评赏、探究一下郁达夫写于七十年前的一篇散文——《故都的秋》。 (二)、整体感知
作家作品简介:郁达夫和郁达夫优美、颓废、伤感和灰冷的文风。 (幻灯片显示资料,老师给予介绍。)(三)、解题 从标题看作者的情感倾向和文章的风格: “故都”二字意味着北平不再是垂拱天下的政治中心,亦非京都繁华之地,但还是拥有数百年辉煌的历史文化的旧都。 “故都”与“秋”所组合的标题,既让人肃然感受到故都的苍凉和凄清,也会很自然地读出作者心中对这座历史名城的珍爱、赞叹及深情的眷恋和向往。 (出示幻灯片) (四)、鉴赏 1.故都的秋的总体印象? 清——静——悲凉 2.给文中出现的5幅画分别起一个名字? 小院清秋——秋槐落蕊——秋蝉残声——秋雨斜阳——清秋佳果 3. 作者用一支生花妙笔,把浓浓的秋味展现得淋漓尽致,但作者觉得这样仍然意犹未尽。因此在第13段,再次提到了北国的秋和南国的秋,与前文呼应,并运用形象的比喻,以排比的句式进行鲜明的对比来体现两者的不同。 南国的秋本体北国的秋 甘甜可口黄酒白干清香后劲足 如回味不永 秋之内蕴 食之有味稀饭馍馍有味耐饥不浓易饿如秋之隽永味美细腻鲈鱼大蟹可大快朵颐玲珑如意跋涉千万里剔刺而食黄犬骆驼得秋之爽气逗玩邀宠有秋之辽阔4.本文的结构:
中级无机化学唐宗薰版课后习题第九章答案
?9ゴд乬 1??? ???? ? ?? FAN ? ? ??(1) V(CO)6 V ?5?6CO ?12? 17??? (2) W(CO)6 W ?6?6CO ?12? 18?? (3) Ru(CO)4H Ru ˇ?7?4CO ?8?H ˉ?2? 17??? (4) Ir(CO)(PPh 3)2Cl Ir ˇ?8?CO ?2?2PPh 3?4?Cl ˉ?2? 16?? (5) Ni(?5-C 5H 5)(NO) Ni ˇ?9?C 5H 5ˉ?6?NO ?3? 18?? (6) PtCl 3(?2-C 2H 4)ˉ Pt 2ˇ?8?3Cl ˉ?6?C 2H 4?2? 16?? 2? ? ?Ё ? M ˙M ????М? ??(1) Fe 3(CO)123h 8 (Fe)ˇ12h 2 (CO)˙48 (3h 18ˉ48)/2˙3? ? ?? ??Fe ???Fe ?? ?? ? M ˙M ??(2) H ˇ2[Os 3(CO)10]2ˉ3h 8 (Os)ˇ10h 2 (CO)ˇ2(???)˙46 (3h 18ˉ46)/2˙4? ?? ??Os ???Os ?? ?? ? ? M ˙M ?? (3) H ˇ4[Re 4(CO)12]4ˉ4h 7 (Re)ˇ12h 2 (CO) ˇ4(???)˙56 (4h 18ˉ56)/2˙8? ?? ?Re ? ?Re ?? ?? ? ? M ˙M ?? (4) [Re 4(CO)16]2ˉ4h 7 (Re)ˇ16h 2 (CO)ˇ2(???)˙62 (4h 18ˉ62)/2˙5 ? ?? ?Re ? ?Re ? ?? ? M ˙M ?? 3 [HFe 4(CO)13]ˉ H 3Os 4(CO)12I ??? ?? ? П? ?? ? ?? ? 4? ? ?Ё?CO ? ??? ?? ?М?В?? ? ?? ? ? ?Ё?CO ? ? ?????? ? ッ ??? ? ? ??? ? ??? 5??[Re 2Cl 8]2ˉ ? ????? ? ???М ? ?? ?? ? к9.7.1??? ˉ? ??Ё [Re 2Cl 8]2ˉЁ?? ?? ?? 6 ㄨ? ?乬: (1)??М? ?Ё?? ? ? ??( Fe(CO)5) ? ??( [Co(CO)4]ˉ)?(a)[HFe 4(CO)13]ˉ(H ? ) (b)H 3Os 4(CO)12I ?? C O M M (a)(b)(c)(d)(e) CO ? ? ??? (a) ッ ?? (b) ?? ?? (c) ? ??(d)?? ??(e)? ??
第十二章中级无机化学课后习题答案
第12章习题 1 解释下列名词术语: 核素 同位素 衰变 放射性 K-电子俘获 衰变速率 半衰期 平均寿命 放射性衰变定律 衰变系 质量数 质量亏损 结合能 平均结合能 质能相当定律 幻数 超重元素 裂变 核聚变 超重岛 解答:核素具有一定数目的质子和一定数目的中子的一种原子。 同位素具有相同质子数和不同中子数的核素互称同位素。 衰变原子核自发地发生核结构的改变。 放射性从原子核自发放射出射线的性质。 K-电子俘获人工富质子核可以从核外K层俘获一个轨道电子,将核中的一个质子转化为一个中子和一个中微子。 衰变速率放射性核素衰变的快慢程度。 半衰期放射性样品衰变掉一半所用的时间。 平均寿命样品中放射性原子的平均存活时间。 放射性衰变定律放射性衰变速率R(或放射性物质的放射活性A)正比于放射核的数量N,即A =R=-dN/dt=λN。 衰变系把大多数原子序数大于81的天然放射性核素根据它们的质量不同划分为的四个放射系列。 质量数质子数与中子数之和。 质量亏损一个稳定核的质量小于组成它的各组元粒子的质量,其间的差额叫做质量亏损。 结合能原子核分解为其组成的质子和中子所需要的能量。 平均结合能每个原子核的结合能除以核子数。 质能相当定律一定的质量必定与确定的能量相当。 幻数稳定的核素所含的质子、中子或电子的个数呈现的特殊的神奇数字。 超重元素原子序数大于109号的元素。 裂变原子核分裂为两个质量相近的核裂块,同时还可能放出中子的过程。 核聚变轻原子核在相遇时聚合为较重的原子核并放出巨大能量的过程。 超重岛由超重元素占据的“稳定岛”。 2 区分下列概念: α粒子与He原子结合能与平均结合能α-射线与β-射线 答:α粒子指的是带2个单位正电荷的氦核;而He原子则不带电荷。 结合能是根据质能相当定律算出的由自由核子结合成原子时放出的能量;而平均结合能是结合能除以核子数得到的数值。 α-射线指的是带2个单位正电荷的氦核流,而β-射线是带1个单位负电荷的电子流。 3 描述α、β和γ-射线的特征。 答:α-射线指的是带正电的氦核流,粒子的质量大约为氢原子的四倍,速度约为光速的1/15,它们的电离作用强,穿透本领小。 β-射线是带负电的电子流,粒子的质量等于电子的质量,速度几乎与光速接近,其电离作用弱,故穿透本领稍高,约为α射线的100倍。 γ-射线是原子核由激发态回到低能态时发射出的一种射线,它是一种波长极短的电磁波(高能光子),不为电、磁场所偏转,显示电中性,比X-射线的穿透力还强,因而有硬射线之称,可透过200 mm厚的铁或88 mm厚的铅板,没有质量,其光谱类似于元素的原子光谱。 4 计算下列顺序中各元素的质量数,原子序数及所属的周期族: 162
