溴乙烷消去反应的实验设计
龙源期刊网 https://www.360docs.net/doc/ef18238321.html,
溴乙烷消去反应的实验设计
作者:王峰叶晓峰陈晓东
来源:《化学教与学》2019年第01期
氧化还原反应知识点归纳 (氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。) 氧化还原反应中的概念与规律: 一、五对概念 在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是: 二、五条规律 1、表现性质规律 同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。 2、性质强弱规律 3、反应先后规律 在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原 剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr 2溶液中通入Cl 2 ,首先被氧 化的是Fe2+ 4、价态归中规律 含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。 5、电子守恒规律 在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。 三.物质氧化性或还原性强弱的比较: (1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱
非金属阴离子的还原性随其单质的氧化性增强而减弱 (2)由反应条件的难易比较 不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如: 前者比后者容易发生反应,可判断氧化性:。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。 (3)根据被氧化或被还原的程度不同进行比较 当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。 如,根据铁被氧化程度的不同, 可判断氧化性:。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。 (4)根据反应方程式进行比较 氧化剂+还原剂=还原产物+氧化产物 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物 (5)根据元素周期律进行比较 一般地,氧化性:上>下,右>左;还原性:下>上,左>右。 (6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关: 温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。 浓度:如浓硝酸的氧化性比稀硝酸的强。 酸碱性:如中性环境中不显氧化性,酸性环境中显氧化性;又如溶液的氧化性随溶液的酸性增强而增强。 注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性:,氧化性:。 【注意】氧化还原反应中的不一定: ⑴含有最高价态元素的化合物不一定具有强氧化性。如前述的氯元素的含氧酸及其盐, 是价 态越低,氧化性超强。H 3PO 4 中+5价的P无强氧化性。 ⑵有单质参加的反应不一定是氧化还原反应。如同素异形体之间的转化。 ⑶物质的氧化性或还原性与物质得到或掉失去电子的多少无关。 ⑷得到电子难的元素失去电子不一定容易,例如:第ⅣA族的C,既难得到电子,又难 失去电 子,与其它原子易以共价键结合。 ⑸元素由化合态变为游离态不一定是是氧化反应,也可能是还原反应。 四、常见的氧化剂和还原剂 1、常见的氧化剂 (1)活泼的非金属单质:Cl 2、Br 2 、O 2 、I 2 、S等 (2)元素处于高价时的氧化物:CO 2、NO 2 、SO 3 、MnO 2 、PbO 2 等 (3)元素处于高价时的含氧酸:浓H 2SO 4 、HNO 3 等 (4)元素处于高价时的盐:KClO 3、KMnO 4 、FeCl 3 、K 2 Cr 2 O 7 等
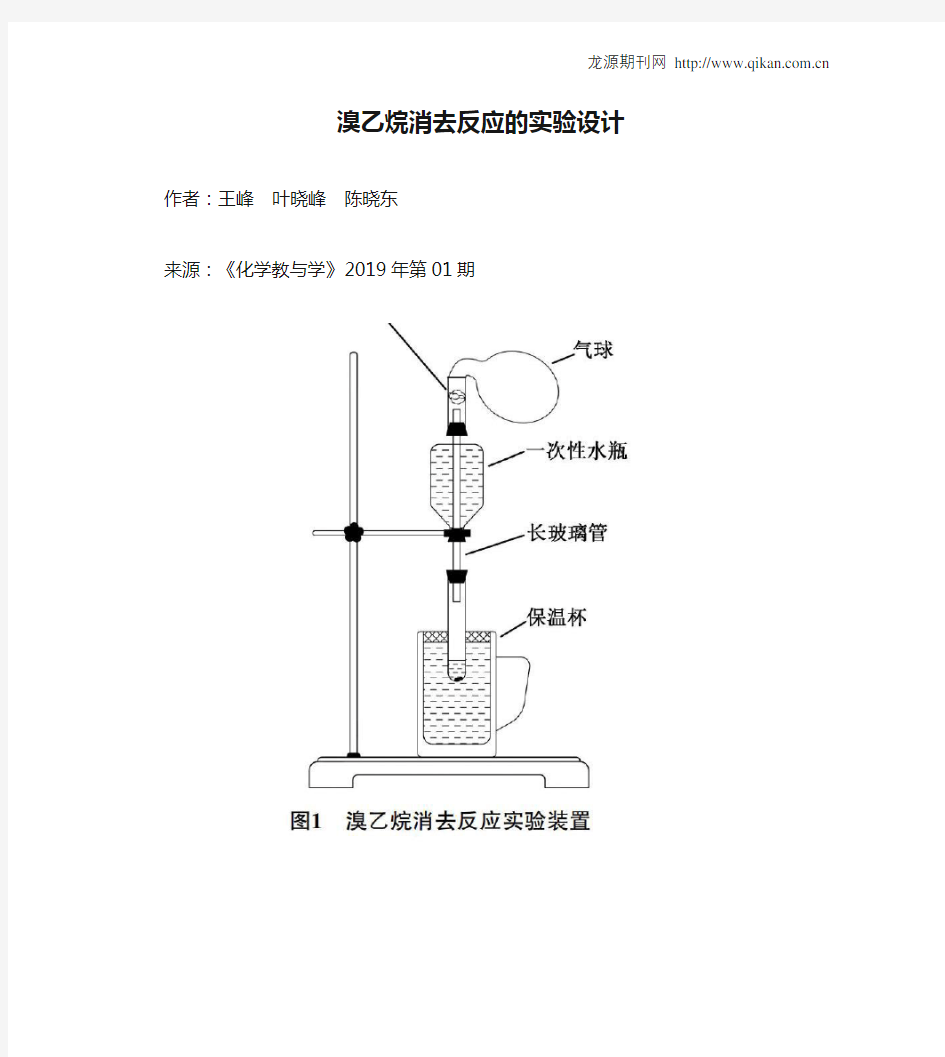
探究溴乙烷消去反应的实验设计在高中有机实验中,溴乙烷的消去反应是一个比较难做的实验,原因主要有两点。首先,在氢氧化钠的乙醇溶液中,卤代烃的取代与消去是竞争关系,且伯卤代烃的取代反应占有绝对优势[1],消去产物乙烯较少,难以检验。再者,溴乙烷沸点较低(38.8℃),在较合适的反应温度(90℃)[2]下很快沸腾,消耗一空,后续检验装置中往往出现大量油状馏出物,证明了溴乙烷利用率极低,产物自然极少。因此,教材并没有将溴乙烷的消去反应列为演示实验。很多研究者为了完成卤代烃消去反应的实验,采取了更换反应物的办法,如利用二氯乙烷[3]、1-溴丙烷、2-溴丙烷等物质替代溴乙烷完成性质演示实验。虽然效果有了较好的提升,但毕竟不是溴乙烷的消去反应。从结构上讲,溴乙烷是能同时实现水解和消去的最简单的卤代烃,其水解产物和消去产物能和教材中其他种类有机物很好地实现衔接。所以,做好溴乙烷消去反应的实验是必要的。 一、溴乙烷消去实验装置设计 1.实验装置通过以上分析不难发现,溴乙烷的消去反应实验存在溴乙烷易沸腾、利用率低和消去产物少、不易检验两个难点。基于这两点我设计了一套实验装置来进行实验。溴乙烷易沸腾,使用较长的玻璃管进行冷凝回流,效果并不好,如加装球形冷凝管则极大地增加了装置的复杂程度,且在教室中冷凝水的来源也是个不易解决的问题。我根据水冷原理和反应体量小的实验特点设计了溴乙烷消去反应实验装置简易水冷装置:装置使用一根长玻璃导管,穿上橡胶塞,将饮
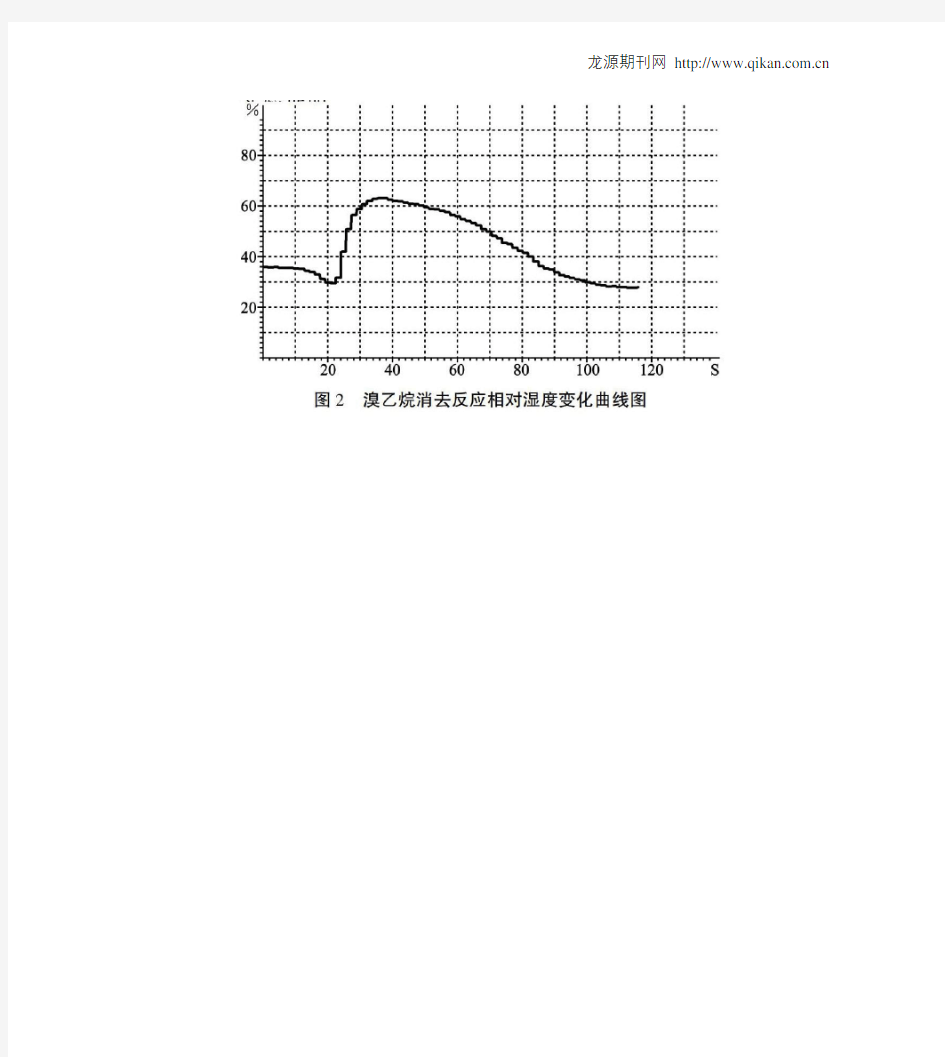
料水瓶口塞在胶塞上,并在瓶盖上打孔旋紧盖子以固定瓶体。实验前将冷水从上口倒入,对玻璃管起到冷却作用。实验证明该设计具有较好的冷凝效果,可维持溴乙烷在90℃下持续反应约2分钟,大大提高了反应物的利用率。乙烯检验装置:关于消去反应乙烯生成量小、不易检验的问题,我改变了检验方法。在长玻璃导管上端加装玻璃管,其中放置蘸有溴的四氯化碳溶液棉花,用于检验乙烯。上套气球或塑料袋收纳蒸气,可以防止溴乙烷蒸气挥发污染环境,保护实验者健康。加热方式:反应的加热方式也有改进,用盛有沸水的保温杯替代酒精灯,既容易控制温度,又简化实验器材,利用教室的饮水机的热水方便地实现加热条件。 2.实验过程实验开始,向试管中添加3mL溴乙烷、5mL饱和氢氧化钠的乙醇溶液,并加入2粒沸石,浸入保温杯的热水中。反应开始半分钟后,棉花的橙色即有明显的褪色变化,证明反应和检验效果良好。设计完全贴合教材环节安排[4],为能不能用酸性高锰酸钾溶液检验乙烯留有探究空间。 二、溴乙烷消去反应产物水的检验 手持技术中的数字化传感器,越来越多地应用到了实验之中,将原本推测、定性的问题表现为直观和定量。在本实验中,利用数字化相对湿度传感器进一步实现了对消去反应产物水的测定。本实验使用朗威相对湿度传感器和配套软件(全国版V8.0),运行于windowsXP 系统。实验环境温度32.5℃,相对湿度47.6%。 1.检验过程实验前,将传感器探头通过胶塞插入试管,保持在试
高中有机反应条件总结 1.根据物质的性质推断官能团,如:能使溴水反应而褪色的物质含碳碳双双键、三键“-CHO”和酚羟基;能发生银镜反应的物质含有“-CHO”;能与钠发生置换反应的物质含有“-OH”;能分别与碳酸氢钠镕液和碳酸钠溶液反应的物质含有“-COOH”;能水解产生醇和羧酸的物质是酯等. 2.根据性质和有关数据推知官能团个数,如:-CHO→2Ag→Cu20;2-0H→H2;2-COOH(CO32-)→CO2 3.根据某些反应的产物推知官能团的位置,如: (1)由醇氧化得醛或羧酸,-OH一定连接在有2个氢原子的碳原子上;由醇氧化得酮,-OH接在只有一个氢原子的碳原子上. (2)由消去反应产物可确定“-OH”或“-X”的位置. (3)由取代产物的种数可确定碳链结构. (4)由加氢后碳的骨架,可确定“C=C”或“C≡C”的位置. 能力点击:以一些典型的烃类衍生物(溴乙烷、乙醇、乙酸、乙醛、乙酸乙酯、脂肪酸、甘油酯、多羟基醛酮、氨基酸等)为例,了解官能团在有机物中的作用.掌握各主要官能团的性质和主要化学反应,并能结合同系列原理加以应用. 注意:烃的衍生物是中学有机化学的核心内容,在各类烃的衍生物中,以含氧衍生物为重点.教材在介绍每一种代表物时,一般先介绍物质的分子结构,然后联系分子结构讨论其性质、用途和制法等.在学习这一章时首先掌握同类衍生物的组成、结构特点(官能团)和它们的化学性质,在此基础上要注意各类官能团之间的衍变关系,熟悉官能团的引入和转化的方法,能选择适宜的反应条件和反应途径合成有机物. 有机化学知识点总结 1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行. 2.需用温度计的实验有: (1)、实验室制乙烯(170℃)(2)、蒸馏(3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃)(5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计.(2)注意温度计水银球的位置. 3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物. 4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质. 5.能使高锰酸钾酸性溶液褪色的物质有: (1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物 (2)含有羟基的化合物如醇和酚类物质 (3)含有醛基的化合物 (4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等) 6.能使溴水褪色的物质有: (1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成) (2)苯酚等酚类物质(取代)
视觉选择反应时 选择反应时(choice reaction time)又称 B反应时。指的是测试中呈现的刺激不止一个,对每一个随机呈现的刺激要求被试做出相应的反应。有研究表明,人类在对特定的刺激做出特定的动作或反应前,在大脑内有一个信息加工过程,又称心理潜伏期。在复杂任务中心里潜伏期可划分为:(1)刺激识别阶段;(2)选择反应阶段;(3)反应组织阶段和反应执行阶段。选择反应时的研究对理解人类对复杂信息的认知加工过程有重要的意义。通过对个体的选择反应时和反应过程的分析,推测其内在的信息加工过程。 影响选择反应时的因素是复杂的。选择反应刺激的数目越多,则反应时间越长;选择的任务越复杂,则反应时间亦越长。此外年龄、性别、疲劳等因素也会对选择反应时产生影响 本实验材料为不同颜色实心圆,共 4种,分别为红、黄、绿和蓝色。实验时随机呈现,要求被试根据呈现的颜色刺激,选择对应的颜色按键反应。 一、目的 1.学习掌握视觉(颜色)选择反应时的测量方法。 2.了解视觉选择反应时与视觉简单反应时的区别。 3.了解选择反应时在信息加工过程研究中的应用。 二、仪器与材料 1.仪器:PsyTech-EP2009型心理实验台。 2.材料:直径为100像素的4种颜色(红、黄、绿、蓝)圆。 三、方法 1.双击桌面“心仪心理实验平台”图标,弹出登录窗口。对首次登录者请先注册 用户;对已做过实验者用已有用户名和密码登录。双击“电脑实验”,打开 PsyTech-EP2009型心理实验台主界面。选中左侧实验列表中的“视觉选择反应时”,右边呈现实验说明。单击“进入实验”弹出“指导语”窗口。实验者可进行参数设置(或使用默认值)、练习等,也可以单击“开始实验”按钮直接进行实验。 2.指导语如下: 这是一个不同颜色刺激的选择反应时实验。请你使用2号反应盒,端坐屏幕前,用优势手放在反应盒上。眼睛注视屏幕。当出现“预备”时,你要准备反应。并根据屏幕呈现的不同颜色,按相对应的颜色键,要求反应既快又准。程序将自动记录正确反应时和按错的次数。 当你明白了实验要求后,可以先进行练习。然后点击“开始实验”按钮开始。 3.实验开始,屏幕上先出现“预备”,然后随机呈现4种颜色圆(各种颜色呈现 次数相等)。被试根据呈现做出相应选择反应。若出现抢按,或者颜色选择错误则程序自动记录次数,且按错的反应时不参于统计平均。被试每次做出反应后,自动进入下一次实验,直至做完设定的次数。
氧化还原反应与离子反应知识点总结 一、氧化还原反应的有关概念 概念转化: 口诀:升失氧,降得还,若说性,恰相反; 1、在化学反应中,有一种物质被氧化,必定有一种物质被还原,这样的反应叫氧化还原反应。 2、物质失去电子的反应就是氧化反应,物质得电子的反应就是还原反应。 3、凡有电子转移(得失或偏移)的反应就是氧化还原反应。 4、在氧化还原反应中,物质中的原子得电子,则元素的化合价降低被还原,发生还原反应,变成还原产物,则该物质是氧化剂,具有氧化性。 5、在氧化还原反应中,物质中的原子失电子,则元素的化合价升高被氧化,发生氧化反应,变成还原产物,则该物质是还原剂,具有还原性。 二、电子转移的表示方法 1、单线桥法:表示氧化剂与还原剂之间电子转移的方向和总数。 2、双线桥法(了解):表示氧化剂及其还原产物、还原剂及其氧化产物之间得失电子情况。 三、中学常见的氧化剂和还原剂及氧化性、还原性强弱的判断方法 (一)常见氧化剂与还原剂 1、氧化剂 (1)非金属性较强的单质:等;、、、、、322222O O I Br Cl F 还原剂 + 氧化剂 = 氧化产物 + 还原产物 -失 e 还原剂 + 氧化剂 = 氧化产物 + 还原产-还原剂 氧化剂 物 质 产物 氧化产物 还原产物 反应物 生成物 发生还原反应(反应) 具有氧化性(性质) 元素化合价降低 元素化合价升高 具有还原性(性质) 发生氧化反应(反应) 元素失电子 元素得电子 元素被氧化 元素被还原 同时发生 电子转移 变价相等
(2)变价元素中高价态化合物: 、固体硝酸盐等; 、稀、浓、浓、、334272243HNO HNO SO H O Cr K KMnO KClO (3)高价态金属阳离子:等;、、+ ++23e Cu Ag F (4)能电离出H +的物质:溶液等;、、稀稀442NaHSO HCl SO H (5)其他: ()等 、银氨溶液、新制、、、、漂白粉、2222222a OH Cu O H NO O N MnO HClO 2、还原剂 (1)金属性较强的单质:等;、、、、、Zn Fe Al Mg Na K (2)某些非金属单质:等;、、Si C H 2 (3)变价金属中某些低价态化合物: ()及亚硫酸盐等; 及其盐、、、盐、及硫化物、、2222SO HI HBr OH Fe Fe S H CO +(4)其他:单质S 、Sn 2+盐、浓盐酸、NH 3等 (二)氧化性、还原性强弱的常用判断方法(两种题型考法) 1、根据金属活泼性判断 金属的金属性越强,单质的还原性越强,其对应离子的氧化性越弱。 (1)单质的还原性:按金属活动性顺序依次减弱。(强调顺序) (2)离子的氧化性:按金属活动性顺序依次增强(铁指Fe 2+) 如氧化性:++++++>>>>>223Fe H Cu Fe Hg Ag 2、根据非金属的活泼性判断 非金属性越强,单质的氧化性越强,其对应离子的还原性越弱。
第二章 烃和卤代烃 第三节 卤代烃 第2课时 溴乙烷的消去反应 卤代烃的应用 高二 班 姓名 【基础知识】比较溴乙烷的取代反应和消去反应,并完成下表: 学方程式(需注明反应条件): (1)CH 2ClCH 2CH 3:在NaOH 溶液中 ; 在NaOH 的乙醇溶液中 。 (2)CH 3CHClCH 3:在NaOH 溶液中 ; 在NaOH 的乙醇溶液中 。 【课堂练习】2、CH 3Cl 、C(CH 3)3-CH 2Cl 能否发生消去反应?为什么?发生消去反应的卤代烃的分子 结构有什么要求?请举例说明。 【结论】若发生消去反应,分子中的C 原子数≥2;连接卤素原子的碳原子的相邻碳原子上要有氢原子。 【课堂练习】3、 消去反应的产物有几种? 【课堂练习】4、CH 2BrCH 2Br 的消去反应最终生成什么物质? 【课堂练习】5、由1-溴乙烷转化为1,2-二溴乙烷,写出有关的化学方程式。 【课堂练习】6、由乙烷制取乙烯,写出有关的化学方程式。 【课堂练习】 7 、由乙烷制取乙醇,写出有关的化学方程式。 【课堂练习】8、由 制取 ,写出有关的化学方程式。 【课堂练习】9、由 制取 ,写出有关的化学方程式。 CH 3CH CH 2Br CH 3
【课后练习】 1.1-溴丙烷和2-溴丙烷分别和NaOH的醇溶液混合加热,则() A.产物不同B.产物相同C.碳氢键的断裂位置相同D.碳溴键的断裂位置相同2.有机物CH3CH=CHCl能发生的反应有:①取代反应②加成反应③消去反应④使溴的四氯化碳溶液褪色⑤聚合反应⑥使酸性高锰酸钾溶液褪色()A.全部B.除⑤外C.除①外D.除①、⑤外 3.下列卤代烃在KOH醇溶液中加热不反应的是() ①C6H5Cl②(CH3)2CHCH2Cl③(CH3)3CCH2Cl ④CHCl2—CHBr2⑤⑥CH2Cl2 A.①③⑥B.②③⑤C.全部D.②④ 4.(双选)下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是()A.CH3Cl B.CH3CHBr(CH2CH3)C.(CH3)3CCH2Br D.CH3CH2CH2Br 5.为了检验某氯代烃中的氯元素,现进行如下操作。其中合理的是() ①取氯代烃少许,加入AgNO3溶液②取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 ③取氯代烃少许与NaOH水溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液④取氯代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液 A.①③B.②④C.③④D.①④ 6.将1-氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有几种() A.2种B.3种C.4种D.5种 7.为探究溴乙烷与NaOH乙醇溶液发生反应后生成的 气体中是否含不饱和烃,设计装置如图所示。回答: (1)A装置中反应的化学方程式为 。 (2)B装置的作用是。 (3)若省去装置B,C装置中试剂应改为,反应的化学方程式为________________________。8.根据下面的反应路线及所给信息填空。 (1)A的结构简式,B的结构简式。 (2)反应④所用的试剂和条件是。 (3)反应⑥的化学方程式是。9.某烃A与Br2发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为C5H6;将C催化加氢生成环戊烷。试写出A、B、C 的结构简式。 A.B.C.
有机反应的常用条件 李 文 志 一、能使)(4+H KMnO 褪色的物质(氧化反应) 1、含碳碳双键、碳碳三键等不饱和键的物质。 2、苯的同系物 3、醇、酚、醛 二、能与溴水或2Br 的4ccl 反应的物质。 1、含碳碳双键、碳碳三键不饱和键的物质(加成反应) 2、有尽 2Br +(液)??→?3FeBr 化气 Br +HBr (取代反应) 3、苯酚与浓溴水(取代反应) 4、醛基使溴水褪色(氧化反应) HBr COOH CH O H Br CHO CH 23223+→++ 三、与2H 加成反应(Ni 作催化剂)(还原反应) 1、33222CH CH H CH CH Ni ?→?+= 2、3322CH CH H CH CH Ni ?→?+≡ 3、苯环与氢气加成 4、OH CH CH H CHO CH Ni 2323?→?+ 5、33233COHCH CH H COCH CH Ni -?→?+ 四、在NaOH 溶液条件下的反应 (一)卤代烃的水解反应和消去反应 1、NaBr OH CH CH NaOH Br CH CH 、+???→?+2323加热水 2、O H NaBr CH CH CH NaOH Br CH CH 、22323++=-???→?+加热乙醇 (二)酯的水解反应 3、OH CH COONa CH NaOH COOCH CH 3333+→+
(三)酚与NaOH 反应 4、 →+N a O H OH O H O N a 2+ (四)羧酸与NaOH 反应 O H COONa CH NaOH COOH CH 233+→+ 五、在浓硫酸、加热条件下的反应(一般有水生成,浓硫酸作用的催化剂、吸水剂) 1、 +????→?加热浓、SO H HNO 423 O H NO 22+ 取代反应 2、O H CH CH C HSO OH CH CH 222423170+↑=?浓 消去反应 3、乙酸与乙醇在浓硫酸、加热条件下发生反应 酯化反应 六、在稀硫酸条件下的反应 (一)酯的水解 O H CH COOCH CH 2323+OH CH CH COOH CH 233+ (二)糖的水解 1、O H O H C 2112212+???→?42SO H 稀 61266126O H C O H C + 蔗糖 葡萄糖 果糖 2、O H O H C 2112212+612624O H C ??→?酸或酯 麦芽糖 葡萄糖 3、612625106(O H nC O nH n O H C ??→?+酸或酯) 淀粉 葡萄糖 稀硫酸 △
视觉简单反应时、视觉选择反应时、视觉辨别反应时的测量 摘要 三个实验分别用于测量视觉简单、选择、辨别的反应时。目的为帮助学生学习掌握视觉(光)简单反应时的测量方法;学会分析个体在信息加工中的辨别加工过程;了解简单反应时与选择反应时的区别,以及了解选择反应时在信息加工过程中的应用。三个实验均通过计算机呈现视觉材料,要求被试根据给与的刺激按键,以测定视觉反应时。被试为华东师大09级心理系大二学生十名,男女比例为5:5。得到的结果是性别差异,左右手差异,个体差异对视觉反应时的影响不显著。 关键词视觉反应时 1引言 1.1简单反应时(Simple Reaction Time)又称A 反应时。是指呈现单一刺激,要求被试立即做出固定反应的时间。由于这种反应时间是感知到刺激就立即做出反应,中间没有其它的认知加工过程,因此也称为基线时间(Baseline Time)。任何复杂刺激的反应时间都是由简单反应时和其它认知加工过程所需时间合成的。 通过本次实验,探究被试间的个体差异、不同实验材料对结果的影响,以及优势手非优势手对实验结果的影响。 1.2选择反应时(choice reaction time)又称B反应时。指的是测试中呈现的刺激不止一个,对每一个随机呈现的刺激要求被试作出相应的反应。有研究表明,人类在对特定的刺激作出特定的动作或反应前,在大脑内有一个信息加工过程,又称心理潜伏期。在复杂任务中,心里潜伏期可划分为:(1)刺激识别阶段;(2)选择反应阶段;(3)反应组织阶段和反应执行阶段。选择反应时的研究对理解人类对复杂信息的认知加工过程有重要的意义。通过对个体的选择反应时和反应过程的分析,推测其内在的信息加工过程。影响选择反应时的因素是复杂的。选择反应刺激的数目越多,则反应时间越长;选择的任务越复杂,则反应时间亦越长。此外年龄、性别、疲劳等因素也会对选择反应时产生影响。 通过本次实验,探究视觉选择反应时与视觉简单反应时的区别,简单与选择反应时的相关系数,实验是否有明显练习效应,以及是否受左右手因素的影响。 1.3辨别反应时(indentification reaction time)又称C反应时,指的是在测试中呈现的刺激为两个或多个,要求被试只对其中一个刺激作出反应,而对其他刺激则不作反应。根据Donders的减数法,用被试的辨别反应时的时间减去被试简单反应时的时间就是其辨别时间。影响辨别反应时的因素主要有:(1)呈现的刺激数目。数目增加,个体的辨别反应时可能会有增加的趋势。(2)刺激的物理特征,如形状、大小、颜色等。(3)辨别反应的数目。另外年龄、性别、疲劳等也会影响个体的辨别反应时。 通过本次实验,探究错误次数与辨别反应时是否有相关性,不同颜色有效刺激的辨别反应时是否存在差异,是否存在个体差异,以及如何用视觉简单反应时和视觉选择反应时的结果计算被试的视觉辨别反应时间。 2实验方法 2.1简单反应时
氧化还原反应知识点归纳 氧化还原反应中的概念与规律: 一、五对概念 在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是: 二、五条规律 1、表现性质规律 同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。 2、性质强弱规律 3、反应先后规律 在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+ 4、价态归中规律 含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。 5、电子守恒规律 在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。 三.物质氧化性或还原性强弱的比较: (1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱
非金属阴离子的还原性随其单质的氧化性增强而减弱 (2)由反应条件的难易比较 不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如: 前者比后者容易发生反应,可判断氧化性:。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。 (3)根据被氧化或被还原的程度不同进行比较 当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。 如,根据铁被氧化程度的不同, 可判断氧化性:。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。 (4)根据反应方程式进行比较 氧化剂+还原剂=还原产物+氧化产物 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物 (5)根据元素周期律进行比较 一般地,氧化性:上>下,右>左;还原性:下>上,左>右。 (6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关: 温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。 浓度:如浓硝酸的氧化性比稀硝酸的强。 酸碱性:如中性环境中不显氧化性,酸性环境中显氧化性;又如溶液的氧化性随溶液的酸性增强而增强。 注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性:,氧化性:。 【注意】氧化还原反应中的不一定: ⑴含有最高价态元素的化合物不一定具有强氧化性。如前述的氯元素的含氧酸及其盐, 是价 态越低,氧化性超强。H3PO4中+5价的P无强氧化性。 ⑵有单质参加的反应不一定是氧化还原反应。如同素异形体之间的转化。 ⑶物质的氧化性或还原性与物质得到或掉失去电子的多少无关。 ⑷得到电子难的元素失去电子不一定容易,例如:第ⅣA族的C,既难得到电子,又难 失去电 子,与其它原子易以共价键结合。 ⑸元素由化合态变为游离态不一定是是氧化反应,也可能是还原反应。 四、常见的氧化剂和还原剂 1、常见的氧化剂 (1)活泼的非金属单质:Cl2、Br2、O2、I2、S等 (2)元素处于高价时的氧化物:CO2、NO2、SO3、MnO2、PbO2等 (3)元素处于高价时的含氧酸:浓H2SO4、HNO3等 (4)元素处于高价时的盐:KClO3、KMnO4、FeCl3、K2Cr2O7等
Cu/O △ 根据反应条件判断有机反应类型和有机物的类别 1.A B; 类型:氧化反应;类别:反应物A :伯醇(或仲醇);生成物:醛(或酮)和水。 辨析:如果B 还能与银氨溶液反应或与斐林试剂反应,说明B 一定是醛,而A 一定是 伯醇,否则,说明B 一定是酮,而A 一定是仲醇。 2CH 3CH 2OH + O 2??→?Cu 2CH 3CHO + 2H 2O ; CH 3CH 2OH + CuO ?→? ?CH 3CHO + H 2O 2.A B 类型:氧化反应;类别:反应物A :醛,生成物:羧酸和水。 CH 3CHO+2Cu(OH)2?→? ?CH 3COOH+Cu 2O ↓+2H 2O 3.A B 类型1:消去反应;类别:反应物:醇,生成物:烯烃和水。 CH 3CH 2OH CH 2=CH 2↑+H 2O 类型2:取代反应;类别:反应物:醇,主要生成物:醚和水。 2CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2O 类型3:酯化反应;类别:反应物:羟基羧酸,生成物:链酯、环酯、聚链酯和水。 HOCH(CH 3)COOH+HOCH(CH 3)COOH HOCH(CH 3)COOCH(CH 3) COOH+H 2O n HOCH(CH 3)COOH OCH(CH 3)CO n + n H 2O 说明:α―羟基羧酸反应生成六元环酯(分子间酯)或三元环酯(分子内酯);β―羟 基羧酸反应生成八元环酯(分子间酯)或四元环酯(分子内酯)。 4.A B 类型:消去反应;类别:反应物:卤代烃,生成物:烯烃、卤化钠和水。 CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 5.A B 类型1:取代反应(水解反应);反应物:卤代烃,生成物:醇和卤化钠。 特点:碳原子数没有减少。 CH 3CH 2Br+NaOH CH 3CH 2OH+NaBr 类型2:取代反应(水解反应);反应物:羧酸酯,生成物:醇和羧酸钠。 特点:碳原子数减少。 新制Cu(OH)2 △ 浓H 2SO 4 △ 浓H 2SO 4 170℃浓H 2SO 4 140℃ 浓H 2SO 4 △ 浓H 2SO 4 △ NaOH 、醇 △ 醇 △ NaOH 、水 △ 水 △
一、背景 在许多情况下,系统呈现一个刺激,要求操作者根据刺激的信息内容作出相应反应。一般将外界刺激出现到操作者根据刺激信息完成反应之间的时间间隔称为反应时。 反应时是人因工程学在研究和应用中经常使用的一种重要的心理特征指标。人的信息处理过程,大部分活动是在体内潜伏进行的,难以对信息接受、加工和传递各个阶段精确地进行实验测定。因此,在实践中往往利用反应时指标来近似说明人对信息处理过程的效率及影响因素。利用反应时可以分析人的感知觉、注意、识别、学习、唤醒水平、动作反应、定向运动、信号刺激量等,在此基础上,实现提高作业效率、监视水平和集中注意力等目的,合理制定作业标准,改进人机界面,改善作业条件和环境等。 二、实验目的 通过刺激概率、数奇偶不同排列、“刺激对”异同及时间间隔、信息量和数差大小排列五个小实验,加深对反应时概念的具体认知,比较不同颜色对反应时的影响,比较简单反应时与选择反应时的差异,寻找影响反应时、选择反应时的因素。为今后人机界面的改进打下基础。 三、实验场所 机械楼5楼,人因工程实验室。 四、实验仪器 BD-Ⅱ-511型视觉反应时测试仪(Visual Reaction Time Tester)。由单片机及有关控制电路、主试面板、被试面板等部分组成。可进行五大类十七组的反应时实验,包括经典反应时实验,也包括认知心理学的反应时实验。用于自动测量视觉的选择反应时,以及检测被试者的判别速度和准确性。 五、实验内容 1、刺激概率对反应时的影响 红、绿、黄三种色光分别作为刺激,每次试验选用一种色光刺激,仪器根据设定的组别,自动确定该组实验中“红”、“绿”、“黄”三种色光应出现的次数。按“红”、“绿”、“黄”三种色光出现次数的不同比例(概率)共分四组实验,即“概率1(组别为1)”、“概率2(组别为2)”、“概率3(组别为3)”、“概率4(组别为4)”。 回答可选用任一反应手键。每组实验完后,将自动反复显示本组实验中红、绿、黄三种色光的各自平均简单反应时及实验次数。 2、数奇偶不同排列特征对反应时的影响 根据数排列特征不同分成三组实验(“横和奇、偶”:数横向整齐排列——组别1;“竖和奇、偶”:数竖向整齐排列——组别2;“随机奇偶”:数随机排列——组别3)。 实验用红色光刺激,被试判别显示点之和是奇数还是偶数,用反应手键回答。如左右刺激点数和为奇数,按“左”键;为偶数,按“右”键。回答正确,显示器自动显示每一次正确判断的反应时间;回答错误,蜂鸣声响提示,自动记录错误次数。实验结束,仪器自动显示正确回答的平均选择反应时及错误回答次数。
一、氧化还原基本概念 1、四组重要概念间的关系 (1)氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。 氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。 (2)氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。 (3)氧化剂、还原剂是指反应物。所含元素化合价降低的物质叫做氧化剂,所含元素化合 价升高的物质叫做还原剂。 (4)氧化产物、还原产物是指生成物。所含元素化合价升高被氧化,所得产物叫做氧化产 物,所含元素化合价降低被还原,所得产物叫做还原产物。 关系: 口诀: 化合价升.高,失.电子,被氧.化,还.原剂,氧.化反应;(升失氧还氧) 化合价降.低,得.电子,被还.原,氧.化剂,还.原反应;(降得还氧还) 2、氧化还原反应与四种基本反应类型 注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。 二、氧化还原反应的有关计算 1.氧化还原中的电子转移表示法 (1)双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原 子或离子间的电子转移情况,如
注意: ○1线桥从方程式的左侧指向右侧; ○2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。 (2)单线桥法:在反应物中的还原剂与氧化剂之间箭头指向氧化剂,具体讲是箭头从失电 子的元素出发指向得电子的元素。如 三、氧化还原反应的类型 1.还原剂+氧化剂氧化产物+还原产物 此类反应的特点是还原剂和氧化剂分别为不同的物质,参加反应的氧化剂或还原剂全部被还原或氧化,有关元素的化合价全部发生变化。例如: 2.部分氧化还原反应 此类反应的特点是还原剂或氧化剂只有部分被氧化或还原,有关元素的化合价只有部分发生变化,除氧化还原反应外,还伴随非氧化还原反应。例如 3.自身氧化还原反应 自身氧化还原反应可以发生在同一物质的不同元素之间,即同一种物质中的一种元素被氧化,另一种元素被还原,该物质既是氧化剂又是还原剂;也可以发生在同一物质的同种元素之间,即同一物质中的同一种元素既被氧化又被还原。例如:
氧化还原反应综述 学习目标: 1、掌握氧化还原反应与元素化合物知识的联系。 2、建立氧化还原反应知识、规律、观点、方法、能力、题型、态度综合一体化。 3、用科学的方法落实有关氧化还原反应的基础知识,掌握高考中有关氧化还原反应题型的解题思路。 学习内容: 一、知识与方法 (一)氧化还原反应与元素化合物知识的联系 1、氧化还原反应的本质:凡有_____________________的反应是氧化还原反应,表现在___________反应前后有变化。 2、联系:回顾下列物质的性质,其中在反应中能发生氧化还原反应的大约占多
元素化合物只是中占有重要地位。 (二)氧化还原反应的有关概念 ne —失ne —,化合价升高,被氧化 总结规律:1、氧化性、还原性强弱比较 (1)依据元素周期表。(2)依据金属性、非金属性强弱(在溶液中反应)。 (3)依据反应原理:氧化剂的氧化性大于氧化产物的氧化性。 还原剂的还原性大于还原产物的还原性。 (4)依据反应条件及反应剧烈程度。(5)依据氧化还原反应程度。 (6)依据电化学原理。(7) 依据反应浓度大小 2、氧化还原反应规律: (1)反应先后规律(2)得失相等规律(3)归中规律(只靠近、不交叉) (4)邻位转化规律(5)跳位转化规律。 (四)氧化还原反应中电子转移的表示方法。 1、单线桥法:箭头由________指向_________,标出电子转移的总数。 2、双线桥法:一个箭头由氧化剂指向_______产物,电子总数前写________(填“得”或“失” );另一个箭头由________指向___________,电子总数前写
高中化学复习知识点:消去反应 一、单选题 1.下列醇类能发生消去反应的是( ) ①甲醇;②1—丙醇;③1—丁醇;④2—丁醇;⑤2,2—二甲基—1—丙醇;⑥2—戊醇;⑦环己醇 A .①⑤ B .②③④ C .②③④⑥ D .②③④⑥⑦ 2.已知:R —CH=CH 2R —CH 2—CH 2Br ,则由2—溴丙烷制取少量的1—丙醇(CH 3CH 2CH 2OH)时,需要经过的各反应分别为( ) A .加成→消去→取代 B .取代→消去→加成 C .取代→加成→消去 D .消去→加成→取代 3.上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C 2H 6O ,简称甲醚)为燃料的公共交通作为“绿色”花园中的一点鲜艳的绿色已正式启动,解决了汽车尾部冒黑烟的问题。下列叙述正确的是 A .甲醚与乙醇是同分异构体 B .甲醚可由甲醇在一定条件下发生消去反应而制得 C .甲醚作燃料不会产生氮的氧化物和碳氢化合物的污染 D .1mol 甲醚完全燃烧消耗的氧气与1mol 甲醇完全燃烧消耗的氧气相同 4.下列反应中与其他三种反应类型不同的是( ) A .CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O B .CH 3CH 2OH CH 2=CH 2↑+H 2O C .2CH 3﹣CH 2﹣OH CH 3﹣CH 2﹣O ﹣CH 2﹣CH 3+H 2O D .CH 3CH 2﹣OH+H ﹣Br CH 3CH 2﹣Br+H 2O 5.由乙醇制取乙二醇,依次发生反应的类型是( ) A .取代、加成、水解 B .消去、加成、取代 C .水解、消去、加成 D .消去、水解、取代 6.有机物与水发生的反应不可能是 A .取代反应 B .加成反应 C .水解反应 D .消去反应 7.化合物Z 由如下反应得到:24 Br NaOH,49ΔCCl C H Br Y Z 醇????→???→,Z 的结构简式不可能是( ) A .CH 3CH 2CHBrCH 2Br B .CH 3CH (CH 2Br )2
视觉简单反应时 山西师范大学教师教育学院心理系11150201班山西041004 摘要本实验通过简单视觉反应来测试不同性别被试,不同颜色和优势手非优势手的视觉简单反应时。以山西师范大学13名心理系二年级学生为被试,男的6名,女的6名,视力正常。实验发现:视觉反应时不同性别间有显著差异,不同颜色也有显著差异,男生的反应时比女生的短,红色的反应时最短,依次为蓝、黄和绿。 关键词视觉简单反应时;优势手;反应时 1 前言 简单反应时又称A反应时,是指呈现单一刺激,要求被试立即作出固定反应的时间。由于这种反应时间是感知到刺激就立即作出反应,中间没有其他的认知加工过程,因此也称为基线时间。任何复杂刺激的反应时间都是由简单反应时和其他认知加工过程所需时间合成的。 简单反应时的实验已有一百多年的历史,最早始于天文学家对人差方差的研究。希施利用计时器,测量视听与触觉的生理时间,得到简单反应时值光为180ms,声为140ms,触觉为140ms。简单反应时是指给被试呈现单一的刺激,只要求做单一的反应,并且两者是固定不变的,这时刺激与反应之间的时距就是简单反应时。2研究方法 2.1被试 山西师范大学心理系二年级学生,平均年龄为21,女7个,男6个,视力全部正常。 2.2 实验仪器和实验材料 2.2.1 仪器:PsyTech-EP2009心理实验台 2.2.2材料:直径为100像素的四种颜色(红、黄、绿、蓝)的圆。 2. 3 实验程序 2.3.1登陆打开Psytech心理实验软件界面,选中实验列表中的“视觉简单反应时”点击进入“进入实验”按钮到“操作向导”窗口。实验者可进行参数设置,选择实验次数,也可直接点击“开始实验”就进入指导语界面。
第三节氧化还原反应 杭信一中何逸冬 一、氧化还原反应 1、氧化反应:元素化合价升高的反应 还原反应:元素化合价降低的反应 氧化还原反应:凡是有元素化合价升降的反应 2、氧化还原反应的实质——电子的转移(电子的得失或共用电子对的偏离) 口诀:失电子,化合价升高,被氧化(氧化反应),还原剂 得电子,化合价降低,被还原(还原反应),氧化剂 3、氧化还原反应的判断依据——有元素化合价变化 失电子总数=化合价升高总数=得电子总数=化合价降低总数 4、氧化还原反应中电子转移的表示方法 ○1双线桥法——表示电子得失结果 ○2单线桥法——表示电子转移情况 5、氧化还原反应与四种基本反应类型的关系
【习题一】 (2018?绍兴模拟)下列属于非氧化还原反应的是() A.2FeCl2+Cl2═2FeCl3 B.ICl+H2O═HCl+HIO C.SiO2+2C高温Si+2CO↑ D.2Na+O2点燃Na2O2 【考点】氧化还原反应. 氧化还原反应的先后规律 【专题】氧化还原反应专题. 【分析】氧化还原反应的特征是元素化合价的升降,从元素化合价是否发生变化的角度判断反应是否属于氧化还原反应,以此解答。 【解答】解:A.Fe和Cl元素的化合价发生变化,属于氧化还原反应,故A不选; B.元素化合价没有发生变化,属于复分解反应,故B选; C.C和Si元素的化合价发生变化,属于氧化还原反应,故C不选; D.Na和O元素化合价发生变化,属于氧化还原反应,故D不选。 故选:B。 【习题二】 (2015春?高安市校级期中)下列说法正确的是() A.1mol Cl2与足量Fe反应,转移电子的物质的量为3mol B.工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子
溴乙烷的性质教案 王泰山(2015.5.15) 【三维目标】 (一)知识与技能: 1.了解溴乙烷的物理性质。 2.掌握其溴乙烷的分子结构和化学性质。 3.通过分析溴乙烷的水解反应和消去反应,进一步结合已经学习过有机化学反应类型,充分认识卤代烃的水解和消去反应;初步形成根据有机物结构特点分析它能在何种试剂条件下发生何种类型的反应生成何种产物的思路。 (二)过程与方法: 1.通过溴乙烷的水解实验,培养学生的实验设计能力; 2.通过学习溴乙烷的分子结构和化学性质,培养学生认识溴乙烷水解反应和消去反应的能力; 3.通过学习消去反应,培养学生对概念的深刻理解和概念之间比较的思维能力; 【教学重点】溴乙烷的结构分析,水解反应和消去反应及反应条件。 【教学难点】溴乙烷的水解反应和消去反应的条件。 【学习方法】学思导练 【教学方法和手段】 1.通过分析溴乙烷分子的球棍模型,探讨其结构特点 2.通过教师启发、设疑、实验探究等方式,掌握溴乙烷的化学性质。 3.通过设疑、举例、分析讨论,总结卤代烃发生消去反应和消去反应应满足的条件。【教学过程设计】 【引言】 同学,你好。本微课是由江苏省句容高级中学傅立华老师主讲。 【设疑】乙烷分子中一个氢原子被溴原子取代可以得到什么分子?其结构与乙烷有什么区别?C—H键与C—Br键有什么不同?其分子中有无Br-,如何设计实验来证明呢?为了更好地解答这些问题,今天我们来学习溴乙烷的知识。 【板书】一、溴乙烷 【动画展示、分析溴乙烷的比例模型和球棍模型,引导学习者书写溴乙烷的结构式和结构简式。】 【板书】1.分子结构 结构式:结构简式:CH3CH2Br / C2H5Br 【设疑】溴乙烷的物理性质包括哪些方面呢? 【板书】2.物理性质 无色液体,难溶于水,可溶于有机溶剂,密度比水大,沸点38.4℃。 【设疑】溴乙烷在水中是否能电离出Br-?它是否为电解质?如何设计实验来验证这一点呢? 【动画展示实验一】将AgNO3溶液滴加到溴乙烷中,观察实验现象。 【现象】无明显现象。 【得出结论】溴乙烷是非电解质,在水中不能电离出Br-,滴加AgNO3溶液无沉淀。 【设疑】如何利用水解反应的原理设计实验来检验溴乙烷中的溴元素? 【动画展示实验二】取一支试管,加入约2mL溴乙烷和2mL氢氧化钠的水溶液,按下图连
