樱桃组培快繁技术研究

樱桃组培快繁技术研究
摘要:以甜樱桃品种高砂、顽童和中国樱桃品种莱阳矮樱为试材,以MS与F14为基本培养基进行组织培养试验。对增殖率和成苗率等指标进行研究。结果表明,用F14做培养基3个樱桃品种茎尖组培苗的增殖系数比MS高,F14上高砂、顽童和莱阳矮樱的增殖系数分别是4.17、3.78和5.0,MS上则分别是3.33、3.22和4.17;在F14上,樱桃茎尖组培成苗率莱阳矮樱为83.3%,高砂23.3%,顽童16.7%;在F14添加植物生长调节剂的增殖培养基中,以F14+6-BA 1.0mg/L+IBA 0.5mg/L+GA32.0mg/L对高砂和顽童的茎尖组培苗增殖系数大,以F14+6-BA 1.Omg/L+IBA 0.1mg/L+GA 2.0mg/L对高砂组培苗的增殖系数大,促进节间伸长的效果好:在一步生根法培养基F14+IBA 1.0mg/L上,平均生根率高砂较顽童高;在F14+IBA 1.0mg/L上添加活性炭500~1000mg/L时,可有效提高顽童的生根率。
关键词:樱桃;茎尖;组织培养;快速繁殖
组织培养技术的发展为果树的育种工作带来许多方便,也为长期保存果树种质资源提供了新的手段?。研究表明,通过茎尖外植体进行樱桃组培繁殖,可达到快速繁殖苗木和脱去病毒病的效果。
1 材料和方法
试材为甜樱桃品种高砂、顽童.中国樱桃品种莱阳矮樱,均来自辽阳市农林科学院果树基地。试验采用F14和Ms 为基本培养基;F14+蔗糖30 L+琼脂7 L为分化培养基;F14+植物生
长调节剂为增殖培养基,添加的植物生长调节剂有6一苄基氨基嘌呤(6.BA)、赤霉素(GA )和吲哚丁酸(IBA),具体配方见表3;F14+IBA和MS+IBA为生根培养基。F14+IBA 1.0mg/L为一步生根法培养基。F14+IBA 1.0mg/L+活性炭为试验活性炭作用的培养基。培养基的pH值为5.6~5.8,分装在lO0ml三角瓶中,在121℃下灭菌20分钟,在黑暗条件下保存备用。
1.1 试材的预处理
取樱桃芽露绿的一年生成熟枝条,剪成带一个芽、长约2cm的枝段,用刀将芽从枝段上削下来(带些木质部),剥除芽鳞片,去除茎表皮,用洗洁精浸泡3分钟,在流水中冲洗60~90分钟,在超净工作台上用70%酒精消毒30秒钟,用无菌水冲洗3次(每次1~2分钟),再用0.1%氯化汞消毒15分钟,置无菌水中浸泡20分钟,用无菌水冲洗4次,待接种。
1.2 试材的接种培养
在超净工作台上将经预处理的试材用镊子剥除芽外部的叶原基,去除木质部,切下1mm大小的茎尖,接种于分化培养基F14+蔗糖3O L+琼脂7 L上培养。培养温度25±2cC,光强2000~2500K.每天光照l6小时。
1.3 评价指标
微茎尖成苗数=萌发后能正常增殖继代、具有成苗能力的微茎尖数。
成苗率(%)=成苗微茎尖数/接种微茎尖数×100
增殖芽数=接种1个芽25天后增殖的所有芽数
增殖系数=转接后芽数/转接前芽数
生根率(%)=生根嫩梢数/接种嫩梢数×100
2 结果与分析
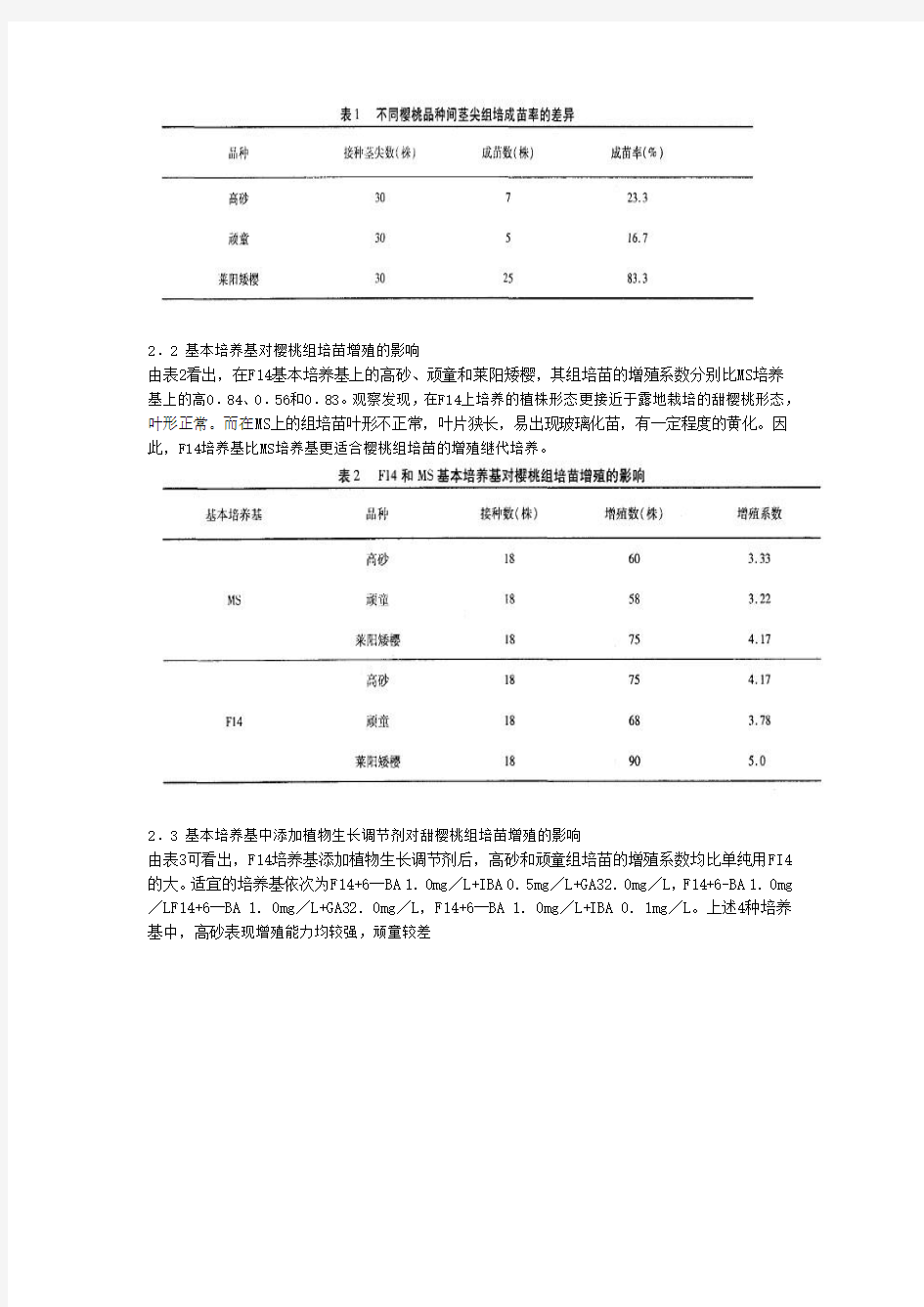
2.1 不同樱桃品种间茎尖组培成苗率的差异
在F14基本培养基上,接种甜樱桃品种高砂、顽童和中国樱桃莱阳矮樱的茎尖,高砂的成苗率为23.3%,顽童16.7%,莱阳矮樱83.3%(表1)。在组培中发现,甜樱桃萌发率较低,接种后的第2天伤口处及茎尖边缘褐变,之后有的茎尖周围发生大量愈伤组织,延缓了茎尖的萌发及成苗时间,甚至导致死亡。而中国樱桃莱阳矮樱则萌发率和成苗率均高,组培容易。
2.2 基本培养基对樱桃组培苗增殖的影响
由表2看出,在F14基本培养基上的高砂、顽童和莱阳矮樱,其组培苗的增殖系数分别比MS培养基上的高0.84、0.56和0.83。观察发现,在F14上培养的植株形态更接近于露地栽培的甜樱桃形态,叶形正常。而在MS上的组培苗叶形不正常,叶片狭长,易出现玻璃化苗,有一定程度的黄化。因此,F14培养基比MS培养基更适合樱桃组培苗的增殖继代培养。
2.3 基本培养基中添加植物生长调节剂对甜樱桃组培苗增殖的影响
由表3可看出,F14培养基添加植物生长调节剂后,高砂和顽童组培苗的增殖系数均比单纯用FI4 的大。适宜的培养基依次为F14+6一BA 1.0mg/L+IBA 0.5mg/L+GA32.0mg/L,F14+6-BA 1.0mg /LF14+6一BA 1.0mg/L+GA32.0mg/L,F14+6一BA 1.0mg/L+IBA 0.1mg/L。上述4种培养基中,高砂表现增殖能力均较强,顽童较差
2.4 增殖培养基中添加不同浓度的GA。对甜樱桃高砂组培苗增殖的影响
用F14+6一BA 1.0mg/L+IBA 0.1mg/L作为增殖培养基,添加不同浓度的GA,,比较甜樱桃高砂的茎尖组培增殖效果。结果表明,添加的GA,浓度由2.0mg/L增至4.0mg/L时,高砂组培苗的增殖系数由4.13下降到3.27。由此认为,上述增殖培养基中添加2.0mg/L GA。对高砂组培苗的增殖效果最佳。试验中发现,随添加的GA。浓度逐渐增大,组培苗表现出节问过度伸长、苗细弱、叶片形态不正常等现象。
2.5 F14和MS基本培养基中添加IBA对樱桃组培苗生根的影响
由表4可以看出,F14和MS基本培养基加入不同浓度IBA对3个樱桃品种组培苗生根的影响差别较大,接种25天后,加入1.0mg/L IBA的培养基樱桃组培苗生根率均较高;莱阳矮樱生根容易,生根多,根系健壮,生根率远远超过高砂和顽童,高砂的生根能力强于顽童。F14基本培养基添加IBA 1.0mg/L较MS基本培养基添加IBA 1.0mg/L对组培苗生根效果好。
2.6 不同甜樱桃品种组培苗生根能力的差异
用F14+IBA 1.0mg/L作生根培养基,甜樱桃高砂与顽童茎尖接种25天后,组培苗的生根情况见表5,高砂较顽童平均生根率高,每株生根组培苗的根数多,但根长不及顽童。
2.7 生根培养基中添加活性炭对甜樱桃顽童组培苗生根的影响
在F14+IBA 1.0mg/L一步生根法培养基中,加人不同浓度的活性炭,接种甜樱桃顽童茎尖25天后,调查组培苗的生根率,结果见表6
由表6看出,在F14+IBA 1.0mg/L生根培养基中添加活性炭浓度为500~1000mg/L时,甜樱顽童的组培苗生根较好,平均生根率为60%~66.7%,浓度过高或过低会降低生根率。
3 小结与讨论
以甜樱桃品种高砂、顽童和中国樱桃品种莱阳矮樱为试材,进行茎尖组织培养研究表明:基本培养基F14比MS对樱桃茎尖组培苗增殖系数高,在F14培养基上高砂、顽童和莱阳矮樱的增殖系数分别是4.17、3.78和5.0,而在MS培养基上则分别是3.33、3.22和4.17;在F14基本培养基上,樱桃茎尖组培成苗率高砂为23.3%,顽童16.7%,莱阳矮樱83.3%;在F14添加植物生长调节剂的增殖培养基中,以F14+6一BA 1.0mg/L+IBA 0.5mg/L+GA 2.Omg/L对甜樱桃茎尖组培苗增殖系数大;在FI4+6一BA 1.0mg/L+IBA 0.1 mg/L+CA,2.0mg/L时,对高砂的增殖系数为高,促进甜樱桃组培苗节间伸长效果好,随GA 浓度的增大组培苗表现出节间过度伸长、苗细弱和叶片形态不正常现象;基因型影响组培苗的增殖继代和生根,在一步生根法培养基F14+IBA 1.0mg/L上,甜樱桃平均生根率高砂比顽童高;在F14+IBA 1.0mg/L添加活性炭浓度为500~1000mg/L时,可有效提高甜樱桃顽童组培苗的生根率。代红艳研究表明,通过预备试验的两步生根法可提高甜樱桃组培苗的生根率 J,如顽童在两步生根法的所有处理中,生根率均为100%。本试验采用~步生根法与两步生根法比较,找到了最佳的处理方法,能提高组培苗的生根系数。试验表明,在F14基本培养基中添加IBA 1.0mg/L有利于根的伸长生长,但愈伤组织大量形成,与两步生根法相比,难于达到商品化微繁的要求。通过前人试验研究,本试验也证明了在甜樱桃生根培养基中添加500—1000mg/L的活性炭可提高植株的生根率,而且可保持根系的正常生长,
防止根系老化,使根系健壮。
草莓组织培养
草莓的组织培养 一、茎尖 1.概述通过对草莓茎尖离体培养的试验研究表明:取草莓茎尖为外植体,以0.35 mm大小为宜;用MS+0.5 mg/L 6-BA+O.2 mg/L NAA培养基. 不定芽再生率高;以1/2 MS+O.1 mg/L IBA 生根效果最好。 2.结论(1)再生途径:草莓刚抽出的匍匐茎的茎尖 (2)灭菌方法:洗去泥土、灰尘,再用自来水冲淋2~3h,置超净工作台上进行75 ﹪乙醇和0.1 升汞不同时间的灭菌处理,最后用无菌水冲洗5~8次,接种于诱导培养基中。诱导培养基为MS+0.5 mg/L6一BA+0.2mg/L NAA+3 蔗糖(w/v)+0.5﹪卡拉胶,pH值为5.6~5.8。每个灭菌处理接种2O枚外植体,l5d后观察记录外植体的污染、死亡、无菌成活生长等情况。 (3)培养基: ①芽诱导试验,于MS培养基附加0.2 mg/L NAA、IAA、IBA不同种类生长素的培养基中,20d后调查记录幼芽分化情况。 ②继代培养与扩大繁殖,MS培养基附加0.5 mg/L6-BA、0.01 mg/L NAA。 ③根诱导试验, 用1/2 MS附加不同浓度(mg/I )IBA 有0.05、0.1、0.2、0.5及不加IBA的5个处理. (3)条件:培养基均在1~ 1.1大气压下热压灭菌20min。培养温度(25± 2)℃。每日光照12h,光强2 000Lux。 (1)再生途径:用其花药、花蕾、叶、叶柄、子叶、下胚轴等作外植体进行离体培养。 (2)灭菌方法:洗去泥土、灰尘,再用自来水冲淋2~3h,置超净工作台上进行75 ﹪乙醇和0.1 升汞不同时间的灭菌处理. (3)培养基:①MS+BA 1.0 mg/L+NAA 0.5 mg/L(浓度单位,下同);②MS+6一BA0.5+KT 0.5;③MS+BA2.0+IAA 1.0;④MS+BA2.0+NAA0.5+2,4-D0.1;⑤MS+BA2.0+IBA0.1。以上培养基各加CH 100 mg/L,蔗糖20g/ L(①为30g/ L)。 ①用于花药诱导培养基; ②用于花药幺伤组织分化培养; ③、④用于其余5种外植体(叶盘、叶柄、下胚轴、子叶、花蕾)诱导培养;⑤仅用于花蕾培养。 (4)条件:培养条件均为12 h光照12 h黑暗。光强度1200-1500lx、温度(25 ±2)℃。 三、叶片以红颊、章姬、丰香草莓叶片为试材,对影响草莓叶片不定芽再生的主要因素进行了试验研究,建立了草莓离体叶片的再生体系。试验结果表明,基因型、不同激素种类和配比直接影响了草莓叶片再生芽的发生。基因型是影响草莓叶片再生能力的决定因素,不同激素配比是不定芽产生的关键因素。 叶片愈伤组织的诱导培养基以MS+TDZ 2~3mg/1较理想, 芽伸长的理想培养基为MS+6一BA 0.3~O.5mg/l, 生根培养基以1/2MS+IBA0.3mg/1较适宜,移栽成活率可达90%以上。 2.结论(1)再生途径:先采取当年生匍匐茎茎尖培养繁殖,建立起三个品种的无性繁殖系;再从继代3周的无菌苗上剪取叶片作为外植体,进行不同的处理,每瓶接10片叶盘,每处理重复5瓶。 (2)灭菌方法:于121℃下高温高压蒸汽灭菌20min。
樱桃生长周期指导
年生长周期条件技术指导 萌芽期170小时; 温度:4~18℃; 湿度:70%~80% 修枝:在芽的上方枝条刻一刀,深及木质部 施肥:尿素、过磷酸钙(每株0.5~1kg),氮磷钾三元 复合肥(每株1.5kg); 浇水:以水过地皮干为度 开花期290小时; 温度:5~22℃; 湿度40%~50%施肥:盛花期喷施0.3%的尿素、0.1~0.2%硼砂、600倍磷酸二氢钾液或初花期和盛花期叶面喷布1~2次200倍尿素液或200倍磷酸二氢钾液; 疏花:花芽膨大期疏除瘦小花芽,使保留3~4个饱满肥大的花芽;现蕾时疏除瘦小花蕾;开花期疏去畸形花,每个花序上保留有2~3个花。 枝叶生长期3920小时 温度15~25℃; 湿度50%~60% 修剪:对树体进行短截、缓放、回缩、疏枝; 施肥:速效性化肥,尿素、过磷酸钙每株0.5~1kg, 果树专用肥或三元复合肥每株1.5kg; 果实生长期1180小时; 温度10~25℃; 湿度50%~70% 修剪:花后10天左右对新梢摘心; 蔬果:疏去小果、畸形果及下垂果,,每支果枝只留3~ 4个大果; 施肥:每株需施50~100kg有机肥,并混入2~3kg过 磷酸钙,0.5~0.8kg尿素,硼砂0.2~0.3kg,硫酸亚 铁0.2~0.3kg或株施人粪尿30kg; 灌水:4月下旬至5月初灌水,水浸透土壤深度50厘 米,5月初及5月下旬至6月初灌水2~3次,水量较 大。
花芽分化期2060小时; 温度为16~25℃; 湿度50%~60%施肥:采果后10天左右追施肥,尿素、过磷酸钙每株0.5~1kg,果树专用肥或三元复合肥每株1.5kg; 灌水:采收后浇灌,水量以过地皮湿为度; 修剪:5月上旬至6月上旬对新梢扭稍;7月份对树枝拿枝、拉枝。 休眠期1440小时 温度为0~7.2℃; 湿度为70%~80% 施肥:8月中旬至9月中旬每隔10~20天追施一次, 共2~3次,叶面喷施0.5~0.8%的尿素,0.2~0.4% 的磷酸二氢钾; 灌水:秋基施肥后灌水; 修枝:8月中下旬疏除背上有立枝、过密枝、过旺枝;
蓝莓组培快繁技术实例 · 附配方
蓝莓(Vaccinium corymbosum)属杜鹃花科,越橘属植物。起源于北美,多年生灌木小浆果果树。因果实呈蓝色,故称为蓝莓国际粮农组织将其列为人类五大健康食品之一。 本试验以蓝莓半木质化茎段为外植体,并通过瓶外生根技术,建立起植株再生体系。 1 材料与方法 1.1 外植体材料及培养条件 1.1.1 外植体选择 高灌蓝莓半木质化茎段。 1.1.2 外植体预处理及灭菌 剪取蓝莓半木质化枝条,立即去掉上部叶片带回室内,剪成带有一个叶芽2-3厘米长茎段,在流动自来水中冲洗20-30分钟,在超净工作台上用75%酒精消毒2-3分钟,用无菌水冲洗3次,吸干水后在0.1%升汞中消毒5-8分钟,用无菌水冲洗3次,吸干水分,剪去茎段两端约 0.5-1厘米,立即接种到初代培养基中。 1.1.3 培养条件 诱导培养基:改良WPM + ZT 1.0mg/L 增殖培养基:改良WPM + IAA 0.1mg/L + ZT 2.0mg/L 复壮培养基:改良WPM + IBA 0.1mg/L WPM具体改良为:以硝酸钙 684mg/L、硝酸钾 190mg/L、EDTA铁钠 73.4mg/L和盐酸硫胺素0.1mg/L代替原WPM培养基中的硫酸钾、氯化钙、硫酸亚铁和乙二胺四乙酸钠。 以上培养基均加蔗糖3%,琼脂0.7%,pH值5.2。 培养温度为25℃,光照强度为2000lx,光照时长为12-16时/天。
2 结果与分析 2.1 初代诱导培养 将处理好的外植体立即接种到诱导培养基中,5-6天叶芽开始萌动,10天开始展叶,20天腋芽长到1厘米长,30天腋芽长到1.5-2.5厘米长。 2.2 继代增殖培养 将初代培养长出的茎剪成1.5-2厘米长茎段转接到增殖培养基中。30-35天增殖5-7倍,增殖苗生长健壮。 2.3 复壮培养 将继代苗剪成1-1.5厘米茎段,转接到壮苗培养基,复壮培养30-40天,复壮苗高5-6厘米且粗壮。 2.4 瓶外生根培养
苹果树组培快繁技术实例 · 含配方
苹果的组织培养是采用无菌培养技术,将来自优良植物的茎尖、腋芽、叶片、鳞片、块根和球茎等器官以及它们的组织切片进行离体培养,使之在短期内获得大量遗传性一致的个体的方法。由于离体技术处理严格,所以很容易脱除一些细菌病原及病毒,是复壮品种的有效措施。已成功脱除的病毒和病害有苹果褪绿叶斑病毒、花叶病病毒、轮纹病等。苹果矮化砧、抗寒砧的组织培养也已成功。苹果脱毒组培技术流程具体如下。
一 外植体材料选择与处理 早春,将上年芽接或切接的盆栽长富2号苹果苗移人温室,待新梢长出3~5片新叶时,放入热处理箱中,37℃恒温热处理30d或32℃与37℃每8h变换一次,变温热处理60d。脱毒率可达80%以上。热处理结束后,从盆栽苗嫩梢上采集生长旺盛、长约2~3cm顶梢,流水冲洗10min,去掉小叶。70%乙醇浸泡30s,蒸馏水冲洗后放入0.1%HgCI。中消毒10min,无菌水冲洗3~5次,解剖镜下迅速剥取1.0mm的茎尖进行分离培养,接种于起始培养基上。
二 培养基制备 1.1 芽诱导 适宜苹果芽诱导培养基为:MS+6-BA1.0mg/L+NAA0.1mg/L。诱导的芽生长正常可发育成新梢。 1.2 继代培养 选择诱导的芽丛切割成单芽茎段,转接于设计的继代培养基上。适宜的苹果继代培养基为:MS+6-BA1.0mg/L+NAA0.05mg/L+蔗糖4%+琼脂0.36mg/L。培养条件:光照强度2000~ 2500lx,光照时间14~16h/d,适宜温度为25℃±2.0℃。40d后增殖6.1倍。 1.3 生根培养 选择生长正常的继代培养苗,剪成单芽茎段,插入生根培养基中,苹果适宜的生根培养基为:1/2MS+IAA1.5mg/L+蔗糖25%+琼脂0.36%。培养30d后,平均4~6条根/苗,长达0.5~1.0cm。根白且粗,多直接生于茎基部。
樱桃介绍
樱桃介绍 烟台大樱桃,也称西洋樱桃,南方区域一般称为“车厘子”,是欧洲甜樱桃和欧洲酸樱桃及其杂交种的总称。原产于亚洲西部和欧洲东南部。中国于19世纪70年代通过西方传教士和船员、侨民等引入山东省烟台地区开始栽培,目前以福山蔡家夼为中心栽培的烟台大樱桃口味最为纯正。 大樱桃是继中国樱桃之后,春季上市最早的果品,故有“春果第一枝”的美称。其果实色泽鲜艳、晶莹美丽、红如玛瑙,黄如凝脂,营养特别丰富,果实富含糖、蛋白质、维生素及钙、铁、磷、钾等多种元素,因而被誉为“果中珍品”。烟台樱桃个大好吃,低温保存效果较好。 素以“北方春果第一枝”闻名遐迩的烟台大樱桃,尤其为常胜村的独特地理环境加上良好的土地资源,以其娇艳欲滴、晶莹剔透的风韵,香甜可口的美味,富含营养,无农药残留的特点,被誉为“果中珍品”、“水果之冠”,具有极高的营养价值和商品价值。 烟台大樱桃有早紫、小紫、大紫、水晶、那翁、鸡心、秋鸡心、琉璃泡,以及毛把酸等九个品种,分作红、黄、紫三类,硬肉和软肉两个类型。大紫、那翁栽培数量最多。大紫樱桃果实大,紫红色,肉软皮薄,含糖量百分之十四左右。那翁樱桃黄中透红,肉硬脆,浆汁多。暮春初夏,即可陆续登市,是北方果树中成熟最早的“第一枝春果”。 烟台大樱桃生产基地广,按照无公害标准露地栽培,产品5月20号左右上市,采摘期二十多天。品种有早红、拉宾斯、红灯等。 樱桃营养丰富,含蛋白质、糖、铁、磷、有机硒元素、胡萝卜素、尼克酸及维生素B1、C等,均比苹果、梨高。每100克鲜果肉中含碳水化合物8克,蛋白质1.2克,钙6毫克,磷3毫克,铁142毫克,硒元素3.8微克,以及多种维生素。特别是,铁的含量为百果之冠,比同量的苹果多19.6倍、比同量的柑橘和葡萄高29.5倍、比同量的梨高20倍。(铁是人体合成血红蛋白、肌红蛋白的原料,不仅在人体的免疫、遗传、蛋白质合成,以及能量、代谢等生命过程中,发挥着重要的作用,而且与人的大脑及神经、衰老过程,甚至与肿瘤发生等均有密切的关系。)
满天星组培快繁技术实例 · 含配方
满天星 Gypsophila elegans 满天星,又名为霞草、重瓣丝石竹,原产地中海沿岸,属石竹科多年生宿根草本花卉。为常绿矮生小灌木,其株高约为65~70cm,茎细皮滑,分枝甚多,叶片窄长,无柄,对生,叶色粉绿。由于它花型小、浅色、花姿蓬松具立体感,气质高雅清秀,给人以朦胧感,花序群体效果极佳,是重要的陪衬花,为当今最流行的切花之一,十分畅销。
满天星种苗多采用边生产切花,边利用植株下部发生的腋芽进行插扦获得。用这种方法,满 天星繁殖系数较低,种苗品质参差不齐,较难获得大批量的优质种苗。一些单瓣种可用种子 繁殖。商品化切花生产的,种苗繁殖以组培为主,采用茎尖培养,繁殖系数高,根系生长状 况好,花枝挺拔,色泽纯正,切花质量高。满天星组织培养繁殖速度快,生根率高,无畸形 变异,过渡苗驯化成活率高,与其他花卉组培相比,易获得成功,但普遍存在玻璃化现象。 1、初代培养 诱导培养基为1/2MS+0.3mg/L 6-BA+0.1mg/L KT+0.3mg/L NAA,或MS+1.0mg/L 6- BA+2.0mg/L KT+0.3mg/L NAA+0.2mg/L IAA,各培养基加3%~4%蔗糖0.6%~0.7%琼脂。培养温度25~27℃,光照强度2000~2200lx,光照时间每天12~16h。 剪取满天星母株上生长较粗壮的嫩梢,剪去展开叶片,留下生长较嫩的叶片,将外植体放在 烧杯中,用自来水冲洗10~20min,然后加入少量家用洗衣粉或洗洁精少许,加入少量的水,用小毛刷搅拌2~5min。用此方法重复数次,再用自来水冲洗干净满天星茎尖上的洗涤液。 把冲洗净的满天星茎尖外植体放入75%的酒精中约3~5min,再用0.1%的升汞浸泡外植体 5~7min,或在10%的漂白粉清洗液中浸泡10~15min,再用无菌蒸馏水冲洗5~7次,即得 无菌外植体,置于无菌操作台中的培养皿中待用。然后将嫩茎切成lcm左右的带芽茎段,腋 芽切取0.5~1.0cm长的茎尖,接种到诱导培养基上。
樱桃组培快繁技术研究
樱桃组培快繁技术研究 摘要:以甜樱桃品种高砂、顽童和中国樱桃品种莱阳矮樱为试材,以MS与F14为基本培养基进行组织培养试验。对增殖率和成苗率等指标进行研究。结果表明,用F14做培养基3个樱桃品种茎尖组培苗的增殖系数比MS高,F14上高砂、顽童和莱阳矮樱的增殖系数分别是4.17、3.78和5.0,MS上则分别是3.33、3.22和4.17;在F14上,樱桃茎尖组培成苗率莱阳矮樱为83.3%,高砂23.3%,顽童16.7%;在F14添加植物生长调节剂的增殖培养基中,以F14+6-BA 1.0mg/L+IBA 0.5mg/L+GA32.0mg/L对高砂和顽童的茎尖组培苗增殖系数大,以F14+6-BA 1.Omg/L+IBA 0.1mg/L+GA 2.0mg/L对高砂组培苗的增殖系数大,促进节间伸长的效果好:在一步生根法培养基F14+IBA 1.0mg/L上,平均生根率高砂较顽童高;在F14+IBA 1.0mg/L上添加活性炭500~1000mg/L时,可有效提高顽童的生根率。 关键词:樱桃;茎尖;组织培养;快速繁殖 组织培养技术的发展为果树的育种工作带来许多方便,也为长期保存果树种质资源提供了新的手段?。研究表明,通过茎尖外植体进行樱桃组培繁殖,可达到快速繁殖苗木和脱去病毒病的效果。 1 材料和方法 试材为甜樱桃品种高砂、顽童.中国樱桃品种莱阳矮樱,均来自辽阳市农林科学院果树基地。试验采用F14和Ms 为基本培养基;F14+蔗糖30 L+琼脂7 L为分化培养基;F14+植物生 长调节剂为增殖培养基,添加的植物生长调节剂有6一苄基氨基嘌呤(6.BA)、赤霉素(GA )和吲哚丁酸(IBA),具体配方见表3;F14+IBA和MS+IBA为生根培养基。F14+IBA 1.0mg/L为一步生根法培养基。F14+IBA 1.0mg/L+活性炭为试验活性炭作用的培养基。培养基的pH值为5.6~5.8,分装在lO0ml三角瓶中,在121℃下灭菌20分钟,在黑暗条件下保存备用。 1.1 试材的预处理 取樱桃芽露绿的一年生成熟枝条,剪成带一个芽、长约2cm的枝段,用刀将芽从枝段上削下来(带些木质部),剥除芽鳞片,去除茎表皮,用洗洁精浸泡3分钟,在流水中冲洗60~90分钟,在超净工作台上用70%酒精消毒30秒钟,用无菌水冲洗3次(每次1~2分钟),再用0.1%氯化汞消毒15分钟,置无菌水中浸泡20分钟,用无菌水冲洗4次,待接种。 1.2 试材的接种培养 在超净工作台上将经预处理的试材用镊子剥除芽外部的叶原基,去除木质部,切下1mm大小的茎尖,接种于分化培养基F14+蔗糖3O L+琼脂7 L上培养。培养温度25±2cC,光强2000~2500K.每天光照l6小时。 1.3 评价指标 微茎尖成苗数=萌发后能正常增殖继代、具有成苗能力的微茎尖数。 成苗率(%)=成苗微茎尖数/接种微茎尖数×100 增殖芽数=接种1个芽25天后增殖的所有芽数 增殖系数=转接后芽数/转接前芽数 生根率(%)=生根嫩梢数/接种嫩梢数×100 2 结果与分析 2.1 不同樱桃品种间茎尖组培成苗率的差异 在F14基本培养基上,接种甜樱桃品种高砂、顽童和中国樱桃莱阳矮樱的茎尖,高砂的成苗率为23.3%,顽童16.7%,莱阳矮樱83.3%(表1)。在组培中发现,甜樱桃萌发率较低,接种后的第2天伤口处及茎尖边缘褐变,之后有的茎尖周围发生大量愈伤组织,延缓了茎尖的萌发及成苗时间,甚至导致死亡。而中国樱桃莱阳矮樱则萌发率和成苗率均高,组培容易。
植物无糖组培快繁技术
植物无糖组培快繁技术 一、无糖组培技术原理 无糖组培快繁技术是由日本千叶大学的古在丰树教授上世纪八十年代末发明。它是一种全新的植物组织培养技术,是环境控制技术和组织培养技术的有机结合。它以CO2代替糖作为植物体的碳源,利用工程技术手段调节组培微环境的空气、光照、温度、湿度等影响因子,促进植物光合作用,使组培植物由兼养型转变为自养型,从而促进植物的生长发育。 经大量实验研究证明,该项研究成果已成为世界领先技术。目前,中国、美国、英国、韩国等国家已将该项技术应用于种苗工业化生产中。该技术于1997年由国家外国专家局和昆明市科技局委托昆明市环境科学研究所从日本引进。 二、无糖组培技术优势 由于植物无糖组培以CO2代替糖作为植物体的碳源,对植物无糖组培微繁殖中的容器换气次数、光照强度、CO2浓度、培养基质、植物生长调节剂进行调节,并通过监测反馈结合植株生长特性建立符合植株生长要求的稳定供气系统和温度调控系统,从而解决了传统组织培养中存在的污染率高、植物生长发育不良、生长迟缓、生理功能紊乱、玻璃苗、畸形苗多等问题。据相关资料报道,无糖组培快繁技术与传统的植物组织培养技术相比,显著提高苗的质量和产苗率,可缩短培养周期,种苗生产综合成本降低。经大量实验研究证明,该项
研究成果已成为世界领先技术。 无糖组培生产工艺简单,流程缩短,技术和设备的集成度提高,降低了人工操作强度,更易于在规模化生产上推广应用。 三、无糖组培技术国内外研究进展 无糖组培快繁技术通过多年的试验研究和生产示范,在引进消化吸收国外先进技术的基础上,结合国情,昆明市环境科学研究所研制开发了无糖培养微繁殖生产的配套设施,获得三项专利。 目前,该项技术已初步应用于非洲菊、彩色马蹄莲、灯盏花、甘薯、葡萄、满天星等植物并获得成功。上述研究结果表明,无糖组培技术培育出的苗具有抽叶多、植株健壮、节间距短、根系发达、干物质积累多、光合自养能力强等优良的生物学性状。美国、韩国、英国、日本等国家已将该项技术应用于生产,并显示出了巨大的优势和良好的效果。 无糖组培快繁技术可解决传统组织培养中存在的诸多问题,显著提高种苗质量,缩短培养周期,提高产苗率,降低生产成本。但目前,该项技术在药用植物方面的应用研究,除云南农大王荔课题组报道外尚未见其它报道。
草莓组织培养研究进展
[摘要] 从草莓组织培养类型(草莓茎尖组织培养、草莓花药培养、草莓叶片、叶柄组织培养)开始,介绍了近几十年国内外草莓组培的研究现状和进展。 [关键词]草莓;组织培养; 草莓是蔷薇科草莓属多年生草本植物,是世界上七大水果之一,素有“水果皇后”的美称。草莓果实色泽艳丽,芳香多汁,酸甜适度,鲜美可口,营养丰富,每百克果实内含有蛋白质1g,脂肪,糖4~12g,酸~2g,无机盐,粗纤维,Vc45~120mg,比苹果和葡萄高10多倍,并含有丰富的磷、钙、铁、锌等矿物质,其中锌的含量是香蕉的4倍以上,比柑橘高6倍以上,比苹果高40倍以上。另外食用草莓对肠胃病和贫血病有一定的疗效,对促进智力发育有重要作用。深受国内外消费者的喜爱。草莓作为一种栽培周期短、结果早、见效快的经济作物,近15年来在我国发展迅猛,中国园艺学会草莓分会统计2003年底,我国草莓总面积和总产量均跃居世界第一位。在浆果中,草莓的总产量和总面积仅次于葡萄,成为我国发展农村经济,促进农民增收的重要经济作物。 随着草莓在国内栽培面积的扩大和种植年限的延长,草莓的病毒病严重影响草莓的生产。作为高级浆果的草莓,在我国目前的生产栽培上多沿用无性繁殖种苗:主要方法是匍匐茎繁殖和分株繁殖,但这两种方法效率低、种苗易退化、易造成病毒蔓延。王国平(1988)等调查,我国栽培草莓带病毒植株率过80%以上,戴子林(1995)等调查,我国长江流域感染大面积植株感染率在50%以上;感染了病毒病的草莓果子一年比一年小、畸形、品质差、生长缓慢,一般减产30%-80%,并逐年加重;严重影响草莓的长势、品质和产量,对病毒病目前还没有药剂可以防治。 通过草莓组织培养扩繁草莓脱毒苗,可以解决上述问题。近年来在草莓种苗生产中,有关草莓组培快繁技术的研究备受人们的重视,本文就草莓组织培养研究与应用作一综述。 一、常见草莓组织培养类型 目前,国内外在草莓品种快速繁殖上已有不少报道:常用的外植体主要有:茎尖(Adam,1972;庆子孝,1972;谭兰英等,1981)、腋芽(Boxus,1974、1977;杨乃博,1981)、叶片、叶柄、茎段,花药(Quak,1977;大泽,1972)。常见的草莓组织培养主要的类型:草莓茎尖组织培养、草莓叶片和叶柄组织培养、
樱桃种植条件和区域
樱桃种植条件和区域 根据我国农业生态条件对甜樱桃生长、发育、产量和品质的影响,在充分考虑我国气候特点和甜樱桃生长需要的前提下,通过七项关键单因子指标的深入研究,提出了适应我国气候特点的甜樱桃栽培区划指标体系。参考的七项关键单因子指标如下。 1. 对年平均气温的要求 以9-14℃为适宜栽植区,但应指出,随着短低温需冷量新品种的研发,一些年均温度较高地区也引种试栽成功。我国南方部分地区具有很大的栽培潜力。 2. 对极端最低气温的要求 以高于-20℃为适宜栽植区,我国东北地区的黑龙江、吉林及内蒙古、山西和陕西北部采用冬季保温设施,也取得成功。 3. 对年降水量的要求 以小于1000毫米为适宜栽植区,我国西北引黄灌区和新疆灌区,年降水量不足400毫米,但依靠灌溉和良好的生态条件也能获得优质、高产。在其他水源不足的情况下,自然降水是影响产量和品质的主要因
素。在年降水量大于2000毫米地区,樱桃年生长量大,不利于花芽分化。 4. 对年日照时数的要求 以高于2400h为适宜栽植区,我国青海和贵州西部地区,年日照时数明显高于沿海内地,其樱桃花芽分化好,果实品质优。 5.对需冷量(0-7.2℃)的要求 需冷量是指植物经历0~7.2℃低温的累计时间,以h(小时)为单位。也就是植物在自然休眠期内有效低温的累计时数,为该品种的需冷量。 以600-1400h为适宜栽植区,多数甜樱桃品种的需冷量在800h以上,随着甜樱桃育种工作的进步,现已选育出部分需冷量小于400h的品种,如罗亚理、罗亚明土莱尔、布鲁克斯、福晨等。 5. 对土壤pH值的要求 以6-7.5为适宜栽植区,在土壤pH值小于5.5或大于8.0以上地区,甜樱桃的生长结果易受影响。土壤pH范围还应根据实际生产与试验进行选择,如在甘肃地区的黄土高原,土壤pH值为8.5的石灰性土壤,甜樱桃生长结果良好。
华南紫萁组培快繁途径研究
2019年第14期现代园艺 华南紫萁(),又名贯众、大凤尾蕨,真蕨目紫萁科紫萁属蕨类植物,原产于亚热带湿润地区,常野生于山地、草丛或溪边。该种是薄囊蕨类中最原始的类群,也是现存厚囊蕨纲和薄囊蕨纲过渡的少数种类之一[1]。植株高1~2m,树形美观、姿态优雅、终冬不凋,可供庭园、绿化带栽植或室内盆栽观赏,在植物造景和生态绿化中的作用日益凸显。其嫩苗、根茎、叶柄髓部还可入药,具有清热解毒、止血生肌、健脾利湿、舒筋活络等功效。 华南紫萁普遍采用分株和孢子繁殖进行人工繁育,对环境条件要求高,且繁殖周期长,受季节限制,不能满足日益增长的市场需求。李杨介绍并提出蕨类组培存在的问题[2];葛佳等以扇蕨茎尖为外植体,通过绿球体(GGB)途径获得了再生植株[3];王淼等研究了不同培养基和激素配比对东北蕨菜组培快繁的影响[4]。本研究旨在探索出适宜华南紫萁离体诱导的快繁方法,为促进其高频、稳定、产业化生产提供参考依据,对缓解野生资源压力,满足市场需求,丰富生态内涵具有重要意义。 1外植体选择及预处理 以徐州生物工程职业技术学院琴湖基地成功引种的健康华南紫萁种苗为试验材料,采集带有幼孢子囊群,未完全展开的叶片作外植体。用软毛刷轻轻去除外植体表面污垢,流水冲洗30min后,转入75%乙醇浸泡20s,0.1%氯化汞振荡清洗4min,无菌水冲洗5~7次,得华南紫萁无菌幼叶孢子囊外植体。 2GGB诱导培养 将外植体首尾切除,剪成2cm小段,按照极性方向接种到B5+1.0mg/L6-BA+0.1mg/L NAA培养基中,培养基添加30g/L蔗糖和7.5g/L琼脂,每瓶1个外植体,共接种60瓶,置于光照度2000~3000Lx,14h/d,温度23~27℃,湿度75%~85%的环境下培养。10d后观察发现,培养基表面有许多散落下来的绿色小孢子,其渐渐膨大,从基部产生不规则的突起,形成绿色球状体(GGB)。培养30d,GGB诱导率可达66.67%。 3GGB的增殖与分化培养 将诱导出的GGB分割成直径为3~5mm的绿球体小块,重新接种到B5+1.0mg/L6-BA+0.1mg/L NAA培养基中继续培养。培养30d后发现,GGB增殖膨大明显,平均直径为2.15cm,增殖率达79.8%,但是未见有不定芽分化现象产生。将增殖后的GGB接种至1/2MS+1.0mg/L6-BA+0.1mg/L NAA+1.5g/L活性炭分化培养基中,培养过程中观察到有不定芽的分化,60d产生的平均芽数可达35个,分化率达58.3%,且叶平展健壮,生长速度较快。 4壮苗生根培养 当新生不定芽长到约2cm,带2~3片健康平展叶片时,切下单芽接种至生根培养基中进行不定根诱导。生根培养基为1/2MS+0.1mg/L NAA+1.5g/L活性炭。30d更换1次培养基,60d后观察有数条不定根产生,生长状况良好,生根率达100%,平均根数达3.5条。若将NAA浓度继续提高,不定芽基部有愈伤化趋势,生根的小苗长势缓慢、叶片发黄、状态不佳。 5炼苗移栽 将高3~4cm,具3~4根健康根系的组培苗置于温度为20~25℃、光强2000Lx,12h/d的条件下进行驯化炼苗。之后小心取出,去除根部培养基,用质量分数为0.125%多菌灵溶液清洗根部,种植于泥炭∶火山岩配比为3∶1的基质中,用薄膜和透光率30%的遮阳网覆盖,30d后统计成活率达91.8%,小苗生长健壮。 我国蕨类植物资源丰富,种类繁多,约有2600多种,占全世界的1/5以上。多数蕨类因其高雅飘逸的体态、碧绿青翠的叶色、精美的羽片图案、精致的脉序以及别致的孢子囊群排列[5],已成为现代园林绿化行业的一个重要组成部分。本研究提出了一种以幼孢子囊群诱导,GGB途径的华南紫萁组培繁殖方法,初步建立了其离体再生体系,有效解决了现有繁殖方法的弊端,为优质华南紫萁商品种苗生产提供了方法和途径。 GGB,又称绿色球状体(),是指由蕨类植物外植体诱导得到的绿色球状分生组织集合体,接种于分化培养基上,可以获得大量蕨类植物幼苗。通过GGB诱导再生获得优质种苗,已是蕨类植物组培一种常见的研究途径。本试验以华南紫萁幼孢子囊叶为外植体,在B5+1.0mg/L 6-BA+0.1mg/L NAA培养基上,成功诱导出GGB,继续培养可对GGB进行有效增殖,但未见不定芽分化。1/2MS配合1.0mg/L6-BA、0.1mg/L NAA及1.5g/L活性炭的情况下,分化率可达58.3%,说明低盐条件对不定芽分化的促进较明显。生根培养以1/2MS+0.1mg/L NAA+1.5g/L活性炭的培养基效果最好。在泥炭∶火山岩配比为3∶1的基质中,组培苗成活率达91.8%,是华南紫萁组培苗移栽驯化的最佳基质。 华南紫萁组培快繁途径研究 陶佩琳1马新永2高政平1 (1徐州生物工程职业技术学院,江苏徐州221000;2徐州市铜山区大彭镇农机服务中心) 摘要:以华南紫萁幼孢子囊叶为外植体,研究不同培养基对GGB诱导、增殖、分化及组培苗生根移栽的影响,初步建立了华南紫萁离体快繁体系。 关键词:华南紫萁;组培;快繁 基金项目:2017年徐州市推动科技创新项目《观赏蕨类引种驯化和商品化繁殖技术研究》,(项目编号:KC17056)。 作者简介:陶佩琳(1984-),女,汉族,江苏南通人,硕士,副教授,研究方向:植物组织培养。 试验研究 7 --
多肉万象组培快繁技术实例分享 · 附配方
万象(Haworthia maughanii)又名毛汉十二卷,为百合科、十二卷属多年生肉质植物。万象形态非常奇特,叶半圆筒状,肉质叶肥厚,属典型的珍奇观赏多肉植物。 试验以花葶为外植体,获得再生植株,并从芽诱导、芽增殖,到诱导生根的培养,已建立起完整的无性繁殖体系,本课题万象微型繁殖技术已应用于在企业生产中。 1 材料与方法 1.1 外植体材料及培养条件 1.1.1 外植体选择 购得的万象成熟种苗在25℃环境下培养,浇少量水,待到其抽出花葶3-5厘米时切下。 1.1.2 外植体预处理及灭菌 用洗衣粉水清洗并用毛笔刷洗;在超净工作台上用75%酒精快速浸泡30秒,然后用加有两滴吐温-80的0.1%氯化汞溶液浸泡8分钟,之后用无菌水冲洗4次,每次洗2分钟。 1.1.3 培养条件 培养温度22℃-26℃之间,光照12小时/天,光照强度1500-2000lx。 2 结果与分析 2.1 初代诱导培养 在超净工作台上把花葶切断,每段0.5-1厘米,接入诱导培养基(配方见文末,下同)中,培养20天左右,会诱导出愈伤组织,培养45-60天可诱导出丛生芽。 2.2 继代增殖培养 愈伤组织形成后,会在愈伤组织上萌发丛生的不定芽。在超净台上,剥离不定芽,接种于增殖培养基,培养30-40天有新的丛生芽长出。 2.3 生根培养 将长至2厘米以上的小苗,转接至生根培养基中,转接时,切净芽基部的愈伤组织。10天开始可以看到根的发生。 2.4 炼苗与移栽 小苗根长1厘米时可以出苗,移栽前在培养室中打开瓶盖练苗3天,取出生根苗,在放有800-1000倍多菌灵溶液中清洗去基部培养基。
栽培基质用新鲜湿润的蛭石,植入后遮阴,第一次不浇水。1个星期后喷杀菌剂,浇少量水。小苗移栽成活率78%。 附配方 诱导培养基:MS + KT 2mg/L + NAA 0.2mg/L + Ad 5mg/L 增殖培养基:MS + KT 1mg/L + NAA 0.1mg/L + NaH2PO4 40mg/L 生根培养基:1/2MS + NAA 0.2mg/L 以上培养基均加琼脂0.7%,诱导愈伤组织和芽以及芽增殖时加蔗糖3%,生根时加蔗糖2.5%。pH值5.6-5.8,其中NaH2PO4主要起促进芽的分化的作用。
樱桃栽培技术详解
大樱桃栽培技术 1、品种选择 宜选择品质好、成熟早的品种,如红灯、先锋、拉宾斯、雷尼早红等。 2、选择适宜砧木 樱桃扦插不易生根,生产上都采用嫁接繁殖。由于砧木对地上部分的生长$结果以及自身的抗病性有很大影响,所以选择合适的砧木非常重要。目前主要应用中国樱桃、欧洲、酸樱桃、山樱桃和考脱等砧木嫁接培育大樱桃,此法培育出的樱桃具有根系发达、栽植成活率高、砧穗亲和力强、小脚现象不明显、抗风力强、幼树生长旺盛等优点,一般3年即可形成稳定的丰产树形,寿命长。 3、定植 定植地选择 适宜在3月(发芽前)和11月(落叶后)进行。大樱桃根系分布浅,呼吸旺盛,耐瘠薄,忌水涝,适于山荒、沙荒和坡崖地栽植。适宜种植在肥沃、通透性较强的砂壤土。建园则要选择土层深厚、土质疏松、通气良好、土壤 PH值 5.0-8.7、含水量15%左右,最低温度不低于-20C°、年平均气温10-12C°,年降水量600-700,年日照时间2600-2800h的地方建园。平原地区选地势平坦开阔的地方;山丘地区选地势平缓,有水利条件的地段。同时,还要尽量选择交通便利的地段建园。 定植密度
大樱桃栽植密度要考虑到立地条件、砧木种类、品种特性及管理水平,以 3m×4-5m为宜。一般立地条件好,乔化砧品种生长势强,栽培密度要小一些;山地果园,矮化砧,品种生长势弱、则栽植密度就稀一些。另外,高度密植果园管理水平要求较高。目前,老果园株行距多为4×5m或5×6m、6×7m,种植密度240-495株/公顷,该密度条件下早期产量低,植株高大,不抗风灾。为了合理利用土地,充分利用光能,提高早期产量和增强植株群体抗风能力,新建樱桃园,应适当密植为3×5或2×4m,种植660-1245株/公顷。 授粉树配置 大樱桃自花结实能力差,甚至自花不孕。栽植时必须配置好授粉树或多品种进行混栽。大樱桃的花粉量不是很大,授粉树的比例应该大一些,只有配置足够的授粉树,才能保证满足授粉受精的要求。在成片的樱桃园中授粉品种不能少于1/4,如果授粉品种比较少,则要求将授粉品种种在行间,因为蜜蜂飞行时,一般是顺行飞行,在同一行授粉比较有利。 栽植 在栽植前山地果园以及平原土壤贫瘠地区要挖较大的定植坑,最好在前一年挖好,要求坑的直径100cm。再将碎树叶、作物碎秸秆、杂草等与周围的表土混合后,回填入坑内,并要混入一定量的有机肥和复合肥,将坑填平。平原土壤肥沃深厚的地区,整地成高垄后,一般不必挖大坑,可挖直径50cm、深50cm的穴,施入有机肥和复合肥后,用表土填平,以备春季栽种。春季栽苗时在已挖坑的中央,挖
大樱桃树种植需要满足哪些气候条件
大樱桃树对温度的要求 大樱桃理想的露地栽培区的年平均气温为7~14℃,一年中平均气温高于10℃的天数为150~200天。樱桃冻害的临界低温是零下20℃,在零下20℃时会发生大枝冻裂而流胶,零下25℃时发生大量死树。樱桃发芽期适宜温度为10℃,开花期适宜温度为15~23℃,樱桃显蕾后抗寒力降低。花蕾期发生冻害的临界温度为℃,在零下3℃下4小时花蕾会100%受冻。开花期遇26℃以上持续高温时,因花粉失去活力而降低坐果率。果实发育到成熟期适宜温度为20~25℃。开花和幼果发育期冻害的临界温度为零下℃。樱桃的不同品种对低温的抵抗能力不同,生长健壮的树体比旺长树体和和弱树抗低温能力强;成龄期树比幼树抗低温能力强。 大樱桃树对水分的要求 大樱桃是一种喜水又不耐涝的果树。樱桃根系分布比较浅,抗旱能力差,但其叶片大,蒸腾作用强,所以需要较多的水分供应,故有“樱桃不离水”的俗语。一般地说樱桃适于年降水量600~800毫米的地区生长。在气温适宜、年降水量少,但有灌溉设备的地方,樱桃不仅能够良好的生长,而且产量高、品质优。如果土壤相对含水量下降到60%左右时地上部分停止生长,下降到50%以下时就会引起大量落果,下降到40%时叶片发生萎蔫。樱桃的根系要求良好的通透气体条件,如果发生果园积水,土壤里的含痒量减少,就会导致根系窒息而引起烂根、流胶,甚至整树死亡。因此,樱桃园要建在排水良好的地方,设置排水沟,必要时起垄栽种,以便随时排除园内的渍水。如果在果实发育期干旱而在成熟期降雨,或在果实接近完全成熟时出现雾天,会引起大量裂果,给生产带来严重损失。樱桃不同发育阶段对水的需求量也不相同。在早春芽萌动期,生长量较小,需水量也减少,盛花期需要有较多水供应以支持花的开放。落花后至硬核期果实、新梢迅速生长,叶面迅速扩大,随着气温的升高,蒸腾作用加强,需要较充足的水分供应。在果实第一生长阶段缺水会加重生理落果,影响果肉细胞分裂数量,减少单果重。如在果实发育的第二阶段(硬核期)缺水,会引起严重的旱黄落果,造成严重减产,而在成熟期遇雨则加重裂果。 大樱桃树对光的要求 大樱桃是强喜光性的果树。樱桃在年日照时数为2600~2800小时,太阳总辐射量为千焦/平方厘米,日照百分率为57%~64%的条件下生长良好。樱桃在光照充足条件下,树体生长健壮,结果枝寿命长,树冠内膛光秃的进程较慢,花芽发育充实,坐果率高,果实成熟早,着色度好,含糖量高,品质好。相反如果树冠密闭、光照不足,则树冠内膛容易光秃,结果枝寿命短,结果部位外移,花芽发育不良,坐果率低,着色差,硬度变小,可溶性固形物含量降低,品质差,成熟晚。 大樱桃树对土壤的要求 土壤的肥力和质地对樱桃的生长发育和产量、品质都有决定性的影响。樱桃在土层深厚,质地疏松、肥力较高的砾质壤土、沙壤土、壤土或轻黏土壤中,根系发达,分布较深。在土壤黏重、透气性差的土壤上,根系发育不良,容易发生根腐病、根癌病,分布层较浅,不抗旱、不抗涝、不抗风,也不抗寒,导致植株生长不良。樱桃对碱性土壤比较敏感,在碱性土壤上轻者生长不良,易感缺素症,重者死亡。 大樱桃树对风的要求 风对大樱桃栽培造成的危害,主要表现为:一是严冬大风易造成枝条抽干,花芽易受冻。二是花期大风可吹干柱头粘液,吹走昆虫,影响授粉。三是树体倒伏造成根系受伤或死树。四是因风产生的枝叶磨,造成果实表光差。
植物组培快繁研究
(一)树型金银花组培快繁技术的研究 实验一组培室设备参观及器皿的洗涤和灭菌 一、目的要求: 1.通过参观,了解组织培养室的几个主要组成部分和各部分应有的基本设备以及有关仪器的用途与功能。 2.通过实际操作,学会洗涤剂的配制和各种器皿的清洗和灭菌方法。 二、材料用具: 高压灭菌锅、烘箱、超净工作台、双筒解剖镜、酸度测定仪、空调机、控温仪、百分之一与万分之一天平、电炉、玻璃器皿(试管、三角瓶、移液管、漏斗、烧杯、容量瓶、试剂瓶、量筒酒精灯),以及镊子、解剖刀、解剖针、手术剪,肥皂、洗衣粉、重铬酸钾、浓硫酸等。 三、说明: 在进行各类具体的组培实验前,首先了解组培室的结构及主要设备的用途和性能是十分必要的,总体上的了解有利于以后各实验的进行以及正确的使用各种仪器和设备。 植物组织培养是一项十分细致的工作,为了保证植物外植体不受污染,第一关就是要对各种器皿进行清洗和消毒,使它们保持无菌状态,做这些工作同样有一套科学的方法和需要熟练的技巧,因此每个学生必须学好这套基本功。 四、方法和步骤: 首先在老师带领下参观组培室,并听取讲解,然后配制洗液,称取工业用重铬酸钾40克,溶解在500ml在水中,然后徐徐加入450ml粗制浓硫酸(或废硫酸)配好的溶液呈红色,铬酸洗液是一种强氧化剂,去污能力强,但玻璃器皿上沾有油脂、凡士林、石蜡等则用此液无效,铬酸洗液可反复使用,直到溶液呈青褐色为止。此溶液腐蚀性强,洗涤时需注意。每人清洗部分玻璃器皿,方法:清水洗净→泡入洗衣粉水溶液中进行洗刷→清水反复冲洗→蒸馏水淋一遍→烘干备用。 然后清洗部分较脏的玻璃器皿,方法:采用先碱后酸,即用洗衣粉洗刷后冲洗干净→晾干→侵入酪酸洗液,浸泡时间视器皿的肮脏程度而定→清水反复冲洗干净→蒸馏水淋洗一遍→烘干备用。 带有石蜡或胶布的器皿:先将其除去,再用常规洗涤,石蜡用水煮沸数次即可去掉,胶布粘着物则需用洗衣粉液煮沸数小时,再用水冲洗,凉干后浸入洗液,以后的步骤同前。 对器皿和用具进行高压灭菌,即用手提式高压灭菌锅,在1.2个大气压下保持15~20分钟。解剖刀、手术剪、解剖针、镊子等用具在接种前还要用百分之七十的酒精棉球擦一下,再用酒精灯的火焰灭菌,冷却后即可应用。 五、作业:试阐述为什么要对器皿和用具进行严格的洗涤和灭菌? 实验二母液的制备及培养基的配制、灭菌 一、目的要求: 通过掌握培养基对母液制备及常用培养基的配制和灭菌方法,为植物组织培养准备合适的营养条件。 二、材料用具: 高压灭菌锅、冰箱、普通及精密天平、电炉、铝锅、玻璃器皿(烧杯、量微、容量瓶、移液管、试剂瓶、三角瓶、漏斗),化学试剂(CaCl2·2H2O,KNO3,MgSO4·7H2O, NH4NO3,KH2PO4,Na2—EDTA,FeSO4·7H2O,MgSO4·4H2O,Zn SO4·7H2O,H3BO3,
康乃馨植物组织培养(1)
《植物组培快繁技术》 康乃馨植物组织培养 实 验 设 计 小组成员:陈梅20141641044 郑莉20141641002 雷雨田20141641043
康乃馨植物组织培养 一、实验目的 掌握植物离体快速繁育原理、方法和完整过程。 二、实验原理 香石竹(学名Dianthuscaryophyllus)又名康乃馨,花色艳丽,开花时间长,装饰效果好,是世界上最畅销的切花之一,具有较高经济价值。由于病毒病侵害,常使植株矮化,花朵变小,花色产生斑点,退色甚至不开花,影响切花产 量和质量。通过茎尖分生组织培养,能够获得“无病毒”的健康植株,对于引 进的少而新的脱毒种苗,再进行一次茎尖培养,进一步降低基础苗中的病毒含量,并通过组织培养的方法快速繁殖,在短期内,就可以获得大量的脱毒试管苗,使引入材料迅速在生产上推广应用,取得明显的经济效益。 三、实验仪器与材料 仪器:超净工作台、酒精灯、电炉、烧杯、玻璃棒、镊子、解剖刀、接种盘、 纱布、记号笔、标签纸 试剂:75%乙醇、0.1%升汞、无菌水、MS培养基、IAA0.1mg/L、BA0.5mg/L、pH5.8-6.0、蔗糖、琼脂 材料:康乃馨带芽外植体材料 四、实验步骤 (一)培养基的配方 1、康乃馨的生芽培养基 MS+IAA(0.1mg/L)+BA(2.0mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L) pH5.8-6.0,配制300ml,用培养瓶分装10~15瓶。另外需要制备无菌水10瓶,培养瓶每人3~4瓶。纱布、碟子若干,后二者分别用报纸包好一同灭菌。
2、康乃馨的继代培养基 MS+BA(0.3mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L),pH5.8-6.0,配制300ml,用培养瓶分装10-15瓶。另外需要制备无菌水10瓶,培养瓶每人3-4瓶。纱布、碟子若干后二者分别用报纸包好一同灭菌。 3、康乃馨的生根培养基 MS+生根培养基为1/2MS+NAA(0.075mg/L)+蔗糖(30g/L)+琼脂(8g/L), pH5.8-6.0,配制0.3L,用培养瓶分装10-15瓶。另外,需要制备无菌水10瓶,每人3-4培养瓶、纱布、碟子若干后二者分别用报纸包好一同灭菌。 (二)康乃馨的生芽培养 1、无菌操作准备 将培养基、无菌水、及各种接种用具放入超净工作台,开紫外灯照射消毒20-30min,开送风开关,关紫外灯,通风10min后,打开照明日光灯。洗手、换鞋,换实验服,戴口罩,进入接种室,开启超净工作台。用纱布吸取75%酒精擦手、擦拭超净台、擦拭培养基和无菌水瓶,点燃酒精灯,镊子、解剖刀、剪刀等接种工具放入灭菌锅灭菌,待冷却后使用。 2、外植体消毒 选取康乃馨叶腋间生出的侧芽为外殖体,用自来水冲洗半小时,将材料上的泥土和灰尘及杂质冲洗干净,用解剖刀切取所需组织放入大烧杯中,用75%的酒精浸泡消毒30s,用无菌水冲洗3次,再将材料移入0.1%升汞溶液浸泡10分钟,然后在超净台内用无菌水冲洗6次。材料消毒完成。 3、外植体的制备 将消毒好的材料用无菌滤纸吸去多余的水份,然后在无菌超净工作台上的接种盘内,借助解剖刀剥离茎尖,剥取茎尖大小通常在0.3mm左右。以上操作均
第一节 植物组培快繁工厂的设计
第一节植物组培快繁工厂的设计 第一节植物组培快繁工厂的设计 一、组培苗生产规模的确定 生产规模的确定首先应根据市场需求、生长的植物种类和经济实力来确定,例如,木本植物比草本植物的培养周期长,设计时必须比草本植物多增30%的空间、设备。植物种苗无糖微繁殖工厂化生产程序包括①入选品种外植体的筛选及获取; ②外植体灭菌诱导培养; ③快速 繁殖; ④生根培养; ⑤出瓶过渡炼苗; ⑥包装进入市场等工艺。一般一个熟练的接种工人根据繁殖品种的不同,年生产量可达15―20万苗。即规划一个年生产量达500万株的组培室,需设25―30个无菌操作位置。当无菌操作位置数量确定后,即可计算出接种室的需求面积。按日生产组培苗的数量及培养周期计算需要的培养架数量,以此为基础很容易就可计算出培养室的需求面积,一般为1台无菌工作台或者说一个无菌操作位置,需配备净培养面积(放置培养物的面积)7-10平方米,无菌操作室与培养室的面积比例为1:2,围绕组培工厂建设,其它必备的配套设施设备及操作用具购置的数量,应以每个无菌工作台的需求量计算,解剖刀、镊子、刀片等常用工具还要有充足的备用量。室外应有相应的温室配套,生产品种栽培展示区等,其面积的大小应根据不同的植物种类来确定。因此组培工厂的建设,需要认真规划、仔细计算、合理投资,使之既有系统性又适用,才能充分发挥最大的生产潜力。在市场竞争中,尽量降低生产成本,提高产品质量和确保品种的可靠性。 二、组培种苗工厂的设计 植物组培育苗工厂应选址在安静、清洁、可避开各种环境污染源的地方,以减少污染,降低生产成本确保工作的顺利进行。根据已确定的生产规模,设计组培生产车间时,要全面了解组培工作中所需的最基本的条件,以便因地制宜地利用现有房屋改建或新建组培工厂,尽量做到合理布局。通常按工作程序先后,安排成一条连续的生产线,避免环节错位,增加日后工作的负担或引起混乱。组织培养的生产线主要包括培养器皿清洗;培养基的配制、分装、包扎和高压灭菌;无菌操作材料的表面灭菌和接种;进入培养室培养;试管苗出瓶、移栽等。各个房间的面积要合理安排,做到大小适中,工作方便,减少污染,节省能源,使用安全。图5.1所示的是一种组培生产车间设计的平面布置图: 图5.1组培生产车间的设计
