(整理)实验六蛙心起搏点分析及心搏动曲线描记084120003陈明辉.

实验六蛙心起搏点分析及心搏动曲线描记
一、实验目的
1、学习暴露蛙类心脏的方法,熟悉心脏的结构;
2、观察心脏各部位节律性活动的时相及频率;
3、学习在体蛙类心脏活动的记录方法。
二、实验原理
两栖类动物的心脏为两心房、一心室,心脏的起搏点是静脉窦。静脉窦的节律最高,心房次之,心室最低。正常情况下,心脏的活动节律服从静脉窦的节律,其活动顺序为:静脉窦、心房、心室。这种有节律的活动可以通过张力传感器在生理信号采集系统中记录下来,称为心搏曲线。
三、实验材料
1、实验动物:牛蛙
2、实验器材:蛙心夹,常用手术器械,生理信号采集系统,张力传感器,支架,双凹夹,培养皿,滴管,任氏液,秒表,棉线。
四、实验流程
实验动物双毁髓暴露动物心脏记录心搏曲线观察心搏曲线
斯氏第一结扎斯氏第二结扎
五、试验方法和步骤
1、暴露动物心脏
取牛蛙一只,用刺蛙针通过枕骨大孔损毁脑和脊髓后,背位固定于蛙板上。左手持有齿镊提起胸骨剑突下端的皮肤,用手术剪剪开一个小口,然后将剪刀由切口处伸入皮下,沿左、右两侧锁骨方向剪开皮肤。将皮肤掀向头端,再用有齿镊提起胸骨剑突下端的腹肌,在腹肌上剪一口,将剪刀伸入胸腔(勿伤及心脏和血管),沿皮肤切口方向剪开胸壁,剪断左右乌喙骨和锁骨,使创口呈一倒三角形。用眼科镊提起心包膜,用眼科剪刀小心地剪开心包膜,暴露心脏。
2、观察心脏的外部结构
从心脏的腹面可看到心房、心室及房室沟。心室右上方动脉根部有一膨大,称动脉圆锥。动脉干由此发出,向上分成左右两支。用玻璃分针将心脏翻向头侧,可见心房下端有节律搏动的静脉窦。在心房与静脉窦之间有一条白色半月形界线,称为窦房沟。
3、观察心搏过程
仔细观察和记录静脉窦、心房及心室收缩的频率、顺序和相互关系。
4、仪器的准备
打开计算机采集系统,接通张力传感器输入通道。
5、心搏曲线记录
用系线的蛙心夹夹住少许心尖部肌肉。蛙心夹的系线与张力传感器的应变梁孔连接,调节系线的拉力,使心脏的收缩活动在显示屏上出现。调整扫描速度,使心搏曲线的幅度与宽度适中。记录心搏曲线。仔细观察曲线各波与心脏各部位活动的关系。
6、蛙心起搏点观察
在主动脉干下方穿一条线,将心脏翻向头端,沿窦房沟作一结扎,称为斯氏第一结扎。观察心肌各部分搏动节律的变化,用秒表计数每分钟的搏动次数。待心房和心室恢复搏动后,计数其搏动频率。然后在房室交界处穿线,准确地结扎房室沟,此称为斯氏第二结扎。待心室恢复搏动后,计数每分钟心脏各部分搏动次数。将记录结果填入下表。
表1 斯氏结扎记录表
实验项目频率/次·min-1
静脉窦心房
心室
对照
第一次结扎
第二次结扎
六、实验注意事项
1、创口不要太大,避免损伤血管。剪开心包膜时要细心,避免损伤心脏。
2、结扎部位要准确,不可扎住静脉窦。
3、实验中注意滴加任氏液保持暴露的组织湿润。
4、每项实验应在上一次实验后,心脏活动恢复稳定后进行。
七、
八、实验思考题
1、斯氏第一结扎和第二结扎后,房室搏动频率各有何不同?实验结果表明了什么?
答:第一次结扎后,静脉窦与心脏之间的通路被截断,此时异位起搏点为房室交界处,此处与静脉窦频率差距小,心跳较正常慢,心室搏动频率减慢;
第二次结扎是阻断房室交界处,此时则有浦肯野纤维作为异位起搏点,其频率比房室界慢,所以心跳更慢,心室频率更慢。第一结扎后,心房和心室的搏动频率相同,与结扎前相比明显变慢,而静脉窦的搏动频率基本不变。斯氏第二结扎后,静脉窦的搏动频率最快,心房次之,而心室最慢。
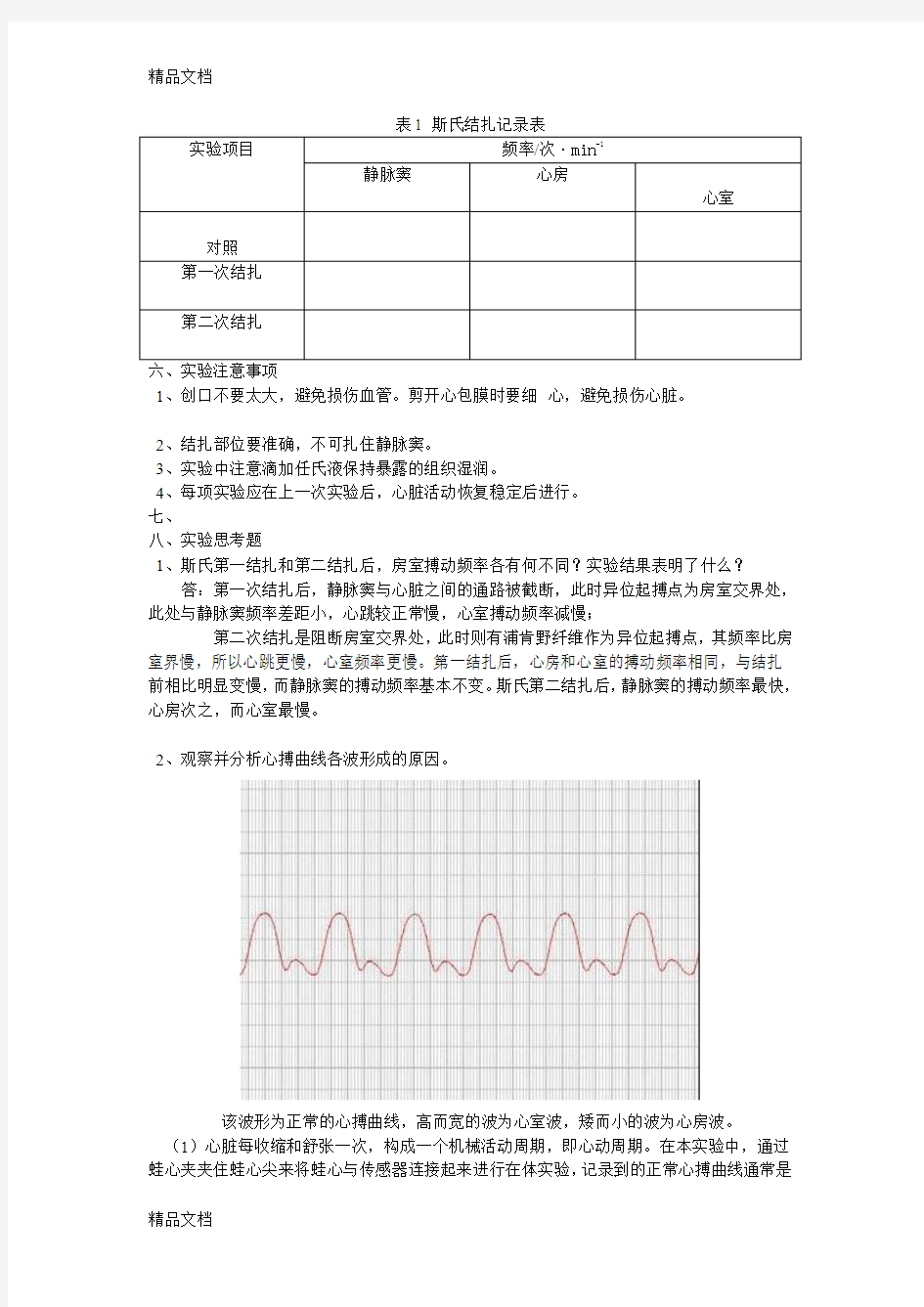
2、观察并分析心搏曲线各波形成的原因。
该波形为正常的心搏曲线,高而宽的波为心室波,矮而小的波为心房波。
(1)心脏每收缩和舒张一次,构成一个机械活动周期,即心动周期。在本实验中,通过蛙心夹夹住蛙心尖来将蛙心与传感器连接起来进行在体实验,记录到的正常心搏曲线通常是
心室波,可能也会记录得到心房波,一般记录不到静脉窦的搏动曲线。如上图所示,较大而高的峰为心室波,较小而矮的峰为心房波。
(2)心室收缩,心室内压迅速上升,当超过心房内压时,推动房室瓣关闭,但因低于主动脉压,主动脉瓣尚未推开,心室仍处于密闭状态,同时心室肌继续进行强有力的收缩,发生等容收缩,使压力迅速上升,(即心室波的上升支的前段),当心室内压大于主动脉压时,心室内血液快速、大量射入主动脉,此时心室波的上升支达到顶点,即心室肌收缩强度应达到最大。在快速射血后,心室内血液减少,心室肌收缩强度减弱,射血缓慢,心室内压减少至低于主动脉压。这段时期对应心室波下支的初始阶段。随后,心室开始舒张,心室内压急速下降,当室内压进一步低于主动脉压时,主动脉瓣关闭,心室呈密闭状态(因此时的心室压仍大于心房压),发生等容舒张(此期为心室波下降支的后一部分),直至心室内压低于心房内压时房室瓣打开。此时心房、心室同处于舒张状态,室内压接近于0,静脉压高于房室压,使血液顺房室压力梯度由静脉流经心房进入心室,再加上心室舒张产生的抽吸作用使室内压很快降低,血液可快速充盈心脏。随后房室压力梯度减少,充盈速度渐慢。
(3) 在心室舒张的末期,心房收缩,将心房内的血液挤入尚处于舒张状态的心室,使心室更加充盈。由上图可知,心房收缩时间短、强度小,因此,充盈主要在房室间压力差较大的共同舒张阶段完成,心房收缩对充盈起的是辅助作用。
试验相关数据:
(1)未进行斯氏结扎前:心脏搏动47次/min;
(2)斯氏第一结扎后:静脉窦搏动43次/min;
在第一次结扎之后,心房与心室都停止搏动,只有静脉窦在搏动。所所以没有进行第二次结扎。
实验总结:由于缺乏经验,将蛙心长时间的悬吊,使得血液外流,心脏到实验后期已经不在跳动。在进行在连接传感器时候,用太大力拉扯心脏。
改进措施:在悬吊一段时间之后,应将心脏放平使其得到适宜的休息及回血,在进行下一步的实验操作。在连线时要多人合作,进行以免拉伤心肌。
通过本次实验,重新对心脏起搏的理论知识进行了复习,以及对传感器使用的一个熟练。
(整理)实验六蛙心起搏点分析及心搏动曲线描记084120003陈明辉.
实验六蛙心起搏点分析及心搏动曲线描记 一、实验目的 1、学习暴露蛙类心脏的方法,熟悉心脏的结构; 2、观察心脏各部位节律性活动的时相及频率; 3、学习在体蛙类心脏活动的记录方法。 二、实验原理 两栖类动物的心脏为两心房、一心室,心脏的起搏点是静脉窦。静脉窦的节律最高,心房次之,心室最低。正常情况下,心脏的活动节律服从静脉窦的节律,其活动顺序为:静脉窦、心房、心室。这种有节律的活动可以通过张力传感器在生理信号采集系统中记录下来,称为心搏曲线。 三、实验材料 1、实验动物:牛蛙 2、实验器材:蛙心夹,常用手术器械,生理信号采集系统,张力传感器,支架,双凹夹,培养皿,滴管,任氏液,秒表,棉线。 四、实验流程 实验动物双毁髓暴露动物心脏记录心搏曲线观察心搏曲线 斯氏第一结扎斯氏第二结扎 五、试验方法和步骤 1、暴露动物心脏 取牛蛙一只,用刺蛙针通过枕骨大孔损毁脑和脊髓后,背位固定于蛙板上。左手持有齿镊提起胸骨剑突下端的皮肤,用手术剪剪开一个小口,然后将剪刀由切口处伸入皮下,沿左、右两侧锁骨方向剪开皮肤。将皮肤掀向头端,再用有齿镊提起胸骨剑突下端的腹肌,在腹肌上剪一口,将剪刀伸入胸腔(勿伤及心脏和血管),沿皮肤切口方向剪开胸壁,剪断左右乌喙骨和锁骨,使创口呈一倒三角形。用眼科镊提起心包膜,用眼科剪刀小心地剪开心包膜,暴露心脏。 2、观察心脏的外部结构 从心脏的腹面可看到心房、心室及房室沟。心室右上方动脉根部有一膨大,称动脉圆锥。动脉干由此发出,向上分成左右两支。用玻璃分针将心脏翻向头侧,可见心房下端有节律搏动的静脉窦。在心房与静脉窦之间有一条白色半月形界线,称为窦房沟。 3、观察心搏过程 仔细观察和记录静脉窦、心房及心室收缩的频率、顺序和相互关系。 4、仪器的准备 打开计算机采集系统,接通张力传感器输入通道。 5、心搏曲线记录 用系线的蛙心夹夹住少许心尖部肌肉。蛙心夹的系线与张力传感器的应变梁孔连接,调节系线的拉力,使心脏的收缩活动在显示屏上出现。调整扫描速度,使心搏曲线的幅度与宽度适中。记录心搏曲线。仔细观察曲线各波与心脏各部位活动的关系。 6、蛙心起搏点观察 在主动脉干下方穿一条线,将心脏翻向头端,沿窦房沟作一结扎,称为斯氏第一结扎。观察心肌各部分搏动节律的变化,用秒表计数每分钟的搏动次数。待心房和心室恢复搏动后,计数其搏动频率。然后在房室交界处穿线,准确地结扎房室沟,此称为斯氏第二结扎。待心室恢复搏动后,计数每分钟心脏各部分搏动次数。将记录结果填入下表。
蛙心灌流分析
蛙心灌流实验结果分析 2011-11-03 08:17:48 来源:评论:0 我要评论 一、蛙心灌流:1、用0.65%Nacl溶液灌注蛙心出现心跳减弱心肌的收缩活动是由Ca2+排触发的,由于心肌细胞的肌浆网不发达,故心肌收缩的强弱与细胞外Ca2+浓度呈正比。用0.65%NaCL溶液灌注心,由于灌注...… 一、蛙心灌流: 1、用0.65%Nacl溶液灌注蛙心出现心跳减弱 心肌的收缩活动是由Ca2+排触发的,由于心肌细胞的肌浆网不发达,故心肌收缩的强弱与细胞外Ca2+浓度呈正比。用0.65%NaCL溶液灌注心,由于灌注液中缺乏Ca2+,以致心肌细胞动作电位二期内流Ca2+减少,胞浆Ca2+浓度减少,心肌的收缩活动也随之减弱。如果长时间用0.65%NaCL溶液灌流蛙心,心脏最终会停止收缩,但心肌仍能产生动作电位(即产生兴奋),这种现象称为兴奋一收缩脱耦联,是心肌细胞内缺少Ca2+后的表现。 2、用高K+任氏液灌注蛙心时,心跳减弱 用高K+任氏液灌注蛙心时,心跳明显减弱,甚至出现心脏停止于舒张状态的现象。因为细胞外K+浓度增高时K+与Ca2+有竞争性拮抗作用,K+可抑制细胞膜对Ca2+的转运,使进人细胞内Ca2+减少,心肌的兴奋一收缩耦联过程减弱心肌收缩力降低。当细胞外K+浓度显著增高时,膜内外的K+浓度梯度减小,静息电位的绝对值过度减少,Na+通道失活,心肌的兴奋性完全丧失,心肌不能兴奋和收缩,停止于舒张状态。 3、滴加2%CaCL2后,离体蛙心收缩力增强 用高Ca2+任氏液灌注蛙心,可见蛙心收缩力增强,但舒张不完全,以致收缩基线上移。在Ca2+浓度较高的情况下,心脏会停止在收缩状态。这种现象称为“钙僵”。心肌的舒缩活动与心肌肌浆中Ca2+浓度高低有关。当Ca2+浓度升高至10-5M水平时,作为钙受体的肌钙蛋白结合了足够的Ca2+,这就引起肌钙蛋白分子构型的改变,从而触发肌丝滑行,肌纤维收缩。当肌浆中Ca2+浓度降至10-7时,Ca2 任氏液灌注蛙心,使得肌浆中Ca2+浓度不断升高,Ca2+与肌钙蛋白结合数量不断增加,甚至达到只结合而不解离的程度,于时心肌将持续收缩,因而出现“钙僵”。 4、滴加肾上腺素后,蛙心收缩增强 向蛙心滴加肾上腺素后,可见蛙心收缩增强,心脏舒张完全,其机理为肾上腺素与心肌细胞膜的β受体结合,提高心肌细胞和肌浆网膜Ca2+通透性导致肌浆中Ca2+浓度增高,使心肌改缩增强。 另外,肾上腺素还有降低肌钙蛋白与Ca2+亲和力,促使肌钙蛋白对Ca2+的释放速率增加;提高肌浆网膜摄取Ca2+的速度,刺激Na+—Ca2+交换使复极期向细胞外排出Ca2+的作用加速。这样,将使心肌舒张速度增快,整个舒张过程明显加强。 5、滴加乙酰胆碱后,蛙心活动减弱 滴加乙酰胆碱后,强见蛙心收缩减弱,心率减慢。最后,心跳停止于舒张阶段。 机理为:乙酰胆碱与心肌细胞膜M受体结合,一方面提高心肌细胞膜K+通道的通透性,促使K+外流,将引起:①窦房结细胞复极时K+外流增多,最大复极电位绝对值增大;衰减过程减弱,自动除极速度减慢。这两方面因素导致窦房结自律性降低,心率减慢;②复极过程中K+外流增加,动作电位2.3期短,Ca2+进人细胞内减少,使心肌收缩减弱;另一方面乙酰胆碱可直接抑制Ca2+通道,减少Ca2+内流,进而使心肌收缩减弱。 二、血压调节:
生理学实验报告-蛙心灌流
实验名称: 蛙类离体心脏灌流 课程名称:生理学实验 指导教师:龙天澄张碧鱼陈笑霞 实验人:叶永锋08344031 学院:海洋学院 实验时间:2009年12月09日
一、【目的要求】 1、学习斯氏离体蛙心灌流法。 2、了解心肌的生理特性。 3、观察Na+,K+,Ca2+及肾上腺素(Adr),乙酰胆碱(ACh)等对离体心脏活动的影响。 二、【原理】 将离体蛙心(失去神经支配的蛙心)保持在适宜的环境中,在一定的时间内仍然能够保持节律性收缩,心脏正常的节律性活动需要一个适宜的理化环境,离体心脏也是如此,离体心脏脱离了机体的神经支配和全身体液因素的直接影响,可以通过改变灌流液的某些成分,观察其对心脏活动的作用。心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。血钾浓度过高时(高于7.9mmol/L),心脏兴奋性、自律性、传导性及收缩性都下降,表现为收缩力减弱、心动过缓和传导阻滞,严重时心脏可停搏于舒张期。血钙浓度升高时,心脏收缩力增强,过高可使心室停搏于收缩期。血钙浓度降低,心肌收缩力减弱。血中钠离子浓度的轻微变化,对心肌影响不明显,只有发生明显变化时,才会影响心肌的生理特性。肾上腺素可使心率加快、传导加快及心肌收缩力增强,乙酰胆碱则与肾上腺素的作用相反。 三、【实验仪器】 青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、纱布、棉线、橡皮泥、任氏液。蛙心套管(斯氏套管或八木氏套管)、套管夹、0.65%NaCl、5%NaCI、2%CaCl2、1%KCl、1:5 000肾上腺素、1:10 000乙酰肌碱、300U/mL肝素。 四、【方法与步骤】 1、斯氏蛙心插管法 (1)一只青蛙,双毁髓后背位置于蜡盘中, 按前面的方法暴露心脏。仔细识别心脏周围的大 血管(见右图)。在左主动脉下方穿一线,于动脉 圆锥处结扎(动物个体小时,结扎位置可靠上些)。 再从左右两主动脉下方穿一线,并打一活结备 用。左手提起主动脉上的结扎线,右手用眼科剪 在结扎线下方、沿向心方向将动脉上壁剪一斜 口。选择大小适宜的蛙心套管,然后将盛有少量 (套管内2~3 cm高度)任氏液(内加入一滴肝素溶 液)的斯氏蛙心套管,山开口处插入动脉圆锥(见右图)。当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后下方及心尖方向推进,经主动脉瓣插入心室腔内(于心室收缩时插入,但不可插得过深,以免心室壁堵住套管下口)。此时可见套管中血液冲人套管,并使液面随心脏搏动而亡下移动,表明操作成功(否则需退回并重新插入)。用滴管吸去套管中的血液,更换新鲜任氏液。稳定住套管后,轻轻提起备用线,将左、右主动脉连同插入的套管用双结扎紧(不得漏液),再将结线固定在套管的小玻璃钩上,然后剪断结扎线上方的血管。轻轻提起套管和心脏,看清静脉窦的位置,于静脉窦下方剪断有牵连的组织,仅保留静脉窦与心脏的联系,使心脏离体(切勿损伤静脉窦)。用任氏液反复冲洗心室内余血,
离体蛙心灌流实验
实验五离体蛙心灌流实验 一实验目的 1、了解蟾蜍离体心脏的灌流的方法。 2、观察细胞外液钾离子、钙离子浓度变化对心脏活动的影响。 二实验原理 心脏离体后,如用人工灌流的方法,保持其新陈代谢的顺利进行,则心脏仍能有节律的自动收缩和舒张,并可维持较长的时间。离体心脏所需的条件应与动物内环境的理化性质基本相近,因此改变灌流液的理化因素,则可引起心脏活动的变化。 1、任氏液:正常对照 含有NaCl、CaCl2、KCl、NaH2PO4、 Na2HPO4 和蒸馏水,其电解质、晶体渗透压、pH值与蛙的组织液相近。 2、0.65%NaCl灌流: 3、2%CaCl2灌流 4、 1%KCl灌流
5、1:10000 E 灌流 6、1:10000 Ach灌流 7、心得安 β1受体阻断剂,抑制肾上腺素与β1受体结合,使E不能发挥作用。 8.、阿托品 M受体阻断剂,抑制Ach减慢心率,加速房室传导,增加心房收缩力。 三实验器材 微机生物信号处理系统, physiology系统,学校服务器系统,蟾蜍离体蛙心,任氏液,1%KCl,3%CaCl2,65%NaCl,1/10000 E,心得安+1/10000,1/10000 Ach,阿托品+1/10000 Ach。 四实验步骤 1、标本制备(观看视频) 2、仪器及标本的连接 3、具体软件操作: 1)离子试剂:任氏液→0.65%NaCl溶液→任氏液清洗→1%KCl溶液→任氏液清洗→2%CaCl2溶液→任氏液清洗 2)药物试剂:肾上腺素(E)→任氏液清洗→心得安→任氏液清洗→Ach,任氏液清洗→阿托品→任氏液清洗。 五实验结果
图1 离体蛙心灌流
蛙心起搏点
蛙心起搏点 实验报告 1.课程名称: 动物机能学实验 2.实验名称: 蛙心起搏点 3.实验目的、要求 1.学习和掌握蛙类手术的操作过程 2.观察蛙心起搏点及各部分自律性的高低 4.实验原理 哺乳动物的心脏特殊传导系统都具有自动节律性,但各部分节律性高低不同,以节律性最高。蛙类及其它两栖动物的正常起搏点是静脉窦,正常时,蛙静脉窦的起搏细胞发出的冲动通过特殊的传导系统依次传入心房和心室。 5.实验材料 ⑴.实验动物: 蟾蜍 ⑵.实验器械:蛙类手术器械、记时器 ⑶.实验药品:任氏液 6.实验步骤及原始数据记录 实验步骤 1.取蟾蜍一只,用探针捣毁其大脑脊髓,将其仰卧于蛙板上。用镊子提起腹部皮肤, 剪一小口,之后向两侧锁骨剪开并剪去皮肤,使成为一个倒三角形,剪开肌肉、胸骨及心包膜,暴露心脏。 2.识别静脉窦,心室及心房,并观察各自的收缩顺序,并记录各部分搏动频率。 3.在主动脉下穿一线备用,然后将心尖翻向头端,暴露心脏背面,然后将主动脉干下 的线结扎,以阻断静脉窦和心房之间的传导,次为斯丹尼氏第一结扎,观察心房、心室及静脉窦的搏动情况,并记录各自节律。 4.待心房、心室及静脉窦搏动恢复正常后,再取一线在房室沟作第二次结扎,阻断心 房和心室之间的传导,观察心房和心室的搏动情况,分别记录单位时间内静脉窦、心房和心室的搏动情况。 7.实验结果与分析 ⑴.实验结果 ⑵.分析 心脏在没有外来刺激的情况下,能够自动地发生节律性兴奋的特征称为心肌的自动节律性。心肌的自动节律性起源于心肌细胞本身。具有自动节律性的组织和细胞,称为自律组织和自律细胞。 心脏的自律性来源于心脏的特定部位,即起搏点。两栖动物的起搏点位于静脉窦。正常情况下,静脉窦的自动节律性最高,然后依次为心房肌、房室结,即静脉窦的自动节律性
离体蛙心灌流及药物对心脏的影响
离体蛙心灌流及药物对心脏的影响 一、实验目的: 1、学习蛙心灌流方法。 2、了解离体心脏的自律性与环境中各因素变化的关系,观察理化因素 对蛙心活动的影响。 二、实验对象:蟾蜍 三、实验方法: 1、标本制备: 取蟾蜍→破坏CNS→固定→剪皮→打开胸腔(暴露胸骨柄,用镊子把胸骨柄捏起来,用粗剪刀剪断,沿胸骨将锁骨剪断,去除多余的骨头,注意勿将心脏剪破)→用眼科剪小心剪开心包膜→暴露心脏→在主动脉叉下方穿一根丝线备用→用蛙心夹在心舒张期夹住心尖部→在左侧主动脉分叉处2-3mm处剪一剪口→将盛有一定量任氏液的蛙心插管插入到主动脉球→将插入到主动脉球的套管稍向后退,再向左下逆时针旋转90°,插入心室→结扎固定→剪断血管和背面静脉窦以下组织,游离标本 2、连接装置: 蛙心管内保持2ml灌流液,用木夹夹住蛙心套管,蛙心夹的线与张力换能器相连,换能器与电脑的相应通道相连。 3、运行电脑: 打开电脑→Medlab→实验/常用生理实验→离体蛙心灌流 四、实验结果: 分别观察正常心脏活动曲线及加入不同溶液后的心脏活动曲线的变化。 曲线规律:心脏节律; 曲线疏密:心率 曲线基线:心室舒张最大程度 顺序观察项目药量心肌(率、力)变化 正常任氏液灌流正常 1 0.65%NaCl 灌流 1~2d 2 2% CaCl 2 3 1%KCl 1~2d 4 1:10000 NA 1~2d 5 1:100000 ACh 1~2d 6 3% LH 1~2d 2.5% NaHCO3 2~4d 7 1:100000 Isop 1ml +任氏液1ml 8 1:1000 prop 0.2ml+任氏液1.8ml 出现效应后,抽出一半液体后 立即加入Isop1ml
蛙心灌流实验报告
实验二离体蛙心灌流实验 专业:学号:姓名: 一、实验目的 1.学习离体器官(蛙心)灌流的方法。 2.观察理化因素对蛙心活动的影响。 二、实验原理 蛙心的灌流:蛙心无营养性血管,离体之后采用人工灌流的方法,仍可保持其新陈代谢,心脏仍能有节律的自动收缩、舒张,并维持较长时间,心肌的营养是通过心脏内膜液体的直接渗透而得。 心肌: 1. 含有NaCl、CaCl2、KCl、NaH2PO4、Na2HPO4 和蒸馏水,其电解质、晶体渗透压、pH值与蛙的组织液相近。 2.0.65%NaCl灌流: 3.2%CaCl2灌流:
4.1%KCl灌流:
5.1:10000 E灌流 6.1:10000 Ach灌流 7.心得安 β 1受体阻断剂,抑制肾上腺素与β 1 受体结合,使E不能发挥作用。 8.阿托品 M受体阻断剂,抑制Ach减慢心率,加速房室传导,增加心房收缩力。
三、 实验器材 离体蛙心 任氏液、l %KCl 溶液、2%CaC12溶液、0.65%NaCl 溶液、1:10000 肾上腺素、1:10000乙酰胆碱、心得安、阿托品 四、 实验步骤 五、 结果与分析 心率:34次/min 最大收缩力:2.5g 最小收缩力:1.1g 图1 正常脉搏曲线 心率:35次/min 最大收缩力:1.6g 最小收缩力:1.1g 图2 0.65%NaCl 灌流脉搏曲线 任氏剂 0.65%NaCl 任氏液清洗 2%CaCl 2 任氏液清洗 1%KCl 任氏液 2.药物试剂 E 任氏液清洗 心得安+E 任氏液清洗 Ach 任氏液清洗 阿托品+Ach 任氏液 1.离子试剂
蛙心起搏点观察实验报告
蛙心起搏点观察实验报告 篇一:蛙心起搏点 蛙心起搏点 实验报告 20081217 01:15:25 阅读175 评论0 字号:大中小 【实验目的】 1 了解在体内观察器官生理特点的方法,并确定蛙心起搏点及传导途径 2 理解内环境稳态的重要性 【实验原理】 哺乳动物心脏的特殊传导系统具有自动节律性,但各部分的节律性高低不同。正常情况下,窦房结的自律性最高,它自动产生的兴奋向外扩布,依次激动心房肌、房室交界、房室束、心室内传导组织和心室肌,引起整个心脏兴奋和收缩。由于窦房结是主导整个心脏兴奋和跳动的正常部分,故称之为正常起搏点;其他部位自律组织受窦房结的“抢先占领或超速驱动压抑”控制,并不表现出它们自身的自动节律性,只是起着兴奋传导作用,故称之为潜在起搏点。一旦窦房结的兴奋不能下传时,则潜在起搏点可以自动发 生兴奋,是心房或心室依从节律性最高部位的兴奋节律而跳动。
两栖类动物心脏的正常起搏点是静脉窦,在正常情况下,其 心房和心室在静脉窦冲动作用下依序搏动,只有当正常起搏点的冲动受阻时,“超速压抑”解除,心脏的自律性次之的部位才可能显示其自律性。 本实验利用结扎阻断传导通路的方法来确定蛙心起搏点和传导途径。 【实验对象】蟾蜍或蛙 【实验器材和药物】蛙板、蛙类手术器械、刺蛙针;线、小烧杯、滴管、任氏液 【实验方法和步骤】 1 暴露心脏蟾蜍或蛙一只,用刺蛙针破坏脑和脊髓后,将其仰卧固定在蛙板上。用剪刀剪开胸骨表面皮肤并沿中线剪开胸骨,可见心脏包在心包中,仔细剪开心包,暴露出心脏,在窦房沟、房室沟处各预 置一段手术用的丝线 2 观察正常心跳频率 观察它们的跳动次序并计数它们在单位时间内的跳动次数 3 结扎窦房沟,并观察心跳的变化 找到静脉窦和心房交界的半月行白线(窦房沟)。然后将预先穿入的丝线沿着
生理学实验报告蛙心灌流
生理学实验报告-蛙心灌流
————————————————————————————————作者: ————————————————————————————————日期: ?
蛙类离体心脏灌流 一、【目的要求】 1、学习离体蛙心灌流法。 2、观察Na+,K+,Ca2+及肾上腺素(Adr),乙酰胆碱(ACh),乳酸对离体心脏活动的影响。 二、【原理】 将离体蛙心(失去神经支配的蛙心)保持在适宜的环境中,在一定的时间内仍然能够保持节律性收缩,心脏正常的节律性活动需要一个适宜的理化环境,离体心脏也是如此,离体心脏脱离了机体的神经支配和全身体液因素的直接影响,可以通过改变灌流液的某些成分,观察其对心脏活动的作用。心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。外源性给予去甲肾上腺素或乙酰胆碱可产生类似心交感神经或迷走神经兴奋时对心脏的作用。 三、【实验仪器】 青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、任氏液。套管夹、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰肌碱、3%乳酸。 四、【方法与步骤】 1、斯氏蛙心插管法 (1)一只青蛙,双毁髓后背位置于蜡盘中,按前面的方法暴露心脏。仔细识别心脏周围的大血管(见右图)。在左主动脉下方穿一线,于动脉圆锥处结扎(动物个体小时,结扎位置可靠上些)。再从左右两主动脉下方穿一线,并打一活结备用。左手提起主动脉上的结扎线,右手用眼科剪在结扎线下方、沿向心方向将动脉上壁剪一斜口。选择大小适宜的蛙心套管,然后将盛有少量(套管内2~3cm高度)任氏液(内加入一滴肝素溶液)的斯氏蛙心套管,山开口处插入动脉圆锥(见右图)。当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后下方及心尖方向推进,经主动脉瓣插入心室腔内(于心室收缩时插入,但不可插得过深,以免心室壁堵住套管下口)。此时可见套管中血液冲人套管,并使液面随心脏搏动而亡下移动,表明操作成功(否则需退回并重新插入)。用滴管吸去套管中的血液,更换新鲜任氏液。稳定住套管后,轻轻提起备用线,将左、右主动脉连同插入的套管用双结扎紧(不得漏液),再将结线固定在套管的小玻璃钩上,然后剪断结扎线上方的血管。轻轻提起套管和心脏,看清静脉窦的位置,于静脉窦下方剪断有牵连的组织,仅保留静脉窦与心脏的联系,使心脏离体(切勿损伤静脉窦)。用任氏液反复冲洗心室内余血,使套管内灌流液不再有残留血液。保持套管内液面高度一致(1.5~2cm),即可进行实验。 (2)将插好离体心脏的套管固定在支架上,用蛙心夹夹住少许心尖部肌肉(不可夹得过多,以免因夹破心室而漏液)。再将蛙心夹上的系线绕过一个滑轮与张力传感器相连(如右图)。注意:勿使灌流液滴到传感器上。调节显示器上心脏收缩曲线的幅度适中。 2、实验观察 (1)记录正常心搏曲线 (2)改用0.65%NaCI溶液灌流,并作好加药标记,观察心搏变化。待曲线氏插管装置出现明显变化时,立即吸去套管中的灌流液,同时做好冲洗标记,并用新鲜任氏液清洗2—3次,待心搏恢复正常。注意:换液时切勿碰套管,以免影响描记曲线的基线,同时保持灌流液面一致(以下同)。
蛙类心脏起搏点分析与心搏曲线观察
中国海洋大学实验报告 2011年11月5日姓名:刘玉姣专业年级:2009级生物技术学号:040012009065 同组者:魏惠惠马丽斐题目:蛙类心脏起搏点分析与心搏曲线观察 一、目的要求 观察蟾蜍心脏起搏点、心脏各部分活动顺序及心脏不同部位自律性的高低。 二、基本原理 心脏活动具有自律性,但各部分的自律性高低不同,窦房结的自律性最高。其每次兴奋依次激动心房、心室。引起心脏各部分的顺序活动。正常生理情况下窦房结为心脏的正常起搏点,其他部位的自律细胞称为潜在起搏点,当窦房结的兴奋传导受阻时,潜在起搏点可取代窦房结引发心房或心室活动。两栖类动物的心脏起搏点称静脉窦。 三、动物与器材 蟾蜍或蛙、手术器械一套、蛙板、玻璃板、蛙心夹、滴管、细线、秒表、任氏液。 四、方法与步骤 1.破坏蟾蜍脑和脊髓后,仰卧于蛙板上。用眼科剪刀仔细剪开心包,暴露出心脏。 2.识别蛙心静脉窦、心房、心室,在心房与静脉窦之间有一半月形白线,即窦房沟。 3.观察项目 (1) 静脉窦、心房、心室跳动顺序及频率。 (2)沿窦房沟进行结扎(斯氏第一结扎),观察心房、静脉窦活动情况。 (3)待心房、心室恢复跳动后,在心房、心室的交界处(房室沟)做斯氏第二结扎,观察心房、心室活动变化情况。 五、注意事项 1.复习心脏兴奋的发生与传播等理论知识。 2.手术过程要小心,避免出血。结扎应迅速扎紧。
3.实验中经常滴加任氏液,使心脏保持湿润。 六、实验结果与分析 第一次结扎后,由于静脉窦为正常起搏点,故仍能进行正常搏动;由于窦房沟处被结扎,兴奋传导受抑制,心房心室潜在起搏点的自律性不能立即恢复,而频率降低。须经一定时间才能从被压抑的状态中恢复其本身的自动兴奋频率。 第二次结扎处为房室沟,此时从静脉窦到心房的兴奋传导正常,故心房跳动频率恢复。从心房到心室的传导受阻,心室跳动停止。一段时间后,心室自身的潜在兴奋性使心室开始跳动。 七、思考题 第一斯氏结扎后和第二斯氏结扎后的心室搏动频率是否相同?为什么? 答:不相同。第一斯氏结扎后心室的搏动是受心房激动,搏动频率与心房的搏动频率相同。第二次斯氏结扎后,是心室自身的潜在兴奋性作用,使其开始搏动,不受心房控制。
1、蛙心灌流实验报告
蛙心灌流实验 实验目的 1、学习斯氏或八木氏离体蛙心灌流法。 2、了解心肌的生理特性。 3、观察Na+、K+、Ca2+及肾上腺素(Adr)、乙酰胆碱(Ach)等对离体心脏活动的影响。实验原理 动物的离体心脏,用理化特性类似于其血浆的代体液灌流时,在一定的时间内,仍然保持有节律的舒张活动。改变灌流液的理化特性,这种节律的舒缩活动也随之发生改变,说明内环境理化因素的相对恒定是维持心脏正常节律活动的必要条件。 实验材料与用品 1、材料:蟾蜍、斯氏蛙心套管、套管夹、支架、双凹夹、蛙心夹、蛙板(蜡盘)、常用手术器械、滴管、废液缸、棉线 2、药品:任氏液、0.65%NaCl、2%CaCl2 、1%KCl、0.01% 肾上腺素、0.01%乙酰胆碱 3、仪器:计算机采集系统、张力传感器 实验步骤 1、取一只蟾蜍,用探针破坏其脑脊髓后仰卧固定于蛙板上,剪开胸前区皮肤,剪去胸骨,暴露心脏。用眼科镊提起心包膜,再用眼科剪在心脏收缩时将其剪破,使心脏完全暴露出来。 2、识别心脏的各个部分,包括心房、心室、静脉窦等,并观察心跳。 3、插蛙心插管,制备离体蛙心。在左主动脉下穿一线结扎,靠近动脉窦,接着在左右主动脉下方穿一线,并打一松结留作固定插管用。 4、用手提起结扎线,用眼科剪在左侧主动脉距分叉3mm处向心脏剪一斜口,右手将盛有少量任氏液的蛙心插管由此口插入,先进入动脉圆锥,然后在心室收缩时,向前略向左推动蛙心插管,使之经主动脉瓣插入心室腔内(注意:为了使蛙心插管顺利插入心室,应使心室与动脉圆锥成一条直线)。进入心室的标志是随着心室搏动,均有血液喷入插管,插管的液面随着心搏而升降。结扎插管并将结扎线固定于插管侧面的小钩上,以防止标本滑脱。在蛙心插管插入心室后,用吸管及时吸出管内的血液,更换新鲜任氏液。提起插管,剪断主动脉左、右侧分支,轻轻提起插管和心脏,在静脉窦下方绕一线,将左右肺静脉及前后腔静脉一起结扎(切勿损伤静脉窦),在结扎线下方剪去所有牵连的组织,将心脏摘出。用任氏液反复冲洗(10~25滴/min的速度缓慢点滴)任氏液。至插管内任氏液完全澄清无色为止。以后做实验注意每次换液时,插管内液面应保持相同的高度。
蛙心灌流实验
实验报告 一、实验结果 1.正常情况下的心搏曲线图 溶液后的心搏曲线图 2.滴加2%CaCl 2 3.滴加0.01%肾上腺素后的心搏曲线图 4.滴加0.01%乙酰胆碱后的心搏曲线图 5.滴加0.01%阿托品后的心搏曲线图(本来应该是先滴加0.01%阿托品再滴加0.01%乙酰胆碱后的心搏曲线图)
6.滴加1%KCl溶液后的心搏曲线图 二、分析与讨论 溶液 1.滴2%CaCl 2 加入氯化钙后,曲线上升。 细胞外Ca2+浓度的增加,使细胞膜对Na+内流产生竞争性抑制,细胞去极化减小,使兴奋性和传导性降低。Ca2+内流增多,导致慢反应细胞去极化加强,传导性增高,复极化加速,心肌细胞的兴奋-收缩偶联加强,最后心脏收缩加强。 2.滴0.01%肾上腺素 加入肾上腺素后,曲线呈上升。 肾上腺素和心肌细胞膜上的β受体结合,导致Ca2+通透性增强,肌浆中Ca2+浓度增高,心肌细胞的兴奋-收缩偶联加强,最后心脏收缩加强。 3.滴0.01%乙酰胆碱 加入乙酰胆碱后,曲线下降。 乙酰胆碱能和心肌细胞膜M受体结合,提高心肌细胞膜 K+通道的通透性,也抑制Ca2+的内流。一K+通道的通透性的增强,促使K+外流,使复极电位绝对值增大; Ca2+内流减少,减弱心肌收缩。心肌细胞的兴奋-收缩偶联减弱,最后心脏收缩减弱。本实验结束后,心脏出现类似于抽搐的现象,因此我们认为乙酰胆碱对心脏的影响较大 4.先滴0.01%阿托品再滴0.01%乙酰胆碱
本实验由于疏忽在滴加阿托品后忘记滴加乙酰胆碱,故无法得出最后实验效果,继而无法确定先滴加阿托品后滴加乙酰胆碱会有什么效果。但根据理论知识阿托品是乙酰胆碱M受体阻断剂,滴加阿托品会占据乙酰胆碱与M受体的结合位点,使乙酰胆碱无结合位点,抑制它的作用。并且阿托品对心肌细胞无影响,所以最后曲线应该是无明显变化。 5.滴1%KCl溶液 加入KCl后,曲线呈明显下降,最后为直线。 细胞外K+浓度增高时,与Ca2+产生竞争性拮抗作用,抑制Ca2+内流,心肌的兴奋—收缩偶联过程减弱,心肌收缩力降低。 三、结论 1.外环境对心肌的收缩有重要影响,其各离子浓度的大小对心肌细胞有不一样的影响。 2. Ca2+、肾上腺素促进心脏的收缩; K+、乙酰胆碱抑制心脏的收缩;阿托品对心脏没有影响但他能抑制乙酰胆碱的作用。 3. 细胞外Ca2+在细胞膜上对钠离子内流有竞争性抑制作用。细胞外K+浓度对Ca2+有竞争性拮抗作用。
蛙腓肠肌实验
实验一坐骨神经腓肠肌标本制备 目的学习坐骨神经腓肠肌标本的制备方法。 原理两栖类动物的一些基本生命活动和生理功能与温血动物相似,而其离体组织所需要的生活条件比较简单,易于控制和掌握。因此在生理实验中常用蟾蜍的神经肌肉标本来观察兴奋性、兴奋过程、刺激的规律以及骨骼肌收缩的特点等。 实验对象蟾蜍 实验用品蛙类手术器械、烧杯、培养皿、棉球、纱布、细丝线、任氏液、粗剪刀、蛙板等。 实验步骤 1.破坏脑和脊髓左手持蛙,用食指压其头部前端,使头前俯。右手持探针由头端沿正中线向后划,触到凹陷即为枕骨大孔,将探针由此垂直刺入。再将探针折向前方,插入颅腔内并左右搅动捣毁脑组织。再将探针退回至进针处,针尖转向后方,刺入椎管捣毁脊髓。此时蟾蜍四肢瘫软,表明脑脊髓已完全破坏。 2.剪除躯干上部及内脏用粗剪刀在骶髂关节水平以上1cm处剪断脊柱。左手握住后肢,右手持剪刀沿脊柱的断口向下剪开两侧的皮肤及肌肉,再剪除已下垂的躯干上部及内脏。 3.剥皮剪掉肛门周围的皮肤,左手捏脊柱断端(勿触碰神经),右手捏住断端边缘的皮肤,向下剥掉两后肢皮肤。将标本背位放于表面有少许任氏液的蛙板上,洗净双手及用过的器械。 4.游离坐骨神经沿脊柱两侧用玻璃分针分离坐骨神经,用线在坐骨神经靠近脊柱处结扎并剪断。左手捏住脊柱,右手持剪刀从背面剪去向上突出的尾骨。然后从腹面沿中线将脊柱剪成两半。捏住两侧下肢带骨用力向两侧掰,使耻骨联合处脱臼,再从耻骨联合中央剪开两后肢,一后肢放入盛有任氏液的平皿中备用,一后肢用玻璃分针划开梨状肌及其附近的结缔组织,循坐骨神经沟(股二头肌与半膜肌之间的裂隙处)找出坐骨神经的大腿部分,用玻璃分针将腹部的坐骨神经小心勾出来,手执结扎神经的线,剪断坐骨神经的所有分支,一直游离至膝关节。 5.完成坐骨神经腓肠肌标本的制备将分离干净的坐骨神经搭于腓肠肌上,在膝关节周围剪掉全部大腿肌肉,并用普通剪刀将股骨刮干净,在股骨中部剪去`上段股骨。再在跟腱处以线结扎,剪断并游
生理实验6蟾蜍心脏起搏点观察期前收缩与代偿间歇的测定
实验六蟾蜍心脏起搏点观察期前收缩与代偿间歇的测定 一、实验目的 1.通过改变局部温度和结扎方法来观察蟾蜍心脏起搏点。 2.比较蟾蜍心脏不同部位的自律性高低,学习在体蟾蜍心跳曲线的记录方法。3.观察心室在收缩活功的不同时期对额外刺激的反应。 4.通过对期前收缩和代偿间歇的观察,了解心肌兴奋性变化的特点。 5.通过实验阐述心肌产生期外收缩的条件与代偿间歇出现的机理。 二、实验原理 蟾蜍的心脏由左心房、右心房和1心室组成,左、右心房有间隔,互不相通,但都与心室相通,因此而出现“混合血”,鱼类只有一条循环路线,蟾蜍具有两条循环路线,即体循环和肺循环。 心脏的特殊传导系统含有自 律细胞,因而活动具有自动 节律性,但各部分的自律性 高低不同。
两栖类动物的起搏点是静脉窦。两栖类动物心脏的结构特点是两个心房和一个心室。在其背面还有一个静脉窦。其心脏活动顺序为:静脉窦,右心房,心室,起博点是静脉窦。 在每次心动周期中,心肌每发生一次兴奋——收缩后,其兴奋性将发生一系列周期性变化。心肌兴奋后其兴奋性变化的特点是有效不应期特别长,相当于整个收缩期加到舒张期的早期,在此期间给予任何强大刺激均不能引起心肌兴奋收缩。随后为相对不应期,在此期给予心肌强的刺激可引起心肌兴奋收缩,最后为超常期。后两期均处于心肌舒张期内,因此,在舒张期如果在窦房结(两栖类为静脉窦)按正常节律性兴奋下达以前,给予心室肌一次适当的阈上刺激可引起一个提前出现的扩布性兴奋和收缩,称为期前收缩或额外收缩,也称早搏。期前收缩也有自已的有效不应期,而随后窦房结传来的正常的节律性兴奋,常常落在这个期前收缩的有效不应期中,因而不能引起心室的兴奋和收缩,这样心室较长时间地停留在舒张状态,直至下一次窦房结正常的节律性兴奋到达时,才恢复原来的正常的节律性兴奋和收缩。因此,期前收缩后就会出现一个较长时间的舒张间歇期,称为代偿间歇。 三、动物与器材 实验动物:蟾蜍4只/组。 实验器材:蟾蜍解剖器械、生物/桥式前置、刺激/记录电极、蛙心夹、线、滴管、小试管、培养皿、冰块、热水、支架、木夹、秒表、大头针。
实验六 蛙心起搏点观察和期前收缩与代偿间歇
实验七期前收缩与代偿间歇 【目的】 学习在体蟾蜍心跳曲线的记录方法,观察心脏在兴奋过程中兴奋性的变化。 【原理】 心肌有效不应期约相当于整个收缩期和舒张早期,在此期间给予任何刺激均不会产生兴奋。在心室舒张中、晚期电刺激心室肌,则可在正常节律性收缩之前发生一次收缩,称为期前收缩,并在其后往往有一较长的心室舒张期,称为代偿间歇。 【实验对象】 蟾蜍或蛙 【实验器材和药品】 蛙类手术器械,生物医学信号采集系统,刺激电极,蛙心夹,张力换能器,任氏液等。 【实验步骤与观察项目】 1、标本制备 (1)破坏脑脊髓取蛙一只,用自来水冲洗干净,用探针破坏脑和脊髓,并将其仰位固定在蛙板上。 (2)暴露内脏用粗剪刀剪开胸骨表面的皮肤并沿中线剪开胸骨,打开胸腔,暴露心脏。 (3)打开心包用眼科镊夹起心包膜,用眼科剪沿纵轴方向剪开心包膜。 2、仪器装置连接(如下图所示) 输入 刺激
蛙心与记录仪、换能器的连接装置 (1)打开主机张力换能器及刺激电极与主机相连接。 (2)在心脏舒张时用系有丝线的蛙心夹夹住心尖,心脏经蛙心夹和换能器连接。将刺激电极固定在铁架台上,使其两极和心室紧密接触。(3)选择张力,调节适宜的放大倍数和刺激参数。 3、观察项目 (1)描记正常心搏曲线,辨认收缩期和舒张期。 (2)在收缩期和舒张早、中、晚期分别电刺激心肌,观察期前收缩和代偿间歇。 【注意事项】 1、蟾蜍毁髓要彻底,否则肢体扭动将影响心跳曲线的记录。 2、刺激电极与心室肌接触要良好,一般将电极紧靠心底部一侧为宜。 3、用蛙心夹夹心室肌时,应在心舒时夹住心尖,不可夹得过多戳破心脏而漏血或夹得过少而脱落。 4、实验过程中经常滴加任氏液,使心脏表面保持湿润。 5、刺激心脏前,先检查电刺激是否有效,强度是否适宜。 【思考题】 1、如何证实心肌有较长的不应期?心肌的较长不应期有何生理意义? 2、期前收缩后一定出现代偿间歇吗?为什么? 3、为何心肌有期前收缩而骨骼肌不会出现?
② 蛙心灌流实验报告
蛙心灌流实验 2012级临七3班廖梦宇2012021320 一、实验目的 1.学习离体蛙心灌流的实验方法。 2.观察Na、K、Ca三种离子及肾上腺素、乙酰胆碱等因素对心脏活动的影响。 二、实验准备 1.实验对象:蟾蜍 2.实验器材:BL-420生物信号采集系统、张力换能器、蛙类手术器械1套、蛙心插管、 蛙心夹、试管夹、双凹夹、滴管、小烧杯4个、任氏液。 3.实验药品:0. 65%氯化钠、3%氯化钙、1%氯化钾、1:10 000肾上腺素、1:10 000 乙酰胆碱等。 三、实验步骤 1.离体蛙心的制备: 破坏脑和脊髓,仰卧固定于蛙板上。由剑突处向两锁骨肩峰端呈三角形剪开皮肤、胸壁,打开心包,暴露心脏。在两个主动脉干下各穿一根细线,并打一活结备 用。用连有细线的蛙心夹在心舒期夹住心尖部,将心脏上翻,辨认心房,静脉窦,腔静脉,然后结扎腔静脉,用眼科剪在左侧主动脉距分叉部3mm处剪一切口。将 盛有少量任氏液的蛙心套管(用拇指将套管堵住) 插入动脉球底部,稍后撤套管,再 将蛙心管尖端转向蟾蜍的背侧及左下方,于心缩期插入心室;将预置线的活结扎紧,并固定于插管壁的小钩上小心提起套管和心脏,剪断主动脉左右分支,将心脏连同 静脉窦一起剪下用任氏液反复冲洗心室。 2.实验装置: 将蛙心插管用试管夹固定于支架上,蛙心夹的连线连接在机械换能器上。 记录心脏收缩曲线。 3.处理因素 (1) 记录仅有任氏液时的收缩曲线,观察心率及收缩幅度,作为正常对照。 (2) 换以等量0.65%Nacl,观察心跳的变化。 (3) 任氏液换洗,待心跳恢复后,加入3%Cacl 1—2滴,观察心跳变化。 (4) 任氏液换洗,待心跳恢复后,加入l%Kcl 1~2滴,观察心跳变化。 (5) 任氏液换洗,待心跳恢复后,加入1:l0 000肾上腺素1~2滴,观察心跳变化。 (6) 任氏液换洗,待心跳恢复后,加入l:10 000乙酰胆碱1~2滴,观察心跳变化。
实验四蟾蜍心脏传导系、心脏起搏点分析;蟾蜍循环系统的解剖
实验四蟾蜍心脏传导系、心脏起搏点分析;蟾蜍循环系统的解剖 一.实验目的 1.练习双毁髓法,熟练掌握双毁髓技术。 2.重复练习并熟练掌握蟾蜍的解剖技术。 3.观察蟾蜍的心脏,辨认和心脏相连的血管,并学会画和心脏相连的血管的图。 4.学习双穿线手法使心脏游离。 5.学会心脏搏跳的技术方法。 6.观察蟾蜍的心血管系统,了解两栖类心脏的构造、循环途径及其特点。二.实验原理 1.双毁髓法麻醉蟾蜍:用金属毁髓针破坏蟾蜍的脑和脊髓,使蟾蜍处于一种麻醉状态,四肢瘫软,从而对蟾蜍进行解剖,露出其心脏。通过对心脏结扎使心脏游离,阻碍循环系统由此可以观察静脉血管。 2.两栖类心脏的起搏和传导系统有静脉窦,窦房沟,房室沟组成。这一类起搏传导系统具有自动节律性,但是各部分的自动节律并不相同,其中静脉窦氏主要起搏点,它的节律性最高,正常情况下心脏的波动频率和静脉窦的节律相同(即取决于静脉窦的节律),窦房沟和房室沟是潜在的起搏点,正常状态下他们只起传导兴奋的作用,其自身的自动节律性被主要起搏点的节律所掩盖。因此他们波动的顺序是:静脉窦先波动,然后是心房最后是心室。但是当主要起搏点的兴奋不能传导到窦房沟和房室沟的时候,他们的自动节律可引起心脏的波动。本实验用斯氏结扎法结扎蟾蜍主要和次要起搏点,观察他们的自动节律性。 3.蛙心的结构示意图 4.斯氏结扎图 (A处为斯氏第一次结扎部位,B为斯氏第二次结扎部位) 三.动物器材 1.动物:蟾蜍一只 2.实验仪器:手术刀两把,普通剪刀一把,解剖针一根,蜡盘两个(一个中央有圆孔),镊子两把,大头针若干个。 四.实验步骤 1.双毁髓麻醉蟾蜍:左手食指与中指、无名指与小指分别夹着前肢、后肢,握住蛙体,拇指按住吻端使头部上下活动,两耳后腺间出现一道褶线,此线中点或用金属毁髓针沿头背中线向后移动触到一凹陷处,即枕骨大孔。拇指下压使头前俯与脊柱相连处凸起,同时将毁髓针由凹陷处垂直刺入1mm,再将针从枕骨大孔向前平行刺入颅腔并在颅腔内搅动,彻底捣毁脑组织使之成为“脊蛙”。 2.将剪开体壁的蛙体腹面向上置于解剖盘中,展开四肢,用蛙钉向内斜呈45
蛙心起搏点观察和心肌收缩特性的观察
动物生理学实验报告 开课学院及实验室:XXX 2011年4月1日 学院生命科学 学院 班别XXX 姓名XXX 学号XXX 实验课程名称动物生理学实验组别第四组成绩 实验项目名称蛙心起搏点观察和心肌收缩特性的观察指导老师 一、实验目的 1.学习蛙类暴露心脏的方法,熟悉其心脏的解剖结构; 2.利用结扎法观察两栖类动物心脏的正常起搏点和心脏不同部位传导系统的自动节律性高低; 3.学习蛙类心脏活动的描记方法; 4.通过在心脏活动的不同时期给予刺激,观察心脏兴奋性周期变化的规律以及心肌收缩的特点。 二、实验原理 心肌的生理特性表现为兴奋性、自律性和传导性。其自律性取决于心脏的特殊传导系统,但心脏各部分的自动节律性高低不同。正常情况下,心脏起搏点窦房结(两栖类动物是静脉窦)的自律性最高,它产生的自动节律性兴奋向外扩布,并以此传到心房、房室交界区、心室,引起整个心脏兴奋和收缩,则静脉窦(窦房结)被称为正常起搏点,而心脏其他部位受窦房结(静脉窦)的控制不表现其自身的自律性,仅起着兴奋传导的作用,故称之为潜在起搏点。在某些病理情况下,窦房结的兴奋因传导阻滞不能控制其他自律组织的活动,或者其他自律组织自律性增高,则心房或心室就会受当时自律性最高的组织发出的兴奋性节律的控制进行活动,这些异常的起搏点部位称为异位起搏点。 在一个心动周期中,兴奋性会经历有效不应期、相对不应期、超常期等一系列周期性变化。其显著特点是有效不应期特别长,相当于整个收缩期和舒张期早期,在此期间施加任何刺激都不能引起心肌的再次兴奋和收缩。但在心肌舒张的早期之后(中晚期之内,相当于相对不应期和超常期),给予刺激可使心肌产生一次比正常节律提前出现的动作电位和收缩,称为期前兴奋和收缩。而期前兴奋和收缩也有自己的有效不应期,所以当下一次正常窦房结的节律性冲动到达时,常常会落在这个有效不应期内,因而不会引起心肌的兴奋和收缩,会出现一个较长的舒张期,称为代偿性间歇。如果窦性心律过慢,当期前兴奋的有效不应期结束时,窦性兴奋才传到心室,则可引起心室的一次新的收缩,而不会出现代偿性间歇。因此心脏不会像骨骼肌那样产生强直收缩,从而实现心脏的泵血机能。 三、使用仪器、材料 1.材料:青蛙、任氏液。 2.仪器:生物信号采集处理系统、10g张力换能器、小动物手术器械、支架、蛙心夹、滴管、烧杯、双极刺激电极、蛙板、蛙钉、玻璃分针、秒表等。
生理学实验报告-蛙心灌流
蛙类离体心脏灌流 一、【目的要求】 1、学习离体蛙心灌流法。 2、观察Na+,K+,Ca2+及肾上腺素(Adr),乙酰胆碱(ACh),乳酸对离体心脏活动的影响。 二、【原理】 将离体蛙心(失去神经支配的蛙心)保持在适宜的环境中,在一定的时间内仍然能够保持节律性收缩,心脏正常的节律性活动需要一个适宜的理化环境,离体心脏也是如此,离体心脏脱离了机体的神经支配和全身体液因素的直接影响,可以通过改变灌流液的某些成分,观察其对心脏活动的作用。心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。外源性给予去甲肾上腺素或乙酰胆碱可产生类似心交感神经或迷走神经兴奋时对心脏的作用。 三、【实验仪器】 青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、任氏液。套管夹、0.65%NaCl、2%CaCl2、1%KCl、1:10000肾上腺素、1:10000乙酰肌碱、3%乳酸。 四、【方法与步骤】 1、斯氏蛙心插管法 (1)一只青蛙,双毁髓后背位置于蜡盘中,按前面的方法暴露心脏。仔细识别心脏周围的大血管(见右图)。在左主动脉下方穿一线,于动脉圆锥处结扎(动物个体小时,结扎位置可靠上些)。再从左右两主动脉下方穿一线,并打一活结备用。左手提起主动脉上的结扎线,右手用眼科剪在结扎线下方、沿向心方向将动脉上壁剪一斜口。选择大小适宜的蛙心套管,然后将盛有少量(套管内2~3 cm高度)任氏液(内加入一滴肝素溶液)的斯氏蛙心套管,山开口处插入动脉圆锥(见右图)。当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后下方及心尖方向推进,经主动脉瓣插入心室腔内(于心室收缩时插入,但不可插得过深,以免心室壁堵住套管下口)。此时可见套管中血液冲人套管,并使液面随心脏搏动而亡下移动,表明操作成功(否则需退回并重新插入)。用滴管吸去套管中的血液,更换新鲜任氏液。稳定住套管后,轻轻提起备用线,将左、右主动脉连同插入的套管用双结扎紧(不得漏液),再将结线固定在套管的小玻璃钩上,然后剪断结扎线上方的血管。轻轻提起套管和心脏,看清静脉窦的位置,于静脉窦下方剪断有牵连的组织,仅保留静脉窦与心脏的联系,使心脏离体(切勿损伤静脉窦)。用任氏液反复冲洗心室内余血,使套管内灌流液不再有残留血液。保持套管内液面高度一致(1.5~2 cm),即可进行实验。 (2)将插好离体心脏的套管固定在支架上,用蛙心夹夹住少许心尖部肌肉(不可夹得过多,以免因夹破心室而漏液)。再将蛙心夹上的系线绕过一个滑轮与张力传感器相连(如右图)。注意:勿使灌流液滴到传感器上。调节显示器上心脏收缩曲线的幅度适中。 2、实验观察 (1)记录正常心搏曲线 (2)改用0.65%NaCI溶液灌流,并作好加药标记,观察心搏变化。待曲线氏插管装置出现明显变化时,立即吸去套管中的灌流液,同时做好冲洗标记,并用新鲜任氏液清洗2—3次,待心搏恢复正常。注意:换液时切勿碰套管,以免影响描记曲线的基线,同时保持灌流液面一致(以下同)。
