无机化学与化学分析的学习指导12

第12 章
s 区元素
一、教学基本要求
1. 了解s区元素的物理性质和化学性质,能解释碱金属与水、醇和液氨反应的不同;
2. 了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同;
3. 了解s区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化
规律;
4. 了解s区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释;
5. 会用离子极化理论解释碳酸盐分解规律;
6. 了解对角线规则和锂、铍的特殊性。
二、要点
1. 汞齐(amalgam )
又称汞合金,汞的特性之一是能溶解除铁以外的许多金属而生成汞齐。汞与一种
或几种金属形成汞齐时,含汞少时是固体,含汞多时是液体。天然的有金汞齐,银
汞齐,人工制备的有:钠汞齐、钾汞齐、锌汞齐、锡汞齐、铅汞齐等。
2. 熔盐电解法(Molten-salt electrolysis)
指以熔融态盐类为原料的电解方法,常用于制备不能由水溶液中制备的金属,如碱
金属、碱土金属以及钍、钽混合稀土金属的生产。有时为降低熔体的熔点,节省电
能,须加入一定量的助熔剂。
3. 热还原法(Thermo-deoxidization)
用化学活性较强的金属,将被还原的金属从其化合物中置换出来,以制备金属或其
合金的方法。
4. 冠醚(Crown ether)
分子结构类似皇冠的“大环多醚”。最常用的有18-冠-6 (如下图中的a)、二环己基
-18-冠-6及二苯基18-冠-6等。冠醚对K+、Na+及其他阳离子有很强的选择性络合
,F- ),提
K + X- 表示( X=MnO
4高了裸阴离子的活性。冠醚在有机合成中常用作“相转移反应的催化剂”。
5.穴醚(Cryptant)
分子结构类似地穴的“大环多醚”。穴醚几乎能够实现对K+和Na+离子的完全
分离,选择性可高达105:1。如下图中的(b) (c)所示。
(a) (b) (c)
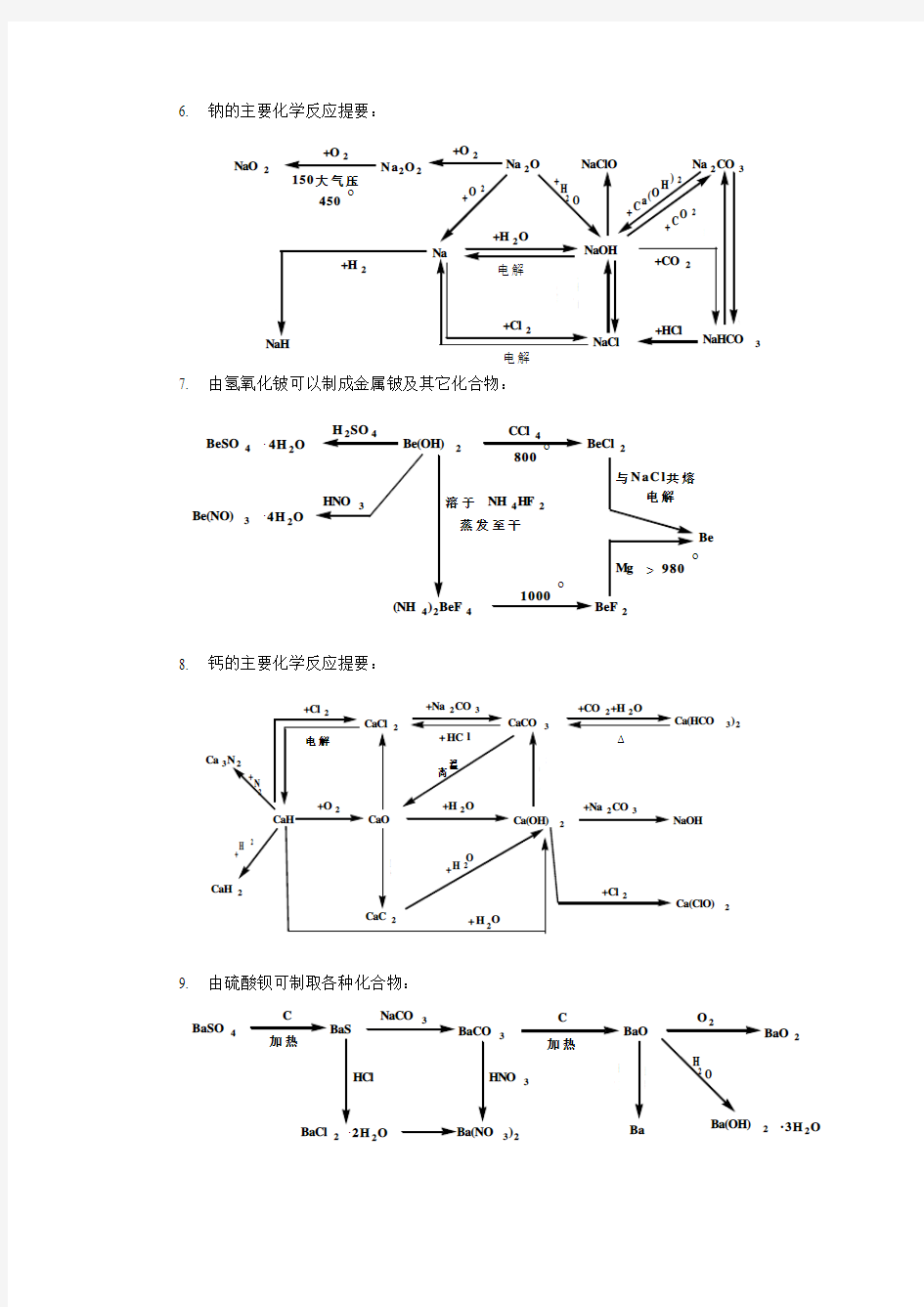
6. 钠的主要化学反应提要:
7. 由氢氧化铍可以制成金属铍及其它化合物:
8. 钙的主要化学反应提要:
9. 由硫酸钡可制取各种化合物:
Ca 33)2
Ca(ClO)
2
BaSO 4C
BaCl 22O NaCO 333BaO 2Ba(OH)23H 2O
2
3)2C
加热
加热·
Ba BeSO 44H 2O H 2SO 42Be(NO)34H 2O (NH 4241000
2
Be
于蒸发至干
·CCl
4800
BeCl ·NH 4HF 2o
o NaO 2+
C
O
+
H
O 3
电解
10. 对角线规则(diagonal rule)
在周期表的二、三周期中,某一元素的性质和它左上方或右下方的元素性质的相似
性,称为对角线规则。这种相似性比较明显的表现在Li和Mg、Be和Al、B和Si
三对元素之间,但C和P以及其它元素之间也存在某些对角线效应。
三、学生自测练习题
1. 是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)
CaH2便于携带,与水分解放出H2,故野外常用它来制取氢气。()
碱金属和碱土金属很活泼,因此在自然界中没有它们的游离状态。()碱金属的熔点、沸点随原子序数增加而降低,因而碱土金属的熔点沸点也会具有这变化规律。()碱金属是很强的还原剂,所以碱金属的水溶液也是很强的还原剂。()碱金属的氢氧化物都是强碱性的。()
氧化数为+2的碱土金属离子,在过量碱性溶液中都是以氢氧化物的形式存在。()铍和其同组元素相比,离子半径小,极化作用强,所以形成键具有较多共价性。()因为氢可以形成H+,所以可以把它划分为碱金属。()
某溶液共存有Na+,K+,Al3+,NO-
3,HCO-
3
和SO-2
4
,并无任何反应发生。()
由Li至Cs的原子半径逐渐增大,所以其第一电离能也逐渐增大。()
2. 选择题(选择正确答案的题号填入)
2.1 下列成对元素中化学性质最相似的是: ()
a. Be 和Mg
b. Mg和Al
c. Li和Be
d. Be和Al
2.2 下列元素中,第一电离能最小的是: ()
a. Li
b. Be
c. Na
d. Mg
2.3 下列最稳定的氮化物是: ()
a. Li3N
b. Na3N
c. K3N
d. Ba3N2
2.4 下列水合离子生成时,放出热量最少的是: ()
a. Li+
b. Na+
c. K+
d. Mg2+
2.5 下列最稳定的过氧化物是: ()
a. Li2O2
b.Na2O2
c. K2O2
d. Rb2O2
2.6 下列化合物中,键的离子性最小的是: ()
a. LiCl
b. NaCl
c.KCl
d. BaCl2
2.7 下列碳酸盐中,热稳定性最差的是: ()
a. BaCO3
b. CaCO3
c. K2
d. Na2CO3
2.8 下列化合物中,在水中溶解度最小的是: ()
a. NaF
b. KF
c.CaF2
d. BaF2
2.9 下列各组化合物中,用煤气灯加热时分解产物类型不同的一组是: ()
a. NaNO3, KNO3
b. LiNO3 , NaNO3
c. LiNO3, Mg(NO3)2
d. Mg(NO3)2 , Cu(NO3)2
2.10 下列化物中,溶解度最大的是: ()
a. LiF
b. NaClO4
c.KClO4
d. K2PtCl6
2.11 下列化合物中,具有磁性的是: ()
a. Na2O2
b. SrO
c. KO2
d.BaO2
2.12 下列钡盐中,在酸中溶解度最小的是: ()
a. BaCO3
b. BaC2O4
c. BaCrO4
d. BaSO4
2.13 关于s区元素的性质,下列叙述中不正确的是: ()
a. 由于s区元素的电负性小,所以都形成典型的离子型化合物;
b. 在s区元素中,Be、Mg因表面形成致密的氧化物保护膜而对水较稳定;
c. s区元素的单质都有很强的还原性
d. 除Be、Mg外,其他s区元素的硝酸盐或氯酸盐都可做焰火材料。
2.14 关于Mg , Ca , Sr , Ba及其化合物的性质,下列叙述中不正确的是: ()
a. 单质都可以在氮气中燃烧生成氮化物M3N2;
b. 单质都易与水、水蒸气反应得到氢气;
c. M(HCO3)2在水中的溶解度大MCO3的溶解度;
d. 这些元素几乎总是生成+2价离子。
3. 填空题
3.1 金属锂应保存在中,金属钠和钾应保存在中。
3.2 在s区金属中,熔点最高的是,熔点最低的是,密度最小的是,硬
度最小的是。
3.3 周期表中,处于斜线位置的B与Si、、性质十分相似,人们习惯上把这
种现象称之为“斜线规则”或“对角线规则”。
3.4 在CaCO3, CaSO4, Ca(OH)2, CaCl2 , Ca(HCO3)2五种化合物中,溶解度最小的
是。
3.5 给出下列物质的化学式:
(1) 萤石;(2) 生石膏;
(3) 重晶石;(4) 天青石;
(5) 方解石;(6) 光卤石;
(7) 智利硝石;(8) 芒硝;
(9) 纯碱;(10) 烧碱。
3.6 Be(OH)2与Mg(OH)2性质的最大差异是。
3.7 电解熔盐法制得的金属钠中一般含有少量的,其原因是。
3.8 熔盐电解法生产金属铍时加入NaCl的作用是。
3.9 盛Ba(OH)2的试剂瓶在空气中放置一段时间后,瓶内出现一层白膜是。
3.10 比较各对化合物溶解度大小:
(1) LiF AgF; (2) LiI AgI; (3) NaClO4KClO4;
(4) CaCO3Ca (HCO3)2; (5) Li2CO3NaCO3。
3.11 ⅡA族元素中,性质表现特殊的元素是,它与p区元素中的性质极相似,
如两者的氯化物都是化合物,在有机溶剂中溶解度较大。
3.12 碱土金属的氧化物,从上至下晶格能依次,硬度逐渐,熔点依次。4.完成并配平下列反应方程式
4.1 在过氧化钠固体上滴加热水。
4.2 将二氧化碳通入过氧化钠。
4.3 将氮化镁投入水中。
4.4 向氯化锂溶液中滴加磷酸氢二钠溶液。
4.5 六水合氯化镁受热分解。
4.6 金属钠和氯化钾共热。
4.7 金属铍溶于氢氧化钠溶液中。
4.8 用NaH还原四氯化钛。
4.9 将臭氧化钾投入水中。
4.10 将氢化钠投入水中。
5.简答题
5.1 市售的NaOH中为什么常含有Na2CO3杂质?如何配制不含Na2CO3杂质的NaOH
稀溶液?
5.2 钾要比钠活泼,但可以通过下述反应制备金属钾,请解释原因并分析由此制备金
属钾是否切实可行。
Na + KCl = NaCl + K
5.3举例说明铍与锂的相似性。
5.4举例说明锂与同族的钠、钾元素计化合物的不同点。
5.5一固体混合物可能含有MgCO3,Na2CO3,Ba (NO3)2,AgNO3和CuSO4。混合物
投入水中得到无色溶液和白色沉淀;将溶液进行焰色试验,火焰呈黄色;沉淀可
溶于稀盐酸并放出气体。试判断那些物质肯定存在,哪些物质肯定不存在,并分析
原因。
5.6在电炉法炼镁时,要用大量的冷氢气将炉口馏出的蒸气稀释、降温,以得到金属镁
粉。请问能否用空气、氮气、二氧化碳代替氢气作冷却剂?为什么?
自测练习题答案
1. 是非题
1.1 (√) 1.2 (√) 1.3 (×) 1.4 (×) 1.5 (×)
1.6 (×) 1.7 (√) 1.8 (√) 1.9 (×) 1.10 (×)
2. 选择题
2.1 ( d ) 2.2 ( c ) 2.3 ( a ) 2.4 ( c ) 2.5 ( d )
2.6 ( a ) 2.7 ( b ) 2.8 ( c ) 2.9 ( b ) 2.10 ( b )
2.11 ( c ) 2.12( d ) 2.13( a) 2.14 (b )
3. 填空题
3.1 液态石蜡,煤油。
3.2 Be, Cs,Li,Cs。
3.3 Be与Al,Li 与Mg。
3.4 CaCO3。
3.5 (1) CaF2,(2) CaSO4·2H2O,(3) BaSO4,(4) SrSO4,(5) CaCO3,
(6) KCl·MgCl2·6 H2O,(7) NaNO3,(8) Na2SO4·10H2O,(9) Na2CO3,(10) NaOH。
3.6 Be(OH)2具有两性,即溶于酸又溶于强碱;Mg(OH)2为碱性,只溶于酸。
3.7 金属钙,电解时加入CaCl2助溶剂而有少量的钙电解时析出。
3.8 增加熔盐的导电性。
3.9 BaCO3
3.10 (1) < , (2) > , (3) > , (4) < , (5) < 。
3.11 Be,Al,共价。
3.12 减小,减小,降低。
4.完成并配平下列反应方程式
4.1 2Na2O2 + 2H2O(热) = 4Na + O2
4.2 2Na2O2 + 2CO2 = 2Na2CO3 + O2
4.3 N2 + 6H2O = Mg(OH)2 + 2NH3
= Li3PO4 + H+
4.4 3Li+ + HPO 2
4
4.5 MgCl2?6H2O = Mg(OH)Cl + HCl + 5H2O
4.6 Na(s) + K = NaCl + K(g)
4.7 Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4.8 TiCl4 + 4NaH = Ti + 2H2 + NaCl
4.9 4KO3 + 2H2O = O2 + 4KOH
4.10 2NaH + 2H2O = 2NaOH + H2
5.简答题
5.1 NaOH是由Ca(OH)2溶液与Na2CO3反应而得到的。过滤除去CaCO3后即得NaOH。
NaOH中可能残留少许Na2CO3。同时,NaOH吸收空气中的气体也引进一些Na2CO3
杂质。欲配制不含杂质的NaOH溶液,可先配制浓的NaOH溶液。由于Na2CO3
在浓NaOH溶液中溶解度极小,静止后析出Na2CO3沉淀。再取上层清液稀释后可
以得到不含杂质的NaOH稀溶液。
5.2 钾的沸点为774℃,钠的沸点为883℃,钾的沸点比钠的沸点低109℃,控制温度
在钠和钾沸点之间,则生成的钾从反应体系中挥发出来,有利于平衡向生成钾的
方向移动。由于反应是一个平衡过程,反应不够彻底。同时,钾易溶于熔融的氯
化物中或生成超氧化物等因素,此方法并不切实可行。
5.3 Be和Al单质及化合物性质有许多相似之处,可以从以下几个方面来理解:
(1) Be和Al都是两性金属,不仅能溶于酸,也都溶于强碱放出氢气。
(2) Be和Al的氢氧化物都是两性化合物,易溶于强碱。
(3) Be和Al都是共价化合物。易升华、聚合、易溶于有机溶剂。
(4) Be和Al的盐都易水解。
5.4 由于Li+ 半径较小极化能力较强,使锂与同族的钠、钾等元素及化合物有许多不
同之处。
(1) 锂与水反应不如钠、钾与水反应剧烈。主要原因是锂的熔点较高,氢氧化锂
的溶解度较小。
(2) Li+ 极化能力强,硝酸锂热分解产物与硝酸钠等不同。
(3) 某些锂盐为难溶盐,,而相应的钠盐、钾盐则为易溶盐。
(4) 锂在空气中燃烧产物与钠、钾不同。钠、钾在空气中燃烧产物主要是过氧化
物,而锂在空气中燃烧产物为正常的氧化物。
(5) 锂与氮气在室温下即可缓慢化合,而钠和钾与氮气的反应需要在高温下才能
进行。
(6) 与氯化钠、氯化钾不同,氯化锂的水合物受热时发生水解。
(7) 锂的氯化物为共价化合物,而钠、钾则形成离子化合物。
5.5 肯定存在:MgCO3,Na2SO4
肯定不存在:Ba(NO3)2,AgNO3,CuSO4
混合物投入水中,得无色溶液和白色沉淀,则CuSO4肯定不存在。溶液在焰色反
应时,火焰呈黄色,则Na2SO4肯定存在。溶液中不存在Ba(NO3)2。沉淀可溶于稀
盐酸并放出气体,则肯定存在MgCO3,而则Ba(NO3)2肯定不存在。AgNO3也肯定
不存在,因为AgNO3遇Na2SO4将有些Ag2SO4白色沉淀生成,沉淀中MgCO3和
Ag2SO4在稀盐酸中溶解而Ag2SO4不溶。
5.6 不能用空气、氮气、二氧化碳代替氢气作制冷剂,因为镁可以和空气、氮气、二氧
化碳发生反应。
四、课后习题及答案
1 写出下列反应的平衡方程式:
(a) 锂和镁与氮气的反应;
(b) 钠和水的反应;
(c) 钠和甲醇的反应;
(d) 钠和四氯化碳的反应;
(e) Na-Hg汞齐和水的反应;
(f) 以钠为还原剂从TiCl4(l) 到Ti(s) 的还原反应;
(g) MgCO3和CaCO3混合的白云石的煅烧反应;
(h) Na2O2和CO2的反应。
解答
(a)6Li + N2 === 2Li3N ;3Mg + N2 === Mg3N2;
(b)2Na + 2H2O === 2NaOH + H2↑;
(c)2Na + 2CH3OH === 2CH3ONa + H2↑;
(d)4Na + CCl4 === 4NaCl + C ;
(e)2↑+2Hg ;
(f)TiCl4
NH 3(l)
(g) MgCO 3 + CaCO 3 === MgO + CaO +2CO 2 ↑ (高温);
(h) Na 2O 2 + CO 2 === Na 2CO 3 + O 2 ↑。
2 Na 溶于液态NH
3 时有何现象发生?请予以解释。
解答
钠溶于纯的无水液氨中得到深蓝色的溶液,原因在于形成了氨合物种?氨合电子,反应如下:
Na(s) ==== N a +(am) + e -(am)
其中,“am ”代表氨,e -(am)为氨合电子。
3 解释下列现象:
(a) 对于给定的碱金属,其第二电离能远高于第一电离能。
(b) Li 是唯一可以形成稳定的氮化物的碱金属。
(c) 对碱金属的反应:M +(aq) + e -
M(s) 而言,E ○一非常接近。 (d) 对所有的碱金属而言,在水溶液中Li 是最强的还原剂。 解答
(a) 对于碱金属而言,最外层的电子组态为n s 1。由于受到内层电子强烈的屏蔽作用而
使得核对n s 电子的控制较为松弛,显示为第一电离能较低;而内层是满层,失去电子自然就比较困难,因此第二电离能远高于第一电离能。
(b) Li 在碱金属中,原子半径最小,电荷密度高,根据“大大?小小”匹配原则,其可
与半径较小的氮形成比较稳定的氮化物。
(c) 对碱金属的反应:M +(aq) + e - M(s) 而言,在水溶液中,由于其热力学循环
的总焓变基本相等,当上述反应在常温常压下进行时,相对于焓变而言的熵变项很小,可以忽略不计,所以还原过程的△G ?可以用△H ?取代。既然△G ?接近,则以─△G ?=nFE ?计算其E ?,必然使得其标准电极电势比较接近。
(d) 以上题来看, 金属的还原性可从其标准电极电势看出,与金属转变成水化离子过程
的总能量有关。Li + 半径极小,在水溶液中,其溶剂化程度和强度最大,产生较大的水合能(负值),不仅补偿了其电离能(正值)的差值,而且还远高于其他碱金属,致使其总焓变较大,从而具有较大的标准电极电势。
4 对于可能是LiCl 或 KCl 的纯固态物体,请给出一种简单的鉴定方法。
解答
LiCl 因具有共价性在水中的溶解度极小,远远小于KCl 的溶解度。因此,可以根据两种物质的溶解度不同来加以鉴别。
5 简要说明Li 和 Mg 之间的“对角线关系”。
解答
对角线规则指在周期表的二、三周期中,某一元素的性质和它左上方或右下方的元素性质的相似性。Li 和 Mg 之间符合这样的关系,是由它们原子半径、离子电荷相差不大,有相近的离子场力决定的。Li 和 Mg 之间相似的性质表现为:与氧反应都生成普通氧化物而不生成过氧化物;都可生成氢化物;都可与氮化合;碳酸盐及磷酸盐难溶于水;氢氧化物都是中强碱,且溶于水,溶解度小。
6 解释为什么钡能形成过氧化物而铍则不能。
解答
因“能量效应”大阴离子通常可被大阳离子所稳定,
而铍的半径特别小,因而铍的过氧化物应当不如钡的
过氧化物稳定。事实上钡在空气中能自发生成过氧
化物而铍只形成BeO 。
7 金属和穴配体的配合物的稳定性,通过其在水中的形
成常数的对数与阳离子半径作图得到如图所示的曲
线。解释为什么较小的2.2.1. 穴趋向于与Na +形成配
合物,而较大的2.2.2. 穴趋向于与K + 形成配合物。
解答
由图可知,2.2.1. 穴趋向于与Na + 形成配合物, 而较大的2.2.2. 穴趋向于与K + 形成配合物,说明穴状配体对不同金属离子具有空间选择性,而影响这种选择性的主要因素是阳离子体积与配体空穴大小的匹配程度。即,2.2.1. 穴的大小适合于Na +的体积,而2.2.2. 穴适合于K +的体积。
五、 中文参考文献
1. 韩维和, 宋红兵, 谭晓维. 碳酸氢镁溶液受热后的产物研究. 化学通报, 2003, 66(8): 564
2. 欧阳健明. 草酸钙结石研究中的化学基础. 化学通报, 2002, 65(5): 326
3. 刘兆平, 杨永会,邵华等. 氢氧化镁阻燃剂的应用进展. 化学通报,2001,64(01003)
4. 陈 铭, 温廷连. LiAlO 2粉体合成. 化学通报,1998,(10):19
5. 刘卫国, 肖应凯, 周引民. 锂化学试剂中锂同位素丰度及原子量的异常. 化学通报, 1996,
(5): 29
6. 刘 平. 碱金属和碱土金属卤化物晶格能计算. 化学通报, 1991, (6): 44
7. 陈 刚, 张青莲, 肖应凯等. 我国锂矿物中锂同位素丰度研究. 化学通报, 1990, (9): 33
8. 申泮文, 张允什, 陈声昌等. 氧化铝钙合成方法研究. 化学通报, 1986, (9): 31
9. 高世杨. 锂及其化合物的用途. 化学通报, 1964, (10)总: 617
10. 卢开涛, 卢明刚. 关于碱土金属硫化物溶解性的探讨. 化学教育,1999,(7~8):79
11. 尹冬冬, 薛恒刚, 王志文. 人体中的钙. 化学教育,1997, (1): 2
12. 刘国宁. 钙与人体骨质疏松. 化学教育, 1997, (2): 2
13. 陈东文. 锂与社会. 化学教育, 1997, (5): 3
14. 邹庆松. 镁跟碱性银氨溶液生成氢气的反应. 化学教育, 1997, (8): 9
15. 郭权译. 锂键. 化学教育, 1987, (6): 35
16. 严宣申. BaS 溶解性为“—”. 化学教育, 2004, 24(6): 64
17. 张彩云. 碱金属双原子分子的键电子与键能关系. 大学化学,1996, (1): 26
18. 杨大荣. 锂键与氢键的比较. 大学化学
, 1994, (2): 29
19.彭谦, 翟高红, 王育彬等. Be和B的几个小分子及其离子的电子结构. 化学学报, 2003,
61(9~12): 1375
20.秦付云, 顾达. 制备稳定的过碳酸钠应注意的几个问题. 化学世界, 2000, 41(7): 386
21.沈国良, 徐铁军. 二硫化钠水溶液的研制. 化学世界, 1999, 40(8): 402
22.李慧芝, 孟昭典, 钟军. 超细硫酸钡合成新方法. 化学世界, 1995, 36(6): 291
23.刘晓红, 卢芳仪. 氯化钾和硫酸钠转化反应制取硫酸钾. 化学世界, 1995, 36(11): 569
24.卓宗一. 固态氯化钠对大气化学的影响. 化学世界, 1989, 30(3): 132
25.陈月华, 沈新谷. 透明碳酸镁的研究. 化学世界, 1988, 29(5): 193
26.叶维瑜, 李克民. 针状结晶碱式氯化镁的研制. 化学世界, 1988, 29(12): 532
27.胡志彤, 新型碳酸钙. 化学世界, 1986, 27(3): 99
28.刘国士. 二氧化锰法制氢氧化钡的研究. 化学世界, 1986, 27(10): 437
29.姜述芹, 周保学, 于秀娟等. 氢氧化镁处理含镉废水的研究. 环境化学, 2003, 22(6): 601 31. 谭干祖, 焦天权, 杨世琰. 我国的冠醚合成化学. 化学通报, 1988, (2): 50
无机化学心得
姓名: 班级: 学号:
无机及分析化学心得 经过一个学期对《无机及分析化学》这门课程的学习,我的感触颇多。因为我是一名转专业的学生,所以在大二的时候才开始上这门课。从一开始的自我想象容易,到自我感觉良好,到有点小小的紧张,再到立志要开始认真的学习,到感觉状态有所好转,再到充满自信。这其中的纠结、艰辛和自豪,不是一两句话就可以描述清楚的。再加上因为我想要获得保研的资格,因此我对于将这门课学好是持着一种前所未有的坚定心情。下面我就将会将我这一学期所收获的一一讲来。 从一开始的自我想象容易,这其中的莫名的自信感来自于因为我在高中的时候是一名理科生,当时的化学成绩自我感觉还行吧,所以在开学的时候说实话根本就没把《无机及分析化学》这门课当做我所学的重点去认真的准备。到后来在开学的第四周的时候开始上无机化学的第一节课,那节课老师在无心之间问了一句:“同学们,现在这个班上有多少人在高中的时候是学的文科啊?”当时我们就只看见前后左右的人都举手了,还认识到只有我们极少数的人是大二的师兄师姐,所以在当时出于身为少数理科生的骄傲和一点点身为师姐的骄傲对这门课的自信又多了一层(虽然其中没有什么联系,但在当时我还真就这么想了,现在想想当时还真幼稚)。在上了3、4 节课的时候吧,紧张感开始出现了,在当时老师其实讲课是讲的很慢的,而我们差不多学到了胶体溶液那一节,当时在听胶团结构的时候,真的就只感觉眼前是一个个熟悉又陌生的字符在眼前飞舞,脑袋中是一片空白,感觉平时都听得懂得字怎么现在就不明白了呢?直到后来在课下复习的时候才渐渐的弄明白。比如:AgNO3 溶液与过量的KI 溶液反应制备AgI 溶胶,其反应的方程式为: AgNO3+KI=AgI+KNO3 又因为过量的KI 溶液和固体AgI 粒子在溶液中选择吸附了与自身组成相关的I -,因此胶粒带负电。而此时形成的AgI 溶胶的胶团结构 - + x- + 为:【(Agl) m? nI ?( n-x)K 】?XK 此时,(AgI) m为胶核,I-为电位离子,一部分K+为反离子,而且电位离子和反离子一起形成吸附层,吸附层与胶核一起组成胶粒。由于胶粒中反离子数比电位离子少,故胶粒所带电荷与电位离子符号相同,为负电荷。其余的反离子则分散在溶液中,形成扩散层,胶 粒与扩散层的整体成为胶团,胶团内反离子和电位离子的电荷总数
考研无机化学_知识点总结
第一章物质存在的状态………………………………………………………………2 一、气体 .......................................................................................................... 2 二、液体 .......................................................................................................... 3 ①溶液与蒸汽压 ................................................................................................ 3 ②溶液的沸点升高和凝固点的下降 ................................................................... 3 ③渗透压 .......................................................................................................... 4 ④非电解质稀溶液的依数性 .............................................................................. 4 三、胶体 .......................................................................................................... 4 第二章 化学动力学初步……………………………………………………………5 一、化学反应速率 ............................................................................................ 5 二、化学反应速率理论 ..................................................................................... 6 三、影响化学反应速率的因素 .......................................................................... 6 2、温度 ............................................................................................................ 7 第三章 化学热力学初步……………………………………………………………8 一、热力学定律及基本定律 .............................................................................. 8 二、化学热力学四个重要的状态函数 ................................................................ 9 4、自由能 ....................................................................................................... 10 ①吉布斯自由能 .............................................................................................. 10 ②自由能G ——反应自发性的判据 .................................................................. 11 ③标准摩尔生成自由能θ m f G ? (11)
大学无机化学第十二章试题及答案
第十三章硼族元素 总体目标: 1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法 2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征 3.掌握铝及其化合物的结构、性质和制备 4. .认识铍和铝的相似性 各节目标: 第一节硼单质及其化合物 1.掌握硼单质的结构、化学性质、用途和制备方法 2.掌握乙硼烷、硼酸(H3BO3)、硼砂和三卤化硼的性质、结构和制备方法 3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成 第二节铝单质及其化合物 1.掌握铝及其化合物的主要性质和AlCl3的结构,了解铝的提取和冶炼 2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物
第三节镓、铟、铊 了解镓、铟、铊单质及其重要化合物的性质 习题 一、选择题 ⒈下列有关硼、铝性质的叙述,错误的是( ) A.都是缺电子原子 (OH)3是弱酸,Al(OH)3是两性偏碱性C.其三卤化物分子都是平面三角形结构 D.都是亲氧元素 ⒉在下列a—Al2O3的制备方法中,不妥的是( ) A.灼烧Al(OH)3 B.灼烧Al(NO3)3 C.高温电解Al2(SO4)3 D.金属铝在氧中燃烧 ⒊下列铝的化合物不能用湿法制得的是( ) A. Al2(CO3)3 (SO4)3 C.AlCl3 (Ac)3 4. 以下矿物中含有铝的是( ) A.冰晶石 B.孔雀石 C.白云石 D.方铅矿 5. 下列化合物属于缺电子化合物的是 ( ) (吉林大学《无机化
学例题与习题》) B. H[BF4] C. B2O3 D. Na[Al(OH)4] 6. 在硼的化合物中,硼原子的最高配位数不超过4,这是因为( ) A .硼原子半径小 B.配位原子半径大 C.硼与配位原子电负性差小 D. 硼原子无价层d轨 道 7. 下列关于BF3的叙述中,正确的是( ) 易形成二聚体为离子化合物 C. BF3为路易斯酸 D. BF3常温下为液体 8. 下列金属单质中,熔点最低的是( ) (吉林大学《无机化学例 题与习题》) A. Cu B. Zn C. Na D. Ga 9. 下列化合物中,熔点最低的是( ) (吉林大学《无机化学 例题与习题》) A. BCl3 B. CCl4 C. SiCl4 D. SnCl4 10. 下列物质中水解并能放出H2的是 ( ) (吉林大学《无机化 学例题与习题》)
无机化学与化学分析
·基础化学· 【课程名称】无机化学与化学分析(Inorganic Chemistry and Chemical Analysis)【课号】041026 【所属院系】化学与化学工程系 【课程总学时】75学时 【教学对象】 1、适合化学教育、化工工艺、环境科学专业的本科学生 2、预备知识:高中化学 【教学目的与课程性质、任务】 性质:无机化学与化学分析是化学教育专业、化工工艺专业、环境科学专业的必修专业基础课。 任务:使学生初步掌握一些化学基本理论;牢固掌握元素化学知识,掌握分析化学的基本原理和基础知识;熟练掌握化学基本技能;提高分析和解决问题的能力;培养严谨的科学态度。为学习后续课程,进行化学研究工作打下良好基础。 【教学内容及学时分配】 第一章原子结构(4学时) 1.1 氢原子的波动力学模型 1.2 轨道概念的图形描述 1.3 多电子原子轨道的能级和基态原子核外电子的排布 1.4 周期表与原子结构 1.5 原子参数 第二章化学键与分子结构(6学时) 2.1 化学键的定义 2.2 离子键理论 2.3 路易斯结构式 2.4 价层电子对互斥理论 2.5 价键理论 2.6 分子轨道理论 2.7 金属键理论 2.8 分子间作用力 第三章化学反应速率的表示方法(4学时) 3.1 化学反应速率的表示方法 3.2 影响化学反应速率的因素 第四章化学热力学的初步概念与化学平衡(6学时) 4.1 热化学 4.2 熵和熵变 4.3 自由能 4.4 标准平衡常数
·教学大纲·第五章酸和酸碱反应(2学时) 5.1 布朗斯特酸碱 5.2 路易斯酸碱 第六章氧化还原反应(4学时) 6.1 基本概念 6.2 氧化还原反应方程式的配平 6.3 埃灵罕母图 6.4 电极电势 6.5 电势数据的图示法 6.6 影响氧化还原反应的动力学因素 第七章配位化合物(4学时) 7.1 相关的定义和命名 7.2 化学键理论 7.3 异构现象和立体化学 7.4 配合物的稳定性 第八章酸碱平衡和酸碱滴定法(8学时) 8.1 弱酸、碱水溶液的质子转移平衡 8.2 溶液H3O+的计算 8.3 水解 8.4 缓冲溶液 8.5 酸碱滴定原理 8.6 滴定方式和应用 第九章重量分析法和沉淀滴定法(8学时) 9.1 沉淀-溶解平衡 9.2 重量分析法 9.3 沉淀滴定法 第十章配位滴定法(4学时) 10.1 副反应系数和条件稳定常数 10.2 配位滴定原理 10.3 干扰的消除和滴定方式 第十一章氧化还原滴定法(4学时) 11.1 氧化还原平衡 11.2 滴定曲线和指示剂 11.3 待测组分的预报处理 11.4 重要的氧化还原滴定法 第十二章S区元素(2学时) 12.1 单质 12.2 化合物
无机及分析化学习题无机化学基本知识图文稿
无机及分析化学习题无机化学基本知识 集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
第一章无机化学基本知识 (一)填空题 中,决定原子轨道形状的是______,觉得原 1.在4个量子数n,l,m,m s 子轨道在空间伸展方向的是______。 2.我国化学家提出能及的相对高低与主量子数n和角量子数l的关系是______,其值越大,轨道能量越高。 3.核外电子排布遵循的三个原则是________,________,________。 4.分散系是指____________________的体系。NaCl、碘酒和泥浆都是分散系,他们分别是______、______、______。 5.与溶液溶质的性质无关,仅取决于____________的性质成为稀溶液的依数性,包括________,________,________,________。 6.丁达尔效应能够证明溶胶具有________性质,其动力学性质可以有________实验证明,电泳和电渗实验证明溶胶具有________性质。 7.常压下,海水的沸点________100℃.(填<,>,=) 8.人类不能饮用海水,吃冰激凌不如喝水解渴,以及海生生物不能在淡水中生存等现象都是与溶液的依数性之一________密切相关。 9.在寒冷的冬天施工是,常在混凝土中添加外加剂如CaCl、NaCl防冻,依据的化学原理为________________。 10.溶液产生渗透现象应具备的条件是_______和_______。 11.溶胶具有聚结稳定性的原因是有二,一是__________;二是 __________。 12.胶粒带电的原因有二,一是_______带电;二是_______带电。
无机化学知识点归纳(高教版)
无机化学知识点归纳(高教版) 注:加黑字体为知识点,加下划线为补充内容。第一章:物质及其变化 1 第一节:物质的聚集状态 1 第二节:化学反应中的质量关系和能量关系 2 第二章化学反应速率和化学平衡 3 第二节影响反应速率的因素 3 第三节化学平衡 3 第四节化学平衡的移动4 第五节反应速率与化学平衡的综合利用4 第三章电解质溶液和离子平衡 4 第一节强电解质溶液 4 第二节水的解离和溶液的ph 4 第三节弱酸、弱碱的解离平衡 5 第四节同离子效应和缓冲溶液 5 第五节盐类的水解 5 第六节沉淀-溶解平衡 6 第七节溶度积规则及其应用 6 第四章氧化和还原 6 第一节氧化还原反应的基本概念 6
第二节氧化还原反应与原电池7 第三节电极电势7 第四节电极电势的应用7 第五章原子结构与元素周期律7 第六章分子结构与晶体结构8 第一节共价健理论 8 第三节分子间力与分子晶体8 第四节离子键与离子晶体8 第五节离子极化8 第六节其他类型晶体9 第七章配位化合物 9 第一节配位化合物的基本概念9 第二节配位化合物的结构9 第三节配位化合物在水溶液中的状况9 第四节熬合物10 第八章主族金属元素(一)碱金属和碱土金属10 第一节化学元素的自然资源10 第二节碱金属11 第三节碱土金属11 第一章:物质及其变化 第一节:物质的聚集状态 1、气体具有两个基本特性:扩散性和可压缩性。主要表现在:
⑴气体没有固定的体积和形状。⑵不同的气体能以任意比例相互均匀的混合。⑶气体是最容易被压缩的一种聚集状态。 2、理想气体方程: 为气体摩尔常数,数值为8.314 3、只有在高温低压条件下气体才能近似看成理想气体。 气体混合物 1、当两种或两种以上的气体在同一容器中混合时,每一种气体称为该混合气体的组分气体。 2、混合气体中某组分气体对器壁所施加的压力叫做该组分气体的分压。 3、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。 4、(Dlton)分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。 5、流体 6、固体 第二节:化学反应中的质量关系和能量关系 1、系统是人们将其作为研究对象的那部分物质世界,即被研究的物质和它们所占有的空间。系统的边界可以是实际的界面也可以是人为确定的用来划定研究对象的空间范围。划定范围的目的是便于研究。 2、环境是系统边界之外与之相关的物质世界。 系统与环境之间可能会有物质和能量的传递。按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。系统质量守恒。 ⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物
无机化学和分析化学
武汉大学 2006年攻读硕士学位研究生入学考试试题科目名称:无机化学和分析化学科目代码483 注意:.所有的答题内容必须答在答题纸上,凡答在试题或草稿纸上的一律无效。 无机化学部分(75分) 一、单项选择题(每小题2分,共20分) 1、基态原子具有下列价电子构型的元素第一电离势最大的是() A.2s22p1B.2s22p2C.2s22p3D.2s22p4 2、O, O2, N, N2的第一电离能由小到大排列顺序正确的是() A.O<O2<N<N2B.O2<O<N<N2 C.N<N2<O<O2D.N2<N<O<O2 3、共价型分子AB n的中心原子A采用sp3d杂化轨道成键时,则分子的空 间构型不可能是() A.直线型B.T型C.三角双锥D.三角锥 4、在0.1 mol·dM-3的氨水溶液中加入氯化铵固体,结果是() A.NH3的电离度变小,电离常数变小。 B.NH3的电离度变大,电离常数变大。 C.NH3的电离度变小,电离常数不变。 D.NH3的电离度变大,电离常数不变。 5、对于配合物中心体的配位数,下列说法不正确的是() A.直接与中心体键合的配位体的数目。 B.直接与中心体键合的配位原子的数目。 C.中心体接受配位体的孤对电子的对数。 D.中心体与配位体之间所形成的。配键数。 6、己知难溶电解质溶度积大小的顺序是: K sp(Hg2S)<K sp(AgI)<K sp(Ag2CrO4)<K sp(PbI2)则溶解度最大的是()A.Hg2S B.AgI C.Ag2CrO4D.PbI2 7、在酸性溶液中,与H2O2作用不能生成过氧化物的是() A.Na4TiO4B.(NH4)3VO4C.K2Cr2O7D.KMnO4 8、下列概念正确的是() A.水解能力PH4+>NH4+B.碱性NH2-<PH2- C.水解能力AsO33->SbO33-D.酸性BF3>BCl3 9、加热分解下列物质时,该物质中的各元素氧化数都发生了变化的是() A.LiNO3B.NH4NO3C.Mn(NO3)2D.AgNO3
无机化学知识点归纳
无机化学知识点归纳 一、常见物质的组成和结构 1、常见分子(或物质)的形状及键角 (1)形状:V型:H2O、H2S 直线型:CO2、CS2 、C2H2平面三角型:BF3、SO3 三角锥型:NH3正四面体型:CH4、CCl4、白磷、NH4+ 平面结构:C2H4、C6H6 (2)键角:H2O:104.5°;BF3、C2H4、C6H6、石墨:120°白磷:60° NH3:107°18′CH4、CCl4、NH4+、金刚石:109°28′ CO2、CS2、C2H2:180° 2、常见粒子的饱和结构: ①具有氦结构的粒子(2):H-、He、Li+、Be2+; ②具有氖结构的粒子(2、8):N3-、O2-、F-、Ne、Na+、Mg2+、Al3+; ③具有氩结构的粒子(2、8、8):S2-、Cl-、Ar、K+、Ca2+; ④核外电子总数为10的粒子: 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+; 阴离子:N3-、O2-、F-、OH-、NH2-; 分子:Ne、HF、H2O、NH3、CH4 ⑤核外电子总数为18的粒子: 阳离子:K+、Ca 2+; 阴离子:P3-、S2-、HS-、Cl-; 分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4。 3、常见物质的构型: AB2型的化合物(化合价一般为+2、-1或+4、-2):CO2、NO2、SO2、SiO2、CS2、ClO2、CaC2、MgX2、CaX2、BeCl2、BaX2、KO2等 A2B2型的化合物:H2O2、Na2O2、C2H2等 A2B型的化合物:H2O、H2S、Na2O、Na2S、Li2O等 AB型的化合物:CO、NO、HX、NaX、MgO、CaO、MgS、CaS、SiC等 能形成A2B和A2B2型化合物的元素:H、Na与O,其中属于共价化合物(液体)的是H 和O[H2O和H2O2];属于离子化合物(固体)的是Na和O[Na2O和Na2O2]。 4、常见分子的极性: 常见的非极性分子:CO2、CS2、BF3、CH4、CCl4、、SF6、C2H4、C2H2、C6H6等 常见的极性分子:双原子化合物分子、H2O、H2S、NH3、H2O2、CH3Cl、CH2Cl2、CHCl3等5、一些物质的组成特征: (1)不含金属元素的离子化合物:铵盐 (2)含有金属元素的阴离子:MnO4-、AlO2-、Cr2O72- (3)只含阳离子不含阴离子的物质:金属晶体 二、物质的溶解性规律 1、常见酸、碱、盐的溶解性规律:(限于中学常见范围内,不全面) ①酸:只有硅酸(H2SiO3或原硅酸H4SiO4)难溶,其他均可溶; ②碱:只有NaOH、KOH、Ba(OH)2可溶,Ca(OH)2微溶,其它均难溶。 ③盐:钠盐、钾盐、铵盐、硝酸盐均可溶; 硫酸盐:仅硫酸钡、硫酸铅难溶、硫酸钙、硫酸银微溶,其它均可溶;
大学无机化学第十二章试题及答案
第十三章硼族元素 总体目标: 1、掌握硼单质、氢化物、卤化物与含氧化物的性质、用途与制备方法 2、通过硼及其化合物的结构与性质,掌握缺电子化合物的成键特征 3、掌握铝及其化合物的结构、性质与制备 4、、认识铍与铝的相似性 各节目标: 第一节硼单质及其化合物 1、掌握硼单质的结构、化学性质、用途与制备方法 2、掌握乙硼烷、硼酸(H3BO3)、硼砂与三卤化硼的性质、结构与制备方法 3、通过硼及其化合物的结构与性质,掌握缺电子化合物的成键特点与桥键的形成第二节铝单质及其化合物 1、掌握铝及其化合物的主要性质与AlCl3的结构,了解铝的提取与冶炼 2、认识铍与铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物 第三节镓、铟、铊 了解镓、铟、铊单质及其重要化合物的性质 习题 一、选择题 ⒈下列有关硼、铝性质的叙述,错误的就是( ) A、都就是缺电子原子 B、B(OH)3就是弱酸,Al(OH)3就是两性偏碱性 C、其三卤化物分子都就是平面三角形结构 D、都就是亲氧元素 ⒉在下列a—Al2O3的制备方法中,不妥的就是( ) A、灼烧Al(OH)3 B、灼烧Al(NO3)3 C、高温电解Al2(SO4)3 D、金属铝在氧中燃烧 ⒊下列铝的化合物不能用湿法制得的就是( ) A、Al2(CO3)3 B、Al2(SO4)3 C、AlCl3 D、Al(Ac)3 4、以下矿物中含有铝的就是( ) A、冰晶石 B、孔雀石 C、白云石 D、方铅矿 5、下列化合物属于缺电子化合物的就是( ) (吉林大学《无机化学例题与习题》)
A、BCL3 B、H[BF4] C、B2O3 D、Na[Al(OH)4] 6、在硼的化合物中,硼原子的最高配位数不超过4,这就是因为( ) A 、硼原子半径小B、配位原子半径大 C、硼与配位原子电负性差小 D、硼原子无价层d轨道 7、下列关于BF3的叙述中,正确的就是( ) A、BF3易形成二聚体 B、BF3为离子化合物 C、BF3为路易斯酸 D、BF3常温下为液体 8、下列金属单质中,熔点最低的就是( ) (吉林大学《无机化学例题与习题》) A、Cu B、Zn C、Na D、Ga 9、下列化合物中,熔点最低的就是( ) (吉林大学《无机化学例题与习题》) A、BCl3 B、CCl4 C、SiCl4 D、SnCl4 10、下列物质中水解并能放出H2的就是( ) (吉林大学《无机化学例题与习题》) A、B2H6 B、N2H4 C、NH3 D、PH3 11、下列化合物中不能稳定存在的就是( ) (吉林大学《无机化学例题与习题》) A、SbI3 B、PI3 C、AlI3 D、TiI3 12 、下列含氧酸中属于一元酸的就是( ) (吉林大学《无机化学例题与习题》) A 、H3AsO3B、H3BO3 C、H3PO3 D 、H2CO3 13、下列物质中,酸性最弱的就是( ) (吉林大学《无机化学例题与习题》) A、、H3PO3 B 、H2S C、H3BO3 D、H5IO6 14、下列金属中,与硝酸反应得到产物的氧化数最低就是( ) A 、In B、Tl C、Fe D 、Bi 15、下列金属中,氧化能力最强的就是( ) (吉林大学《无机化学例题与习题》) A、NO2 B、SO3 C 、B2O3 D、Tl2O3 16、下列分子中,偶极矩最小的就是( ) (吉林大学《无机化学例题与习题》) A 、B2H6 B、SO2C、NCl3 D、SF4 17、下列化合物中,氧化性与惰性电子对效应有关的就是( ) A 、I2O5 B、Tl2O3 C 、Mn2O7 D、CrO3
无机化学与化学分析答案8
第八章 酸碱平衡和酸碱滴定 8.1 (a )θb K (F -) = θw K /θa K (HF) = 10-14/6.8×10-4 = 1.5×10-11 (b )θa K (NH 4+) =θw K /θb K (NH 3) = 10-14/ 1.8×10-5 = 5.6×10-10 8.2根据θa K ·θb K = θw K θb K (HPO 42-) = θw K /θa K (H 2PO 4-) = 10-14/ 6.2×10-8 = 1.6×10-7 >> 4.2×10-13 即θb K (HPO 42-) >> θa K (HPO 42-),也就是说,HPO 42-的水解作用远大于其自身的离解作用,所以Na 2HPO 4水溶液呈碱性。 8.3 (a) 水合是H 2O 分子以其偶极的一端在离子周围取向,H 2O 分子作为整体参与反应;而 水解是H 2O 分子被撕裂产生OH ﹣或H +,再与离子结合。 (b) 缓冲容量是指维持系统pH 大体恒定的条件下,缓冲溶液能够中和外来酸或外来碱的量;缓冲范围是指能够起缓冲作用的pH 区间。 (c) 滴定终点是指示剂的实际变色点;而化学计量点指滴定剂与被滴定物之间按照化学计量关系完全反应时所达到的点。 8.4此缓冲溶液NaC 2H 3O 2的浓度为: c (NaC 2H 3O 2)/ mol·dm -3 = 5.00.822.25÷ = 0.622 根据公式:pH = θa p K ﹣lg ()()33dm mol /dm mol /--??共轭碱酸c c 得 pH =﹣lg(1.8×10-5)﹣lg ()()3 2323232/O H NaC /O H HC --??dm mol c dm mol c = ﹣lg(1.8×10-5)﹣lg 622.0550.0 = 4.80 8.5根据公式:pH = θa p K ﹣lg ()()33dm mol /dm mol /--??共轭碱酸c c 得 pH = 5.09 =﹣lg(1.8×10-5 )﹣lg ()()32323232dm mol /O H NaC dm mol /O H HC --??c c 得: c (NaC 2H 3O 2)/ mol·dm -3 = 0.550 m(NaC 2H 3O 2)/g = c(NaC 2H 3O 2)/ mol·dm -3×V/dm 3×M(NaC 2H 3O 2)/g·mol - = 0.550×0.300×82.0 = 14.0 8.6 (a) 当加入0.0060mol HCl 时,溶液中HC 2H 3O 2 和NaC 2H 3O 2的浓度分别为: c (HC 2H 3O 2)/ mol·dm -3 = 3-330.300dm mol 006.0dm mol 0.250dm 300.0+?? = 0.270
无机化学_知识点总结
无机化学(上) 知识点总结 第一章 物质存在的状态 一、气体 1、气体分子运动论的基本理论 ①气体由分子组成,分子之间的距离>>分子直径; ②气体分子处于永恒无规则运动状态; ③气体分子之间相互作用可忽略,除相互碰撞时; ④气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。碰撞时总动能保持不变,没有能量损失。 ⑤分子的平均动能与热力学温度成正比。 2、理想气体状态方程 ①假定前提:a 、分子不占体积;b 、分子间作用力忽略 ②表达式:pV=nRT ;R ≈8.314kPa 2L 2mol 1-2K 1- ③适用条件:温度较高、压力较低使得稀薄气体 ④具体应用:a 、已知三个量,可求第四个; b 、测量气体的分子量:pV=M W RT (n=M W ) c 、已知气体的状态求其密度ρ:pV=M W RT →p=MV WRT →ρMV RT =p 3、混合气体的分压定律 ①混合气体的四个概念 a 、分压:相同温度下,某组分气体与混合气体具有相同体积时的压力; b 、分体积:相同温度下,某组分气体与混合气体具有相同压力时的体积 c 、体积分数:φ= 2 1 v v d 、摩尔分数:xi= 总 n n i ②混合气体的分压定律 a 、定律:混合气体总压力等于组分气体压力之和; 某组分气体压力的大小和它在混合气体中体积分数或摩尔数成正比 b 、适用范围:理想气体及可以看作理想气体的实际气体 c 、应用:已知分压求总压或由总压和体积分数或摩尔分数求分压、 4、气体扩散定律 ①定律:T 、p 相同时,各种不同气体的扩散速率与气体密度的平方根成反比: 2 1 u u =21p p =2 1 M M (p 表示密度) ②用途:a 、测定气体的相对分子质量;b 、同位素分离 二、液体
无机化学与化学分析的学习指导4
第 4 章 化学反应速率与反应动力学的初步概念 一、 基本要求 1. 初步了解化学反应速率、速率方程、碰撞理论、过渡状态理论和活化能的概念; 2.理解并会用浓度、温度、催化剂诸因素解释其对化学反应速率的影响; 3.初步掌握阿仑尼乌斯公式的应用,会用其求算指定反应活化能及某温度下的反应速率; 4.理解反应分子数和反应级数的概念,会进行有关基元反应的简单计算; 5.初步掌握零级、一级和二级反应的特征。 二、 要点 1.反应速率 单位时间内反应物或生成物浓度改变量的正值。又有平均速率和瞬时速率之分。 2.碰撞理论 1918年Lewis 运用气体分子运动论的成果提出的一种反应速率理论。它假设: ① 原子、分子或离子只有相互碰撞才能发生反应,即碰撞是反应的先决条件; ② 只有少部分碰撞能导致化学反应,大多数反应物微粒碰撞后发生反弹而与 化学反应无缘。 3.有效碰撞 能导致化学反应发生的碰撞,反之则为无效碰撞。 4.活化能 对于基元反应,活化分子的平均能量与反应物分子平均能量之差,常用E a 表示;对于复杂反应,E a 的直接物理意义就会含糊了,因此,由实验求得的E a 也叫作“表现活化能”。 5.过渡状态理论 20世纪30年代,在量子力学和统计力学发展基础上,由Eyring 等人提出的另一种反应速率理论。它认为反应物并不只是通过简单碰撞就能变成生成物,而是要经过一个中间过渡状态,即反应物分子首先形成活化络合物,通常它是一种短暂的高能态的“过渡区物种”,既能与原来的反应物建立热力学的平衡,又能进一步解离变为产物。 6.基元反应 亦称为简单反应或元反应。 指反应物分子在有效碰撞中一步直接转化为产物的反应。 7.复杂反应 亦称非基元反应。即由两个或多个基元反应步骤完成的反应。 8.速率方程 化学反应速率υ同反应物、产物浓度c 的函数关系式 υ = f (c A 、c B …) 经验表明,不少反应其速率方程具有 g B f A υc kc ?=
大学无机化学知识点总结
大学无机化学知识点总结 无机化学,有机化学,物理化学,分析化学无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。 有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。 物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。 分析化学化学分析、仪器和新技术分析。包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。 无机化学 第一章:气体 第一节:理想气态方程
1、气体具有两个基本特性:扩散性和可压缩性。主要表现在:⑴气体没有固定的体积和形状。⑵不同的气体能以任意比例相互均匀的混合。⑶气体是最容易被压缩的一种聚集状态。 2、理想气体方程:为气体摩尔常数,数值为= 8、314 3、只有在高温低压条件下气体才能近似看成理想气体。 第二节:气体混合物 1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。 2、Dlton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。 3、(0℃=273、15K STP下压强为101、325KPa =760mmHg =76cmHg) 第二章:热化学 第一节:热力学术语和基本概念 1、系统与环境之间可能会有物质和能量的传递。按传递情况不同,将系统分为:⑴封闭系统:系统与环境之间只有能量传递没有物质传递。系统质量守恒。 ⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。 ⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
大学无机化学第十二章试题及答案讲课稿
大学无机化学第十二章试题及答案
第十三章硼族元素 总体目标: 1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法 2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征 3.掌握铝及其化合物的结构、性质和制备 4. .认识铍和铝的相似性 各节目标: 第一节硼单质及其化合物 1.掌握硼单质的结构、化学性质、用途和制备方法 2.掌握乙硼烷、硼酸(H3BO3)、硼砂和三卤化硼的性质、结构和制备方法 3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成第二节铝单质及其化合物 1.掌握铝及其化合物的主要性质和AlCl3的结构,了解铝的提取和冶炼 2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物 第三节镓、铟、铊 了解镓、铟、铊单质及其重要化合物的性质 习题 一、选择题 ⒈下列有关硼、铝性质的叙述,错误的是( ) A.都是缺电子原子 B.B(OH)3是弱酸,Al(OH)3是两性偏碱性 C.其三卤化物分子都是平面三角形结构 D.都是亲氧元素 ⒉在下列a—Al2O3的制备方法中,不妥的是( ) A.灼烧Al(OH)3 B.灼烧Al(NO3)3 C.高温电解Al2(SO4)3 D.金属铝在氧中燃烧
⒊下列铝的化合物不能用湿法制得的是( ) A. Al2(CO3)3 B.Al2(SO4)3 C.AlCl3 D.Al(Ac)3 4. 以下矿物中含有铝的是( ) A.冰晶石 B.孔雀石 C.白云石 D.方铅矿 5. 下列化合物属于缺电子化合物的是 ( ) (吉林大学《无机化学例题与习题》) A.BCL3 B. H[BF4] C. B2O3 D. Na[Al(OH)4] 6. 在硼的化合物中,硼原子的最高配位数不超过4,这是因为( ) A .硼原子半径小 B.配位原子半径大 C.硼与配位原子电负性差小 D. 硼原子无价层d轨道 7. 下列关于BF3的叙述中,正确的是( ) A.BF3易形成二聚体 B.BF3为离子化合物 C. BF3为路易斯酸 D. BF3常温下为液体 8. 下列金属单质中,熔点最低的是( ) (吉林大学《无机化学例题与习题》) A. Cu B. Zn C. Na D. Ga 9. 下列化合物中,熔点最低的是( ) (吉林大学《无机化学例题与习题》) A. BCl3 B. CCl4 C. SiCl4 D. SnCl4 10. 下列物质中水解并能放出H2的是 ( ) (吉林大学《无机化学例题与习题》) A. B2H6 B. N2H4 C. NH3 D. PH3 11. 下列化合物中不能稳定存在的是 ( ) (吉林大学《无机化学例题与习题》) A. SbI3 B. PI3 C. AlI3 D. TiI3 12 . 下列含氧酸中属于一元酸的是 ( ) (吉林大学《无机化学例题与习题》) A .H3AsO3 B.H3BO3 C.H3PO3 D .H2CO3 13.下列物质中,酸性最弱的是( ) (吉林大学《无机化学例题与习题》) A.. H3PO3 B . H2S C. H3BO3 D. H5IO6
无机化学知识点总结归纳共10页
无机化学知识点总结 1、知道典型的溶解性特征 ①加入过量硝酸从溶液中析出的白色沉淀:AgCl,原来溶液是Ag(NH3)2Cl;后者是硅酸沉淀,原来的溶液 是可溶解的硅酸盐溶液。生成淡黄的沉淀,原来的溶液中可能含有S2-,或者是S2O32- ②加入过量的硝酸不能观察到沉淀溶解的有AgCl,BaSO4;BaSO3由于转化成为BaSO4而不能观察到沉淀的溶 解。AgBr,AgI,也不溶解,但是沉淀的颜色是黄色。 ③能够和盐反应生成强酸和沉淀的极有可能是H2S气体和铅、银、铜、汞的盐溶液反应。: ④沉淀先生成后溶解的:CO2和Ca(OH)2;Al3+和氢氧化钠;AlO2-和盐酸;,氨水和硝酸银。 2、操作不同现象不同的反应: Na2CO3和盐酸;AlCl3和NaOH,NaAlO2和盐酸;AgNO3和氨水;FeCl3和Na2S;H3PO4 和Ca(OH)2反应。 3、先沉淀后澄清的反应: AlCl3溶液中加入NaOH溶液,生成沉淀,继续滴加沉淀溶解: AgNO3溶液中滴加稀氨水,先沉淀后澄清: NaAlO2溶液中滴加盐酸,也是先沉淀后澄清: 澄清石灰水通入二氧化碳,先沉淀后澄清:; 次氯酸钙溶液中通入二氧化碳,先沉淀后澄清:; KAl(SO4)2与NaOH溶液:; 4、通入二氧化碳气体最终能生成沉淀的物质:苯酚钠溶液、硅酸钠溶液、偏铝酸钠溶液(这三种都可以与 少量硝酸反应产生沉淀)、饱和碳酸钠溶液。 苯酚钠溶液:; 硅酸钠溶液:; 饱和碳酸钠溶液:; 偏铝酸钠溶液:; 5、能生成两种气体的反应: HNO3的分解:; Mg与NH4Cl溶液的反应:; 电解饱和食盐水:; C与浓HNO3加热时反应:;
无机化学和分析化学习题
《无机与分析化学》综合练习题及答案 (本综合练习题及答案与中国农业出版社出版,张凤、王耀勇、余德润主编的 《无机与分析化学》教材配套使用) 《无机与分析化学》综合练习题 一、选择题 1.与难挥发非电解质稀溶液的蒸气压降低、沸点升高、凝固点下降有关的因素为()。 A. 溶质的本性 B. 溶液中溶质的粒子数 C. 剂的体积 D. 溶液的体积 2. 高原地区水的沸点一般( )。 A. 等于100℃ B. 高于100℃ C. 低于100℃ D. 无法确定 3. 在常压下,海水的沸点一般( )。 A. 等于100℃ B. 高于100℃ C. 低于100℃ D. 无法确定 4. 在常压下,海水的凝固点一般( )。 A. 等于0℃ B. 高于0℃ C. 低于0℃ D. 无法确定 5. 溶液的凝固点总是( )纯溶剂的凝固点。 A. 等于 B.高于 C.低于 D. 无法确定 6. 静脉注射时,注射液应与血液是( )。 A. 等渗溶液 B.高渗溶液 C. 低渗溶液 D. 无法确定 7. 常量分析的称量一般在( )。 A. 0.1g以上 B. 10g以上 C. 0.01~0.001g D. 1~10g 8. 确定样品中各组分的相对含量属于()。 A. 定性分析 B. 定量分析 C. 结构分析 D. 滴定分析 9.对微量成分进行分析一般采用()。 A. 滴定分析 B. 重量分析 C. 气体分析 D. 仪器分析 10.下列叙述错误的是()。 A. 方法误差属于系统误差 B. 系统误差呈正态分布 C. 系统误差具有重现性 D. 系统误差包括操作误差 11.下列()种情况可引起系统误差。 A. 天平零点突然有变动 B. 看错滴定管读数 C. 加错试剂 D. 使用的蒸馏水不纯 12. 减少偶然误差的方法为()。
大学无机化学知识点总结.
无机化学,有机化学,物理化学,分析化学 无机化学 元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。 有机化学 普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。 物理化学 结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。 分析化学 化学分析、仪器和新技术分析。包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学 第一章:气体 第一节:理想气态方程 1、气体具有两个基本特性:扩散性和可压缩性。主要表现在: ⑴气体没有固定的体积和形状。⑵不同的气体能以任意比例相互均匀的混合。⑶气体是最容易被压缩的一种聚集状态。 2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--??K mol J 3、只有在高温低压条件下气体才能近似看成理想气体。 第二节:气体混合物 1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。 2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。 3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg) 第二章:热化学 第一节:热力学术语和基本概念 1、 系统与环境之间可能会有物质和能量的传递。按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。系统质量守恒。 ⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。 ⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。 2、 状态是系统中所有宏观性质的综合表现。描述系统状态的物理量称为状态函数。状态函 数的变化量只与始终态有关,与系统状态的变化途径无关。 3、 系统中物理性质和化学性质完全相同而与其他部分有明确界面分隔开来的任何均匀部 分叫做相。相可以由纯物质或均匀混合物组成,可以是气、液、固等不同的聚集状态。 4、 化学计量数()ν对于反应物为负,对于生成物为正。 5、反应进度νξ0 )·(n n sai k e t -==化学计量数 反应前反应后-,单位:mol 第二节:热力学第一定律 0、 系统与环境之间由于温度差而引起的能量传递称为热。热能自动的由高温物体传向低温 物体。系统的热能变化量用Q 表示。若环境向系统传递能量,系统吸热,则Q>0;若系统向环境放热,则Q<0。 1、 系统与环境之间除热以外其他的能量传递形式,称为功,用W 表示。环境对系统做功, W>O ;系统对环境做功,W<0。 2、 体积功:由于系统体积变化而与环境交换的功称为体积功。 非体积功:体积功以外的所有其他形式的功称为非体积功。 3、 热力学能:在不考虑系统整体动能和势能的情况下,系统内所有微观粒子的全部能量之 和称为热力学能,又叫内能。 4、 气体的标准状态—纯理想气体的标准状态是指其处于标准压力θ P 下的状态,混合气体 中某组分气体的标准状态是该组分气体的分压为θP 且单独存在时的状态。 液体(固体)的标准状态—纯液体(或固体)的标准状态时指温度为T ,压力为θP 时的状态。
