设备URS模版
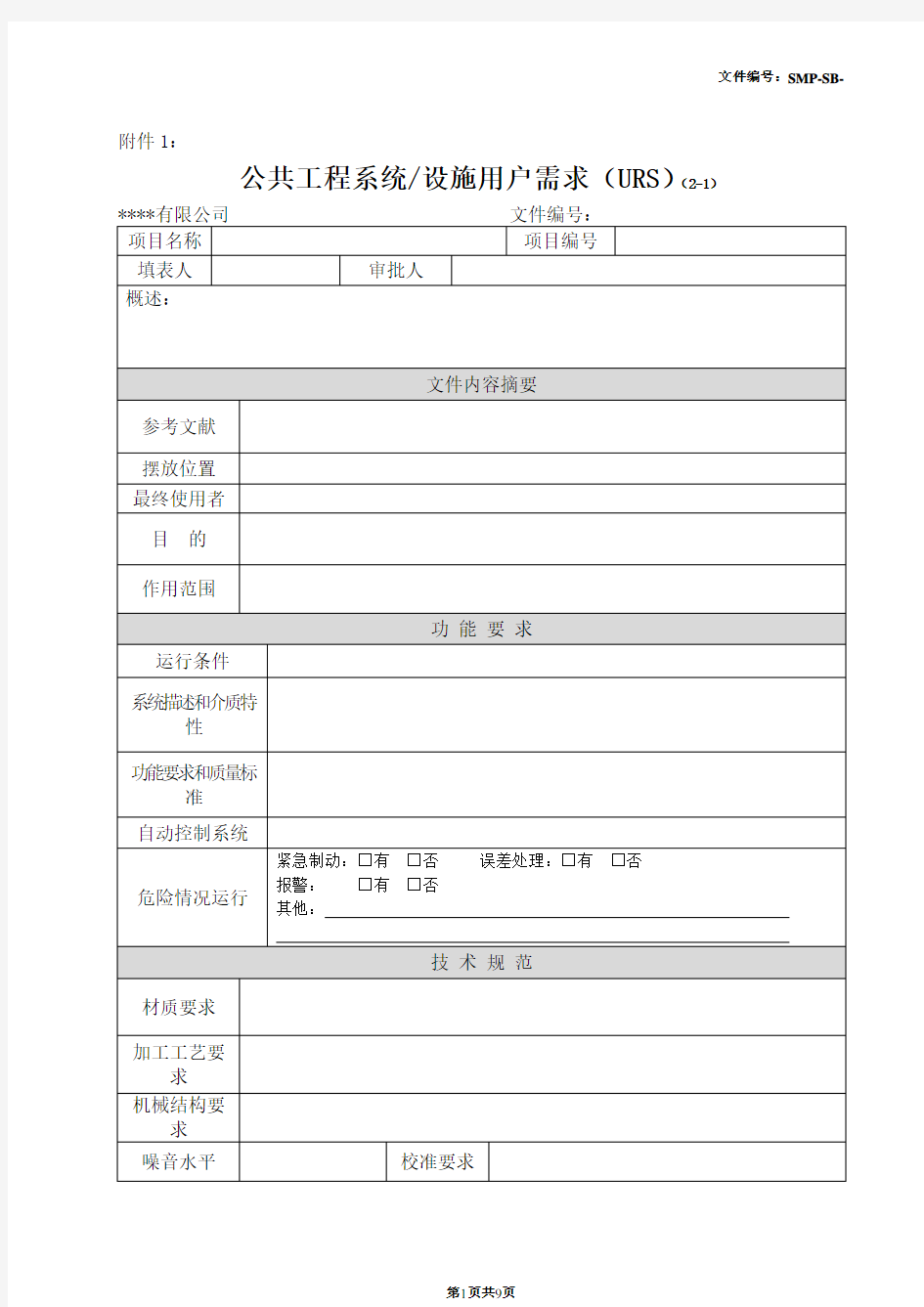

附件1:
公共工程系统/设施用户需求(URS)(2-1)
公共工程系统/设施用户需求(URS)(2-2)
工艺设备用户需求(URS)(3-1)
工艺设备用户需求(URS)(3-2)
工艺设备用户需求(URS)(3-3)
填表时间:年月日
附件3:
实验仪器用户需求(URS)(2-1)
附件3:
实验仪器用户需求(URS)(2-2)
附件4:
单一设备和仪器用户需求(URS)
附件2:
审核批准表
用户需求标准(URS)管理
用户需求标准(URS)管理
目录 1.目的 (3) 2.范围 (3) 3.职责 (3) 4.参考 (3) 5.定义 (3) 6.编写原则 (4) 7.各类别用户需求(URS)的编写 (5) 7.1公共工程系统/设施用户需求(URS)的编写(见附件1) (5) 7.2工艺设备URS的编写(见附件2) (8) 7.3实验仪器用户需求(URS)的编写(见附件3) (12) 7.4单一设备和仪器用户需求(URS)(见附件4) (15) 8.文件管理 (15) 8.1文件版本规划 (15) 8.2文件起草 (16) 8.3文件会审 (16) 8.4文件批准 (17) 8.5文件变更 (17) 8.6文件关闭 (17) 9.附件 (17) 9.1公共系统/设施用户需求(URS)编写模板(VA-3-02(A01)) (17) 9.2工艺设备用户需求(URS)编写模板(VA-3-02(A02)) (17) 9.3实验仪器用户需求(URS)编写模板(VA-3-02(A03)) (17)
1.目的 通过制定《用户需求(URS)编写及管理程序》,提出《用户需求 (URS)》的编写原则、编写要求和主要内容,规范URS文件的管 理规定,达到公司文件管理要求。 2.范围 2.1 《用户需求(URS)编写及管理程序》应包括URS用途、编写原则、编写规定和文件模版。 2.2 《用户需求(URS)编写及管理程序》适用于公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写。 3.职责 3.1 设施、设施支持系统、公共工程系统的URS由工程部负责编写。 3.2 生产工艺设备的URS由负责该项工作分属的生产部、技术部专业经理和直接操作人员编写。 3.3 实验室检测仪器的URS由负责该项工作分属的生产部、技术部和质量部专业经理和直接操作人员编写。 4.参考 4.1 《药品生产质量管理规范》(2010年修订版) 4.2 《药品生产质量管理规范指南》(2001) 4.3 美国cGMP标准 4.4 欧盟GMP 4.5 公司内相关管理文件 5.定义 5.1 用户需求(URS):为达到项目目标,根据项目技术包中的设备清单及要求和
药品设备urs设计模版
User Requirements Specification (URS) 用户需求标准 xxx(英文名称) xxx(中文名称) 审核及批准 REVIEW AND APPROVAL
目录
1.0目的PURPOSE (3) 2.0范围SCOPE (3) 3.0法规要求及相关技术规范Regulatory and statutory Compliance (3) 4.0介绍Introduction (3) 5.0用户及系统要求User / System requirement specification (3) 6.0术语表Glossary (3) 7.0文件变更控制Version Change History (3)
1.0目的PURPOSE 1.1该文件的目的是定义xxx的用户需求标准。该URS在移交给供应商之后,将意味着所有指定的要求被涵盖在供应商的供应范围之内。 2.0范围SCOPE 2.1概述:阐述该设备或系统的背景、用途等 2.2本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的要求和期望。主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。 2.3本URS表述的系统实际可能无法满足要求,某些额外的功能或特性在本URS中表述的也不尽详细,期望厂家根据实际形成更为详细的功能需求规范(FRS)并作为该设备的关键控制要求。当然,厂家对本URS所规定的各项内容若需改动,均需以书面形式提出并经天津天士力之骄药业有限公司同意,否则应按本URS定义的内容实施,同时本URS将作为设备接收确认的依据之一和设备采购合同的附件之一。 3.0法规要求及相关技术规范Regulatory and statutory Compliance 3.1--cGMP 法规,例如 该设备用于药品的包装生产,因此必须符合cGMP的要求,主要包括: 3.1.1药品生产质量管理规范(2010年修订); 3.1.2药品GMP指南(2011版)--无菌药品; 3.1.3参考GAMP5 I.S.P.E. Good Automated Manufacturing Practice Guidance Document, version 5 3.1.4参考Guidance for Industry Sterile Drug Products, Produced by Aseptic Processing, Current Good Manufacturing Practice. US FDA 3.2行业标准,例如 3.2.1 GBZ1-2010《工业企业设计卫生标准》; 3.2.2符合中华人民共和国制药机械行业标准; 3.3国家标准,例如
设备URS书写模板
URS 用户需求及 DQ 确认 需求种类:□设备□设施□仪器□其它 配置名称:搪玻璃反应釜(17B-F09) 需求部门:208车间填表人:何美君申请理由:满足12005-Ⅲ聚合反应工艺需求。 项目介绍项目描述: 满足12005-III经过聚合反应得到12005浓缩液工艺需求做出相应技改项目。 工艺过程(或系统)描述: (1)向反应釜(17B-F09)加入全批12005-Ⅲ(3090)和5×12005-Ⅲ折纯重量的纯化水(2005),开启搅拌,控制温度10~25℃。加入1.06×12005-Ⅲ折纯重量六水合三氯化铁(2163),控制温度10~25℃搅拌溶清。 (2)控制反应釜(17B-F09)温度23~35℃,缓慢加入10%碳酸钠水溶液调pH=2.1~2.4,滴加结束,搅拌1小时,复测pH,要求pH=2.1~2.4,若不合格则继续缓慢加入10%碳酸钠水溶液直至复测合格。控制反应釜(17B-F09)温度23~35℃,缓慢加入约1.28×12005-Ⅲ折纯重量的10%氢氧化钠水溶液调pH=11.8~12.2,滴加结束,搅拌1小时,复测要求pH=11.8~12.2,若不合格则继续调pH直至复核合格。 (3)反应釜(17B-F09)升温至98~103℃,保温反应8小时,取样HPLC检测,要求糖酐铁 MP=135000~195000(中间控制6:TMP-QA-4159)。 (4)反应釜(17B-F09)降温至25~35℃,用约70kg,3%盐酸调pH=5.5~6.0,搅拌30分钟,复测pH,若不合格则继续加入3%盐酸调pH。 (5)将反应釜(17B-F09)的物料过超滤膜D(17B-Q07),温度30~50℃,压力0.3~1.2MPa,透析液收集到反应釜(17B-F07),透析出8.3×12005-Ⅲ折纯重量的透析液时,用3×8.3×12005-Ⅲ折纯重量的纯化水洗涤浓缩液,当洗涤开始时浓缩液取样检测氯离子残留,要求糖酐铁折纯量至30%浓度后氯离子残留=0.42~0.54%(中间控制7:TMP-QA-4161)。超滤结束后透析液收集入桶,转移至环保处理。 (6)向反应釜(17B-F09)加入0.03×12005-Ⅲ折纯重量的12005-03(2167),控温25~35℃,缓慢加入约0.22×12005-Ⅲ折纯重量的10%氢氧化钠溶液调pH=6~8,搅拌10分钟,复测pH, 若不合格则继续调pH直至复测合格。 (7)控制反应釜(17B-F09)温度80~90℃,保温反应2小时,保温结束后降温至25~35℃。缓慢加入约13kg,3%盐酸溶液调pH=5.5~6.0,搅拌30分钟,复测pH,若不合格则继续加入3%盐酸溶液调pH。
生物发酵系统与设备的URSWord版
生物发酵系统与设备的URS 摘要:从GMP要求和生物培养工艺的要求两个方面出发,阐述了生物发酵系统与设备的URS,从而引申出URS编制要点,供生物发酵工程项目的技术同行参考。关键词:生物发酵;系统设备;URS(用户需求标准) 随着我国生物医药技术的蓬勃发展,生物发酵系统(也称为生物培养)项目越来越多,无论是工业化大发酵,如抗生素原料药的发酵、氨基酸和有机酸(柠檬酸,乳酸)的发酵、酶制剂、酵母或淀粉糖的发酵,还是各种生物疫苗、动植物细胞的发酵等。品种众多,生产规模大小也不一,大到几百立方米容积,小到几千升容积的发酵罐,在项目的实施过程中都要系统或设备的需求标准的建立。对URS而言,生物发酵系统设备的URS编写就越显其重要性。因此,如何切合生产实际、结合发酵的品种和培养工艺的要求,编写出既合理又实用的URS是生物发酵系统项目能够顺利实施的第一步,这也是生物发酵项目的招投标、设备制造、工程系统安装调试的基本依据条件。 1 生物发酵系统设备URS的范围生物发酵系统设备的URS文件可以分两个部分,即生物发酵主系统设备和与之配套的辅助系统设备(亦称发酵支持系统)组成。其中,生物发酵主系统由菌种保存、解冻复活、移种、生物培养器(发酵罐)及其支持控制系统、培养基的配制与灭菌以及输送系统组成;生物发酵的辅助系统是由与之相关联的工艺用水系统(纯 气体等)、固液分离系统(如离心分离、膜过滤、板框过滤等)、发化用水及注射用水)、无菌压缩气体系统(空气,氮气,CO 2 酵液的收集系统、发酵液的贮存与冷藏等组成。 2生物发酵主系统设备URS的编制依据 2.1发酵流程生物发酵的过程是一组涉及多相、多组分、非线性的生物化学反应,也是一组群体性的生物生长过程,是人们把预先选定的微生物或动植物细胞在一组密闭的系统中按其生长规律与生长发育条件的代谢过程,常见的流程见图1 。
URS模板(纯化水)
纯化水系统用户需求标准 (参考模板) 编号: 生产部门:生产x部 年月日
用户需求标准
说明:上表中起草部门、审核部门、批准部门、分发范围、引用文件可根据实际需要填写。
目录 1.制定用户需求规格的原因1 2.水处理工艺描述1 2.1.现有的系统1 2.2.欲购置的系统1 3.GXP特性:2 4.关键工艺参数2 5.技术要求3 6.公用系统需求5 7.软件需求5 8.仪表需求5 9.安全特性6 10.实施、跟进和通过6 10.1.项目实行阶段6 10.2.咨询阶段文件6 10.3.供应商质量保证计划(QAP)6 10.4.研究文件6 10.5.设备文件6 10.6.时间表6 10.7.运输和处理6 10.8.测试6 11.文件6 12.维护7 纯化水系统的设计和执行必须便于维护的进行7 13.培训7 标准培训7 14.附录7
1.制定用户需求规格的原因 制定本文件的原因是: 【请在下列方框中打√(单选或者多选)】 新建或者改建 购置公用系统 购置生产设备 定制设备 预定或者用户配置的电脑系统 其他 其他原因描述: 2.水处理工艺描述 2.1.现有的系统 现有的水系统包括以下内容: 注:现有水处理系统,应从工艺流程、设备装置、设施现状以及关键参数等方面进行详细的描述。 2.2.欲购置的系统 欲购置的系统包括以下内容: 例:氯化处理-源水储罐-石英砂过滤泵-石英砂过滤器-去氯-软化器-超滤储罐-超滤泵-超滤快速冲洗泵-超滤模块-超滤后冲洗泵-Anti scaling dosing system-PH调节
系统-纯化水储罐-纯化水循环系统-UV-臭氧发生器(消毒用) 其中: ●超滤系统描述: ●臭氧发生器:用于纯化水循环系统的消毒。 ●UV:UV系统用于臭氧消毒后去除水中所含臭氧。 注:欲购置的水处理系统,应从工艺流程、设备装置、关键参数、关键设备以及更新、改进或提高内容等方面进行详细的描述。 3.GXP特性: 【描述说明】:根据法律、法规以及相关管理规范的要求,列出满足系统正常运转要求的内容、标准和相关条件。 4.关键工艺参数 【描述说明】:对该系统工艺过程各阶段水质的技术要求和标准参数进行详细描述。 4.1.源水水质
设备URS模板
机用户需求标准 你的签名表明你已清楚了解本文件及附件内容,充分理解并认可本文件的所有条款。 任何对本文件及其附件的目的、内容或标准进行的改变或修正都必须起到改善的作用,并详细记录本文件的修订及变更历史,并且在执行以前必须取得批准。
目录 1.目的 (4) 2.范围 (4) 3.术语及定义 (4) 3.1GMP:药品生产质量管理规范 (4) 3.2URS:用户需求说明 (4) 3.3FAT:工厂验收测试 (4) 3.4SAT:现场验收测试 (4) 3.5DQ:设计确认 (4) 3.6IQ:安装确认 (4) 3.7OQ:运行确认 (4) 3.8PQ:性能确认 (4) 3.9GAMP:良好自动化生产规范 (4) 3.10PLC:程序控制器 (4) 4.职责 (4) 4.1需求方职责 (5) 4.2供应商职责 (5) 5.项目概述 (5) 5.1项目简介 (5) 5.2主要用途 (5) 5.3工艺流程 (5) 5.4主要生产产品 (5) 6.供货范围(主要设备及数量) (5) 7.法规与标准 (5) 7.1药品法规要求 (5) 7.2国家标准要求 (6) 7.3行业标准要求 (6) 7.4公司管理制度要求 (6)
8.用户需求标准 (6) 1.1生产/运动能力 (6) 1.2性能/系统要求 (7) 1.3GMP要求 (8) 1.4EHS要求 (9) 1.5控制系统要求 (9) 1.6安全/断电及恢复 (9) 1.7清洁要求 (10) 8.1所需文件 (11) 8.2转运要求 (11) 8.3安装/验收要求 (12) 8.4培训要求 (13) 8.5售后服务 (13) 8.6对供应商要求 (13) 8.7其它 (14) 9.附件 (14) 10.客户回馈表 (15)
URS文件模板
用户需求说明文件 文件名称文件编码XXXXX用户需求说明文件XXXXXXXXXXX XXXXXXXXXX公司 XXX年
目录 1.文件审批 (3) 2目的 (4) 3范围 (4) 4法规和国家标准 (4) 法规 (4) 行业标准 (4) 国家标准 (5) 5工艺描述及产品介绍 (5) 5.1工艺/流程描述 (5) 5.2产品介绍 (5) 6.用户及系统要求 (5) 6.1.URS要求 (6) 6.1.1.URS01:设备整体要求 (6) 6.1.2.URS02:具体技术要求 (6) 6.1.3.URS03:安全及环保要求 (7) 6.1.4.URS04:文件资料要求 (8) 6.1.5.URS05:服务与维修要求 (8) 6.1.6.供应商对项目要求的确认 (9) 7.缩略词附件 (10) 8.文件修订变更历史 (10) 9.附件 (10)
1.文件审批 起草 起草部门签名日期 工程设备部年月日 审核 审核部门签名日期 质量管理部年月日 生产技术部年月日 设备总监年月日 生产总监年月日批准 批准人签名日期质量受权人年月日
2目的 本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的期望。主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。在本URS中用户仅提出基本的技术要求和设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。投标方应在满足本URS的前提下提供卖方能够达到的更高标准和功能的高质量设备及其相关服务。卖方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。如遇与卖方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。 3范围 本用户需求书所列技术要求适用于新项目颗粒剂车间沸腾搅拌干燥机生产线设备的采购。新的设备在设计、制造技术及性能上达到国内先进水平,符合中国新版GMP要求。 4法规和国家标准 法规 新建的沸腾搅拌干燥机生产线用于颗粒剂车间前工序制粒产品的沸腾搅拌干燥生产。因此必须符合要求,主要包括: ?中国GMP(2010年修订)及其附录 ?中国药品生产验证指南(2003版) ?GEP良好工程管理规范 ?《中国药典》2010年版 行业标准 ?GBZ 1-2010 工业企业设计卫生标准 ?GB20021-2004中华人民共和国制药机械行业标准 ?JB/T20045-2005沸腾干燥机标准
生产设备URS文件模板
文件审定起草人审核人批准人 部门品管部品管部品管部 签名 日期年月日年月日年月日 颁发部门品管部生效日期年月日 分发部门机动技安部、生产部、品管部 目录 1.文件审批 (2) 2目的 (3) 3范围 (3) 4法规和国家标准 (3) 法规 (3) 行业标准 (3) 国家标准 (3) 5工艺描述及产品介绍 (3) 5.1工艺/流程描述 (3) 5.2产品介绍 (4) 6. 用户及系统要求 (4) 6.1. URS要求 (4) 6.1.1. URS01:设备整体要求 (4) 6.1.2. URS02:具体技术要求 (4) 6.1.3. URS03:安全及环保要求 (6) 6.1.4. URS04:文件资料要求 (6) 6.1.5. URS05:服务与维修要求 (7) 6.1.6. 供应商对项目要求的确认 (7) 7. 缩略词附件 (8) 8. 文件修订变更历史 (8) 9. 附件 (8)
1.文件审批 起草 起草部门签名日期 机动技安部年月日 审核 审核部门签名日期 品管部年月日 生产部年月日 批准 批准人签名日期 质量受权人年月日
2目的 本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的期望。主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。设备生产商(供应商)应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。在本URS中用户仅提出基本的技术要求和设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。投标方应在满足本URS的前提下提供卖方能够达到的更高标准和功能的高质量设备及其相关服务。卖方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。如遇与卖方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。 3范围 本用户需求书所列技术要求适用于设备的采购。新的设备在设计、制造技术及性能上达到国内先进水平,符合中国新版GMP要求。 4法规和国家标准 法规 液体灌装机用于乳酸钠溶液、乳酸的灌装,必须符合的要求,主要包括: GMP(2010年修订)及其附录 中国药品生产验证指南(2003版) 产品生产工艺规程 《中国药典》2015年版二部 行业标准 GBZ 1-2010 工业企业设计卫生标准 GB20021-2004中华人民共和国制药机械行业标准 QB/T 2754-2005 定容式液体定量灌装机 5工艺描述及产品介绍 5.1工艺/流程描述 车间此过程不断重复进行,物料在设备设定的工艺条件下完成沸腾快速干燥生产过程。
生产设备URS文件模板
目录 1.文件审批错误!未定义书签。 2目的错误!未定义书签。 3范围错误!未定义书签。 4法规和国家标准错误!未定义书签。 法规错误!未定义书签。 行业标准错误!未定义书签。 国家标准错误!未定义书签。 5工艺描述及产品介绍错误!未定义书签。 工艺/流程描述错误!未定义书签。 产品介绍错误!未定义书签。 6. 用户及系统要求错误!未定义书签。 . URS要求错误!未定义书签。 URS01:设备整体要求错误!未定义书签。 URS02:具体技术要求错误!未定义书签。 URS03:安全及环保要求错误!未定义书签。 URS04:文件资料要求错误!未定义书签。 URS05:服务与维修要求错误!未定义书签。 供应商对项目要求的确认错误!未定义书签。 7. 缩略词附件错误!未定义书签。 8. 文件修订变更历史错误!未定义书签。 9. 附件错误!未定义书签。
1.文件审批 起草 审核 批准 2目的 本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的期望。主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。设备生产商(供应商)应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。在本URS中用户仅提出基本的技术要求和
设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。投标方应在满足本URS的前提下提供卖方能够达到的更高标准和功能的高质量设备及其相关服务。卖方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。如遇与卖方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。 3范围 本用户需求书所列技术要求适用于设备的采购。新的设备在设计、制造技术及性能上达到国内先进水平,符合中国新版GMP要求。 4法规和国家标准 法规 液体灌装机用于乳酸钠溶液、乳酸的灌装,必须符合的要求,主要包括: GMP(2010年修订)及其附录 中国药品生产验证指南(2003版) 产品生产工艺规程 《中国药典》2015年版二部 行业标准 GBZ 1-2010 工业企业设计卫生标准 GB20021-2004中华人民共和国制药机械行业标准 QB/T 2754-2005 定容式液体定量灌装机 5工艺描述及产品介绍 工艺/流程描述 车间此过程不断重复进行,物料在设备设定的工艺条件下完成沸腾快速干燥生产过程。本文所述的一条沸腾搅拌干燥机生产线,由主机系统、新风处理系统、引风及消声系统、换热系统、电气控制操作系统、流化床系统、自动清洗系统等组成,用于车间制粒前工序湿颗粒的干燥生产。 产品介绍 待生产的产品如下: 用户及系统要求 URS要求
压片机用户需求(URS)范本
用户需求文件 X X X X 股份有限公司
目录 一、背景概述 (1) 二、目的 (1) 三、适用范围 (1) 四、人员及职责 (1) 五、参考法规和标准 (1) 六、缩写和定义 (2) 七、用户需求 (2) 八、偏差及变更 (7) 九、修订历史 (7) 十、附件 (7)
一、背景概述: 压片工序是片剂生产过程中重要工序之一。目前,我公司固体制剂车间现有ZP-45型旋转式压片机(设备编号:SG-078)采购于2006年,因使用年限长,且该设备PLC不符合GMP 要求(无用户权限分级),为确保生产,拟通过选型,采购新的符合生产需求的压片机替换现有ZP-45型旋转式压片机(设备编号:SG-078)。 二、目的: 制定本用户需求,概括性的描述对压片机的选型要求,包括设备原理、技术参数、设备性能、供方服务等,保证采购的设备符合相关法规和生产的需求,同时为后续设备验收、设备确认提供文件性的参考资料,建立完善的设备文件管理体系。 三、适用范围: 本URS适用于本次对压片机的选型要求。 四、人员及职责: 4.1生产部:依据生产需求、法规要求起草设备选型URS;并跟踪设备选型、采购的进度。 4.2维保部:审核生产部提交的URS,并确认设备的相关设备需求;执行经批准后的URS,对市场上的设备进行选型,与采购部沟通采购事宜。 4.3采购部:审核URS,依据经批准的URS和经确定的设备型号,采购设备。 4.4质量保证部:审核URS,确认其法规符合性;监督设备选型各阶段的进行,对URS的执行各阶段的变更、偏差进行管理。 4.5质量管理负责人:负责URS的批准工作,确保既定的URS法规符合性和适用性;对URS执行的各阶段做最终管理决定。 五、参考法规和标准: 所供应的设备(系统)必须符合以下适用的法规和标准但并不限于: 5.1GMP法规 《药品生产质量管理规范》(2010年修订) 5.2国家、行业标准 《JB20067-2005 制药机械符合药品生产质量管理规范的通则》 《GBZ 1-2010工业企业设计卫生标准》 GB-50236-1998焊接及验收规范 GB-12265-90机械防护安全要求 5.3安全标准 《GB5226.1-2002/IEC60204-1机械安全机械电气设备第1部分:通用技术条件》
瓶装流水线生产设备的URS
1.目的:建立数片间瓶装流水线生产设备的设计、安装和验证的可接受标准的依据,保证 设备选型符合生产要求。 2.范围:数片间瓶装流水线生产设备,包括LP-160自动理瓶机、BG-160自动园盘式数粒 机、ZSG-200自动直线式旋盖机、DLF-2000电磁感应铝箔封口机、TB-300自动不干胶贴标机、ZH-125自动装盒机。 3.责任者:制造科(制剂)、设备科、质管科、生产技术科。 4.需求:用于制剂车间药品塑料瓶包装工序的设备。 4.1总体要求:数片间瓶装流水线生产设备的设计合理、性能优越、操作方便、安全可靠、控制合理、清洁方便、维修保养方便,符合GMP要求。 4.2 数片间瓶装流水线生产设备的具体要求: 4.2.1瓶装线所有设备接触和不接触产品的金属表面产品都要使用304或更好的不锈钢,并要提供材质证明、内部镜面抛光、外表面亚光处理,所有焊件要抛光,设备任何部位不能有锋利的边缘和尖角。垫圈、密封圈和O型圈只能使用食物级别的聚合材料。 4.2.2设备功能失调或者失灵的情况下,必要有保护措施保证设备和产品仍然处于安全状态。设备危险可动零部件应装有防护罩,重新开启电力必须要求人工开机,不能是自动的。 4.2.3整体设备持续运行须稳定,日运行时间应≥12小时。 4.2.4LP-160自动理瓶机的要求: 4.2.4.1自动理瓶机的运行速度须达到125瓶/min,能够对20ml的瓶进行自动理瓶,上机率达到99.5%,无卡瓶现象。 4.2.4.2输送带上产生堵瓶现象时,理瓶机须具有自动停止供瓶的功能;同时,还须具有当恢复畅通后自动恢复供瓶的功能。 4.2.4.3电力有故障时设备须处于停止状态,以保护操作者、设备本身以及产品。重新开启电力必须要求人工开机,不能是自动的。 4.2.4.4更换瓶型时,更换花盘模具须简单快捷,且出瓶稳定、连续,瓶子外表无划痕、瓶口整齐依次向上有序送出。 4.2.5 BG-160自动圆盘式数粒机的要求: 4.2. 5.1数粒机的运行稳定速度须达到125瓶/min。 4.2. 5.2要有吸尘装置,药粒充填时,落料嘴能牢牢套住瓶口,确保装时补掉料。主机速度、输送速度、筛动速度可调节。 4.2. 5.3设备危险可动零部件应装有防护罩。重新开启电力必须要求人工开机,不能是自动的。 4.2. 5.4设备控制板必须提供人机中文界面,能自动控制关键参数,并自动检测故障。
完整性测试仪URS(终板) 用户需求说明标准模板
**集团制药总厂 设备设施用户需求标准(URS)
**集团制药总厂 1.1文件说明 (3) 1.2项目说明 (3) 2.设备需求及技术要求: (4) 2.1设备描述: (4) 2.2工艺设备清单: (4) 3.项目实施的用户需求 (5) 3.1法律和常规需求 (5) 3.2维护与保养 (5) 3.3 SAT 验收: (6) 4.交货 (6) 4.1发货 (6) 4.2安装 (7) 4.3文件 (7) 4.4服务与培训 (9) 4.5付款要求 (9) 5 .修订历史 (9)
**集团制药总厂 设备设施用户需求标准(URS) 1.简介: 1.1文件说明 1、本用户需求标准(URS)文件的技术规格中指出的工艺、材料和设备的标准以及参照的品牌或型号仅起说明作用,并没有任何限制性。投标人在投标中可以选用替代标准、品牌或型号,但这些替代要实质上满足或超过本用户需求标准(URS)文件的要求。项目招标评审时,由评标委员会负责对投标人提供的替代标准、品牌或型号的响应性进行审查。 2、本用户需求标准(URS)一般包括项目背景、技术要求、工艺要求、文件要求、商务要求等内容。其中技术要求主要包括采购项目名称、数量、技术规格和基本需求等;工艺要求主要包括系统配置、结构规格、设备材质、运行环境、布局接口、质量保证等内容;文件要求主要包括供应商资质证明、材质证明、环保安全证明、报价单、FAT (出厂测试)等一系列相应文件;商务要求主要包括交货期(完工期)、付款方式、货物安装调试、检验验收、保险、产品配送地点、服务响应、培训、质保期、售后服务及备品备件等。 3、投标人应充分结合本用户需求标准(URS)了解项目招标需求。 1.2项目说明 1-2.1本设备位于无菌三楼膜过滤间,洁净级别为C级,是一种适用于单芯、三芯过滤器进行在线泡点、扩散流、压力保持、压力衰减测试的自动完整性测试仪。可以对亲水性滤膜和疏水性滤膜进行测试,测试的范围不局限于某一品
URS 模板_冻干&自动进出料
Project Engineering – User Requirements Specifications Project No: Customer: Name: Document No: Author: Reviewed by: Approved by:
EQUIPMENT DESCRIBED IN THIS DOCUMENT Revision History
包1、冻干机 Package 1:Lyophilizers 用户需求技术规格书Revision index修订索引
Table of Contents内容目录 1.0 Overview 概况 1.1 Project introduction项目介绍 1.2 Project Standard项目标准 1.3 Equipment description设备描述 1.4 Refrence standard/guideline for equipment设备参考标准/指南 2.0 Process Description工艺描述 2.1 Input & Charging method装料方法 2.2 Brief Process Steps主要工艺步骤 2.3 Output & Discharging method输出出料方法 3.0 Productivity Requirement 生产要求 3.1 Productivity Requirement产能要求 3.2 Process Key Parameter Requirement 生产工艺关键参数要求 4.0 GMP requirements GMP要求 4.1 Failure mode detection故障模式探测 4.2 Level of instrumentation仪器级别 4.3 Cleaning requirement清洗要求 4.4 Qualification requirement确认要求 4.5 Material of construction材质要求 4.6 Use of lubricants润滑油使用 4.7 Data integrity数据完整性 4.8 Batch record printing批记录打印 4.9 Desired documents所需文件 4.10 Training培训 4.11 GMP requirement (Others) GMP要求(其它) 5.0 Safety requirement安全要求 5.1 General概况 5.2 Power failure and recovery电力故障和恢复 6.0 Technical requirement技术要求 6.1 Basic technical requirement基本技术要求 6.2 Level of automation自控水平 6.3 Specific requirements特殊要求 7.0 Good Engineering Practices Requirements (Suggested)良好工程规范要求(建议) 8.0 Constraints约束 Abbreviation 缩略语
臭氧设备URS
臭氧设备URS 第 1 页共 10页 公司名称*******有限责任公司 文件名称臭氧设备URS 制订/颁发 部门质量管理部 文件类型确认与验证技术标准 文件编号GR-ST-06(A)-SB-URS-O20-00 适用范围 分发部门 参考文件 人员车间/部门签名日期制订人 审核人 批准人 生效日期执行日期 版本/修订号回顾日期 替换记载 制订/变更原 因及目的
臭氧设备URS 第 2 页共 10页 目录 1、概述 2、参考文献 3、定义与缩写 4、系统描述 5、功能设计需求说明: 6. 供应商对项目要求的确认 7. 附件1
臭氧设备URS 第 3 页共 10页 1、概述: 根据公司输液一车间大容量注射剂(玻瓶)生产线和小容量注射剂生产线技改项目计划(含一车间二楼库房取样室、微生物实验室),按照2010版GMP需新增臭氧设备。本文就臭氧设备URS进行详述。 1.1目的: 本文件的目的在于公司输液一车间大容量注射剂(玻瓶)生产线和小容量注射剂生产线技改项目(含一车间二楼库房取样室、微生物实验室)臭氧设备的基本需求,包括性能要求、技术要求、设备要求、职业健康、安全与环保要求、服务要求、文件要求及其它要求。同时也是臭氧设备设计和验证的可接受标准的依据。设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。 1.3范围: 本用户需求文件为公司输液一车间大容量注射剂(玻瓶)生产线和小容量注射剂生产线技改项目(含一车间二楼库房取样室、微生物实验室)臭氧设备的用户要求文件。 2、参考文献: ?中国药品生产质量管理规范GMP(2010版) ?中国药典(2010年版) ?GB-52261-2002 机械安全机械电气设备第一部分:通用技术条件 ?GB-8196-87 机械设计防护罩安全要求 ?GB-12265-90 机械防护安全要求 3、定义与缩写: URS:用户需求规范 EHS:环境、健康、安全 FDA:美国食品药品管理局 DQ:设计确认
urs文件模板(1)
用户需求说明文件 XXXXXXXXXX公司 XXX年
目录 1.文件审批.................................................. 错误!未定义书签。 2目的....................................................... 错误!未定义书签。 3范围....................................................... 错误!未定义书签。 4法规和国家标准............................................. 错误!未定义书签。 法规......................................................... 错误!未定义书签。 行业标准..................................................... 错误!未定义书签。 国家标准..................................................... 错误!未定义书签。 5工艺描述及产品介绍......................................... 错误!未定义书签。 工艺/流程描述................................................ 错误!未定义书签。 产品介绍..................................................... 错误!未定义书签。 6. ..............................................................用户及系统要求错误!未定义书签。 . URS要求.................................................. 错误!未定义书签。 URS01:设备整体要求........................................ 错误!未定义书签。 URS02:具体技术要求........................................ 错误!未定义书签。 URS03:安全及环保要求...................................... 错误!未定义书签。 URS04:文件资料要求........................................ 错误!未定义书签。 URS05:服务与维修要求...................................... 错误!未定义书签。 供应商对项目要求的确认..................................... 错误!未定义书签。 7. ................................................................. 缩略词附件错误!未定义书签。 8. ............................................................ 文件修订变更历史错误!未定义书签。 9. ....................................................................... 附件错误!未定义书签。
urs内容及怎样写
GHL-250型 高速混合制粒机 用户需求说明(URS) (编制单位:) (编制时间:) (URS编号:) 目录 1、综述 2、标准及法规 3、供货范围 4、术语说明 5、技术要求 5.1生产工艺要求 5.2厂房设施及公用系统要求5.3设备主机部分 5.4电气控制及安全防爆 5.5清洗消毒要求 5. 6 EHS要求
6、服务要求 6.1 FAT要求 6.2包装运输要求 6.3文件资料要求 6.4 备品零件要求 6.5安装调试要求 6.6 SAT要求 6.7培训要求 6.8 保修要求 6.9 其它要求 7、修订历史 1、综述 目的:提供GHL-250型高速混合制粒机的设计、制造、采购、验收和确认的依据。 范围:本URS适用于GHL-250型高速混合制粒机招标采购和加工制作。 责任:参加投标方即编制方负责编制此URS,招标方对本URS的编制文件审核,确认URS的内容完全满足招标方的需求,作为进行技术及商务招标的依据。一旦编制方(即供方)中标,必须严格按照本URS所明确的法规标准、技术要求、服务要求,提供相关设备设施和服务,招标方及中标方均有责任对此URS 保密。 工艺描述:物料在添加辅料之后,在设备的容器内,经高速搅拌混合均匀,并在容器内形成一定的高速流动层,切碎刀在此流动层内高速剪切,形成颗粒状,在出料推杆作用下,颗粒被卸出。整个过程在设备容器内完成,可以有效防止产尘。密封装置采用净化的气密封。
环境标准:D级净化环境,GMP标准厂房,温度18-26度,湿度45%-65% 公用介质情况:压缩空气(气动和净化)、电源、清洁用纯化水 2、标准及法规 除满足本URS特殊要求外,必须符合中国的相关法规: 《药品生产质量管理规范(2010 年修订)》 中华人民共和国制药机械行业标准JB20014-20018-2004 《中华人民共和国环境保护法》 《GB 50231-98 机械设备安装工程施工及验收通用规范》 《GB 12348-90工业企业厂界噪声标准》 3、供货范围 GHL-250型高速混合制粒机1台套(其组成是GHL-250型高速混合制粒机主机,以及随机文件和操作维护工具) 4、术语说明 词语定义 URS User requirement specification 客户需求说明 IQ Installation Qualification 安装验证 OQ Operational Qualification 操作验证 EHS Environment Health Safety 环境健康安全 FAT Factory Acceptance Test 工厂接收测试
高效液相色谱仪URS 用户需求说明标准模板
1目的 本用户需求URS文件,旨在从项目和系统的角度阐述用户的需求,总结了用户对该项目的质量要求(GMP),描述了用户对该设备的工作过程及功能的期望。主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。 2适用范围 本文件适用于公司内需要购买的高效液相色谱仪的购买,维护,验证等过程需求。 3参考 3.1中国药品生产质量管理规范 3.2美国药品生产质量管理规范 3.3欧洲药品生产质量管理规范 4定义 4.1URS URS是User Requirement Specification字母简写,意思是用户需求,即用户 对设备设施等关于法规,技术,安全,验证,校准,文件,维护,培训,供 应商的具体要求,并形成具体的经批准的用户需求文件。 4.2FAT FAT是Factory Acceptance Test字母简写,意思是工厂验收测试,即按照批准 的文件对指定的设备设施进行测试,包括稳定性测试,有效性测试,安全性 测试等,FAT一般在制造工厂进行测试。 4.3SAT SAT是Site Acceptance Test字母简写,意思是现场验收测试,即在IQ 完成前 或后,在公司内按照批准的文件对指定的设备设施进行现场验收测试。 5职责 5.1供应商在规定时间对供应商确认表进行确认并回复。 6程序 6.1项目介绍 液相色谱仪是现今使用最广泛的仪器,用其对样品进行鉴别,有关物质,含 量等项目的测定。从而控制药品的纯杂程度。 6.2法规要求
设备URS模板
*****机用户需求标准 文件类别:用户需求标准 生效日期:2014年2月23日 页码1/12 机用户需求标准 你的签名表明你已清楚了解本文件及附件内容,充分理解并认可本文件的所有条款。 Prepared by / 编制者 部门:签名/日期: Reviewed by / 审核者 部门:签名/日期: 部门:签名/日期: 部门:签名/日期: 部门:签名/日期: Authorized by / 批准者 部门:签名/日期: 本文件根据需要应分发于以下部门: 01质量部、02 生产技术部、03设备计量室 质量部 颁发 任何对本文件及其附件的目的、内容或标准进行的改变或修正都必须起到改善的作用,并详细记录本文件的修订及变更历史,并且在执行以前必须取得批准。 版本号修订日期修订原因文件变更控制号 1.0 新订N/A
*****机用户需求标准 文件类别:用户需求标准 生效日期:2014年2月23日 页码2/12 目录 1.目的 (4) 2.范围 (4) 3.术语及定义 (4) 3.1GMP:药品生产质量管理规范 (4) 3.2URS:用户需求说明 (4) 3.3FAT:工厂验收测试 (4) 3.4SAT:现场验收测试 (4) 3.5DQ:设计确认 (4) 3.6IQ:安装确认 (4) 3.7OQ:运行确认 (4) 3.8PQ:性能确认 (4) 3.9GAMP:良好自动化生产规范 (4) 3.10PLC:程序控制器 (4) 4.职责 (4) 4.1需求方职责 (4) 4.2供应商职责 (4) 5.项目概述 (4) 5.1项目简介及背景 (5) 5.2主要用途 (5) 5.3工艺流程 (5) 5.4主要生产产品 (5) 6.供货范围(主要设备及数量) (5) 7.法规与标准 (5) 7.1药品法规要求 (5) 7.2国家标准要求 (5) 7.3行业标准要求 (6)
