常见阴离子的检验

常见阴离子的检验
离
子
试剂操作及现象有关离子方程式OH- 酚酞(石蕊)变红色(变蓝色)
Cl- AgNO3 、稀HNO3 白色不溶于HNO3沉淀Ag+ + Cl- = AgCl↓
Br-
①AgNO3 、稀
HNO3
浅黄色不溶于HNO3沉淀Ag+ + Br - = AgBr↓
②Cl2水、CCl4(或
苯)
溶液变黄(橙)色,加CCl4
震荡,下层呈红棕色
Cl2 +2Br - = 2Cl- + Br2
I-
①AgNO3 、稀
HNO3
黄色不溶于HNO3沉淀Ag+ + I - = AgI↓
②Cl2 (或Br2)水、
CCl4(或苯)
溶液变棕黄(褐)色,加CCl4
震荡,下层呈紫红色
Cl2 +2 I - = 2Cl- + I 2
③Cl2(FeCl3)、淀
粉
溶液变蓝色2Fe3++2 I - = 2 Fe2+ + I 2
CO 32- BaCl2、HCl、
澄清石灰水
先加BaCl2,产生白色沉淀,
加HCl沉淀溶解,产生无色无味气
体使石灰水变浑浊
Ba2+ + CO32- =BaCO3↓
BaCO3 + 2H+=
Ba2++CO2↑+H2O
Ca +2OH-+CO2 =
CaCO3↓+H2O
HC O3- BaCl2、HCl、
澄清石灰水
先加BaCl2,无现象,加HCl,
产生无色无味气体使石灰水变浑
浊
HCO3-+ H+= CO2↑+H2O
Ca +2OH-+CO2 =
CaCO3↓+H2O
SO 32- BaCl2、HCl、
品红溶液
先加BaCl2,产生白色沉淀,
加HCl沉淀溶解,产生无色有刺激
性气味气体使品红退色
Ba2+ + SO32- =BaSO3↓
BaSO3 + 2H+=
Ba2++SO2↑+H2O
先加BaCl2,无现象,加HCl,
产生无色有刺激性气味气体使品
HSO3-+ H+= SO2↑+H2O
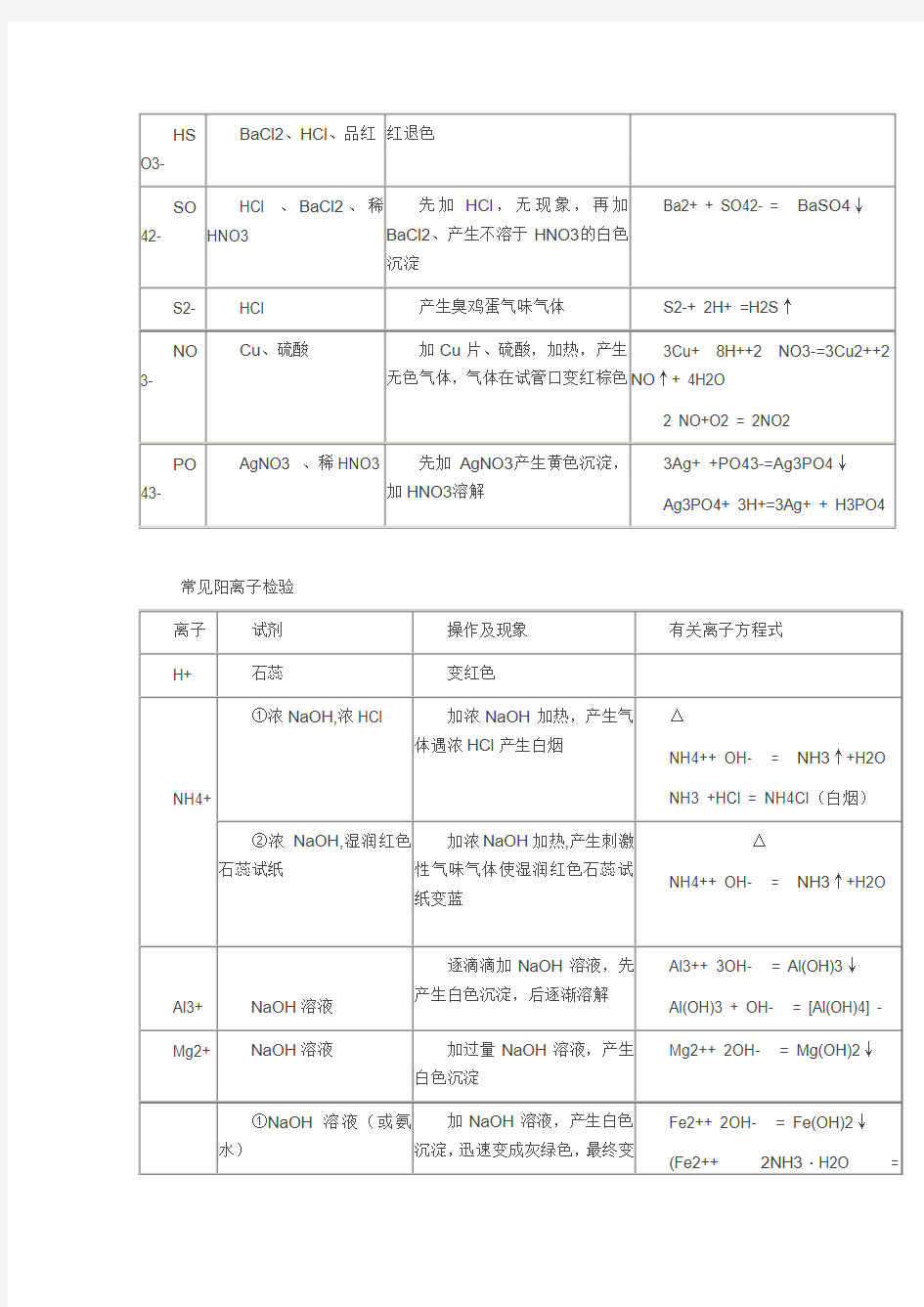
HS
O3-
BaCl2、HCl、品红红退色
SO 42-
HCl 、BaCl2、稀
HNO3
先加HCl,无现象,再加
BaCl2、产生不溶于HNO3的白色
沉淀
Ba2+ + SO42- = BaSO4↓
S2- HCl 产生臭鸡蛋气味气体S2-+ 2H+ =H2S↑
NO 3- Cu、硫酸加Cu片、硫酸,加热,产生
无色气体,气体在试管口变红棕色
3Cu+ 8H++2 NO3-=3Cu2++2
NO↑+ 4H2O
2 NO+O2 = 2NO2
PO 43- AgNO3 、稀HNO3 先加AgNO3产生黄色沉淀,
加HNO3溶解
3Ag+ +PO43-=Ag3PO4↓
Ag3PO4+ 3H+=3Ag+ + H3PO4
常见阳离子检验
离子试剂操作及现象有关离子方程式H+ 石蕊变红色
NH4+ ①浓NaOH,浓HCl 加浓NaOH加热,产生气
体遇浓HCl产生白烟
△
NH4++ OH- = NH3↑+H2O
NH3 +HCl = NH4Cl(白烟)
②浓NaOH,湿润红色
石蕊试纸
加浓NaOH加热,产生刺激
性气味气体使湿润红色石蕊试
纸变蓝
△
NH4++ OH- = NH3↑+H2O
Al3+ NaOH溶液
逐滴滴加NaOH溶液,先
产生白色沉淀,后逐渐溶解
Al3++ 3OH- = Al(OH)3↓
Al(OH)3 + OH- = [Al(OH)4] -
Mg2+ NaOH溶液加过量NaOH溶液,产生
白色沉淀
Mg2++ 2OH- = Mg(OH)2↓
①NaOH溶液(或氨水)
加NaOH溶液,产生白色
沉淀,迅速变成灰绿色,最终变
Fe2++ 2OH- = Fe(OH)2↓
(Fe2++ 2NH3·H2O =
Fe2+
(浅绿色)
成红褐色Fe(OH)2↓+2NH4+)
4Fe(OH)2
+O2+2H2O=4Fe(OH)3
②氯水、KSCN(或
NH4SCN)溶液
先加KSCN(或NH4SCN)
溶液无现象,再加氯水变血红色
2Fe2+ +Cl2 =2Fe3+ +2Cl-
Fe3+ + 6SCN- = [Fe
(SCN)6]3- (血红色溶液)
Fe3+
(棕黄色)
①NaOH溶液(或氨
水)
产生红褐色沉淀Fe3++ 3OH- = Fe(OH)3↓
(Fe3++ 3NH3·H2O =
Fe(OH)3↓+3NH4+)
②KSCN(或NH4SCN)
溶液
生成血红色溶液Fe3+ + 6SCN- = [Fe
(SCN)6]3- (血红色溶液)
Cu2+
(蓝
色)
NaOH溶液产生蓝色沉淀Cu 2++ 2OH- = Cu (OH)2↓Ag+ NaCl溶液产生白色沉淀Ag+ + Cl- = AgCl↓
Ba2+ 加硫酸或可溶性硫酸盐,稀硝酸
产生不溶于硝酸的白色沉
淀
Ba2+ + SO42- = BaSO4↓
Na+ 用铂丝蘸取式样(溶液或固
体),在酒精灯火焰上灼烧,看
到黄色火焰
K+ 用铂丝蘸取式样(溶液或固
体),在酒精灯火焰上灼烧,透
过蓝色钴玻璃,看到紫色火焰
常见离子的检验方法
常见离子的检验方法 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。 8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色 二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。 5、 SO42-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色。②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO3)2试纸变黑。②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS 或CuS)。
(新)高中化学常见离子检验方法一览表
高中化学常见离子检验方法一览表(一)常见阳离子的检验方法 离子检验试剂实验步骤实验现象离子方程式 H+①pH试纸 ②石蕊试 液 ①用玻璃棒蘸取少 量待测液滴到干燥 的pH试纸上②取 样,滴加石蕊试液 ①pH<7 ②石蕊变红 K+焰色反应①铂丝用盐酸洗涤 后在火焰上灼烧至 原火焰色②蘸取溶 液,放在火焰上灼 烧,观察火焰颜色。 浅紫色(通过蓝色 钴玻璃片观察钾 离子焰色) Na+焰色反应火焰分别呈黄色 NH4+NaOH溶液 (浓) 取少量待测溶液于 试管中,加入NaOH 浓溶液并加热,将 湿润红色石蕊试纸 置于试管口 加热,生成有刺激 性气味、使湿润红 色石蕊试纸变蓝 的气体 Ag+ 稀HNO、 稀盐酸(或 NaCl) 取少量待测溶液于 试管中,加入稀 HNO3酸化再加入 稀盐酸(或NaCl) 生成白色沉淀,不 溶于稀HNO3 Ag++Cl-=AgCl↓ Ba2+①稀H2SO4 或可溶性 硫酸盐溶 液②稀 HNO3 取少量待测溶液于 试管中,加入稀 H2SO4再加入稀 HNO3 产生白色沉淀,且 沉淀不溶于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液 取少量待测溶液于 试管中,加入KSCN 溶液 变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚 取少量待测溶液于 试管中,加苯酚 溶液显紫色 淀粉KI溶 液 滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2 加NaOH溶 液 加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓
离子检验试剂实验步骤实验现象离子方程式 Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测溶液 于试管中,加入 KSCN溶液,新制 的氯水 ①加入KSCN溶 液不显红色,加入 少量新制的氯水 后,立即显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3 ②加NaOH 溶液 ②取少量待测溶液 于试管中,加入 NaOH溶液并露置 在空气中 ②开始时生成白 色Fe(OH)2沉淀, 迅速变成灰绿色, 最后变成红褐色 Fe(OH)3沉淀。 Fe2++2OH —=Fe(OH)2↓ 4Fe(OH)2十O2+2H2O=4Fe(OH)3 ③(无其它 还原性物 质如SO32-) 酸性高锰 酸钾 取少量待测溶液于 试管中,加入酸性 高锰酸钾溶液 加入酸性高锰酸 钾溶液紫色褪去 Al3+NaOH溶液取少量待测溶液于 试管中,逐滴加入 NaOH溶液至过量 加入适量NaOH 溶液后生成白色 沉淀,该沉淀溶于 过量NaOH溶液 中 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+ 2H2O Cu2+NaOH溶液取少量待测溶液于 试管中,加入NaOH 溶液 加入适量NaOH 溶液后生成蓝色 沉淀 Cu++2OH-=Cu(OH)2↓
高中化学常见离子的检验和物质的鉴别
(一)常见阳离子的检验方法 离子检验试剂实验步骤实验现象离子方程式 H+①酸度计 ②pH试纸 ③石蕊试 液 ①将酸度计的探头 浸泡在待测液中② 用玻璃棒蘸取少量 待测液滴到干燥的 pH试纸上③取样, 滴加石蕊试液 ①、②pH<7 ③石蕊变红 K+焰色反应①铂丝用盐酸洗涤 后在火焰上灼烧至 原火焰色②蘸取溶 液,放在火焰上灼 烧,观察火焰颜色。 浅紫色(通过蓝色 钴玻璃片观察钾 离子焰色) Na+焰色反应火焰分别呈黄色 NH4+NaOH溶液 (浓) 取少量待测溶液于 试管中,加入NaOH 浓溶液并加热,将 湿润红色石蕊试纸 置于试管口 加热,生成有刺激 性气味、使湿润红 色石蕊试纸变蓝 的气体 Ag+稀HNO3、稀 盐酸(或 NaCl) 取少量待测溶液于 试管中,加入稀HNO3 再加入稀盐酸(或 NaCl) 生成白色沉淀,不 溶于稀HNO3 Ag++Cl-=AgCl↓ Ba2+①稀H2SO4 或可溶性 硫酸盐溶 液②稀 HNO3 取少量待测溶液于 试管中,加入稀 H2SO4再加入稀HNO3 产生白色沉淀,且 沉淀不溶于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液 取少量待测溶液于 试管中,加入KSCN 溶液 变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚 取少量待测溶液于 试管中,加苯酚 溶液显紫色 淀粉KI溶 液 滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2加NaOH溶 液 加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测溶液 于试管中,加入 KSCN溶液,新制的 氯水 ①加入KSCN溶液 不显红色,加入少 量新制的氯水后, 立即显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3
中学常见离子检验方法与常见操作
一、常见离子的检验方法 1.常见阳离子的检验 2.常见阴离子的检验
1.检验溶液中含有F e3+的实验操作: 取少量溶液置于试管中,滴加几滴K S C N溶液,若溶液变红,则证明溶液中含有F e3+。2.检验溶液中含有F e2+的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液变红,则证明溶液中含有F e2+。 3.验证溶液中不含有铁元素的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液不变红,则证明溶液中不含+铁元素。 4.检验溶液中含有N H 4 +的实验操作是: 取少量溶液置于试管中,加入氢氧化钠后加热,将湿润的红色石蕊试纸放在试管口,若试纸 变蓝则证明溶液中含有N H 4+。
5.如何检验S O 4 2- 取少量溶液置于试管中,加入盐酸无现象,在加入B a C l 2 溶液产生白色沉淀则证明溶液 中有S O 4 2- 。 6.如何检验C l - 取少量溶液置于试管中,加入A g N O 3 溶液有白色沉淀产生,再加入H N O 3 后沉淀不 溶解则证明溶液中含有C l - 。 二、实验室常见操作 1. 气密性检验 (1)装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等) →描述现象→得出结论; (2)微热法检查的关键词是封闭、微热、气泡、水柱; (3)液差法的关键词是封闭、形成液差。 甲 ①实验开始前,某同学对甲实验装置进行了气密性检查,方法是: 关闭活塞,从长颈漏斗加水至浸没长颈漏斗的下端,继续加水形成一段水柱,一段时间水柱无变化则证明装置气密性良好。 ①实验开始前,某同学对乙实验装置进行了气密性检查,方法是: 关闭分液漏斗活塞,将导管插入水中用酒精灯微热烧瓶,导管口有气泡冒出,停止加热导管内出现一段水柱,证明气密性良好。 2.气体的收集 依据:根据气体的溶解性或密度 ① ② ③ ④ ⑤ ⑥
高中化学 常见离子的检验
常见离子的检验 高考频度:★★★★☆ 难易程度:★★★☆☆ 典例在线 草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的、和Cl?。 (1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整: ①____________________ ②过滤③蒸发浓缩④冷却结晶⑤过滤。 (2)上述操作中需要用到玻璃棒的是__________(填序号)。 (3)将制得的少量晶体加水溶解后,分别置于三支试管中。 ①向第一支试管中加入少量稀盐酸,可观察到_____________,说明溶液中存在__________离子。 ②向第二支试管中加入__________,可观察到____________________,说明溶液中存在 。 ③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量__________溶液, 可观察到白色沉淀,说明溶液中存在Cl?。其中,加入足量Ba(NO3)2溶液的目的是__________。【答案】(1)加水搅拌(或溶解) (2)①②③⑤ (3)①产生大量气泡 ②足量稀盐酸,再加入BaCl2溶液白色沉淀 ③(硝酸酸化的)AgNO3溶液排除和的干扰 【解析】(1)草木灰中含有的离子化合物为固态,首先需要将草木灰溶于水,然后过滤才可以将可溶性的离子与难溶的其它杂质分离。 (2)在溶解时用玻璃棒搅拌加速溶解,过滤时用玻璃棒引流,蒸发时用玻璃棒搅拌使液体受热均匀。 (3)加入盐酸若产生无色无味气体,说明溶液中含有,的检验需要用到可溶性Ba2+,
为了避免的干扰,所以应该先加足量稀盐酸,再加入BaCl 2溶液,若有白色沉淀生成, 说明溶液中存在,Cl ? 检验时应用AgNO 3溶液,因原溶液中存在 及,所以先加 入足量的Ba(NO 3)2溶液,再加入(硝酸酸化的)AgNO 3溶液,若有白色沉淀生成,说明原溶液中存在Cl ? 。 解题必备 几种常见离子的检验 的检验 ? Cl 和. 1 (1) 的检验:取少量待测液加入试管中,先加足量稀盐酸,无明显现象,然后加BaCl 2溶 液,出现白色沉淀,说明溶液中含有 。 (2)Cl ? 的检验:取少量待测液加入试管中,然后滴加几滴稀硝酸和几滴AgNO 3溶液,若有白色沉淀产生,说明待测液体中含有Cl ? ,若无白色沉淀生成,说明原待测液中不含Cl ? 。 2.其他常见离子的检验 离子 操作、现象及结论 H + 向待测液中加入紫色石蕊试液,溶液变红,证明溶液显酸性,有H + OH ? 向待测液中加入酚酞试液,溶液变红,证明溶液显碱性,有OH ? 向待测液中加入盐酸,产生无色无味气体,气体通入澄清石灰水中产 生白色沉淀,证明有 (或 ) 取待测液与NaOH 溶液混合加热,产生有刺激性气味、其使湿润的红色石蕊试纸变蓝的气体,证明有 易混易错 1.在检验 时,为什么要加入稀盐酸? 能否加
高中化学常见离子检验篇演示教学
高中化学常见离子检 验篇
精品文档 常见物质性质小结之离子检验篇 下面这些,完全可以在化学推断题、实验设计题中直接使用。像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等) 一、阳离子 1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。 2.钠离子(Na+):焰色反应,火焰呈黄色。 3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。 4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。 5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于 NH4Cl溶液,则可证明溶液中含有镁离子。 6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。 7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。 8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。 9.亚铁离子(Fe2+): ①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子。(请注意“先”“迅 速”“最后”,不要更改) ②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。 10.三价铁离子(Fe3+): ①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子。 收集于网络,如有侵权请联系管理员删除
常见阴离子的检验
一、常见阴离子的检验 1 .阴离子的初步检验 ①与稀H2SO4 作用,试液中加入稀H2SO4 并加热,有气泡产生,可能有CO32- 、SO32- 、S2- 、NO2- 或CN- 存在,再根据气体的特性不同,再进行判断。 ②与BaCl2 的作用。 试液中加入BaCl2 溶液,生成白色沉淀,可能有SO42- 、SO32- 、PO43- 、S2O32- 根据沉淀性质不同进行检验。 ③与AgNO3+HNO3 作用。 试液中加入AgNO3 再加入稀HNO3 若为白色沉淀为Cl- 黄色沉淀可能有 I- 、Br- 和CN- 存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32- 存在,Ag2S 为黑色沉淀。 ④氧化性阴离子的检验 试液用H2SO4 酸化后,加入KI 溶液和淀粉指示剂,若溶液变蓝,说明有 NO2- 存在。 ⑤还原性阴离子检验 a 、强还原性阴离子与I2 的试验,试液用H2SO4 酸化后,加含0.1%KI 的I2- 淀粉溶液,若其蓝色褪去,可能有SO32- 、C2O42- 、S2O32- 、S2- 和CN- 等离子存在。 b、还原性阴离子与KMnO4 的试验,试液用H2SO4 酸化后,加入 0.03%KMnO4 溶液,若能褪色,可能有SO32- 、S2O32- 、S2- 、C2O42- 、Br- 、I- 、NO2- 等离子。 2 .个别鉴定反应 ⑴SO42- 加入BaCl2 溶液生成BaSO4 白色沉淀,该沉淀不溶于稀HCl 或稀HNO3
Ba2++SO42- === BaSO4 ↓ ⑵SO32- a 、加入BaCl2 溶液生成BaSO3 白色沉淀,加入稀HCl ,沉淀溶解并放出有刺激性气味的气体SO2 Ba2++SO32- === BaSO3 ↓ BaSO3+2H+ === Ba2++H2O+SO2 ↑ b 、加入少量I2- 淀粉溶液,蓝色褪去 SO32-+I2+H 2O === SO42-+2I-+2H + ⑶Cl- 加入AgNO3 生成AgCl 白色沉淀,该沉淀不溶于稀HNO3 或稀 HCl ,但溶于浓NH3 · H2O AgCl+2NH3 · H2O === [Ag(NH3)2]++Cl -+2H2O ⑷Br- a 、加入AgNO3 生成淡黄色AgBr 沉淀,该沉淀不溶于HCl 或HNO3 中,微溶于浓NH3 · H2O 。 Ag++Br- === AgBr ↓ b 、加入新制氯水,振荡后再加入CCl4 ,继续振荡,无色CCl4 层变为红棕色。 Cl2+2Br- === 2Cl-+Br2 ⑸I- a 、加入AgNO3 生成AgI 黄色沉淀,该沉淀不溶于稀HNO3 和浓 NH3 · H2O 。
常见离子的检验方法
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH) 2 ],该沉淀不溶于过量 的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO 4 ),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH) 2 ],迅速变成灰 绿色,最终变成红褐色[Fe(OH) 3 ]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH) 2 ]。②插入铁片或锌片,有红色的铜析出。 8、 NH 4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH 3 ),该气体 能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na 2CO 3 溶液,产生无色气体;②能使紫色石蕊试液、pH 试纸变红。 10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色
二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO 3 溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO 3 溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO 3 溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。 ②加入氯水和淀粉试液,溶液变蓝。 5、 SO 4 2-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO 32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO 2 ),该 气体可使品红溶液褪色。②加入BaCl 2溶液,生成白色沉淀(BaSO 3 ),该沉淀可 溶于盐酸,产生无色、有刺激性气味的气体(SO 2 )。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO 3) 2 试纸变黑。②能与Pb(NO 3 ) 2 溶液或CuSO 4 溶液生成黑色的沉淀(PbS或 CuS)。 8、 CO 32-:①加入CaCl 2 或BaCl 2 溶液,生成白色沉淀(CaCO 3 或BaCO 3 ),将 沉淀溶于强酸,产生无色、无味的气体(CO 2 ),该气体能使澄清的石灰水变混 浊。②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向 原溶液中加入CaCl 2 溶液,产生白色沉淀。 9、 HCO 3 -:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变 浑浊;向原溶液中加入CaCl 2 溶液,无明显现象。 10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味 的气体(NO 2 )。 11、PO 43-:AgNO 3 溶液、稀硝酸生成黄色沉淀,加硝酸沉淀溶解
高中化学常见离子检验大全完整版
高中化学常见离子检验 大全 标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]
(一)常见阳离子的检验方法
Fe2+ ①KSCN溶 液,新制的 氯水 于试管中,加入 KSCN溶液,新 制的氯水 加入KSCN溶 液不显红色, 加入少量新制 的氯水后,立 即显红色。 2Fe2+ + Cl 2 2Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN) 3 ②NaOH溶 液 取少量待测溶液 于试管中,加入 NaOH溶液并露 置在空气中 开始时生成白 色沉淀,迅速 变成灰绿色, 最后变成红褐 色沉淀。 Fe2++2OH - =Fe(OH) 2 ↓ 4Fe(OH) 2 十 O 2 +2H 2 O=4Fe(OH) 3 ③酸性高锰 酸钾(无其 它还原性物 质) 取少量待测溶液 于试管中,加入 酸性高锰酸钾溶 液 加入酸性高锰 酸钾溶液紫色 褪去 5Fe2+ + MnO 4 -+8H+ 5Fe3+ +Mn2++4 H 2 O ④铁氰化钾 K 3 [Fe(CN) 6 ] 取少量待测溶液 于试管中,加入 铁氰化钾溶液 产生蓝色沉淀 3 Fe2++2[Fe(CN) 6 ] 3- ═ Fe 2 [Fe(CN) 6 ] 3 ↓ Al3+NaOH溶液取少量待测溶液 于试管中,逐滴 加入NaOH溶液 至过量 加入适量NaOH 溶液后生成白 色沉淀,该沉 淀溶于过量 NaOH溶液中 Al3++3OH-=Al(OH) 3 ↓ Al(OH) 3 +OH-=AlO 2 -+ 2H 2 O Cu2+NaOH溶液取少量待测溶液加入适量NaOH Cu2++2OH-=Cu(OH)2↓
几种常见离子的检验
几种常见离子的检验 离 子 所用试剂方法现象化学方程式 Cl-AgNO3溶液和稀 HNO3 将AgNO3溶液滴入待测液中,再加稀 HNO3 生成白色沉淀.且不溶于稀HNO3 AgNO3+NaCl ==AgCl↓+N aNO3 SO4 2-BaCl2溶液和稀 盐酸 将稀盐酸滴入待测液中,再加BaCl2 溶液 滴加稀盐酸无现象,滴加 BaCl2 溶液生成白色沉淀,且沉淀不溶 于稀盐酸 BaCl2+Na2S O4==BaSO4 ↓+ +2NaCl CO3 2-盐酸(或HNO3) 和澄清石灰水 向待测液中加入盐酸(或HNO3).将产 生的气体通入澄清石灰水中 产生无色无味的气体,此气体能 使澄清的石灰水变浑浊 Na2CO3+2HC l==2NaCl+H 2O+ CO2↑ CO2+Ca(OH) 2==CaCO3↓ +H2O OH-酚酞试液、紫色 石蕊试液或红 色石蕊试纸 ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 ①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 —— H+紫色石蕊试液 或蓝色石蕊试 纸 ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 ①溶液变红 ②蓝色石蕊试纸变红 —— NH4 +浓NaOH溶液 将浓NaOH溶液加入待测液中,加热, 将湿润的红色石蕊试纸置于试管口 (或用玻璃棒蘸浓盐酸置于试管口) 放出有刺激性气味的气体,该气 体能使湿润的红色石蕊试纸变 蓝(或遇到浓盐酸产生大量白 烟) NH4Cl+NaOH NaCl+H2 O+NH3↑ Cu2NaOH溶液将NaOH溶液加入待测液中生成蓝色沉淀CuSO4+2NaO
高中化学常见离子检验大全.docx
(一 )常见阳离子的检验方法 离子检验试剂 ①酸度计②H+pH 试纸③ 石蕊试液 K +焰色反应 Na+焰色反应NH4+ NaOH溶液 (浓 ) 稀HNO 3、Ag+ 稀盐酸(或 NaCl )实验步骤实验现象离子方程式 ? ①将酸度计的探头 浸泡在待测液中② ①、② pH<7 用玻璃棒蘸取少量 待测液滴到干燥的 ③石蕊变红 pH 试纸上③取样, 滴加石蕊试液 ① 铂丝用盐酸洗涤浅紫色(通过蓝 后在火焰上灼烧至色钴玻璃片观察 原火焰色② 蘸取溶钾离子焰色) 液,放在火焰上灼 火焰分别呈黄色 烧,观察火焰颜色。 取少量待测溶液于 加热,生成有刺 试管中,加入 NaOH 激性气味、使湿 浓溶液并加热,将 润红色石蕊试纸 湿润红色石蕊试纸 变蓝的气体 置于试管口 取少量待测溶液于 试管中,加入稀生成白色沉淀,Ag ++Cl -= AgCl↓HNO 3再加入稀盐不溶于稀 HNO 3 酸(或 NaCl ) 稀 H 24 或取少量待测溶液于 SO产生白色沉淀, 可溶性硫酸试管中,加入稀 Ba2+且沉淀不溶于稀Ba2++ SO42-=BaSO 4↓盐溶液、稀H2 SO4再加入稀 HCl HCl HCl 取少量待测溶液于 KSCN 溶液试管中,加入变为血红色溶液Fe3++3SCN -= Fe(SCN)3 KSCN 溶液 取少量待测溶液于6C6H5OH + Fe 3+? 加苯酚溶液显紫色 Fe3+试管中,加苯酚 [Fe(C6 H5O)6]3- + 6H +淀粉 KI溶滴加淀粉 KI 溶液溶液显蓝色2Fe3++2I-= 2Fe2+ + I 2 液 加 NaOH 溶 加 NaOH 溶产生红褐色沉淀Fe3+- +3OH = Fe(OH) 3 液↓离子检验试剂实验步骤实验现象离子方程式?
高中化学常见离子检验汇总大全
黑龙江省林口林业局助考辅导中心 高中化学离子检验汇总(一)常见阳离子的检验方法 离子检验试剂实验步骤实验现象离子方程式? H+①pH试纸 ②石蕊试 液 ①用玻璃棒蘸取少 量待测液滴到干燥 的pH试纸上② 取样滴加石蕊试液 ①pH<7 ②石蕊变红 K+焰色反应①铂丝用盐酸洗涤 后在火焰上灼烧至 原火焰色②蘸取溶 液,放在火焰上灼 烧,观察火焰颜色。 浅紫色(通过蓝色 钴玻璃片观察钾 离子焰色) Na+焰色反应火焰分别呈黄色 NH4+ NaOH溶液 (浓) 取少量待测溶液于 试管中,加入NaOH 浓溶液并加热,将 湿润红色石蕊试纸 置于试管口 加热,生成有刺激 性气味、使湿润红 色石蕊试纸变蓝 的气体 Ag+ 稀HNO 3 、 稀盐酸(或 NaCl)取少量待测溶液于 试管中,加入稀 HNO3再加入稀盐 酸(或NaCl) 生成不溶于稀硝 酸的白色沉淀 Ag++Cl-=AgCl↓ Ba2+①稀H2SO4 或可溶性 硫酸盐溶 液②稀 HNO3 取少量待测溶液于 试管中,加入稀 H2SO4再加入稀 HNO3 产生不溶于稀硝 酸的白色沉淀 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液加入KSCN溶液变为血红色溶液Fe3++3SCN-=Fe(SCN)3(络合物)加苯酚 取少量待测溶液于 试管中,加苯酚 溶液显紫色 淀粉KI溶 液 滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2 NaOH溶液加NaOH溶液产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测溶液 于试管中,加入 KSCN溶液,新制 的氯水 ①加入KSCN溶 液不显红色,加入 少量新制的氯水 后,立即显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3
高中常见离子检验规律总结
高中常见离子检验规律总结沙湾一中化学组:史晓敏 【摘要】各种常见阴阳离子的检验方法;对学生来说又比较容易混淆的。所以对中学阶段常见的一些阴阳离子的检验方法的总结、归纳、记忆;就显得很重要。 【摘要】阴阳离子检验 元素化合物知识的学习在高中阶段的学习很重要,在整个高中阶段占得比重也比较大,而要对高中阶段遇到所有元素化合物知识有一个全面的、系统的掌握有比较困难,因此对元素化合物知识的归纳总结显得尤为重要,而在这些元素化合物知识中,各种常见阴阳离子的检验方法;对学生来说又比较容易混淆的。所以对中学阶段常见的一些阴阳离子的检验方法的总结、归纳、记忆;就显得很重要。 第一:常见重要阳离子的检验及方法 1、H+的检验,能使紫色石蕊试液或橙色的甲基橙 试液变为红色。 2、Na+的检验,用焰色反应来检验时,它们的火焰 分别呈黄色。 3、K+的检验,用焰色反应来检验时,透过蓝色钴 玻片呈紫色。 4、Ba2+的检验,能使稀硫酸或可溶性硫酸盐溶液产 生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 5、Mg2+的检验,能与NaOH溶液反应生成白色 Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 6、Al3+的检验,能与适量的NaOH溶液反应生成白 色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 7、Ag+的检验,能与稀盐酸或可溶性盐酸盐反应, 生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成[Ag(NH3)2]+。 8、NH4+的检验,铵盐(或浓溶液)与NaOH浓溶液 反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。 9、Fe2+的检验,能与少量NaOH溶液反应,先生成 白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl- 10、Fe3+的检验,能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液;或能与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀。11、Cu2+的检验,蓝色水溶液(浓的CuCl2溶液显 绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的 CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 第二:常见重要的阴离子的检验及方法。 (1)OH-的检验,能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄 色。 (2)Cl-的检验,能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水, 生成[Ag(NH3)2]+。 (3)Br-的检验,能与硝酸银反应,生成淡黄色AgBr 沉淀,不溶于稀硝酸;或加氯水溶液显橙黄色,再加CCl4溶液变为橙红色。 (4)I-的检验,能与硝酸银反应,生成黄色AgI 沉淀,不溶于稀硝酸;也能与氯水反应,生成 I2,使淀粉溶液变蓝;或加氯水溶液显黄褐色,再加CCl4溶液变为紫色。 (5)SO42-的检验,先在溶液中加盐酸我现象,再加BaCl2出现白色沉淀。 (6)SO32-的检验,浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红 溶液褪色。能与BaCl2溶液反应,生成白色 BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺 激性气味的SO2气体。 (7)S2-的检验,能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。 (8)CO32-的检验,能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸), 生成无色无味、能使澄清石灰水变浑浊的CO2 气体。 (9)HCO3-的检验,加BaCl2溶液无任何现象,再加盐酸放出无色无味CO2气体,气体能使澄清石 灰水变浑浊或向HCO3-盐酸溶液里加入稀MgSO4 溶液,无现象,加热煮沸,有白色沉淀 MgCO3 生成,同时放出 CO2气体。 (10)NO3-的检验,浓溶液中加入铜片、浓硫酸加热,放出红棕色气体。 参考文献 1、《步步高高考总复习》作者:王朝银 2、《2013高考优化方案》作者:张学宪
高中化学常见离子检验篇
高中化学常见离子检验 篇 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】
常见物质性质小结之离子检验篇下面这些,完全可以在化学推断题、实验设计题中直接使用。像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等) 一、阳离子 1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。 2.钠离子(Na+):焰色反应,火焰呈黄色。 3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。 4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。 5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子。 6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。 7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。 8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。 9.亚铁离子(Fe2+):
①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子。(请注意“先”“迅速”“最后”,不要更改) ②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。 10.三价铁离子(Fe3+): ①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子。 ②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子。 11.铜离子(Cu2+):取少量蓝色溶液,加入NaOH溶液,生成蓝色沉淀,沉淀加热后变为黑色,则可证明溶液中含有铜离子。 二、阴离子 1.氢氧根(OH-): ①取少量溶液,滴加无色酚酞试液,溶液显红色,则可证明溶液中含有氢氧根。 ②取少量溶液,滴加紫色石蕊试液,溶液显蓝色,则可证明溶液中含有氢氧根。 ③取少量溶液,滴加橙色甲基橙试液,溶液显黄色,则可证明溶液中含有氢氧根。 2.氯离子(Cl-):取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的白色沉淀,则可证明溶液中含有氯离子。 3.溴离子(Br-):取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的淡黄色沉淀,则可证明溶液中含有溴离子。 4.碘离子(I-):
常见阳离子的检验方法
(一)常见阳离子的检验方法 离子 检验 试剂 实验步骤 实验现象 离子方程式 H+ ①酸度计 ②pH 试纸③石蕊试液 ①将酸度 计的探头 浸泡在待 测液中② 用玻璃棒蘸取少量待测液滴 到干燥的pH 试纸上③取样,滴 加石蕊试 液 、②pH<7 ③石蕊变红 K+ 焰色反应 ① 铂丝用盐酸洗涤后在火焰浅紫色(通过蓝色钴玻璃
上灼烧至原火焰色②蘸取溶液,放在火 焰上灼烧,观察火焰颜色。 片观察钾 离子焰 色) Na + 焰色反应 火焰分别呈黄色 NH 4+ NaOH 溶液(浓) 取少量待 测溶液于试管中,加入NaOH 浓溶液并加热,将湿润红色石蕊试纸置于试管口 加热,生 成有刺激 性气味、使湿润红色石蕊试 纸变蓝的 气体 Ag + 稀HNO3、稀盐酸(或取少量待 测溶液于试管中,加入稀生成白色沉淀,不溶于稀Ag++Cl -= AgCl↓
NaCl)H NO3再 加入稀盐 酸(或 NaCl) HNO3 Ba 2+ ①稀 H2SO 4或可 溶性 硫酸 盐溶 液②稀 HNO3 取少量待 测溶液于 试管中,加 入稀 H2SO4再 加入稀 HNO3 产生白色 沉淀,且 沉淀不溶 于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe 3+ KSCN 溶液 取少量待 测溶液于 试管中,加 入KSCN 溶液 变为血红 色溶液 Fe3++3SCN-= Fe(SCN)3 加苯 取少量待 测溶液于 溶液显紫
酚试管中,加 苯酚 色 淀粉KI溶液滴加淀粉 KI溶液 溶液显蓝 色 2Fe3++2I-= 2Fe2++ I2 加NaOH 溶液加NaOH 溶 产生红褐 色沉淀 Fe3++3OH-= Fe(OH)3↓ 离子检验 试剂 实验步骤实验现象离子方程式 Fe 2+ ①KSC N溶 液,新 制的 氯水 ①取少量 待测溶液 于试管中, 加入 KSCN溶 液,新制的 氯水 ①加入 KSCN溶 液不显红 色,加入 少量新制 的氯水 后,立即 2Fe2+ + Cl2#FormatImgI D_1# 2Fe3+ + 2Cl- Fe3++3SCN -=Fe(SCN)3
高考化学常见物质的检验
高考化学常见物质的检验 1.常见气体的检验常见气体检验方法 氢气纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气 氧气可使带火星的木条复燃 氯气黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝 ) 氯化氢无色有刺激性气味的气体。在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成。二氧化硫无色有刺激性气味的气体。能使品红溶液褪色,加热后又显红色。能使酸性高锰酸钾溶液褪色。 硫化氢无色有具鸡蛋气味的气体。能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑。 氨气无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟。 二氧化氮红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。一氧化氮无色气体,在空气中立即变成红棕色
二氧化碳能使澄清石灰水变浑浊;能使燃着的木条熄灭。SO2气体也能使澄清的石灰水变混浊, N2等气体也能使燃着的木条熄灭。 一氧化碳可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;能使灼热的 CuO由黑色变成红色。 甲烷无色气体,可燃,淡蓝色火焰,生成水和CO2;不能使高锰酸钾溶液、溴水褪色。乙烯无色气体、可燃,燃烧时有明亮的火焰和黑烟,生成水和 CO2。能使高锰酸钾溶液、溴水褪色。 乙炔 无色无臭气体,可燃,燃烧时有明亮的火焰和浓烟,生成水和 CO2,能使高锰酸钾溶液、溴水褪色。 2.几种重要阳离子的检验 (l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变为红色。 (2)Na+、K+ 用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色 (通过钴玻片)。 (3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 (4)Mg2+ 能与NaOH溶液反应生成白色 Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
高中化学常见离子检验篇
常见物质性质小结之离子检验篇 下面这些,完全可以在化学推断题、实验设计题中直接使用。像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等) 一、阳离子 1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。 2.钠离子(Na+):焰色反应,火焰呈黄色。 3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。 4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。 5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl 溶液,则可证明溶液中含有镁离子。 6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。 7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。 8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。 9.亚铁离子(Fe2+): ①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子。(请注意“先”“迅速”“最后”,不要更改) ②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。 10.三价铁离子(Fe3+): ①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子。 ②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子。
常见阳离子的检验方法
常见阳离子的检验方法: 离 子 检验试剂实验步骤实验现象离子方程式 K+焰色反应①铂丝在火焰上灼烧至原火 焰色②蘸取溶液,放在火焰 上灼烧,观察火焰颜色。浅紫色(通过蓝色钴玻璃片 观察钾离子焰色) —— N a+ 焰色反应火焰分别呈黄色N H4 +NaOH溶液(浓) 向未知溶液中加入NaOH 浓溶液并加热 生成有刺激性气味、使湿润 红色石蕊试纸变蓝的气体 NH4++OH-=NH3↑+H 2 O Al 3+加NaOH溶液 向未知溶液中加入NaOH 溶液 加入适量NaOH溶液后生 成白色沉淀,该沉淀溶于过 量NaOH溶液中 Al3++3OH-=Al(OH)3↓ Cu 2+浓氨水向未知溶液中加入浓氨水 加入适量浓氨水后生成蓝色 沉淀,该沉淀溶于过量浓氨 水中,溶液呈深蓝色 Cu2++2OH-=Cu(OH) 2 ↓ Cu(OH)2+4NH 3 ·H2O=[Cu(NH3)4]2++ 2OH-+4H2O A g+①稀盐酸或可 溶性盐酸盐② 稀HNO3③氨 向未知溶液中加入稀盐酸再 加入稀HNO3向过滤出的沉 淀中加氨水 生成白色沉淀,不溶于稀H NO3,但溶于氨水,生成[A g(NH3)2]+ Ag++Cl-=AgCl↓
水 Ba 2+稀H2SO4或可 溶性酸盐溶液 向未知溶液中加入稀H2SO4 再加入稀HNO3 产生白色沉淀,且沉淀不溶 于稀HNO3 Ba2++SO42-=BaSO4↓ Fe 3+KSCN溶液 向未知溶液中加入KSCN溶 液或加NaOH溶液或加苯 酚 变为血红色溶液 Fe3++3SCN-=Fe(SC N)3 加NaOH溶液产生红褐色沉淀 Fe3++3OH-=Fe(OH)3 ↓ 加苯酚溶液显紫色 Fe3++6C6H6OH→[Fe (C6H5O)]3-+6H+ Fe 2+①加NaOH溶 液 向未知溶液中加入NaOH 溶液并露置在空气中 开始时生成白色Fe(OH)2沉 淀,迅速变成灰绿色,最后 变成红褐色Fe(OH)3沉淀。 Fe2++2OH-=Fe(OH)2 ↓4Fe(OH)2+O2+2 H2O=4Fe(OH)3 ②KMnO4 (H+) 溶液 向未知溶液中加入KMnO4 (H+)溶液 KMnO4(H+)紫色褪去 MnO4-+5Fe2++8H+= 5Fe3++Mn2++4H2O ③K3[Fe(CN)6] 向未知溶液中加入K3[Fe(C N)6]溶液 出现蓝色Fe3[Fe(CN)6]2沉 淀 3Fe2++2[Fe(CN)6]-=F e3[Fe(CN)6]2↓ ④KSCN溶液, 新制的氯水 加入KSCN溶液,新制的氯 水 加入KSCN溶液不显红色, 加入少量新制的氯水后,立 即显红色。 2Fe2++Cl2=2Fe3++2C l-Fe3++3SCN-=Fe(SC N)3
