地下水化学类型的舒卡列夫分类法
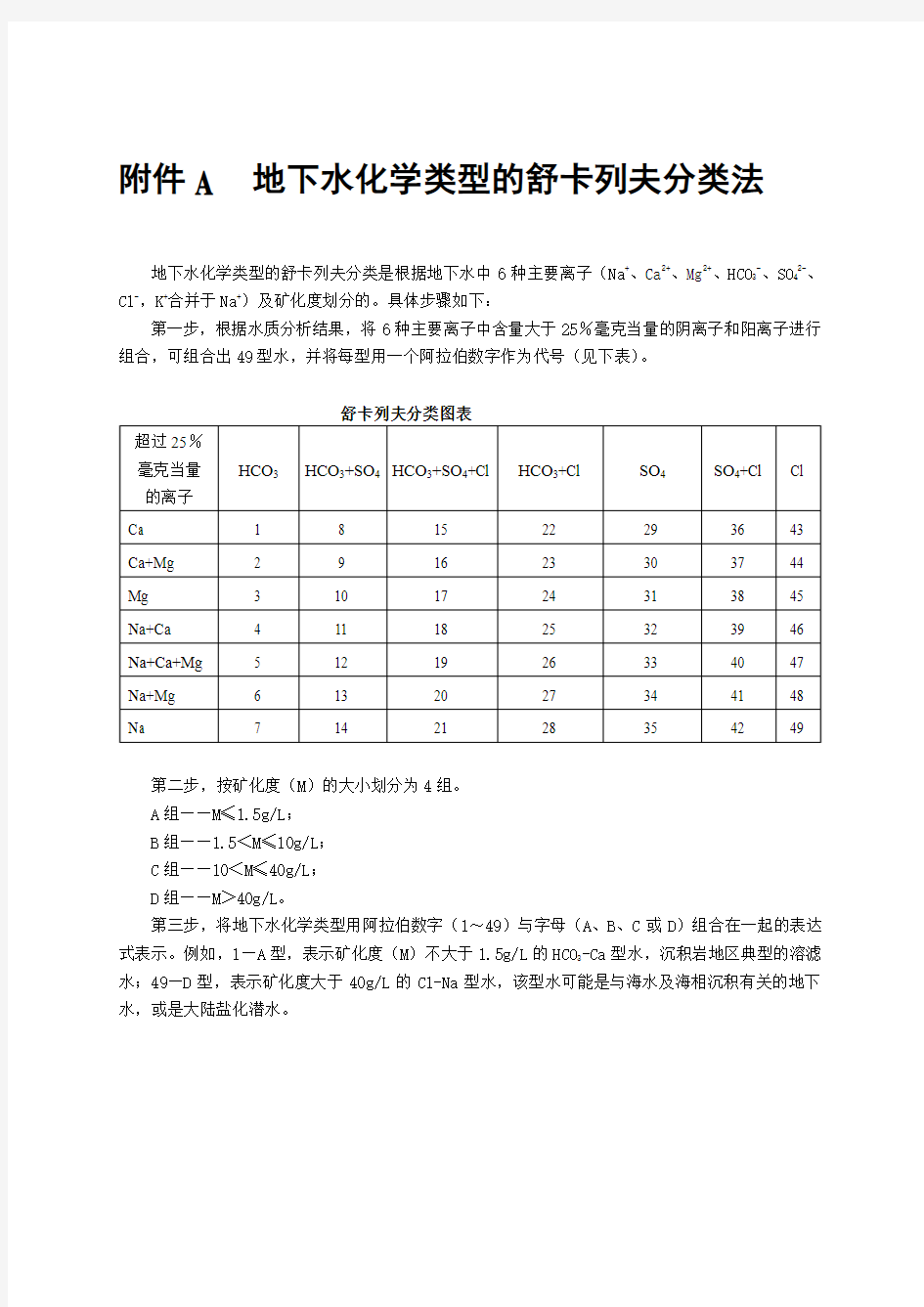

附件A 地下水化学类型的舒卡列夫分类法
地下水化学类型的舒卡列夫分类是根据地下水中6种主要离子(Na+、Ca2+、Mg2+、HCO3-、SO42-、Cl-,K+合并于Na+)及矿化度划分的。具体步骤如下:
第一步,根据水质分析结果,将6种主要离子中含量大于25%毫克当量的阴离子和阳离子进行组合,可组合出49型水,并将每型用一个阿拉伯数字作为代号(见下表)。
第二步,按矿化度(M)的大小划分为4组。
A组——M≤1.5g/L;
B组——1.5<M≤10g/L;
C组——10<M≤40g/L;
D组——M>40g/L。
第三步,将地下水化学类型用阿拉伯数字(1~49)与字母(A、B、C或D)组合在一起的表达式表示。例如,1—A型,表示矿化度(M)不大于1.5g/L的HCO3-Ca型水,沉积岩地区典型的溶滤水;49—D型,表示矿化度大于40g/L的Cl-Na型水,该型水可能是与海水及海相沉积有关的地下水,或是大陆盐化潜水。
层次分析法例题(1)
层次分析法在最优生鲜农产品流通中的应用 班级 (一)、建立递阶层次结构 目标层:最优生鲜农产品流通模式。 准则层:方案的影响因素有:c1自然属性、c2经济价值、c3基础设施、c5政府政策。 方案层:设三个方案分别为:A1农产品产地一产地批发市场一销地批发市场一消费者、A2农产品产地一产地批发市场一销地批发市场一农贸市场一消费者、A3农业合作社一第三方 物流企业一超市一消费者(本文假设农产品的生产地和销地不在同一个地区)。 。 目标层:G:最优生鲜农产品流通模式 自经基政 准则层:然济础府属价设政性值施策 方案层:A A2A3 1 图 3— 1 递阶层次结构 (二)、构造判断 (成对比较 )矩阵 所谓判断矩阵昰以矩阵的形式来表述每一层次中各要素相对其上层要素的相对重要程度。为
了使各因素之间进行两两比较得到量化的判断矩阵,引入1~9 的标度,见表 标度 a定义 ij 1i 因素与 j 因素同等重要 3i 因素比 j 因素略重要 5i 因素比 j 因素较重要 7i 因素比 j 因素非常重要 9i 因素比 j 因素绝对重要 2,4,6,8为以上判断之间的中间状态对应的标度值 倒数若 i因素与 j 因素比较,得到判断值为, a ji=1/a ij,a ii=1 为了构造判断矩阵,作者对 6 个专家进行了咨询,根据专家和作者的经验,四个准则下的两两比较矩阵分别为: G c1 c2 c3 c4 c1 A1 A2 A3c1c2c3c4 1853 1/811/21/6 1/5211/3 1/3631 A1A2A3 11/31/9 311/8 981
c2 A1 A2 A3 c3 A1 A2 A3 c4 A1 A2 A3 A1A2A3 139 1/318 1/91/81 A1A2A3 129 1/217 1/91/71 A1A2A3 11/31/9 311/7 971 (三)、层次单排序及其一致性检验 层次单排序就是把本层所有要素针对上一层某一要素,排出评比的次序,这种次序以相对的数值大小来表示。 对应于判断矩阵最大特征根λ max 的特征向量,经归一化 (使向量中各元素之和等于 1) 后记为W。 W的元素为同一层次因素对于上一层次因素某因素相对重要性的排序权值,这一过程 称为层次单排序。 能否确认层次单排序,需要进行一致性检验,所谓一致性检验是指对 A 确定不一致的允许范围。 由于λ连续的依赖于a ij,则λ比n大的越多,A的不一致性越严重。用最大特征值对 应的特征向量作为被比较因素对上层某因素影响程度的权向量,其不一致程度越大,引起的判断误差越大。因而可以用λ― n 数值的大小来衡量 A 的不一致程度。
化学分析用各种溶液的浓度表示方法和标签内容格式
化学分析用各种溶液的浓度表示方法和标签内容格式 溶液浓度是指在一定质量或一定体积的溶液中所含溶质的量.正确表示各种溶液浓度及正确书写标签内容是搞好检测工作的基本规范要求之一.国际标准化组织ISO,国际理论化学与应用化学联合会IUPAC和我国国家标准GB都作出相关规定.现结合日常工作实践,就化学分析用各种溶液的浓度表示方法和标签内容格式作一介绍,以满足实验室认可对化学分析用各种溶液的浓度表示方法和标签内容书写格式的要求. 1 标准滴定溶液 standard volumetric solution 1.1 定义 已知准确浓度的用于滴定分析用的溶液. 1.2 浓度表示方法 1.2.1 物质的量浓度 a. 定义:单位体积中所含溶质B的物质的量. b. 物质的量浓度符号:cB. c. 物质的量浓度单位:计量单位为"mol/m3"及其倍数,实验室中常用的单位是"mol/L"或 1mol/dm3. d. 说明:物质的量的SI基本单位是摩尔 (单位符号为"mol"),其定义如下:摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg碳-12数目相等。在使用摩尔时,基本单元应予指明,可以是原子,分子,离子,电子及其他粒子,或是这些粒子的特定组合.因此,在使用物质的量浓度时也必须指明基本单元. e. 实例 c(NaOH)=0.1015mol/L氢氧化钠溶液,小括号内的NaOH是指溶液中溶质的基本单元,c(NaOH)是表示基本单元为NaOH的物质的量浓度.等号右边的0.1015mol/L表示物质的量浓度数数值为0.1015摩尔每升,即每升含氢氧化钠1×氢氧化钠分子量×0.1015克. c(1/2H2SO4)=0.2042mol/L硫酸溶液,表示基本单元为1/2H2SO4的物质的量浓度为0.2042摩尔每升.即每升含硫酸1/2×硫酸分子量×0.2042克. c(1/5KMnO4)=0.1000mol/L高锰酸钾溶液,表示基本单元为1/5KMnO4的物质的量浓度为 0.1000摩尔每升.即每升含高锰酸钾1/5×高锰酸钾分子量×0.1000克. c(1/6K2Cr2O7)=1.0042mol/L重铬酸钾溶液,表示基本单元为1/6 K2Cr2O7的物质的量浓度为1.0042摩尔每升.即每升含重铬酸钾1/6×重铬酸钾分子量×1.0042克. c(1/2Ca2+)=1.0035mol/L钙阳离子溶液,表示基本单元为1/2 Ca2+的物质的量浓度为1.0035摩尔每升.即每升含钙阳离子1/2×钙原子量×1.0035克. 1.2.2 质量浓度 a. 质量浓度定义:作为溶质的物质的质量除以混合物(即溶液)体积. b. 质量浓度符号:ρB B代表作为溶质的物质. c. 质量浓度单位:计量单位为"kg/m3","kg/L"(1kg/L=103kg/ m3=1kg/d 实验室常用"g/L","mg/L","mg/mL","μg/mL"等. d. 质量浓度表示法实例: ρB表示法: ρ(Na2CO3)=0.5021mg/mL碳酸钠标准滴定溶液,表示碳酸钠标准滴定溶液的质量浓度为 0.5021毫克每毫升.
化学式的计算J
1.10 化学式综合计算 姓名: 日期: [知识要点] 化学式计算类型: 一. 基本计算 计算相对分子质量、元素质量比、元素的质量分数 相对分子质量等于化学式中各原子相对原子质量的总和.其中结晶水合物的相对分子质量等于无水物的相对分子质量与结晶水相对分子质量的总和. 化合物中各元素的质量比,等于化学式中各元素原子的相对原子质量总和之比.两种元素组成的化合物中两个元素质量比也等于两元素相对原子质量之比乘以原子个数比 R 元素的质量分数=×100% 根据这个关系式,可以计算R 元素的质量分数,也可以计算物质的相对分子质量或化学式中某元素的相对原子质量及原子个数,还可以比较不同物质中某元素质量分数的大小. 例1. 在某些番茄酱、辣椒酱等食品中发现含有一种色素苏丹红(C 16H 12N 2O ),它能造成人体内肝脏细胞的DNA 突变,显现致癌的特性,目前多数国家都已禁止其作为食品添加剂使用。试计算: (1)苏丹红的相对分子质量为______________。 (2)苏丹红中C 、H 、N 、O 四种元素的质量比为______________。 (3)苏丹红中氮元素的质量分数为______________。 相对分子质量 的原子个数化学式中的相对原子质量R R
二. 逆向计算 1. 由化合物中元素的质量比或质量分数推求物质的化学式(或原子个数比) ×相对原子质量之比 原子个数比元素质量比 相对原子质量之比÷ 化学式中能直接看出原子个数比,乘以相对原子质量之比就能算出元素质量比.反之,要确定某化合物化学式,只需根据上述公式确定原子个数比即可. 通过原子个数比或元素质量比推导纯净物的化学式,关键在于掌握解题方法。确定纯净物的化学式,最根本的就是确定组成元素和原子个数(比),通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),可推测化学式。 关系如下: 例2. 一种与金刚石硬度相近的新型无机非金属材料M,它与A、B两种非金属元素组成,其中A在地壳中含量占第二位,B在空气中含量最多。A的元素符号是___________;该无机非金属材料中A、B元素的质量比为3∶2,则M的化学式为___________。 2. 由相对分子质量、元素的质量比或元素的质量分数计算化合物中某元素的相对原子质量 例3. 已知某+3价金属氧化物中氧元素的质量分数为30%,该金属的相对原子质量为()。 A. 40 B. 64 C. 56 D. 127 三. 综合计算 1. 样品纯度的计算 例4. 小明替他爸爸到街上买化肥,在某产品标签上有如下的广告: (1)根据你所学的化学知识,通过计算判断此广告是否真实。 (2)后来质检局到该销售点取该肥料检测,其含氮量为 3.5%,请你帮质检局的检测人员算一下该肥料的纯度。 解析:本题以揭发虚假广告为情景考查化学式的综合计算。可先通过NH4NO3的化学式计算出其中氮元素的质量分数,然后和标签上的含氮量进行比较,即可辨别广告是否真实;肥料的纯度可用公式:
水化学分析资料整理(完成)
水化学分析资料整理 一、学习目的 熟悉水化学分析资料整理的基本方法。 二、各种离子浓度单位的换算 1、离子的毫克当量浓度(meq/L) 离子的毫克浓度(mg/L) 离子毫克当量浓度(meq/L) = 离子的毫克当量 2、离子的毫克当量百分数浓度(meq%) 该离子毫克当量浓度(meq/L) 某阴(阳)离子毫克当量百分数(meq%) = ×100% 阴(阳)离子毫克当量浓度总和 3、离子的毫摩尔浓度(mmol/L) 离子的毫克浓度(mg/L) 离子的毫摩尔浓度(mmol/L) = 离子的毫摩尔质量(mg/mmol) 4、离子的毫摩尔百分数浓度(mmol%) 该离子毫摩尔浓度(mmol/L) 某阴(阳)离子毫摩尔百分数浓度(mmol%) = 100% 阴(阳)离子毫摩尔浓度总和 5、离子的毫克当量百分数浓度与离子的毫摩尔百分数浓度的换算 X-(+) meq ×X-(+)meq/L X-(+) mmol% = ×100% X-(+) m mol × ∑X i-(+)mmol/L X-(+) mmol × X-(+)mmol/L X-(+) meq% = ×100% X-(+)meq × ∑ X i-(+)meq/L 式中:X-(+)为某种阴(阳)离子。ΣX-i(+)为阴(阳)离子总和。 三、水化学分析结果误差检验 根据水中各成分化合当量相等原理, 水中阴、阳离子当量总数应当相等。因此, 由下面式子就可检验水分析结果的可靠程度: ∑k —∑a e = ×100% ∑k + ∑a 式中:e 为分析误差值;
∑k 为阴离子总含量(meq%); ∑a 为阳离子总含量(meq%)。 一般全分析的允许误差<2%, 简分析<5%, 否则结果不能采用。 四、水的硬度 1、总硬度(H) 为水中钙、镁离子含量的总和。可由德国度(Ho)或mg/L表示: H = [ Ca2+ ] + [ Mg2+ ] 2、暂时硬度 根据钙、镁离子与重碳酸根离子的当量关系可知: (1)、当r(Ca2+ + Mg2+) ≤ rHCO3-时, 暂时硬度等于总硬度。 (2)、当r(Ca2+ + Mg2+) > rHCO3-时, 暂时硬度等于重碳酸根浓度, 即rHCO3-。 3、永久硬度 永久硬度= 总硬度—暂时硬度 五、水化学成分的库尔洛夫式表示方法 库尔洛夫式是以类似数学分式的形式来表示地下水化学成分。其方法为: 1、将阴、阳离子分别标示在横线上、下, 按毫克当量百分数自大而小的顺序排列, 小于10%的离子不予标示。 2、横线前依次标示气体成分、特殊成分及矿化度(用M表示), 单位均为g/L。 3、横线后以字母t为代号, 表示水温, 单位为℃。 4、式中各成分含量一律标于该成分符号的右下角, 原子数则移至右上角。即: 阴离子成分原子数毫克当量百分数 气体成分 含量特殊成分 含量 M 含量 t 水温℃ 阳离子成分 毫克当量百分数 六、舒卡列夫的水化学类型分类 1、根据水中各阴、阳离子含量, 将大于25%毫克当量百分数的离子参加分类命名。阴离子在前, 阳离子在后, 含量大的在前, 含量小的在后, 中间用短横线相连来对地下水化学类型进行命名。共分49种类型, 每型用一个阿拉伯数字表示。 2、根据矿化度大小, 将地下水分为四组:A组为矿化度<1.5g/L; B组为1.5—10g/L; C组为10—40g/L; D组为>40g/L。 3、各水型的代号在前, 矿化度划分的组在后, 中间用一短横线相连。
常用的地下水分类方法
一、常用的地下水分类方法 (一)按赋存形式和物理性质划分 1.结合水 被分子力吸附在岩土颗粒周围形成极薄的水膜,可抗剪切,不受重力影响,不能传送静水压力,在110°C消失,主要存在于粘土中,影响其物理力学性质。 2.毛细管水 赋存于岩土毛细孔中,受毛细管力和重力的共同作用,可被植物吸收,影响岩土的物理力学性质,会引起沿海地区和北方灌区的土地盐碱化。 3.重力水 赋存于岩土孔隙、裂隙和洞穴中,不能抗剪切,受重力作用,可以传送静水压力。 结合水、毛细管水属专门研究课题,在水文地质勘察中,所指地下水一般是重力水。 (二)按含水介质特征划分 1.松散岩类孔隙水 主要赋存于第四系、第三系松散~半固结的碎石土和砂性土的孔隙中。 2.碎屑岩类裂隙孔洞水 主要赋存于中、新生代红色岩层的孔隙、孔洞中。 3.碳酸盐岩类裂隙溶洞水(岩溶水) 主要赋存于古、中生代灰岩、白云岩的裂隙溶洞中,分为: (1)裸露型:灰岩、白云岩基本上出露。 (2)覆盖型:灰岩、白云岩被第四系松散层覆盖。 (3)埋藏型:灰岩、白云岩被非碳酸盐岩类覆盖。 4.火山岩裂隙孔洞水
赋存于火山岩的裂隙、孔隙、气孔、气洞(熔岩隧道)中,在广东主要分布于雷州半岛。 5.基岩裂隙水 (1)块状岩类裂隙水 赋存于侵入岩、混合岩、正变质岩的裂隙中。 (2)层状岩类裂隙水 赋存于沉积岩、副变质岩的裂隙中。 (三)按埋藏条件和水力特征划分 1.上层滞水 位于不连续隔水层之上的季节性潜水。 2.潜水 位于地表下第一个隔水层之上,具自由水面的水。 3.承压水 充满两层隔水层之间,具压力水头的水。 (四)按地下水矿水度划分 1.淡水:M﹤1g/L。 2.咸水:M≥1g/L,分为: (1)微咸水:1g/L≤M﹤3g/L; (2)半咸水:3g/L≤M﹤10g/L; (3)咸水:M≥10g/L,可分为: ①盐水:10g/L≤M﹤50g/L; ②卤水:M≥50g/L。
化学化学方程式的计算试题类型及其解题技巧
化学化学方程式的计算试题类型及其解题技巧 一、中考化学方程式的计算 1.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100 g 该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO 3溶液120 g ,反应结束后溶液的总质量是215.6 g 。试计算下列问题: (知识卡片) ①洁厕灵有效成分是HCl ,洁厕灵中其它成分均不跟NaHCO 3反应。 ②HCl 和NaHCO 3反应的化学方程式为HCl+NaHCO 3=NaCl+H 2O+CO 2↑ (1) 产生的二氧化碳质量为_________克。 (2) 该品牌洁厕灵中HCl 的质量分数是多少?_____(写出计算过程) 【答案】4.4 3.65% 【解析】 【分析】 盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。 【详解】 (1) 由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故产生的二氧化碳质量为100g+120g-215.6g=4.4g 。 (2) 设100 g 该品牌洁厕灵中HCl 的质量为x 322HCl +NaHCO =NaCl +H O +CO 36.544x 4.4g ↑ 36.544=x 4.4g x=3.65g 该品牌洁厕灵中HCl 的质量分数为:3.65g 100%=3.65%100g ? 答:该品牌洁厕灵中HCl 的质量分数为3.65%。 【点睛】 =100%?溶质质量溶质质量分数溶液质量 2.为测定某过氧化钠样品的纯度,将2g 该样品与足量水发生如下反应(杂质不参与反应) :22222Na O + 2H O=4NaOH+O ↑ 。生成气体质量与时间的关系如图所示。计算该样品中过氧化钠的质量分数。____________
ABC分类法例题
某企业保持有10种商品的库存,有关资料如表所示,为了对这些库存商品进行有效的控制和管理,该企业打算根据商品的投资大小进行分类。 (1)请您选用ABC分析法将这些商品分为A、B、C三类? (2)并给出A类库存物资的管理方法? 表
A类:资金金额占总库存资金总额的60%-80%, 品种数目占总库存品种总数的5%-20%; B类:资金金额占总库存资金总额的10%-15%, 品种数目占总库存品种总数的20%-30%; C类:资金金额占总库存资金总额的0%-15%, 品种数目占总库存品种总数的60%-70%; 根据已知数据,按照商品所占金额从大到小的顺序排列(首先要把10种商品各自的金额计算出来),计算结果如下表一: 表一: 根据以上表格的计算结果,按照ABC分类管理的方法,(草稿纸上还要有计算比较,才能得到最后结果)可以对此企业的库存如下分类:见表二:
表二: (2)对于A类库存,即对b和j两种商品,企业需对它们定时进行盘点,详细记录及经常检查分析货物使用、存量增减和品质维持等信息,加强进货、发货、运送管理,在满足企业内部需要和顾客需要的前提下,维持尽可能低的经常库存量和安全库存量,加强与供应链上下游企业合作来控制库存水平,既要降低库存,又要防止缺货,加快库存周转。
练习: 某企业保持有9种商品的库存,有关资料如下表所示,为了对这些库存商品进行有效的控制和管理,该企业打算根据商品的投资大小进行分类。 (1)请您选用ABC分析法将这些商品分为A、B、C三类? (2)并给出A类库存物资的管理方法? 表
练习解:(1) ABC分类管理方法: A类:资金金额占总库存资金总额的60%-80%, 品种数目占总库存品种总数的5%-20%; B类:资金金额占总库存资金总额的10%-15%, 品种数目占总库存品种总数的20%-30%; C类:资金金额占总库存资金总额的0%-15%, 品种数目占总库存品种总数的60%-70%; 根据已知数据,按照商品所占金额从大到小的顺序排列, 计算结果如下表一: 表一: 根据以上表格的计算结果,按照ABC分类管理的方法,可以对此企业的库存如下分类:见表二:
有关化学式计算的几种典型例题
1.计算CuSO4·5H2O的相对分子质量 分析:CuSO4·5H2O组成中,是由CuSO4和5个H2O分子组成的,因此是二者相对质量之和。 解答:CuSO4·5H2O的相对分子质量=64+32+16×4+(1×2+16)×5=250 2.计算NH4NO3中所含各元素的质量比 分析:从NH4NO3的化学式知:组成硝酸铵的三种元素是N、H、O,在一个NH4NO3中分别计算各元素的相对质量比即硝酸铵中各元素的质量比。 解答: ∵m N :m H:m O=(14×2):(1×4):(16×3) =28 : 4 : 48 =7 : 1 : 12 ∴N、H、O三种元素的质量比为7:1:12 3.某黄铁矿中含FeS2为72%,计算该黄铁矿中硫元素的质量分数是() A.36% B.38.4% C.42.6% D.48% 分析1:黄铁矿中含FeS2为72%,其余为杂质,再根据化学式算出FeS2中硫的质量分数。 设取黄铁矿100克,则其中FeS2的质量为:100×72%=72克,在72克FeS2中所含硫的质量为: 分析2:也可以根据对应关系计算:设100克黄铁矿中含硫的质量为x。 对应关系:黄铁矿~含FeS2~含2S 100克100×72%=72克x克 120 32×2 列出比例式:x=38.4克 解:本题的正确答案应选B. 4.有气肥(化学式为NH4HCO3)样品50克,其中含NH4HCO3为96%,则该气肥样品中所含氮元素的质量为()
A.17克 B.8.5克 C.6.5克 D.4克 分析1:样品中含NH4HCO3 96%,说明样品为不纯净的物质。利用纯度可以计算出50克样品中纯NH4HCO3的质量,再根据气肥的化学式算出所含氮元素的质量分数,利用氮元素质量分数便可计算氮元素的质量。 50克气肥样品中所含纯NH4HCO3的质量:50×96%=48克 NH4HCO3中氮元素的质量分数: ∴50克样品中所含氮元素的质量:48×17.7%=8.5克 分析2:也可以根据对应关系计算,设50克气肥样品中含氮元素的质量为x。 对应关系:气肥样品~含NH4HCO3~含N 79 14 50克50×96%=48克x克 列出比例式:x=8.5克 解答:本题的正确答案应选B。 某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21:8,原子个数5. 比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为() A.24 B.27 C.56 D.65 分析:由于已知氧化物中R原子与氧原子的个数比,可以写出氧化物的化学式;又知R元素和氧元素的质量比,根据化学式可以求算出元素R的相对原子质量。 设元素R的相对原子质量为x ∵在氧化物中R原子与氧原子的个数比为3:4 ∴R元素所形成的氧化物的化学式为:R3O4 又∵氧元素的相对原子质量为16,且二者之间的质量比为21:8 ,x=56 解答:本题的正确答案应选C。 6.某化合物由Na、S、O三种元素组成的,其钠元素在化合物中的质量分数为32.4%,硫元素在化合物中的质量分数为22.5%,且该化合物的式量为142,那么该化合物的化学式为____ ______。
层次分析法例题94055
。数 学 建 模 作 业 班级:高分子材料与工程 姓名:林志许、朱金波、任宇龙
。 学号:1211020115、1211020126、1211020134 层次分析法 某物流企业需要采购一台设备,在采购设备时需要从功能、价格与可维护性三个角度进行评价,考虑应用层次分析法对3个不同品牌的设备进行综合分析评价和排序,从中选出能实现物流规划总目标的最优设备,其层次结构如下图所示。以A 表示系统的总目标,判断层中1B 表示功能,2B 表示价格,3B 表示可维护性。1C ,2C ,3C 表示备选的3种品牌的设备。 解题步骤: 1、标度及描述 人们定性区分事物的能力习惯用5个属性来表示,即同样重要、稍微重要、较强重要、强烈重要、绝对重要,当需要较高精度时,可以取两个相邻属性之间的值,这样就得到9个数值,即9个标度。 为了便于将比较判断定量化,引入1~9比率标度方法,规定用1、3、5、7、9分别表示根据经验判断,要素i 与要素j 相比:同样重要、稍微重要、较强重要、强烈重要、绝对重要,而2、4、6、8表示上述两判断级之间的折衷值。 目标层 判断层 方案层 图 设备采购层次结构图
注:a ij 表示要素i与要素j相对重要度之比,且有下述关系: a ij =1/a ji ; a ii =1; i,j=1,2,…,n 显然,比值越大,则要素i的重要度就越高。 2、构建判断矩阵A 判断矩阵是层次分析法的基本信息,也是进行权重计算的重要依据。根据结构模型,将图中各因素两两进行判断与比较,构造判断矩阵: ●判断矩阵B A-(即相对于物流系统总目标,判断层各因素相对重要性比较)如表1所示; ●判断矩阵C B- 1(相对功能,各方案的相对重要性比较)如表2所示; ●判断矩阵C B- 2(相对价格,各方案的相对重要性比较)如表3所示; ●判断矩阵C B- 3(相对可维护性,各方案的相对重要性比较)如表4所示。 B A- C B- 1 C B- 3 3、计算各判断矩阵的特征值、特征向量及一致性检验指标 一般来讲,在AHP法中计算判断矩阵的最大特征值与特征向量,必不需
水的化学与微生物基础知识
水的化学与微生物基础知识 1. 物理和化学性质 A.色 水本身是无色的,只有在水层很深时才显示出深蓝色,但当其受到污染时会有颜色。 B.悬浮物与浊度 水中的悬浮物是各种水处理工艺中都需要监督的项目,否则会影响水处理设备的正常运行。测定悬浮物较易的方法是测定浊度,浊度的大小除了与水中的悬浮固体有关外,还指示水中胶体,它实质上是这两类物质的综合指标。 C.溶解固形物 溶解固形物是指水中除溶解气体外各种溶解物的总量。它是一种理论上的指标。 E.含盐量 含盐量表示水中含有溶解盐类的总和,有两种表示法:其一是摩尔表示法,即将水中各种阳离子(或各种阴离子)均按带一个电荷的离子为基本单元,计算其含量( mmol/L),然后将它们全部相加;其二是重量表示法,即将水中各种阴、阳离子的含量换算成mg/L.然后全部相加。 F.矿物残渣 矿物残渣是表示水中溶有矿物质的总量。含盐量和矿物残渣量两种指标都是根据水全分析结果进行计算的,不易用于运行监督,因为全分析是繁重的工作,费时又费力。 ● 蒸发残渣 这是指将过滤过的水样在一定条件下蒸干所得的残渣量。它与水中溶解固形物相似,但不完全相等,因为在测试条件下( 105~110℃).有许多物质的湿分和结晶水不能除尽,某些有机物会发生氧化。在蒸发残渣中,水中原有的碳酸氢盐都转变成了碳酸盐。 ●灼烧残渣 这表示蒸发残渣在8000℃时灼烧所得到的残渣量。蒸发残渣量和灼烧残渣量之差称为灼烧碱量,它大致的表示有机物量。 G.电导率 衡量水中含盐量最简便和迅速的方法是测定水的电导率,因为组成天然水含盐量的主要物质为离子,而离子具有导电性能,所以,水溶液的导电率可以间接的表示出溶解盐的含量。水本身的电导率非常小,所以只要水中含有少量杂质离子,它的电导率便可反映水中杂质离子的多少。一般情况下水的电导率越大,其含盐量也就越大,但仅靠电导率不能计算含盐量,因为水电导率的大小除了与水中离子含量有关系,还决定于离子的本质。电导是电阻的倒数,电导率是指一定
地下水质量分类指标表
表1 地下水质量分类指标 项目序号类别标准值项目Ⅰ类Ⅱ类Ⅲ类Ⅳ类Ⅴ类 1 色(度) ≤5≤5≤15≤25>25 2 嗅和味无无无无有 3 浑浊度(度) ≤3≤3≤3≤10>10 4 肉眼可见物无无无无有 5 pH 6.5~8.5 5.5~6.5,8.5~9<5.5,>9 6 氨氮(NH4)(mg/L) ≤0.02≤0.02≤0.2≤0.5>0.5 7 高锰酸盐指数(mg/L) ≤1.0≤2.0≤3.0≤10>10 8挥发性酚类(以苯酚计)(mg/L) ≤0.001≤0.001≤0.002≤0.01>0.01 9铬(六价)(Cr6+)(mg/L) ≤0.005≤0.01≤0.05≤0.1>0.1 10氰化物(mg/L) ≤0.001≤0.01≤0.05≤0.1>0.1 11硝酸盐(以N计)(mg/L) ≤2.0≤5.0≤20≤30>30 12亚硝酸盐(以N计)(mg/L) ≤0.001≤0.01≤0.02≤0.1>0.1 13阴离子合成洗涤剂(mg/L) 不得检出≤0.1≤0.3≤0.3>0.3 14 总硬度(以CaCO3,计)(mg/L) ≤150≤300≤450≤550>550 15 总大肠菌群(个/L) ≤3.0≤3.0≤3.0≤100>100 16 细菌总数(个/L) ≤100≤100≤100≤1000>1000 17 碘化物(mg/L ≤0.1 ≤0.1 ≤0.2 ≤1.0 >1.0 18 氟化物(mg/L) ≤1.0≤1.0≤1.0≤2.0>2.0 19 氯化物(mg/L) ≤50≤150≤250≤350>350 20 硫酸盐(mg/L) ≤50≤150≤250≤350>350 21 铜(Cu)(mg/L) ≤0.01≤0.05≤1.0≤1.5>1.5 22 锌(Zn)(mg/L) ≤0.05≤0.5≤1.0≤5.0>5.0 23 铅(Pb)(mg/L) ≤0.005≤0.01≤0.05≤0.1>0.1 24 镉(Cd)(mg/L) ≤0.0001≤0.001≤0.01≤0.01>0.01 25 铁(Fe)(mg/L) ≤0.1≤0.2 ≤0.3≤1.5>1.5 26 锰(Mn)(mg/L) ≤0.05≤0.05≤0.1≤1.0>1.0 27 镍(Ni)(mg/L) ≤0.005≤0.05≤0.05≤0.1>0.1 28 铍(Be)(mg/L) ≤0.00002≤0.0001≤0.0002≤0.001>0.001 29 钡(Ba)(mg/L) ≤0.01≤0.1≤1.0≤4.0>4.0 30 钼(Mo)(mg/L) ≤0.001≤0.01≤0.1≤0.5>0.5 31 钴(Co)(mg/L) ≤0.005≤0.05≤0.05≤1.0>1.0 32 砷(As)(mg/L) ≤0.005≤0.01≤0.05≤0.05>0.05 33 硒(Se)(mg/L) ≤0.01≤0.01≤0.01≤0.1>0.1 34 汞(Hg)(mg/L) ≤0.00005≤0.0005≤0.001≤0.001>0.001 35 溶解性总固体(mg/L) ≤300≤500≤1000≤2000>2000 36 滴滴滴(μg/L) 不得检出≤0.005≤1.0≤1.0>1.0 37 六六六(μg/L) ≤0.005≤0.05≤5.0≤5.0>5.0 38 总σ放射性(Bq/L) ≤0.1≤0.1≤0.1>0.1 >0.1
化学式计算的解题技巧
专题六有关化学式的计算[知识网络] [典例剖析] 例1、最近,科学家研究确认,一些零食特别是油炸食品含有致癌物质丙烯酰胺(C 3H 5 ON)。丙 烯酰胺的相对分子质量__________,碳、氢、氧、氮元素的质量比为__________,氮元素的质量分数为__________。 解析: 单纯计算熟悉物质的相对分子质量、各元素质量比和元素质量分数的题目已被中考淘汰,取而代之的是以这类计算作为传播最新科技、最新发现或普及健康知识等内容的载体。背景材料只需大致了 解,关键是提取解题的有效信息——丙烯酰胺的化学式(C 3H 5 ON)。在计算中注意所给元素的顺序、 数准各原子的数目,并保证计算准确。 C 3H 5 ON的相对分子质量:12×3+1×5+16+14=71 C 3H 5 ON中碳、氢、氧、氮四种元素的质量比=12×3∶1×5∶16∶14=36∶5∶16∶14 C 3H 5 ON中氮元素的质量分数:×100%=%
71;36∶5∶16∶14;% 例2、为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐。碘盐就是在食盐中加入一 定量的碘酸钾(KIO 3 )。1000g碘盐中约含碘。(相对原子质量:K-39 I-127 O-16)(1)__________g碘酸钾中含有碘。(保留小数点后3位) (2)成人每天约需×10-4g碘,假设这些碘是从碘盐中摄取的,成人每天需要食用碘盐______g。 解析: 碘盐中碘元素的质量=碘盐中碘酸钾的质量×碘酸钾中碘元素的质量分数 (1)碘酸钾中碘元素的质量分数为:×100%=% 需碘酸钾的质量为:/%= (2)需要食用碘盐的质量为:×10-4g/x=/1000g x= 答案: (1) (2) 例3、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。营养学家指出每天铝的安全摄入量为每千克体重。请回答下列问题: (1)传统食品加工过程中,一般在1kg面粉中加入1g明矾(已知:明矾的化学式为KAl(SO 4) 2 ·12H 2 O, 其相对分子质量是474;1g = 1000mg)。试求: ①1g明矾中含铝元素__________mg; ②该200g食品中含铝元素__________mg; ③体重为50kg的某同学一天食用该食品150g,他摄入的铝量______(选填“已”或“未”)超过安全摄入量。 (2)为降低铝的摄入量,请你提出两条建议。
高三地理重要知识点地下水
高三地理重要知识点:地下水 1.类型:地下水按照埋藏条件划分为潜水和承压水 2.地下水的来源: ①主要是大气降水。降雨历时长,强度不大,地形平缓,植被良好的情况,对地下水补给最有利。 ②河湖水补给。河湖水位高于潜水面时,河湖水补给两岸潜水。反之,潜水补给河湖水。黄河下游只有河水补给地下水。 ③凝结水:在干旱地区,大气降水很少,主要是大气中水汽直接凝结渗入地下。 ④原生水:主要与岩浆活动有关,数量很少。 3.地下水的问题与保护: ①不合理灌溉——土壤盐渍化——科学管理。 ②过量开采——地下漏斗区,地面下沉;沿海海水入侵,地下水水质变坏。——及时人工回灌。 ③保护自流水补给区的自然环境。 4.潜水面的形状及其表示方法 潜水面通常是一个起伏的曲面,一般倾向于邻近的低洼地区,即潜水的排泄区,如冲沟、河谷等。它的起伏与地貌大体一致,但比地貌的起伏要小些。山区潜水面的坡度较大,可达百分之几。潜水面的形状可以用潜水剖面图和潜水等水位线图来表示。前者是在地质剖面图上,将已知各点的潜水位联接起来而成,它可以反映出潜水面形状与地貌、隔水底板及含水层岩性的关系等。所谓潜水等水位线图就是潜水面的等高线图。它是根据潜水面上各点的水类型 位置 流向 补给 分布 深度和水质 潜水 (重力水) 地表以下第一个隔水层以上 从高处流向低处 雨水和地表水 分布区与补给区一致 埋藏浅,易开采,易污染 承压水 (自流水) 上下两个隔水层之间 从压力大处流向压力小处 潜水 分布区与补给区不一致 埋藏深,水质好,流量稳定
位标高绘制成的,一般绘制在地形图上。绘制的方法与绘制地形等高线的方法类似。 根据潜水等水位线图,可以解决下列问题:(1)潜水的流向:垂直于潜水等水位线从高水位向低水位的方向,就是潜水的流向。(2)潜水埋藏深度:将地形等高线和潜水等水位线绘于同一张图上时,则等高线与等水位线相交之点的潜水埋藏深度即为二者高程之差。(3)潜水于地表水的补给关系:根据潜水等水位线和地表水的水位高程便可以确定。 5.泉是地下水的天然露头,无论哪一种地下水都可以在适当的条件下涌出地表形成泉。泉的形成还与地质构造有关,分布最广泛的泉总是与石灰岩地区的单面山构造相联系;在断层发育的岩区,泉可以沿断层一带的透水层上升涌出地表。 6.澳大利亚盆地位于澳大利亚东部,又称自流盆地。该盆地的地质构造是一个巨大的向斜盆地。水层埋藏在上下两个隔水层之间,为承压水。含水层在湿润的东部山地出露,向西倾斜,一部分渗入地下的降水顺着倾斜的含水层流向盆地中部。盆地中部为承压水的承压区,地下水承受一定的压力,在盆地地势较低处打井,有的可以自然喷出,形成自流井。 澳大利亚自流盆地是世界上最大的自流盆地。自流井的盐度高,不宜用来灌溉农田,一般可作牲畜饮用水,因此对畜牧业发展非常有利。 7.深层地下水与浅层地下水、承压水与潜水不是一回事。深层地下水与浅层地下水是依据地下水的埋藏深度来区分的,而潜水与承压水是依据埋藏条件来区分的。
化学式和化学方程式计算(全部类型题目) (1)
化学方程式 化学方程式是用化学式表示化学反应的式子。化学方程式不仅表达了物质在质的方面的关系,即什么是反应物质和什么是生成物质,而且还表达物质在量的方面上的变化关系,即反应物质和生成物质的质量关系,同时包括反应物质和生成物质的微粒个数关系。这是我们计算化学方程式的理论依据。 我们将化学方程式计算分为以下几个类型: 一、有关反应物和生成物质量的的计算 1,通过电解水值得的氢气可用于电子工业制备高纯硅。若要制得0.4kg氢气,理论上消耗水的质量是多少? 2、 二、根据质量守恒定律利用差量法计算相关物质的质量以及质量分数(或纯度) 1、氯酸钾与二氧化锰的混合物26.5克,放入试管中加热,完全反应后剩余物质为16.9克,求: (1)生成氧气多少克? (2)有多少克氯酸钾发生反应? (3)剩余固体中的物质是什么?质量各是多少克? 2、实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5克, 加入1克MnO2,完全反应后称得剩余物的质量为41.9克。 计算:(1)反应中放出氧气的质量。 (2)实验中加入的过氧化氢溶液的质量分数。 3、某同学把3 g碳放在给定的氧气中充分燃烧,实验数据如下: 第一次第二次第三次 给定O2的质量 6 g 8 g 13 g 生成CO2的质量8.25 g 11 g 11 g 回答:(1)从以上数据说明,这三次实验中第______ 次恰好完全反应。 (2)第______ 次实验中,碳有剩余,剩余________g。 (3)第______ 次实验中,氧气有剩余,剩余________g。 4、氢气和氧气共5克,点燃后充分反应生成1.8克水,则原来氢气和氧气各为多少克?
ABC分类法例题
例题:ABC分类管理问题: 某企业保持有10种商品的库存,有关资料如表所示,为了对这些库存商品进行有效的控制和管理,该企业打算根据商品的投资大小进行分类。 (1)请您选用ABC分析法将这些商品分为A、B、C三类 (2)并给出A类库存物资的管理方法 表 ~
解:(1) ABC分类管理方法: A类:资金金额占总库存资金总额的60%-80%, 品种数目占总库存品种总数的5%-20%; B类:资金金额占总库存资金总额的10%-15%, 品种数目占总库存品种总数的20%-30%; C类:资金金额占总库存资金总额的0%-15%, 品种数目占总库存品种总数的60%-70%; 根据已知数据,按照商品所占金额从大到小的顺序排列(首先要把10种商品各自的金额计算出来),计算结果如下表一: ^ 表一:
| 根据以上表格的计算结果,按照ABC分类管理的方法,(草稿纸上还要有计算比较,才能得到最后结果)可以对此企业的库存如下分类:见表二: 表二: (2)对于A类库存,即对b和j两种商品,企业需对它们定时进行盘点,详细记录及经常检查分析货物使用、存量增减和品质维持等信息,加强进货、发货、运送管理,在满足企业内部需要和顾客需要的前提下,维持尽可能低的经常库存量和安全库存量,加强与供应链上下游企业合作来控制库存水平,既要降低库存,又要防止缺货,加快库存周转。
? 练习: 某企业保持有9种商品的库存,有关资料如下表所示,为了对这些库存商品进行有效的控制和管理,该企业打算根据商品的投资大小进行分类。 (1)请您选用ABC分析法将这些商品分为A、B、C三类 (2)并给出A类库存物资的管理方法 表
水化学类型表示方法
水化学类型表示方法. 老:水质分析结果用各种形式的指标值及化学表达式来表示:1、离子含量指标
溶解于地下水中的盐类,以各种阴、阳离子形式存在,其含量一般以mmol/L (毫摩尔/升)、mg/L(毫克/升)、me/L(毫克当量/升)表示。海水中的主要离子以单位ml/L(摩尔/升)、g/L(克/升)表示。超微量元素的离子以,其单位以mg/L(毫克/升)表示。 2、分子含量指标 溶解于地下水的气体和胶体物质,如CO、SiO,其含量一般用单位
mmol/L、22mg/L表示。 3、综合指标 氢离子浓度(pH值)、酸碱度、硬度、矿化度四项指标,集中地表示了地下水的化学性质。 +],[HpH=﹣㏒pH值反映了地下水的酸碱性,由酸、碱和盐的水pH ⑴值:解因素所决定。pH值与电极电位存在一定的关系,影响地下水化学元素的迁移强度,是进行水化学平衡计算和审核水质分析结果的重要参数。 ⑵酸度和碱度:酸度是指强碱滴定水样中的酸至一定pH值的碱量,地下水中酸度的形成主要是未结合的CO2、无机酸、强酸弱碱盐及有机酸。碱度是指强酸滴定水样中的碱至一定pH值的酸量,地下水碱度的形成主要是氢氧化物、硫化物、氨、硝酸盐、无机和有机弱酸盐以及有机碱。酸碱度一般表示单位有mmol/L、me/L表示。 硬度:水中硬度取决于水中钙、镁和其它金属离子(碱金属除外)的含⑶. 量。总硬度:地下水中钙镁的重碳酸盐、氯化物、硫酸盐和硝酸盐的总含量。:水煮沸后呈碳酸盐形态的析出量。暂时硬度(碳酸盐
硬度) :水煮沸后,留于水中的钙盐和镁盐的含量。永久硬度(非碳酸盐硬度):地下水中碱金属钾钠的碳酸盐、重碳酸盐和氢氧化物负硬度(钠钾硬度)的含量。碳酸盐硬度+非碳酸盐硬度=总硬度暂时硬度+永久硬度= 负硬度(钠钾硬度)=总碱度-总硬度(总硬度>总碱度). H°(德国度)表示mg/Lmmol/L、、me/L、硬度一般以单位矿化度:地下水含离子、分子及化合物的总量称为矿化度,或称总矿化⑷度。
地下水污染防治区划分工作指南
附件4 地下水污染防治区划分 工作指南 (试行) 2014年10月
目次 第一章总则 (1) 1.1 编制目的 (1) 1.2 适用范围 (1) 1.3 编制依据 (1) 1.4 术语与定义 (2) 1.5 指导原则 (3) 1.6 组织编制单位 (3) 第二章工作内容与流程 (4) 2.1 工作内容 (4) 2.2 工作流程 (4) 第三章地下水污染防治区划分方法 (7) 3.1 地下水污染源荷载评估 (7) 3.2 地下水脆弱性评估 (14) 3.3 地下水功能价值评估 (19) 3.4 地下水污染现状评估 (23) 3.5 地下水污染防治区划分 (24) 第四章地下水污染防治区划分技术报告及成果图表 (29) 4.1 报告编制大纲 (29) 4.2 成果图 (29) 4.3 成果表 (31) 附录 A地下水保护区、防控区及治理区评估结果分析表(参考式样) (32) 附录 B岩溶区域地下水脆弱性评估指标说明 (35) 附录 C土地利用现状分类及说明 (40) 附录 D权重和参数敏感度分析 (45)
地下水污染防治区划分工作指南 (试行) 第一章总则 1.1编制目的 为贯彻落实《全国地下水污染防治规划(2011-2020年)》,推进我国地下水污染防治工作,规范地下水污染防治区划分工作,根据《中华人民共和国环境保护法》、《中华人民共和国水污染防治法》、《地下水质量标准》(GB/T 14848)及相关法律、法规、标准、文件,编制《地下水污染防治区划分工作指南(试行)》(以下简称“指南”)。 1.2适用范围 1.2.1 本指南适用于区域尺度地下水污染防治区划分,评估区面积一般不小于0.4万km2,精度一般不小于1:25万。 1.2.2本指南主要包括开展地下水污染防治区划分工作的主要工作内容、工作流程、技术方法、报告图集编制要求等方面。 1.3编制依据 《中华人民共和国环境保护法》 《中华人民共和国水污染防治法》 《全国地下水污染防治规划(2011-2020年)》 GB/T 14175 水文地质术语 GB/T 14848 地下水质量标准
化学化学方程式的计算试题类型及其解题技巧及解析
一、中考化学方程式的计算 1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: 计算稀盐酸中溶质质量。 【答案】 【解析】 【分析】 【详解】 根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+= 设稀盐酸中溶质质量为x 3222 CaCO2HCl=CaCl CO H O 7344 x 4.4g 73x =,x=7.3g 44 4.4g ++↑+ 答:稀盐酸中溶质质量 【点睛】 根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量 2.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~%,钢中碳的含量为 %~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示: 烧杯质量样品的质量稀盐酸的质量烧杯+剩余物的总质量 50g 注:碳既不溶于水也不与稀盐酸发生反应。 请根据相关信息完成下列计算: (1)恰好完全反应时,生成氢气的质量为_____ g; (2)样品中碳的质量分数_____(计算结果保留到%); 【答案】 %
【解析】 【分析】 【详解】 (1)根据质量守恒定律可知,恰好完全反应时,生成氢气的质量:50g++ ,故填; (2)解:设样品中铁的质量 x 22Fe +2HCl =FeCl +H 562x 0.2g ↑ 56:2=x : x= 铁合金中碳的质量分数= 5.8g-5.6g 5.8g ×100%≈% 答:铁合金中碳的质量分数为%。 3.某兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取16g 石灰石样品,把80g 稀盐酸分4次加入样品中(样品中的其它成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥、称量等操作,实验数据如下表: (1)表中X 的值为________g ; (2)所用盐酸的质量分数_____(写出计算过程,结果保留一位小数); (3)充分反应后最终所得溶液中钙元素的质量为_______g 。 【答案】12 % 【解析】 【分析】 【详解】 (1)比较第一、二、三次数据,前两次加入稀盐酸一共反应了8g 碳酸钙,故每次加稀盐酸可以反应4g 碳酸钙x=16g -4g=12g 故填:12g 。 (2)由第一次数据可知20g 稀盐酸反应了4g 碳酸钙 解:设盐酸质量分数为y , 3222CaCO 2HCl =CaCl CO H O 10073 4g 20g y 1004g =,y=14.6%7320g y ++↑+?? 答;所用盐酸的质量分数%。
