(详细)NH3——CO2——H2O三元体系相图

NH3-CO2-H2O三元体系相图
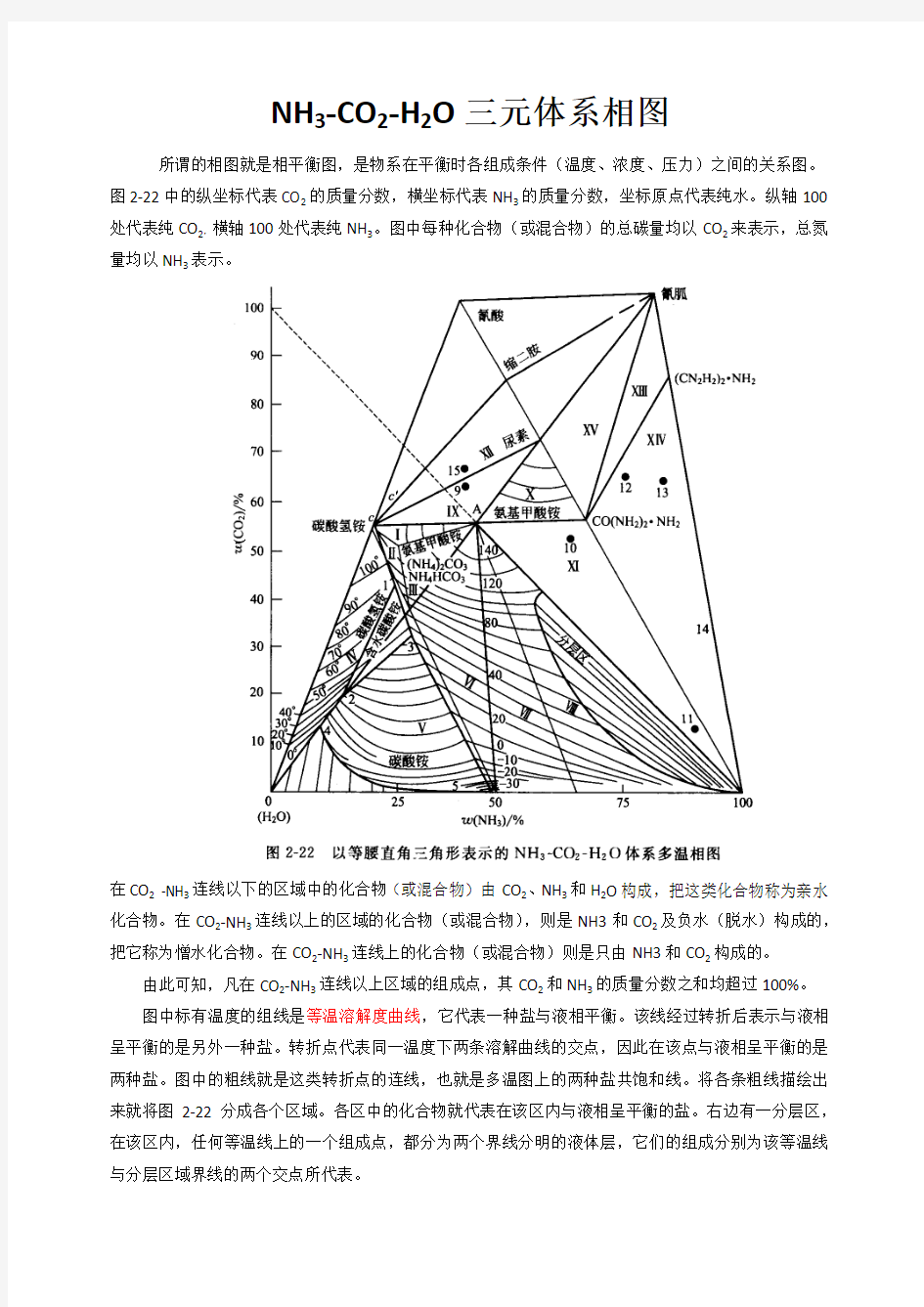
所谓的相图就是相平衡图,是物系在平衡时各组成条件(温度、浓度、压力)之间的关系图。图2-22中的纵坐标代表CO2的质量分数,横坐标代表NH3的质量分数,坐标原点代表纯水。纵轴100处代表纯CO2,横轴100处代表纯NH3。图中每种化合物(或混合物)的总碳量均以CO2来表示,总氮量均以NH3表示。
在CO2 -NH3连线以下的区域中的化合物(或混合物)由CO2、NH3和H2O构成,把这类化合物称为亲水化合物。在CO2-NH3连线以上的区域的化合物(或混合物),则是NH3和CO2及负水(脱水)构成的,把它称为憎水化合物。在CO2-NH3连线上的化合物(或混合物)则是只由NH3和CO2构成的。
由此可知,凡在CO2-NH3连线以上区域的组成点,其CO2和NH3的质量分数之和均超过100%。
图中标有温度的组线是等温溶解度曲线,它代表一种盐与液相平衡。该线经过转折后表示与液相呈平衡的是另外一种盐。转折点代表同一温度下两条溶解曲线的交点,因此在该点与液相呈平衡的是两种盐。图中的粗线就是这类转折点的连线,也就是多温图上的两种盐共饱和线。将各条粗线描绘出来就将图2-22分成各个区域。各区中的化合物就代表在该区内与液相呈平衡的盐。右边有一分层区,在该区内,任何等温线上的一个组成点,都分为两个界线分明的液体层,它们的组成分别为该等温线与分层区域界线的两个交点所代表。
一、CO2 -NH3 -H2O体系(Ⅰ)恒温相图
图2-23为20℃时CO2-NH3-H2O体系的恒温相图。图中有四条溶解度曲线:E'E1是NH4HCO3(组成点为C)的溶解度曲线,E1E2是复盐2NH4HCO3?(NH4)2CO3?H2O(组成点为P)的溶解度曲线,E2E3是一水碳酸盐(NH4)2CO3?H2O(组成点为S)的溶解度曲线,E3F'是氨基甲酸铵(组成点为A)的溶解度曲线。因为E'E1和E3 F'两条曲线未能在图上完全表示出来,因此E'和F'分别为两条曲线上的一个点。
1.与四条溶解度曲线对应的四个两相区
面积CE'E1代表NH4HCO3结晶区,面积PE1E2代表P盐结晶区,面积SE2E3代表(NH4)2CO3?H2O盐结晶区,面积AE3F'A代表NH4COONH2结晶区。E1、E2和E3是三个两盐共饱点:E1是C、P两盐共饱点,E2是P、S两盐共饱点,E3是S、A两盐共饱点。
2.与三个两盐共饱点相对应的有三个两盐共同结晶区
三角形E1PC是P、C两盐共晶区,三角形E2SP是S、P两盐共晶区,三角形E3AS是A、S两盐共晶区。饱和曲线E'E1E2E3F'以下是不饱和区。由图2-23可知,四种盐均为不相称盐,因为A、C、P、S各点分别与O点的连线都不与本身溶解度曲线相交。如果用组成为a的氨水进行碳化,则系统点将沿着CO2 - a 连线移动。先生成(NH4)2CO3?H2O结晶,后又转变为2NH4HCO3?(NH4)2 CO3?H2O结晶,继续碳化则变为NH4HCO3结晶。
二、CO 2-NH 3-H 2O 体系(Ⅰ)多温相图
如果把各种温度下CO 2-NH 3-H 2O 体系的的溶解度数据(见最后一页表2—1)都叠加在一张相图上,就可以得到多温相图。图2-24是根据表2-1数据绘出的CO 2-NH 3 -H 2O 体系的多温相图。它是为了讨论NH 4HCO 3生产过程而突出NH 4 HCO 3结晶区的相图。 图中的细线是溶解度曲线,也叫等温线。粗线是连接同类两种盐在不同温度下的共饱点而得到的连线,称为共饱线。图中共绘出七条两种盐共饱线。
线HA :C 、P 两种盐共饱和; AB :P 、R 两种盐共饱和(R 盐组成为 NH 4HCO 3?NH 4COONH 2); AJ :C 、R 两种盐共饱和; GB :P 、S 两种盐共饱和; BC :S 、R 两种盐共饱和; CD :R 、A 两种盐共饱和; CF :S 、A 两种盐共饱和。以上七条线分割出各种相区:
① 区域LHAJN 是NH 4HCO 3的饱和面,图中N 不是一个固定位置,因为这部分数据不完整。② 区域GBAH 是P 盐饱和面。③ ABCDJ 是R 盐饱和面。④ FCBG 是(NH 4)2CO 3?H 2O 饱和面。⑤曲线FCD 以右的区域是NH 4COONH 2饱和面。
三、碳酸氢铵生产过程中碳化过程分析
图2-25上的I点代表NH4HCO3的组成点(21.5%的NH3,55.7%的CO2,22.8%的H2O)。图中LHAJK区代表20~50℃温度间隔内的NH4HCO3结晶区。在用CO2碳化氨水时,当体系点进到NH4HCO3结晶区时,就出现NH4HCO3结晶。
为使得到的NH4HCO3产品的纯度较高,不希望体系在碳化过程中在达到NH4HCO3结晶区之前,先经过其他盐的结晶区,因为那样就有可能夹带其他盐结晶出来。为此,使碳化操作线从邻近NH4HCO3相区的别种盐的结晶区的边缘通过。由图可见,20%为最合适的原始氨水浓度了(在图上以Q点表示之)。
当用100%的CO2(图中以R点表示之)碳化时,新体系点应位于QR连线上,当体系达到P点并使溶液维持在20℃时,则连接IP并延长至与20℃溶解度曲线相交于M点,M 点即代表此时的液相组成。
如果开始时氨水含量高于20%,则为了避免夹带其他杂质,只好提高碳化度或温度,但提高碳化度会使出塔气体中CO2含量增高,而提高温度则又要增加氨的损失。
四、CO2-NH3-H2O 体系(Ⅱ)相图
重点讨论与氨基甲酸铵结晶有关联的区域,因为这是与尿素生产过程有密切关系的区域。
1.CO2-NH3-H2O体系(Ⅱ)恒温相图
图2-26是用直角等腰三角形表示的140℃的恒温相图。图中的A代表NH4COONH2的组成点,C代表NH4HCO3(55. 7%的CO2,21.5%的NH3)的组成点。OC是NH4HCO3和H2O的连线。直线左方无实验数据,直线AC的上方也不去进行研究。在140℃只有氨基甲酸铵一种固相可能存在,因为它的熔点较高(约152℃)。曲线ab是它的溶解度曲线(或叫熔点曲线)。扇形面积Aba是NH4COONH2结晶区。NH4COONH2的结晶区随温度的下降而扩大,如温度为120℃时,它的溶解度曲线变成了虚线a1b1。如果把温度降到120℃以下,除NH4COONH2结晶区外,液相发生分层现象,又出现NH4HCO3溶解度曲线。
图2-27为100℃的恒温图。图中cE线NH4HCO3溶解度曲线,扇形面积CcE是其结晶区。NH4COONH2的结晶区有明显扩大。直线a l a2是分层结线。在这条线上的任何组成点,都分为两个液相层,一层的组成为a1,另一层的组成为a2,其数量关系可由杠杆规则计算出来。组成点a l是液体NH4COONH2中溶解少量的NH3,而a2为液氨中溶解少量的NH4COONH2,两层都与固相NH4COONH2保持平衡。
图中的E点是A、C两种盐共饱和点。面积AcE是A和C两种盐共同结晶区。当温度进一步降低到了70℃时,除NH4COONH2和NH4 HC03结晶外,又出现P:2 NH4 HCO3?(NH4)2 CO3结晶,液相仍分层。
图2-28所示为70℃的恒温相图。图中的P点是2NH4HCO3?(NH4)2CO3(又名倍半碳酸铵)的组成点(26.8%的NH3,52%的CO2)。曲线EE1是P盐的溶解度曲线,面积PEE1是其结晶区。分层连接线为a'1 a'2。a'1的组成是63%的NH3,26%的CO2;a'2的组成是88%的NH3,2%的CO2,NH4COONH2的结晶区比100℃
的又扩大了。
图2-29为CO2-NH3-H2O体系30℃的恒温相图。图上有四条溶解度曲线,cE是NH4HCO3的溶解曲线,EE1是2NH4HCO3?(NH4)2CO3溶解度曲线;E1E2是(NH4)2CO3?H2O的溶解度曲线,E2a是NH4COONH2的溶解度曲线。
面积AE2a为NH4COONH2结晶区,面积sE1E2为(NH4)2C03?H2O结晶区,面积PEE1为倍半碳酸铵结晶区,面积CcE为NH4HCO3结晶区。三角形ASE2为NH4 COONH2和(NH4)2CO3?H2O二盐的共结晶区,三角形SPE1力(NH4)2CO3?H2O和倍半碳酸铵二盐的共结晶区,三角
形PCE为倍半碳酸铵和NH4HCO3二盐的共结晶区。四条线以下的区域为不饱和区。
如图2-30所示为0℃时该体系的相图。固相只有NH4 HCO3、(NH4)2CO3?H2O和NH4COONH2三种盐结晶。
上面介绍了五个温度的恒温相图。如果将此各温度的溶解度数据绘在一个图上,就可得到如图2-31所示的多温相图的梯形部分。由此可清楚地看出温度对相变的影响。
2.C02-NH3-H20 体系(Ⅱ)多温相图
3、NH3-CO2-H2O溶解度数据表(表2—1原数据模糊,有待于进一步核准):
注:
C表示NH4HCO3
P表示2 NH4HCO3·(NH4)2CO3·H2O
S表示(NH4)2CO3·H2O
A表示NH2COONH4
R表示NH4HCO3·NH2COONH4
柴油微乳液拟三元相图的绘制及燃烧性能测定
柴油微乳液拟三元相图的绘制及燃烧性能测定 指导老师:何广平 杜格林20102401029 10化学1班 同组组员苏礼浩余澎凡 一、实验目的 本实验学习柴油微乳体系拟三元相图的绘制与研究方法,并根据相图,选择合适的柴油微乳液,通过氧弹卡计进行燃烧性能测定,比较柴油、微乳柴油燃烧时其燃烧效率的不同,对微乳柴油的经济与环保价值进行评价。 通过对乳化柴油的燃烧热的测定,掌握燃烧热的定义,学会测定物质燃烧热的方法,了解恒压燃烧热与恒容燃烧热的差别;了解氧弹卡计的主要部件的作用,掌握氧弹卡计的量热技术;熟悉雷诺图解法校正温度改变值的方法。 二、实验原理 微乳燃料的制备比较简单,只需要把油、水、表面活性剂、助表面活性剂按合适的比例混合在一起就可以自发形成稳定的微乳燃料。微乳燃油可长期稳定,不分层,且制备简单,并能使燃烧更完全,燃烧效率更高,其节油率可达5%~15%,排气温度下降20%~60%,烟度下降40%~77%,NO X和CO的排放量降低25%,在节能环保和经济效益上都有较为可观的效果,已成为世界各国竞相开发的热点。随着近年来对两亲分子有序组合体研究的不断深入,微乳液理论在乳化燃油领域取得了突破性进展,开发透明、稳定、性能与原燃油差不多的微乳液燃料成为了研究热点。 乳化燃油与通常的乳状液一样,也分为油包水型(W/O)和水包油型(O/W),在油包水型乳化燃料油中,水是以分散相均匀地悬浮在油中,被称为分散相或内相,燃料油则包在水珠的外层,被称为连续相或外相。我们目前所见的大多数乳化燃料油都为油包水型乳化燃料。乳化燃料燃烧是个复杂的过程,对其节能降污机理较为成熟的解释是乳化燃料中存在的“微爆”现象和水煤气反应,也就是从燃料的物理过程和化学过程来解释。 对微乳柴油的研究通常包括为微乳燃油配方选择合适的表面活性剂和助表面活性剂,并考察各组分对可增溶水量的影响,确定最佳的微乳燃油配方比例。然后针对微乳柴油体系,通过相图、电导、NMR、FT-IR、分子光谱、荧光光谱、黏度法、电子显微镜等方式研究微乳液的结构,并进行燃烧性能与尾气排放量测定。 三、实验试剂与仪器 实验试剂:柴油0#、油酸(化学纯)、十六烷基三甲基溴化铵(CTAB)(化学纯)、氨水、正丁醇实验仪器:燃烧热测定装置一套、充氧装置一套、万用电表、5安保险丝、磁力搅拌器、搅拌子(中)、电导率仪、电子分析天平、烧杯、镊子、滤纸、PH试纸、玻棒、洗耳 球、胶头滴管等。 四、实验步骤 1.水-柴油体系配制及拟三元相图绘制
OP-10拟三元体系微乳区域相图研究
Advances in Material Chemistry 材料化学前沿, 2020, 8(3), 43-54 Published Online July 2020 in Hans. https://www.360docs.net/doc/9f6517015.html,/journal/amc https://https://www.360docs.net/doc/9f6517015.html,/10.12677/amc.2020.83006 Study on the Quasi-Ternary Phase Diagram of OP-10 Microemulsion Region Bounmyxay Malayphone1, Qingluo Meng1, Yiwen Zeng2*, Nong Wang1* 1School of Chemical and Biological Engineering, Lanzhou Jiaotong University, Lanzhou Gansu 2College of Materials and Chemical Engineering, Hezhou University, Hezhou Guangxi Received: Jun. 2nd, 2020; accepted: Jun. 19th, 2020; published: Jun. 30th, 2020 Abstract A series of quasi ternary phase diagrams of alkyl phenol polyoxyethylene ether (OP-10) + alcohols (n-butanol, isopentyl alcohol or n-octanol) + n-hexane + water (calcium chloride aqueous solution) system have been drawn based on experiments. We investigated the influence of cosurfactant al- cohol with different addition and CaCl2solution with different molar concentrations on the mi-croemulsion region respectively. In pure water quasi-ternary phase diagram, we found that the relative area of microemulsion region in the ternary system increases at the beginning and then decreases with the mass ratios of OP-10 and cosurfactant n-butanol, isopentyl alcohol or n-octanol increase. When the OP-10:n-butanol = 1.5:1, OP-10:isopentyl alcohol = 2:1, and OP-10:n-octanol = 2.5:1, it has the largest area of microemulsion region. In general, the change tendency of micro- emulsion region relative areas increased at the beginning and then decreased in calcium chloride aqueous solution quasi-ternary phase diagram. The influence of relative area of microemulsion region is also different from adding different alcohols. Among them, the concentrations of CaCl2 with the largest relative area of microemulsion region corresponding to n-butanol, isopentyl al-cohol, and n-octanol are 0.1 mol/L, 0.5 mol/L and 0.1 mol/L respectively. This study has important reference value for the drawing of quasi-ternary phase diagram, preparation of microemulsion and synthesis of nanomaterials by microemulsion method. Keywords OP-10, Quasi-Ternary Phase Diagram, Microemulsion Region, Relative Area OP-10拟三元体系微乳区域相图研究 井小莲1,孟庆络1,曾一文2*,王农1* 1兰州交通大学化学与生物工程学院,甘肃兰州 2贺州学院材料与环境工程学院,广西贺州 *通讯作者。
三元相图的应用
三元相图的应用 用三元相图对煤灰熔点预报研究 利用HR-4灰熔点测定仪,对府谷、露天、宝雁、宝一等4个煤灰样,分别在弱还原性和氧化性气氛下测得它们的灰熔融特征温度,利用CaO.SiO2.AI2O3三元系统相图对实验结果进行比较分析。结果表明:弱还原性气氛下,CaO-Si02.AI203三元相图预报煤灰熔点比实验值高是因为忽略了煤灰中其它杂质矿物质组分;氧化性气氛下,运用CaO-SiO2_Al2 三元相图来预报煤灰熔点,预报值很接近实验值,且煤灰系统中CaO的含量越高预报值和实验值越接近。 锅炉结渣对锅炉安全运行危害极大?。电站锅炉的结渣受煤质特性和炉内燃烧工况影响,煤灰熔融特性是煤质特性中对结渣影响较大的因素。煤灰是由各种矿物质组成的混合物,在高温下熔化过程比较复杂,煤灰中除各矿物质组分外,矿物质之间还会发生反应生成新的矿物质,且各矿物质问也会发生共熔现象。国内为许多专家学者对煤灰熔融性做了大量的研究工作,但用三元相图对不同气氛下煤灰熔点进行预报还很少见诸报道。本文利用三元相图为理论基础,运用HR.4灰熔点测定仪在不同气氛下对煤灰熔融特性进行实验研究。 1 实验装置及条件 实验仪器采用HR.4灰熔点测定仪,它是以硅炭管为发热元件,并配合可控硅调压器进行温度控制的加热炉。它按国标(GB.210)(900℃以前为l5~20℃/min,900℃以后为5±l℃/min)实现自动升温控制功能。试样采用的是府 谷、露天矿、宝雁矿和宝一矿等4种煤灰样,根据GB212.77测定灰成分方法所规定的步骤和要求制成灰样。灰成分分析见表l,煤灰成分数据由北京煤科院提供。实验方法采用GB219.74煤灰熔融性的角锥法,运用HR-4灰熔点测定仪分别在氧化性气氛和还原性气氛测得试样的煤灰熔融特征温度的软化温度(ST)。实验中炉内弱还原性气氛采取封炭法获得,即在刚玉舟中央放置石墨粉l6g,两端放置无烟煤35 g;炉内氧化性气氛通过让空气在炉内自由流通的方式获得,把HR-4灰熔点测定仪置于自然通风状态下即可达到炉内为氧化性气氛。 2 实验结果 4种灰样在弱还原性和氧化性气氛下的软化温度(ST)见表2(本文中的煤灰特征温度均指软温度ST)。
三元系相图绘制
实验三组分相图的绘制 一实验目的 绘制苯一醋酸一水体系的互溶度相图。为了绘制相图就需通过实验获得平衡时,各相间的组成及二相的连结线。即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的成分。但体系达到平衡的时间,可以相差很大。对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡;对于一些难溶的盐,则需要相当长的时间,如几个昼夜。由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后把它移放在温度较低的恒温槽中,令其结晶,加速达到平衡。另外摇动、搅拌、加大相界面也能加快各相间扩散速度,加速达到平衡。由于在不同温度时的溶解度不同,所以体系所处的温度应该保持不变。 二实验原理 水和苯的互溶度极小,而醋酸却与水和苯互溶,在水和苯组成的二相混合物中加入醋酸,能增大水和苯之间的互溶度,醋酸增多,互溶度增大。当加入醋酸到达某一定数量时,水和苯能完全互溶。这时原来二相组成的混合体系由浑变清。在温度恒定的条件下,使二相体系变成均相所需要的醋酸量,决定于原来混合物中水和苯的比例。同样,把水加到苯和醋酸组成的均相混合物中时,当水达到一定的数量,原来均相体系要分成水相和苯相的二相混合物,体系由清变浑。使体系变成二相所加水的量,由苯和醋酸混合物的起始成分决定。因此利用体系在相变化时的浑浊和清亮现象的出现,可以判断体系中各组分间互溶度的大小。一般由清变到浑,肉眼较易分辨。所以本实验采用由均相样品加人第三物质而变成二相的方法,测定二相间的相互溶解度。 当二相共存并且达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连结线。 一般用等边三角形的方法表示三元相图(图1)。等边三角形的三个顶点各代表纯组分;三角形三条边AB、BC、CA分别代表A和B、B和C、C和A所组成的二组分的组成;而三角形内任何一点表示三组分的组成。 例如图1-1中的P点,其组成可表示如下:经P点作平行于三角形三边的直线,并交三边于a、b、c三点。若将三边均分成100等分,则P点的A、B、C组成分别为: A%=Cb,B%=Ac,C%=Ba 对共轭溶液的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC则不溶或部分互溶的相图,如图1-2所示。图中EK1K2K3DL3L2L1F是互溶度曲线,K1L1、K2L2等是连结线。互溶度曲线下面是两相区,上面是一相区。 图1-1等边三角形法表示三元相图图1-2共轭溶液的三元相图
实验四三元液液平衡数据的测定 (1)
实验四三元液-液平衡数据的测定 液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定。 一、实验目的 (1)测定醋酸水醋酸乙烯在25℃下的液液平衡数据 (2)用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较。(3)通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制。 二、实验原理 三元液液平衡数据的测定,有两不同的方法。一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成。这种方法可以直接测出平衡连接线数据,但分析常有困 难。 另一种方法是先用浊点法测出三元系的溶解度曲 线,并确定溶解度曲线上的组成与某一物性(如折光率、 密度等)的关系,然后再测定相同温度下平衡接线数据。 这时只需要根据已确定的曲线来决定两相的组成。对于 醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最 为方便,因此采用浊点法测定溶解度曲线,并按此三元 溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标 绘,画成曲线,以备测定结线时应用。然后配制一定的 三元混合物,经搅拌,静止分层后,分别取出两相样品,图1 Hac-H2O-Vac的三元相图示意分析其中的醋酸含量,有溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量。 三、预习与思考 (1)请指出图1溶液的总组成点在A,B,C,D,E点会出现什么现象? (2)何谓平衡联结线.有什么性质? (3)本实验通过怎样的操作达到液液平衡? (4)拟用浓度为0.1mol/L的NaOH定法测定实验系统共轭两相中醋酸组成的方法和计算式。 取样时应注意哪些事项,H2O及V Ac的组成如 何得到? 四、实验装置及流程 (1)木制恒温箱(其结构如图2所示)的作用原理是: 由电加热器加热并用风扇搅动气流,使箱内温度 均匀,温度有半导体温度计测量,并由恒温控制 器控制加热温度。实验前先接通电源进行加热, 使温度达到25℃,并保持恒温。 (2)实验仪器包括电光分析天平,具有侧口的100mL 三角磨口烧瓶及医用注射器等。
三元相图的绘制详解
三元相图的绘制 本实验是综合性实验。其综合性体现在以下几个方面: 1.实验内容以及相关知识的综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。 2.运用实验方法和操作的综合 本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。本实验中滴定终点的判断,不同于分析化学中的大多数滴定。本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。 一.实验目的 1. 掌握相律,掌握用三角形坐标表示三组分体系相图。 2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。 二.实验原理 三组分体系K = 3,根据相律: f = K–φ+2 = 5–ф 式中ф为相数。恒定温度和压力时: f = 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。一般用等边三角形的方法表示三元相图。 在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:
图1 图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。三角形内任一点则表示三组分体系的组成。如点P 的组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液的三组分体系的相图如图2所示。该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。曲线DEFHIJKL为溶解度曲线。EI和DJ是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿)绘制溶解度曲线的方法有许多种,本实验采用的方法是:将将完全互溶的两组分(如氯仿和醋酸)按照一定的比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三. 实验准备 1. 仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2. 药品:冰醋酸,氯仿,NaOH溶液(0.2mol·mol–3),酚酞指示剂。
三元相图的绘制详解
三元相图得绘制 本实验就就是综合性实验。其综合性体现在以下几个方面: 1、实验内容以及相关知识得综合 本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其就就是在一般得实验中(比如分析化学实验、无机化学实验等)作图都就就是用得直角坐标体系,几乎没有用过三角坐标体系,因此该实验中得等边三角形作图法就具有独特得作用。这类相图得绘制不仅在相平衡得理论课中有重要意义,而且对化学实验室与化工厂中经常用到得萃取分离中具有重要得指导作用。 2、运用实验方法与操作得综合 本实验中涉及到多种基本实验操作与实验仪器(如电子天平、滴定管等)得使用。本实验中滴定终点得判断,不同于分析化学中得大多数滴定。本实验得滴定终点,就就是在本来可以互溶得澄清透明得单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。准确地掌握滴定得终点,有助于学生掌握多种操作,例如取样得准确、滴定得准确、终点得判断准确等。 一、实验目得 1、掌握相律,掌握用三角形坐标表示三组分体系相图。 2、掌握用溶解度法绘制三组分相图得基本原理与实验方法。 二、实验原理 三组分体系K= 3,根据相律: f =K–φ+2=5–ф 式中ф为相数。恒定温度与压力时: f= 3–φ 当φ= 1,则f = 2 因此,恒温恒压下可以用平面图形来表示体系得状态与组成之间得关系,称为三元相图。一般用等边三角形得方法表示三元相图。 在萃取时,具有一对共轭溶液得三组分相图对确定合理得萃取条件极为重要。在定温定压下,三组分体系得状态与组分之间得关系通常可用等边三角形坐标表示,如图1所示:
图1图2 等边三角形三顶点分别表示三个纯物质A,B,C。AB,BC,CA,三边表示A与B,B与C,C 与A所组成得二组分体系得组成。三角形内任一点则表示三组分体系得组成。如点P得组成为:A%=Cb B%=Ac C%=Ba 具有一对共轭溶液得三组分体系得相图如图2所示。该三液系中,A与B,及A与C完全互溶,而B与C部分互溶。曲线DEFHIJKL为溶解度曲线。EI与DJ就就是连接线。溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。物系点落在两相区内,即分为两相。 图3(A醋,B水,C氯仿) 绘制溶解度曲线得方法有许多种,本实验采用得方法就就是:将将完全互溶得两组分(如氯仿与醋酸)按照一定得比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。 三、实验准备 1、仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。 2、药品:冰醋酸,氯仿,NaOH溶液(0、2mol·mol–3),酚酞指示剂。 四、操作要点(各实验步骤中得操作关键点) 1、因所测得体系中含有水得成分,所以玻璃器皿均需干燥。
物化实验思考题
1.物理化学实验技术 思考题、讨论题、作业:物理化学实验与其他化学课程实验有哪些异同点? 2,微乳柴油燃烧热的测定 思考题、讨论题、作业: 1.什么是燃烧热?它在化学反应热的计算中有何应用? 2.影响本实验准确度的主要有哪些因素?为什么? 3.什么是氧弹卡计的水当量?如何测得? 4.实验测得的温差为何经过雷诺校正? 3. 柴油-水微乳体系拟三元相图的绘制 7.问题思考 (1)柴油的主要成分是什么?其燃烧后可能形成的产物有那些? (2)乳化柴油与微乳柴油的区别?制备方法上有什么不同? (3)乳化柴油为什么不稳定?其对柴油发动机产生的损害是什么? (4)为什么要进行柴油微乳液的研究?形成微乳柴油的通常条件是什么?其中各组分的作用是什么? (5)什么是相图?什么是拟三元相图?通过拟三元相图的绘制与分析,你可以得到那些信息? (6)确定微乳液基本性质的简单方法(W/0型乳液或0/W型乳液)有那些?其原理是什么?(7)为什么将柴油微乳化可提高柴油的燃烧效率,减少尾气排放?其可能的机理有那些?(8)氧弹量热技术的基本测量原理是什么?如何通过氧弹量热计测定微乳柴油的燃烧值? 燃油的完全燃烧与不完全燃烧有什么区别? (9)本实验乳化剂配方中,各种物质的作用是什么? (10)你能否将本实验设计为中学教学中的课外化学实验?如何设计? 思考题 1、溶胶-凝胶粉末的细度、均匀性受什么因素的影响? 2、自查文献了解稀土纳米荧光粉的研究进展。 自查文献了解开展纳米材料研究所需要的各种仪器及相应的表征对象。 4.电动势的测定和应用 思考题、讨论题、作业: 1.为何测电动势要用对消法?原理是什么? 2.测电动势为什么要用盐桥?如何选用盐桥以适合不同体系? 3.使用醌氢醌电极的限制条件是什么? 4.在测量过程中,如果示零器总是正值或负值,而不能示零,可能的原因是什么? 5.乙酸乙酯皂化反应速率常数的测定 思考题、讨论题、作业: 1.如何减小恒温水浴温度的波动? 2.影响二级反应速率常数测定准确性的因素? 6. 洗涤剂的配制 思考题、讨论题、作业: 课后根据课堂讲解和实验操作,总结实验现象,记录实验数据并处理实验数据,分析实验产生误差的可能之处,完成实验报告。
微乳柴油拟三元相图的绘制及燃烧热的测定
微乳柴油的拟三元相图绘制及燃烧热的测定 化学与环境学院 2010级 一、实验资料 微乳液:微乳液是一种由两种互不相溶的液体在表面活性剂界面膜的作用下生成的热力学稳定、各向同性的透明的分散体系。由于其能形成超低界 面张力,且具有高稳定性、大增溶量、以及粒径小等特殊性质,已引起人们广泛关注。 柴油微乳液:油与水在表面活性剂的作用下以合适的比例混匀将自发产生稳定的微乳燃料,它可以使燃烧更为完全且效率更高,从而节约了能源也 同时更加环保。 微乳燃料的节能环保及经济效益吸引着世界各国的科学家,并成为各国竞相开发的热点。随着近年来对两亲分子有序组合体研究的不断深入, 微乳液理论在乳化燃油领域取得了突破性进展,开发透明、稳定、性能与原燃油差不多的微乳液燃料成为了研究热点。 二、实验原理 微乳柴油与燃烧减排机理:乳化燃油与通常的乳状液一样,也分为油包水型(W/o)和水包油型(O/W),在油包水型乳化燃料油中,水是以分散相均匀 地悬浮在油中,被称为分散相或内相,燃料油则包在水珠的外层,被称为连续相或外相。我们目前所见的大多数乳化燃料油都为油包水型乳化燃 料。乳化燃料燃烧是个复杂的过程,对其节能降污机理较为成熟的解释是 乳化燃料中存在的“微爆”现象和水煤气反应,也就是从燃料的物理过程和化学过程来解释。 物理作用—“微爆现象”油包水型分子基团,油是连续相,水是分散相,由于水沸点(100℃)低于燃油沸点(130℃以上)。在气缸温度急剧升高时,水微粒先沸腾气化,体积在万分之一秒内瞬间增大了1500倍左右,其气 化膨胀相当于一次极小的爆炸。当油滴中的压力超过油的表面张力及环境压力之和时。水蒸气产生的巨大压力将冲破油膜的束缚,无数小液珠产生的阻力使油滴发生爆炸,油雾化成更细小的油滴。小油滴与空气接触的比表面积成倍提高,形成二次燃烧的雾化条件,爆炸后的细小油滴更易燃烧,其燃烧表面比纯燃油增加了104倍左右。因此,减少了物理上的不完全燃
第8章 三元相图 笔记及课后习题详解(已整理 袁圆 2014.8.7)
第8章三元相图 8.1 复习笔记 一、三元相图的基础 三元相图的基本特点:完整的三元相图是三维的立体模型;三元系中的最大平衡相数为四。三元相图中的四相平衡区是恒温水平面;三元系中三相平衡时存在一个自由度,所以三相平衡转变是变温过程,反应在相图上,三相平衡区必将占有一定空间。 1.三元相图成分表示方法 ( 1)等边成分三角形 图8-1 用等边成分三角形表示三元合金的成分 三角形内的任一点S都代表三元系的某一成分点。 (2) 等边成分三角形中的特殊线 ①等含量规则:平行于三角形任一边的直线上所有合金中有一组元含量相同,此组元为所对顶角上的元素。
②等比例规则:通过三角形定点的任何一直线上的所有合金,其直线两边的组元含量之比为定值。 ③背向规则:从任一组元合金中不断取出某一组元,那么合金浓度三角形位置将沿背离此元素的方向发展,这样满足此元素含量不断减少,而其他元素含量的比例不变。 ④直线定律:在一确定的温度下,当某三元合金处于两相平衡时,合金的成分点和两平衡相的成分点必定位于成分三角形中的同一条直线上。 (3)成分的其他表示方法: ①等腰成分三角形:两组元多,一组元少。 ②直角成分坐标:一组元多,两组元少。 ③局部图形表示法:一定成分范围内的合金。 2.三元相图的空间模型 图8-2 三元匀晶相图及合金的凝固(a)相图(b)冷却曲线
3.三元相图的截面图和投影图 ( 1)等温截面 定义: 等温截面图又称水平截面图,它是以某一恒定温度所作的水平面与三元相图立体模型相截的图形在成分三角形上的投影。 作用:①表示在某温度下三元系中各种合金所存在的相态; ②表示平衡相的成分,并可以应用杠杆定律计算平衡相的相对含量。 图8-3 三元合金相图的水平截面图 (2)垂直截面 定义:固定一个成分变量并保留温度变量的截面,必定与浓度三角形垂直,所以称为垂直截面,或称为变温截面。 常用的垂直截面有两种: ①通过浓度三角形的顶角,使其他两组元的含量比固定不变; ②固定一个组元的成分,其他两组元的成分可相对变动。 图8-4 三元相图的垂直截面图 (3)三元相图的投影图 定义:把三元立体相图中所有相区的交线都垂直投影到浓度三角形中,就得到了三元相图的投影图。
三液系相图的绘制.
实验三氯甲烷—醋酸—水三液系相图的绘制 一.实验目的 1.掌握用三角坐标表示三组分相图的方法; 2.用溶解度法绘制具有一对共轭溶液的三组分相图。 二.实验原理 为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或者物理方法确定达成平衡时各相的组成。但体系达到平衡的时间,可以相差很大。对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大但不生成化合物的水盐体系,也容易达到平衡。对于一些难溶的盐,则需要相当长的时间,如几个昼夜。由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其溶解较多,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡,另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。 水和氯仿的相互溶解度很小,而醋酸却与水、氯仿互溶。在水和氯仿组成的两相混合物中加入醋酸,能增大水和氯仿间的互溶度,醋酸增多,互溶度越大,当加入醋酸到某一数量时,水和氯仿能完全互溶,原来由两相组成的混合体系由混变清。在温度恒定的情况下,使两相体系变成均匀的混合物所需要的醋酸量,取决于原来混合物中水和氯仿的比例。同样,把水加到醋酸和氯仿的均相混合物中时,当水达到一定数量,原来的均相体系变成水相和氯仿相的两相混合体系,体系由清变混。使体系变成两相所需要的水量,取决于醋酸和氯仿的起始成分。因此利用体系在相变化时的浑浊和清亮现象的出现。可以判断体系中各组分间互溶度的大小。一般由清到浊,肉眼比较容易分辨。所以实验由均相样品中加入第三物质使变成二相的方法,测定两相间的相互溶解度。 当二相共存并达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连接线。 用等边三角形的方法表示三元相图。等边三角形的三个定点各代表纯组分,三角形三条边AB、BC和CA分别代表A和B,B和C,C和A所组成的二组分的组成,而三角形内任意一点表示三组分的组成。 如上图。经过P点作平行于三边的直线,并交于三边于a,b,c三点。若将三边均匀分成100等分,则P点的A、B、C组成分别为: A%=Cb B%=AC C%=Ba
三元相图软件安装与使用指南
三元相图软件安装与使用指南 日前,我在小木虫网站上传了二元合金相图软件和三元相图软件,有部分虫友反映三元相图软件的安装与使用有些问题,因此,我制作了本指南,希望能对广大虫友有所帮助。 本人电脑系统:Windows xp sp3, Vista和Windows 7系统可能无法兼容此软件。 一、三元相图软件安状 1.将下载到的三元相图软件解压到非系统盘(如:D:\)下,打开文件夹“三元相图软件”,运行SETUP.EXE文件,出现如下界面: 点击“Continue”,出现如下界面:
输入一个用户名,单位名可不输。然后“确认”,知道出现如下界面: 点击“OK”后出现如下界面: 点击电脑图标(如图示),进入如下界面:
直接“Continue”,出现如下界面: 点击“OK”,软件到此安装完毕。
2.运行软件 点击“开始”,运行TERNARY中的Ternary Phase Diagrams,如下图: 出现如下界面(根据电脑配置,有时候也不会出现此界面) 出现这种情况是因为你的机器配置太好,内存过多造成,呵呵! 按如下方法解决: 开始---运行---msconfig---Boot.ini---高级----MAXMEN设置为768,重起电脑。出现如下界面,打钩确认。 再次运行运行TERNARY中的Ternary Phase Diagrams,出现如下界面:
根据系统配置不同,有的在设置好运行的时候会要求输入cdkey,见压缩文件cdkey.txt文件,手动输入即可,复制不行(有时需要输入几次,若出现错误,忽略退出重新运行即可)。 点击“确认”,出现如下界面,选择“三元相图软件”文件夹中“data”文件夹在你电脑上的位置(见前面开始解压文件的位置)。确认无误后出现如下界面: 至此,软件设置完成,点击Keywords,输入相关元素符号查询即可(输一个元素符号,点击一次后面的“Search”,最后点“OK”),如下:
(详细)NH3——CO2——H2O三元体系相图
NH3-CO2-H2O三元体系相图 所谓的相图就是相平衡图,是物系在平衡时各组成条件(温度、浓度、压力)之间的关系图。图2-22中的纵坐标代表CO2的质量分数,横坐标代表NH3的质量分数,坐标原点代表纯水。纵轴100处代表纯CO2,横轴100处代表纯NH3。图中每种化合物(或混合物)的总碳量均以CO2来表示,总氮量均以NH3表示。 在CO2 -NH3连线以下的区域中的化合物(或混合物)由CO2、NH3和H2O构成,把这类化合物称为亲水化合物。在CO2-NH3连线以上的区域的化合物(或混合物),则是NH3和CO2及负水(脱水)构成的,把它称为憎水化合物。在CO2-NH3连线上的化合物(或混合物)则是只由NH3和CO2构成的。 由此可知,凡在CO2-NH3连线以上区域的组成点,其CO2和NH3的质量分数之和均超过100%。 图中标有温度的组线是等温溶解度曲线,它代表一种盐与液相平衡。该线经过转折后表示与液相呈平衡的是另外一种盐。转折点代表同一温度下两条溶解曲线的交点,因此在该点与液相呈平衡的是两种盐。图中的粗线就是这类转折点的连线,也就是多温图上的两种盐共饱和线。将各条粗线描绘出来就将图2-22分成各个区域。各区中的化合物就代表在该区内与液相呈平衡的盐。右边有一分层区,在该区内,任何等温线上的一个组成点,都分为两个界线分明的液体层,它们的组成分别为该等温线与分层区域界线的两个交点所代表。
一、CO2 -NH3 -H2O体系(Ⅰ)恒温相图 图2-23为20℃时CO2-NH3-H2O体系的恒温相图。图中有四条溶解度曲线:E'E1是NH4HCO3(组成点为C)的溶解度曲线,E1E2是复盐2NH4HCO3?(NH4)2CO3?H2O(组成点为P)的溶解度曲线,E2E3是一水碳酸盐(NH4)2CO3?H2O(组成点为S)的溶解度曲线,E3F'是氨基甲酸铵(组成点为A)的溶解度曲线。因为E'E1和E3 F'两条曲线未能在图上完全表示出来,因此E'和F'分别为两条曲线上的一个点。 1.与四条溶解度曲线对应的四个两相区 面积CE'E1代表NH4HCO3结晶区,面积PE1E2代表P盐结晶区,面积SE2E3代表(NH4)2CO3?H2O盐结晶区,面积AE3F'A代表NH4COONH2结晶区。E1、E2和E3是三个两盐共饱点:E1是C、P两盐共饱点,E2是P、S两盐共饱点,E3是S、A两盐共饱点。 2.与三个两盐共饱点相对应的有三个两盐共同结晶区 三角形E1PC是P、C两盐共晶区,三角形E2SP是S、P两盐共晶区,三角形E3AS是A、S两盐共晶区。饱和曲线E'E1E2E3F'以下是不饱和区。由图2-23可知,四种盐均为不相称盐,因为A、C、P、S各点分别与O点的连线都不与本身溶解度曲线相交。如果用组成为a的氨水进行碳化,则系统点将沿着CO2 - a 连线移动。先生成(NH4)2CO3?H2O结晶,后又转变为2NH4HCO3?(NH4)2 CO3?H2O结晶,继续碳化则变为NH4HCO3结晶。
相态拟合参考(cmg)
3 油藏注气动态研究—跟踪模拟研究 数值模拟是分析油藏动态的重要工具之一,为了能弄清油藏目前和未来的开采动态,为动态监测和油田开发提供依据,针对葡北油田的生产实际进行了下列研究工作: (1)相态拟合 (2)细管试验拟合 (3)长岩心实验拟合 (4)三维地质参数场建立 (5)储量拟合 (6)历史拟合 (7)目前生产动态 (8)动态预测 通过历史拟合等研究工作得到了目前的气水前沿位置及剩余油饱和度分布情况,并获到了用于动态预测的地质、流体参数场。在动态预测中考虑了按目前现有井网和注采方式及明年另加两口新井(一采一注)进行开发的2个方案;另外还考虑了按目前现有井网在2001年1月将所有的注气井转为注水井,及明年另加两口新井(一采一注)进行开发的2个方案,方案总数共四个。最后给出了油藏整体开发动态及部份典型井开采至2020年的生产动态指标。 3.1相态参数的拟合 本次研究选用加拿大CMG数值模拟软件集团的相态模拟分析软件Winprop对葡北油田相态参数进行拟合计算。 Winprop是与油气藏模拟一体化的相态分析软件,模拟相态特征和油气藏流体性质,确定油气藏特征和流体组分变化,形成完整的PVT拟合数据,包括流体重馏分特征化、组分归并、实验室数据回归拟合、相图计算等。对于分析和拟合分离器油和气的合并、压缩系数确定、等组分膨胀、等容衰竭、分离器测试等过程,是一个有力的相态分析工具,既能分析复杂油气藏油气系统的相态,又能产生组分模拟器GEM所需的PVT拟合参数场。 3.1.1 相态特征研究 利用井所产流体的实验室分析参数,结合油气藏的开发生产动态资料是判别地层流体性质特征的有效方法和主要手段。葡北20井取得高压物性、地层水饱和蒸汽压等丰富的实验数据,并已累计生产了大量的天然气和原油,为地层流体性质的综合研究和确定油气藏类型奠定了坚实的基础。 3.1.2 地层流体组成 本次研究中,葡北20井流体资料来自吐哈石油勘探开发研究院1996年的实验报告。其井流物组份组成见表3-1。 3.1.3 拟组分划分PVT拟合 PVT拟合的目的是用状态方程型相态分析软件对实验室所做的等组分膨胀、等容衰竭实验等数据进行计算拟合,得到可代表真实储层流体特性的状态方程参数。这些参数是组分模型中凝析油、气性质计算的基础,用于组分模拟研究。 应用组分模拟器GEM前处理相态软件Winprop对葡北20井相态资料进行了拟合计算,为数值模拟提供相匹配的流体相态参数场。
第三章多元凝聚系统相图及其应用(精)
第三章多元凝聚系统相图及其应用 和传统化学不同,本书不讨论含水系统,而把注意力集中在凝聚态相图同时,和金属物理或物理冶金学不同,本书主要是讨论金属氧化物系统相图。无机材料化学是一门应用学科,因此,本书除了介绍一些必要的基本原理外,重点放在解释如何分析相图,以及讨论相图对实际过程的指导意义。 多元凝聚系统的相律表达式为f * = C–Φ+ 1,f*为条件自由度,C为独立组元数,Φ为相数,数字1代表温度变量。本书采用大多数无机材料化学类文献[3~7]约定俗成的说法,在下文中把f *称为自由度,并以通常代表自由度的符号f来表示。于是,凝聚系统相律便写成为 f = C –Φ+ 1 。(3–1) 对于二元凝聚系统,C = 2,于是(3–1)式便成为f = 3–Φ。可见在二元凝聚系统中,平衡共存的相最多只有3个,最大自由度f = 2,是温度和任意1个浓度项这2个热力学强度因素。 §3.1 二元系统相图 3.1.1KF–BaTiO3系统和提拉法低温制备单晶 图3–1 KF–BaTiO3相图,纵标为温度T, 横标为BaTiO3的物质的量分数x[7] 参见Karan C, Skinner B J. J. Chem. Phys., 1953, 21: 2 225[8] 图3–1为KF–BaTiO3系统相图。这是一种最简单的具有一个低共熔点(eutectic point)的二元系统相图[1],或称为二元固态不互溶凝聚系统相图[2]。本书相图(二元系统及下文的
三元系统立体相图)纵标单位一般为绝对温度T(个别相图仍保留摄氏温度t),横标为物质的量分数x或质量分数w等。 由图3–1可见,如欲将BaTiO3熔融,用提拉法生长BaTiO3单晶,温度要求高达1 885 K。若加入一定量的KF,就可在比1 106 K略高一点的温度,提拉出质量合格的BaTiO3单晶[7],而使制备温度下降700 K左右。通常配料控制在靠近BaTiO3的一侧。但BaTiO3含量过高时,拉制温度会过高[7],这是由于此种情况下在比1 106 K稍高一点的温度时,系统的液相量过少。一般可通过实验确定最佳的原料配比和提拉温度。 3.1.2 CaO–Al2O3系统和转熔过程的包晶反应 一、CaO–Al2O3系统 此系统的相图如图3–2所示。本书和大部分无机材料化学类文献[3, 7, 8]一样,把分子式为CaAl2O4的化合物,写成CaO·Al2O3,简写为CA,其他以此类推。系统中CA、CA2、六铝酸钙CA6和铝酸三钙C3A均为不一致熔融化合物(物理化学教科书往往称它们为不稳定化合物[12,]),它们各自的分解温度[或称为转熔温度(peritectic temperatures)]亦已在图中标出。七铝酸十二钙C12A7在通常的温度下为一致熔融化合物(或称为稳定化合物[1, 2]、同成分熔融化合物)。有的文献认为它的熔点为1 665 K[7, 9],但较为经典的文献则认为它的熔点为1 728 K[10],后一个数据与图3–2中C12A7组成附近的两个低共熔点温度较为相符。C3A 和CA在完全干燥的空气中于1 633 K时,能生成质量分数50.65%Al 2O3和49.35%的CaO两者的低共熔混合物(eutectic mixture)[7],在此种情况下,C12A7在相图中当然没有稳定的相区。最近报道C12A7具有宝贵的电性能。 此相图的化合物与水泥密切相关。C12A7虽然在硅酸盐水泥和矾土水泥中均有存在,但它的水化活性较差,是水泥中不希望有的矿物组成。此外,C12A7还是一种良的导体,但是好的电导体却很少是透明的[26]。Nature(03 Oct. 2002)报道了在氢气气氛中,通过热处理,可把氢离子结合进C12A7,从而把它做成透明的。C3A与水反应强烈,硅酸盐水泥中C3A含量较高时,水化速度较快。CA是矾土水泥的主要矿物,CA和水化合时反应较快,产物强度也较高,所以矾土水泥也称为快硬高强水泥。此外,CA2常作为耐火水泥的主要矿物。
第二十讲三元相图总结
第二十讲三元相图总结 第五节三元相图总结 一、主要内容: 三元系的两相平衡 三元系的三相平衡 三元系的四相平衡 三元相图的相区接触法则 三元合金相图应用举例 二、要点: 三元系的两相平衡特点,共轭曲面,共轭曲线,三元系三相平衡特点(共晶型,包晶型),等温截面的相区接触法则,三元系的四相平衡特点,三元共晶反应型,包晶反应型,三元包晶反应型,利用单变量线的走向判断四相平衡类型,相区接触法则 三、方法说明: 掌握三元合金相图的特点,使学生能够看懂并应用三元相图,重点是掌握相区接触法则,利用单变量线判断四相平衡的类型,利用杠杆定律,重心法则估算出各组成相的相对含量 授课内容: 一、三元系的两相平衡 三元相图的两相区以一对共轭曲面为边界,所以无论是等温截面还是变温截面都截取一对曲线为边界。 在等温截面上平衡相的成分由两相区的连线确定,可用杠杆定律计算相的相对含量。 在变温截面上,只能判断两相的温度变化范围,不反应平衡相的成分。 二、三元系的三相平衡 三元系的三相平衡区的立体模型是一个三棱柱体,三条棱边为三个相成分的单变量线。 三相区的等温截面图的三个顶点就是三个相的成分点。各连接一个单相区,三角形的三个边各邻接一个两相区。可以用重心法则计算三个相的含量。 如何判断三相平衡是二元共晶反应还是二元包晶反应? 在垂直截面图中,曲边三角形的顶点在上方的是二元共晶反应;顶点在下方的是二元包晶反应。 三、三元系的四相平衡 三元系的四相平衡,为恒温反应。如果四相平衡中由一个相是液体三个相是固体,会有如下三种类型: 1)三元共晶反应: 2)包共晶反应: 3)三元包晶反应: 四个三相区与四相平衡平面的邻接关系有三种类型: 1)在四相平面之上邻接三个三相区,是三元共晶反应。 2)在四相平面之上邻接两个三相区,是包共晶反应。 3)在四相平面之上邻接一个三相区,是三元包晶反应。 液相面的投影图应用的十分广泛。 以单变量线的走向判断四相反应类型: 当三条液相单变量线相交于一点时,在交点所对应的温度必然发生四相平衡转变。 1)若三个箭头都指向交点为三元共晶反应。 2)若两条液相单变量线的箭头指向交点,一条背离交点,发生包共晶反应。 3)若一条液相单变量线的箭头指向交点,两条背离交点,发生三元包晶反应。
