苯亚甲基苯乙酮的制备(期末实验报告)
苯亚甲基苯乙酮的制备
一、实验的目的和要求:
1. 掌握羟醛缩合反应的原理和机理;学会苯亚甲基苯乙酮的合成方法;
2. 掌握水蒸气蒸馏
3. 掌握反应温度控制方法;恒压滴液漏斗的使用。巩固重结晶。
二、实验原理:
苯甲醛的沸点是178,如果直接蒸馏的话,到达179度它会在空气中氧化,于水微溶,采用水蒸气蒸馏,用水把它带出,增大蒸汽压,低温下就可蒸出提纯。
水蒸汽蒸馏操作是将水蒸气通入不溶或难溶于水,但有一定挥发度性的有机物质(在 100℃其蒸气压至少为5-10mmHg ,665.5—1333Pa )中,使该有机物质在低于100℃的温度下,随着水蒸汽一起蒸馏出来。根据道尔顿分压定律,两种互不相溶的液体混合物的蒸气压等于两液体单独存在时的蒸气压之和。因为当组成混合物的两液体的蒸气压之和等于大气压力时混合物就开始沸腾(此时的温度为共沸点)。所以互不相溶的液体混合物的沸点,要比每一物质单独存在时的沸点低。
NaOH -H 2O
C 6H 5CHO + CH 3COC 6H 5
C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5
OH +H 2H C
H 2C O
+C
H 2C O
C O
C O
H CH CH 2
O O
+CH CH 2
O O CH 2
O OH
+OH
C 6H 5CH=CHCOC 6H 5
-H 2O
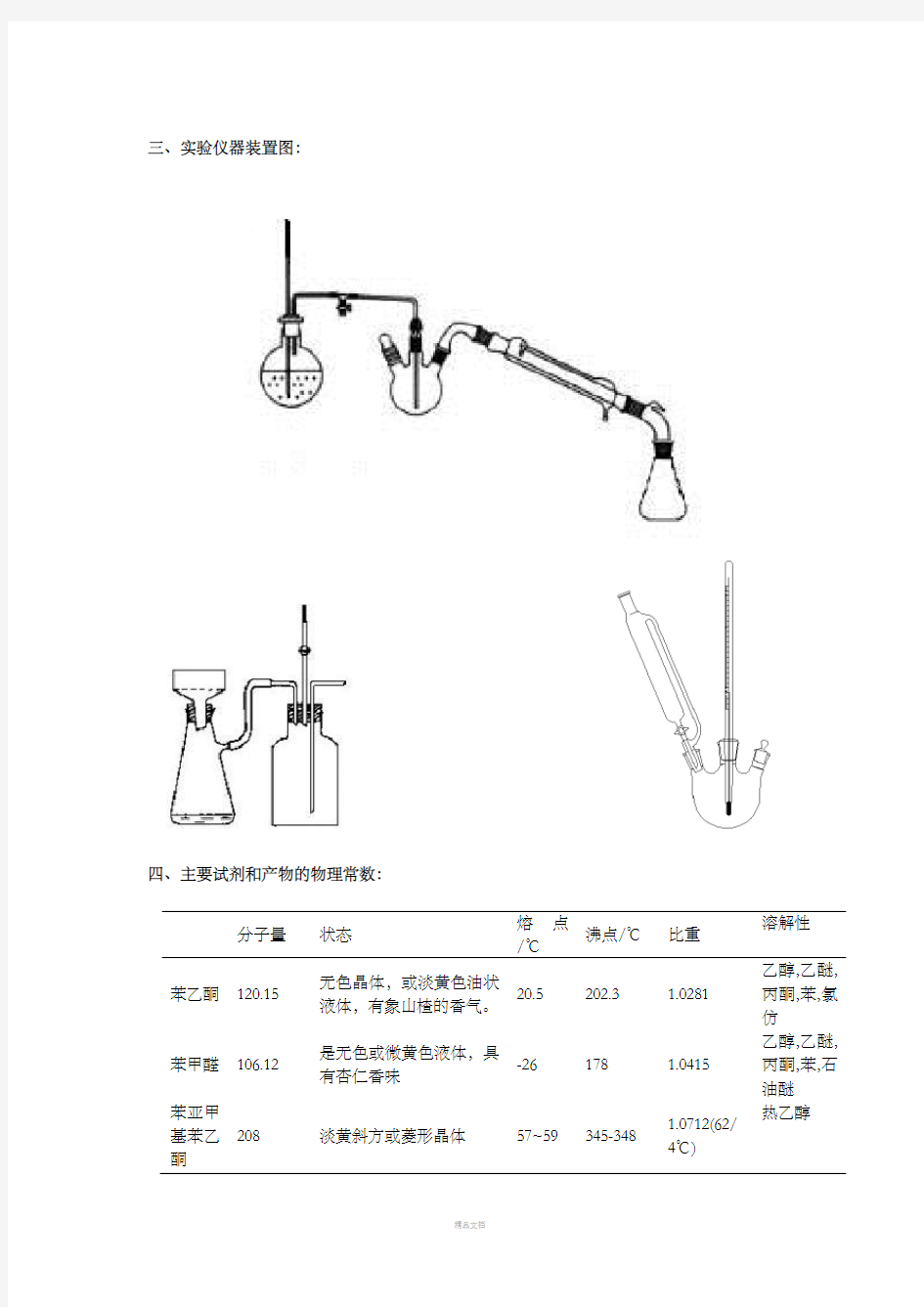
三、实验仪器装置图:
四、主要试剂和产物的物理常数:
分子量状态熔点
/℃
沸点/℃比重
溶解性
苯乙酮120.15无色晶体,或淡黄色油状
液体,有象山楂的香气。
20.5202.3 1.0281
乙醇,乙醚,
丙酮,苯,氯
仿
苯甲醛106.12是无色或微黄色液体,具
有杏仁香味
-26178 1.0415
乙醇,乙醚,
丙酮,苯,石
油醚
苯亚甲
基苯乙酮208淡黄斜方或菱形晶体57~59345-348
1.0712(62/
4℃)
热乙醇
主要仪器:恒压滴液漏斗、25mL三口烧瓶、25mL圆底烧瓶、直形冷凝管、接液管、弹簧夹、磁力搅拌器、布氏漏斗、抽滤瓶
主要试剂:10%氢氧化钠水溶液、95%乙醇、苯乙酮、苯甲醛
五、实验步骤
1.苯甲醛的蒸馏
在三口烧瓶中加入2mL苯甲醛与3-5mL水后,加热圆底烧瓶中的水至沸腾(为节省时间可先加入热水),当有水蒸气从T形管的支管冲出时,旋紧原来打开着的弹簧夹,使水蒸气通入三口烧瓶中,并对烧瓶中的液体进行加热,使混合物沸腾,不久有液体流出,控制流出液的速度为每秒2—3滴。为了保证烧瓶内混合物不致增加太多,必要时(体积超过三口烧瓶容积1/3),可在通水蒸气的同时,将烧瓶用酒精灯小火加热,以避免水蒸气过多地在烧瓶中冷凝成水。
当馏出液已经澄清透明,不再含有机物油珠时,即可停止蒸馏。蒸馏完毕,首先打开螺旋夹,然后停止加热,最后停止通冷却水。
2.苯亚甲基苯乙酮的制备
在25 mL三口瓶中,加入5 mL10%氢氧化钠水溶液、5 mL95%乙醇和加入1.3mL苯乙酮,三口瓶装上温度计和恒压滴液漏斗,另一口用磨口塞子塞塞住,启动磁力搅拌,慢慢滴加1.2mL新蒸馏过的苯甲醛,维持温度在20-25℃必要时用冷水浴冷却,滴加完毕后,继续保持此温度搅拌45min,将反应液在冰水浴中充分冷却使结晶完全.,待结晶析出完全后,减压过滤,用水充分洗涤,至洗涤液对石蕊试纸呈中性。粗产品可用95%乙醇重结晶.。若颜色过深,可用活性碳脱色。得浅黄色片状结晶约1.5g。
注意要点
(1)苯甲醛须新蒸馏后使用。
(2)控制好反应温度,温度过低产物发粘,过高副反应多。
六、实验数据记录
产品:1.3g
七、产率计算:
理论产量:M=nm=208*0.072=1.5g
实际产量:1.1g
产率:1.1g/1.5g*100%=73.3%
八、结论:
1.苯甲醛容易变质变成苯甲酸,导致实验产率偏低。通过蒸馏可以把苯甲醛分离出来。
2.水蒸气蒸馏可以在较低的温度下蒸出沸点较高的有机物。
3.制备苯亚甲基苯乙酮必须控制好反应的温度,否则会使副反应增多,产率在70%左右。
九、思考题
1.本反应中若将稀碱换成浓碱可以吗,为什么?
答:不能.如果换成浓碱,苯甲醛发生自身的氧化还原反应(即康尼扎罗反应,cannizzaro),生成苯甲酸和苯甲醇.对你目标的反应不利。
2.本实验中如何避免副反应的发生?
答:先将苯乙酮与碱混合,产生碳负离子,控制低温,防止苯乙酮的自身缩合;采取控温滴加与搅拌,有利于发生交叉羟醛缩合而防止苯甲醛的岐化。
3.本实验中,苯甲醛与苯乙酮加成后为什么不稳定并会立即失水?
答:生成的反式烯烃稳定,或者说亚甲基氢受羰基和羟基的影响比较活泼,易于消除。
九、参考文献:
[1]李霁良. 微型半微型有机化学实验[ M]. 高等教育出版社. 2003
对硝基苯甲酸的制备1
对硝基苯甲酸的制备 一、实验目的: 1. 掌握利用对硝基甲苯制备对硝基苯甲酸的原理及方法。 2. 熟练掌握回流、抽滤、重结晶等过程的操作。 3. 练习并掌握固体酸性产品的纯化方法。 二、实验原理: 三、实验操作流程图: 250mL + 6g 对硝基甲苯 18g K 2Cr 2O 7 40mL H 2O 颜色 ? 搭建回流 搅拌装置 小火微沸 回流0.5h 颜色 ? 稍 冷 倒入盛有80mL 冷水的250m L 的烧杯 S 抽 滤 粗产品 颜 色 ? 25mL ×2 水洗涤 转移到盛有 30mL 50% H 2SO 4 的250m L 烧杯 (研碎固体) 直火煮沸 10min 转移到盛有 50mL 5% NaOH 的250m L 烧杯 滤 液 1g 活性C 脱 色 趁热抽滤 滤 液 冷 却 搅拌下缓慢转移到盛有 60mL 15% H 2SO 4的250mL 烧杯 冰水冷却 10min S ↓ 颜色 ? 抽 滤 少量水洗涤2次 产 品 100~105℃ 烘箱干燥 20min CH 3 NO 2 +Na 2Cr 2O 7+4H 2SO 4 + ++Na 2SO 4Cr 2(SO 4)35H 2O CO 2H NO 2 煮 沸3 min 50℃温热溶解 抽 滤 缓慢加入 25mL 浓 硫酸20m i n 加完 滤液(倒入指定废液桶) 沉 淀 物 t <沸腾温度 pH 为1~2 10mL ×2水洗 称重 计算产率
四、实验注意事项 1. 在滴加硫酸反应过程中由于反应剧烈放热,必要时可用冷水冷却,以免对硝基甲苯因升华而凝结在冷凝管内壁,故必须严格控制硫酸的滴加速度。 2. 滴加完后加热反应过程中,冷凝管内壁可能有对硝基甲苯析出,这时可适当关小冷凝水,使其熔融滴下。 3. 粗产品加硫酸煮沸的目的是溶解未反应的铬盐。 4. 沉淀用NaOH溶液处理的目的是除去未反应的对硝基甲苯(m.p.为51.3℃)和进一步除去铬盐(生成Cr(OH)3沉淀),如过滤温度过低,则对硝基苯甲酸钠也会析出而被滤去。 5. 不能把硫酸往脱色后的滤液中滴加,否则生成的沉淀会包含一些钠盐而影响产物的纯度。中和时应使溶液呈强酸性(pH为1~2),否则需补加少量的硫酸。 6. 所得的产品对硝基苯甲酸除可用升华法进行精制外,还可用50%的乙醇溶液精制。
对甲苯乙酮的制备
对甲苯乙酮的制备 作者:xxx 学号:xxx 摘要:以甲苯和乙酸酐为原料,无水氯化铝为催化剂,制备对甲基苯乙酮。在实验过程中,要求掌握实验室中利用Friedel Crafts酰基化制备对甲基苯乙酮的原理和方法。同时要求掌握带有气体吸收装置的加热回流等基本操作,学会控制无水的反应条件。 关键词:对甲苯乙酮、傅克酰基化反应、乙酸酐、尾气吸收 The preparation of toluene Acetophenone Author: xxx Number: xxx Abstract: Toluene and acetic anhydride is as raw materials,Anhydrous aluminium chloride is as catalyst to preparate for methyl acetophenone. In the experimental process, we require to master the principle and method of preparing methyl acetophenone using Friedel Crafts acyl laboratory. At the same time,we require to master with gas absorption heating reflux device and other basic operations,to learn to control the anhydrous reaction conditions. Keywords: absorption of toluene acetophenone, Friedel Crafts acylation reaction,acetic anhydride, tail gas 对甲基苯乙酮为无色略带黄色的透明液体,在稍低的温度下凝固,具有山楂子花的芳香及紫苜蓿、蜂蜜和香豆素的香味,且香气较苯乙酮较为柔和,极度稀释后有及草莓似的甜香味。对甲基苯乙酮的沸点为226度,熔点为28度,密度为1.0051,折射率为1.5335,闪点为92度,易溶于乙醇、乙醚、氯仿和丙二醇等,几乎不溶于水和甘油。对甲基苯乙酮有毒,应避免吸入对甲基苯乙酮的蒸气,避免与眼睛、皮肤接触,其存在于烤烟烟叶、白肋烟烟叶、香料烟烟叶、烟气中。天然存在于可可、黑醋栗、玫瑰木油、巴西檀木油、西藏柏木油、芳樟油,以及含羞草中。制备对甲基苯乙酮主要是采用乙酰化法,以甲苯和醋酸酐为原料,在无水三氧化铝催化剂存在下,进行乙酰化反应,然后冰解、中和、水洗、分离、蒸馏而得。也可以从巴西檀香木、玫瑰木等天然原料中经精馏提取而得。对甲基苯乙酮常用于调和花精油,也用于香皂及草莓等水果味香料的制造。对甲基苯乙酮也常用于烘烤食品、糖果、布丁,可用于日化香精和食用香精的配方中。 1.结果与讨论 1.1.实验装置的选取
实验十三.苯乙酮的制备
实验十三: 苯乙酮的制备 一、实验目的 1、学习傅-克酰基化制备芳酮的原理和方法; 2、初步掌握无水操作、吸收、搅拌、回流、滴加等基本操作。 二、实验原理 Friedel-Crafts 酰基化反应是制备芳酮的重要方法之一,酰氯、酸酐是常用的酰基化试剂,无水FeCl 3,BF 3,ZnCl 2和AlCl 3等路易斯酸作催化剂,分子内的酰基化反应还可以用多聚磷酸(PPA )作催化剂,酰基化反应常用过量的芳烃、二硫化碳、硝基苯、二氯甲烷等作为反应的溶剂。 用苯和乙酐制备苯乙酮的反应方程式如下: (CH 3CO)2O 3 CH 3 COOH ++COCH 3 具体过程: CH O CH 3 O O ++ 3 3 Cl 3δ CH 3COOAlCl 2CH 3O AlCl 3 红色溶液 + CH 3COOAlCl 2CH 3 O AlCl 3H 2O COCH 3 Al(OH)Cl +HCl 2CH 3COOH +Al(OH)Cl 2 Al(OH)Cl 2 Al + 3Cl + H 2O 三、实验药品及其物理常数 四、主要仪器和材料 升降台 木板 隔热垫 电炉 水浴锅 机械搅拌器 四氟搅拌套塞(19#) 玻璃搅拌 三口烧瓶(100 mL 、19#×3) 恒压滴液漏斗(14#×2) 大小头(口14#+塞19#) 空心塞(14#) 球形冷凝管(19#) 直形干燥
管(19#×2)分液漏斗圆底烧瓶(100 mL、19#)蒸馏头(19#)螺帽接头(19#)温度计(300℃) 直形冷凝管(19#)空气冷凝管(19#)真空接引管(19#)锥形瓶(50 mL、19#)量筒(100 mL)三角漏斗冰 五、实验装置 ⑴搅拌、滴加、回流、尾气吸收装置⑵萃取、洗涤装置 ⑶常压蒸馏回收低沸物装置⑷减压蒸馏提纯高沸物装置 六、操作步骤
新实验药物合成实验报告
实验一TLC铺板、干燥、活化、色谱用硅胶柱的填装 1.硅胶薄层色谱板的制备、干燥和活化 薄层色谱中的吸附剂是铺在玻璃、塑料或金属片或薄板上的较薄的、均匀的一层细粉状物质,因支持剂的种类、制备方法和选用溶剂的不同,可按吸附、分配或二者结合的方式达到分离化合物的目的。可以通过比较斑点的R f值,或将未知样品与对照品在同一板上展开至同样高度,对样品进行初步的鉴定。还可通过比较可见斑点的大小进行半定量的判断。还可以通过光密度测量法实现定量测定。 TLC中涂布的物质与柱色谱用的吸附剂非常相似,如硅胶、氧化铝、聚酰胺等,只是它们的颗粒更细一些,一般直径为5~40μm。有些还含有石膏、淀粉等粘合剂以增强涂层与薄板的粘合力。有时里面还含有荧光指示剂(如硅酸锌等),在254或365nm的紫外光下能显示荧光,可借此对分离的斑点进行检测。到目前为止,硅胶是最常用的薄层色谱吸附剂。 在涂布吸附剂时,用于排列和放置薄板的排列盘和具有平整表面的薄板是必需的。而涂布器也很常用,当它从玻璃板上移过时,会在板的表面均匀铺上所需厚度的吸附剂涂层。 (1)实验目的 掌握硅胶薄层色谱板的制备方法。 (2)仪器和试剂 ①玻璃板(5×10cm或10×20cm,洁净且干燥); ②薄层色谱用硅胶G; ③%羧甲基纤维素钠水溶液; (3)实验步骤 ①把玻璃板在排列盘中依次相邻放好,置涂布器于其中一端。 ②在具塞锥形瓶中把一份硅胶G和2~3份CMC-Na溶液混合,并用力振摇30秒。 ③把混好的糊倒入涂布器中,均匀地移动涂布器至排列盘的另一端后,移开涂布器。 ④铺好的板静置5分钟,然后把它们面朝上移至一个水平的平面上,阴干。 ⑤把阴干后的板在105℃的烘箱中烘30分钟。 ⑥待板凉至室温后,置干燥器中保存。 2.色谱用硅胶柱的填装 液相柱色谱可以是液-固色谱或液一液色谱。如果固定相是吸附剂,也称为液相吸附色谱.若为离子交换物质,就称为离子交换色谱;若为非离子的聚合物,如聚苯乙烯或hadex,则称为凝胶渗透色谱、凝胶过滤色谱或分子排阻色谱。在柱中或纸上的液一液分配色谱可以进一步分为正相分配色谱(极性固定液)和反相分配色谱(固定相非极性)。 对于液相吸附色谱来说,固定相是填入柱中的表面活性固体(如氧化铝、硅胶和活性炭
实验十二 苯亚甲基苯乙酮的制备
实验十二 苯亚甲基苯乙酮的制备 一、实验目的 1、掌握羟醛缩合反应原理和方法; 2、掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。 3、巩固产物重结晶的方法。 二、反应原理 NaOH -H 2O C 6H 5CHO + CH 3COC 6H 5 C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5 反应历程: OH +H 2C O H H 2C O +C H 2C O C O C O CH 2 O O +C CH 2 O O C CH 2 O OH +OH C 6H 5CH=CHCOC 6H 5 -H 2O
四、实验装置图 五、反应步骤 苯亚甲基苯乙酮是由苯甲醛与苯乙酮在10%氢氧化钠溶液催化下缩合而合成。为了使反应顺利进行和控制苯甲醛的滴加速度,通常在装有搅拌器、温度计和滴液漏斗的三颈瓶中进行。 在装有搅拌器、温度计和恒压漏斗的250ml三口烧瓶中,加入25mL10%氢氧化钠溶液、50mL 95%乙醇和12ml苯乙酮。保持反应温度在20~250C之间,搅拌下由恒压漏斗滴加10mL 苯甲醛,控制滴加速度(5-10min滴完)。滴加完毕后,继续保持此温度搅拌搅拌1~1.5h,即有固体析出。反应结束后将三口烧瓶置于冰水浴中冷却15~30min,使结晶完全。 抽滤收集产物,用水充分洗涤,至洗涤液对PH 试纸显中性,得苯亚甲基苯乙酮粗品。粗产物用95%乙醇重结晶(每克产物约需4~5mL溶剂),若溶液颜色较深可加少量活性炭脱色,得浅黄色片状结晶产物,熔点56~570C。 六、实验流程
七、注意要点 (1)稀碱最好新配(浓度要够)。 (2)控制好反应温度,温度过低产物发粘,过高副反应多。 (3)洗涤要充分,可转移至烧杯中进行。 (3)产物熔点较低,重结晶加热时易呈熔融状,故须加乙醇作溶剂使呈均相。 八、思考题 1.本实验中如何避免副反应的发生? 答:先将苯乙酮与碱混合,产生碳负离子,控制低温,防止苯乙酮的自身缩合;采取控温滴加与搅拌,有利于发生交叉羟醛缩合而防止苯甲醛的岐化。 3.本实验中,苯甲醛与苯乙酮加成后为什么不稳定并会立即失水? 答:生成的反式烯烃稳定,或者说亚甲基氢受羰基和羟基的影响比较活泼,易于消除。
对硝基苯甲酸的制备
对硝基苯甲酸的制备(预习报告) 一、实验目的 1、掌握利用对硝基甲苯制备对硝基苯甲酸的原理及方法。 2、掌握电动搅拌装置的安装及使用。 3、练习并掌握固体酸性产品的纯化方法。 二、实验原理 C H3 N O2 N a2C r2O7H 2 SO4 + + 4 H 2 ++ + Na2SO4C r2(S O4)3H 2 O 5 该反应为两相反应,还要不断滴加浓硫酸,为了增加两相的接触面,为了尽可能使其迅速均匀地混合,以避免因局部过浓、过热而导致其它副反应的发生或有机物的分解,本实验采用电动搅拌装置。这样不但可以较好地控制反应温度,同时也能缩短反应时间和提高产率。 生成的粗产品为酸性固体物质,可通过加碱溶解、再酸化的办法来纯化。纯化的产品用蒸汽浴干燥。 三、实验药品用量及物理常数
四、实验装置图 滴 液 漏 斗 反应装置 抽滤装置干燥 装置 面皿 布氏漏斗 抽 滤 瓶 五、实验流程及步骤 对硝基甲苯 重铬酸钠 15m l水 30分钟 1.安装带搅拌、回流、滴液的装置如图 2.在250ml的三颈瓶中依次加入6g对硝基甲苯,18g重铬酸钾粉末及40ml水。 3.在搅拌下自滴液漏斗滴入25ml浓硫酸。(注意用冷水冷却,以免对硝基甲苯因温度过高挥发而凝结在冷凝管上)。 4.硫酸滴完后,加热回流0.5h,反应液呈黑色。(此过程中,冷凝管可能会有白色的对硝基甲苯析出,可适当关小冷凝水,使其
熔融滴下)。 5.待反应物冷却后,搅拌下加入80ml冰水,有沉淀析出,抽滤并用50ml水分两次洗涤。 6.将洗涤后的对硝基苯甲酸的黑色固体放入盛有30ml 5%硫酸中,沸水浴上加热10min,冷却后抽滤。(目的是为了除去未反应完的铬盐) 7.将抽滤后的固体溶于50ml 5%NaOH溶液中,50℃温热后抽滤,在滤液中加入1g活性炭,渚沸趁热抽滤。(此步操作很关键,温度过高对硝基甲苯融化被滤入滤液中,温度过低对硝基苯甲酸钠会析出,影响产物的纯度或产率) 8.充分搅拌下将抽滤得到的滤液慢慢加入盛有60ml 15%硫酸溶液的烧杯中析出黄色沉淀,抽滤,少量冷水洗涤两次,干燥后称重。(加入顺序不能颠倒,否则会造成产品不纯)。 9.混合溶剂重结晶粗对硝基苯甲酸。 六、实验注意事项 1、安装仪器前,要先检查电动搅拌装置转动是否正常,搅拌棒要垂 直安装,安装好仪器后,再检查转动是否正常。 2、从滴加浓硫酸开始,整个反应过程中,一致保持搅拌。 3、滴加浓硫酸时,只搅拌,不加热;加浓硫酸的速度不能太快,否 则会引起剧烈反应。 4、转入到40ml冷水中后,可用少量(约10ml)冷水再洗涤烧瓶。 5、碱溶时,可适当温热,但温度不能超过50℃,以防未反应的对硝
第四章酰化反应答案
第四章 酰化反应 答案 一、完成下列反应 1、 Cl Cl Cl O O +AlCl 3 西替利嗪中间体 金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。实用医药杂志。2005.22(12).1108-1109 2、 N H H N O Cl O Cl N H N O Cl O HCl 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 3、 N H H N O Cl O O N H N O Cl O 2 HCl Cl 3 阿洛西林中间体 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 4、 N H H N O NaH N H Na N O CH COCl N H N O O 青霉素。 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000, 5、 H H N O SO 2Cl N H N O O 2 HCl 半合成β-内酰胺类抗生素 苏为科,何洪潮。医药中间体制备方法。化学工业出版社。2000
6、 O O 3 C O CH 2CH 2COOH 芬不芬 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,1340 7 N H S O O O N S COCH 3 乙酰丙嗪 8 NH 2COOH NHCOCH 3COOH 安眠酮 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,13 9 N N S H 2N SH O 3 O N N S HN SH 3 乙酰唑胺 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,14 10 NH 2 OH O O O NHCOCH 3 OH 嘧啶苯芥 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,15 11 NH 2 3NHCOCH 3 磺胺类药物 章思规。实用精细化学品手册(有机卷)下。化学工业出版社。1996,17 12
高中化学溴苯与硝基苯的制取实验操作口诀
高中化学溴苯与硝基苯的制取实验操作口诀 溴苯制取实验 苯溴铁屑诉离情,微沸最佳管冷凝,云海茫茫卤酸雾,溴苯无色常变棕。 除溴需用碱液洗,漏斗分液便告成。 解释: 1. 苯溴铁屑诉离情:意思是说在实验室中是用苯、溴在铁屑做催化剂的条件下制取溴苯[联想:加药品时应先苯再溴后铁]。 2. 微沸最佳管冷凝:"微沸最佳"的意思是说注意控制反应速度,以反应物液面微微沸动为宜,不可太激烈,否则大量苯和溴蒸发出来造成实验失败;"关冷凝"的意思是说跟瓶口垂直的一段长导管除导气外,还可以兼起冷凝器的作用,使蒸发出来的苯或溴回流回去。 3. 云海茫茫卤酸雾:意思是说在常温时很快就会看到在导管口出现白雾,这是反应生成的溴化氢遇水蒸气所形成的酸雾[联想:溴化氢溶入锥形瓶中的水中,生成氢溴酸。因此反应完毕后,向锥形瓶里滴入硝酸银溶液,则有浅黄色溴化银沉淀生成:HBr+AgNO3=AgBr↓+HNO3。 4. 溴苯无色常变棕:意思是说把烧瓶里的生成物倒入盛有蒸馏水的烧杯里,烧杯底部有褐棕色的不溶于水的液体,这是溴苯,它本是比水重的无色液体,由于溶解了溴而常显褐棕色。 5. 除溴需用碱液洗,漏斗分液便告成:这句的意思是说除掉溴笨中的溴用碱液(常用10%的NaOH)洗涤后,再用分液漏斗分离即可。
硝基苯制取实验 硝酸硫酸冷滴苯,黄色油物杏仁味。 温计悬浴加冷管,硫酸催化又脱水。 解释: 1. 硝酸硫酸冷滴苯:意思是说浓硝酸和浓硫酸混合后,必须立即在50-60℃的水浴中冷却后再滴入苯(否则,一方面两酸混合产生大量的热,使混合酸的温度升高,那么一部分浓硝酸将分解了;另一方面,苯的沸点比较低,大量的苯将蒸发掉,影响硝基苯的产率)。 2. 黄色油物杏仁味:意思是说反应完毕把试管里的混合物倒入盛着水的烧杯中去,则过量的硝酸和硫酸就溶解在水里,而聚集在烧杯底的具有浓烈的苦杏仁气味的黄色油状液体就是硝基苯,硝基苯是无色的液体,由于溶解了一些杂质,所以常显黄色。 3. 温计悬浴加冷管:"温计悬浴"的意思是说温度计必须悬吊在水浴中,切不可与烧杯底接触;"加冷管"的意思是说为了防止苯的蒸发,需在试管口塞上一个起冷凝管作用的长玻璃导管。 4. 硫酸催化又脱水:意思是说硫酸在这里既做催化剂又做脱水剂。
苯乙酮的制备
实验十二苯乙酮的制备 【实验目的】 1.学习利用Friedel-Crafts酰基化反应制备芳香酮的原理与方法。 2.巩固无水实验操作的基本实验技巧。 【实验原理】 Friedel-Crafts酰基化反应是制备芳香酮的最重要和常用的方法之一,酸 酐是常用的酰化试剂,无水FeCl 3,BF 3 ,ZnCl 2 和AlCl 3 等路易斯酸作催化剂,分 子内的酰化反应还可用多聚磷酸(PPA)作催化剂。酰基化反应常用作过量的液体芳烃、二硫化碳、硝基苯、二氯甲烷等作为反应的溶剂。该类反应一般为放热反应,通常是将酰基化试剂配成溶液后,慢慢滴加到盛有芳香族化合物的反应瓶中。用苯和乙酸酐制备苯乙酮的反应方程式如下: +(CH3CO)2O3COCH 3 +CH 3 COOH 【仪器与药品】 仪器:三颈烧瓶(100ml)、恒压滴液漏斗、机械搅拌器、回流冷凝管、分液漏斗、蒸馏装置 药品:无水三氯化铝、无水苯、乙酐、浓盐酸、氢氧化钠(10%)、无水硫酸镁 【实验装置图】
【实验步骤】 向装有恒压滴液漏斗、机械搅拌器和回流冷凝管(上端通过一氯化钙干燥管与氯化氢气体吸收装置相连)的100ml三颈烧瓶中[1]迅速加入研细的13g(0.097 mol)无水三氯化铝[2]和16 ml(约14g,0.18 mol)无水苯。在搅拌下自滴液漏斗慢慢滴加4ml乙酐(约4.3g,0.04mol),ml回流,直到不再有氯化氢气体逸出为止(约30 min)。 将反应混合物冷却到室温,在搅拌下倒入18 ml浓盐酸和35g萃冰的烧杯中(在通风橱中进行)。若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层每次用8 ml苯萃取2次。合并有机层,依次用15 ml 10%氢氧化钠、15 ml水洗涤,无水硫酸镁干燥。 将干燥后的反应混合物在水浴上蒸馏回收苯,然后再石棉网上加热蒸去残留的苯,稍冷却后改用空气冷凝管,蒸馏收集195~202oC馏分,产量约为4g。 纯苯乙酮为无色透明油状液体。 【注释】 [1] 本实验所用仪器和试剂均需充分干燥,否则影响反应顺利进行,装置中凡是与空气相连的部位,应安装干燥管。 [2] 由于芳香酮与三氯化铝可形成配合物,与烷基化反应相比,酰基化反应的催化剂用量大得多。对烷基化反应n(AlCl3)/n(RX)=0.1,酰基化反应n(AlCl3)/n(RCOCl)=1.1,由于芳烃与酸酐反应产生的有机酸会与AlCl3反应,所以n(AlCl3)/n(Ac2O)=2.2。
苯乙酮的制备
苯乙酮的制备 实验目的: 学习利用Friedel-Crafts酰基化反应制备芳香酮的原理和方法。 实验原理: Friedel-Crafts酰基化反应是制备芳香酮的最重要和最常用的方法之一,可用FeCl3,SnCl2, BF3,ZnCl2, AlCl3,等Lewis酸作催化剂,催化性能以无水AlCl3和无水AlBr3为最佳;分子内的Friedel-Crafts酰基化反应还可用多聚磷酸(PPA)作催化剂。酸酐是常用的酰化试剂,这是因为酰卤味难闻而酸酐原料易得,纯度高,操作方便,无明显的副反应或有害气体放出,反应平稳且产率高,生成的芳酮容易提纯。 酰基化反应常用过量的液体芳烃、二硫化碳、硝基苯、二氯甲烷等作为反应的溶剂。 Friedel-Crafts反应时一个放热反应,通常是将酰基化试剂配成溶液后慢慢滴加到盛有芳香族化合物溶液的反应瓶中,并需密切注意反应温度的变化。 由于芳香酮与三氯化铝和形成配合物,与烷基化反应相比,酰基化试剂的催化剂用量大得多。对烷基化反应,AlCl3/RX(摩尔比)=0.1,酰基化反应AlCl3/RCOCl=1.1,由于芳烃与酸酐反应产生的有机酸会与AlCl3反应,所以AlCl3/Ac2O=2.2。 实验步骤: 向装有10ml恒压滴液漏斗、机械搅拌装置[1]和回流冷凝管(上端通过一个氯化钙干燥管与氯化氢气体吸收装置相连)的100ml三颈烧瓶中迅速加入13g(0.097mol)分装无水三氯化铝和16ml(约14g,0.18mol)无水苯[2]。在搅拌下将4ml(约4.3g,0.04mol)乙酐[3]自滴液漏斗慢慢滴加到三颈烧瓶中(先加几滴,待反应发生后再继续滴加),控制乙酐的滴加速度以使三颈烧瓶稍热为宜。加完后(约需10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。 将反应混合物冷到室温,在搅拌下倒入18ml浓盐酸和35g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层(哪一层?),水层用苯萃取2次(每次8ml)。合并有机层,依次用15ml10%氢氧化钠、15ml水洗涤,在用无水硫酸镁干燥。 先在水浴上蒸馏回收苯,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管(为什么?)蒸馏收集195~202℃馏分,产量约为4.1g(产率85%)。 纯苯乙酮为无色透明油状液体,bp为202℃,mp为20.5℃,n D201.5372. 注释: [1] 本实验也可用电磁搅拌器或人工振荡代替机械搅拌,此时可改用二颈烧瓶。若采用人工振荡,回流时间应增长以提高产率。 [2] 本实验所用的仪器和试剂均需充分干燥。无水AlCl3质量的好坏对实验的影响很大,研细、称量、投料都要迅速;可用带塞锥形瓶称量AlCl3,投料时将纸卷成筒状插入瓶颈。从普通苯中除去噻吩的方法为:用等体积的15%H2SO4洗涤数次,直至酸层为无色或淡黄色。再分别用水、10%Na2CO3溶液、水洗涤,用无水氯化钙干燥过夜,过滤,蒸馏。 [3]乙酐在用前应重新蒸馏,收集137~140℃馏分备用。 课后思考题(在实验报告中回答): 1 反应完成后为什么加入浓盐酸和冰水混合物来分解产物? 2 下列试剂在无水三氯化铝存在下相互作用,应得什么产物? (1)过量苯+ClCH2CH2Cl (2)苯和马来酐
溴苯硝基苯实验室制备最全总结,有答案
溴苯、硝基苯的实验室制备实验题 一、溴苯的制备 1)原理: 2)2Fe+3Br2=2FeBr3 实验试剂:苯、液溴、铁粉 实验装置: 实验资料: 1.溴是一种易挥发有剧毒的药品 2.溴的密度比苯大 3.溴与苯的反应非常缓慢,常用铁粉作为催化剂 4.该反应是放热反应,不需要加热 5.反应最后苯和溴会有剩余它们易挥发 6.长导管在很多实验中被用作冷凝蒸气使之回流 7.溴化氢的性质与氯化氢相似 8.液体轻微翻腾,有气体逸出.导管口有白雾,溶液中生成浅黄色沉淀。烧瓶底部有褐色 不溶于水的液体 问题:(此问题答案的得出可依照上面“反应物说明”的信息) 1.本实验的现象有? 2.试剂的加入顺序是怎样的?各试剂在反应中起的作用是什么? 3.导管为什么要这么长?末端为何不插入液体? 4.纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色 液体,为什么?产物中含有什么杂质,如何分离?分离步骤?
5.实验过程中看到导管口有白雾,为什么? 6.哪种事实说明苯与液溴发生了取代反应而不是加成反应? 7.该反应为什么不能在溴水中而在液溴中进行?能用浓溴水代替液溴吗?为什么? 8.反应的速度为什么一开始较缓慢,一段时间后明显加快? 9.生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?为什么? 如何除去混在HBr中的溴蒸气? 答案:1、圆底烧瓶内液体微沸,液面上方有红棕色气体,导管末端有白雾出现。 2.①为防止溴的挥发,先加入苯后加入溴,然后加入铁粉。 ②溴应是纯溴,而不是溴水。加入铁粉起催化作用,实际上起催化作用的是FeBr3。 3、①伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。 ②导管未端不可插入锥形瓶内水面以下,因为HBr气体易溶于水,以免倒吸。 4、①这是因为溴苯溶有溴的缘故。 ②含有溴单质、溴化氰、苯等杂质。 ③精确步骤: 水洗、用10%的NaOH溶液洗、水洗、用干燥剂干燥、过滤分液、蒸馏 说明各步骤的作用: a.水洗洗去溴与苯反应生成的氢溴酸。(HBr易溶于水而其它不易溶于水) b.用氢氧化钠洗去溴单质(溴和氢氧化钠反应) c.用水洗去多余的氢氧化钠(氢氧化钠溶于水而其他不易溶于水) d.干燥剂除去多余的水 e.蒸馏分离溴苯与苯(两者沸点不同,笨的沸点小,被蒸馏出,溴苯留在母液中) 5、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。 6、苯与溴反应生成溴苯的同时有溴化氢生成。 7、溴化铁,注意在有水存在时,溴化铁就会电离和水解,改变了溴化铁的结构,失去了 催化作用,反应就无法进行, 8、该反应是放热,随着反应的进行,温度升高,有利于加快反应速率。 9、不可靠,溴与硝酸银溶液种水反应生成的HBr也会与硝酸银反应生成白色沉淀。将导管内的气体通入盛有四氯化碳的洗气瓶后再通入硝酸银溶液。
苯乙酮的制备
苯乙酮的制备(6学时) 【实验目的】 学习利用Fridel-Crafts 酰基化反应制备芳香酮的原理和方法 【实验原理】 1877年法国化学家付瑞德和美国化学家克拉夫茨发现了制备烷基苯和芳酮的反应,简称为付—克反应。制备烷基苯的反应叫付—克烷基化反应,制备芳酮的反应叫付—克酰基化反应。Friedel —Craffs 烷基化反应可合成乙苯 许多Lewis 酸可作为Friedel —Craffs 反应的催化剂:无水AlCl 3、无水ZnCl 2、FeCl 3、SbCl 3、SnCl 4、BF 3等,因为酸是一种非质子酸,在反应中是电子对的接受者,形成碳正离子,便于向苯环进攻。在烷基化反应中,AlCl 3可以重复使用,所以烷基化反应的AlCl 3用量只需催化剂用量。 由Friedel —Craffs 酰基化反应制苯乙酮的原理: 反应历程: O C O CH 3 O CH 3+ AlCl O C CH 3 Cl + O C CH 3 O AlCl 2 从反应历程可看出: 1. 酰基化反应:苯乙酮与当量的氯化铝形成络合物,副产物乙酸也与当量氯化铝形成盐,反应中一分子酸酐消耗两分子以上的氯化铝 2. 反应中形成的苯乙酮/氯化铝络合物在无水介质中稳定,水解时,络合物被破坏,析出苯乙酮。氯化铝与苯乙酮形成络合物后,不再参与反应,因此,氯化铝的用量是在生成络合物后,剩余的作为催化剂
3. 氯化铝可以与含羰基的物质形成络合物,所以原料乙酸酐也与氯化铝形成分子络合物;另外,氯化铝的用量多时,可使醋酸盐转变为乙酰氯,作为酰化试剂,参与反应: O C CH 3 Cl O C CH 3 O AlCl 2 + AlOCl 4. 苯用量是过量的,苯不但作为反应试剂,而且也作为溶剂,所以乙酸酐才是产率的基准试剂。 5. 酰基化反应特点:产物纯、产量高(因酰基不发生异构化,也不发生多元取代) 【实验仪器及药品】 药品:乙酸酐 苯 硫酸镁 盐酸 氯化铝 氢氧化钠 仪器:圆底烧瓶 冷凝管 滴液漏斗 蒸馏装置 干燥管 搅拌装置 【主要反应试剂及产物的物理常数】 【实验装置图】 图8-1 无水滴加搅拌气体吸收反应装置 【实验步骤】 向装有10ml 恒压滴液漏斗、机械搅拌装置和回流冷凝管(上端通过一氯化钙干燥管与氯化氢气体吸收装置相连)的100ml 三颈烧瓶中迅速加入13g (0.097mol )粉状无水三氯化铝和16ml(约14g, 0.18mol)无水苯。在搅拌下将4ml (约4.3g,0.04mol )乙酐自滴液漏斗慢慢滴加到三颈烧瓶中(先加几滴,待反应发
苯亚甲基苯乙酮的制备
苯亚甲基苯乙酮的制备 一、实验目的 1 掌握羟醛缩合反应原理和方法; 2掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。巩固重结晶。 二、反应式 NaOH -H 2O C 6H 5CHO + CH 3COC 6H 5 C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5 反应历程: OH +H 2C O H C H 2C O +H 2C O C O C O H C CH 2 O O +CH CH 2 O O C CH 2 O OH +OH C 6H 5CH=CHCOC 6H 5 苯亚甲基苯乙酮又称查耳酮(cha-lcone)。有顺(Z)-,反(E)-异构体。(E)-构型:淡黄色棱状晶体,熔点58℃,沸点345~348℃(分解),219℃(2.4kPa)。(Z)-构型:淡黄色晶体,熔点45~46℃。合成的混合体:熔点55~57℃,沸点208℃(3.3kPa),相对密度1.0712,1.6458。溶于乙醚、氯仿、二硫化碳和苯,微溶于乙醇,不溶于石油醚。吸收紫外光。有刺激性。能发生取代、加成、缩合、氧化、还原反应。由苯乙酮在碱性条件下与苯甲醛缩合而成。用作有机合成试剂和指示剂。 查耳酮广泛应用于医药和日用化学品等领域。查耳酮经典的合成方法是在乙醇水溶液中,强碱氢氧化钠或氢氧化钾催化苯甲醛和苯乙酮羟醛缩合后脱水而得到。近年来,在无溶剂条件下的固相有机反应由于具有反应效率高、操作简单和环境友好等优点而深受关注。1990年首次报道了在无溶剂条件下使用氢氧化钠催化取代苯甲醛和苯乙酮羟醛缩合,以比较高的收率得到相应的查耳酮。1997年有人采用球磨技术进一步改善了有机固相反应的效率,克服了反应底物不能充分接触的缺点。在无溶剂条件下利用氢氧化钠和碳酸钾混合碱作为催化剂,使用球磨技术促进取代苯甲醛和苯乙酮的固相羟醛缩合,反应时间明显缩短,收率可达到90%~98%。 -H 2O
12、新实验:苯亚甲基苯乙酮的制备
实验名称:苯亚甲基苯乙酮的制备 一、实验目的: 1 掌握羟醛缩合反应原理和方法; 2掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。巩固重结晶。 二、实验原理: 强碱性条件下发生的羟醛缩合反应。反应式如下: 反应历程: 苯亚甲基苯乙酮又称查耳酮(cha-lcone)。有顺(Z)-,反(E)-异构体。(E)-构型:淡黄色棱状晶体,熔点58℃,沸点345~348℃(分解),219℃(2.4kPa)。(Z)-构型:淡黄色晶体,熔点45~46℃。合成的混合体:熔点55~57℃,沸点208℃(3.3kPa),相对密度1.0712,1.6458。溶于乙醚、氯仿、二硫化碳和苯,微溶于乙醇,不溶于石油醚。吸收紫外光。有刺激性。能发生取代、加成、缩合、氧化、还原反应。由苯乙酮在碱性条件下与苯甲醛缩合而成。用作有机合成试剂和指示剂。 查耳酮广泛应用于医药和日用化学品等领域。查耳酮经典的合成方法是在乙醇水溶液中,强碱氢氧化钠或氢氧化钾催化苯甲醛和苯乙酮羟醛缩合后脱水而得到。近年来,在无溶剂条件下的固相有机反应由于具有反应效率高、操作简单和环境友好等优点而深受关注。1990年首次报道了在无溶剂条件下使用氢氧化钠催化取代苯甲醛和苯乙酮羟醛缩合,以比较高的收率得到相应的查耳酮。1997年有人采用球磨技术进一步改善了有机固相反应的效率,克服了反应底物不能充分接触的缺点。在无溶剂条件下利用氢氧化钠和碳酸钾混合碱作为催化剂,使用球磨技术促进取代苯甲醛和苯乙酮的固相羟醛缩合,反应时间明显缩短,收率可达到90%~98%。
苯亚甲基苯乙酮是由苯甲醛与苯乙酮在10%氢氧化钠溶液催化下缩合而合成。为了使反应顺利进行和控制苯甲醛的滴加速度,通常在装有搅拌器、温度计和滴液漏斗的三颈瓶中进行。反应时间由滴加苯甲醛算起至加入晶种继续搅拌待反应瓶中有结晶止,需1.5~2.0h,产率67~72%。 三、物理常数 试剂用量减半:苯乙酮3g,0.025mol;苯甲醛2.65g, 0.025mol ,理论产量:5.2g 四、反应步骤 在装有搅拌器、温度计和恒压漏斗的50 ml三口烧瓶中,加入12.5ml 10%氢氧化钠溶液、7.5 ml 95%乙醇和3 ml苯乙酮。搅拌下由滴液漏斗 滴加2.5 ml苯甲醛,控制滴加速度,保持反应温度在25~30。C之间, 必要时用冷水浴冷却。滴加完毕后,继续保持此温度搅拌0.5 h。然后 加入几粒苯亚甲基苯乙酮作为晶种,室温下继续搅拌1~1.5 h,即有固 体析出。反应结束后将三口烧瓶置于冰水浴中冷却15~30 min,使结晶 完全。 抽滤收集产物,用水充分洗涤,至洗涤液对石蕊试纸显中性。然后 用少量冷乙醇(3~4 ml)洗涤结晶,挤压抽干,得苯亚甲基苯乙酮粗品。 粗产物用95%乙醇重结晶(每克产物约需4~5ml溶剂),若溶液颜色较 深可加少量活性炭脱色,得浅黄色片状结晶4~5g,熔点56~57。C。 五、实验流程 六、注意要点 (1)苯甲醛须新蒸馏后使用。 (2)控制好反应温度,温度过低产物发粘,过高副反应多。 (3)苯亚甲基苯乙酮熔点较低,溶样回流时会呈熔融油状物,需加溶剂使之真正溶解。本品可引起某些人皮肤过敏,故操作时慎勿触及皮肤。 (4)反应温度以25~30℃为宜,偏高则副产物较多,过低则产物发粘,不易过滤和洗涤。 (5)一般室温搅拌1h后即有晶体析出,但如有苯亚甲基苯乙酮成品,可在开始室温搅
对硝基苯甲醛的合成
对硝基苯甲醛的合成 一、实验目的 1. 了解苯环侧链氧化反应的原理和方法; 2. 掌握苯环侧链氧化反应的操作步骤和注意事项。 二、实验原理 对硝基苯甲醛是重要的医药、染料和农药中间体,在医药工业上常用于合成胺苯硫脲(Thioacetazonum)、甲氧苄胺嘧啶(TMP)和乙酰胺苯烟腙(INHA-17)等。 对硝基苯甲醛为白色或淡黄色晶体,熔点:106~107℃,不溶于水,微溶于乙醚,易溶于乙醇、苯、冰醋酸,难与蒸汽一同挥发。 合成路线如下: CH3 NO2CrO3/Ac2O NO2 CH(OAc)2 H2O/H2SO4 NO2 CHO 三、实验步骤 1、铬醋酸酐溶液的制备 向250ml的烧杯中加入57ml醋酸酐,在玻璃棒的搅拌下分批加入12.5g铬酸酐,搅拌均匀,待用。 2、对硝基苯甲醛二醋酸酯的制备 在250ml的四口瓶上配置搅拌器、温度计、回流冷凝器及滴液漏斗,将醋酸酐50ml及对硝基甲苯6.3g加入反应瓶中,冰盐浴冷却下加入浓硫酸10ml,冷却到0摄氏度,在搅拌下滴加事先制好的铬醋酸酐溶液,维持反应温度在10℃以下,加毕,于5~10℃反应2h,将反应混合物倒入250g碎冰中,搅拌均匀后再以冰水稀释至750ml,抽滤析出固体。将滤饼悬浮于40ml 2%的碳酸钠溶液中,充分搅拌后抽滤,依次用水、乙醇洗涤滤饼,抽干后得对硝基苯甲醛二醋酸酯粗品。 3、对硝基苯甲醛的制备
将上述制得的对硝基苯甲醛二醋酸酯粗品置于250ml的四口瓶中,加入水20ml、乙醇20ml、浓流酸2ml,加热回流30min,趁热抽滤,滤液在冰水中冷却后析出结晶,抽滤水洗,干燥后得产品,称重,计算收率。 四、注意事项 1、铬酸酐溶液配制:将铬酸酐在搅拌下分批加入到醋酐中,不能反加料,否则易爆炸。 2、滤液用50ml水稀释后还可以析出部分产品。
各类有机物的红外吸收峰
第四节各类有机化合物红外吸收光谱 σ伸缩振动,δ面内弯曲振动,γ面外弯曲振动 一、烷烃 饱和烷烃IR光谱主要由C-H键的骨架振动所引起,而其中以C-H键的伸缩振动最为有用。在确定分子结构时,也常借助于C-H键的变形振动和C-C 键骨架振动吸收。烷烃有下列四种振动吸收。 1、σC-H在2975—2845 cm-1范围,包括甲基、亚甲基和次甲基的对称与不对称伸缩振动 2、δC-H在1460 cm-1和1380 cm-1处有特征吸收,前者归因于甲基及亚甲基C-H的σas,后者归因于甲基C-H的σs。1380 cm-1峰对结构敏感,对于识别甲基很有用。共存基团的电负性对1380 cm-1峰位置有影响,相邻基团电负性愈强,愈移向高波数区,例如,在CH3F中此峰移至1475 cm-1。 异丙基1380 cm-1裂分为两个强度几乎相等的两个峰1385 cm-1、1375 cm-1叔丁基1380 cm-1裂分1395 cm-1、1370cm-1两个峰,后者强度差不多是前者的两倍,在1250 cm-1、1200 cm-1附近出现两个中等强度的骨架振动。 3、σC-C在1250—800 cm-1范围内,因特征性不强,用处不大。 4、γC-H分子中具有—(CH2)n—链节,n大于或等于4时,在722 cm-1有一个弱吸收峰,随着CH2个数的减少,吸收峰向高波数方向位移,由此可推断分子链的长短。 二、烯烃 烯烃中的特征峰由C=C-H键的伸缩振动以及C=C-H键的变形振动所引起。烯烃分子主要有三种特征吸收。 1、σC=C-H 烯烃双键上的C-H键伸缩振动波数在3000 cm-1以上,末端双键氢 C=CH2 在3075—3090 cm-1有强峰最易识别。 2、σC=C 吸收峰的位置在1670—1620 cm-1。随着取代基的不同,σC=C吸收峰的位置有所不同,强度也发生变化。 3、δC=C-H烯烃双键上的C-H键面内弯曲振动在1500—1000 cm-1,对结构不敏感,用途较少;而面外摇摆振动吸收最有用,在1000—700 cm-1范围内,该振动对结构敏感,其吸收峰特征性明显,强度也较大,易于识别,可借以判
二苯乙酮制备
二苯乙二酮的制备 安息香可被温和氧化剂醋酸铜氧化生成二苯乙二酮,铜盐被还原为亚铜盐,生成的亚铜盐不断地被硝酸铵氧化生成铜盐,硝酸铵被还原为亚硝酸铵,后者在反应条件下分解为氮和水。反应只用催化量的醋酸铜。醋酸铜是由冰醋酸和硫酸铜就地反应生成的。安息香也可被浓硝酸氧化成α-二酮,但反应生成的二氧化氮对环境产生污染 【方法1】 【药品】 安息香(自制),硝酸铵.冰酷酸,一水合硫酸铜、乙醇(95%). 【实验步骤】 在50 mL因底烧瓶中加入4.3 g(0.02 mol)安息香,12.5 rnl冰醋酸、2g(0.025 mol)粉状硝酸铵和2.5 mL 2%硫酸铜溶液[1],加入几粒沸石,装上回流冷凝管,在石棉网上缓慢加热并时加摇荡。当反应物溶解后开始放出氮气,继续回流1.5h 使反应完全。将反应混合物冷至50~60 ℃,在搅拌下倾入20mL冰水中,析出二苯乙二酮结晶。抽滤,用冷水充分洗涤,尽量压干,粗产物干燥后为3~3.5g,可用于下步合成。若要得到纯品,可用乙醇重结晶。 纯二苯乙二酮为黄色结晶.熔点为95 ℃。 本实验需4 h. 【方法2】 【药品】 安息香(自制)、浓硝酸、乙醇(95%) 【实验步骤】 将6.0(0.028 mol)自制的安息香和20.0 mL 浓硝酸(1.44 mol)加入圆底烧瓶中,混合均匀。泠凝管上端节一气体吸收装置,用稀碱吸收放出的氧化氮气体。 在搅拌下于沸水浴中加热10 ~ 12 min。加热过程中固体物逐渐溶解,并
伴有油状物生成。泠却至室温,自冷凝管顶端加入100 mL 冰冷的水,有黄色晶体析出。冰浴中冷却,使晶体析出完全。 抽滤,用冷水充分洗涤。粗产物可用乙醇重结晶,得黄色针状晶体约4.6 g。 本实验约需 4 h。 【注释】 [1] 2%醋酸铜可用下述方法制备:溶解2.5g一水合硫酸铜于100 mLlo%醋酸水溶液中,充分搅拌后滤去碱性铜盐的沉淀
甲苯硝化实验实验报告
甲苯的选择性硝化实验报告 姓名:陈祥林文岳 学院:化材 专业:化工 指导老师:葛承胜 2016年 11 月 14 日
目录 1. 绪论 (1) 2. 实验性质、目的和任务 (1) 3. 实验内容 (2) 3.1. 实验药品 (2) 3.2. 实验主要设备 (2) 3.3. 邻硝基甲苯和对硝基甲苯的合成 (3) 3.3.1. 反应时间的影响 (3) 3.3.2. 反应温度的影响 (6) 3.3.3. 溶剂的影响 (8) 3.3.4. 醋酐用量的影响 (10) 3.3.5. 硝酸盐的影响 (14) 4. 邻硝基甲苯和对硝基甲苯的分离 (16) 5. 产物分析 (16) 6. 总结 (16) 参考文献 (17) 致谢 (18)
1.绪论 摘要: 硝化反应(nitration),硝化是向有机化合物分子中引入硝基(-NO2)的过程,硝基就是硝酸失去一个羟基形成的一价的基团。芳香族化合物硝化的反应机理为:硝酸的-OH基被质子化,接着被脱水剂脱去一分子的水形成硝酰正离子(nitronium ion,NO2)中间体,最后和苯环行亲电芳香取代反应,并脱去一分子的氢离子。 在此种的硝化反应中芳香环的电子密度会决定硝化的反应速率,当芳香环的电子密度越高,反应速率就越快。由于硝基本身为一个亲电体,所以当进行一次硝化之后往往会因为芳香环电子密度下降而抑制第二次以后的硝化反应。必须要在更剧烈的反应条件(例如:高温)或是更强的硝化剂下进行。 常用的硝化剂主要有浓硝酸、发烟硝酸、浓硝酸和浓硫酸的混酸或是脱水剂配合硝化剂 硝化反应是生产染料、药物及某些炸药的重要反应,在现在化工工业中被广泛利用。硝化是向有机化合物分子中引入硝基的过程,硝基就是硝酸失去一个羟基形成的一价的硝基。对于脂肪族化合物的硝化代表产品为硝基烷烃,硝基烷烃为优良的溶剂,对纤维素化合物、聚氯乙烯、聚酰胺、环氧树脂等均有良好的溶解能力,并可作为溶剂添加剂和燃料添加剂。它们也是有机合成的原料,如用于合成羟胺、三羟甲基硝基甲烷、炸药、医药、农药和表面活性剂等。 关键词:固体酸、酸性离子液体、催化剂、甲苯、选择性硝化、气相色谱2.实验性质、目的和任务 硝基甲苯有邻、间、对位三种异构体, 其中对硝基甲苯是一种最为重要的精细化工中间体, 可广泛用于含能材料等合成领域。目前, 工业上普遍采用硝硫混酸硝化技术生产对硝基甲苯, 随着社会的进步, 该工艺的缺点日益突出:硝化产物邻位和对位异构体的重量比(o/p值)约为1.67, 而且几乎没有选择性;过程中会产生大量的废酸和有机酸性废水, 对设备腐蚀和环境污染严重, 无法满足可
