YBB20282012抗生素瓶用铝塑组合盖

ISO 8362-6-2010 注射容器及附件.注射小瓶用铝塑组合盖
Reference number ISO 8362-6:2010(E) ? ISO 2010 INTERNATIONAL STANDARD ISO 8362-6 Second edition 2010-06-01 Injection containers and accessories — Part 6: Caps made of aluminium-plastics combinations for injection vials Récipients et accessoires pour produits injectables — Partie 6: Capsules pour flacons d'injection fabriquées en un mélange aluminium-plastique Copyright International Organization for Standardization --`,,```,,,,````-`-`,,`,,`,`,,`---
ISO 8362-6:2010(E) PDF disclaimer This PDF file may contain embedded typefaces. In accordance with Adobe's licensing policy, this file may be printed or viewed but shall not be edited unless the typefaces which are embedded are licensed to and installed on the computer performing the editing. In downloading this file, parties accept therein the responsibility of not infringing Adobe's licensing policy. The ISO Central Secretariat accepts no liability in this area. Adobe is a trademark of Adobe Systems Incorporated. Details of the software products used to create this PDF file can be found in the General Info relative to the file; the PDF-creation parameters were optimized for printing. Every care has been taken to ensure that the file is suitable for use by ISO member bodies. In the unlikely event that a problem relating to it is found, please inform the Central Secretariat at the address given below. COPYRIGHT PROTECTED DOCUMENT ? ISO 2010 All rights reserved. Unless otherwise specified, no part of this publication may be reproduced or utilized in any form or by any means, electronic or mechanical, including photocopying and microfilm, without permission in writing from either ISO at the address below or ISO's member body in the country of the requester. ISO copyright office Case postale 56 ? CH-1211 Geneva 20 Tel. + 41 22 749 01 11 Fax + 41 22 749 09 47 E-mail copyright@https://www.360docs.net/doc/667386462.html, Web https://www.360docs.net/doc/667386462.html, Published in Switzerland ii ? ISO 2010 – All rights reserved Copyright International Organization for Standardization --`,,```,,,,````-`-`,,`,,`,`,,`---
铝塑组合瓶盖项目可行性研究报告
铝塑组合瓶盖项目可行性研究报告 核心提示:铝塑组合瓶盖项目投资环境分析,铝塑组合瓶盖项目背景和发展概况,铝塑组合瓶盖项目建设的必要性,铝塑组合瓶盖行业竞争格局分析,铝塑组合瓶盖行业财务指标分析参考,铝塑组合瓶盖行业市场分析与建设规模,铝塑组合瓶盖项目建设条件与选址方案,铝塑组合瓶盖项目不确定性及风险分析,铝塑组合瓶盖行业发展趋势分析 提供国家发改委甲级资质 专业编写: 铝塑组合瓶盖项目建议书 铝塑组合瓶盖项目申请报告 铝塑组合瓶盖项目环评报告 铝塑组合瓶盖项目商业计划书 铝塑组合瓶盖项目资金申请报告 铝塑组合瓶盖项目节能评估报告 铝塑组合瓶盖项目规划设计咨询 铝塑组合瓶盖项目可行性研究报告 【主要用途】发改委立项,政府批地,融资,贷款,申请国家补助资金等【关键词】铝塑组合瓶盖项目可行性研究报告、申请报告 【交付方式】特快专递、E-mail 【交付时间】2-3个工作日 【报告格式】Word格式;PDF格式 【报告价格】此报告为委托项目报告,具体价格根据具体的要求协商,欢迎进入公司网站,了解详情,工程师(高建先生)会给您满意的答复。 【报告说明】 本报告是针对行业投资可行性研究咨询服务的专项研究报告,此报告为个性化定制服务报告,我们将根据不同类型及不同行业的项目提出的具体要求,修订报告目录,并在此目录的基础上重新完善行业数据及分析内容,为企业项目立项、上马、融资提供全程指引服务。
可行性研究报告是在制定某一建设或科研项目之前,对该项目实施的可能性、有效性、技术方案及技术政策进行具体、深入、细致的技术论证和经济评价,以求确定一个在技术上合理、经济上合算的最优方案和最佳时机而写的书面报告。可行性研究报告主要内容是要求以全面、系统的分析为主要方法,经济效益为核心,围绕影响项目的各种因素,运用大量的数据资料论证拟建项目是否可行。对整个可行性研究提出综合分析评价,指出优缺点和建议。为了结论的需要,往往还需要加上一些附件,如试验数据、论证材料、计算图表、附图等,以增强可行性报告的说服力。 可行性研究是确定建设项目前具有决定性意义的工作,是在投资决策之前,对拟建项目进行全面技术经济分析论证的科学方法,在投资管理中,可行性研究是指对拟建项目有关的自然、社会、经济、技术等进行调研、分析比较以及预测建成后的社会经济效益。在此基础上,综合论证项目建设的必要性,财务的盈利性,经济上的合理性,技术上的先进性和适应性以及建设条件的可能性和可行性,从而为投资决策提供科学依据。 投资可行性报告咨询服务分为政府审批核准用可行性研究报告和融资用可 行性研究报告。审批核准用的可行性研究报告侧重关注项目的社会经济效益和影响;融资用报告侧重关注项目在经济上是否可行。具体概括为:政府立项审批,产业扶持,银行贷款,融资投资、投资建设、境外投资、上市融资、中外合作,股份合作、组建公司、征用土地、申请高新技术企业等各类可行性报告。 报告通过对项目的市场需求、资源供应、建设规模、工艺路线、设备选型、环境影响、资金筹措、盈利能力等方面的研究调查,在行业专家研究经验的基础上对项目经济效益及社会效益进行科学预测,从而为客户提供全面的、客观的、可靠的项目投资价值评估及项目建设进程等咨询意见。 可行性研究报告大纲(具体可根据客户要求进行调整) 为客户提供国家发委甲级资质 第一章铝塑组合瓶盖项目总论 第一节铝塑组合瓶盖项目背景 一、铝塑组合瓶盖项目名称 二、铝塑组合瓶盖项目承办单位 三、铝塑组合瓶盖项目主管部门 四、铝塑组合瓶盖项目拟建地区、地点 五、承担可行性研究工作的单位和法人代表
抗生素瓶用铝塑组合盖微生物方法验证方案2013.04.02
项目人员I t e m P e r s o n n e l 部门/岗位 Dept./Position 签名 Signature 日期 Date 方案起草Prepared by QC/检验员 年月日 (Y) (M) (D) QA/验证 年月日 (Y) (M) (D) 方案审核Reviewed by QC/经理 年月日 (Y) (M) (D) QA/副经理 年月日 (Y) (M) (D) QA/经理 年月日 (Y) (M) (D) 方案批准Approved by 质量受权人 年月日 (Y) (M) (D) 颁发部门Issued by QA 生效日期 Effective Date 年月日 (Y) (M) (D) 分发部门Distributed to QC 制作备份:1份 Copies prepared: 1pcs
目录 1.概述 (3) 2.目的 (3) 3.依据及参考文件 (3) 4.验证小组和各部门职责 (3) 5.验证时间安排 (4) 6.验证内容 (4) 7. 偏差处理及变更控制 (7) 8.验证结果评价内容 (7) 附件1 :《培训确认》 (1) 附件2:《文件检查确认》 (2) 附件3 :《设备确认结果》 (3) 附件4 :《试验器材确认结果》 (4) 附件5 :《试验用菌种确认结果》 (4) 附件6:《培养基确认结果》 (5) 附件7:《试剂确认结果》 (5) 附件8:《器皿确认结果》 (6) 附件9:《总菌落数计数验证结果记录》 (7) 附件10:《检验记录》 (8)
1.概述 抗生素瓶用铝塑组合盖是本公司注射剂的包装材料,规格有7.2mm、7.3 mm两种,来源:湖北银华药用包装材料有限公司。新建的206车间(粉针剂车间)轧盖操作选择在C级背景A级送风环境下进行,A级送风环境应当至少符合A级区的静态要求。为减少洁净区工序操作,现拟使用免消毒的铝塑组合盖用于生产,为避免铝塑组合盖对环境与产品质量的影响,需修订抗生素瓶用铝塑组合盖的质量标准,增加其微生物限度检查项,并同时进行微生物限度检查方法验证。A级区动态下表面微生物<1CFU/皿(Φ55mm的接触皿表面培养基面积约23.7cm2),而10个铝塑组合盖展开面积约94 cm2,约为1个接触皿面积的4倍,所以拟定抗生素瓶用铝塑组合盖的微生物限度标准为:总菌落数不得过10个。由于初拟的微生物限度检查采用铝塑组合盖浸渍洗脱法,实际采样面积远大于展开面积,所以本次拟定的质量标准较为严格,可用于铝塑组合盖的微生物控制。初步拟定其检验方法为:取供试品10个,加入100 ml的0.9%无菌氯化钠溶液中,手工震摇1分钟,使瓶盖与液体充分接触,制成供试液,将供试液用薄膜过滤器全部过滤,滤干后将滤膜菌面朝上贴于胰酪胨大豆琼脂培养基平板上培养,平行制备2皿;同法制备2膜置沙氏葡萄糖琼脂培养基上。胰酪胨大豆琼脂培养基置30~35℃倒置培养3天;沙氏葡萄糖琼脂培养基置20~25℃倒置培养5天。 本次验证的抗生素瓶用铝塑组合盖使用的两个规格,其总表面积相差很小,分别约为31.1 cm2与31.3 cm2,根据库存情况选择三批(不分规格)抗生素瓶用铝塑组合盖进行三次独立验证。 2.目的 通过微生物方法学验证建立抗生素瓶用铝塑组合盖的微生物限度检验标准操作规程。 3.依据及参考文件 3.1《中国药典》2010年版二部附录XI J“微生物限度检查法” 3.2《中国药品检验标准操作规范》2010年版“微生物限度检查法” 3.3现行版《欧洲药典》:非无菌产品微生物检测:微生物计数试验 3.4《药品GMP指南》2011年版“无菌药品” 3.5 SOP-QC-0213-V01《微生物限度检查法》 3.6 SOP-QA-017-V02《验证管理规程》 4.验证小组和各部门职责
铝塑组合盖质量标准
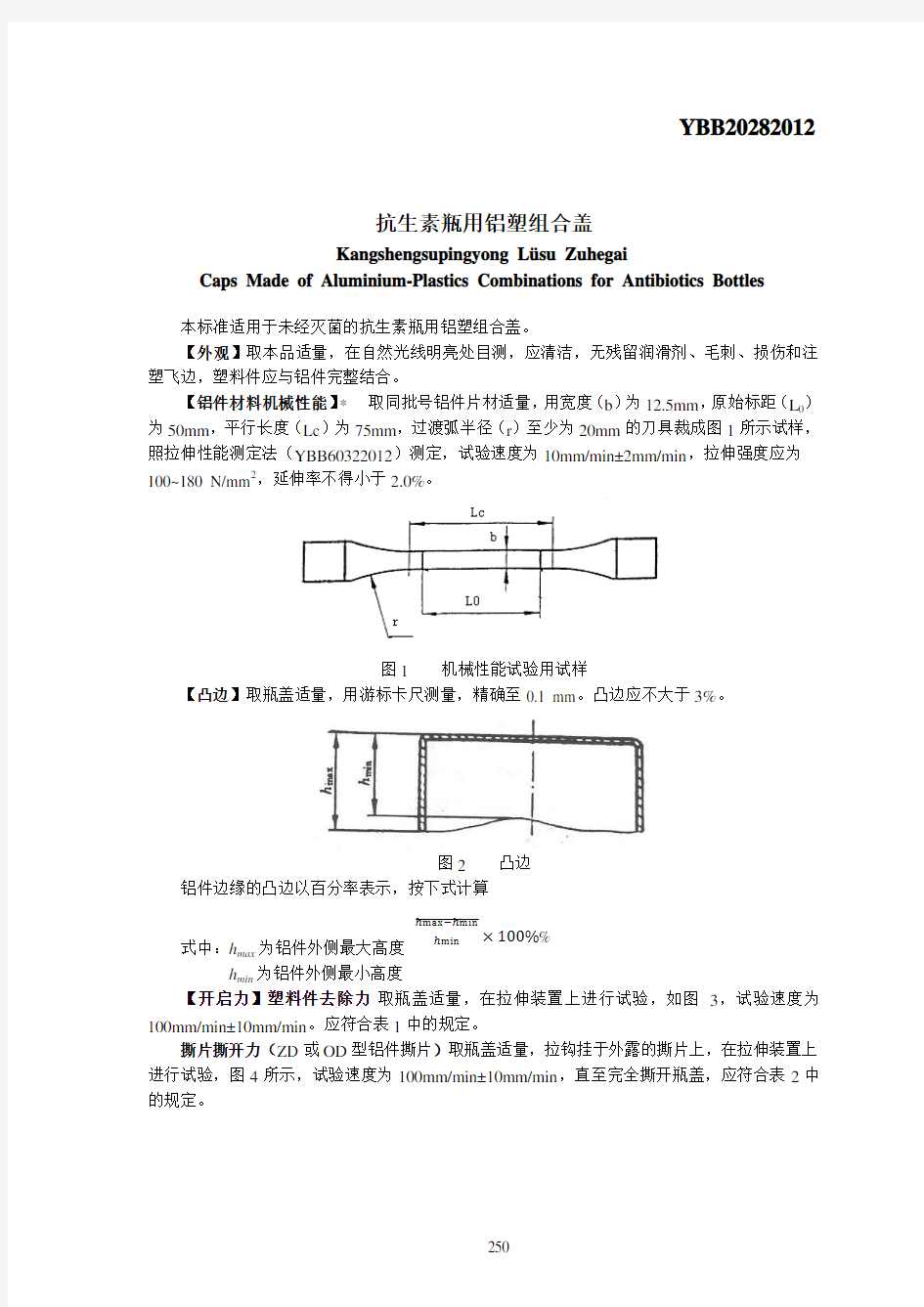
1.目的:建立铝塑组合盖检验标准操作规程,以确保检验操作正确。 2.范围:铝塑组合盖的检验。 3.责任者: 4.内容: 4.1.型式分类 瓶盖分为以下型式: -ZB型:由带中心孔铝盖和塑料件组成; -ZD型:由带撕开式撕片的铝盖和塑料件组成; 4.2尺寸与公差 4.2.1尺寸 各种型式的瓶盖(扁平形、环形或其他形状)应符合图1和表1规定的尺寸。 瓶盖未注公差应符合GB/T1804中m级规定。 4.3标记 标记由“瓶盖”、本标准编号,型式字母和公称尺寸组成。 示例:执行本标准,公称尺寸32,ZD型铝塑料组合瓶盖标记为瓶盖GB5197.2- ZD-32 4.4要求 4.4.1铝件材料机械性能 铝件材料的机械性能应符合表2中A、B、C三类所规定的要求。 注2:附录C例举出常用的铝合金的化学成分。
瓶盖应清洁、无残留润滑剂毛刺、损伤和注塑飞边,塑料件应与铝件完整结合。 4.4.3凸边 瓶盖铝件的凸边应大于3%。 4.4.4开启力 4.4.4.1按附录A进行试验时,去除塑料和撕开ZD型铝件的撕力所需最大力值应符 合表3规定。 4.4.4.2 4.5配合性 瓶盖以4.11.5.1条规定的过程后,应配合适宜。 4.6强度 瓶盖经4.11.5.1和4.11.5.2条规定的过程后,应不出现断裂和异常变形。 4.7耐蒸汽灭菌 瓶盖经4.11.5.2条规定的过程后,塑料件应无变形变色,铝件表面不应有任何明显的变化,塑料件还应能短时间(最大5min)经受130℃的蒸汽灭菌温度无变形变色。 注3:普通铝合金在蒸汽灭菌器内灭菌时有产生斑痕的趋向。 4.8开口质量 瓶盖经开启力试验时,去除塑料件(打开瓶盖)后,铝件上的开口处不应受到损坏。 4.9涂层牢固度 外表面有涂层的铝件,经4.11.5.3条试验后不应有任何涂层磨损的迹象。 4.10工艺要求 铝件与塑料件的组装应在清洁状态下进行,并保证组装后的瓶盖不受到污染。4.11试验方法 4.11.1机械性能: 铝化材料的机械性能(抗拉强度和延伸率)应按GB228的规定进行。 注4:瓶盖制造厂可根据铝材供应厂出具的机械性能测试和化学成分分析报告收货。 4.11.2外观质量 目测 4.11.3尺寸 内径用极限量规检查,其他尺寸用游标卡尺,高度尺和千分尺等通用量具检验。 4.11.4凸边 铝件边缘的凸边缺陷以百分率表示。按下式计算: h max -h min -------------------- ×100 h min
口服液铝塑复合盖质量标准
文件编号 口服液瓶铝塑组合盖质量标准 执行日期XXXX 2014.XX.XX 起草人审核人批准人 起草日期审核日期批准日期 版本号00 原文件有效期 分发部门科研中心、质量保证部、生产部 目的:建立口服液瓶铝塑组合盖的规格标准,使产品包装材料的规格编制标准化、规范 化。 适用范围:适用于口服液瓶铝塑组合盖的购进、入库验收、检验及对口服液瓶铝塑组合 盖的质量检查。 责任人:科研中心主任、质量保证部部长、生产部部长 内容: 1 标准来源:企业内定。 2 质量标准要求 2.1 材质:铝塑组合 2.2 规格:XXXX 2.3 外观要求 瓶盖应清洁、无残留润滑剂毛刺、损伤和注塑飞边,塑料件应与铝件完整结合。 2.4 微生物限度应符合下表要求(是否可以与口服液瓶合并检验此项?) 要求标准 微生物限度细菌数不得过1000cfu/瓶, 霉菌、酵母菌数不得过100cfu/瓶,大肠杆菌每瓶不得检出 2.5 一般技术要求 凸边瓶盖铝件的凸边应大于3%。 配合性经封盖后,两者应配合适宜。 强度经封盖和蒸汽灭菌之后,应不出现断裂和异常变形。 耐蒸汽灭菌瓶盖经蒸汽灭菌后,塑料件应无变形变色,铝件表面不应有任何明显的变化,塑料件还应能短时间(最大5min)经受130℃的蒸汽灭菌温度无变形 变色。(注:普通铝合金在蒸汽灭菌器内灭菌时有产生斑痕的趋向。) 开口质量瓶盖经开启力试验时,去除塑料件(打开瓶盖)后,铝件上的开口处不应受到损坏。 涂层牢固度外表面有涂层的铝件,经试验后不应有任何涂层磨损的迹象。 工艺要求铝件与塑料件的组装应在清洁状态下进行,并保证组装后的瓶盖不受到污
染。 2.6包装质量及贮藏要求 内包装用符合药用要求的聚乙烯塑料袋密封 外包装纸箱 贮藏保存于干燥、清洁处 3 变更历史及记载 版本号文件号变更执行日期变更原因、依据及详细变更内容00 STP-ZL(B)-XX 2014.XX.XX 新文件
抗生素瓶用铝盖组合盖质量标准
目的 明确抗生素瓶用铝塑组合盖质量标准,为其质量评价提供依据。 适用范围 适用于公司生产技术部、质量管理部、化验室、物料部、仓库、车间等部门。 职责 质量管理部对本技术标准制订、审核及执行负责。 规程目录 1质量标准制订依据 2经批准的供应商 3规格和用途 4取样及检验方法 5定性和定量的限度要求 6贮存条件和注意事项 7复验期 8附件 9培训要求 10文件变更历史 正文 1质量标准制订依据 依据《国家药包材标准》YBB00372003-2015 抗生素瓶用铝塑组合盖制订。 2经批准的供应商 经批准的供应商详见本公司“已批准物料采购供应商目录”现行文件。采购人员不得向其它未经质量审计及批准的供应厂家进行采购。 3规格和用途 3.1规格:20-ZB型,蓝色,物料代码 503004; 13- ZB型,蓝色,物料代码 503005。 3.2用途:用于冻干粉针制剂的生产。
4取样及检验方法 4.1取样件数 4.1.1如在同等条件下生产出来的抗生素瓶用铝盖组合盖并于一次交付的货,可看作一个批号;如一次交付的货中有不同的生产批号或用不同批号材质制成,则每一个部分应看作一个单独批。 4.1.2当一个批号是以几个包装的形式交付的,则应按下表从一定数量包装中取样,每个包装的取样量应相接近。 4.2取样数量:从总件数中抽取100套作为该批物料的理化检验用样品,70 套作留样用。 4.3取样步骤:详见“SQC310003*物料取样程序” 4.4检验方法:详见“TES 503004*抗生素瓶用铝盖组合盖检验操作规程”。 5定性和定量的限度要求
注:1、厂家报告书需按质量标准及检验规则进行全检且结果符合要求; 2.、质量标准中带“★”项及规格尺寸为企业进厂后每批次必检项目; 3、更换生产厂家后,首批次应送样委托广东省医疗器械质量监督检验所包装材料容器检验中心进行全检。 附件一检验规则 1、产品检验分为全项检验和部分检验。 2、有下列情况之一时,应按标准的要求进行全项检验。 (1)产品注册; (2)产品出现重大质量事故后重新生产; (3)监督抽验; (4)产品停产后重新恢复生产。 3、产品批准注册后,药包材生产、使用企业在原料产地、添加剂、生产工艺等没有变更的情形下,可按标准的要求,进行除“*”外项目检验。 4、外观、凸边、开启力、开口质量、配合性、耐灭菌及涂层牢固度的检验,按《计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批抽样计划》(GB/T2828.1-2012)规定进行,检验项目、检验水平及接收质量限见表2。 注:带“*”的项目半年内至少检验一次。 表1 开启力 表2 检验项目、检查水平及接收质量限
安瓿西林瓶尺寸(新)教案资料
安瓿西林瓶尺寸(新)
安瓿、西林瓶外形尺寸(新) 安瓿(YBB00332002低硼硅玻璃安瓿) 西林瓶(YBB00302002低硼硅玻璃管制注射剂瓶) 注:括号内为非标尺寸。 YBB药包材标准(1~6辑)目录 第一辑 YBB00012002低密度聚乙烯输液瓶(试行) YBB00022002聚丙烯输液瓶(试行) YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005 YBB00042002药用氯化丁基橡胶塞(试行)
YBB00052002药用溴化丁基橡胶塞(试行) YBB00062002低密度聚乙烯药用滴眼剂瓶(试行) YBB00072002聚丙烯药用滴眼剂瓶(试行) YBB00082002口服液体药用聚丙烯瓶(试行) YBB00092002口服液体药用高密度聚乙烯瓶(试行) YBB00102002口服液体药用聚酯瓶(试行) YBB00112002口服固体药用聚丙烯瓶(试行) YBB00122002口服固体药用高密度聚乙烯瓶(试行) YBB00132002药品包装用复合膜、袋通则(试行) YBB00142002药品包装材料与药物相容性试验指导原则(试行) 第二辑 YBB00152002药品包装用铝箔 YBB00162002铝质药用软膏管 YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋 YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋 YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋 YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片 YBB00212002聚氯乙烯固体药用硬片 YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片 YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片 YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片 YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB002520 05
药品包装用材料最新版
药品包装用材料、容器管理办法(暂行) 第一章总则 第一条为加强药品包装用材料、容器(以下简称“药包材”)的监督管理,保证药品质量,保障药品使用安全、有效、方便,根据《中华人民共和国药品管理法》的规定,制定本办法。 第二条凡生产、经营药包材和使用药包材包装药品的,须符合本办法规定。 第三条国家对药包材实行产品注册制度。国家药品监督管理局和省、自治区、直辖市药品监督管理部门按照统一管理、分级负责的原则负责药包材的注册管理工作。 第二章分类与标准 第四条药包材产品分为Ⅰ、Ⅱ、Ⅲ三类。 Ⅰ类药包材指直接接触药品且直接使用的药品包装用材料、容器。 Ⅱ类药包材指直接接触药品,但便于清洗,在实际使用过程中,经清洗后需要并可以消毒灭菌的药品包装用材料、容器。 Ⅲ类药包材指Ⅰ、Ⅱ类以外其它可能直接影响药品质量的药品包装用材料、容器。 药包材分类目录由国家药品监督管理局制定、公布。 第五条药包材须按法定标准生产,不符合法定标准的药包材不得生产、销售和使用。 第六条药包材国家标准或行业标准由国家药品监督管理局组织制订和修订。 第七条未制定国家标准、行业标准的药包材,由申请产品注册企业制订企业标准。 第八条药包材标准由药品监督管理部门监督实施。 第三章注册管理 第九条药包材须经药品监督管理部门注册并获得《药包材注册证书》后方可生产。未经注册的药包材不得生产、销售、经营和使用。《药包材注册证书》有效期为五年,期满前六个月按规定申请换发。 第十条《药包材注册证书》不得伪造、变造、出租、出借。 第十一条生产Ⅰ类药包材,须经国家药品监督管理局批准注册,并发给《药包材注册证书》。生产Ⅱ、Ⅲ类药包材,须经所在省、自治区、直辖市药品监督管理部门批准注册,并发给《药包材注册证书》。 第十二条药包材执行新标准后,药包材生产企业需向原发证机关重新申请核发《药包材注册证书》。
TSQB08-00 抗生素瓶用铝塑组合盖质量标准及检验操作规程
1 目 的: 建立抗生素瓶用铝塑组合盖的质量标准并规范抗生素瓶用铝塑组合盖检验操作。 2 范 围: 本规程适用于抗生素瓶用铝塑组合盖的质量检验及质量判定。 3 标准依据: 《国家食品药品监督管理局国家药品包装容器(材料)标准 (试行)》 YBB00372003 4 内 容: 4.1 类别:药用包材。 4.2 物料代码:B08 4.3 贮藏:密闭,干燥处保存。 4.4 质量要求: 4.4.1 质量标准: 项目 标准 外观 应清洁,无残留润滑剂、毛刺、损伤和注塑飞边,塑料件 应与铝件完全结合 凸边 应不大于3% 耐灭菌 瓶盖应不出现断裂和异常变形 规格尺寸 应符合表1的规定 注:其他项目由生产厂家进行检验,检验结果见厂家报告单。 4.4.2 规格尺寸 表1 规格尺寸 公称 型式 铝盖内径 塑片外径 铝盖厚度 铝盖内高 瓶盖全高 题 目 抗生素瓶用铝塑组合盖 质量标准及检验操作规程 文件编码 TSQB08-00 制 定 人 制定日期 年 月 日 文件页数 共 6页 审 核 人 审核日期 年 月 日 生效日期 年 月 日 批 准 人 批准日期 年 月 日 颁发部门 质量部 分发部门 质量部(QC 、QA )、物控部、采购供应部
尺寸 d 1 d 2 e h 1 h 2 20b ZB +0.10 min max min max ±0.25 min max 20.00 22.0 23.0 0.168 0.242 7.3 8.7 9.8 4.4.3 检验方法 4.4.3.1 外观 方法:取本品适量,在自然光线明亮处,正视目测。 4.4.3.2 凸边 A)仪器与用具:游标卡尺。 B)方法:取瓶盖适量,用游标卡尺测量,精确至0.1cm 。瓶盖铝件的凸边应不大于3%。 铝件边缘的凸边以百分率表示,按下式计算: %100%min min max ?-= H H H 凸边 式中:max H ---为铝件外侧最大高度 min H ---为铝件外测最小高度 4.4.3.3 耐灭菌 A)仪器与用具:YXQ-LS-50S Ⅱ立式压力蒸汽灭菌器。 B)方法:取瓶盖适量,封盖后置蒸汽灭菌器中,121℃±2℃ 30min (包含130℃±2℃ 5min ),瓶盖经灭菌后塑料件能经受121℃(130℃)的蒸汽灭菌温度,无变形变色,铝件表面不应有任何明显变化。瓶盖应不出现断裂和异常变形。塑料件还应能短时间(最大5min )经受130℃的蒸汽灭菌温度无变形变色。 4.4.3.4 规格尺寸 A)仪器与用具:游标卡尺。 B)方法:用精确度为0.02mm 的游标卡尺进行主要尺寸的检验。 4.5 检验规则 4.5.1 则规格尺寸的检验量为10个; 4.5.2 规格尺寸合格率≥97.5%; 4.5.3 外观质量合格率≥97%; 4.5.4 凸边质量合格率≥97%。
《钠钙玻璃输液瓶》等项直接接触药品的包装材料和容器国家标准编名称
YBB00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器 国家标准编号、名称 1. YBB00032005-2015 钠钙玻璃输液瓶 2. YBB00012004-2015 低硼硅玻璃输液瓶 3. YBB00022005-2-2015 中硼硅玻璃输液瓶 4. YBB00332002-2015 低硼硅玻璃安瓿 5. YBB00322005-2-2015 中硼硅玻璃安瓿 6. YBB00332003-2015 钠钙玻璃管制注射剂瓶 7. YBB00302002-2015 低硼硅玻璃管制注射剂瓶 8. YBB00292005-2-2015 中硼硅玻璃管制注射剂瓶 9. YBB00292005-1-2015 高硼硅玻璃管制注射剂瓶 10. YBB00312002-2015 钠钙玻璃模制注射剂瓶 11. YBB00322003-2015 低硼硅玻璃模制注射剂瓶 12. YBB00062005-2-2015 中硼硅玻璃模制注射剂瓶 13. YBB00032004-2015 钠钙玻璃管制口服液体瓶 14. YBB00282002-2015 低硼硅玻璃管制口服液体瓶 15. YBB00022004-2015 硼硅玻璃管制口服液体瓶 16. YBB00272002-2015 钠钙玻璃模制药瓶 17. YBB00302003-2015 低硼硅玻璃模制药瓶 18. YBB00052004-2015 硼硅玻璃模制药瓶 19. YBB00362003-2015 钠钙玻璃管制药瓶 20. YBB00352003-2015 低硼硅玻璃管制药瓶 21. YBB00042004-2015 硼硅玻璃管制药瓶 22. YBB00282003-2015 药用钠钙玻璃管 23. YBB00272003-2015 药用低硼硅玻璃管 24. YBB00012005-2-2015 药用中硼硅玻璃管 25. YBB00012005-1-2015 药用高硼硅玻璃管 26. YBB00162005-2015口服固体药用陶瓷瓶
注射用头孢哌酮钠他唑巴坦钠(1.0g)生产工艺规程-00+混粉
目录 1.目的及范围 (2) 2.产品概述 (2) 3.历史沿革 (3) 4.生产处方及所用质量标准 (3) 5.工艺流程图及环境区域说明 (4) 6.各工序操作间及主要设备 (6) 7.生产工艺操作要求 (6) 8.成品质量标准 (15) 9.物料平衡计算方式及指标 (15) 10.工艺卫生及劳动保护 (15) 附件1:印刷性包装材料的样品 附件2:粉针制剂生产线B线制造记录
1.目的及范围 1.1.目的:本规程规定了注射用头孢哌酮钠他唑巴坦钠(1.0g)制剂生产全过程。 1.2.适用范围:粉针制剂生产线B线。 2.产品概述 2.1.产品名称 2.1.1.中文名称:注射用头孢哌酮钠他唑巴坦钠 2.1.2.英文名称:Cefoperazone Sodium and Tazobactam Sodium for Injection 2.1. 3.拼音名称:Zhusheyong Toubaopaitongna Tazuobatanna 2.1.4.化学名称:头孢哌酮钠:6R7R-3-1-甲基-1H-四唑-5 基硫甲基-7-R-2-(4-乙基-23-二氧代-1-哌嗪碳酰氨基)-2-对羟基苯基-乙酰氨基-8-氧代-5-硫杂-1-氮杂双环4.2.0辛-2-烯-2-甲酸钠盐;他唑巴坦钠:[2S-(2α,2β,5α)]-3-甲基-7 氧-3-(1H-1,2,3-三唑-1-甲基) -4-硫杂-1-氮杂双环-[ 3.2.0]庚烷-2- 羧酸-4,4-二氧化物钠盐。 2.2.批准文号:国药准字H20123098 2.3.剂型及规格:本品为粉针剂,规格为1.0g,其中含头孢哌酮钠0.8g(以C25H27N9O8S2计),他唑巴坦钠0.2g(以C10H12N4O5S计)。 2.4.包装 2.4.1.内包装形式:低硼硅玻璃管制注射剂瓶、注射用无菌粉末用卤化丁基橡胶塞包装,瓶口轧有抗生素瓶用铝塑组合盖。 2.4.2.包装规格:每盒10瓶、一张说明书,每箱40盒。 2.5.性状:本品为白色或类白色结晶性粉末。 2.6.适应症:本品适用于治疗由敏感菌所引起的下列感染: 2.6.1.仅用于治疗由对头孢哌酮单药耐药、对本品敏感的产β-内酰胺酶细菌引起的中、重度感染。在用于治疗由对头孢哌酮单药敏感菌与对头孢哌酮单药耐药、对本品敏感的产β-内酰胺酶菌引起的混合感染时,不需要加用其他抗生素。 2.6.2.下呼吸道感染:由产β-内酰胺酶的铜绿假单胞茵、肺炎链球菌和其他链球菌、肺炎克雷伯菌和其他克雷伯菌属、流感嗜血杆菌、金黄色葡萄球菌等敏感菌所致的肺炎、慢性支气管炎急性发作、急性支气管炎、肺脓肿和其他肺部感染。 2.6. 3.泌尿生殖系统感染:由产β一内酰胺酶的大肠埃希茵、变形杆菌、克雷伯菌属、铜绿假单胞菌、葡萄球菌属等敏感菌所致的急性肾盂肾炎、慢性肾盂肾炎急性发作、复杂性尿路感染、子宫内膜炎、淋病和其他生殖道感染。 2.6.4.腹腔、盆腔感染:由产β-内酰胺酶的肠杆菌属细菌、大肠埃希菌、克雷伯菌、铜绿假单胞菌、枸椽酸杆菌属、拟杆菌消化链球茵、梭状芽孢杆菌所致的腹膜炎、胆囊炎、胆管炎和其他腹腔内感染、盆腔炎等。 2.6.5.其他感染:对以上产β-内酰胺酶的革兰阳性菌和革兰阴性菌所致的败血症,脑膜炎双球菌和流感嗜血杆菌所致的脑膜炎、重症皮肤和软组织感染。 2.7.用法与用量: 2.7.1.静脉滴注。先用氯化钠注射液或灭菌注射用水适量(5—10m1)溶解,然后再加5%葡萄糖注射液或氯化钠注射液150-250ml稀释供静脉滴注,滴注时间为30-60分钟,每次滴注时间不得少于30分钟。疗程一般7-10天(重症感染可以适当延长)。 2.7.2.成人用量:每次2g(2瓶),每8小时或12小时静脉滴注1次。严重肾功能不全的患者(肌肝消除率<30ral/min),每12小时他唑巴坦的剂量应不超过0.5g。 2.8.贮存与有效期 2.8.1.贮存:密闭,在凉暗干燥处(避光并不超过20℃)保存。
直接接触药品的包装材料与容器的所有标准目录2015
附件1 YBB00032005-2015《钠钙玻璃输液瓶》等130项直接接触药品的包装材料和容器 国家标准编号、名称 1. YBB00032005-2015 钠钙玻璃输液瓶 2. YBB00012004-2015低硼硅玻璃输液瓶 3. YBB00022005-2-2015中硼硅玻璃输液瓶 4. YBB00332002-2015低硼硅玻璃安瓿 5. YBB00322005-2-2015中硼硅玻璃安瓿 6. YBB00332003-2015 钠钙玻璃管制注射剂瓶 7. YBB00302002-2015低硼硅玻璃管制注射剂瓶 8. YBB00292005-2-2015中硼硅玻璃管制注射剂瓶 9. YBB00292005-1-2015高硼硅玻璃管制注射剂瓶 10. YBB00312002-2015 钠钙玻璃模制注射剂瓶 11. YBB00322003-2015低硼硅玻璃模制注射剂瓶 12. YBB00062005-2-2015中硼硅玻璃模制注射剂瓶 13. YBB00032004-2015 钠钙玻璃管制口服液体瓶 14. YBB00282002-2015低硼硅玻璃管制口服液体瓶 15. YBB00022004-2015硼硅玻璃管制口服液体瓶 16. YBB00272002-2015 钠钙玻璃模制药瓶 17. YBB00302003-2015低硼硅玻璃模制药瓶 18. YBB00052004-2015硼硅玻璃模制药瓶 19. YBB00362003-2015 钠钙玻璃管制药瓶 20. YBB00352003-2015低硼硅玻璃管制药瓶 21. YBB00042004-2015硼硅玻璃管制药瓶 22. YBB00282003-2015 药用钠钙玻璃管
安瓿西林瓶尺寸(新)
安瓿、西林瓶外形尺寸(新)安瓿(YBB00332002低硼硅玻璃安瓿) 西林瓶(YBB00302002低硼硅玻璃管制注射剂瓶) 注:括号内为非标尺寸。
YBB药包材标准(1~6辑)目录 第一辑 YBB00012002低密度聚乙烯输液瓶(试行) YBB00022002聚丙烯输液瓶(试行) YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005 YBB00042002药用氯化丁基橡胶塞(试行) YBB00052002药用溴化丁基橡胶塞(试行) YBB00062002低密度聚乙烯药用滴眼剂瓶(试行) YBB00072002聚丙烯药用滴眼剂瓶(试行) YBB00082002口服液体药用聚丙烯瓶(试行) YBB00092002口服液体药用高密度聚乙烯瓶(试行) YBB00102002口服液体药用聚酯瓶(试行) YBB00112002口服固体药用聚丙烯瓶(试行) YBB00122002口服固体药用高密度聚乙烯瓶(试行) YBB00132002药品包装用复合膜、袋通则(试行) YBB00142002药品包装材料与药物相容性试验指导原则(试行) 第二辑 YBB00152002药品包装用铝箔 YBB00162002铝质药用软膏管 YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋 YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋 YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋 YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片 YBB00212002聚氯乙烯固体药用硬片 YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片 YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片 YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片 YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005 YBB00262002口服固体药用聚酯瓶 YBB00272002钠钙玻璃药瓶 YBB00282002低硼硅玻璃管制口服液体瓶 YBB00292002硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2 YBB00302002低硼硅玻璃管制注射剂瓶 YBB00312002钠钙玻璃模制注射剂瓶 YBB00322002硼硅玻璃安瓿废止,新标准号YBB00322005-2 YBB00332002低硼硅玻璃安瓿 YBB00342002多层共挤输液用膜、袋通则 第三辑 YBB00012003细胞毒性检查法 YBB00022003热原检查法 YBB00032003溶血检查法 YBB00042003急性全身毒性检查法 YBB00052003皮肤致敏检查法 YBB00062003皮内刺激检查法
口服液瓶用铝塑组合盖企业标准
新乡市红福瓶盖有限公司 企业药品包装容器(材料)标准 Q/XHF001-2008 口服液瓶用铝塑组合盖 Koufuyepingyong Lüsu Zuhegai Caps Made of Aluminium-Plastics Combinations for Oral Liquid Preparation 本标准适用于口服液瓶用铝塑组合盖。 【外观】取瓶盖适量,在自然光线明亮处目测,应清洁,无残留润滑剂、毛刺、损伤和注 塑飞边,塑件应与铝件完整结合。铝盖:表面光洁、无斑痕、边口平整,无毛刺。塑片:色泽鲜艳,颜色无色差,无飞边,标志清晰、无缩痕等现象。 【铝件材料机械性能】* 应符合表1规定 表1 材料的机械性能 抗拉强度N/mm2延伸率% 100~180 ≥2.0 抗拉强度系指在拉伸试验中,实验直至断裂位置,单位初始横截面上承受的最大拉伸负荷。延伸率系指在拉伸试验中,试样断裂时,标线间距离的增加量与初始标距之比,以百分率表示。延伸率按照公式(1)计算 ε1= {(L-L0)/L0}×100% ………………………………………………公式(1)公式中:ε1———延伸率,%; L0———试样原始标线距离,mm; L ———试样断裂时标线距离,mm。 取同批号铝件片材适量,用宽度为12.5mm。原始标距为50mm,平行长度为75mm,过渡弧半径至少为20mm的刀具裁成图1试样,在拉伸装置上进行试验,试验速度为10mm/min±2mm/min。材料的机械性能应符合表1中规定的要求。
注:试样应在(23±2)℃、(50±5)%相对湿度放置4小时以上,并在此条件进行试验。 【凸边】取瓶盖适量,用游标卡尺测量,精确至0.1cm,瓶盖铝件的凸边应不大于3%。 铝件边缘的凸边以百分率表示,按公式(2)计算 ……………………………………………公式(2)式中:h max 为铝件外侧最大高度 h min 为铝件外侧最小高度 【开启力】塑料件去除力取瓶盖适量,在拉伸装置上进行试验,如图3,试验速度为100mm/min±10mm/min,应符合表2中的规定 撕片撕开力取瓶盖适量,拉钩挂于外露的撕片上,在拉伸装置上进行试验,试验速度为100mm/min±10mm/min,直至完全撕开瓶盖应符合表2中的规定 表2 开启力 公称尺寸(mm)塑料件去除力最小值 (N) 塑料件去除力最大值 (N) 撕片撕开力最大值 (N) 13 6 25 30
SOP-QC-4104-01 抗生素瓶用铝塑组合盖检验标准操作规程
题目:抗生素瓶用铝塑组合盖检验标准操作规程文件编号:SOP-QC-4104-01 1 目的:制定抗生素瓶用铝塑组合盖的检验操作规程,确保检验按规范进行。 2 范围:适用于抗生素瓶用铝塑组合盖的检验。 3 引用标准:国家药用包装容器(材料)标准YBB00372003与双方约定尺寸标准;本规程所引用的文件未注明版本号均为现行有效版本。 4 责任者:检验人员对本规程的实施负责。 5 规程: 5.1外观 取本品适量(按取样规则所取的样品),在自然光线明亮处,正视目测: 5.1.1 瓶盖应清洁,无残留润滑剂、毛刺、损伤和注塑飞边。 5.1.2 塑料件应与铝件完整结合。 5.2开口质量 5.2.1去除塑料件后,铝件的开口处不应受到损坏。 5.3 配合性 5.3.1 取瓶盖在相应的瓶子上,(含胶塞)用扎盖器扎盖,应配合适宜。 5.4 耐蒸气灭菌 5.4.1 蒸气灭菌过程饱和蒸汽处理:加热121±2℃,保持时间30min。 5.4.2 瓶盖经蒸气灭菌后,塑料件应无变形、变色,铝件表面不应有任何明显的变化。 5.5 涂层牢固度 铝盖(外表面有涂层)经过4.3项下蒸气灭菌试验后,去除塑料件,用浸有80%(V/V) 乙醇溶液的脱脂棉擦拭表面30秒,再用浸有70%(V/V)异丙醇溶液的脱脂棉擦拭表面,涂层应无任何涂层磨损的迹象。 5.6 规格尺寸:取本品20个,按用0.01㎜精度的游标卡尺测定铝盖内径、铝盖内
题目:抗生素瓶用铝塑组合盖检验标准操作规程文件编号:SOP-QC-4104-01高度、组合高度、材料厚度,、铝盖外径、塑盖高度、组合盖高度,均应符合规定。 瓶盖尺寸(单位:mm)
